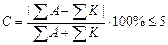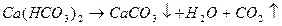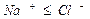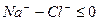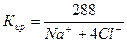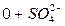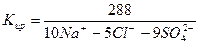Требования, предъявляемые к качеству воды, могут быть самыми различными и определяются её целевым назначением. Для оценки качества пластовых, природных и сточных вод их образцы подвергают анализу. На основании результатов анализа делаются выводы о пригодности воды для конкретного вида потребления, возможности применения тех или иных методов очистки. Анализы подземных вод позволяют прогнозировать сопутствующие месторождения полезных ископаемых. При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
6) состав растворенных газов.
Общее солесодержание характеризует присутствие в воде минеральных и органических примесей, количество этих примесей в виде общей минерализации, сухого и плотного остатков. Общая минерализация представляет собой сумму всех найденных в воде анализом катионов и анионов. Минерализацию выражают в миллиграмм-эквивалентах солей, находящихся в I л воды, или в процентах, то есть числом граммов растворенных веществ, содержащихся в 100 г раствора. Сухим остатком называется суммарное количество нелетучих веществ, присутствующих в воде во взвешенном, коллоидном и растворенном состоянии, выраженное в мг/л. Сухой остаток определяют путем выпаривания пробы воды, последующего высушивания при 105 о С и взвешивания. Плотный остаток – это сухой остаток, определенный из профильтрованной пробы воды. Следовательно, разница двух показателей соответствует содержанию взвешенных веществ пробы. Если сухой остаток прокалить при температуре 500-600 о С, то масса его уменьшится и получится остаток, называемый золой. Уменьшение массы происходит за счет сгорания органических веществ, удаления кристаллизационной воды, разложения карбонатов. Потери при прокаливании приближенно относят за счет органических примесей.
Жесткость воды обусловливается наличием в ней ионов Са 2+ и Mg 2+ . Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са 2+ или
12,16 мг/л ионов Mg 2 + . Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3 – в CO3 2 – и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са 2+ , Mg 2+ , CO3 2 – , соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общая жесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
Если известны концентрации (мг/л) в воде Ca 2+ , Mg 2+ и HCO3 – , то жесткость рассчитывается по следующим формулам:
Общая жесткость
Карбонатная жесткость равна концентрации (мг/л) [HCO3 – ]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:

Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК = ЖО – ЖК . Следовательно, ЖНК – это содержание Ca 2+ и Mg 2 + , эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Окисляемостьхарактеризует содержание в воде восстановителей, к которым относятся органические и некоторые неорганические (сероводород, сульфиты, соединения двухвалентного железа и др.) вещества. Величина окисляемости определяется количеством затраченного окислителя и выражается числом миллиграммов кислорода, необходимого для окисления веществ, содержащихся в 1 л воды. Различают общую и частичную окисляемость. Общую окисляемость определяют обработкой воды сильным окислителем – бихроматом калия K2Cr2O7 или йодатом калия KIO3. Частичную окисляемость определяют по реакции с менее сильным окислителем – перманганатом калия КMnO4. По этой реакции окисляются только сравнительно легко окисляющиеся вещества.
Для полного окисления содержащихся в воде органических веществ, при котором происходят превращения по схеме
требуется количество кислорода (или окислителя в расчете на кислород), называемое химическим потреблением кислорода (ХПК) и выражаемое в мг/л.
При любом методе определения ХПК вместе с органическими веществами окисляются и неорганические восстановители, содержащиеся в пробе. Тогда содержание неорганических восстановителей в пробе определяют отдельно специальными методами и результаты этих определений вычитают из найденного значения ХПК.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Солевой состав.При анализе природных вод определяют содержание в них преимущественно главных ионов: Cl – , SO4 2– , HCO3 – , CO3 2– , Ca 2+ , Mg 2+ , K + , Na + .
Определение ионаCl – .В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl – мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO4 2– . Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария: Ba 2+ + SO4 2– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO4 2– .
Определение ионов CO3 2– иHCO3 – . Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии.
Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3 – . Поэтому общее количество CO3 2 – эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3 – в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН – , СО3 2– и НСО3 – , характеризует общую щелочность воды. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca 2+ , Mg 2+ . Имеется несколько методов обнаружения и определения содержания ионов Са 2+ и Mg 2+ . При добавлении в воду оксалата аммония (NH4)2C2O4 в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
После отделения осадка оксалата кальция в воде можно определить ионы Mg 2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg 2 + образуется мелкокристаллический осадок соли магния:
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са 2 + и Mg 2 + является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)


образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора — мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашенное в малиновый цвет.
Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са 2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
По количеству трилона Б, расходуемого на титрование, определяют содержание Са 2 + . Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са 2 + и Mg 2 + , то есть общую жесткость воды. Вода, содержащая Са 2 + и Mg 2 + , в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg 2 + . При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:
Содержание Mg 2+ вычисляют по разности между общим содержанием (Са 2+ + Mg 2+ ) и содержанием Са 2 + . Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение ионов Na + , K + . Производится вычислением по разности между суммой мг-экв найденных анионов и катионов, поскольку вода электронейтральна:
rNa + + rK + + rCa 2+ + rMg 2+ = rCO3 2- + rHCO3 – + rSO4 2 + rCl –
rNa + + rK + = rCO3 2– + rHCO3 – + rSO4 2 + rCl – – rCa 2+ – rMg 2+
С достаточно высокой точностью все присутствующие в воде катионы можно определить эмиссионной спектроскопией сухого остатка.
Растворенные в воде газы определяют химическими методами или газовой хроматографией.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
Определение растворенного кислорода производится йодометрическим методом.
Для анализа в пробу воды поcледовательно добавляют раствор хлорида марганца и щелочной раствор йодида калия. Метод основан на окислении свежеполученного гидроксида двухвалентного марганца содержащимся в воде кислородом:
Количество образовавшегося в воде бурого осадка гидроксида четырехвалентного марганца эквивалентно количеству растворенного кислорода. При последующем добавлении к пробе соляной или серной кислоты четырехвалентный марганец вновь восстанавливается до двухвалентного, окисляя при этом йодид калия. Это приводит к выделению свободного йода, эквивалентного содержанию четырехвалентного марганца, или, что то же самое, растворенного кислорода в пробе:
Выделившийся свободный йод определяется количественно путем титрования раствором тиосульфата натрия:
I2 + 2Na2S2O3
Йодометрический метод определения растворенного кислорода неприменим для вод, содержащих сероводород, так как сероводород вступает во взаимодействие с йодом и занижает результат. Во избежание этой ошибки предварительно связывают содержащийся в пробе сероводород в соединение, не препятствующее нормальному течению реакции. Для этой цели обычно используют хлорид ртути (II):
Определение H2S. Прежде чем приступить к количественному определению сероводорода, определяют его качественное присутствие по характерному запаху. Более объективным качественным показателем служат свинцовые индикаторные бумажки (фильтровальная бумага, пропитанная раствором ацетата свинца). При опускании в воду, содержащую сероводород, свинцовая бумага темнеет, принимая желтую (малое содержание), бурую (среднее содержание) или темно-коричневую (высокое содержание) окраску.
В водных растворах сероводород присутствует в трех формах: недиссоциированный H2S, в виде ионов HS – и S 2 – . Относительные концентрации этих форм в воде зависят от рН этой воды и в меньшей степени от температуры и общего солесодержания.
Если анализируемая вода не содержит веществ, реагирующих с иодом, то сероводород и его ионы можно определить следующим образом.
В основе количественного метода определения H2S лежит реакция окисления сероводорода йодом:
К точно отмеренному подкисленному раствору йода, взятого в избытке по отношению к ожидаемому содержанию сероводорода, прибавляют определенное количество воды. Количество йода, израсходованное на окисление сероводорода, определяется обратным титрованием остатка йода тиосульфатом. Разница между количеством раствора тиосульфата, соответствующим всему количеству взятого для анализа йода, и количеством этого же раствора, затраченного на титрование остатка йода в пробе, эквивалентна содержанию сероводорода в исследуемой пробе.
Дата добавления: 2016-07-29 ; просмотров: 902 | Нарушение авторских прав
источник
Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 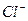 , мг/дм 3 , мг/дм 3 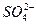 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


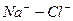
 |
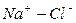

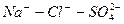
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды | ||||||||||||||||||||||||||||||||||||||||||||||||||
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник Данная работа рассчитана на 2 часа академических занятий и на 4 часа самостоятельной работы студентов с преподавателем. Целью данной работы является ознакомление студентов с данными сокращенного химического анализа подземных вод, методикой их обработки и пересчета путем использования нормативов ГОСТа, систематизация и оценка пригодности их для питьевого водоснабжения или технического использования. 2.2.1 Свойства и характеристика подземных вод. Вопросы практического использования подземных и рудничных вод могут быть решены только после полного изучения их физико-химических свойств, химического и бактериального состава. Химический состав и физические свойства подземных вод изучают для различных целей: питьевого и технически-хозяйственного водоснабжения (питания паровых котлов, охлаждения машин, тушения пожаров и т.п.), орошения полей, лечебных целей, как поисковый критерий на различные полезные ископаемые, для оценки агрессивности подземных вод по отношению к бетону, коррозирующих свойств по отношению к металлам, для установления связи водоносных горизонтов между собой и с поверхностными водами и т.п. Подземные воды представляют собой сложные естественные растворы, находящиеся в многообразных связях и взаимодействии с окружающей природной средой. Естественная физико-географическая и геологическая обстановка определяют особенности генезиса и дальнейшего преобразования подземных вод. К физическим свойствам подземных вод относятся температура, цвет, запах, прозрачность, вкус, привкус, электропроводность и радиоактивность. Определение этих свойств частично проводится непосредственно в полевых условиях при отборе проб воды, а в основном – в химических лабораториях по специальной методике. Химические свойства подземных вод определяются количеством и соотношением содержащихся в них в растворенном виде солей, присутствующих в воде в виде ионов – анионов и катионов, а также некоторых недиссоциированных соединений, газов и органических соединений. Среди ионов наибольшее практическое значение имеют следующие: катионы – водород – H + , натрий – Na + , калий – K + , магний – Mg 2+ , кальций – Ca 2+ , железо – Fe 2+ ; анионы – хлор – Cl — , сульфат – SO4 2- , гидрокарбонат – HCO3 — . Из недиссоциированных соединений наиболее часто встречаются окислы железа – Fe2O3, кремния – Si2O3, алюминия – Al2O3, а из газов – углекислый газ – CO2, кислород – O2, азот – N2, метан – CH4, сероводород – H2S. В результате выполнения данной работы студенты, изучив химический состав подземных вод, должны иметь определенные навыки по их обработке и систематизации, а также определить область практического использования. Перечень необходимых определений веществ, содержащихся в подземных водах, устанавливается в соответствии с целевым назначением анализа, что и указывается в программе работ гидрогеологических исследований. 2.2.2 Способы выражения химического состава подземных вод. В природной воде молекулы солей почти полностью диссоциированы на ионы, поэтому основной формой выражения результатов химического анализа воды является ионная форма. При этом содержание любого иона в процессе исследования выражается в граммах или миллиграммах на кубический дециметр (что равнозначно литру) воды (г/дм 3 (г/л), мг/дм 3 (мг/л)). Поэтому результаты анализов в химических лабораториях даются в ионной форме, т.е. в г/дм 3 (г/л), мг/дм 3 (мг/л). Но, делать некоторые выводы о составе и свойствах воды можно, лишь имея анализы в миллиграмм — эквивалентной и эквивалент — процентной формах. Поэтому данные химического анализа должны быть пересчитаны (табл. 3). Для этого вначале необходимо определить эквивалент каждого аниона и катиона. Дело в том, что ионы взаимодействуют между собой в строго определенных эквивалентных весовых соотношениях. Например, один эквивалент одного иона хлора Cl — может взаимодействовать только с одним эквивалентом иона натрия Na + или кальция Ca 2+ . Следовательно, эквивалент – это число, показывающее, в каком весовом соотношении данный ион вступает в соединение с другим ионом. Для пересчета анализа из ионной формы в миллиграмм – эквивалентную следует число миллиграммов каждого иона разделить на его эквивалентный вес, который представляет собой отношение атомного (или ионного) веса данного элемента к его валентности. Например, кальция Ca 2+ в воде содержится 420 мг/дм 3 . Эквивалентный вес одного иона кальция Ca 2+ равен: 40,08 : 2 = 20,04 мг/экв. Чтобы определить его миллиграмм – эквивалентное содержание надо 420 : 20,04 = 20,96 мг/экв. Также для пересчета анализов воды в миллиграмм-эквиваленты содержание ионов умножают на специальные пересчетные коэффициенты, которые представляют частное от деления единицы на эквивалентный вес. Для выше приведенного примера пересчетный коэффициент кальция Ca 2+ равен 1 : 20,04 = 0,0499. Если 420 • 0,0499 = 20,96 мг/экв – миллиграмм-эквивалентная форма. Ниже приведены пересчетные коэффициенты для некоторых ионов: гидрокарбонат HCO3 — – 0,0164 Если сумму всех катионов и анионов в миллиграмм-эквивалентной форме принять за 100%, можно получить соответствующие выражения для анионов и катионов в эквивалент-процентной форме. Количества катионов и анионов, выраженные в эквивалент-процентной форме, должны быть равны между собой, т.е. сумма всех катионов должна составлять 50% и сумма всех анионов тоже 50%, что является удобным контролем анализа. В последнее время очень часто принимают за 100% сумму миллиграмм-эквивалентов анионов и также за 100% — сумму миллиграмм-эквивалентов катионов. Расчет от этого не изменяется, но величины эквивалент-процентов становятся в два раза больше. Если результаты анализа воды выражены в миллиграмм-эквивалентной форме, то перед символом иона ставят букву r, например rCl — и т.д. При анализе могут быть неточности. Допустимая неточность анализа определяется из выражения: Таблица 3 — Исходные данные
В итоге пересчетов должна быть составлена таблица следующей формы (табл. 4): Таблица 4 — Порядок пересчета ионной формы в другие формы
При химическом анализе воды определяют величину сухого остатка после выпаривания и количества веществ, содержащихся в воде (минерализацию). Количества веществ показывают в ионной форме, при которой содержание отдельных ионов определяют в миллиграммах на 1 л воды. При выборе и оценке воды источника централизованного хозяйственно-питьевого водоснабжения пользуются государственными стандартами (ГОСТ – 2874 – 82 и др.). Сумма растворенных в воде веществ – сухой остаток – при t = 105 – 110 0 C не должна превышать 1000 мг/л. 2.2.3 Минерализация. Это экспериментально определенный сухой остаток или подсчитанная сумма минеральных веществ. Единой классификации по степени минерализации нет, их достаточно много применительно к требованиям отдельных ведомств. В таблице 5 приводится выражение общей минерализации подземных вод по В.М. Вернадскому, согласующееся с требованиями их практического использования. Таблица 5 — Классификация подземных вод по общей минерализации
2.2.4 Жесткость воды. Особое ее качество, обусловленное присутствием углекислых и сернокислых солей Ca 2+ и Mg 2+ . Жесткость поземных вод имеет большое значение при их оценке для практического использования. Жесткая вода плохо взмыливается, дает накипь в паровых котлах (что уменьшает их теплопроводность, приводит к перерасходу топлива и может вызвать аварию) и в посуде, вспенивается, в жесткой воде медленнее развариваются овощи, мясо, крупы и другие продукты. Различают общую, временную (карбонатную или устранимую) и постоянную жесткость воды. Общей называют жесткость, соответствующую пробе свежей воды. При кипячении воды растворенные в ней бикарбонаты (двууглекислые соли) переходят в углекислые и выпадают в виде осадка или накипи. Жесткость, соответствующая кипяченной воде, называется постоянной. Разность между общей и постоянной жесткостью воды называют временной жесткостью. Жесткость выражают в градусах жесткости. Существует три системы градусов жесткости: немецкая, французская, английская. За один немецкий градус жесткости принимается содержание в 1 л 10 мг CaO или 7,2 мг MgO. За один французский градус – содержание в 1 л воды 10 мг CaCO3 или 17,5 мг MgCO3. В английской системе одному градусу жесткости соответствует содержание в 1 л воды14 мг CaCO3 (точнее, в английских мерах, — 1 гран (64,79892 мг) CaCO3 на 1 галлон (4,546 л) воды). Для перевода из одной системы градусов в другую можно воспользоваться такими соотношениями: 1,0 0 жестк. нем. = 1,79 0 жестк. франц. = 1,25 0 жестк. англ. 0,56 0 жестк. нем. = 1,0 0 жестк. франц. = 0,7 0 жестк. англ. 0,8 0 жестк. нем. = 1,43 0 жестк. франц. = 1,0 0 жестк. англ. Количество солей, мг/л, из которых каждая в отдельности обусловливает 1 0 жесткости, представлены ниже: 1,0 0 жестк. нем. 10,0 7,2 17,9 8,0 19,7 17,0 25,0 21,5 1,0 0 жестк. франц. 5,6 4,0 10,0 4,4 11,0 9,5 14,0 12,0 1,0 0 жестк. англ. 8,0 5,8 14,0 6,4 15,8 13,6 20,1 17,2 В настоящее время в нашем государстве вместо жесткости в градусах введено понятие жесткости в миллиграмм-эквивалентах на литр. За единицу жесткости принимают 1 мг-экв Ca, т.е.20,04 мг Ca на 1 л воды. Вместо кальция может быть принят 1 мг-экв магния, т.е. 12,16 мг Mg на 1 л воды. Для перевода из системы градусов жесткости (немецких) в миллиграмм-эквиваленты и обратно можно воспользоваться такими соотношениями: 1 мг-экв/л соответствует 2,8 0 жест. (нем.); 0,357 мг-экв/л соответствует 1,0 0 жест. (нем.). Жесткость природных вод колеблется в пределах от нескольких до десятков и сотен мг-экв/л; в одном и том же водоисточнике жесткость неодинаковая в разные времена года. В случае необходимости использования жестких вод для тех или иных целей их приходится обрабатывать специальными способами для снижения жесткости до требуемых норм. Природные воды по общей жесткости О.А. Алекин подразделяет на пять групп (табл. 6): Таблица 6 — Классификация природных вод по общей жескости
2.2.5 Оценка воды по активной реакции. Как уже отмечалось, в воде часть молекул всегда находится в диссоциированном состоянии, в виде ионов H + и OH — . Концентрация недиссоциированной воды считается постоянной, поэтому произведение ионов водорода и ионов гидроксила при данной температуре тоже будет величиной постоянной. При температуре 22 0 C эта величина равна 10 -14 . Так как чистая вода имеет нейтральную реакцию, количества ионов водорода и ионов гидроксила должны быть равны. Следовательно, Это выражение означает, что в 1 л чистой воды при 22 0 C содержится 10 -7 грамм-молекул воды в ионизированном виде, т.е. 10 -7 грамм-ионов водорода и 10 -7 грамм-ионов гидроксила. Если [H + ] = 10 -7 , то lg[H + ] = -7 и — lg[H + ] = 7. Выражение — lg[H + ] означает pH. Следовательно, если pH 7 – щелочная. По величине активной реакции или водородного показателя pH природные воды классифицируются следующим образом (табл. 7): Таблица 7 — Классификация природных вод по активной реакции
Подземные воды в большинстве своем имеют слабощелочную реакцию. Воды сульфидных и особенно колчеданных и каменноугольных месторождений обычно кислые и часто весьма кислые. Определять концентрацию водородных ионов необходимо на месте взятия пробы; наиболее употребительный способ определения – колориметрический, основанный на свойстве индикаторов менять окраску в зависимости от концентрации водородных ионов. 2.2.6 Агрессивные свойства подземных вод. Отрицательное воздействие подземных вод на металл и бетон называется агрессивностью воды. Это свойство обусловлено присутствием в воде ионов бикарбоната, водорода, агрессивной углекислоты, сульфатов и магния. В связи с этим различают агрессивность выщелачивания, общекислотную, углекислую, сульфатную и магнезиальную. Оценку различных видов агрессивности проводят по справочнику «Нормы и технические условия. Бетон гидротехнический. Признаки и нормы агрессивности воды-среды». Наличие натриевых и калиевых солей вызывает образование накипи. Свободный ион H + вызывает разъедание стенок котлов и труб. Временная (устранимая) жесткость воды является с этой точки зрения положительным фактором, так как ионы HCO3 — связывают свободные ионы H + . Кроме ионов водорода разъедающее действие на металл оказывают ионы кислорода, углекислоты, сероводорода. Поэтому вода, применяемая для технических целей, нуждается в предварительной обработке. После обработки вода по большей части становится непригодной для питья. Агрессивность выщелачивания возникает при малом содержании в воде HCO3 — (менее 1,5 мг-экв/л). В этих условиях происходит растворение и вымывание из бетона содержащейся в нем извести. Общекислотная агрессивность обусловлена низким значением водородного показателя pH (менее 5), из-за чего усиливается растворение извести бетона. Углекислая агрессивность возникает в результате действия агрессивной углекислоты CO2. В процессе взаимодействия с водой из цемента выделяется свободная известь CaCO3, которая реагирует со свободной углекислотой CO2. Реакция идет по схеме CaCO3 + CO2 + H2O = Ca(HCO3)2. Образующийся при этом бигидрокарбонат кальция является растворимым и легко выносится из бетона. Вода для большинства марок цемента становится агрессивной, если содержание в ней свободной углекислоты больше величины, определяемой по формуле a∙Ca + b. Содержание Ca 2+ выражается в мг/л, а коэффициенты a и b определяются в зависимости от карбонатной жесткости HCO3 — (мг-экв/л) и суммарного содержания ионов Cl — + SO4 2- в мг/л по специальной таблице 14. Сульфатная агрессивность возникает при наличии в воде повышенного количества сульфата SO4 2- ; в бетоне происходит кристаллизация новых соединений, образование которых сопровождается увеличением объема, вследствие чего происходит разрушение бетона. Такими новыми соединениями являются гипс CaSO4 ∙ 2H2O и сульфоаллюминат кальция 3CaO ∙ Al2O3 ∙ 3CaSO4 ∙ 31H2O (цементная бацилла). При образовании гипса объем бетона увеличится в два раза, а при образовании цементной бациллы – в 2,5 раза. При содержании в воде SO4 2- менее 250 мг/л сульфатная агрессивность отсутствует независимо от содержания хлора Cl — . Вода становится агрессивной по отношению к обычным портландцементам, если содержание ионов SO4 2- будет больше приведенных ниже показателей с учетом содержания в воде ионов хлора Cl — (мг/л): Cl — — менее 1000 SO4 2- — 250 Магнезиальная агрессивность, подобно сульфатной, ведет к разрушению бетона при соприкосновении его с водой, содержащей повышенное количество Mg 2+ . При этом, если содержание ионов магния Mg 2+ будет меньше 1000 мг/л, вода считается магнезиально – неагрессивной независимо от содержания иона SO4 2- (мг/л). При содержании ионов магния Mg 2+ более 1000 мг/л и больше величины, определяемой по формуле К- SO4 2- , вода считается агрессивной. Величина К для обычного портланд — цемента равна 7000. 2.2.7 Классификация подземных вод по химическому составу. Единой общепринятой классификации подземных вод в зависимости от их химического состава нет, что объясняется чрезвычайно разнообразным качественным и количественным химическим составом природных вод. Наиболее удобны те классификации, которые построены на принципе деления вод по преобладающим ионам (катионам и анионам) и по соотношению между ними. Именно на этом принципе построена классификация О.А. Алекина, широко используемая в геолого–разведочной, горной промышленности, гидротехнике и коммунальном хозяйстве. В соответствии с этой классификацией все природные воды по преобладающему в них аниону делятся на три больших класса – гидрокарбонатные, хлоридные и сульфатные. Каждый класс, в свою очередь, по преобладающему катиону делится на три группы – натриевые, кальциевые и магниевые. Группы по соотношению между ионами подразделяются на четыре типа: I тип: HCO3 — > Ca 2+ + Mg 2+ — воды маломинерализованные; II тип: HCO3 — 2+ + Mg 2+ — + SO4 2- — воды умеренной минерализации; III тип: HCO3 — + SO4 2- 2+ + Mg 2+ или, что то же самое, Cl — > Na + — воды высокоминерализованные; IV тип — HCO3 — = 0 – воды кислые, имеются только в сульфатном и хлоридном классе. Для удобства сопоставления анализов воды используют различные способы сокращенного изображения состава. Наиболее часто применяются формула М.Г. Курлова, графические – прямоугольник солевого состава Н.И. Толстихина и треугольники Фере ионного состава. Формула М.Г. Курлова представляет собой псевдодробь, где в числителе располагаются по убывающей анионы с индексом, равным содержанию данного иона в экв/%, в знаменателе — в такой же последовательности катионы. Ионы, содержание которых не превышает 10 экв/%, в формулу не включаются. Количество анионов и катионов округляется до целого числа. Перед дробью даются значение минерализации (М) с индексом, равным количеству сухого остатка в г/л, а также содержание элементов и газов с индексами, равными их содержанию в мг/л. После дроби указываются температура воды в градусах (t 0 C) и активная реакция воды (pH). В наименовании состава воды рекомендуется называть первыми анионы, затем катионы, а также элементы и газы. Ионы, содержание которых в воде менее 25%, не называются. Прямоугольник солевого состава Н.И. Толстихина (рис. 13) состоит из трех вертикальных граф. Левая и правая графы делятся на 10 равных частей, каждая часть приравнивается 10%. Нумерация производится снизу вверх. В левой графе изображаются катионы, в правой – анионы в экв/%. В средней графе показывают состав и процентное содержание солей, которые образуются в результате реакции катионов и анионов. Катионы и анионы на графике располагаются снизу вверх в последовательности, определяемой относительной реактивной силой: K + , Na + , Mg 2+ , Ca 2+ , Fe 2+ , NO3 — , Cl — , Br — , I — , SO4 2- , HCO3 — , CO3 2- .
Рисунок 13 – Прямоугольник солевого состава Треугольники Фере ионного состава (рис. 14) составляются отдельно для катионов и анионов, содержание которых дается в экв/%. В произвольном масштабе вычерчиваются два равносторонних треугольника, в вершинах которых располагаются катионы и анионы. Считается, что в вершине количество каждого катиона и аниона равно 100%. Далее, каждая сторона треугольника делится на 10 равных отрезков, соответствующих 10-ти процентам. Содержание катиона или аниона откладывается в виде точек на двух прилежащих к этой вершине сторонах треугольника. Эти точки затем соединяются прямой линией, параллельной третьей стороне. В итоге в каждом треугольнике получится по три прямые линии, точка пересечения которых графически изображает химический состав воды. 2.2.8 Оценка воды для питьевого водоснабжения. Вода, используемаядля хозяйственно-питьевого водоснабжения, должна удовлетворять требованиям ГОСТ — 2874-82 «Вода питьевая, технические требования к качеству». Согласно этого стандарта ниже приведены предельно-допустимые концентрации (ПДК) для некоторых показателей (табл. 8): Таблица 8 — Нормативы ГОСТ 2874-82
При отсутствии источника с пресной водой разрешается использовать воду с сухим остатком до 1500 мг/л, при общей жесткости до 10 мг-экв/л. В каждом случае возможность использования таких вод должна быть согласована с органами санитарно-эпидемиологической службы. Питьевая вода должна быть прозрачна, бесцветна, не иметь запаха, быть приятной на вкус. Золотисто-желтая или бурая окраска воды свидетельствует о наличии в ней растворенных органических веществ. Соленый вкус обуславливается значительным количеством NaCl, а горький – присутствием MgSO4. Наличие в воде солей азотной и азотистой кислот, а также аммиака указывает на связь этой воды с участками, где происходит разложение органических веществ, следовательно, на возможность наличия болезнетворных бактерий. Кроме того, пригодность воды для питья определяется по наличию кишечной палочки Coli. Сама по себе кишечная палочка безвредна, но ее наличие также свидетельствует о возможном присутствии болезнетворных бактерий. Количественные показатели определяются коли-тиром, т,е. наименьшим количеством кубических сантиметров воды, содержащим одну кишечную палочку (300 см 3 ), или коли-тестом, т.е. наибольшим количеством кишечных палочек, содержащихся в 1 л воды ( 0 C | Второ-степен. компо-ненты, мг/л | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Na + + K + | Ca 2+ | Mg 2+ | HCO3 — | SO4 2- | Cl — | ||||||||||||||||||||||||||||||||||||||||||||||
| 25,0 | 6,5 | 33,0 | CO2=18 Br2=0,6 |
Выполнить следующие виды работ:
а) Пересчитать результаты анализа из ионной формы в миллиграмм-эквивалентную и эквивалент-процентную формы и составить таблицу.
б) Оценить воду по степени минерализации.
в) Определить и оценить воду по всем видам жесткости.
д) Определить и оценить воду по всем видам агрессивности.
е) Произвести классификацию подземных вод по химическому составу.
ж) Выразить химический состав подземных вод в виде:
2) прямоугольника солевого состава
з) Оценить пригодность воды для питьевого водоснабжения.
Порядок выполнения работы
а) Для перерасчета результатов анализа согласно заданию составляется таблица 10.
В природной воде содержание K + составляет всего 4 – 10% от содержания Na + , поэтому все расчеты производятся по Na + .
Таблица 10 — Порядок пересчета из ионной формы в другие
| Основные ионы | мг/л | мг∙экв/л | экв./проц. | пересчетные коэффициен-ты | прочие определения, мг/л |
| Катионы: Na + K + Ca 2+ Mg 2+ | 482,85 20,96 106,86 | 79,07 3,43 17,50 | 0,0435 0,0256 0,0499 0,0822 | CO2=18,0 Br2=0,6 | |
| ∑ ∑r + Анионы HCO3 — Cl — SO4 2- ∑ ∑r — Всего | 610,67 1,15 545,67 56,16 602,98 | 0,19 90,50 9,31 | 0,0164 0,0282 0,0208 |
б) Определяем степень минерализации
Таблица 11 — Классификация подземных вод по общей минерализации
| Оценка воды (раствора) | Минерализация г/л |
| Пресная Солоноватая Соленая Горько-соленая Слабые рассолы Крепкие рассолы | До 1 1 – 3 3 – 10 10 – 50 50 – 100 >100 |
Согласно классификации данная вода горько-соленая (М = 34,940 г/л).
в) Определяем все виды жесткости
Общая жесткость равна 20,96 + 106,86 = 127,82 мг-экв/л
Карбонатная жесткость равна 1,15 мг-экв/л
Постоянная жесткость равна 127,82 – 1.15 = 126,67 мг-экв/л
Таблица 12 — Классификация природных вод по общей жесткости
| Оценка воды | Жесткость, мг-экв/л |
| Очень мягкая Мягкая Умеренно-жесткая Жесткая Очень жесткая | До 1,5 1,5 – 3,0 3,0 – 6,0 6,0 – 9,0 >9,0 |
Согласно таблицы 12 данная вода относится к очень жестким.
г) По значению активной реакции определяем pH среду
Таблица 13 — Классификация природных вод по активной реакции
| Признак | Значение pH |
| Весьма кислые Кислые Нейтральные Слабощелочные Высокощелочные | 9 |
Так как в нашем анализе pH = 6,5, данная среда – кислая.
д) Определяем агрессивные свойства данной воды
— так как значение HCO3 — равно 1,15 мг-экв/л, т.е меньше 1,5 мг-экв/л, агрессивность выщелачивания присутствует;
— так как pH = 6,5, больше 5,0, общекислотная агрессивность отсутствует;
— в нашем анализе содержание свободной углекислоты составляет 18,0 мг/л. Из таблицы 14 берем значения коэффициентов a = 0,00 и b = 17. Вычисляем по формуле: a∙Ca + b = 17. Так как содержание свободной углекислоты составляет 18,0 мг/л, т.е. больше, чем определенное по формуле, углекислая агрессивность присутствует.
— Так как в данном анализе содержание SO4 2- составляет 2700 мг/л при содержании Cl — = 19350 мг/л, сульфатная агрессивность присутствует.
— Содержание Mg 2+ составляет 1300 мг/л (>1000), применяем формулу К — SO4 2- , т.е. 7000 – 2700 = 4300, 1300 0 C pH6,5 ( 5 )
По химическому составу вода хлоридно-натриевая, бромисто-углекислая.
Рисунок 15—Прямоугольник солевого состава.
з) Оценка воды для питьевого водоснабжения
Таблица 15 — Нормативы ГОСТ 2874-82
| № | Показатель | ПДК, не более | Данные анализа |
| Активная реакция, pH Сухой остаток, мг/л Общая жесткость, мг∙экв/л Хлориды Cl — , мг/л Сульфаты SO4 2 , мг/л | 6,0 – 9,0 | 6,5 127,82 |
Вывод: Данная вода по сухому остатку, общей жесткости, содержанию хлоридов и сульфатов не подходит для практического применения.
Таблица 14 — Значения коэффициентов «a» и «b» для определения углекислой агрессивности водной среды.
| Карбонат. жестк. мг-экв/л | Суммарное содержание Cl — + SO4 2- | ||||||||||
| 0 — 200 | 201 -400 | 401 — 600 | 601 — 800 | 801 — 1000 | >1000 | ||||||
| a | b | a | b | a | b | a | b | a | b | b | b |
| 1,4 1,8 2,1 2,5 2,9 3,2 3,6 4,0 4,3 4,7 5,0 5,4 5,7 6,1 6,4 6,8 7,1 7,5 7,8 8,2 8,6 9,0 | 0,01 0,04 0,07 0,10 0,13 0,16 0,20 0,24 0,28 0,32 0,36 0,40 0,44 0,48 0,54 0,61 0,67 0,74 0,81 0,88 0,96 1,04 | 0,01 0,04 0,06 0,08 0,11 0,14 0,17 0,20 0,24 0,28 0,32 0,36 0,40 0,44 0,47 0,51 0,55 0,60 0,65 0,70 0,76 0,81 | 0,01 0,03 0,05 0,07 0,09 0,11 0,14 0,16 0,19 0,22 0,25 0,29 0,32 0,36 0,40 0,44 0,48 0,53 0,58 0,63 0,68 0,73 | 0,00 0,02 0,04 0,06 0,08 0,10 0,12 0,15 0,17 0,20 0,23 0,26 0,29 0,33 0,36 0,40 0,44 0,48 0,53 0,58 0,63 0,67 | 0,00 0,02 0,04 0,06 0,07 0,09 0,11 0,13 0,16 0,19 0,22 0,24 0,27 0,30 0,33 0,37 0,41 0,45 0,49 0,53 0,57 0,61 | 0,00 0,02 0,04 0,05 0,07 0,08 0,10 0,12 0,14 0,17 0,19 0,22 0,25 0,28 0,31 0,34 0,38 0,41 0,44 0,48 0,52 0,56 |
Вопросы для контроля знаний студентов
1. Перечислите основные физические свойства подземных вод и показатели, которыми они характеризуются.
2. Что входит в понятие «состав подземных вод»?
3. Каковы источники минерализации подземных вод? Что входит в понятие общей минерализации воды?
4. Что называется агрессивной углекислотой? Перечислите все виды агрессивности воды по отношению к бетону.
5. Каковы свойства жесткой воды и в каких единицах выражается жесткость?
6. Почему при кипячении жесткость уменьшается?
7. Какой показатель pH должна иметь вода, чтобы ее можно было отнести к кислотной, активной по отношению к металлам?
8. Как оценивается пригодность воды для питьевых целей? При каком коли-титре вода считается допустимой к употреблению без кипячения?
9. Как проводится пересчет результатов анализа воды из весовой формы в эквивалент-процентную?
10. Чем отличаются минеральные воды от минерализованных?
Список использованных источников
1. Ларионов А.К. Занимательная гидрогеология. – М.: Недра, 1979. – 155 с.
2. Николадзе Г.И. Улучшение качества подземных вод. – М.: Стройиздат, 1988. – 366 с.
3. Пешковский Л.М., Перескокова Т.М. Инженерная геология. – М: Высшая школа, 1982. – 344 с.
4. Седенко М.В. Основы гидрогеологии и инженерной геологии. – М: Недра, 1979. – 216 с.
5. Ташенов К.М. Подготовка технической воды. – А: КазГАСА, 1977. – 173 с.
6. Толстой М.П., Малыгин В.А. Геология и гидрогеологи. – М: Недра, 1988. – 274 с.
источник