Жесткостью воды называют химическое качество, определяющее объем присутствующих в жидкости примесей соляного кальция и магния. Данный показатель — одно из ключевых качеств воды, которое всегда проверяется в процессе анализа жидкости на предмет пригодности для употребления и бытового применения. Знать о норме показателей и о том, как определить жесткость воды, крайне важно. Знание данного качества жидкости позволит сохранить здоровье и продлить работоспособность техники, так или иначе использующей в своей работе воду.
Микробиологические исследования и химические научные опыты определили, что жесткостью воды единицы измерения является содержание в ней большей части солей кальция (Са2+) и несколько меньшего количества магния (Mg2+). На самом деле ситуация обстоит так, что оба эти элементы участвуют в формировании показатель определения жесткости воды и не могут существовать отдельно. В процессе химических реакций с анионами, соли кальция и магний формируют специальные кристаллы жесткости, которые оседают на дно и в дальнейшем используются в качестве биологического материала при проверке воды и ее химического состава.
Таблица наличия в воде катионов металлов и анионов и тест на жесткость воды позволяют узнать детальней о процессе формирования кристаллов жесткости и характере их развития. Влияние на временную жесткость воды и каждого из металлов является различным и зависит от типа жидкости и источника ее происхождения. К примеру такие металлы, как стронций, железо и марганец могут оказывать на состав и степень жесткости воды менее выраженное воздействие и практически не котироваться при анализе и проведении химической экспертизы. Алюминий оказывает влияние на общую жесткость воды, только если кислотность воды достигает нужного уровня, что встречается исключительно в природных водоемах. Из этого следует, что наличие и патогенное воздействие на воду выше указанных металлов при проверке воды бытового использования практически не учитывается из-за крайне низких показателей. Крайне малое влияние на показатель жесткости воды и способы ее устранения также может оказывать барий.
Проверка воды на показатель жесткости проводится в несколько этапов, с учетом типа водоема, в котором был произведен забор, условий содержания жидкости и цели произведенной экспертизы. Как определить жесткость воды в домашних условиях? Чаще всего жесткость при проверке делят на следующие группы:
- Жесткость воды общего типа. В процессе определения вида жесткости воды этого показателя выводится единица наибольшей концентрации солей кальция и магния. Данный показатель рассчитывается путем выведения данных о постоянной жесткости воды и непостоянной, временной жесткости некарбонатного типа. Для того чтобы смягчить воду при завышенных показателях общей жесткости используют ионизирующие фильтрующие установки для воды и таблицу жесткости воды.
- Жесткость карбонатного типа. Проверка позволяет выявить наличие в составе воды карбонатных и гидрокарбонатных элементов солей кальция и магния. Такой вид жесткости нередко может называться временным, поскольку устранить завышенные показатели поможет кипячение и вываривание лишних солей. Нагревание воды способствует тому, что гидрокарбонаты и карбонаты кальция и магния раскладываются и становятся осадочным веществом на дне посудины. Такой тип не постоянной жесткости воды превращается в бытовой налет, который нередко можно наблюдать на посуде, в которой часто кипятится вода. Как устранить жесткость воды? Очистить жесткость такой воды можно также путем использования ионизирующих фильтров или механизмов для устранения лишних солей.
- Жесткость воды некарбонатного типа. Данный тип проверки позволяет выявить в воде присутствие кислот солей кальция и магния сильного воздействия. В число таких кислот входят серная, азотная и соляная кислоты. Данный вид не карбонатной жесткости воды нельзя устранить простым кипячением воды и вывариванием патогенных элементов. Постоянную жесткость нередко очищают ионизирующими фильтрами или растворяющими соль веществами.
В чем измеряется жесткость воды? Стоит отметить, что мировая таблица единиц измерений имеет несколько разных обозначений для типов и разновидностей жесткости. Каждая из этих единиц взаимосвязана с остальными. На территории постсоветского пространства до их пор используют единицу моль для обозначения показателя определения общей жесткости воды. В европейских государствах могут нередко использовать такие обозначения как do, dH, fo. В США используется обозначение ppm CaCO3.
Изначально стоит отметить, что вся жидкость мирового океана имеет определенные показатели жесткости, то есть в ее химическом составе неизменными веществами являются соли кальция и магний, а также несколько других щелочных металлов и земельных веществ. От чего зависит жесткость воды? Такой состав жидкости обуславливается тем, что минеральные воды изначально проистекают на поверхность из залежей многовековых пластов известняка и разных типов доломита. Соли кальция и магний попадают в воду путем химической связи диоксида углерода с группой минералов. Процесс выветривания и химической деформации горных пород приводит к образованию кристаллов жесткости в воде. Их источники — природные залежи известняков, гипса и доломитов. Ионизирующие вещества многовековых залежей, через которые протекает вода, могут появляться из-за еще не изученных биологических реакций и процессов в глубине плит на месте, из которого проистекает жидкость. Добавлять в состав побочные минералы и кристаллы способны и другие химические примеси, сточные воды, элементы и организмы окружающей среды.
Большинство минерализованной воды, которая попадает в открытые водоемы и становится источником жидкости для бытового и промышленного существования, имеет жесткость, превышающую показатели 75-85%. Как проверить жесткость воды в домашних условиях? Такой высокий показатель свидетельствует о том, что вода содержит повышенное количество солей кальция и магния из-за наличия ионизирующих горных пород. С учетом источника минеральной воды, в ряде случаев уровень жесткости не превышать 60%. Важно отметить, что от показателя минерализации напрямую зависит наличие ионов кальция. Жесткость воды, норма для питьевой воды такова: в открытых водоемах с пресной водой уровень содержания кальция не поднимается выше, чем 1 г из расчета на литр воды; соленые водоемы могут содержать примерно 10-15 г солей кальция на литр.
Стоит сказать, что показатель жесткости и концентрация солей кальция в воде напрямую определяется типом воды и местом ее расположения. Так, поверхностные воды нередко могут иметь наиболее низкие показатели жесткости, тогда как подземные водоемы или озера могут быть максимально жесткими и насыщенными солями. Концентрация солей в воде находится также в прямой зависимости от времен года и сезонных осадков. В конце зимы наличие кристаллов жесткости может увеличиваться, однако в период таяния снега и выпадения мягкой воды в виде снега и дождя кристаллы солей разбавляются и показатели жесткости заметно снижаются. Максимально жесткой вода считается в океанах и морях, где концентрация солей является максимально высокой.
Жесткость воды и ее показатели являются позволительными и удовлетворительными, в зависимости от цели использования жидкости. Если вода предназначается для использования в бытовых целях, показатели ее жесткости не должны превышать 2-6 мг на литр. Такая концентрация солей кальция считается максимально допустимой для бытового использования и не вредит человеческому здоровью. Прибор для измерения жесткости воды показывает, что промышленные цели использования воды могут повышать показатель жесткости до 10 мг на литр, однако не более этих рамок. Важно отметить, что вода с высоким показателем жесткости является, как правило, слишком горькой и имеет характерный запах, а также может оказывать патогенное воздействие на пищеварительную систему и желудочно-кишечный тракт, что делает ее непригодной для использования в пищевых или бытовых целях.
Важно сказать, что Всемирная организация здравоохранения проводит множество исследований и до сих пор не может найти единого ответа на вопрос о том, насколько велика патогенность влияния жесткой воды на человеческий организм и полезно ли постоянное использование в пищу только мягкой и фильтрованной воды без примесей солей и кальция. Предварительные исследования говорят о том, что некоторые типы вод с повышенным показателем жесткости могут провоцировать сердечно-сосудистые заболевания, проблемы с суставами и каменные болезни.
Специалисты компании ЭкоТестЭкспресс производят качественную аналитику жесткости воды в зависимости от требуемых целей и особенностей проверки. Связаться с нами, оставить заявку можно в онлайн-форме ниже.
источник
Жесткость воды, норма которой служит критерием качества не только в исследовании питьевой, но и в применяемой для технических нужд, определяется наличием примесей. Определяемый показатель и есть та цифра (так называемый градус жесткости), на который превышено присутствие посторонних молекул по отношению к стандартному значению нормы. Для питьевой воды необходимо сразу определять несоответствие нормативам, чтобы исключить осложнения со здоровьем.
Поставка воды, горячей и холодной, потребителю требует от предприятия, которое несет ответственность за этот процесс, соблюдения определенных норм. Их регламентируют ГОСТы, Санитарные правила и нормы (СанПиН) и другие нормативные документы, согласно которым определяется соответствие требованиям.
В обработке применяются химические реактивы, позволяющие снизить уровень эпидемиологической безопасности.
Отметим некоторые особенности:
- Питьевая вода средней степени жесткости считается относительно нормальным явлением в водопроводных системах, она же – наиболее частый вариант в родниковой и добываемой из артезианских скважин.
- Мягкая – это дождевая (хотя в современной неблагоприятной экологии она может с огромной степенью вероятности содержать вредоносные примеси). Под это определение подпадает жидкость, подвергавшаяся длительному кипячению, не очень желательная для применения в пищевых нуждах, и дистиллированная, полностью от них избавленная.
- К жесткой относится любая вода (из моря, океана или вытекающая из минеральных напластований) с большим содержанием в ней примесей. Они могут превышать треть общего объема исследуемой жидкости, и только 2/3 приходятся на привычные атомы водорода и кислорода.
Применяя жесткую жидкость в работе с бытовой техникой, можно быстро прийти к необходимости ремонта. Обычное мыло при ручной стирке или при мытье в ней растворяется плохо.
Проблема соответствия необходимому показателю жесткости воды в водопроводном кране состоит не только в источнике, из которого она добывается. Общая жесткость воды бывает постоянной и временной.
И если вторую, карбонатную кальциевую и магниевую, можно нейтрализовать кипячением, то перманентно присутствующая может повлиять на состояние здоровья потребителя, исправность стиральной машины или чайника. Она практически ничем не устранима.
Природная вода может менять свои показатели в результате сезонной миграции потоков от дождя и таяния снега. Зимой, когда таких явлений в природе не наблюдается, уровень показателей обычно становится более жестким.
Оптимальной мягкостью по нормам обладает вода из поверхностных потоков или та, что протекает в местах залегания доломитов или известняковых пород.
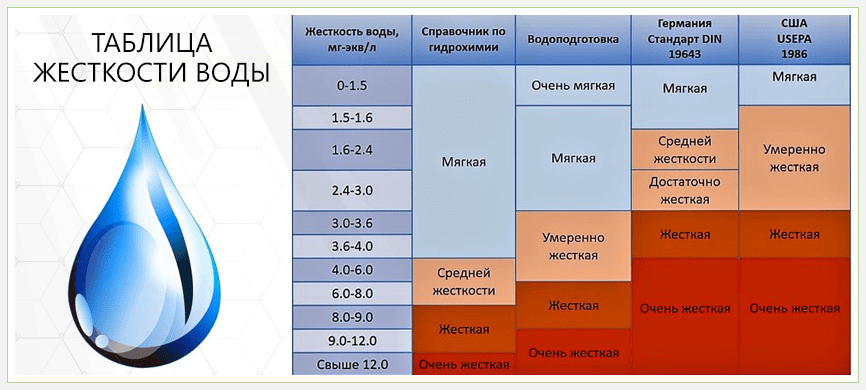
Еще совсем недавно жесткость питьевой воды измерялась в Российской Федерации в молях на метр кубический (моль/м3). Эта единица в Советском Союзе и в России применялась начиная с 1952 года и вплоть до 2014 г., когда был снова введен международный стандарт.
До середины прошлого столетия в СССР использовался в качестве единицы измерения жесткости градус, соответствующий современному немецкому (dH). Он и французский градус (fo) используются в качестве единицы измерения в странах Европы. У Соединенных Штатов Америки есть свой, американский градус, ppm.
С 2014 года Россия ввела в обращение градус жесткости (°Ж). Его значение в понимании простого человека не составит особых затруднений, потому что моль на кубический метр и ½ миллимоля на литр (значение 1 °Ж) – понятия родственные.
Речь идет просто об уменьшении масштабов исследуемого сырья. Сейчас чаще используется нормативное обозначение 1 мг-экв/л, которое равняется ½ миллимоля на литр. Но для ионов кальция и магния имеет разное цифровое значение:
- ионов Ca 2+ – 20,04 мг;
- ионов Mg 2+ – 12,16 мг.
Эти показатели – вовсе не норма жесткости воды для питья. Это общепринятые единицы измерения, тождественные друг другу в контексте, когда речь идет об одном °Ж, ½ миллимоля на литр (ммоль/л) или 1 мг-экв/л.
Для кальция и магния все эти обозначения выражаются в разных числовых показателях. Нормативы в Российской Федерации, определенные в СанПиН, могут быть вариативными, если нужно обозначить нормальную жесткость воды для питья (речь идет только о магнии), бутилированной (кальций и магний).
Всемирная организация здравоохранения установила отдельные значения для понятия «норматив жесткости воды». Они находятся ниже планки российских требований. Однако фактическое водоснабжение в некоторых регионах, например в Москве, с трудом укладывается в общие нормы ВОЗ.
По статистическим данным, столица России находится где-то на среднем уровне между другими крупными мировыми мегаполисами. В Париже и Берлине дела обстоят хуже, а в Нью-Йорке и Сиднее показатели выглядят менее жестко.
В Российской Федерации есть некоторые расхождения норм с международными стандартами. Разнообразие природных и климатических условий, вариативность используемых для добычи питьевой воды и жидкости для бытового использования не позволяет установить безоговорочно единые нормативы, обязательные для любого региона.
Однако нормы жесткости воды питьевой в целом соответствуют рекомендациям ВОЗ. В неблагополучной экологической обстановке они приводятся в соответствие с санитарно-гигиеническими нормами страны различными способами. Вариантов для этого достаточно много.
На сегодняшний день потребитель может сам контролировать наличие в воде, подаваемой из крана, нормы показателя жесткости и устанавливать различные приспособления для приведения ее в соответствие нормам санитарии и гигиены.
Приведенные ниже нормы касаются временной жесткости, устранение которой возможно и самыми простыми способами. В домашних условиях самый известный – паровой – проводится кипячением воды в чайнике.
Таблица показателей норм кальция и магния по требованиям СанПиН РФ и нормативам ВОЗ.
| Нормативный документ | Продукт | Магний | Кальций | °Ж |
| СанПиН 2.1.4.1074-01; ГН 2.1.5.1315-03 | Питьевая вода | до 50 мг/л | не регламентируется | 7 |
| СанПиН 2.1.4.1116-02 | Бутилированная вода | 5–65 мг/л | 25–130 мг/л | 1,5–7 |
| Рекомендации ВОЗ | Питьевая вода | 10–30 мг/л | 20–80 мг/л | не обозначается |
Измерение в градусах жесткости выглядит следующим образом: менее двух °Ж – это мягкая вода, начиная с двух и до десяти °Ж средней жесткости – нормальный уровень, более 10 – жесткая. Однако в аквариуме нормальным может считаться и показатель в 15 градусов жесткости. Все зависит от того, какие в нем живут обитатели.
Снижение кальция в аквариумной воде происходит за счет потребления необходимых для жизнедеятельности ионов растениями, моллюсками и рыбками. Для понижения уровня временной жесткости могут использоваться разные методы и приспособления.
Воду на питие кипятят. О результативности метода наглядно свидетельствует уровень накипи в чайнике. В бассейне может использоваться мембранный метод фильтрации или магнитогидродинамический резонанс.
Как и в случае с уровнем подогрева горячей воды, потребитель вправе выдвигать претензии к поставляющей организации, если речь идет о временной жесткости. Обилие ионов магния или кальция свыше нормы не только изменяет вкусовые качества воды для питья, но и вредно влияет на здоровье человека, выводит из строя бытовую технику.
В распоряжении поставщика может находиться одно из многочисленных устройств для смягчения воды. Однако недобросовестные компании игнорируют существующие требования нормативов. Для того чтобы говорить о недопустимости существующего в питьевой воде показателя, нужно произвести определенные измерения и сравнить с нормой жесткости.
В данном случае доморощенные критерии, вроде мыла, которое плохо мылится даже в горячей воде, или быстро образующаяся накипь на чайнике неприемлемы.
Пробы воды можно отнести в СЭС, где будут выявлены и патогенные микроорганизмы, и органические примеси, и ядовитые вкрапления вроде нитратов. Для домашнего экспресс-анализа можно применить тест-полоски, стоимость которых не превышает 500 руб.
Если речь идет о самостоятельном водоснабжении особняка, коттеджа или загородного дома из подручных источников, вроде артезианской скважины, можно сделать комплексный анализ в специализированной лаборатории, стоимость которого вариативна.
В лаборатории МГУ анализ жесткости воды выйдет недешево, а в местной может варьироваться от 1200 до 4500 руб., если потребуется расширенный. Зато имея на руках все показатели и выявив несоответствия с какими-либо нормами жесткости в используемом источнике, можно подобрать одну из многочисленных систем очистки воды.
Это поможет обезопасить собственное здоровье от грядущих неприятностей и чувствовать себя комфортно. Данные меры также обеспечат сохранность бытовой техники.
источник
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды.
- жёсткой называется вода с большим содержанием солей ,
- мягкой с малым содержанием
«Жёсткая» вода — исторически: ткань, постиранная с использованием мыла на основе жирных кислот в жёсткой воде — более жёсткая на ощупь. Этот факт объясняется, с одной стороны, отложением на ткани кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне.
- временная (карбонатная) жёсткость, — обусловлена гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2,
- постоянная (некарбонатная) жёсткость — вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
| Жесткость, °Ж | Кальций, мг/л | Магний, мг/л | |
|---|---|---|---|
| Москва | 2,0-5,5 | 46 | 11 |
| Париж | 5,0-6,0 | 90 | 6 |
| Берлин | 5,0-8,8 | 121 | 12 |
| Нью-Йорк | 0,3-0,4 | 6 | 1 |
| Сидней | 0,2-1,3 | 15 | 4 |
- Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
- кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается. Московская питьевая вода по данным показателям соответствует рекомендациям ВОЗ.
- Российские нормативные документы (СанПиН 2.1.4.1074-01 и ГН 2.1.5.1315-03) для питьевой воды регламентируют:
- кальций – норматив не установлен; магний – не более 50 мг/л; жесткость — не более 7°Ж.
- Норматив физиологической полноценности бутилированной воды (СанПиН 2.1.4.1116-02):
- кальций – 25-130 мг/л; магний – 5-65 мг/л; жесткость – 1,5-7°Ж.
- По содержанию кальция и магния бутилированная вода высшей категории официально ничем не лучше воды из-под крана
| °Ж = 1 мг-экв/л | mmol/L | ppm, mg/L | dGH, °dH | gpg | °e, °Clark | °fH | |
| 1 русский °Ж = 1 мг-экв/л это: | 1 | 0,5 | 50,05 | 2,804 | 2,924 | 3,511 | 5,005 |
|---|---|---|---|---|---|---|---|
| 1 ммоль/л = mmol/L это: | 2 | 1 | 100.1 | 5.608 | 5.847 | 7.022 | 10.01 |
| 1 американский° ppmw = mg/L = American degre: | 0,01998 | 0.009991 | 1 | 0.05603 | 0.05842 | 0.07016 | 0.1 |
| 1 немецкий° dGH, °dH это: | 0,3566 | 0.1783 | 17.85 | 1 | 1.043 | 1.252 | 1.785 |
| 1 американская популярная ед. gpg это: | 0,342 | 0.171 | 17.12 | 0.9591 | 1 | 1.201 | 1.712 |
| 1 английский °e, °Clark это: | 0,2848 | 0.1424 | 14.25 | 0.7986 | 0.8327 | 1 | 1.425 |
| 1 французский °fH это: | 0,1998 | 0.09991 | 10 | 0.5603 | 0.5842 | 0.7016 | 1 |
| Пример: 1 °Ж = 50,05 ppm | |||||||
- американские градусы жесткости воды, внимание тут два пункта:
- gpg = Grains per Gallon: 1 гран (0.0648 г) CaCO3 в 1 американском галлоне (3.785 л) воды. Поделив граммы на литры получаем: 17.12 мг/л СаСО3 — это не «американский градус», но очень употребляемая в штатах величина жесткости воды.
- американский градус = ppmw = mg/L = American degre: 1 часть CaCO3 в 1000000 частей воды 1мг/л CaCO3
- английские градусы жесткости воды = °e = °Clark: 1 гран (0.0648 г) в 1 английском галлоне (4.546) л воды = 14.254 мг/л CaCO3
- французские градусы жесткости воды (°fH or °f) (fh): 1 часть CaCO3 в 100000 частей воды, или 10 мг/л CaCO3
- немецкие градусы жесткости воды = °dH (deutsche Härte = «немецкая жесткость» может быть °dGH (общая жесткость) или °dKH (для карбонатной жёсткости)): 1 часть оксида кальция – СаО в 100000 частей воды, или 0.719 частей оксида магния – MgO в 100000 частей воды, что дает 10 мг/л СаО или 7.194 мг/л MgO
- русский (РФ) градус жесткости воды °Ж = 1 мг-экв/л: соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр, что дает 50,05 мг/л CaCO3 or 20.04 мг/л Ca2+
- ммоль/л = mmol/L: соответствует концентрации щелочноземельного элемента, численно равной 100.09 мг/л CaCO3 or 40.08 мг/л Ca2+
- Термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
- Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
- Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
- Реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
- Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
- Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
- 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
- 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
- Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
- Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование.
- При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж.
- В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду.
- Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %.
- Различают нанофильтрацию (условный диаметр отверстий мембраны равен единицам нанометров) и пикофильтрацию (условный диаметр отверстий мембраны равен единицам пикометров).
- В качестве недостатков данного метода следует отметить:
- — необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану;
- — относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны);
- — низкую минерализацию получаемой воды (особенно при пикофильтрации). Вода становится практически дистиллированной.
- Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
источник
Вода имеет огромное значение в жизни каждого человека. Организм представляет собой комплекс водных растворов, суспензий и коллоидов. Степень жесткости воды непосредственно влияет на состояние организма, а также отвечает за долгий срок службы бытовой техники.
Фактически ни один из природных источников не обладает идеальным составом воды H2O. Основными источниками влаги являются поверхностные
наземные и подземные воды. Почему вода стала жесткой? Что на нее влияет? Процесс начинается еще в период ее формирования в горных породах. Жесткость воды – это комплекс физических характеристик воды, соответствующих количеству солей щелочноземельных металлов. Он претерпевает изменения также в соответствии с климатом, погодными условиями. Особо влияет на состав техногенный фактор, включающий сточные воды промышленного и бытового характера, сельского хозяйства. Влага из открытых и подземных источников требует очистки, чтобы соответствовать нормативным требованиям СанПин.
От чего зависит изменение состава воды? Жесткость обеспечивается повышенным содержанием минералов и химических элементов: железа, сульфидов, фторидов, марганца, солей кальция и магния, органических соединений. Она проявляется в ухудшении вкусовых параметров воды, плохом образовании пены при использовании мыла, стянутости кожи после умывания. Характерная жесткость волос, скрип после мытья говорят о разрушении защитной жировой пленки вследствие негативного воздействия повышенного количества минералов. Но излишне мягкая вода обладает высокими коррозионными свойствами, сказывающимися на состоянии водопроводных труб. Отсутствие необходимых минералов в составе мягкой воды приводит к развитию рахита у детей, так как кости не получают требуемых веществ.
Общий показатель минерализации представлен временной и постоянной составляющей:
- Временная (карбонатная). В составе, кроме катионов Ca2+, Fe2+, Mg2+, содержатся также растворимые бикарбонаты Mg и Ca. После кипячения они становятся нерастворимыми карбонатами, образующими накипь.
- Постоянная (некарбонатная). Независимо от кипячения жидкость такого типа сохраняет свои жесткие признаки, так как содержит соли магния
и кальция нитратных, хлоридных, сульфатных анионов.
Вода допустимой жесткости пригодна для питья. Содержащиеся в ней микроэлементы нужны человеческому организму:
- Магний. Активизирует обмен углеводов, участвует в образовании белков, уменьшает возбудимость нервных клеток.
- Кальций. Поддерживает костную ткань, отвечает за работу сердца, свертываемость крови, расслабление мышц, работу иммунитета.
Постоянный прием жесткой воды ведет к проблемам функционирования пищеварительной системы, формированию камней в почках, печени, желчном пузыре. Нормальный уровень минерализации составляет не более 7 мг/л. При бытовом использовании временная жесткость приводит в негодность бытовую технику из-за образования плотного налета накипи.
Какая должна быть вода для питья и бытовых нужд? Классификация единиц измерения жесткости весьма разноплановая. Часто можно увидеть обозначение в миллимолях на литр, принятое на постсоветском пространстве. Миллимолем называют единицу объема соли жесткости на литр воды. Единицей измерения жесткости воды за границей является градус жесткости. Основные категории обозначения:
- ppm (мг/литр) CaCO3;
- DH – Германия (1 dH=17,8 ppm);
- F – Франция (1 f =10 ppm);
- A – Америка (1A=50,05 ppm);
- Clarc – Великобритания (1 Clarc=14,3 ppm);
- мг-экв/л (1 мг-экв/л =50,05 ppm).
Как рассчитать жесткость воды? Один мг-экв/л – это 20,04 миллиграмм Ca2+ или 12,16 миллиграмм Mg2+ на литр. Норма жесткости – 1,0–2,0 мг-экв/л. Водопроводная вода имеет жесткость от 1,5 до 5 мг-экв/л, что зависит от водозабора и не требует корректировки. Централизованный источник водоснабжения обязан выдавать питьевую воду с нормальной жесткостью – до 7 мг-экв/литр (в исключительных случаях – не более 10 мг-экв/литр).
После 2005 года Россия применяет новый национальный стандарт, определяющий параметры известковости. Для измерения содержания солей используется «градус жесткости» – °Ж, который равняется 1 мг-экв/литр. Формула общего показателя °Ж – H общая = H карбонатная + H некарбонатная. В соответствии с этим коэффициентом шкала степени мягкости подразделяется на несколько категорий:
- сверхжесткая – свыше 12 мг-экв/л;
- жесткая – более 10 °Ж (от 8 до 12 мг-экв/л);
- средняя – от 2 до 10 °Ж (от 4 до 8 мг-экв/л);
- мягкая – до 2 °Ж (до 4 мг-экв/л);
- очень мягкая (до 1,5 мг-экв/л).
Какая должна быть вода? Характеристика высококачественной питьевой воды по нормативным требованиям:
- органолептические характеристики: прозрачность, отсутствие запаха, приятный вкус;
- pH = 7–7,5, жесткость не превышает значение 7 ммоль/л, что является средним уровнем. Допускается небольшое ощелачивание воды, но не окисление;
- общее число минералов не выше 1 г/л, вода является слабоминерализованной;
- отсутствие вредных веществ или концентрация в пределах десятых-сотых долей ПДК;
- отсутствие вирусов, бактерий, грибков.
Даже средний параметр жесткости по стандарту, равняющийся 4–5 °Ж, уже доставляет неприятности в виде налета извести на мойке, накипи на чайнике, белесых разводов на посуде, забитого аэратора водопроводного крана.
Как измеряется жесткость воды? Степень жесткости следует знать не только в отношении питьевой воды. Аквариумисты сталкиваются с необходимостью создания определенной минерализации водной среды для разведения рыб. Выращивание комнатных растений также требует информированности о показателе жесткости.
Оборудование для очистки невозможно подобрать правильно без понимания результатов анализа. Самым точным измерением является лабораторный анализ, сделанный в Санэпидемстанции. Фиксирование степени минерализации производится тремя основными методами:
- химическим;
- комплексонометрическим (определение карбонатной и временной жесткости);
- атомной спектрометрии.
Все приборы диагностирования, от бытовых до профессиональных лабораторных, позволяют осуществлять контроль над составом и уровнем загрязнения. Анализ питьевой воды осуществляется не только стационарно, но и непосредственно на точке забора.
Анализаторы воды подразделяются на монопараметрические (анализ одного параметра) и многопараметрические (анализ нескольких характеристик). С их помощью проводятся исследования всех типов воды: питьевой, технической, грунтовой, из искусственных водоемов; сточной. При этом анализ производится на основе химического, оптического, электрохимического, хроматографического, фотохимического метода.
Анализаторы могут быть портативными, производящими замер параметров в течение 5 минут в бытовых или полевых условиях. Другой вариант анализаторов – стационарный. Они монтируются в проточных трубах водопровода и других магистралей. Постоянная работа устройств обеспечивает выдачу объективных данных состава воды каждый час.
Одним из самых доступных механизмов для определения жесткости является электролизер. Этот аппарат не производит измерений, жесткость определяется по степени изменения цвета воды во время его работы. Более точный инструмент, помогающий получить косвенные показатели величины общей жесткости – TDS-3. Принцип его работы основан на определении электропроводности.
Наиболее быстрый способ установления жесткости в домашних условиях — использование тест-полоски со специальным реагентом. Опущенная в воду полоска начнет менять цвет в соответствии с концентрацией жесткости воды. Точность у приема невысокая, результат определяется по интенсивности окраса путем сравнения с градацией возможных вариантов.
- Термический. Производится кипячение.
- Реагентный (известь, сода кальцинированная и пищевая, едкий натр, синтетические средства). Наблюдается появление осадка нерастворимых соединений кальциевых и магниевых солей. Один из лучших реагентов – ортофосфат натрия, понижающий уровень жесткости до 0,05 °Ж.
- Мембранный. Ионы отделяются посредством нанофильтрации и обратного осмоса полунепроницаемой мембраны.
- Магнитный и Электромагнитный. Магнитогидродинамический резонанс предотвращает кристаллизацию карбоната кальция. Происходит его модификация в арагонит, лишенный свойства откладываться на поверхностях.
- Ионообменный.
- Комбинированный.
Простая технология устранения жесткости – это процесс кипячения, в результате которого часть солей гидрокарбоната кальция разлагается. Но такой метод не полностью избавляет от жесткости и не годится для больших объемов воды. Водопроводная кипяченая вода приносит человеку лишь вред. Процесс кипячения увеличивает вредоносность хлорорганики, содержащейся в ее составе и обладающей канцерогенными свойствами.
Защитить технику позволяет бытовая химия, например, специальное средство «Калгон». Действие подобных препаратов основано на предотвращении выпадения солей в осадок. Метод подходит лишь для защиты стиральной или посудомоечной машины. Такие вещества не предназначены для питьевой воды. Добавление извести для очистки должно сочетаться с применением реагентов-коагулянтов. Способ помогает снизить повышенное содержание карбонатных соединений.
Сочетание извести и соды позволяет смягчить воду до 1,4–1,8 мг-экв/л. Если жидкость обладает карбонатной жесткостью, то применяется сода с натрием. Недостатком приема использования реагентов является наличие твердого осадка, очистка только не питьевой воды, непременность точной дозировки и безопасного хранения.
Более простой механизм для очистки жесткой воды – магнитный. Он эффективен для технической воды, позволяя контролировать чистоту внутренних поверхностей оборудования. В пластиковом корпусе находится процессор, постоянный магнит, два провода. Процесс основывается на изменении физических свойств воды. Минерализующие элементы перестают образовывать накипь и отложения, устраняются с потоком. Образующийся шлак скапливается в отстойниках, а затем удаляется.
Электромагнитный способ базируется на использовании электромагнитных волн. Ионы кальция и магния не осаждаются, а в виде взвесей ликвидируются вместе со струей воды. При этом происходит очистка загрязненных ранее участков.
Самый экономичный и доступный рецепт смягчения воды – это ионообменный кувшин с электромагнитом. Процесс очистки основан на ионообменных свойствах мелкозернистой натриевой смолы. Объем очищаемой воды небольшой, запас ионов в смолах требует своевременной регенерации или замены, но качество очистки хорошее.
Устранение жесткости происходит реагентным путем, использованный картридж подлежит замене. Подобного типа прибор может быть магистральным, врезаемым непосредственно в трубу. Так осуществляется очищение всей поступающей в квартиру воды. При этом затраты при использовании возрастают из-за потребности создания обходного пути или запорной арматуры, а также замены картриджей. Смена картриджа производится раз в квартал. Недостаток метода – в очистке воды, не предназначенной для питья и приготовления пищи.
Есть также усовершенствованный вариант – мембранный, служащий основой для обратноосмотического эффекта. Посредством избыточного давления жесткая влага продавливается сквозь полупроницаемую мембрану, освобождаясь от всех солей и примесей. На выходе остается почти дистиллированная вода. Это тактика максимальной очистки. После такой обработки вода требует дополнительной минерализации.
Для смягчения питьевой воды применяются фильтры:
- Фильтр обратного осмоса. Производит полную очистку от всех ненужных примесей и солей, придающих жесткость воде. Обратноосмотическая мембрана действует до 1,5 лет, картриджи меняют раз в полгода.
- Проточный фильтр под мойку («Умягчающий», H). Дополнительный картридж содержит ионообменную смолу внутри, заменяющую ионы солей магния и кальция безопасными ионами натрия.
Все перечисленные методики могут использоваться также в различных комбинациях друг с другом.
Изменение параметра жесткости в меньшую сторону – это недешевая операция, требующая вложения денег. Развитие современных технологий вносит новые решения очистки. Снижение высокой минерализации воды – это жизненная потребность любого человека, желающего оставаться здоровым.
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
Чтобы выразить жесткость воды в цифрах, указывают концентрацию в ней ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы жесткости и миллиграмм-эквиваленты на литр (мг-экв/л).
Чтобы выразить жесткость воды в цифрах, указывают концентрацию в ней ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы жесткости и миллиграмм-эквиваленты на литр (мг-экв/л).
По действующему ГОСТу 31865-2012 единицей измерения жесткости воды является градус — °Ж. 1°Ж = 1 мг-экв/л. Для сравнения 1°Ж (Россия) = 2,8 dH (Германия).
По величине данного показателя вода делится на 3 категории:
По действующему ГОСТу 31865-2012 единицей измерения жесткости воды является градус — °Ж. 1°Ж = 1 мг-экв/л. Для сравнения 1°Ж (Россия) = 2,8 dH (Германия).
По величине данного показателя вода делится на 3 категории:
По санитарным правилам и нормам ( СанПиН 2.1.4.1074–01 ) жесткость питьевой воды из централизованного источника водоснабжения не должна превышать 7 мг-экв/л (в отдельных случаях 10 мг-экв/л).
На практике даже «средняя» жесткость вызывает заметный дискомфорт. Уже 4–5 °Ж дадут о себе знать: оставят накипь в чайнике и плёнку на самом чае, известковый налет на мойке и белые разводы на посуде, «забьют» аэратор водопроводного крана и лейку душа.
По санитарным правилам и нормам ( СанПиН 2.1.4.1074–01 ) жесткость питьевой воды из централизованного источника водоснабжения не должна превышать 7 мг-экв/л (в отдельных случаях 10 мг-экв/л).
На практике даже «средняя» жесткость вызывает заметный дискомфорт. Уже 4–5 °Ж дадут о себе знать: оставят накипь в чайнике и плёнку на самом чае, известковый налет на мойке и белые разводы на посуде, «забьют» аэратор водопроводного крана и лейку душа.
Вариант «Точно»:
Самый точный метод определить жесткость воды — сдать ее на анализ в лабораторию. Например, в Санэпидемстанцию. СЭС проверит не только концентрацию солей жесткости, но и зафиксирует нитраты, пестициды, уровень содержания железа, сероводород, органические примеси и другие вещества, которые часто встречаются в грунтовых водах. Если вы подбираете систему водоочистки для коттеджа, вам обязательно нужно сделать анализ воды.
Вариант «Точно»:
Самый точный метод определить жесткость воды — сдать ее на анализ в лабораторию. Например, в Санэпидемстанцию. СЭС проверит не только концентрацию солей жесткости, но и зафиксирует нитраты, пестициды, уровень содержания железа, сероводород, органические примеси и другие вещества, которые часто встречаются в грунтовых водах. Если вы подбираете систему водоочистки для коттеджа, вам обязательно нужно сделать анализ воды.
Вариант «Быстро»:
Использовать тест-полоски для определения жесткости воды. Они продаются в зоомагазине или в магазине с кофе-машинами, иногда — в фирменных магазинах бытовой техники. Такой тест покажет примерную жесткость. На бумагу нанесен реагент, который при контакте с водой меняет окрас. Полоска опускается на время в воду, и интенсивность ее окраса будет меняться в зависимости от концентрации вещества в воде.
Основные недостатки такого метода: низкая точность и то, что интерпретировать результат теста бывает сложно. Придется сначала на глаз определить интенсивность окраса, сравнив с «палитрой» возможных результатов. А затем указанные на палитре численные значения жесткости переводить из европейских градусов в российские. Качественные тест-полоски обычно зарубежного производства.
источник
Жесткость — свойство воды, обусловленное присутствием в ней растворенных солей щелочно-земельных металлов (преимущественно кальция и магния). Различают жесткость кальциевую и магниевую, связанную с присутствием в воде соответственно ионов кальция и магния. Суммарное содержание ионов этих металлов в воде называется общей жесткостью.
Общая жёсткость подразделяется на карбонатную, обусловленную присутствием в воде гидрокарбонатов и карбонатов кальция и магния, и некарбонатную, обусловленную наличием кальциевых и магниевых солей сильных кислот.
Карбонатную жёсткость также называют временной (устранимой), а некарбонатную — постоянной. Гидрокарбонаты кальция и магния при длительном кипячении воды разлагаются с выделением диоксида углерода и выпадающих в осадок карбонатов кальция и магния (при дальнейшем кипячении карбонат магния гидролизуется с образованием гидроксида); жесткость воды при этом уменьшается:
Жесткость, оставшаяся после кипячения воды в течение определенного времени, достаточного для полного разложения гидрокарбонатов и удаления диоксида углерода (обычно 1 — 1,5 ч), называется постоянной жесткостью. Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей. Она преимущественно зависит от содержания ионов кальция и магния, которые после кипячения уравновешиваются сульфатами и хлоридами. Эту часть постоянной жесткости, называемую также остаточной жесткостью, можно найти по разности между общей жесткостью и концентрацией гидрокарбонатов, выраженной в миллимолях на кубический дециметр. Однако кроме остаточной жесткости в воде после кипячения остается небольшое количество ионов кальция и магния, обусловленное растворимостью карбоната кальция и гидроксида магния. Эта часть постоянной жесткости называется неустранимой жесткостью. Поскольку растворимость карбоната кальция и гидроксида магния в присутствии ионов кальция и магния в растворе весьма незначительна, обычно некарбонатную (остаточную) жесткость отождествляют с постоянной жесткостью. Способ расчета постоянной жесткости и составляющих ее остаточной и неустранимой жесткости на основе результатов определения компонентов солевого состава воды приведен в «Руководстве по химическому анализу вод суши». Л.: Гидрометеоиздат. 1973.
Жесткость воды в настоящее время выражают в миллимолях количества вещества эквивалентов (КВЭ) Са 2+ и Mg 2+ , содержащихся в 1 дм 3 воды — ммоль/дм 3 КВЭ (ранее эту единицу обозначали мг-экв/л или мг-экв/дм 3 ). Миллимоль КВЭ Са 2+ и Mg 2+ равны соответственно 20,04 мг/ммоль и 12,15 мг/ммоль.
В естественных условиях ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов являются также микробиальные процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий: силикатной, металлургической, стекольной, химической промышленности, стоки с сельскохозяйственных угодий.
Общая жесткость поверхностных вод колеблется в основном от единиц до десятков миллимолей КВЭ в кубическом дециметре, причем карбонатная жесткость часто составляет 70 — 80 % от общей жесткости. Она подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Вода с жесткостью менее 4 ммоль/дм 3 КВЭ характеризуется как мягкая; от 4 до 8 ммоль/дм 3 КВЭ — средней жесткости; от 8 до 12 ммоль/дм 3 КВЭ — жесткая; более 12 ммоль/дм 3 КВЭ — очень жесткая.
Обычно преобладает (иногда в несколько раз) жесткость, обусловленная ионами кальция, однако в отдельных случаях, магниевая жесткость может достигать 50 — 60 % общей жесткости и более (часто магниевая жесткость превосходит кальциевую в морских и океанических водах, либо в поверхностных водах суши с высоким содержанием сульфат-ионов).
Высокая жесткость оказывает отрицательное влияние на свойства воды используемой в промышленности и для хозяйственно-бытовых целей. Жесткие требования в отношении величины жесткости предъявляются к воде, питающей паросиловые установки, поскольку в присутствии сульфатов и карбонатов кальций и магний образуют прочную накипь, уменьшающую теплопроводность металла и приводящую к перерасходу топлива и перегреву котлов. Для устранения жесткости применяют различные способы — осаждение труднорастворимых солей кальция и магния химическим или термическим путем, умягчение с помощью ионитов.
Высокая жесткость, особенно, обусловленная превышением солей магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное воздействие на органы пищеварения. Предельно допустимая величина жесткости в питьевых водах 7 ммоль/дм 3 КВЭ, но в некоторых случаях допускается использовать для питьевых целей воду с жесткостью 10 ммоль/дм 3 КВЭ.
ЖЕСТКОСТЬ ВОДЫ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ С ТРИЛОНОМ Б
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) общей и некарбонатной жесткости в пробах природных и очищенных сточных вод в диапазоне от 0,060 до 13,00 ммоль/дм 3 КВЭ (далее — ммоль/дм 3 ) титриметрическим методом с трилоном Б.
При анализе проб воды с величиной жесткости, превышающей 13,00 ммоль/дм 3 , допускается выполнение измерений после соответствующего разбавления пробы дистиллированной водой.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа
РД 52.24.403-2007. Массовая концентрация кальция в водах. Методика выполнения измерений титриметрическим методом с трилоном Б
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, В.3 и В.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих (Р = 0,95)
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s r, ммоль/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, ммоль/дм 3
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± D с, ммоль/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , ммоль/дм 3
источник