Анализ периферической крови показывает, у большинства больных с множественной миеломой, наличие анемии. Эта анемия, обычно умеренная, гипохромного типа может быть иногда сильно выраженной (менее 1 миллиона гематий/мм3). На мазке наблюдаются аспекты анизоцитоза и пойкилоцитоза. Гематии проявляют часто тенденцию располагаться в виде «монетных столбиков»,—явление, связанное с наличием миеломатозных протеинов в сыворотке и с их скоплением на поверхности гематий. Количество Гб также понижено.
Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге.
Число тромбоцитов нормальное или умеренно пониженное.
Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости.
Для миеломы характерен численный рост плазмоцитарной серии, которая может составлять 90% клеточного населения костного мозга. Вообще, при 20% плазмоцитарных элементов ставится вопрос о существовании миеломы. Аномалийные плазмоцитарные элементы или так называемые «миеломатозные клетки», это клетки диаметром в 15—30(л, круглые или овальные. Ядро, диаметром в 5—7у., круглое, расположенное эксцентрично, содержит 1—2 нуклеоли. Нуклеарный хроматин менее комковатый и уже не представляет тот регулярный порядок, который наблюдается в нормальном плазмоците. Цитоплазма этих клеток интенсивно базофильная, становится яркосиней при окрашивании May-Grunwald-Giemsa (цветная вклейка III).
В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III).
Вариабильное число клеток может иметь 3 или более ядер. Другие имеют сильно выраженные черты незрелости: они более крупных размеров (20—35u) с болыпдм, круглым ядром, с очень тонким хроматином, а цитоплазма интенсивно базофильная. Встречаются также и несколько зрелых плазмоцитарных клеток, с ядром в виде «колесной спицы » и ясной перинуклеарной зоной. Иногда плазмоциты могут иметь ацидофильную цитоплазму, так называемые «пламенистые клетки » (flaming cells) (цветная вклейка III).
С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные.
Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.
Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид.
Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме.
Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев.
Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA.
Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14.
Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы.
Изменения протеинового метаболизма проявляются в трех формах:
1) появление сывороточной гипериротеинемии;
2) выведение протеинов через мочу и
3) отложение на уровне тканей аномалийных протеиновых веществ, известных под названием «амилоид» или «параамилоид».
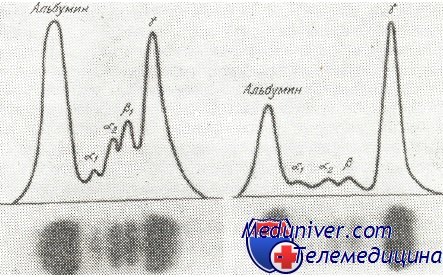
В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М.
В рамках множественной миеломы может происходить:
1) избыточный синтез, однако уравновешенный, цепей Н и L, с образованием цельных Ig;
2) неуравновешенный синтез, с избытком цепей L и образованием цельных Ig, параллельно с повышенным количеством свободных цепей L и
3) синтез лишь цепей L.
В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы).
В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2.
Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig.
Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр.
У больных с миеломой, количественный рост характерного миеломатозного Ig сопровождается сокращением производства других типов глобулинов.
Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакция оседания эритроцитов в большинстве случаев бывает очень ускоренной, достигая 100 мм в час. При миеломах Бенс-Джонса, РОЭ показывает более низкие цифры, иногда даже в нормальных пределах.
Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная.
В редких случаях отмечалось наличие сывороточных криоглобулинов с появлением синдрома Рейно на холоде и наблюдалось также наличие пироглобулинов.
Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными.
Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина.
В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты.
Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму.
Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота.
Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы.
В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях.
При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick).
В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена.
Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации.
Почечная интерстициальная ткань представляет инфильтрационные поражения, либо благодаря миеломатозным клеткам, либо благодаря клеткам хронического воспаления.
В общей сложности, эти поражения составляют аспект «миеломатозной клетки».
источник
Миеломная болезнь (плазмоцитома) — заболевание, относящееся к парапротеинемическим гемобластозам, специфическим маркером которых, в большинстве случаев, являются иммуноглобулины (парапротеины) сыворотки крови.
Иммунохимические варианты миеломы определяются по классу иммуноглобулинов и типу легких цепей (λ или κ):
1. иммуноглобулин G — миелома встречается в 55-65 %,
3. иммуноглобулин D — миелома — в 2-5%,
5. болезнь легких цепей (миелома Бенс-Джонса) — в 12 -20%.
Общий анализ крови — у большинства больных анемия нормохромного и нормоцитарного типа. Железодефицитная анемия может развиться при кровотечениях, нарушениях гемостаза и по другим причинам. При дефиците витамина В12 и фолиевой кислоты в костном мозге выявляются признаки мегалобластного кроветворения (В12-дефицитной анемии, фолиеводефицитной анемии). Количество ретикулоцитов понижено. СОЭ увеличена.
У больных миеломной болезнью отмечается лейкопения, реже лейкоцитоз (повышенное количества лейкоцитов в крови). В лейкоцитарной формуле нейтропения, моноцитоз. Плазматические клетки обычно выявляются в небольшом количестве (лучше в лейкоконцентратах). Содержание тромбоцитов снижено.
Биохимический анализ крови — в сыворотке отмечается увеличение общего белка до 90 — 100 г/л и выше (повышение уровня гамма-глобулинов), количество альбумина снижено. При миеломной болезни возрастает уровень кальция, мочевой кислоты. У большинства больных отмечается повышение уровня креатинина и азота мочевины, снижение содержания электролитов. Значительное повышение активности альфа-нафтилацетатэстеразы выявляется в плазматических клетках.
Определение бета-2-микроглобулина используется для наблюдения за динамикой заболевания и эффективностью лечения.
При миеломной болезни проводят электрофорез белков сыворотки крови в полиакриламидном геле. Анализ выявляет М-компонент, чаще всего за счет иммуноглобулинов G и М (иммунохимические варианты миеломы). При миеломе Бенс-Джонса М-компонент в крови обычно отсутствует и выявляется на электрофореграмме белков мочи.
В анализе костного мозга находят большое количество плазматических клеток, которые выявляются у 86 — 95 % больных.
В анализе мочи при миеломной болезни находят протеинурию, цилиндрурию, белок Бенс-Джонса (свыше 12 г/сут). Поражение почек наблюдается при миеломной болезни у большинства больных. С учетом этого обстоятельства проводятся пробы Зимницкого и Реберга-Тареева.
- функция почек ослаблена в менее 50% случаев, обычно это потеря почечной концентрационной способности и азотемия
- протеинурия встречается часто из-за наличия микроальбумина и глобулинов в моче
- протеинурия Бенс-Джонса может быть интермиттирующей
- белок Бенс-Джонса наблюдается в 50% случаев миеломы, но почти всегда формируется почечная недостаточность вследствие миеломы почки
- выраженная анемия непропорциональна азотемии
- непостоянные изменения вследствие поврежденной функции канальцев:
— снижение уровня мочевой кислоты в сыворотке
— потеря с мочой фосфатов со снижением сывороточного фосфора и увеличением уровня щелочной фосфатазы
— нефрогенный несахарный диабет
— олигурия или анурия с острой почечной недостаточностью из-за дегидратации.
- гиперхлоремия (повышение уровня хлора) или гипербикарбонатемия с нормой или снижением натрия в сыворотке снижает ионную проницаемость, и следует предположить миелому при конкретных клинических симптомах
- изменения вследствие ассоциированной гиперкальциемии
источник
Множественная миелома – это злокачественное заболевание крови, при котором образуется избыточное количество дефектных плазмоцитов (одного из видов лейкоцитов), что приводит к повреждению костного мозга, костей, почек, к нарушению работы иммунной системы.
Поврежденные плазмоциты могут образовывать опухоли, которые обычно располагаются в костях. Если опухоль одна, то ее называют единичная плазмоцитома. В случае если опухолей несколько, речь идет о множественной миеломе.
Миелома – достаточно редкое заболевание, которым чаще страдают люди старше 60 лет. Пациенты моложе 40 лет встречаются крайне редко. Эта болезнь неизлечима, однако современные методы лечения позволяют приостановить развитие процесса на несколько лет. Прогноз заболевания во многом зависит от стадии, на которой начато лечение.
Болезнь Рустицкого, миелома, миеломатоз, ретикулоплазмоцитоз, генерализованная плазмоцитома, болезнь Рустицкого – Калера.
Plasma cell myeloma, Kahler’s disease, myeloma.
Проявления миеломы зависят от активности процесса, и на начальной стадии заболевания могут полностью отсутствовать. Признаки миеломы неспецифичны, то есть такие же симптомы могут быть вызваны другим заболеванием, поэтому точную причину их появления может установить только врач. Основными симптомами являются:
- боли в костях, чаще в ребрах, позвонках,
- частые переломы,
- частые инфекционные заболевания,
- слабость, недомогание,
- жажда,
- запоры,
- учащенное мочеиспускание,
- увеличение или уменьшение объема мочи,
- онемение, боли в конечностях.
Общая информация о заболевании
Несмотря на то что основные проявления заболевания связаны с повреждением костей, миеломная болезнь – разновидность рака крови. В основе болезни лежит повреждение плазмоцитов, разновидности лейкоцитов. Они, как и все остальные клетки крови, образуются в костном мозге из стволовых клеток. Этот процесс заключается в ряде последовательных, запрограммированных на уровне ДНК клетки делений, в результате которых сначала формируются лимфоидные стволовые клетки, а затем В-лимфоциты. В-лимфоциты являются клетками иммунитета, то есть осуществляют борьбу с чужеродными для организма вирусами и бактериями. Окончательное созревание В-лимфоцитов происходит вне костного мозга – в лимфатических узлах, селезенке, тимусе. Для этого необходим антиген – белок чужеродного микроорганизма. При контакте с антигеном В-лимфоцит превращается в плазмоцит и начинает секретировать антитела – специфические белки, которые разрушают чужеродные клетки. Каждый плазмоцит секретирует определенный вид антител, направленных на борьбу с конкретным микроорганизмом. В норме у человека образуется необходимое, строго контролируемое количество плазмоцитов.
При миеломной болезни повреждается ДНК плазмоцитов. В организме накапливается избыточное количество бесполезных, измененных плазмоцитов, которых еще называют миелоцитами. Эти клетки накапливаются в костях, образуя опухоли и разрушая кости, а также вырабатывают дефектные – моноклональные белки, или белки Бенс-Джонса. Эти белки не способны бороться с чужеродными клетками, как нормальные антитела, и выводятся из организма почками. Разрушение костей приводит к повышению уровня кальция в крови, что проявляется жаждой, запорами, тошнотой. Повышенное количество кальция и белка вызывает повреждение почек. Происходит угнетение нормального кроветворения и, как следствие, уменьшается количество эритроцитов и нормальных лейкоцитов. В итоге развивается анемия и снижается устойчивость организма к инфекциям.
Точная причина патологических изменений в плазмоцитах неизвестна, однако существуют факторы, повышающие вероятность миеломной болезни.
- Люди старше 60 лет.
- Страдающие ожирением.
- Подвергавшиеся облучению.
- Работающие с инсектицидами, пестицидами, продуктами нефтепереработки и другими токсическими веществами.
- ВИЧ-инфицированные.
- Пациенты с аутоиммунными заболеваниями, например ревматоидным артритом, системной красной волчанкой.
- Пациенты с моноклональной гаммопатией (это группа заболеваний, при которых в организме вырабатываются аномальные антитела).
- Люди, у родственников которых была миеломная болезнь.
Часто миеломная болезнь определяется еще до проявления симптомов, в ходе стандартного профилактического обследования. Заподозрить заболевание на начальной стадии позволяют изменения в результатах лабораторных анализов. Дальнейшее обследование зависит от проявлений болезни.
- Общий анализ крови (без лейкоцитарной формулы и СОЭ). При миеломной болезни уровень лейкоцитов чаще всего снижен. Также могут быть понижены концентрации эритроцитов, тромбоцитов и гемоглобина.
- Определяется протеинурия, то есть выделение с мочой белка Бенс-Джонса.
- Общий белок сыворотки. Его уровень повышается за счет большого количества моноклональных белков.
- Альбумин сыворотки. Альбумин – это белок, который синтезируется в печени и отвечает за перенос различных веществ, например билирубина, жирных кислот, некоторых гормонов. Уровень альбумина бывает снижен даже при высоком общем белке, так как белок повышен именно из-за патологических компонентов – моноклональных белков, которые по структуре отличаются от альбумина.
- Креатинин в сыворотке. Является побочным продуктом обмена веществ, который выводится почками. При миеломной болезни может быть повышен вследствие повреждения почек.
- Кальций в сыворотке. Уровень кальция повышается из-за разрушения костей.
Другие методы исследования
- Электрофорез белков мочи и крови. Метод необходим для выявления моноклональных белков и белков Бенс-Джонса. Основан на том, что разные виды белков, помещенных на специальную бумагу, гель или мембрану, под действием постоянного электрического поля движутся с разной скоростью.
- Биопсия костного мозга – взятие образца костного мозга из грудины или костей таза с помощью тонкой иглы. Проводится после предварительного обезболивания. Затем под микроскопом обнаруживают изменения в структуре костного мозга. Процедура необходима для выявления плазмоцитов в костном мозге.
- Рентгенография, компьютерная томография и магнитно-резонансная томография. Эти методы позволяют сделать снимки костей, на которых определяются четко очерченные, округлой или овальной формы участки разрушения костей, а также патологические переломы.
- Позитронно-эмиссионная томография. В организм вводят дезоксифлюороглюкозу – препарат, помеченный радионуклидом, который поглощается клетками опухоли. Затем с помощью позитронной камеры исследуют участки накопления этого вещества. Дезоксифлюороглюкоза находится в организме очень короткое время, большая часть ее распадается уже во время исследования, что позволяет уменьшить лучевую нагрузку на пациента. Информативность метода заключается в том, что можно оценить не только внешние характеристики опухоли, как при КТ или МРТ, но и активность обмена веществ в тканях опухоли.
Лечение зависит от стадии заболевания, вида миеломы, общего состояния пациента. На начальной стадии, до появления внешних признаков и при медленном прогрессировании болезни лечение может быть отложено. Однако пациент должен регулярно проходить обследование для контроля за развитием болезни. При первых симптомах следует начинать лечение.
- Химиотерапия – использование специальных препаратов, которые разрушают злокачественные клетки или препятствуют их делению.
- Иммунотерапия. При терапии множественной миеломы используют препараты, активизирующие иммунную систему. Структура этих препаратов идентична веществам, которые вырабатываются лейкоцитами и участвуют в борьбе с инфекциями, раковыми клетками. Чаще всего используют синтетический альфа-интерферон – специфический белок, идентичный по строению интерферону человека и обладающий противовирусной активностью.
- Лучевая терапия – разрушение злокачественных клеток с помощью ионизирующего излучения.
- Трансплантация стволовых клеток. У пациента с миеломной болезнью или подходящего донора забирают часть стволовых клеток с помощью специального аппарата, после чего их замораживают. Затем пациент подвергается химиотерапии или лучевой терапии, которые разрушают большинство клеток костного мозга, как больных, так и здоровых. После этого пациенту пересаживают его собственные или донорские стволовые клетки. Трансплантация стволовых клеток не излечивает пациента, но увеличивает продолжительность его жизни.
- Симптоматическая терапия – терапия, направленная на конкретные симптомы. Например, антибиотики при инфекции и введение эритропоэтина (вещества, стимулирующего деление эритроцитов) при анемии.
Специфической профилактики миеломной болезни нет.
Рекомендуемые анализы
- Общий анализ крови
- Общий анализ мочи с микроскопией осадка
- Кальций в сыворотке
- Креатинин в сыворотке
- Белок общий в сыворотке
- Альбумин в сыворотке
- Цитологическое исследование пунктатов, соскобов других органов и тканей
источник
Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.
Правда, достоверных доказательств участия всего перечисленного в злокачественном перерождении не представлено. Ясно одно, что-то помешало нормальному созреванию В-лимфоцитов или вмешалось в многоэтапный путь от их «детства» до лимфатической зрелости, из-за чего-то лимфоцит превратился в дефектный плазмоцит, давший начало миеломе.
Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.
Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
Вырабатываемые злокачественными плазмоцитами парапротеины откладываются в тканях органов, излюбленное «место складирования» — почки, в которых развивается «болезнь лёгких цепей» с исходом в почечную недостаточность. В поражённой печени снижается выработка разжижающих кровь веществ — повышается вязкость крови, нарушающая обменные процессы в тканях, образуются тромбы. Отложения иммуноглобулинов наносят урон и другим органам, но не столь фатальный.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.
Давний маркёр заболевания — белок Бенс-Джонса в моче, выявляемый у 70% пациентов. Белок формируется из цепочек иммуноглобулинов А и G небольшого молекулярного веса — «лёгких», которые просачиваются из почечных канальцев. По содержания Бенс-Джонса тоже контролируют течение болезни.
Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.
Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
Для каждого варианта заболевания предусмотрены определенные количественные характеристики и сочетания критериев, так для полной убеждённости в наличии у пациента миеломы необходимо обнаружить специфические «продукты»:
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны. Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.
Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания. Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями. При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов. Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
Астенизированного человека наши предки называли «квёлым». Такие пациенты рискуют не перенести агрессивного лечения, но достаточно неплохо отвечают на более легкие варианты противоопухолевой химиотерапии.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.
Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
Играет роль концентрация парапротеинов и их фракций, объем поражения на момент выявления болезни и степень вовлечения в патологический процесс других органов, так уже развившаяся почечная недостаточность «перевесит» все прочие благоприятные признаки заболевания.
источник
Уважаемые пациенты! В октябре детская медицинская сестра принимает — 10, 11, 16, 17, 19 и 26 числа.
Множественная миелома, миеломная болезнь, multiple myeloma.
При миеломной болезни появляются клинические проявления, которые объясняются пролиферацией миеломных клеток в костном мозге и действием продуцируемых ими иммуноглобулинов и свободных легких цепей. В результате вытеснения здорового костного мозга наблюдается угнетение нормального гемопоэза, что проявлется повышенной утомляемостью, объясняемой анемией, расстройством гемостаза из-за тромбоцитопении, рецидивами инфекции в результате гипогаммаглобулинемии или лейкопении. Пролиферация миеломных клеток и активность остеокластов приводят к гиперкальциемии, появлению «штампованных» дефектов костей и патологических переломов. Отложение моноклонального иммуноглобулина или свободных легких цепей оказывает прямое повреждение почек, приводя или к тубулярному или гломерулярному повреждению (цилиндровой нефропатии или болезни отложения легких цепей соответственно) или к инфильтрации различных органов (сердца, печени, тонкой кишки, нервов) как в случае системного ALамилоидоза. Синдром гипервязкости крови чаще развивается при повышенном IgA или IgM моноклональном иммуноглобулине (парапротеине) и может проявляться церебоваскулярной или дыхательной недостаточностью. Повышенная скорость оседания эритроцитов может рассматриваться как маркер моноклональной гипергаммаглобулинемии и как нередкий повод для обследования пожилых больных.
Хотя у ряда лиц симптомы миеломы впервые обнаруживаются после 50 лет, средний возраст больных во время выявления болезни равен 66 годам, и только 2% пациентов моложе 40 лет. Миеломная болень развивается из иммунологического состояния, определяемого как моноклональная гаммапатия неизвестного значения (MGUS-англ. или МГНЗ) . Это состояние, по американской статистике, может быть выявлено у 2-4% населения старше 50 лет. Поскольку моноклональная гаммапатия не вызывает каких-либо жалоб, то определяется лишь как случайная лабораторная находка и является предраковым состоянием. Переход от моноклональной гаммапатии неизвестного значения к миеломной болезни за год отмечается у одного из 100 лиц, пораженных МГНЗ. Такая трансформация обычно наблюдается через промежуточную стадию тлеющей миеломы (smoldering multipe myelona- SMM), при которой риск прогрессии увеличивается в 10 раз т.е. до 10% в год. На фоне тлеющей миеломы отмечается резкое увеличение содержания парапротеина в крови, достигающего уровня развернутой миеломы.
Классификация множественной миеломы 2014 года
В 2014 году Международная рабочая группа по миеломной болезни обновила диагностические критерии различных форм этого заболевания. Основная ревизия состояла в добавлении трех специфических биомаркеров: количество клональных плазматических клеток в костном мозге ≥60%, соотношение свободных легких цепей в сыворотке ≥100 и более одного локального поражения на МРТ, — к существующим маркерам поражения конечных органов (гиперкальциемия, почечная недостаточность, анемия или поражение костей). Ранее, поражение конечных органов трактовались как акроним CRAB — calcium, renal disease, anemia, bone lesions.
Обновленные критерии позволяют обеспечить раннюю диагностику и назначение лечения до развития поражения конечных органов. Как следует из критериев, диагноз миеломной болезни требует 10% и более плазматических клеток при исследовании костного мозга или наличия плазмацитомы, доказанной биопсией, плюс одно или более нарушений, обусловленных заболеванием.
Диагностические критерии Международной рабочей группы для миеломной болезни и связанных клеточных нарушений (2014)
1.Моноклональная гаммопатия неизвестного значения – МГНЗ (MGUS): моноклональный парапротеин (не-IgM)
2.Тлеющая множественная миелома (Smoldering MM): моноклональный белок в сыворотке (IgG или IgA) ≥30 г/л, или моноклональный белок в моче ≥500 мг/24 часа и/или клональные плазматические клетки в костном мозге 10%-60%, отсутствие с миеломой связанных осложнений или амилоидоза
3.Множественная миелома: клональные плазматические клетки костного мозга ≥10% или доказанные биопсией костные или экстрамедулярные плазмоцитомы. Для постановки диагноза необходимо вявление одного или более из следующих, связанных с миеломной болезнью, осложнений или MDE- myeloma defining event англ.:
Гиперкальциемия: кальций сыворотки >0.25 mmol/L или выше, чем верхний лимит нормального для соответствующей лаборатории значения или >2.75 mmol/L;
Почечная недостаточность: клиренс креатинина 177 μmol/L;
Анемия: значение гемоглобина >20 г/л ниже нижнего предела нормального в лаборатории или значение гемоглобина 5% и низкое насыщение трансферрина типичны для дефицита железа.является проявлением миеломной болезни примерно у 75% больных. В этих случаях уровень анемии умеренный. Но у 10% больных с Hb 2 , обнаруживается у 20% больных миеломой на этапе диагноза и примерно у половины больных в ходе миеломной болезни. Причины поражения почек комплексные и включают дегидратацию, гиперкальциемию, инфекции, воздействие нефротоксических лекарств, в частности, прием больших доз НПВС для купирования болевого синдрома.
Наиболее характерно для миеломы обнаружение тубулоинтестинального повреждения почек, известного как цилиндровая нефропатия, которая является прямым следствием повышенного содержания свободных легких цепей иммуноглобулинов в крови. Клетки канальцевого эрителия повреждаются и атрофируются из-за усиленного «переноса» свободных цепей из просвета канальцев в интерстиций. На фоне обезвоживания может развится синдром острой почечной недостаточности, обусловленный нарушением кровотока и канальциевыми нарушениями.
Наличие легких цепей в моче при миеломной болени может вызвать нарушение функции почек, известное как вторичный синдром Фанкони. Он обусловлен недостаточностью реабсорбционной способности проксимальных канальцев, что проявляется глюкозурией, аминоацидурией, гипофосфатемией и гипоурикемией.
В интерстиции развивается процесс воспаления с итоговым тубуло-интерстициальным фиброзом, приводящим к почечной недостаточности. Более того, невыведенные почками моноклональные легкие цепи могут откладываться в почках, сердце, печени, тонком кишечнике, нервных стволах, приводя к развитию первичного амилоидоза (AL-амилоида) или болезни отложения легких цепей (light-chain deposition disease — LCDD англ, БОЛЦ). Для диагностки почечной недостаточности требуется определение креатинина, мочевины, натрия и калия, кальция и оценка СКФ по формуле MDRD или CKD-EPI. Также рекомендуется измерение общего белка, электрофорез и иммунофиксация в образцах 24-часовой мочи. У больных с неселективной протеинурией или селективной альбуминурией требуется исключить наличие амилоидоза или MIDD , для чего показана биопсия почки или подкожного жира с окраской на конго-рот. У больных с протеинурией свободных легких цепей (белка Бенс-Джонса) биопсия жира не обязательна, поскольку в этом случае диагноз миеломного повреждения почек не вызывает сомнений и требует планирования терпии основного заболевания.
Свободные легкие цепи имеют высокую чувствительность и специфичность по сравнению с электрофорезом белков в моче. Больные с почечной недостаточностью при ММ имеют повышенное каппа/лямбда отношение даже при отсутствии доказательств моноклональной гаммапатии. Причина состоит в нарушении выделения легких цепей. У здоровых людей очищение крови от легких цепей осуществляется почками. Каппа цепи являются мономерными и быстрее покидают кровь сравнительно с лямбда цепями, что доказывается каппа/лямбда отношением в среднем 0.6 у лиц без поражения почек. У больных с почечной недостаточностью основной системой очищения становится ретикуло-эндотелиальная система, полупериод жизни каппа цепей из-за этого удлиняется. Отношение каппа/лямбда оказывается при почечной недостаточности равным в среднем 1.8. Свободные легкие цепи имеют высокую чувствительность и специфичность, и больные с почечной недостаточностью имеют повышенное каппа/лямбда отношение вследствие нарушения клиренса каппа и лямбда цепей.
Инфекционные осложнения при множественной миеломе.
При миеломной болезни возрастает частота бактериальных и вирусных инфекций в 7-10 раз по сравнению с популяционным контролем. Гемофильная палочка, пневмонический стрептококк, кишечная палочка, грам-отрицательные бактерии и вирусы (грипп и герпес зостер) являются наиболее частыми виновниками инфекции у больных миеломной болезнью.
Повышенная чувствительность больных к инфекционным заболеваниям является результатом двух основных обстоятельств. Во-первых, влиянием самого заболевания, во-вторых, пожилым возрастом и побочным действием проводимой терапии. Лимфоцитопения, гипогаммаглобулинемия, нейтропения вследствие инфильтрации миеломными клетками костного мозга и под влиянием проводимой химиотерапии обуславливают повышенную чувствительность к инфекции. Связанная с болезнью недостаточность врожденного иммунитета вовлекает разные части иммуной системы и включает дисфункцию В-клеток, а также функциональные отклонения со стороны дендритных клеток, Т- клеток и натуральных киллеров (NK). Нарушения функции почек и легких, слизистой ЖКТ, мультиорганные нарушения, вызванные отложением легких цепей иммуноглобулинов, также увеличивают риск инфекционных заболеваний. Наконец, миеломная болень поражает приемуществено пожилых лиц с коморбидными возрастными заболевниями и малоподвижным образозм жизни, исходно предрасположенных к инфекциям.
Иммуномодуляторы и глюкокортикоиды являются частью лечения наиболее тяжелых вариантов заболевания. При имеющихся инфекционных контактах, наличии нейтропении и гипогаммаглобулинемии и подавленном клеточном иммунитете терапия иммуномодуляторами требует профилактического назначения антибиотиков.
Гиперкальциемия.
Симптомы гиперкальциемии неспецифичны и зависят как от абсолютных значений, так и от сроков прироста кальция. Умеренная гиперкальциемия (кальций сыворотки 3–3.5 mmol/л), которая развивалась месяцами, может переноситься незаметно с минимальными жалобами , в то время как как подобная гиперкальциемия, возникшая за недельный период, приводит к ярким симптомам. Тяжелая гиперкальциемия ( кальций более 3.5 mmol/л) почти всегда приводит к клиническим проявлениям. Больные жалуются на отсутствие аппетита и запоры. При этом общее недомогаение и мышечная слабость может прогрессировать до летаргии, спутанности и комы. Кардиоваскулярные проявления включают укорочение QT интервала и аритмии. Почечная дисфункция представляется другим важным проявлением гиперкальциемии. Пациенты часто отмечают полиурию как следствие пониженной концентрационной способности почек в условиях гиперкальциемии. Появление камней в почках наблюдается только при длительной гиперкальциемии. Острая почечная недостаточность в результате прямой вазоконстрикции и натриурезом-вызываемого сокращения объема крови относится к наиболее тяжелым проявлениям поражения почек при гиперкальциемии. Причиной гиперкальциемии является повышенная активность остеокластов при пониженной активности остеобластов и лизис костной ткани при миеломной болезни. Активация остеокластов, разрушающих структуру костей, вызывается цитокинами, секретируемыми миеломными клетками, в частности , интерлейкином-1. Не случайно степень гиперкальциемии зависит от общей массы накопившихся миеломных клеток, так что наиболее тяжелая гиперкальциемия обнаруживается у больных с широко распространенной болезнью.
Признаки гиперкальциемии зависят от уровня кальция и быстроты его повышения, что создает необходимость в ускоренном обследовании. Большинство причин гиперкальциемии на практике обусловлено повышенным уровнем паратгормона и его производных (гуморальная форма), а в 20 % — с инфильтрацией костного мозга клетками опухолей (инфильтративная форма). Множественная миелома с легкими цепями в крови является самой частой причиной среди заболеваний крови. Число больных с гиперкальциемий из-за наличия опухоли в 2-3 раза выше, чем из-за первичного гиперпаратиреоза.
Для миеломной болезни с гиперкальциемией характерен низкий уровень паратгормона, фосфор в норме. При гуморальной форме гиперкальциемии обнаруживается повышенный уровень паратгормона, низкий уровень фосфора.
Тромбофилии.
Риск венозных тромбозов обусловлен целым рядом причин, а миеломная болезнь его значительно увеличивает. К факторам риска тромбозов относятся пожилой возраст,, ограничение подвижности из-за болей, частые инфекции, дегидратация, почечная недостаточность, ожирение, сахарный диабет и другие коморбидные заболевания.
Среди проявлений наиболее опасна тромбоэмболия легких, которая может оказаться фатальной.
Частота примерно тромбоэмболии при миеломе оценивается в 5-8/100 больных.
Это связано с тем что миелома сопровождается повышенной вязкостью крови, угнетением выработки естественных антикоагулянтов и гиперкоагуляцией крови, спровоцированной инфекциями, с повышенным уровнем фактора Виллебранда, фибриногена и фактора VIII, пониженным уровнем протеина S и.т.д.). Проведение курса лекарственной терапии, в том числе назначение эритропоэтинов, также может сыграть роль триггера венозных тромбоэмболий. Поэтому в первые месяцы терапии рекомендуется дополнять традиционную терапию миеломы аспирином или антикоагулянтной терапией.
Скрининг предрасположенности к тромбозам и венозной тромбоэмболии при миеломной болезни, наряду со стандартным коагулогическим обследованием, должен включать исследование вязкости крови.
Прогнозировование и факторы риска при миеломе
«Международная система прогнозирования» (ISS. 2005) была разработана на основании данных естественного исхода заболевания значительной клинической группы больных и основана на исследовании бета2-микроглобулина в динамике. Бета-2-микроглобулин повышен у 75% больных миеломной болезнью.
Выделено три уровня этого онкомаркера, которые связаны с длительной выживаемостью пациентов. Это позволяет определить несколько стадий заболевния.
1. бета-2-микроглобулин менее 3,5 мг/л и альбумин более 35 г/л, средняя выживаемость 62 месяца,
2. промежуточная между 1 и 3 стадиями, средняя выживаемость 44 месяца.
3. стадия бета 2-микроглобулин более 5.5 мг/л, средняя выживаемость 29 мес.
Однако, в настоящее время использование новых препаратов значительно изменило прогноз естественного течения заболевания. Тем не менее, международная система была протестирована для новейшей терапии и подтвердила свою надежность. Так 5-летняя выживаемость больных в стадии I, II и III составила 66%, 45% и 18% соответственно.
В Международной системе не оказалось места для таких ценнных прогностических показателей как число тромбоцитов, уровень лактатдегидрогеназы и свободных легких цепей в крови.
Число тромбоцитов в крови коррелирует с вытеснением костного мозга и имеет предсказательное значение выше, чем у альбумина. Содержание лактатдегидрогеназы (ЛДГ) коррелирует с общей массой миеломных клеток, недостаточным ответом на терапию и укорочением выживаемости. У больных с уровнем свободных легких цепей в крови свыше 4,75 г/л чаще выявляется почечная недостаточность, высокой процент миеломных клеток в пунктате костного мозга, высокие значения бета-2-микроглобулина и лактатдегдрогеназы, чаще обнаруживается болезнь отложения легких цепей и стадия III по Международной системе. Однако представленных доказательств оказалось недостаточно, чтобы включить эти три критерия в Международную систему. Но они были представлены в системе Дьюри-Саймона (1975), значение которой не оспаривается до сих пор.
Повышенный уровень сывороточного бета 2-микроглобулина, повышенный уровень лактатдегидрогеназы и низкий уровень сывороточного альбумина относятся к неблагоприятным признакам прогноза при миеломной болезни. Хотя уровень бета2- микроглобулина увеличивается при почечной недостаточности, однако существует значительная корреляция между объемом опухолевой ткани и концентрацией этого биомаркера в крови. Исключение составляют лишь случаи, когда миеломная болезнь развивается уже на фоне имеющейся почечной недостаточности.
Перспективным методом оценки прогноза заболевания является генетическое исследование опухоль-ассоциированных генов. Цитогенетическое выявление транслокаций в отличие от трисомии относится к неблагоприятным прогностическим признакам. Метод флюоресцентной гибридизации in situ (FISH) позволил упростить выявление хромосомных аберраций в миеломных клетках, что предлагается исследователями клинико Мэйо (США) использовать для выбора индивидуальной лечебной тактики, исходя из прогноза для больного на основании учета выявленных аббераций. Генетические исследования хромосомных аномалий и мутаций при миеломе являются перспективными методами для лабораторной оценке прогноза и устойчивости к терапии при миеломе. Однако для их оценки тебуются большие сроки и число пролеченных больных, чтобы определить способность новых средств терапии преодолеть цитогенетические показатели высокого риска при миеломной болезни.
источник
Миеломная болезнь (множественная миелома) составляет около 1% всех злокачественных образований, частота встречаемости миеломной болезни колеблется в разных этнических группах от 1 до 10 на 100000 населения. Заболевание диагностируется в возрасте 40-70 лет в два раза чаще у женщин. В клинической картине характерны: остеодеструкция плоских костей, миеломная нефропатия, реже гепатоспленомегалия, поражение лимфатических узлов, бактериальные и вирусные инфекции, геморрагический синдром.
Существует несколько типов множественной миеломы: несекретирующая, дремлющая, индолентная миелома, плазмоклеточный лейкоз. Миеломная болезнь характеризуется присутствием в сыворотке крови и/или в моче моноклональных иммуноглобулинов (парапротеинов). Парапротеины часто не способны выполнить функцию антител! Молекула парапротеинов состоит из тяжелых или легких цепей одного типа, иногда они состоят только из отдельных легких цепей (каппа и лямбда) или только из тяжелых цепей (фрагментов иммуноглобулинов). Класс и тип цепей не меняется в течение болезни. Необходимо проведение электрофореза белков сыворотки крови, и иммуноглобулинов А, М, G в сыворотке крови. Так как все молекулы парапротеинов идентичны, то они определяются при электрофорезе белков по наличию узкого M- пика (М-градиента).
Для постановки диагноза врачом, как правило, назначаются три вида исследований:
Электрофорез белков (белковые фракции)
Иммуноглубулины (целая молекула):
Свободные легкие цепи лямбда и каппа:
— Лямбда и каппа легкие цепи в сыворотке крови;
— Лямбда и каппа легкие цепи в моче.
При несекреторной миеломе диагноз можно поставить только на основании исследования костного мозга (миелограмме).
боли в суставах у женщин старше 50 лет, потеря веса, повышенное содержание кальция в сыворотке крови, увеличение общего белка и снижение альбумина, увеличение мочевины и креатинина, в общем анализе крови: появление плазматических клеток в периферической крови тромбоцитопения, анемия, лейкопения, увеличение СОЭ.
При множественной миеломе; при системных заболеваниях иммунной системы: макроглобулинемия Вальденстрема, остромплазмобластном лейкозе, болезни тяжелых цепей, лимфоме с парапротеинемией.
- количественное определение лямбда и каппа легких цепей в сыворотке крови с помощью иммунотурбидиметрического метода на биохимическом анализаторе «АRCHITECT c8000»
- количественное определение лямбда и каппа легких цепей в моче с помощью турбидиметрического метода на биохимическом анализаторе «SAPPHIRE-400»
- белковые фракции с помощью электрофореза (выдача результата с распечаткой электрофореграммы с указанием результов в абсолютных и относительнах единицах) на автоматическом аппликаторе «SAS 1 plus» и автоматическом окрашивателе «SAS 2»
Необходимо воздержкться от физических нагрузок, приема алкоголя и лекарств, изменений в питании в течение 24 часов до взятия крови. Рекомендуется сдавать кровь на исследование утром, натощак (8-ми часовое голодание). В это время необходимо воздержаться от курения.
Желательно, утренний прием лекарственных средств провести после взятия крови (если это возможно).
Не следует перед сдачей крови осуществлять следующие процедуры: инъекции, пункции, общий массаж тела, эндоскопию, биопсию, ЭКГ, рентгеновское обследование, особенно с введением контрастного вещества, диализ.
Если все же была незначительная физическая нагрузка – нужно отдохнуть не менее 15 минут перед сдачей крови.
Очень важно, чтобы точно соблюдались указанные рекомендации, так как только в этом случае будут получены достоверные результаты исследования крови.
В апреле 2019 года Артур Робертович меня прооперировал и полностью вёл всё послеоперационное лечение.
Его внимание и забота ощущались во всём: он проводил перевязки и всячески помогал мне.
Общение с ним было душевным и, мне кажется, оно способствовало моему выздоровлению.
Спасибо Вам, дорогой Артур Робертович! А ещё рана у меня зажила очень быстро!
Желаю Вам успешных операций и нетрудных пациентов!
От всей души благодарю доктора хирурга-эндокринолога Николая Алексеевича Соловьева за высоко-профессионально сделаную операцию моей сестре.Очень внимательный доктор с огромным опытом. Всем довольны,очень рекомендую!
Николаю Алексеевичу крепкого здоровья,удачи во всём и огромное Вам спасибо!
Выражаю огромную благодарность оториноларингологу-хирургу Усатюк Виктории Валерьевне за вовремя оказанную профессиональную помощь. Этот врач — грамотный специалист, который внимательно и чутко относится к конкретной проблеме. Долгое время искала хорошего врача оториноларинголога и наконец нашла! Спасибо большое, Виктория Валерьевна! Успехов Вам и адекватных пациентов!
Большое спасибо урологам вашего центра за блестяще проведенную операцию. Вся процедура консультации, подготовки, самого удаления водянки прошла в короткий срок. Никаких болевых ощущений. Восстановился очень быстро. Атмосфера в клинике очень доброжелательная. Везде чувствуется профессионализм персонала.
Сегодня-11.08.2019г. почти два месяца как мы знакомы с Романом Сергеевичем Чайкиным. У моей мамы было сужение пищевода. Нормальное питание было невозможным. детское питание должной поддержки организму не приносило. мама буквально таяла на глазах. По совету знакомого врача мы обратились к Роману Сергеевичу, к тому моменту мама могла только пить. Обследование, подготовительные процедуры к сложной операции. мама начала есть. и вот.
За такими врачами уверенное будущее нашей медицины. Спасибо за высокий профессионализм, за проявление высокой ответственности в отношении к своим пациентам , за душевное отношение к доверившим Вам свою жизнь, за помощь в решении сложной организационной ситуации. Вы спасли очень ценное , жизнь человека. Буду молится за Вас.
Выражаю благодарность Анненковой Олесе Юрьевне .Огромное спасибо за то, что проявили чуткость, внимание. Спасибо за терпение и квалифицированную помощь. Также выражаю Благодарность заведущей неврологоческого отделения Ширшовой Елене Вениаминовне за помощь в организации госпитализации.
Хотела бы выразить слова благодарности всем сотрудникам и врачам Вашего уникального медицинского учреждения. Сам Бог велел попасть к Вам. Моя мать (мы из Чувашии) после проведенной операции — хордэктомии в ФГБУ «Научно-клинический Центр оториноларингологии» с подозрением на трахеопищеводный свищ была направлена в хирургическое отделение Вашего центра. Наша семья выражает огромную благодарность зав.
Огромная благодарность урологическому отделению ФНКЦ ФМБА. У вас работают настоящие профессионалы. Очень внимательный персонал, и средний, и младший. При интимных проблемах, мы, мужчины стесняемся обратиться к врачу. Но в вашем центре очень деликатное отношение к пациентам. Долго боялся идти на операцию. Но здесь сделали все быстро, боли не почувствовал никакой ни во время, ни после операции. Все зажило хорошо. Скоро возвращаюсь к привы.
Теперь мы с дочерью — Никифоровой Дарьей — точно знаем, где работают лучшие врачи. Какой удивительный центр есть в Москве! Удивительный по масштабу! Удивительный по оборудованию! И с удивительными врачами! Огромное спасибо врачам ревматологического отделения — Сайковскому Роману Станиславовичу и Чигириной Юлии Анатольевне! Спасибо ВАМ, уважаемые доктора, за доброе большое сердце и профессионализм! Спасибо, что взяли нас под опеку. .
источник



