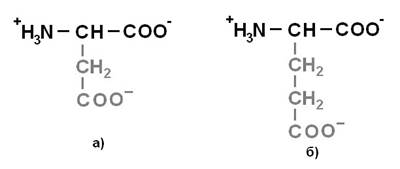Лабораторная работа «Анализ белков и аминокислот»
Цели и задачи: изучить методы выделения и анализа веществ из биологических объектов, строение и свойства аминокислот и белков, освоить хроматографический метод исследования, объяснить возможности использования этого метода в медицинской практике.
Белки — это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот, соединенных пептидными связями. Белки составляют основу и структуры, и функций живых организмов.
При гидролизе белков образуются аминокислоты. Все многообразие белков определяется количественным и качественным содержанием различных аминокислот, взаиморасположением аминокислотных остатков в белковой молекуле.
Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление. Молекулы белка не способны проникать через полупроницаемые искусственные мембраны, а также биомембраны растительных и животных тканей.
Денатурация белков—нарушение структуры нативной молекулы белка, приводящее к потере характерных для белка свойств (растворимость, биологическая активность и т.д.). Денатурация может происходить под влиянием как физических, так и химических факторов. Внешне она проявляется как потеря растворимости, особенно в изоэлектрической точке.
Качественный анализ аминокислотных смесей методом тонкослойной хроматографии.
Реактивы и оборудование: растворы аминокислот 0,04 М, смесь бутанола, уксусной кислоты и воды (15:3:7), раствор нингидрина в ацетоне 0,5%, пластины хроматографические,капиллярные пипетки, сосуд хроматографический с крышкой, палочки стеклянные, термостолик, спрей-камера, пульверизатор.
Проводят карандашом линию на расстоянии 2 см от нижнего края хроматографической пластины. На линии на равном расстоянии размечают 4 точки. В пипетку набирают раствор первой аминокислоты. Прикасаясь кончиком пипетки к пластине в точке 1, выпускают раствор. То же проделывают для точек 2, 3, 4 с растворами оставшихся аминокислот и их смесью, каждый раз используя чистую пипетку.
Хроматограмму помещают в хроматографический сосуд, на дно которого налита смесь бутанола, уксусной кислоты и воды (15:3:7) так, чтобы край пластины был погружен в проявитель на 1 см. Сосуд плотно закрывают крышкой и оставляют в нем хроматограмму на время, за которое проявитель пройдет по ней путь снизу вверх, равный примерно 10 см. Хроматограмму вынимают из сосуда, отмечают границу фронта проявителя и высушивают на термостолике. На высушенную хроматограмму наносят в спрей-камере при помощи пульверизатора 0,5%-ный раствор нингидрина в ацетоне до равномерного (без подтеков) смачивания. Затем хроматограмму помещают на термостолик при температуре 70 °С на 15 мин. Позиции аминокислот на хроматограмме выявляются в виде сине-фиолетовых пятен.
Идентификацию аминокислот можно осуществить по значению Rf(коэффициент распределения). Для этого измеряют расстояние, пройденное проявителем от линии старта до границы фронта проявителя, а так же расстояние от точки нанесения каждой аминокислоты до центра цветного пятна, образовавшегося в результате нингидриновой реакции. Путем деления величины пути, пройденного аминокислотой на хроматограмме, на величину пути, пройденного проявителем, находят значение коэффициента распределения (Rf) каждой аминокислоты-свидетеля. Такие же расчеты проводят с аминокислотами исследуемой смеси. Сопоставляя величины Rfаминокислот-свидетелей и аминокислот исследуемой смеси, делают заключение о природе аминокислот в составе изучаемой смеси. Аминокислоты, располагающиеся на одном уровне, идентичны.
1. Зарисуйте хроматограмму.
2. Рассчитайте значения Rf для всех веществ. Сопоставьте значения. Сделайте вывод.
2. Цветные реакции на белки.
Реактивы и оборудование: раствор белка, реактив Миллона, 10% раствор сахарозы, конц. серная кислота, уксусная кислота ледяная, 0,2% раствор нингидрина в спирте, пробирки, спиртовки, пипетки.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Известно, что все 20 разновидностей канонических α-аминокислот имеют однотипную структуру, с тремя вариантами функциональных групп (рис. 3.3). К сожалению, реакции на амино- и карбоксигруппы малоспецифичны, т.к. соответственно, свойственны всем аминам, ряду амидов и карбоновых кислот. То же относится и к большинству их радикалов = R, 10 из которых неполярны, то есть представлены алифатическими = углеводородными группами, большинство которых химически инертно. Относительно низка и специфичность большинства R полярных аминокислот, в которых встречаются спиртовые (Сер, Тре, Тир) амидные (Асн, Глн) и карбоксигруппы (Асп, Глу). Более активны аминогруппа (Лиз), имидазол Гис и гуанидиногруппа Арг, а максимальна активность тиогруппы Цис. Поэтому наибольшее практическое значение в качественном и количественном анализе α-аминокислот, в том числе и в аминокислотных анализаторах, получила универсальная нингидриновая реакция, специфичная для одновременного присутствия у α-С атома, как амино-, так и карбоксигруппы.
Рис. 3.3. Общие формулы структуры α-аминокислот и продукта их полимеризации. Пояснения в тексте.
Полимеризация α-аминокислот в структуру пептидов и белков (рис. 3.3) сохраняет все типы их R, но:
1. Нингидриновая реакция становится отрицательной, т.к. за исключением N- и C-концевых, α-амино- и α-карбоксигруппы расходуются на образование пептидных связей. Положительная нингидриновая реакция с белком, скорей свидетельствует о присутствии примесей аминокислот в препарате или посуде.
2. Для всех пептидов и белков специфична биуретовая реакция на пептидную группу, отсутствующую в мономерных аминокислотах.
3. Из более специфических реакций на R аминокислот, бывают полезны: ксантопротеиновая реакция с концентрированной азотной кислотой, на ароматические R Фен, Тир, Три; реакция с изатином на пятичленный цикл Про, а также реакции на имидазольный R Гис, тиогруппу Цис и гуанидиногруппу Арг. Важно учитывать, что часть этих R скрыта внутри белковых глобул и потому, качественные реакции на них ослаблены. Поэтому, перед их проведением, белки обычно денатурируют тем или иным способом.
4. В отличие от истинных растворов аминокислот, коллоидным растворам белков свойственны осадочные реакции, связанные с разрушением их гидратных оболочек и, вследствие этого, снижением их растворимости под действием водоотнимающих средств: нейтральных солей = высаливание, метанола = МеОН, этанола = EtОН, ацетона, мочевины и др. агентов.
Выполняя качественные реакции, следует:
1. Тщательно соблюдать правила пожарной безопасности и работ с концентрированными кислотами и щелочами = ЕЖ.
2. Промаркировать стеклографом или фломастером 2 ряда пробирок и поместить в один из них не более 0,5 мл (2-5 капель) 1 % раствора аминокислоты, а в другой – примерно тот же объем 1 % раствора белка.
3. В пару пробирок с растворами аминокислоты и белка, параллельно добавить по 3-5 капель соответствующих реактивов и, провести остальные процедуры, указанные для соответствующей реакции.
4. При необходимости нагрева пробирок – снять крышку тигля и поджечь спичкой сухое горючее. Затем, зажать пробирку в держатель, примитивная конструкция которого, очень ненадежна. Поэтому лучше обернуть пару пробирок сложенным в полоску листком бумаги и, придерживая их большим пальцем, равномерно пропускать нижние половины пробирок через пламя, избегая направления горлышек на соседей и бурного вскипания раствора. Выполнив операцию, своевременно погасить пламя крышкой тигля.
5. Результаты опытов, в соответствии с шаблоном, оформлять на развороте лабораторной тетради в виде таблицы:
6. Обдумав полученные результаты и, завершив оформление протокола, вместе со штативом пробирок, предъявить их преподавателю для защиты.
1. Нингидриновая реакция.Основана на дезаминировании и декарбоксилировании α-аминокислот спиртовым раствором нинги-дрина:
Возникший аммиак, реагируя с двумя молекулами нингидрина, образует окрашенное производное, с максимумом поглощения при 540 нм (для Про – 440 нм).
Ход работы: К исследуемым образцам добавить по 3-5 капель 0,5 % спиртового раствора нингидрина. Пробирки со смесями аккуратно прогреть на пламени и через 2-3 мин зарегистрировать появление окраски.
2. Ксантопротеиновая реакция. Как уже сказано выше, основана на образовании нитропроизводных аминокислот с ароматическим R: Фен, Тир, Три.
Ход работы: Включив тягу вытяжного шкафа, в пару пробирок с исследуемыми растворами осторожно добавить по нескольку капель концентрированной азотной кислоты (HNO3). Пробирки аккуратно прогреть на пламени, избегая направления горлышек на соседей, и зарегистрировать развитие окраски.
3. Нитропруссидная реакция.Основана на щелочном гидролизе серусодержащей аминокислоты цистеина, с выделением сульфида натрия (Na2S), дающего со свежеприготовленным раствором нитропруссида натрия, комплекс красного цвета.
Ход работы: В обе пробирки с 5-10 каплям исследуемых растворов добавить равный объём 20 % едкого натра и прокипятить не менее 3-5 мин. Добавить в пробирки по 3-5 капель раствора нитропруссида натрия и зафиксировать развитие окраски.
4. Биуретовая реакция. Основана на образовании в щелочной среде цветного комплекса пептидной связи с ионом Cu 2+ . Служит универсальным тестом для выявления пептидов и белков в растворах. Так как с ростом количества пептидных связей, интенсивность окраски раствора линейно нарастает, широко применяется для фотометрического определения концентраций белка.
Ход работы. В пробирки с 5-10 каплями исследуемых растворов добавить столько же 10 % раствора едкого натра. Хорошо перемешать и добавить по 2 капли 1 % раствора сульфата меди (CuSO4). Пробы перемешать и через несколько минут зарегистрировать развитие окраски.
5. Проба с кипячением.Основана на тепловой денатурации белков.
Ход работы. Обе пробирки с исследуемыми растворами подкислить, не более, чем одной каплей 1 % раствора уксусной кислоты (AcOH) и нагреть до кипения. Прокипятив растворы 2-3 мин, зарегистрировать результаты и объяснить механизм явления.
6. Осаждение солями тяжелых металлов(Ме).Их денатурирующие свойства основаны на способности катионов тяжелых Ме реагировать с функциональными группами R молекулы белка: тио-, амино-, карбокси-, ароматическими. Также, их сильные анионы вызывают перезарядку ионогенных групп в молекулах белков, разрушая в них тем самым, ионные связи.
Ход работы. В обе пробирки с исследуемыми растворами добавить по нескольку капель 5 % раствора сульфата меди (CuSO4). Зарегистрировать и объяснить полученные результаты.
7. Осаждение органическими кислотами.Основано на кислотной денатурации белков и образовании ковалентных производных тио-, амино- и ароматических групп R аминокислот с хлорорганикой.
Ход работы. В пробирки с исследуемыми растворами добавить по нескольку капель 10 % раствора трихлоруксусной кислоты (ТХУ) и, через несколько минут зарегистрировать результаты
Дата добавления: 2016-02-16 ; просмотров: 1090 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Аминокислоты можно обнаружить с помощью цветных реакций: нингидриновой, ксантопротеиновой, Фоля, Милона, биуретовой пробы и др. Эти реакции неспецифичны, т.к. основаны на обнаружении отдельных фрагментов в структуре аминокислот, которые могут встречаться и в других соединениях.
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции. При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
По интенсивности окраски можно судить о количестве аминокислот.
Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др.
Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
При действии концентрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
Реакция Фоля. Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Реакция Циммермана. Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
Реакция на триптофан. Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
Реакция Сакагучи. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра α-нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Биуретовая реакция – используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание. Окраска обусловлена образованием комплексного соединения меди(II), за счет пептидной группы -СО-NH- , которая характерна для белков. Свое название эта реакция получила от производного мочевины — биурета, который образуется при нагревании мочевины с отщеплением аммиака:
Кроме белков и биурета такое же окрашивание дают и другие соединения, содержащие -эту группу: амиды, имиды карбоновых кислот, а также соединения, содержащие в молекуле группы -CS-NH- или =CH-NH-. Также реакцию дают белки, некоторые аминокислоты, пептиды, биурет и средние пептоны.
Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
кетонная форма полипептида
енольная форма полипептида
При взаимодействии полипептида с Cu (OH)2 образуется комплекс, строение которого можно показать так:
источник
Реактивы и оборудование те же, что и в работе 1.
1. Аминопептид или другой гидролизат белков – препарат для парентерального питания.
2. Желатиноль (препарат из пищевого желатина) или желатин, 1%-ный раствор.
Метод анализа основан на использовании качественных реакций, рассмотренных в предыдущей работе, для выявления присутствия отдельных аминокислот в составе белковых препаратов.
Ход определения. С белковыми препаратами проводят качественные реакции – биуретовую, нингидриновую, ксантопротеиновую, Миллона, Фоля, Адамкевича и нитропруссидную. Для проведения каждой реакции используют по 5 капель гидролизата белков и препарата желатина.
Оформление работы. Полученные данные оформить в виде таблицы, приведенной в работе 1.
В выводе показать наличие, согласно проведенному анализу, отдельных аминокислот и сравнительную полноценность исследуемых белковых препаратов.
Практическое значение работы. Состав аминокислот определяет не только свойства белка, но и его питательную и лекарственную ценность. Биологически полноценными считаются белки, содержащие все незаменимые аминокислоты. Поэтому представляет интерес наличие именно этих аминокислот в белковых гидролизатах. Гидролизаты белков различной природы используются в медицине как лекарственные препараты для парентерального обмена. В лечебных целях применяются различные белки плазмы крови, желатина и др.
В практике контроль качества и количественный анализ таких лекарственных средств, как гидролизаты белков и препаратов, содержащих смеси аминокислот или отдельные аминокислоты, основываются на качественном и количественном анализе конкретных аминокислот. Так, одним из основных показателей качества гидролизатов белков является содержание триптофана, которое составляет в аминопептиде и в фибриносоле около 0,5 г/л, а в растворах гидролизина и гидролизата казеина не менее 0,15 г/л.
Работа 3. Хроматографический метод разделения аминокислот
Хроматография – один из эффективных и широко применяемых в биохимических исследованиях методов разделения аминокислот. Наиболее простой и доступной является распределительная хроматография на бумаге. Для проведения ее используют систему растворителей, составляющих подвижную и неподвижную фазы, от правильного подбора которых зависит эффективность разделения аминокислот. В частности, применяют фенол, насыщенный водой. При обработке хроматографической бумаги этой смесью растворителей вода с небольшим количеством фенола впитывается в бумагу и образует неподвижную фазу, а фенол, насыщенный водой, служит подвижной фазой.
В зависимости от направления фронта передвижения растворителя различают следующие виды хроматографии: восходящую, нисходящую, одномерную, двухмерную и радиальную. Расположение отдельных аминокислот обнаруживают путем проявления хроматограмм. Для этого высушенную бумагу обрабатывают раствором нингидрина и затем нагревают ее в сушильном шкафу при 100°С, т.е. проводится качественная нингидриновая реакция на аминокислоты, находящиеся на бумаге.
Скорость перемещения аминокислот выражают коэффициентом Rf, который представляет собой отношение расстояния, пройденного данной аминокислотой, к пути, пройденному фронтом растворителя:
где a – расстояние от места нанесения раствора смеси аминокислот (линия старта) до центра пятна конкретной аминокислоты;
b – путь, пройденный растворителем от линии старта до его фронта окончания хроматографии, мм.
Для каждой аминокислоты характерно свое значение Rf, которое зависит от сорта хроматографической бумаги, системы растворителей, температуры, рН среды и т.д.
Реактивы. Фенол, насыщенный водой * ; нингидрин, 0,2%-ный раствор в ацетоне.
Оборудование. Термостат, отрегулированный на температуру 37-38°С; сушильный шкаф, отрегулированный на температуру 100-105°С и имеющий перекладины с крючками для подвешивания хроматограмм; большие пробирки (диаметр 2,0-2,5 см, длина 18-20 см) с плотно подогнанными пробками и штатив для них; полоски хроматографической бумаги (ленинградская, лучше марки «быстрая», 12х150 мм); простой карандаш и линейка; игла с ниткой; микропипетка; чашка Петри или пульверизатор; пинцет; ножницы; пипетка вместимостью 5 мл.
Материалы. Раствор смеси L-аланина, лейцина и глутаминовой кислоты, 0,04 моль/л.
Метод основан на разной скорости передвижения аминокислот по бумаге в зависимости от коэффициента распределения их между неподвижной (вода с примесью фенола) и подвижной (фенол, насыщенный водой) фазами растворителя.
Ход определения. Берут пинцетом за конец полоску бумаги (не касаться бумаги пальцами!), прокалывают его иглой с ниткой, которую завязывают петлей длиной 5-6 см. На противоположном конце полоски, отступив от края 2 см, проводят простым карандашом линию старта и в центре ее очерчивают кружок диаметром 3-4 мм для нанесения раствора смеси аминокислот.
Полоску укладывают на лежащие стеклянные пробирки и наносят 0,2 мл раствора смеси аминокислот, но не сразу, а порциями. После нанесения каждой порции пятно подсушивают, чтобы оно не расплывалось за пределы очерченного карандашом кружка.
В сухую пробирку с помощью пипетки вносят 2 мл фенола, насыщенного водой (при работе с фенолом соблюдать осторожность: вызывает ожоги! Не насасывать его в пипетку ртом!), следя за тем, чтобы не смочить стенки пробирки.
Ставят пробирку в штатив строго вертикально. Осторожно, держа за нитку, опускают в пробирку полоску бумаги, погружая ее нижний конец в растворитель не более чем на 2-3 мм, и закрепляют ее в висячем положении, прижав петлю плотно закрытой пробкой (рис.4).
Помещают штатив с пробиркой в термостат (при 37-38°С) на 1,5 ч.
Рис. 4. Прибор для хроматографии (а)
и хроматограмма аминокислот (б)
Затем вынимают полоску, подвешивают ее за петлю в сушильном шкафу и выдерживают при 100-105°С в течение 10 мин.
Для проявления хроматограммы полоску переносят в чашку Петри, в которую налито 15 мл раствора нингидрина, держа ее пинцетом, проводят через раствор и вновь помещают в сушильный шкаф на 5 мин при той же температуре.
Оформление работы. Зарисовать в рабочем состоянии прибор, отметив положение аминокислот на хроматограмме. Измерить линейкой расстояния (в мм) a и b для каждой аминокислоты и рассчитать их Rf. В выводе отметить возможность разделения хроматографией на бумаге разных аминокислот.
Практическое значение работы. Хроматографический анализ свободных аминокислот в сыворотке крови, моче и других жидких средах применяется в клинике для диагностики наследственных заболеваний обмена аминокислот, патологии печени, почек, а также при оценке степени тяжести сахарного диабета: в фармации – для контроля качества белковых гидролизатов и препаратов смеси аминокислот, а в научных экспериментах – для изучения аминокислотного состава гидролизатов очищенных белков.
Дата добавления: 2014-11-06 ; Просмотров: 407 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Раздел 1. Строение, свойства и функции белков
Тема 1.1. Строение и классификация аминокислот. Структура белков 6
Тема 1.2. Структура и физико-химические свойства белков 11
Тема 1.3. Классификация белков. Строение и функции белков в организме. Сложные белки 16
Раздел 2. Строение, классификация и роль витаминов
Тема 2.1. Жирорастворимые витамины 22
Тема 2.2. Водорастворимые витамины 27
Тема 3.1. Строение и свойства ферментов. Регуляция активности ферментов 36
Тема 3.2. Классификация и номенклатура ферментов. Использование ферментов в медицине 45
Контрольные вопросы к итоговому занятию
Раздел 4. Биологическое окисление
Тема 4.1. Общие пути катаболизма: окислительное декарбоксилирование пирувата. Цикл трикарбоновых кислот. Ферменты дыхательной цепи. Окислительное фосфорилирование (семинар) 54
Раздел 5. Обмен аминокислот и белков
Тема 5.1. Внешний обмен белков 58
Тема 5.2. Внутриклеточный обмен аминокислот 67
Тема 5.3. Пути превращения аммиака и его обезвреживание 71
Тема 5.4. Особенности и нарушения обмена некоторых аминокислот 76
Раздел 6. Строение и обмен пуриновых и пиримидиновых нуклеотидов
Тема 6.1. Строение и метаболизм пуриновых и пиримидиновых нуклеотидов 84
Раздел 7. Матричные биосинтезы
Тема 7.1. Синтез нуклеиновых кислот и его регуляция 92
Тема 7.2. Биосинтез белка и его регуляция 95
Контрольные вопросы к итоговому занятию
Раздел 8. Строение и обмен углеводов
Тема 8.1. Строение и внешний обмен углеводов. Обмен гликогена 109
Тема 8.2. Окисление глюкозы в анаэробных условиях. Глюконеогенез 115
Тема 8.3. Аэробное окисление глюкозы. Пентозофосфатный путь 122
Контрольные вопросы к итоговому занятию
Раздел 9. Строение и обмен липидов
Тема 9.1. Строение и внешний обмен липидов 134
Тема 9.2. Внутриклеточный обмен жирных кислот и триацилглицеролов 140
Тема 9.3. Внутриклеточный обмен фосфолипидов и холестерола. Транспорт липидов в крови 147
Контрольные вопросы к итоговому занятию
Раздел 10. Гормональная регуляция обмена веществ и функций организма
Тема 10.1. Механизмы передачи гормонального сигнала. Классификация гормонов. Гормоны гипофиза. (семинар) 157
Тема 10.2. Гормоны гипоталамуса, гипофиза, щитовидной
поджелудочной и паращитовидной желез 159
Тема 10.3. Гормоны гипофиза, надпочечников и половых желез 164
Тема 11.1. Азотсодержащие вещества крови: белки, ферменты, фракции остаточного азота 170
Тема 11.2. Обмен железа. Гемопротеины. Синтез и распад гема 182
Тема 11.3. Неорганические вещества крови. Кислотно-основное
состояние 190
Раздел 12. Биохимия почек и печени
Тема 12.1. Водно-солевой обмен. Нормальные и патологические компоненты мочи 204
Тема 12.2. Участие печени в метаболизме веществ. Биотрансформация ксенобиотиков 214
Контрольные вопросы к итоговому занятию
Классификация и номенклатура ферментов 226
Индивидуальные белки плазмы крови 240
Нормальные величины изученных биохимических показателей 246
Эталоны ответов к тестовым заданиям 250
Эталоны ответов к ситуационным задачам 252
Раздел 1.
Строение, свойства и функции белков
Тема 1.1.
Строение и классификация аминокислот.
Структура белков
Актуальность
Аминокислоты являются материалом для строительства белков – пластического материала клеток живого организма. Особенностями аминокислотного состава обусловлено огромное разнообразие структуры и функций белковых молекул, благодаря чему белкам принадлежит ведущая роль во всех процессах жизнедеятельности. Аминокислоты участвуют в образовании биогенных аминов, азотистых оснований и мононуклеотидов, нейромедиаторов и т.д. Ряд из них используются в качестве лекарств.
Знакомство со строением, физико-химическими свойствами и классификацией аминокислот, входящих в состав белков организма человека.
Приобретение практических навыков по проведению качественного анализа биологических жидкостей на присутствие аминокислот, пептидов и белков при помощи цветных реакций.
Вопросы для самоподготовки
Принципы классификации аминокислот.
o по биологической роли (заменимые и незаменимые);
o по физико-химическим свойствам (нейтральные, кислые, основные; гидрофобные, гидрофильные);
o по химическому строению (с алифатическими радикалами, с дополнительной функциональной группой, с ароматическим и гетероциклическим радикалом, иминокислоты);
o по растворимости в воде (неполярные, полярные незаряженные, полярные отрицательно и положительно заряженные).
Структурные формулы протеиногенных аминокислот.
Физико-химические свойства аминокислот, роль их функциональных групп.
Изоэлектрическая точка аминокислот и пептидов. От чего она зависит?
Влияние изменения рН на заряд аминокислот.
Пептидная связь, реакция образования. Свойства пептидной связи.
Влияние изменения рН на заряд и растворимость пептидов.
Цветные качественные реакции на аминокислоты и белки. Принцип методов. Практическое применение реакций.
Обнаружение белка и свободных аминокислот в биологическом материале. Ключевые моменты анализа. Как удалить белок из биологической жидкости? Как обнаружить наличие свободных аминокислот в жидкости?
Лабораторная работа 1
Цветные качественные реакции на белок и аминокислоты
1) 1% р-р яичного белка, 2) 0,5% р-р нингидрина, 3) 30% р-р NaOH, 4) 10% р-р NaOH, 5) 5% р-р Pb(CH3COO)2, 6) 5% р-р нитропруссида натрия, 7) конц. HNO3, 8) 5% р-р CuSO4.
Материал исследования
При изучении цветных реакций в качестве объекта исследования используют 1% водный раствор яичного белка, содержащего полный набор аминокислот.
Реакция на пептидную связь
Для обнаружения пептидной связи в белках и пептидах используется универсальная биуретовая реакция. Биуретовую реакцию дают вещества, содержащие не менее двух пептидных группировок.
Пептидная группа образует в щелочной среде с ионами Сu 2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей. Интенсивность окрашивания пропорциональна количеству пептидных групп.
Проведение анализа
В пробирку с 5 каплями 1% раствора белка вносят 3 капли 10% раствора NаОН и 1 каплю 5% раствора CuSО4.
Реакция для обнаружения a‑аминогрупп
Для обнаружения a‑аминогрупп, содержащихся в аминокислотах, и концевых a‑аминогрупп пептидов и белков используется нингидриновая реакция.
При нагревании аминокислот и пептидов с нингидрином происходят окислительное отщепление a‑аминогрупп и восстановление нингидрина. Восстановленный нингидрин реагирует с аммиаком и другой молекулой окисленного нингидрина с образованием комплекса сине-фиолетового цвета.
Проведение анализа
5 капель раствора белка смешивают с 5 каплями 0,5% раствора нингидрина. Пробирки нагревают и кипятят до появления сине-фиолетового окрашивания.
Реакция на ароматические аминокислоты
Для обнаружения ароматических аминокислот (фенилаланин, тирозин, триптофан) используется ксантопротеиновая реакция.
Ароматическое кольцо при взаимодействии с концентрированной азотной кислотой образует динитросоединение желтого цвета.
Проведение анализа
К 5 каплям 1% раствора белка добавляют 2 капли конц.HNO3 и осторожно нагревают. Наблюдают за появлением желтого окрашивания, при отсутствии желтого цвета еще добавляют 1-2 капли конц.HNO3. При добавлении избытка 30% раствора NаОН окраска переходит в оранжевую.
Реакции на серосодержащие аминокислоты
Сульфгидрильные группы в белке или пептиде подвергаются щелочному гидролизу, в результате чего происходит отщепление серы в виде сульфида натрия Na2S, который вступает в дальнейшие реакции:
o реакция Фоля – Na2S с ацетатом свинца Pb(CH3COO)2 дает черный или бурый осадок сульфида свинца;
o реакция с нитропруссидом – Na2S дает с нитропруссидом натрия соединение, окрашенное в красно-коричневый цвет.
Проведение анализа
5 капель 1% раствора белка и 5 капель 30% раствора NaOH кипятить 1‑2 минуты. Разделить содержимое на 2 части для реакций «а» и «б».
а) Реакция Фоля
К 5 каплям гидролизата добавляют 1 каплю раствора уксусно-кислого свинца и нагревают до кипения. Отмечают появление бурого или черного осадка.
б) Реакция с нитропруссидом
К 5 каплям гидролизата добавляют 2-3 капли раствора 5% натрия нитропруссида. Отмечают появление красно-коричневого окрашивания.
источник
Учебно-методическое пособие
«ОСНОВЫ БИОХИМИИ»
(практический курс)
0407 Лабораторная диагностика
Составлено в соответствии с Государственными требованиями к минимуму содержания и уровню подготовки выпускника по специальности 0407 «Лабораторная диагностика». Учебно-методическое пособие включает биохимические методы исследования для выполнения самостоятельной работы на практических занятиях по дисциплине «Основы биохимии с методами клинико-диагностических исследований», а также задания для конроля.
Автор: Жаднова И.В., преподаватель биохимии и ТЛР ГОУЗ «ВОМК №1»
Рецензенты: Догадова И.В., зав. КДЛ МУЗ ДКБ №25
Островский О.В., зав. кафедрой биохимии ВолГМУ д.м.н.
Утверждено на заседании методического Совета колледжа (протокол № от )
Председатель С.В. Сотникова
Предназначено для студентов и преподавателей медицинских колледжей и училищ Волгоградской области.
Раздел 1. Макромолекулы, составляющие основу живой материи – организма человека.
1.1. Анализ аминокислотного состава белков при помощи цветных реакций.
Работа №1. Биуретовая реакция на белки
Работа № 2. Реакция на ароматические аминокислоты (реакция нитрования)
Работа № 3. Реакция на тирозин (реакция Миллона)
Работа № 4. Реакция на цистеин (реакция Фоля)
Работа № 5. Реакция на аргинин (реакция Сакагути)
Колическтвенное определение белка
Работа № 6. Количественное определение белка биуретовым методом
Работа № 7. Количественное определение белка по методу Лоури
Физико-химические свойсва белков
Работа № 8. Разделение альбуминов и глобулинов яичного белка методом высаливания
Работа № 9. Обессоливание растворов белка методом диализа
Работа №10. Обессоливание белкового раствора методом гель-фильтрации
1.4. Элекро-химические свойсва белков.
Работа №11. Электрофоретическое фракционирование белков сыворотки крови на мембране из ацетатцеллюлозы
Работа №12. Турбидиметрический метод определения белковых фракций сыворотки крови.
Размеры и формы белковых молекул. Денатурация белка.
Работа №13. Осаждение белков при нагревании
Раздел 2. Химические сойства углеводов.
Работа №14 Обнаружение пентоз (проба Биаля)
Работа №15 Обнаружение лактозы и мальтозы
Работа №16 Обнаружение крахмала
Работа №17 Определение глюкозы
Раздел 3. Химические свойства липидов.
Работа №18 Обнаружение глицеринсодержащих липидов. Акролеиновая проба.
Работа №19 Обнаружение лецитина в желтке куриного яйца.
Работа №20 Обнаружение холестерина.
Работа №21 Растворение и эмульгирование жиров.
Раздел 4. Химические свойства нуклеиновых кислот.
Работа №22 Изучение состава нуклеопротеидов дрожжей.
Раздел 5. Витамины.
Работа №23 Количественное определение аскорбиновой кислоты (витамина С) в моче.
Раздел 6. Свойства ферментов, влияние различных факторов на скорость химических реакций
Работа №24 Ферментный гидролиз крахмала.
Работа №25 Кинетика ферментов. Специфичность действия ферментов.
Работа №26 Влияние температуры на активность ферментов.
Работа №27 Влияние рН среды на активность ферментов.
Работа №28 Влияние активаторов и ингибиторов на активность ферментов.
Раздел 6. Количественное определение ферментов.
Работа №29 Колориметрический динитрофенилгидразиновый метод исследования активности аминотрансфераз в сыворотке крови (по Райтману, Френкелю, 1957)
Работа №30 Определение активности щелочной фосфатазы в сыворотке крови методом конечной точки по Бессею, Лоури, Броку
Работа №31 Определение активности альфа-амилазы методом Каравея
Работа №32 Колориметрический динитрофенилгидразиновый метод определения активности лактатдегидрогеназы в сыворотке крови (по Севелу и Товареку)
Работа №33 Определение активности креатинкиназы в сыворотке крови
Работа №34 Определение активности сьюороточной холинэстеразы колориметрическим методом
Работа №35 Цитохимический метод определения миелопероксидазы (МП) нейтрофилов
Приложение 1. Список условных сокращений.
Приложение 2. Международная система единиц измерения в клинико-биохимических исследованиях.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическое пособие «Основы биохимии (практический курс)» составлено для студентов специальности 0407 «Лабораторная диагностика».
Цель создания учебного пособия — помощь студентам в изучении практических основ биохимии и овладении биохимическими методами анализа. Пособие составлено в соответствии с учебной программой по биохимии с методами клинико-биохимических исследований.
Данное пособие содержит основные виды исследований химических свойств белков, углеводов, липидов, нуклеиновых кислот, витаминов и ферментов, применяемых в клинико-биохимических лабораториях. В конце каждого раздела приведены задания для контроля.
В пособие включены практические работы, которые могут быть выполнены в течение 6ч, отводимых для практического занятия. В то же время даны практические работы, в которых студенты знакомятся с методами экспресс — диагностики.
В конце пособия даны приложения, которые, несомненно, облегчат организацию лабораторных занятий.
Пособие адресовано студентам и слушателям медицинских колледжей, а также лабораторным техникам и технологам, работающим в биохимических и клинико-диагностических лабораториях лечебно-профилактических учреждений.
Макромолекулы, составляющие основу живой
материи – организма человека.
АНАЛИЗ АМИНОКИСЛОТНОГО СОСТАВА БЕЛКОВ ПРИ ПОМОЩИ ЦВЕТНЫХ РЕАКЦИЙ
В лабораторной практике для идентификации, полуколичественного определения белков и отдельных аминокислот очень часто используются цветные реакции. В цветных реакциях происходит взаимодействие специфических реактивов с функциональными группами радикалов аминокислот, входящих в состав белков, или с пептидными группировками.
Цветные реакции на белки проводят параллельно с растворами двух белков: яичного белка (I) и желатина (II). Результаты оформляют в виде таблицы.
| Опре- | При- | Результа | ты реак- | Вывод. | ||
| № | деляе- | меняе- | ции: нал | ичие (+) | Сравнение | |
| п/п | Реакция | мая | мые | или отсут | ствие (—) | аминокис- |
| амино- | реак- | лотного состава белков | ||||
| кислота | тивы | I | II | |||
| Биуретовая | ||||||
| Ксантолро- | ||||||
| теиновая | ||||||
| (нитрования) | ||||||
| Миллона | ||||||
| Фоля | ||||||
| Сакагути |
Работа №1. Биуретовая реакция на белки
В щелочной среде раствор белка при добавлении разбавленного раствора сульфата меди окрашивается в сине-фиолетовый цвет. Окраска обусловлена образованием комплексов ионов меди с пептидными группами белка.
Биуретовую реакцию дают все белки, а также олиго-пептиды, содержащие не менее двух пептидных связей.
Материал для исследования* (для выполнения работ №1-5).Яичный белок — 1 % раствор; желатин — 1 % раствор.
Реактивы (для выполнения работ № 1—5).CuS04, 1 % раствор; гидроксид натрия, 10 % и 30 % растворы; азотная кислота, концентрированный раствор; аммиак, концентрированный раствор; ацетат свинца, 5 % раствор; а-нафтанол, 0,1 % спиртовой раствор; гипобромит натрия.
Оборудование.Штативы с пробирками; пипетки; газовые горелки; водяные бани.
Ход работы.В одну пробирку наливают 5 капель раствора яичного белка, в другую — 5 капель раствора желатина. В каждую пробирку добавляют по 5 капель 10 % раствора NaOH и по 1 капле 1 % раствора CuS04. В обеих пробирках наблюдают устойчивое сине-фиолетовое окрашивание.
Оформление работы.Результаты опыта вносят в таблицу.
источник
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКА. КЛАССИФИКАЦИЯ И СВОЙСТВА АМИНОКИСЛОТ. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Кожина Ольга Владимировна
Самарцев Виктор Николаевич
Малый практикум
Биохимия – наука о химическом строении и функциях веществ, входящих в состав живой материи, и их превращениях в процессах жизнедеятельности. Биохимия изучает различные структуры, свойственные живым организмам, и химические реакции, протекающие на клеточном и организменном уровнях. Биохимия изучает процессы, лежащие в основе обмена веществ.
В биохимии выделяют два раздела:
1. СТАТИЧЕСКАЯ биохимия – изучает состав живых организмов.
2. ДИНАМИЧЕСКАЯ биохимия – изучает обмен веществ.
Статическая биохимия выявила характерную черту живых клеток – их сложность и высокий уровень молекулярной организации, переход от более простых компонентов клетки к более сложным. Структурную организацию живой клетки можно представить в виде следующей схемы: неорганические вещества (H2O, N2, CO2, O2, P, S) → мономеры(нуклеотиды, аминокислоты, моносахариды, жирные кислоты, глицерин) → макромолекулы (нуклеиновые кислоты, белки, полисахариды, липиды) → сложные макромолекулы(нуклеопротеины, гликопротеины, липопротеины) → комплексы (рибосомы, ядрышко, мембраны, сократительные системы) → органеллы (ядро, митохондрии, лизосомы) → клетка.
Переход от простых биомолекул к сложным биологическим структурам основывается на физико-химических принципах самоорганизации.
Задачей динамической биохимии является изучение обмена веществ, или метаболизма клетки. Обмен веществ – это совокупность двух диаметрально противоположных, но гармонически сочетающихся процессов – синтеза (анаболизма) и распада (катаболизма) веществ. Обмен веществ в клетке не отделим от обмена энергии, т.к. синтез веществ невозможен без затраты энергии.
Другой чертой обмена веществ является тонкое регулирование скорости протекания отдельных химических реакций. Важную роль в регулировании процессов метаболизма играют биологические катализаторы – ферменты. Регуляция клеточного метаболизма может осуществляться либо путем активации или подавления действия ферментов, либо за счет изменения скорости их биосинтеза в клетке.
Раздел 1. БЕЛКИ
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКА. КЛАССИФИКАЦИЯ И СВОЙСТВА АМИНОКИСЛОТ. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белок – высокомолекулярное азотистое природное соединение, распадающееся в ходе гидролиза на аминокислоты.
Белки содержат углерода — 50-55 %, водорода — 6,5-7,3 %, азота — 15-18 %, кислорода — 21-24 %, серы — до 2,4 % и золы — до 0,5 %.
Для построения всех белков используется один и тот же набор из 20 различных аминокислот, ковалентно связанных друг с другом в определенной, характерной только для данного белка последовательности.
Общей структурной особенностью аминокислот является наличие карбоксильной и аминогруппы, связанных с одним и тем же атомом углерода. Различаются аминокислоты боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде. Карбоксильные и аминогруппы аминокислот участвуют в образовании пептидных связей.
Помимо 20 стандартных, основных или нормальных аминокислот, входящих в состав белков, существуют другие аминокислоты, присутствующие в живых организмах, но не встречающиеся в белках.
Стандартные аминокислоты имеют трехбуквенные и однобуквенные условные обозначения (таблица 1).
Сокращенные обозначения аминокислот
| № | Аминокислота | Трехбуквенное сокращенное обозначение | Однобуквенное обозначение |
| Аланин | ала | Ala | A |
| Аргинин | арг | Arg | R |
| Аспарагин | асн | Asn | N |
| Аспарагиновая кислота | асп | Asp | D |
| Валин | вал | Val | V |
| Гистидин | гис | His | H |
| Глицин | гли | Gly | G |
| Глутамин | глн | Gln | Q |
| Глутаминовая кислота | глу | Glu | E |
| Изолейцин | иле | Ile | I |
| Лейцин | лей | Leu | L |
| Лизин | лиз | Lys | K |
| Метионин | мет | Met | M |
| Пролин | про | Pro | P |
| Серин | сер | Ser | S |
| Тирозин | тир | Tyr | Y |
| Треонин | тре | Thr | T |
| Триптофан | три | Trp | W |
| Фенилаланин | фен | Phe | F |
| Цинтеин | цис | Cys | C |
Протеиногенные аминокислоты делят на 4 группы по полярности радикалов: 1) неполярные (гидрофобные) (рисунок 1);2) полярные (гидрофильные) незаряженные (рисунок 2);3) отрицательно заряженные(рисунок 3);4) положительно заряженные (рисунок 4).
Рисунок 1. Неполярные (гидрофобные) аминокислоты: а) Аланин (Ala) – Ала; б) Валин (Val) – Вал; в) Пролин (Pro) – Про; г) Лейцин (Leu) – Лей; д) Изолейцин (Ile) – Иле; е) Фенилаланин (Phe) – Фен; ж) Метионин (Met) – Мет; з) Триптофан (Trp) – Три.
Рисунок 2. Незаряженные полярные аминокислоты: а) Глицин (Gly)- Гли; б) Серин (Ser) – Сер; в) Треонин (Thr) – Тре; г) Тирозин (Tyr) – Тир; д) Аспарагин (Asn) – Асн; е) Глутамин (Gln) – Глн; ж) Цистеин (Cys) — Цис
Рисунок 3. Отрицательно заряженные аминокислоты: а) Аспарагиновая кислота (Asp) – Асп; б) Глутаминовая кислота (Glu) – Глу.
Рисунок 4. Положительно заряженные аминокислоты: а) Лизин (Lys) – Лиз; б) Аргинин (Arg) – Арг; г) Гистидин (His) – Гис.
Радикалы аминокислот участвуют в образовании связей: 1) гидрофобные радикалы участвуют в гидрофобных взаимодействиях; 2) гидрофильные радикалы формируют водородные связи; 3) полярные (заряженные) радикалы образуют ионные связи; 4) сближение двух радикалов цистеина цис-SH + цис-SH ведет к образованию дисульфидной связи цис-S–S-цис.
Лабораторная работа №1
Дата добавления: 2016-11-23 ; просмотров: 662 | Нарушение авторских прав
источник
Один из способов определения структуры белка включает его гидролиз, а затем качественный и количественный анализ образовавшейся при этом смеси аминокислот. Ниже обсуждается несколько методов такого анализа.
Смесь известных аминокислот наносится в виде пятна на стеклянную пластину, покрытую тонким слоем оксида кремния или оксида алюминия (рис. 15-2). В качестве пластины можно также использовать специальную бумагу без всякого покрытия. Пластину помещают в стеклянную камеру, на дно которой налито небольшое количество растворителя. Благодаря действию капиллярных сил растворитель начинает постепенно подниматься по пластине, увлекая за собой компоненты нанесенной на пластину смеси. Различные вещества движутся по пластине с различными скоростями. Относительная скорость движения компонентов смеси определяется относительной полярностью вещества, покрывающего пластину (неподвижной фазы), и растворителя (подвижной фазы). Например, если подвижная фаза малополярна, то менее полярные аминокислоты будут
Рис. 15-2. (см. скан) Тонкослойная хроматография: 1 — стеклянная или алюминиевая пластина, покрытая тонким слоем неподвижной фазы или нанесенное на точку старта пятно анализируемой смеси; 3 — стеклянная камера; 4 — крышка; 5 — растворитель (подвижная фаза) растворитель медленно поднимаете и по пластинке; фиолетовые (после обработки нингидрином) пятна аминокислот: 7 — лизин; 8 — пролин; 9 — серин; 10 — тирозии; 11 — место, где должно было бы оказаться пятно аланина, которого в анализируемой смеси нет; 12 — точка старта
двигаться по пластине сравнительно быстро, тогда как более полярные аминокислоты будут сильнее удерживаться неподвижной фазой. Различие в скорости движения приводит к разделению смеси на компоненты. После того как фронт подвижной фазы достигнет верхнего края пластины, ее вынимают из камеры, высушивают и опрыскивают раствором специального вещества — нингидрина. При этом бесцветные (и потому невидимые) аминокислоты образуют фиолетовые комплексы с нингидрином, что позволяет увидеть пятна аминокислот на пластине. Зная заранее положение на хроматограмме пятен каждой из двадцати аминокислот (при использовании определенных подвижной и неподвижной фаз),
легко определить, какие именно аминокислоты содержатся в исследуемой смеси. На рис. 15-2 показана хроматограмма смеси тирозина, серина, пролина и лизина.
Тонкослойная хроматография (ТСХ) позволяет провести лишь качественный анализ белков или смесей аминокислот. Очень приблизительно относительное содержание аминокислот в смеси можно оценить по интенсивности окраски пятен. Чем темнее пятно, тем выше содержание аминокислоты в изучаемом образце.
Еще одним методом определения аминокислот служит электрофорез, который имеет значительное сходство с ТСХ. Анализируемую смесь аминокислот помещают в центр расположенного горизонтально бумажного листа, который смочен буферным раствором, обеспечивающим желаемое значение рН. Под действием внешнего электрического поля молекулы аминокислот, в зависимости от знака заряда, начинают двигаться либо к катоду, либо к аноду (рис. 15-3, табл. 15-3). Если значение рН буферного раствора выше данной аминокислоты, то аминокислота существует в виде аниона и в электрическом поле будет двигаться к аноду. Наоборот, если аминокислота находится в катионной форме и будет двигаться к катоду. Чем больше разница между тем быстрее (дальше) будет двигаться аминокислота. В табл. 15-3 приведены значения и относительные подвижности некоторых аминокислот при
На рис. 15-4 показана электрофореграмма, полученная после проявления нингидрином.
Электрофорез используется для анализа смесей аминокислот, полученных в результате гидролиза белков. В некоторых случаях электрофоретическое обнаружение необычных аминокислот в плазме крови позволяет поставить больному правильный диагноз.
Рис. 15-3- Схема установки для электрофореза: а — вид сбоку; б — вид сверху; 1 — бумажный лист; 2 — пятно исследуемой смеси; 3 — буферный раствор
Рис. 15-4, Электрофореграмма: 1 — точка старта; 2 — лейцин; 3 — фенил аланин; 4 — аспарагиновая кислота; 5 — лизин
На рис. 15-5 показана принципиальная схема аминокислотного анализатора, который позволяет устанавливать как качественный, так и количественный состав смесей аминокислот, полученных в результате гидролиза белка.
Белок, чей аминокислотный состав анализируется, смешивают с соляной кислотой. Нагревание смеси приводит к гидролизу белка до аминокислот. Затем смесь аминокислот пропускают через колонку, заполненную оксидом алюминия или ионообменной смолой. В колонке аминокислоты разделяются и выходят из нее с различной скоростью. Разделенные аминокислоты смешивают с нингидрином и снова нагревают для ускорения образования окрашенного комплекса. Затем раствор проходит через фотометр, который регистрирует наличие и интенсивность окраски и изображает график зависимости оптической плотности раствора от времени. Поскольку время удерживания каждой из двадцати аминокислот в колонке известно, можно установить, какие именно аминокислоты входят в состав исследуемого белка. Площадь пика пропорциональна количеству данной аминокислоты, что позволяет установить относительное содержание аминокислот в белке.
Аминокислотный состав белка может быть установлен несколькими способами. После гидролиза белка до аминокислот смесь последних можно анализировать с помощью тонкослойной хроматографии или электрофореза. Оба эти метода дают только качественный состав смеси аминокислот. С помощью автоматического аминокислотного анализатора можно установить и качественными количественный аминокислотный состав белка.
Таблица 15-3. (см. скан) Относительные подвижности некоторых аминокислот в электрическом поле
источник
Раздел 1. Строение, свойства и функции белков
Тема 1.1. Строение и классификация аминокислот. Структура белков 6
Тема 1.2. Структура и физико-химические свойства белков 11
Тема 1.3. Классификация белков. Строение и функции белков в организме. Сложные белки 16
Раздел 2. Строение, классификация и роль витаминов
Тема 2.1. Жирорастворимые витамины 22
Тема 2.2. Водорастворимые витамины 27
Тема 3.1. Строение и свойства ферментов. Регуляция активности ферментов 36
Тема 3.2. Классификация и номенклатура ферментов. Использование ферментов в медицине 45
Контрольные вопросы к итоговому занятию
Раздел 4. Биологическое окисление
Тема 4.1. Общие пути катаболизма: окислительное декарбоксилирование пирувата. Цикл трикарбоновых кислот. Ферменты дыхательной цепи. Окислительное фосфорилирование (семинар) 54
Раздел 5. Обмен аминокислот и белков
Тема 5.1. Внешний обмен белков 58
Тема 5.2. Внутриклеточный обмен аминокислот 67
Тема 5.3. Пути превращения аммиака и его обезвреживание 71
Тема 5.4. Особенности и нарушения обмена некоторых аминокислот 76
Раздел 6. Строение и обмен пуриновых и пиримидиновых нуклеотидов
Тема 6.1. Строение и метаболизм пуриновых и пиримидиновых нуклеотидов 84
Раздел 7. Матричные биосинтезы
Тема 7.1. Синтез нуклеиновых кислот и его регуляция 92
Тема 7.2. Биосинтез белка и его регуляция 95
Контрольные вопросы к итоговому занятию
Раздел 8. Строение и обмен углеводов
Тема 8.1. Строение и внешний обмен углеводов. Обмен гликогена 109
Тема 8.2. Окисление глюкозы в анаэробных условиях. Глюконеогенез 115
Тема 8.3. Аэробное окисление глюкозы. Пентозофосфатный путь 122
Контрольные вопросы к итоговому занятию
Раздел 9. Строение и обмен липидов
Тема 9.1. Строение и внешний обмен липидов 134
Тема 9.2. Внутриклеточный обмен жирных кислот и триацилглицеролов 140
Тема 9.3. Внутриклеточный обмен фосфолипидов и холестерола. Транспорт липидов в крови 147
Контрольные вопросы к итоговому занятию
Раздел 10. Гормональная регуляция обмена веществ и функций организма
Тема 10.1. Механизмы передачи гормонального сигнала. Классификация гормонов. Гормоны гипофиза. (семинар) 157
Тема 10.2. Гормоны гипоталамуса, гипофиза, щитовидной
поджелудочной и паращитовидной желез 159
Тема 10.3. Гормоны гипофиза, надпочечников и половых желез 164
Тема 11.1. Азотсодержащие вещества крови: белки, ферменты, фракции остаточного азота 170
Тема 11.2. Обмен железа. Гемопротеины. Синтез и распад гема 182
Тема 11.3. Неорганические вещества крови. Кислотно-основное
состояние 190
Раздел 12. Биохимия почек и печени
Тема 12.1. Водно-солевой обмен. Нормальные и патологические компоненты мочи 204
Тема 12.2. Участие печени в метаболизме веществ. Биотрансформация ксенобиотиков 214
Контрольные вопросы к итоговому занятию
Классификация и номенклатура ферментов 226
Индивидуальные белки плазмы крови 240
Нормальные величины изученных биохимических показателей 246
Эталоны ответов к тестовым заданиям 250
Эталоны ответов к ситуационным задачам 252
Раздел 1.
Строение, свойства и функции белков
Тема 1.1.
Строение и классификация аминокислот.
Структура белков
Актуальность
Аминокислоты являются материалом для строительства белков – пластического материала клеток живого организма. Особенностями аминокислотного состава обусловлено огромное разнообразие структуры и функций белковых молекул, благодаря чему белкам принадлежит ведущая роль во всех процессах жизнедеятельности. Аминокислоты участвуют в образовании биогенных аминов, азотистых оснований и мононуклеотидов, нейромедиаторов и т.д. Ряд из них используются в качестве лекарств.
Знакомство со строением, физико-химическими свойствами и классификацией аминокислот, входящих в состав белков организма человека.
Приобретение практических навыков по проведению качественного анализа биологических жидкостей на присутствие аминокислот, пептидов и белков при помощи цветных реакций.
Вопросы для самоподготовки
Принципы классификации аминокислот.
o по биологической роли (заменимые и незаменимые);
o по физико-химическим свойствам (нейтральные, кислые, основные; гидрофобные, гидрофильные);
o по химическому строению (с алифатическими радикалами, с дополнительной функциональной группой, с ароматическим и гетероциклическим радикалом, иминокислоты);
o по растворимости в воде (неполярные, полярные незаряженные, полярные отрицательно и положительно заряженные).
Структурные формулы протеиногенных аминокислот.
Физико-химические свойства аминокислот, роль их функциональных групп.
Изоэлектрическая точка аминокислот и пептидов. От чего она зависит?
Влияние изменения рН на заряд аминокислот.
Пептидная связь, реакция образования. Свойства пептидной связи.
Влияние изменения рН на заряд и растворимость пептидов.
Цветные качественные реакции на аминокислоты и белки. Принцип методов. Практическое применение реакций.
Обнаружение белка и свободных аминокислот в биологическом материале. Ключевые моменты анализа. Как удалить белок из биологической жидкости? Как обнаружить наличие свободных аминокислот в жидкости?
Лабораторная работа 1
Цветные качественные реакции на белок и аминокислоты
1) 1% р-р яичного белка, 2) 0,5% р-р нингидрина, 3) 30% р-р NaOH, 4) 10% р-р NaOH, 5) 5% р-р Pb(CH3COO)2, 6) 5% р-р нитропруссида натрия, 7) конц. HNO3, 8) 5% р-р CuSO4.
Материал исследования
При изучении цветных реакций в качестве объекта исследования используют 1% водный раствор яичного белка, содержащего полный набор аминокислот.
Реакция на пептидную связь
Для обнаружения пептидной связи в белках и пептидах используется универсальная биуретовая реакция. Биуретовую реакцию дают вещества, содержащие не менее двух пептидных группировок.
Пептидная группа образует в щелочной среде с ионами Сu 2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей. Интенсивность окрашивания пропорциональна количеству пептидных групп.
Проведение анализа
В пробирку с 5 каплями 1% раствора белка вносят 3 капли 10% раствора NаОН и 1 каплю 5% раствора CuSО4.
Реакция для обнаружения a‑аминогрупп
Для обнаружения a‑аминогрупп, содержащихся в аминокислотах, и концевых a‑аминогрупп пептидов и белков используется нингидриновая реакция.
При нагревании аминокислот и пептидов с нингидрином происходят окислительное отщепление a‑аминогрупп и восстановление нингидрина. Восстановленный нингидрин реагирует с аммиаком и другой молекулой окисленного нингидрина с образованием комплекса сине-фиолетового цвета.
Проведение анализа
5 капель раствора белка смешивают с 5 каплями 0,5% раствора нингидрина. Пробирки нагревают и кипятят до появления сине-фиолетового окрашивания.
Реакция на ароматические аминокислоты
Для обнаружения ароматических аминокислот (фенилаланин, тирозин, триптофан) используется ксантопротеиновая реакция.
Ароматическое кольцо при взаимодействии с концентрированной азотной кислотой образует динитросоединение желтого цвета.
Проведение анализа
К 5 каплям 1% раствора белка добавляют 2 капли конц.HNO3 и осторожно нагревают. Наблюдают за появлением желтого окрашивания, при отсутствии желтого цвета еще добавляют 1-2 капли конц.HNO3. При добавлении избытка 30% раствора NаОН окраска переходит в оранжевую.
Реакции на серосодержащие аминокислоты
Сульфгидрильные группы в белке или пептиде подвергаются щелочному гидролизу, в результате чего происходит отщепление серы в виде сульфида натрия Na2S, который вступает в дальнейшие реакции:
o реакция Фоля – Na2S с ацетатом свинца Pb(CH3COO)2 дает черный или бурый осадок сульфида свинца;
o реакция с нитропруссидом – Na2S дает с нитропруссидом натрия соединение, окрашенное в красно-коричневый цвет.
Проведение анализа
5 капель 1% раствора белка и 5 капель 30% раствора NaOH кипятить 1‑2 минуты. Разделить содержимое на 2 части для реакций «а» и «б».
а) Реакция Фоля
К 5 каплям гидролизата добавляют 1 каплю раствора уксусно-кислого свинца и нагревают до кипения. Отмечают появление бурого или черного осадка.
б) Реакция с нитропруссидом
К 5 каплям гидролизата добавляют 2-3 капли раствора 5% натрия нитропруссида. Отмечают появление красно-коричневого окрашивания.
источник