Настоящий документ устанавливает методику измерений массовой концентрации ионов хрома общего, трех- и шестивалентного в питьевых, природных (пресных, включая воды поверхностных и подземных источников) и сточных водах фотометрическим методом с дифенилкарбазидом. Методика предназначена для измерения показателей состава питьевых, природных и сточных вод.
Диапазон измерений от 0,010 до 3,0 мг/дм 3 .
Если массовая концентрация ионов хрома в анализируемой пробе ниже минимально определяемой, то допускается концентрирование путем упаривания.
Если массовая концентрация ионов хрома в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы массовая концентрация ионов хрома соответствовала регламентированному диапазону.
Определению мешают присутствующие в высоких массовых концентрациях (свыше 200 мг/дм 3 ) ионы ртути. С дифенилкарбазидом также вступают в реакцию и окрашивают раствор ванадий и молибден (VI), присутствие этих элементов допустимо при массовых концентрациях до 200 мг/дм 3 .
Мешает определению железо (III) при содержании более 1 мг/дм 3 , образующее с дифенилкарбазидом соединение, окрашивающее анализируемый раствор в желто-бурый цвет. Влияние железа устраняется добавлением ортофосфорной кислоты, что предусматривается в ходе определения.
Марганец при большом его содержании в пробе при окислении персульфатом может выпасть в осадок в виде диоксида марганца: осадок тогда отделяют фильтрованием через пористую пластинку.
При определении хрома (VI) на результаты может повлиять то обстоятельство, что хром в виде хромата и бихромата может окислять некоторые содержащиеся в пробе вещества в интервале времени между отбором пробы и анализом. В подобных случаях хром определяют непосредственно после отбора пробы.
В водах с высоким содержанием растворенных веществ может оказывать мешающее влияние повышенное содержание кальция, который в реакции с серной кислотой в ходе определения дает помутнение, вызванное осаждением сульфата кальция. В таких случаях рекомендуется использовать вариант определения, при котором вместо серной кислоты применяют трихлоруксусную кислоту (п. 9.3).
В нейтральных или щелочных водах раздельное определение хрома (VI) и хрома (III) затруднено тем, что при подкислении таких вод, если они (как это обычно бывает) содержат восстановители — соли железа, сульфиты, многие органические вещества и т.п., происходит восстановление хрома (VI) до хрома (III).
В водах, содержащих окрашенные органические вещества, а также органические вещества, приводящие к восстановлению хрома при подкислении пробы, определить хром (VI) фотометрическим методом трудно даже тогда, когда эти воды имеют кислую реакцию, и поэтому по данной методике в мутных и окрашенных водах определяют только общее содержание хрома.
При невозможности устранения мешающих влияний при определении хрома по данной методике необходимо проводить определение хрома в соответствии с другими аттестованными методиками измерений.
Методика измерений должна обеспечивать выполнение измерений с погрешностью (неопределенностью), не превышающей норм точности измерений показателей состава и свойств вод, установленных ГОСТ 27384-2002.
Значения показателя точности измерений 1 — расширенной относительной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в приложении А.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
Диапазон измерений, мг/дм 3
Суммарная стандартная относительная неопределенность, u , %
Расширенная относительная неопределенность, U при коэффициенте охвата k = 2, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
При выполнении измерений должны быть применены следующие средства измерений, вспомогательное оборудование, материалы, реактивы.
3.1 Средства измерений, стандартные образцы
Спектрофотометр или фотоколориметр, позволяющий измерять оптическую плотность при длине волны λ = 540 нм.
Весы лабораторные неавтоматического действия, обеспечивающие в диапазоне от 1 г до 210 г измерения с относительной погрешностью не более 0,1 %. Весы должны быть поверены.
Государственные стандартные образцы (ГСО) состава раствора ионов хрома с массовой концентрацией 1 мг/см 3 . Относительная погрешность аттестованных значений массовой концентрации не более 1 % при Р = 0,95.
Колбы мерные вместимостью 50; 100; 500; 1000 см 3 по ГОСТ 1770-74, 2 класс точности.
Пипетки градуированные вместимостью 1; 2; 5 и 10 см 3 по ГОСТ 29227-91, 2 класс точности.
Пипетки с одной отметкой вместимостью 1; 2; 5; 25 и 50 см 3 по ГОСТ 29169-91, 2 класс точности.
Цилиндры мерные вместимостью 50; 100 и 250 см 3 по ГОСТ 1770-74, 2 класс точности.
Шкаф сушильный с температурным режимом (105 ± 2) °С, например, СНОЛ по ТУ 16-681.032-84.
3.2 Вспомогательное оборудование, материалы
Кюветы с толщиной поглощающего слоя 10 и 50 мм.
Баня песчаная или плитка электрическая с регулятором температуры по ГОСТ 14919-83.
Фильтры обеззоленные по ТУ 6-09-1678-95.
Бумага индикаторная универсальная (с шагом 1 ед. pH) по ТУ 6-09-1181-89.
Колбы конические плоскодонные термостойкие КН-1(2)-100 (250) по ГОСТ 25336-82.
Воронки стеклянные для фильтрования по ГОСТ 25336-82.
Фильтры Шотта по ГОСТ 25336-82 или фильтры мембранные с диаметром пор 0,40 — 0,45 мкм, например, производства фирмы Millipore или фирмы Владипор.
Холодильник бытовой любой марки, обеспечивающий хранение проб при температуре (2 — 8) °С.
Бутыли из полимерного материала или боросиликатного стекла с притертыми или винтовыми пробками вместимостью не менее 250 см 3 для отбора и хранения проб.
1 Допускается использование других средств измерений утвержденных типов, обеспечивающих измерения с установленной точностью.
2 Допускается использование другого оборудования с метрологическими и техническими характеристиками, аналогичными указанным.
3 Средства измерений должны быть поверены в установленные сроки.
Калий двухромовокислый по ГОСТ 4220-75.
Аммоний надсернокислый (персульфат аммония) по ГОСТ 20478-75.
Спирт этиловый ректификованный по ГОСТ Р 55878-2013.
Трихлоруксусная кислота по ТУ 6-09-1926-77.
1 Все реактивы, используемые для измерений, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Фотометрический метод определения массовой концентрации ионов хрома основан на реакции дифенилкарбазида в кислой среде с бихромат-ионами с образованием соединения фиолетового цвета, в котором хром содержится в восстановленной форме в виде хрома (III), а дифенилкарбазид окислен до дифенилкарбазона.
Измерение проводят при длине волны λ = 540 нм.
В одной порции пробы проводят окисление хрома (III) до хрома (VI) персульфатом и определяют суммарное содержание в пробе обеих форм хрома, в другой порции пробы окисление хрома (III) не проводят и определяют только содержание хрома (VI). По разности между полученными результатами находят содержание хрома (III).
При выполнении измерений массовой концентрации ионов хрома необходимо соблюдать следующие требования техники безопасности.
5.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами ГОСТ 12.1.007-76.
5.2 Электробезопасность при работе с электроустановками по ГОСТ Р 12.1.019-2009.
5.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
5.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
5.6 Используемую в работе посуду не допускается мыть хромовой смесью! Для обработки стеклянной посуды необходимо применять моющие средства, раствор азотной кислоты и тщательно промывать водопроводной, а затем дистиллированной водой.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического анализа, изучивший инструкции по эксплуатации спектрофотометра или фотоколориметра и получивший удовлетворительные результаты при выполнении контроля процедуры измерений.
Измерения проводятся в следующих условиях:
— температура окружающего воздуха (20 ± 5) °С;
— атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм рт. ст.);
— относительная влажность не более 80 % при t = 25 °С;
— напряжение сети (220 ± 22) В.
При подготовке к выполнению измерений должны быть проведены следующие работы: отбор и хранение проб, подготовка прибора к работе, приготовление вспомогательных и градуировочных растворов, установление и контроль стабильности градуировочной характеристики.
8.1.1 Отбор проб природных и сточных вод производится в соответствии с требованиями ГОСТ 31861-2012 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 (Издание 2015 г.) «Методические указания по отбору проб для анализа сточных вод».
Отбор проб питьевых вод производится в соответствии с требованиями ГОСТ Р 56237-2014 «Вода питьевая. Отбор проб на станциях водоподготовки и в трубопроводных распределительных системах».
При необходимости определения хрома (VI) анализ осуществляют непосредственно после отбора пробы, так как хромат или бихромат может окислять некоторые вещества, находящиеся в пробе между взятием пробы и ее исследованием. Срок хранения пробы при этом не более 6 часов после отбора пробы при обычных условиях и не более 24 часов при хранении в тёмном месте при температуре (2 — 8) °С.
8.1.2 Бутыли для отбора и хранения проб воды при необходимости обезжиривают раствором синтетического моющего средства, промывают водопроводной водой, обрабатывают раствором азотной кислоты (1:1), тщательно промывают водопроводной, затем 3 — 4 раза дистиллированной водой.
8.1.3 Пробы воды (объём не менее 250 см 3 ) отбирают в бутыли из полимерного материала или стекла, предварительно ополоснутые отбираемой водой.
8.1.4 Пробы анализируют не позже, чем через 6 часов после отбора. При определении общего содержания хрома допускается консервирование (приблизительно 5 см 3 концентрированной азотной кислоты (HNO3) на 1 дм 3 воды до достижения pH пробы не менее 2 ед. pH по универсальной индикаторной бумаге). Срок хранения законсервированной пробы составляет не более 1 месяца.
Если требуется отдельно определить хром в растворимой и нерастворимой формах, часть пробы фильтруют через фильтр с диаметром пор 0,45 мкм (до консервации), и в ней определяют растворенную форму. В этом случае, пробу необходимо отбирать только в емкости из полимерного материала, консервировать при этом следует полученный фильтрат.
8.1.5 Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной в лаборатории форме, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
8.2 Подготовка прибора к работе
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
8.3 Приготовление вспомогательных растворов
40 г NaOH растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки дистиллированной водой. Срок хранения в полиэтиленовом флаконе с плотно завинчивающейся крышкой — 6 месяцев.
27,3 см 3 серной кислоты плотностью 1,84 г/см 3 вносят небольшими порциями при перемешивании в (150 — 200) см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой. Срок хранения — 6 месяцев.
Смешивают равные объёмы серной кислоты и дистиллированной воды, осторожно приливая кислоту в воду. Срок хранения — 6 месяцев.
8.3.4 Азотная кислота, разбавленный раствор (1:1)
Смешивают равные объёмы кислоты и дистиллированной воды, приливая кислоту в воду. Срок хранения — 6 месяцев.
Растворяют 0,50 г дифенилкарбазида в 50 см 3 этилового спирта. Раствор хранят в тёмной склянке не более 7 суток. Если раствор приобретает при хранении окраску, он непригоден для использования.
10,0 г персульфата аммония растворяют в 100 см 3 дистиллированной воды. Раствор хранят не более 5 суток.
Растворяют 163,4 г трихлоруксусной кислоты приблизительно в 500 см 3 дистиллированной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки этой же водой. Срок хранения составляет не более 3 месяцев.
8.3.8 Приготовление основного градуировочного раствора из ГСО 2 с аттестованным содержанием ионов хрома
В качестве основного градуировочного раствора используется ГСО 3 (1 см 3 раствора должен содержать 1 мг хрома).
Основной градуировочный раствор готовят из ГСО и хранят в соответствии с инструкцией по применению.
2 Приготовление градуировочных растворов из бихромата калия приведено в Приложении Б.
3 Разрешается использование ГСО состава водного раствора ионов хрома другого значения при условии приготовления градуировочных растворов с указанными значениями массовой концентрации хрома.
8.3.9 Приготовление рабочего градуировочного раствора (I)
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 100 раз бидистиллированной водой. В 1 см 3 раствора содержится 0,010 мг хрома.
8.3.10 Приготовление рабочего градуировочного раствора (II)
Раствор готовят в день проведения анализа разбавлением рабочего раствора (I) в 10 раз бидистиллированной водой.
Для этого в мерную колбу вместимостью 50 см 3 пипеткой вносят 5,0 см 3 рабочего градуировочного раствора (I). Объём раствора доводят до метки бидистиллированной водой и перемешивают.
1 см 3 раствора должен содержать 0,001 мг хрома.
Рабочие градуировочные растворы готовят в день проведения анализа.
8.4 Построение градуировочных графиков
8.4.1 Градуировочный график для определения хрома (VI)
Для построения градуировочного графика необходимо приготовить образцы для градуировки с массовой концентрацией ионов хрома 0,01 — 1,0 мг/дм 3 .
Для этого в ряд мерных колб вместимостью 100 см 3 необходимо поместить аликвоту соответствующего рабочего градуировочного раствора в соответствии с таблицей 2. Далее объём разбавляют дистиллированной водой до приблизительно 80 см 3 , перемешивают и приливают 1 см 3 серной кислоты (1:1), 0,3 см 3 фосфорной кислоты, тщательно перемешивают, вносят 2 см 3 раствора дифенилкарбазида (по п. 8.3.5), доводят объём дистиллированной водой до 100 см 3 и снова перемешивают.
Полученный раствор переносят в кювету через 10 — 15 минут и фотометрируют при λ = 540 нм по отношению к холостой пробе. Холостой пробой служит нулевой раствор (номер образца 1 в таблице 2).
Холостые пробы для определения хрома общего и хрома шестивалентного приготавливаются отдельно!
Состав и количество образцов для градуировки приведены в таблице 2). Неопределенность, обусловленная процедурой приготовления, для образцов для градуировки не превышает 2,8 %.
Таблица 2 — Состав и количество образцов для градуировки
Массовая концентрация ионов хрома в градуировочных растворах, мг/дм 3
Аликвотная часть растворов (см 3 ), помещенных в мерную колбу на 100 см 3
Рабочий раствор (II) с массовой концентрацией 0,001 мг/см 3 .
График 1 (кювета 50 мм)
Рабочий раствор (I) с массовой концентрацией 0,010 мг/см 3 .
График 2 (кювета 10 мм)
8.4.2 Градуировочный график для определения хрома общего
Для построения, градуировочного графика для определения хрома общего необходимо в конические колбы вместимостью до 250 см 3 поместить аликвоты соответствующих рабочих градуировочных растворов в соответствии с таблицей 2, развести дистиллированной водой до приблизительно 80 см 3 , прилить 0,3 см 3 серной кислоты (по п. 8.3.3) и 10 см 3 раствора персульфата аммония. Полученную смесь кипятят 20 — 25 мин (весь персульфат должен разложиться, так как даже следы неразложившегося персульфата аммония мешают последующему фотометрическому определению с дифенилкарбазидом) — при этом объём упаривается приблизительно до 50 см 3 , охлажденный раствор переносят в мерную колбу вместимостью 100 см 3 и дальше продолжают анализ, как при определении хрома (VI).
Охлажденный раствор переносят в мерную колбу вместимостью 100 см 3 и дальше продолжают анализ как при определении хрома (VI), начиная со стадии добавления серной кислоты.
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочных графиков каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных. При построении градуировочных графиков по оси ординат откладывают значения оптической плотности, а по оси абсцисс — величину концентрации вещества в колориметрируемой пробе воды, мг/дм 3 .
8.4.3 Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал, а также при смене партий реактивов, после поверки или ремонта прибора. Средствами контроля являются вновь приготовленные образцы для градуировки.
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где X — результат контрольного измерения массовой концентрации ионов хрома в образце для градуировки, мг/дм 3 ;
С — аттестованное значение массовой концентрации ионов хрома, мг/дм 3 ;
uI(TOE) — стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности, %.
Если условие стабильности градуировочной характеристики не выполняется, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Отбирают такой объём предварительно профильтрованной анализируемой воды, чтобы в нем содержалось от 0,001 до 0,1 мг хрома (полученное значение массовой концентрации не должно превышать верхнюю границу диапазона градуировочной характеристики), переносят в мерную колбу вместимостью 100 см 3 . Пробу нейтрализуют раствором гидроксида натрия (по п. 8.3.1) или раствором серной кислоты (по п. 8.3.2) до рН = 4 ед. рН, контролируя значение pH по универсальной индикаторной бумаге. Затем приливают 1 см 3 серной кислоты (по п. 8.3.3), 0,3 см 3 фосфорной кислоты, перемешивают, вносят 2 см 3 раствора дифенилкарбазида (по п. 8.3.5), снова перемешивают. Далее доводят объём дистиллированной водой до 100 см 3 и через 10 — 15 мин измеряют оптическую плотность при λ = 540 нм по отношению к холостой пробе.
В случае, если окраска и мутность пробы не уничтожены в процессе фильтрования, необходимо измерить оптическую плотность данной пробы подготовленной так же, как и при анализе, но без реактива дающего окраску — без дифенилкарбазида («корректирующий раствор») и вычесть из полученной оптической плотности раствора с дифенилкарбазидом.
9.2 Определение суммарного (общего) содержания хрома (III) и (VI)
В термостойкую колбу вносят 100 см 3 первоначально неразбавленной, разбавленной или сконцентрированной пробы, содержащей в этом объёме (0,001 — 0,1) мг хрома, нейтрализуют раствором едкого натра (по п. 8.3.1) или раствором серной кислоты (по п. 8.3.3) до pH около 4 ед. рН, контролируя значение pH по универсальной индикаторной бумаге. Затем прибавляют 0,3 см 3 раствора серной кислоты (по п. 8.3.3) и 10 см 3 раствора персульфата аммония (по п. 8.3.6) и кипятят 20 — 25 мин для окисления Cr 3+ до Cr 6+ .
Если выпал осадок диоксида марганца (в процессе окисления персульфатом в случае присутствия больших количеств марганца), его отфильтровывают через фильтр Шотта или стеклянную фильтрующую пластинку.
Раствор выпаривают примерно до 50 см 3 , охлаждают, переносят в мерную колбу вместимостью 100 см 3 , и дальше продолжают анализ, как при определении хрома (VI), начиная со стадии добавления серной кислоты: приливают 1 см 3 серной кислоты (по п. 8.3.3), 0,3 см 3 фосфорной кислоты, перемешивают, вносят 2 см 3 раствора дифенилкарбазида (по п. 8.3.5), снова перемешивают и доводят объём дистиллированной водой до 100 см 3 — через 10 — 15 мин измеряют оптическую плотность при λ = 540 нм по отношению к холостой пробе.
Определив суммарное содержание обеих форм хрома и содержание хрома (VI) по формуле 2, по разности находят содержание хрома (III).
Отбирают такой объём, предварительно профильтрованной, анализируемой воды (pH = 7,0), чтобы в нем содержалось от 0,001 до 0,1 мг хрома (VI), переносят в мерную колбу вместимостью 100 см 3 , добавляют 2 см 3 раствора трихлоруксусной кислоты (по п. 8.3.7) и 1 см 3 раствора дифенилкарбазида (по п. 8.3.5). Объём доводят дистиллированной водой до 100 см 3 , хорошо перемешивают и через 15 мин измеряют оптическую плотность.
10.1 Массовую концентрацию ионов хрома X (мг/дм 3 ) рассчитывают по формуле
где С — массовая концентрация хрома, найденная по градуировочному графику, мг/дм 3 ;
100 — объём, до которого была разбавлена проба, см 3 ;
V — объём, взятый для анализа, см 3 .
10.2 За результат измерений принимают единичное значение или в случае анализа нестандартных проб сточной воды (со сложной матрицей, существенным превышением значения ПДК и т.д) Хср — среднее арифметическое значение двух параллельных определений Х1 и Х2:
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
Диапазон измерений, мг/дм 3
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (4) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно разделу 5 ГОСТ Р ИСО 5725-6-2002.
Результат измерений в документах, предусматривающих его использование, может быть представлен в виде:
где X, Хср — результат измерений массовой концентрации, установленный по п. 10, мг/дм 3 ;
U — значение показателя точности измерений (расширенная неопределенность измерений с коэффициентом охвата 2).
Значение U приведено в таблице 1.
Допускается результат измерений в документах, выдаваемых лабораторией, представлять в виде:
При представлении результата измерений в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерений;
— способ определения результата измерений (среднее арифметическое значение или медиана результатов параллельных определений).
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры измерений;
— контроль стабильности результатов измерений на основе контроля стабильности среднего квадратического отклонения (СКО) повторяемости, СКО промежуточной (внутрилабораторной) прецизионности и правильности.
Периодичность контроля исполнителем процедуры выполнения измерений и алгоритмы контрольных процедур, а также реализуемые процедуры контроля стабильности результатов измерений регламентируют во внутренних документах лаборатории.
Ответственность за организацию проведения контроля стабильности результатов анализа возлагают на лицо, ответственное за систему менеджмента качества в лаборатории.
Разрешение противоречий между результатами двух лабораторий проводят в соответствии с 5.3.3 ГОСТ Р ИСО 5725-6-2002.
12.2 Оперативный контроль процедуры измерений с использованием метода добавок
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Кк с нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
где Хʹср — результат анализа массовой концентрации ионов хрома в пробе с известной добавкой — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4), мг/дм 3 .
Хср — результат анализа массовой концентрации ионов хрома в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4), мг/дм 3 .
Сд — величина добавки, мг/дм 3 .
Норматив контроля К рассчитывают по формуле:
где 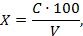
Процедуру измерений признают удовлетворительной при выполнении условия:
При невыполнении условия (7) контрольную процедуру повторяют. При повторном невыполнении условия (7) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
12.3 Оперативный контроль процедуры измерений с использованием образцов для контроля
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Ккс нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
где Сср — результат анализа массовой концентрации ионов хрома в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4), мг/дм 3 ;
С — аттестованное значение образца для контроля, мг/дм 3 .
Норматив контроля К рассчитывают по формуле
где σI(TOE) — стандартное отклонение промежуточной прецизионности, соответствующие массовой концентрации ионов хрома в образце для контроля, мг/дм 3 .
Процедуру анализа признают удовлетворительной при выполнении условия:
При невыполнении условия (10) контрольную процедуру повторяют. При повторном невыполнении условия (10) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Диапазон измерений, мг/дм 3
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно разделу 5 ГОСТ Р ИСО 5725-6-2002.
Таблица А.1 — Бюджет неопределенности измерений
Стандартная относительная неопределенность, %
Приготовление градуировочных растворов, uI , %
Степень чистоты реактивов и дистиллированной воды, u 2 , %
Подготовка проб к анализу, u 3 , %
Стандартное отклонение результатов измерений, полученных в условиях повторяемости 4 , ur (σ r ), %
Стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности 5 , uI(TOE) σI(TOE) , %
Стандартное отклонение результатов измерений, полученных в условиях воспроизводимости, uR ( σR ), %
Суммарная стандартная относительная неопределенность, uR , %
Расширенная относительная неопределенность, ( U отн. ) при k = 2, %
1 Оценка (неопределенности) типа А получена путем статистического анализа ряда наблюдений.
2 Оценка (неопределенности) типа В получена способами, отличными от статистического анализа ряда наблюдений
4 Согласно ГОСТ Р ИСО 5725-3-2002 учтено при расчете стандартного отклонения результатов измерений, получаемых в условиях воспроизводимости.
5 Согласно ГОСТ Р ИСО 5725-3-2002 учтено при расчете стандартного отклонения результатов измерений, получаемых в условиях воспроизводимости.
Б.1 Приготовление основного градуировочного раствора
Растворяют (2,828 ± 0,001) г бихромата калия, высушенного в течение 2 часов при (105 ± 2) °С, и доводят до метки бидистиллированной водой в мерной колбе вместимостью 1 дм 3 .
1 см 3 раствора содержит 1,0 мг хрома.
Срок хранения раствора — 2 месяца при температуре (2 — 8) °С.
Б.2 Приготовление рабочих градуировочных растворов
Рабочий градуировочный раствор (I) с массовой концентрацией ионов хрома 0,010 мг/дм 3 и рабочий градуировочный раствор (II) с массовой концентрацией ионов хрома 0,001 мг/дм 3 готовят соответствующим разведением основного градуировочного раствора в мерных колбах бидистиллированной водой.
Растворы готовят в день проведения анализа.
источник
ПНД Ф 14.1;2.52-96 Количественный химический анализ вод. Методика выполнения измерений массовой концентрации ионов хрома в природных и сточных водах
МИНИСТЕРСТВО ОХРАНЫ ОКРУЖАЮЩЕЙ СРЕДЫ ПРИРОДНЫХ РЕСУРСОВ РОССИЙСКОЙ ФЕДЕРАЦИИ
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
МАССОВОЙ КОНЦЕНТРАЦИИ
ИОНОВ ХРОМА В ПРИРОДНЫХ И СТОЧНЫХ ВОДАХ
ФОТОМЕТРИЧЕСКИМ МЕТОДОМ С ДИФЕНИЛКАРБАЗИДОМ
Методика допущена для целей государственного экологического контроля
Методика рассмотрена и одобрена Главным управлением аналитического контроля и метрологического обеспечения природоохранной деятельности (ГУАК) и Главным метрологом Минприроды РФ.
В соответствии с требованиями ГОСТ Р ИСО 5725-1-2002 ? ГОСТ Р ИСО 5725-6-2002 и на основании свидетельства о метрологической аттестации № 224.01.03.026/2004 в МВИ внесены изменения (Протокол № 1 заседания НТС ФГУ «ФЦАМ» МПР России от 03.03.2004).
Настоящий документ устанавливает методику количественного химического анализа проб природных и сточных вод для определения в них ионов хрома общего, трех- и шестивалентного при массовой концентрации от 0,01 до 1,0 мг/дм 3 .
Если массовая концентрация ионов хрома в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы концентрация ионов хрома соответствовала регламентированному диапазону.
Если массовая концентрация ионов хрома в анализируемой пробе ниже минимально определяемой, то допускается концентрирование.
Определению мешают присутствующие в высоких концентрациях (свыше 200 мг/дм 3 ) Hg ++ и Нg2 ++ — ионы. С дифенилкарбазидом вступают в реакцию и окрашивают раствор также ванадий и молибден (+6) , оба эти элемента допустимы в концентрациях до 200 мг/дм 3 .
Мешает определению также железо (1 мг/дм 3 ), образующее с этим реактивом соединение, окрашивающее анализируемый раствор в желтобурый цвет. Влияние железа можно частично устранить добавлением фосфорной кислоты, что предусматривается в ходе определения (см. п. 9.1).
Марганец при большом его содержании в пробе при окислении персульфатом может выпасть в осадок в виде гидрата диоксида марганца: осадок тогда отделяют фильтрованием через пористую пластинку или через стеклянную вату (см. п. 9.2).
При определении хрома (+6) на результаты может повлиять то обстоятельство, что хромат и бихромат могут окислять некоторые содержащиеся в пробе вещества в интервале времени между отбором пробы и анализом. В подобных случаях хром определяют непосредственно после отбора пробы.
В водах с высоким содержанием растворенных веществ могут оказывать мешающее влияние повышенные концентрации кальция, которые при использовании серной кислоты в ходе определения дают помутнение, вызванное выделением сульфатов. В таких случаях рекомендуется применять вариант определения, при котором вместо серной кислоты применяют трихлоруксусную кислоту (см. п. 9.3).
В нейтральных или водах раздельное определение хрома (+6) и хрома (+3) затруднено тем, что при подкислении таких вод, если они (как это обычно бывает) содержат восстановители — соли железа, сульфиты, многие органические вещества и т.п., происходит восстановление хрома (+6) до хрома (+3) .
В водах, окрашенных органическими веществами, определить хром (+6) фотометрическим методом трудно даже тогда, когда эти воды имеют кислую реакцию, и поэтому определяют только общее содержание хрома (см. п. 9.2).
Фотометрический метод определения массовой концентрации ионов хрома основан на реакции дифенилкарбазида в кислой среде с бихромат-ионами с образованием соединения фиолетового цвета, в котором хром содержится в восстановленной форме в виде хрома (+3) , а дифенилкарбазид окислен до дифенилкарбазона.
Измерение проводят при длине волны ? = 540 нм.
В одной порции пробы проводят окисление хрома (+3) до хрома (+6) персульфатом и определяют суммарное содержание в пробе обеих форм хрома, в другой порции пробы окисление хрома (+3) не проводят и определяют только содержание хрома (+6) . По разности между полученными результатами находят содержание хрома (+3) .
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Значения показателей точности, повторяемости и воспроизводимости методики
Диапазон измерений, мг/дм 3
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± ?, %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), ?r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), ?R, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
3.1. Средства измерений, оборудование и материалы
Спектрофотометр или фотоколориметр, позволяющий измерять оптическую плотность при длине волны ? = 540 нм.
Кюветы с толщиной поглощающего слоя 10 и 50 мм.
Весы лабораторные, 2 класса точности, ГОСТ 24104.
Стандартный образец с аттестованным содержанием ионов хрома.
Фильтры обеззоленные, ТУ 6-09-1678.
Бумага индикаторная, универсальная, ТУ-6-09-1181.
Колбы мерные, наливные 2-50-2;
Колбы конические КН-2-100-34, ГОСТ 25336.
Воронки стеклянные для фильтрования ГОСТ 25336.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб и реактивов.
Калий двухромовокислый, ГОСТ 4220.
Аммоний надсернокислый, ГОСТ 20478.
Спирт этиловый, ГОСТ 18300.
Натрия гидроокись, ГОСТ 4328.
Дифенилкарбазид, ГОСТ 5859.
Фосфорная кислота, ГОСТ 6552.
Азотная кислота, ГОСТ 4461.
Трихлоруксусная кислота, ТУ 6-09-1926-77.
Вода дистиллированная, ГОСТ 6709.
Все реактивы должны быть квалификации х.ч. или ч.д.а.
4.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами ГОСТ 12.1.007.
4.2. Электробезопасность при работе с электроустановками по ГОСТ 12.1.019.
4.3. Организация обучения работающих безопасности труда по ГОСТ 12.0.004.
4.4. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического и спектрофотометрического анализов, изучивший инструкцию по работе с соответствующими приборами.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм рт.ст);
относительная влажность (80 ± 5) %;
напряжение сети (220 ± 10) В;
частота переменного тока (50 ± 1) Гц.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
7.1. Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, обрабатывают раствором азотной кислоты (1:1), тщательно промывают водопроводной, затем 3 — 4 раза дистиллированной водой.
7.2. Пробы воды (объем не менее 500 см 3 ) отбирают в стеклянные или полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
7.3. Пробы анализируют не позже, чем через 2 часа после отбора; при определении общего содержания хрома допускается консервирование (5 см 3 концентрированной HNО3 на 1 дм 3 воды) — срок хранения пробы в течение месяца.
7.4. Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
8.1. Подготовка прибора к работе
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора. Прибор должен быть поверен.
8.2. Приготовление вспомогательных растворов
8.2.1. Гидроокись натрия, водный раствор.
40 г NaOH растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 1 дм и доводят до метки дистиллированной водой. Хранят под защитой от контакта с воздухом.
27,3 см 3 серной кислоты пл. 1,84 г/см 3 вносят небольшими порциями при перемешивании в 150 — 200 см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой.
Смешивают равные объемы серной кислоты и дистиллированной воды, осторожно приливая кислоту в воду.
8.2.4. Фосфорная кислота, концентрированная, 85 %-ная.
Смешивают равные объемы кислоты и дистиллированной воды, приливая кислоту в воду.
8.2.6. Дифенилкарбазид, 1,0 %-ный спиртовой раствор.
Растворяют 0,50 г дифенилкарбазида в 50 см 3 этилового спирта. Раствор хранят в темной склянке. Если раствор приобретает при хранении окраску, он непригоден для использования.
0,1 г персульфата аммония растворяют в 100 см 3 дистиллированной воды. Раствор применяют свежеприготовленным.
Растворяют 163,4 г трихлоруксусной кислоты
в 500 см 3 дистиллированной воды, переносят в мерную колбу на 1 дм 3 и доводят до метки этой же водой.
8.2.9. Приготовление основного градуировочного раствора из ГСО с аттестованным содержанием.
Раствор готовят в соответствии с прилагаемой к образцу инструкцией.
1 см 3 раствора должен содержать 1 мг хрома. Срок хранения — один месяц.
8.2.10. Приготовление рабочего градуировочного раствора (I).
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 100 раз бидистиллированной водой. В 1 см 3 раствора содержится 0,010 мг хрома.
8.2.11. Приготовление рабочего градуировочного раствора (II).
Раствор готовят в день проведения анализа разбавлением рабочего раствора (I) в 10 раз бидистиллированной водой.
1 см 3 раствора должен содержать 0,001 мг хрома.
Для приготовления реактивов и разбавления пробы используют бидистиллированную воду, полученную в стеклянном приборе.
8.3. Построение градуировочного графика
Для построения градуировочного графика необходимо приготовить образцы для градуировки с концентрациями ионов хрома примерно 0,01 — 1,0 мг/дм 3 . Условия анализа, его проведение должны соответствовать описанным в пунктах 6 и 9.1 или п. 9.3 (если предполагается работать с высоким содержанием кальция в пробах).
Состав и количество образцов дня построения градуировочных графиков приведены в таблице 2. Погрешность, обусловленная процедурой приготовления, для образцов для градуировки не превышает 2,8 %.
Состав и количество образцов для градуировки при анализе хрома
Массовая концентрация ионов хрома в градуировочных растворах, мг/дм 3
Аликвотная часть растворов, помещенных в мерную колбу на 100 см 3
Рабочий раствор (II) с концентрацией 0,001 мг/см 3 . График 1 (кювета 50 мм)
Рабочий раствор (I) с концентрацией 0,010 мг/см 3 . График 2 (кювета 10 мм)
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных.
Строят градуировочньй график в координатах оптическая плотность — концентрация в мг/дм 3 .
8.4. Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал или при смене партии реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в таблице 2).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия.
где X — результат контрольного измерения массовой концентрации хрома в образце для градуировки;
С — аттестованное значение массовой концентрации хрома в образце для градуировки;
— среднеквадратическое отклонение внутрилабораторной прецизионности, установленное при реализации методики в лаборатории.
Примечание. Допустимо среднеквадратическое отклонение внутри-лабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Значения ?R приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
9.1. Определение хрома шестивалентного (Сr +6 )
Отбирают такой объем предварительно профильтрованной, анализируемой воды, чтобы в нем содержалось от 0,001 до 0,1 мг хрома (+6) , переносят в мерную колбу вместимостью 100 см 3 . Пробу нейтрализуют раствором едкого натра (по п. 8.2.1) или раствором серной кислоты (по п. 8.2.2.). Необходимое количество щелочи или кислоты устанавливают титрованием отдельной порции пробы. Затем приливают 1 см 3 серной кислоты (по п. 8.2.3), 0,3 см 3 фосфорной кислоты (по п. 8.2.4) и доводят объем дистиллированной водой до 100 см 3 , перемешивают и вносят 2 см 3 раствора дифенилкарбазида (по п. 8.2.6), снова перемешивают и через 10 — 15 мин измеряют оптическую плотность.
Из полученной величины вычитают оптическую плотность холостого определения и по графику находят содержание хрома.
9.2. Определение суммарного содержания хрома (Сr +6 и Сr +3 )
100 см 3 первоначально неразбавленной, разбавленной или сконцентрированной пробы, содержащей в этом объеме 0,001 — 0,1 мг хрома, нейтрализуют раствором едкого натра (по п. 8.2.1) или раствором серной кислоты (по п. 8.2.2). Необходимое количество щелочи и кислоты определяют титрованием другой порции пробы. Затем прибавляют 0,3 см 3 раствора серной кислоты (по п. 8.2.2) и 5 — 10 см 3 раствора персульфата аммония (по п. 8.2.7) и кипятят 20 — 25 мин (весь персульфат должен разложиться, так как даже следы неразложившегося персульфата аммония мешают последующему фотометрическому определению с дифенилкарбазидом).
Если выпал осадок диоксида марганца, его отфильтровывают через стеклянную фильтрующую пластинку или через стекловату. Раствор выпаривают примерно до 50 см 3 , охлаждают, переносят в мерную колбу вместимостью 100 см 3 , разбавляют до метки дистиллированной водой и дальше продолжают анализ, как при определении хрома (+6) .
Определив суммарное содержание обеих форм хрома и содержание хрома шестивалентного, по разности находят содержание хрома (+3) .
9.3. Определение содержания хрома (+6) при высоком содержании кальция
Отбирают такой объем, предварительно профильтрованной, анализируемой воды (рН
7,0), чтобы в нем содержалось от 0,001 до 0,1 мг хрома (+6) , переносят в мерную колбу вместимостью 100 см 3 , добавляют 2 см 3 раствора трихлоруксусной кислоты (по п. 8.2.8) и 1 см 3 раствора дифенилкарбазида (по п. 8.2.6).
Объем доводят дистиллированной водой до 100 см 3 , хорошо перемешивают и через 15 мин измеряют оптическую плотность.
Содержание ионов хрома X (мг/дм 3 ) рассчитывают по формуле
где С — концентрация хрома, найденная по гравировочному графику, мг/дм 3 ;
100 — объем, до которого была разбавлена проба, см 3 ;
V — объем, взятый для анализа, см 3 .
За результат анализа Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
для которых выполняется следующее условие:
(1)
где r — предел повторяемости, значения которого приведены в таблице 3.
Значения предела повторяемости при вероятности P = 0,95
Диапазон измерений, мг/дм 3
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (1) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Значения предела воспроизводимости при вероятности P = 0,95
Диапазон измерений, мг/дм 3
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ РИСО 5725-6.
11.1. Результат анализа Xср в документах, предусматривающих его использование, может быть представлен в виде: Хср ± ?, Р = 0,95,
где ? — показатель точности методики.
Значение ? рассчитывают по формуле: ? = 0,01 ? ? ? Хср. Значение 8 приведено в таблице 1.
Допустимо результат анализа в документах, выдаваемых лабораторией, представлять в виде: Хср ± ?л, Р = 0,95, при условии ?л
источник
Качество питьевой воды и, в частности, содержание в ней хрома проверяют санитарно-эпидемиологические станции и лаборатории водопроводов. Пробы воды отбирают на водозаборных сооружениях и в водоеме. Наиболее чувствительным реактивом при анализах воды на содержание хрома, как и при исследовании воздуха, является реактив дифенилкарбазид, применяемый при колориметрических исследованиях.
Колориметрический метод анализа воды на содержание хрома с реактивом дифенилкарбазидом описан Ф. И. Гинзбург. Этот анализ производится но тому же принципу, что и исследование хрома в воздухе, когда определяется содержание этого элемента в водном растворе.
1. Стандартный раствор бихромата калия. Берут навеску 2,8284 г бихромата калия и растворяют в 1 л дистиллированной воды из расчета содержания 1 мг хрома в 1 мл раствора. Затем к 1 мл этого раствора добавляют до 100 мл дистиллированной воды и получают раствор, 1 мл которого содержит 0,01 мг хрома.
2. Двунормальный раствор серной кислоты. Отвешивают 9,8 г крепкой серной кислоты с удельным весом 1,84 и растворяют ее в 100 мл дистиллированной воды.
3. 0,1% спиртовой раствор дифенилкарбазида.
4. Пробирки для колориметрирования с плоским дном емкостью до 20 мл, с меткой н а 10 мл. Пробирки должны быть из бесцветного стекла, одинакового диаметра.
В пробирку, предназначенную для колориметрпрования, наливают 10 мл исследуемой воды, а в несколько других пробирок — стандартные растворы бихромата калия раз-пых концентраций, примерно таких, какие возможны в исследуемой пробе, например 0,1 мг, 0,2 мг, 0,3 мг и т. д. Количество стандартного раствора бихромата калия должно быть таким же, как и в пробах, т. е. 10 мл (до метки).
Содержимое всех пробирок подкисляют, добавляя в каждую по 0,25 мл 2 н. серной кислоты, перемешивают стеклянной палочкой и добавляют к каждой пробе по 0,2 мл раствора дифенилкарбазида. После этого стеклянной палочкой вновь перемешивают содержимое пробирок.
Присутствие хрома в пробе обнаруживают по появляющемуся окрашиванию, интенсивность которого сравнивают со стандартными растворами путем колориметрирования.
Если в пробе воды предполагается содержание хрома-тов, то стандартный раствор готовят из них, а не из бихроматов. В этом случае берут навеску хромата калия 0,374 г, растворяют ее в 1 л дистиллированной воды, затем разводят в 100 раз и получают раствор, 1 мл которого содержит 0,001 мг хрома.
При работе с реактивом дифенилкарбазидом нужно учитывать его небольшую стабильность. Хранить раствор реактива следует в холодильнике при температуре 10° в течение не более 2 недель. За этот период допускается появление в нем лишь слегка красноватого оттенка.
Ф. И. Гинзбург рекомендует колориметрировать пробы с хромом не ранее 20 минут после добавления реактива, М. Е. Логинов и М. В. Алексеева с соавторами — через 30 минут.
Чувствительность этой реакции, по данным Ф. И. Гинзбург, М. В. Алексеевой и соавторов, 0,1 мг хрома на 1 л воды, по мнению Мулена и М. Е. Логинова — 0,02 мг хромового ангидрида на 1 л воды, а в переводе на хром — 0,01 мг/л. По нашему мнепию, при колориметриро-вании хром нужно определять через 20 минут и чувствительность этого метода составляет 0,01 мг хрома на 1 л воды.
Приводится пример расчета результатов анализа. Для исследования взято 10 мл пробы. Интенсивность окраски пробы оказалась такой же, как и в стандартном растворе, 10 мл которого содержат 0,002 мг хрома. Следовательно, в 1 л воды концентрация хрома будет в 100 раз больше, т. е. 0,2 мг.
источник
Анализ воды на хром III-х валентный; хром VI-ти валентный; хром общий основан на фотометрическом методе [2]
Фотометрический метод — это метод анализа, основанный на переведении определяемого компонента в поглощающее свет соединение с последующим определением количества этого компонента путём измерения светопоглощения раствора полученного соединения.
По окраске растворов окрашенных веществ можно определять концентрацию того или иного компонента или визуально, или при помощи фотоэлементов — приборов, превращающих световую энергию в электрическую. В соответствии с этим различают фотометрический визуальный метод анализа, называемый часто колориметрическим, и метод анализа с применением фотоэлементов — собственно фотометрический метод анализа. Фотометрический метод является объективным методом, поскольку результаты его не зависят от способностей наблюдателя.
Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20 -30% определяемого компонента, так и для определения микропримесей в этих объектах при содержании их до 10 -3 — 10 -4% . Комбинирование фотометрических методов с некоторыми методами разделения — хромотографическим, экстракционным позволяет на 1-2 порядка повысить чувствительность определения, доведя его до 10 -5.
В некоторых случаях фотометрический метод может быть применён для одновременного определения в растворе в растворе нескольких ионов, хотя его возможности ограничены.
Градуировочные растворы готовят из ГСО (Государственный стандартный образец) с массовой концентрацией хрома 1,00 мг/смі. Вскрывают ампулу и ее содержимое переносят в сухую чистую пробирку. Для приготовления градуировочного раствора №1 отбирают 5,0 смі образца с помощью чистой сухой пипетки с одной отметкой вместимостью 5 смі и переносят в мерную колбу вместимостью 50 смі. Доводят объем в колбе до метки бидистиллированной водой и перемешивают. Массовая концентрация хрома в градуировочном растворе №1 составит 100 мг/дмі (если концентрация хрома в ГСО не равна точно 1,00 мг/смі, рассчитывают массовую концентрацию хрома в градуировочном растворе №1 в соответствии с концентрацией конкретного образца). Раствор хранят в плотно закрытой склянке из темного стекла в холодильнике 1 мес. Для приготовления градуировочного раствора №2 пипеткой с одной отметкой вместимостью 5 смі отбирают 5,0 смі градуировочного раствора №1, помещают его в мерную колбу вместимостью 100 смі и доводят до метки бидистиллированной водой. Массовая концентрация хрома в градуировочном растворе №2 составит 5,00 мг/дмі. Раствор используют в день приготовления. Для приготовления градуировочного раствора №3 градуированной пипеткой вместимостью 1 смі отбирают 1,0 смі раствора №1, помещают его в мерную колбу вместимостью 100 смі и доводят до метки бидистиллированной водой. Массовая концентрация хрома в градуировочном растворе №3 составит 1,00 мг/дмі. Раствор используют в день приготовления.
Для установления градуировочной зависимости при выполнении измерений хрома в водном растворе в мерные колбы вместимостью 100 смі градуированными пипетками вместимостью 1 и 5 смі вносят 0; 0,5; 1,0; 1,5; 2,0; 2,5; 3,0 смі градуировочного раствора №2 с массовой концентрацией хрома 5,00 мг/дмі, доводят объем растворов до меток бидистиллированной водой и тщательно перемешивают. Массовые концентрации хрома в полученных градуировочных образцах равны, соответственно, 0; 25; 50; 75; 100; 125; 150 мкг/дмі. Из каждой колбы цилиндром вместимостью 100 смі отбирают 80 смі раствора, переносят его в сухие конические или плоскодонные колбы вместимостью 250 смі. Выполняют определение хрома согласно 11.1, измеряя оптическую плотность водного раствора. Одновременно выполняют холостой опыт, используя 80 смі бидистиллированной воды. Оптическую плотность холостого опыта вычитают из оптической плотности градуировочных образцов. Градуировочные зависимости оптической плотности от массовой концентрации хрома в градуировочных образцах рассчитывают методом наименьших квадратов. Градуировочные зависимости устанавливают при использовании новой партии 1,5 — дифенилкарбазида, либо при замене измерительного прибора, но не реже одного раза в год.
При превышении ПДК соединений хрома в поверхностных водоемах, предприятие, совершившее выброс хрома, облагается платой за сверхлимитное загрязнение окружающей природной среды, она определяется путем умножения соответствующих дифференцированных ставок платы за загрязнение в пределах установленных лимитов на величину превышения фактической массы выбросов, сбросов загрязняющих веществ, объемов размещения отходов над установленными лимитами, суммирования полученных произведений по видам загрязнения и умножения этих сумм на пятикратный повышающий коэффициент.
В случае отсутствия у природопользователя оформленного в установленном порядке разрешения на выброс, сброс загрязняющих веществ, размещение отходов вся масса загрязняющих веществ учитывается как сверхлимитная.
источник
Физические и химические свойства воды. Особенность ионов хрома. Теоретические основы фотоэлектроколориметрического метода анализа. Приготовление приборов, реактивов, материалов и посуды. Отбор проб анализируемых водных ресурсов и подготовка их к синтезу.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Мониторинг загрязнения окружающей среды
ТЕМА Определение хрома по реке Москве в природном заказчике «Воробьёвы горы»
1.1 Характеристика реки Москва
1.2 Характеристика ионов хрома
1.3 Отбор проб анализируемого объекта
1.4 Физические и химические свойства воды
1.5 Теоретические основы фотоэлектроколориметрического метода анализа
2. Экспериментальная часть
2.1 Приборы, реактивы, материалы и посуда
2.2 Приготовление растворов
2.3 Отбор проб и подготовка их к анализу
2.4 Схема и принцип действия прибора
2.5 Графики, расчёты,таблицы
3. Безопасность жизнедеятельности
3.1 Требования безопасности перед началом работы
Цель данной курсовой работы заключается в определении содержания ионов хрома на Москва-реке ГПУ г.Москвы «Природный заказника «Воробъёвы горы»».
Для достижения поставленной цели необходимо решить следующие задачи:
— подбор метода анализа (зависимости от исследуемого вещества в воде)
— проведение анализа воды в химической лаборатории на содержание хрома
Экологическое обоснование хозяйственной и иной деятельности осуществляется для оценки экологической опасности намечаемых мероприятий, своевременного учета экологических, социальных и экономических последствий воздействия планируемых объектов на окружающую среду. Экологическое обоснование осуществляется в соответствии с «Инструкцией по экологическому обоснованию хозяйственной и иной деятельности», утвержденной приказом МПР России №539 от 29 декабря 1995 года.[1]
Хром относится к тяжёлым металлам и поступает в объекты окружающей среды и поступает в объекты окружающей среды в виде (). В поверхностные воды соединения трёх- и шестизарядного хрома попадают в результате выщелачивания из пород (хромит, крокоит, уваровит и др. ). Некоторые количества поступают из почв, в процессе разложения организмов и растений. Значительные количества могут поступать в водоёмы со сточными водами гальванических цехов, красильных цехов текстильных предприятий, кожевенных заводов и предприятий химической промышленности. Понижение концентраций ионов хрома может наблюдаться в результате потребления их водными организмами и процессов адсорбции.[2]
Практическое значение и актуальность курсовой работы:
При повышенном содержание и, они обладают канцерогенными свойствами. Соединения являются наиболее опасными Содержание нитритов является важным санитарным показателем. ПДК нитритов в воде согласно СанПиН 2.1.4.1074-01 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 0,05 мг/л. [3]
1.1 Характеристика реки Москва
Москва-река — левый приток Оки, ее длина достигает 502 километра, площадь бассейна 17600 квадратных километров. Ее ширина в верховьях (близи Оки) колеблется от двух до десяти метров, в пределах Москвы и ниже составляет примерно 100 метров, а глубина не превышает шести метров. В Москву-реку впадают 92 притока, а сами они питаются огромным количеством рек, речек, ручьев, ключей; к бассейну Москвы-реки примыкают 362 реки и около 550 ручьев.
На расстоянии в полкилометра от истока бочагов, окруженных зарослями осоки, становится меньше, появляется русло, река струится, журча, по крупным валунам и несет свои потоки через леса, холмы и болота, обретая полноту и силу.
У деревни Марфин Брод в четырех километрах к северо-западу от Можайска, где была построена плотина, образовалось Можайское водохранилище (1960-1962). Его площадь составила 31 квадратный километр, длина 47 километров, наибольшая ширина — 3,5 километров. На участке от Можайска до Звенигорода долина Москвы-реки прорезает толщи известняков. Она менее извилиста здесь, повороты ее часто круты.
Ниже в Москву-реку впадает самый длинный ее приток — Руза, которая в свою очередь принимает около 30 речек, ручьев и ручейков. Ниже Звенигорода дно Москвы-реки становится более вязким, почвы глинистыми, склоны долины положе, повороты менее круты.
На подмываемых рекой высоких берегах часто проходят оползни. Участки суши сползают вниз вместе с травой и кустами. На оползших склонах деревья стоят косо, как бы зависая над рекой, образуя так называемый «пьяный лес». На этом участке самым крупным притоком, впадающим в Москву-реку, является живописная река Истра. Ее верховье в 1934 году было перегорожено плотиной. Истренское водохранилище — одно из самых крупных на территории Московской области. Его площадь равна 3,8 квадратных километра, длина — 24 километра, а глубина достигает 23-х метров. Оно питает реку, насыщает ее водой.
В пределы города Москва-река вступает на северо-западе, в районе Строгино, на расстоянии 320 километров от устья и покидает город на юго-востоке, пересекая МКАД у Бесединского моста. Долина реки хорошо разработана и, кроме поймы, имеет три надпойменные террасы. Большая извилистость реки (четыре большие, частично врезанные излучины у Серебряного бора, у Фили — Кунцевского лесопарка, в районе Краснопресненской и Лужнецкой набережных) не только увеличивает ее протяженность, но и создает особую живописность ее долины. Контрасты высокого подмытого левобережья и низменного правобережья Замоскворечья, а также Кремль, возвышающийся на Боровицком холме, придают городу запоминающийся облик.
В черте города Москвы река принимает около 70 притоков. Большинство рек Москвы теперь заключены в трубы или засыпаны, и только Яуза, преобразованная и обрамленная каменными набережными, пересекает город. Ниже столицы долина Москвы-реки извилиста. В 1937 году многие излучины были выпрямлены, и водный путь намного сократился.
1.2 Характеристика ионов хрома
Соединения хрома являются тяжёлыми металлами, в поверхностные воды попадают при выщелачивании из пород, некоторые количества поступают из почв в процессе разложения организмов и растений. А также могут поступать в водоёмы со сточными водами гальванических цехов, красильных цехов текстильных предприятий, кожевенных заводов и предприятий химической промышленности. Понижение концентраций ионов хрома может наблюдаться в результате потребления их водными организмами и процессов адсорбции.
Анализ воды на соединения хрома которые находится в растворённом и взвешенных состояниях проводятся для поверхностных вод, соотношение между которыми зависят от состава вод, температуры, pH среды.
В речных незагрезнённых и слабозагрезнённых водах содержание хрома колеблется от нескольких десятых долей микрограмма до нескольких микрограммов в 1 л., в загрезнённых водоёмах оно достигает несколько десятков и сотен микрограммов в 1 л.
При повышенном содержание и, они обладают канцерогенными свойствами. Соединения являются наиболее опасными.
Предельно-допустимая концентрация(ПДК) соединий хрома хозяйственно-питьевого и культурно-бытового назначения составляет: мг/л, мг/л. Вводе водоёмов рыбохозяйственного назначения: мг/л, мг/л. [2]
Физические и химические свойства хрома
Физические свойства хрома
Давление паров (в мм.рт.ст.): 0,001 (1240°C)
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).[5]
Химические свойства хрома Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами. Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3 + 2NaOH > 2NaCrO2 + H2O.
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
Cr2O3 + 6HCl > 2CrCl3 + 3Н2О.
При термическом разложении карбонила хрома Cr(СО)6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OH)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II).
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO3.
Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2K2CrO4 + 2H2SO4 > K2Cr2O7 + 2K2SO4 + Н2О.
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат калия K2CrO4:
K2Cr2O7 + 2KOH > 2K2CrO4 + Н2О.
При этом до высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2 и тригалогениды CrF3, CrCl3, CrBr3 и CrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3?.
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na3[Cr(OH)6] + 3H2O2 > 2Na2CrO4 + 2NaOH + 8H2O.
При добавлении к жёлтому раствору, содержащему хромат-ионы, раствора соли бария выпадает жёлтый осадок хромата бария BaCrO4:
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7 + 14HCl > 2CrCl3 + 2KCl + 3Cl2^ + 7H2O[6]
1.3 Отбор проб анализируемого объекта
Отбор проб воды является очень существенным этапом в экоаналитическом контроле. Ошибки, возникающие при отборе проб, как правило, исправить не удается. Поэтому достоверность и точность последующего анализа в значительной степени зависят от правильности проведения отбора проб.
Правильно отобрать пробу, значит получить пробу представительную, репрезентативную. Представительная проба статистически правильно отражает состояние объекта анализа и его качественный и количественный состав в настоящее время в данном месте, содержит достаточное количество вещества для анализа и в ней обеспечены условия сохранности вещественного состава среды в течение всего времени до получения результата анализа. Место для первичной оценки и отбора пробы выбирается в соответствии с целями анализа и на основании внимательного изучения всей имеющейся предварительной информации, а также натурного исследования местности или контролируемого объекта.
При поиске точек отбора проб воды из поверхностных источников особенно внимательно необходимо обследовать приток реки и возможные источники загрязнения выше по течению от предполагаемого места первичной оценки или пробоотбора.
Место отбора проб сточных вод оценивается и выбирается только после подробного ознакомления с технологией производств, потреблением и сбросом воды, местоположением цехов объекта, системой канализации, назначением и работой отдельных элементов систем очистки.
Створы отбора и оценки проб устанавливают на водоемах примерно в 1 км выше ближайшего по течению пункта водопользования, а на непрочных водоемах и водохранилищах — в 1 км в обе стороны от пункта водопользования.
Условия, которые следует соблюдать при отборе проб.
Ч Проба должна быть представительной
Ч Проба воды, взятая для анализа, должна отражать условия и место её взятия
Ч Отбор пробы, её хранение, транспортировка должны производиться так, чтобы не произошли изменения в содержании определенных количеств или свойств воды
Объем пробы воды должен быть достаточным и соответствовать применяемой методике контроля.
В зависимости от целей контроля применяют разовый или серийный отбор проб. При разовом отборе пробу берут один раз в определенном месте и рассматривают результат анализа. Для характеристики изменения состава воды отдельных стоков промышленных сточных вод отбирают разовые пробы в разное время через одинаковые промежутки времени и определяют в них компоненты, характерные для данного стока. Это серийный отбор проб.
Пробы бывают простые и смешанные. Простые пробы — это пробы, полученные путем однократного отбора всего требуемого количества воды. Смешанные пробы получают, сливая простые пробы, взятые в одном месте, через определенные промежутки времени.
Оборудование для отбора проб воды.
Пробы воды с намеченной глубины открытого водоема отбирают батометром. Также допускается отбор проб бутылью. Бутыль закрывают пробкой, к которой прикреплен шнур. Затем бутыль вставляют в тяжелую оправу или к ней подвешивают груз на тросе. Перед отбором пробы бутыль не менее двух раз ополаскивают водой, подлежащей исследованию. Бутыль опускают на намеченную глубину, открывают крышку, отбирают пробу, затем крышку герметично закрывают. Хром обладает всеми характерными свойствами металлов — хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре около 37°С он ведет себя явно «вызывающе» — многие его физические свойства резко, скачкообразно меняются. В этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. Так же внезапно изменяются электропроводность, коэффициент линейного расширения, термоэлектродвижущая сила. Пока ученые не могут объяснить эту аномалию.
1.4 Физические и химические свойства воды
В современной шкале измерений вода принята за эталон по очень многим показателям. Температурой таяния льда является 0 градусов Цельсия, а температурой кипения воды 100 градусов.
Всем известно, что замерзание водоема происходит только в верхней толще воды. Благодаря этому явлению, подводный мир, остающийся на зимовье, «засыпает», но не погибает, что могло бы произойти при полном промерзании водоема. Это уникальное свойство воды обусловлено тем, что при температуре в 4 градуса по Цельсию, вода имеет наивысшую плотность. Вода отдает свое тепло, нагревая воздух, и тем самым охлаждается, холодный слой воды имеет более высокую плотность и стремится опуститься на более низкий уровень, вытесняя тем самым более теплые водяные слои, имеющее меньшую плотность. Этот процесс мог бы продолжаться до бесконечности, до полного замерзания водоема, но этого не наступает, так как в любом случае температура охлаждения воды когда-нибудь достигает отметки +4 градуса тепла и вступает в силу «аномальное» явление — предельная плотность, после этого обмен слоев воды заканчивается.
При дальнейшем понижении температуры менее плотные (верхние) слои воды будут образовывать крепкую ледяную корку, нижняя часть которой не будет таять при соприкосновении с жидкой водой, так как она будет иметь температуру в 0 градусов по Цельсию.Ледяная корка выполняет защитную функцию от поступления дополнительного тепла, и поэтому при нуле градусов вода может находиться в двух состояниях одновременно — жидком и твердом. Надо отметить, что ближе ко дну водоема, вода будет намного теплее, чем на поверхности. Существует зависимость — чем больше глубина водоема, тем меньше он промерзает, в мелководных водоемах, имеющих тенденцию к полному промерзанию, виживают лишь отдельные организмы, имеющие споровую защитную структуру.
Если принять за константу, что плотность воды равна 1, то плотность льда будет равна 0,91. Подобные вычисления помогают узнавать толщину плывущей льдины.
Это становится очень актуальным для рыболовных судов и морских грузоперевозок, осуществляемых на территориях Крайнего Севера, Южного и Северного полюсов, так как эти природные регионы просто наводнены айсбергами и торосами, которые могут вызвать, при столкновении с ними, поломки или полное крушение судна. Еще одна особенность при нагревании характерна для воды — любое горячее тело, нагревается тяжелее, чем холодное, так как поглощает намного больше тепла. Этот закон не относится к воде. При нагревании воды от 0 градусов ее теплоемкость падает, при температуре 28 градусов тепла, значение теплоемкости воды становится наименьшим. Становится не очень понятно, как же быть с понятием «калория». Дело в том, что в технических характеристиках используются свойства не простой воды, а чистой, которую нагревают в температурном диапазоне от 14,5 градусов тепла до 15.5 (понятие пятнадцатая калория).
Значение это очень близко к нагреванию обычной воды, от 0 до 100 градусов по Цельсию.
Переход воды в состояние водяного пара. Пар образуется посредством испарения воды и состоит из мельчайших частиц, которые незаметны для глаза. Процесс испарения воды в природе происходит круглогодично. Процесс парообразования ускоряется при повышении температуры.Молекула её состоит из двух атомов водорода и одного атома кислорода().
Вода — это самый уникальный природный растворитель, который только существует на нашей планете. Вода растворяет в себе неимоверное количество элементов, образуя различные химические соединения, служащие во благо человечества.Это отличительное свойство воды приводит к тому, что абсолютно чистой воды в природе не существует.
Помимо твердых веществ, вода так же растворяет различные газы. Если сравнить воздух, выделенный из воды и воздух, которым мы дышим, то он будет разительно отличаться. Воздух выделенный из воды значительно сильнее обогащен кислородом (63% — азот, 36% — кислород, атмосферный воздух содержит 78% азота и 21% кислорода).. Понятие жесткости воды напрямую зависит от количества растворенных в ней минеральных веществ. Чем веществ больше, тем и жесткость воды выше. Жесткость воды подразделяется на карбанатную, некарбанатную и общую.Временная жесткость определяется наличием в воде двууглекислых солей магния, железа и кальция — это слабые химические соединения, легко разрушаемые и выпадающие в осадок.Постоянная жесткость определяет наличие хлористых и сернокислых солей магния, натрия, калия, кальция, эти соли имеют устойчивую химическую природу и при кипячении не образуют осадка, а значит не разрушаются. Самыми вредными считаются сернокислые и хлористые соли магния (при кипячении они образуют соляную и серную кислоту, очень вредную для здоровья всего живого мира флоры и фауны, а так же и человека). ион хром реактив водный
Вещества, полученные путем кристаллизации при участии воды — называются кристаллогидратами, их молекулярное взаимодействие происходит самостоятельно или частично замещено, молекулы воды входят в таких веществах в их кристаллические решетки.Вода, которая входит в состав кристаллов в строго определенном количестве, называется кристаллизационной (медный купорос). Особое свойство такой воды — она имеет все свойства твердых кристаллов вещества, в составе которых находится (сахар, соль, сода). Некоторые такие кристаллические соединения очень непрочны, например сода, она легко теряет свою кристаллизационную воду — в науке такой процесс называют выветриванием.
Химические процессы в природе проходят постоянно, некоторые из них настолько медленны, что не заметны для наружного наблюдения.
Для ускорения таких химических процессов существуют различные вещества, которые называются катализаторами. Вода один из самых мощных и сильных катализаторов. Посредством воды появляется ржавчина на железе, взрыв гремучего газа так же может произойти только при участии воды.
1.5 Теоретические основы фотоэлектроколориметрического метода анализа
Фотоэлектроколориметрические методы относятся к объективным методам, так как интенсивность окраски растворов оценивают с помощью специальных устройств — фотоэлементов, в основе которых лежит явление фотоэффекта.
Фотоэффектом называют явление отрыва электронов от атомов веществ под действием светового потока.
В Фотоэлектроколориметрических методах анализа используют приборы двух типов: однолучевые фотоэлектроколориметры (фотоэлектроколориметры с одним фотоэлементом или фотоэлектроколориметры прямого действия); двухлучевые фотоэлектроколориметры (фотоэлектроколориметры с двумя фотоэлементами)
Для определения ионов хрома в питьевых, поверхностных и сточных водах используют фотоэлектроколориметрический метод, основанный на зависимости светопоглощения раствора от его концентрации. Использования света видимой области спектра в данном методе дает возможность анализировать окрашенные вещества, которые можно перевести в окрашенные растворы.
В основе фотоэлектроколориметрического метода анализа лежит закон Бургера — Ламберта — Бера: абсорбционность прямо пропорциональна концентрации раствора и толщине поглощающего слоя.
источник