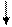Цель работы: изучение методик определения различных форм углекислоты.
Угольная кислота и её соли постоянные компоненты природных вод. Углекислота может находиться в воде в свободной форме и в виде гидрокарбонатов и карбонатов. Содержание свободной угольной кислоты Н2СО3 зависит от концентрации растворенного диоксида углерода. Так как в форме угольной кислоты находится лишь часть растворенного СО2 (около 1 %), то содержание свободной углекислоты в воде характеризуется суммой: Н2СО3 + СО2. При этом расчет ведут не на кислоту, а на СО2. Угольная кислота диссоциирует в водном растворе:
Константы диссоциации для 1 и 2 ступени:
Из уравнений следует, что концентрация свободной угольной кислоты находится в прямой зависимости от концентрации водородных ионов, а концентрация карбонат-ионов – в обратной. При рН — , причем с возрастанием рН увеличивается концентрация НСО3 — — ионов и понижается концентрация свободной угольной кислоты. При рН = 8,4 в воде присутствуют практически только гидрокарбонаты (99,7%). При дальнейшем увеличении рН в воде наряду с гидрокарбонат-ионами появляются и карбонат-ионы, которые при рН > 10 становятся преобладающими.
Связанной считается угольная кислота в форме карбонатов, форме гидрокарбонатов она состоит из связанной и полусвязанной кослоты (поровну), так как при кипячении половина гидрокарбонатов переходит в свободную угольную кислоту.
Если в воде находится свободная угольная кислота и НСО3 — —ионы, то количество связанной кислоты равно содержанию полусвязанной. При
рН > 8,4 количество связанной кислоты ( ) будет больше полусвязанной ( ).
При одновременном присутствии в воде ионов HCO3 — и СО3 2- определение ведут в одной пробе, нейтрализуя рабочим раствором соляной кислоты щелочность, создаваемую этим ионами. Определение основано на изменении содержания различных форм углекислоты в зависимости от рН. В присутствии кислоты ионы CО3 2- и НСО3 — переходят в свободную угольную кислоту. Карбонаты с соляной кислотой взаимодействуют в две стадии. На первой стадии карбонаты переходят в гидрокарбонаты:
Таким образом, можно считать, что объем кислоты, затраченный на перевод СО3 2 — в НСО3 — , соответствует половине содержащихся в воде карбонатов. Индикатор – фенолфталеин.
Проба, оттитрованная рабочим раствором кислоты в присутствии фенолфталеина, содержит гидрокарбонаты, ранее находившиеся в воде, и гидрокарбонаты, образовавшиеся из карбонатов. Гидрокарбонаты переводят в свободную угольную кислоту последующим титрованием пробы кислотой в присутствии метилового оранжевого.
При расчете содержания СО3 2- -ионов объемов соляной кислоты израсходованной на титрование пробы воды с фенолфталеином, соответственно удваивается. А при расчете количества гидрокарбонатов из объема кислоты, израсходованного на титрование воды в присутствии метилоранжа, вычитается объем, пошедший на титрование с фенолфталеином.
Карбонат – ионы содержатся в щелочных водах. В этом случае, в воде определяют только гидрокарбонаты титрованием кислотой в присутствии метилоранжа.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10436 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Настоящий документ устанавливает титриметрический метод определения содержания свободной углекислоты в пробах питьевых и природных вод в диапазоне измерений от 5,0 до 300 мг/дм 3 .
Метод определения содержания свободной углекислоты включает три этапа:
1) определение общей кислотности;
2) определение свободной кислотности;
3) определение кислотности, обусловленной слабыми нелетучими кислотами.
Содержание свободной углекислоты определяют по общей кислотности за вычетом свободной кислотности и кислотности, обусловленной слабыми нелетучими кислотами. Соотношение форм углекислоты от рН воды приведено в Приложении А.
В настоящем документе использованы ссылки на следующие стандарты:
ГОСТ 12.0.004-90 ССБТ. Организация обучения безопасности труда. Общие положения.
ГОСТ 12.1.004-91 ССБТ. Пожарная безопасность. Общие требования.
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности.
ГОСТ 12.4.009-83 ССБТ. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание.
ГОСТ 12.1.019-79 ССБТ. Электробезопасность. Общие требования и номенклатура видов защиты.
ГОСТ 12.4.021-75 ССБТ. Системы вентиляционные. Общие требования.
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия.
ГОСТ 4328-77 Натрия гидроокись. Технические условия.
ГОСТ 6709-72. Вода дистиллированная. Технические условия.
ГОСТ 9147-80 Посуда и оборудование фарфоровые. Технические условия.
ГОСТ 10733-98 Часы наручные и карманные механические. Общие технические условия.
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия.
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия.
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования.
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры.
ГОСТ 27752-88 Часы электронно-механические кварцевые настольные, настенные и часы будильники. Общие технические условия.
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические условия. Методы испытания.
ГОСТ 29251-91 Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования.
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб.
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецезионность) методов и результатов измерений. Часть 6. Использование значений точности на практике.
Весы лабораторные по ГОСТ 24104, с ценой деления не более 10 мг и наибольшим пределом взвешивания не менее 500 г.
Термометр стеклянный лабораторный по ГОСТ 28498 с ценой деления 2 °С, с диапазоном измерений от 0 до 150 °С.
РН-метр с погрешностью измерения не более ±0,1 ед. рН.
Бюретки по ГОСТ 29251, 2 класса точности, номинальной вместимостью 2, 5, 10, 25 см 3 .
Пипетки градуированные по ГОСТ 29227.
Колбы мерные по ГОСТ 1770, 2 класса точности.
Цилиндры с носиком 2 класса точности или мензурки по ГОСТ 1770.
Часы любого типа, например, по ГОСТ 10733 или ГОСТ 27752.
Шкаф сушильный общелабораторного назначения, обеспечивающий поддержание температуры (105 ± 5) °С.
Электроплитки с закрытой спиралью по ГОСТ 14919.
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Стаканчики для взвешивания по ГОСТ 25336.
Натрия гидроокись по ГОСТ 4328, ч.д.а. или стандарт-титр, например, по ТУ-2642-001-0750062
Соляная кислота стандарт-титр, например, по ТУ 6-09-2540.
Фенолфталеин (индикатор), например, по ТУ-6-09-5360.
Допускается использование средств измерений, вспомогательного оборудования и реактивов с метрологическими и техническими характеристиками не хуже указанных.
Общие требования к отбору проб по ГОСТ Р 51592 и ГОС Р 51593.
Для измерения содержания свободной углекислоты пробы воды отбирают в посуду из стекла или полимерных материалов вместимостью не менее 500 см 3 так, чтобы между слоем воды и пробкой не было воздушного пространства. Пробы не консервируют, к анализу приступают как можно быстрее, но не позднее, чем через 6 ч.
5.1 Приготовление растворов
5.1.1 Раствор гидроксида натрия молярной концентрации С (NaOH) = 15 моль/дм 3
Растворяют 625 г гидроксида натрия в 800 см 3 дистиллированной воды и оставляют раствор для осветления не менее, чем на 48 часов. Хранят раствор в плотно закрытом полиэтиленовом сосуде не более 6 мес.
5.1.2 Раствор гидроксида натрия молярной концентрации С (NaOH) = 0,1 моль/дм 3
Для приготовления 1 дм 3 раствора 6,6 см 3 раствора гидроксида натрия, приготовленного по 5.1.1, вносят в мерную колбу вместимостью 1 дм 3 и доводят до метки прокипяченной дистиллированной водой. Раствор хранят в сосуде с закрытой пробкой с хлор-кальциевой трубкой. Срок хранения — не более 1 мес. с еженедельным определением титра раствора.
В случае применения стандарт-титра (фиксанала) раствор готовят в соответствии с инструкцией по приготовлению. Раствор хранят в плотно закрытом полиэтиленовом сосуде. Срок хранения — не более 1 мес.
Поправочный коэффициент устанавливают по раствору соляной кислоты молярной концентрации С (НСl) = 0,1 моль/дм 3 .
5.1.3 Раствор гидроксида натрия молярной концентрации С (NaOH) = 0,01 моль/дм 3
Для приготовления 1 дм 3 раствора 100 см 3 раствора гидроксида натрия, приготовленного по п. 5.1.2, вносят в мерную колбу вместимостью 1 дм 3 и доводят до метки прокипяченной дистиллированной водой.
Поправочный коэффициент устанавливают по раствору соляной кислоты молярной концентрации С (НСl) = 0,01 моль/дм 3 .
Хранят раствор в плотно закрытом полиэтиленовом сосуде. Срок хранения — не более 7 сут.
5.1.4 Раствор соляной кислоты молярной концентрации С (НСl) = 0,1 моль/дм 3
Раствор готовят из стандарт-титра (фиксанала) в соответствии с инструкцией по приготовлению. Раствор хранят в плотно закрытом стеклянном сосуде. Срок хранения — не более 6 мес.
5.1.5 Раствор соляной кислоты молярной концентрации С (НСl) = 0,01 моль/дм 3
Для приготовления 1 дм 3 раствора 100 см 3 раствора соляной кислоты, приготовленного по п. 5.1.4, вносят в мерную колбу вместимостью 1 дм 3 и доводят до метки прокипяченной дистиллированной водой. Срок хранения — не более 3 мес.
5.1.6 Раствор гидроксида натрия молярной концентрации С (NaOH) = 0,02 моль/дм 3
Для приготовления 1 дм 3 раствора 200 см 3 раствора гидроксида натрия, приготовленного по п. 5.1.2, помещают в мерную колбу вместимостью 1 дм 3 и доводят дистиллированной прокипяченной водой до метки. Хранят раствор в плотно закрытом полиэтиленовом сосуде. Срок хранения — не более 7 сут.
5.1.7 Приготовление индикаторов
5.1.7.1 Раствор метилового оранжевого
Для приготовления 1 дм 3 раствора 0,5 г метилового оранжевого растворяют в небольшом количестве дистиллированной воды, количественно переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой. Срок хранения — не более 6 мес.
5.1.7.2 Раствор фенолфталеина
0,5 г фенолфталеина растворяют в 50 см 3 96 % этилового спирта и добавляют 50 см 3 дистиллированной воды. В раствор по каплям добавляют раствор гидрооксида натрия, приготовленный по 5.1.6, до появления слабой розовой окраски. Срок хранения — не более 1 года.
5.2 Установление поправочных коэффициентов растворов гидроксида натрия
В коническую колбу вместимостью 250 см 3 наливают 70 ÷ 80 см 3 прокипяченной дистиллированной воды, 10 см 3 соляной кислоты (VHCL), см 3 , добавляют 3 — 5 капель раствора фенолфталеина и титруют раствором гидроксида натрия, (VNaOH), см 3 , до бледно-розового окрашивания, не исчезающего в течение 10 ÷ 30 с. Титрование повторяют 1 — 3 раза. Из полученных результатов берут среднее. Поправочный коэффициент раствора гидроксида натрия вычисляют по формуле:
Значение поправочного коэффициента должно быть равным (1,00 ± 0,03). Если поправочный коэффициент выходит из указанных пределов, то раствор гидроксида натрия, соответственно, укрепляют или разбавляют. Поправочный коэффициент устанавливают при приготовлении растворов гидроксида натрия, но не реже 1 раза в неделю.
6.1 Определение общей кислотности
В коническую колбу вместимостью 250 см 3 помещают мензуркой или цилиндром 100 см 3 исследуемой пробы, добавляют 5 ÷ 10 капель раствора фенолфталеина и титруют раствором гидроксида натрия, приготовленным по 5.1.2 или 5.1.3, до появления слаборозовой окраски, не исчезающей в течение 2 ÷ 3 мин.
Конечную точку титрования можно определить потенциометрически, проводя титрование до получения устойчивого значения рН = (8,3 ± 0,1).
Если при добавлении фенолфталеина к исследуемой пробе раствор сразу приобретает розовую окраску, отмечают, что углекислота отсутствует.
При необходимости определение общей кислотности повторяют следующим образом: в коническую колбу вместимостью 250 см 3 помещают 5 ÷ 10 капель раствора фенолфталеина, почти весь объем титрованного раствора гидроксида натрия, затем 100 см 3 исследуемой пробы, после чего дотитровывают по каплям до устойчивого розового окрашивания, либо до рН (8,3 ± 0,1) при потенциометрическом титровании.
6.2 Определение свободной кислотности
В коническую колбу вместимостью 250 см 3 помещают мензуркой или цилиндром 100 см 3 исследуемой воды, добавляют 3 капли раствора метилового оранжевого и титруют раствором гидроксида натрия, приготовленным по 5.1.2 или 5.1.3 до перехода окраски в золотисто-розовую.
Конечную точку титрования можно определить потенциометрически, проводя титрование до получения устойчивого значения рН = (4,5 ± 0,1).
Если при добавлении раствора метилового оранжевого к исследуемой пробе раствор становится желтым, отмечают, что свободная кислотность отсутствует (значение содержания свободной кислотности равно нулю).
6.3 Определение кислотности, обусловленной слабыми нелетучими кислотами
Оттитрованную по 6.2 пробу воды кипятят в течение 2 мин для удаления свободной двуокиси углерода, быстро охлаждают, добавляют 5 ÷ 10 капель раствора фенолфталеина и титруют раствором гидроксида натрия, приготовленным по 5.1.2 или 5.1.3, до появления устойчивого слабо-розового окрашивания. Конечную точку титрования можно определить потенциометрически, проводя титрование до получения устойчивого значения рН = (8,3 ± 0,1).
7.1 Значение общей кислотности, соб ммоль/дм 3 , вычисляют по формуле:
где С — молярная концентрация раствора гидроксида натрия, моль/дм 3 ;
K — поправочный коэффициент раствора гидроксида натрия;
VToб — объем раствора гидроксида натрия, пошедшего на титрование, см 3 ;
1000 — коэффициент массового пересчета;
V — объем пробы, взятой для определения, см 3 .
7.2 Значение свободной кислотности, ссв, ммоль/дм 3 , вычисляют по формуле:
где С — молярная концентрация раствора гидроксида натрия, моль/дм 3 ;
K — поправочный коэффициент раствора гидроксида натрия;
VTcв — объем раствора гидроксида натрия, пошедшего на титрование, см 3 ;
1000 — коэффициент массового пересчета;
V — объем пробы, взятой для определения, см 3 .
7.3 Значение кислотности, обусловленной слабыми нелетучими кислотами, сснк, ммоль/дм 3 , вычисляют по формуле:
где С — молярная концентрация раствора гидроксида натрия, моль/дм 3 ;
K — поправочный коэффициент раствора гидроксида натрия;
VTснк — объем раствора гидроксида натрия, пошедшего на титрование, см 3 ;
1000 — коэффициент массового пересчета;
V — объем пробы, взятой для определения, см 3 .
7.4 Значение содержания свободной углекислоты, у, мг/дм 3 , вычисляют по формуле:
где 44 — коэффициент пересчета.
7.5 При необходимости проверки приемлемости результатов измерения в условиях повторяемости (например, по требованию заказчика или в случае анализа сложных проб) получают два результата измерений содержания свободной углекислоты в пробах природных и питьевых вод по разделу 6 в условиях повторяемости.
Проверяют приемлемость результатов измерений, сравнивания расхождение между ними с пределом повторяемости (r для n = 2, таблица 2). Если полученное значение расхождения не превышает предела повторяемости, то за результат измерений содержания свободной углекислоты в пробе принимают среднее из двух полученных значений. В противном случае процедуру повторяют.
Результаты измерений содержания свободной углекислоты в анализируемой пробе в документах, предусматривающих их использование, представляют в виде:
где U — расширенная неопределенность, вычисленная по формуле:
где 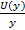
Настоящая методика выполнения измерений обеспечивает получение результатов с расширенной неопределенностью, значения которой приведены в таблице 1.
Диапазон измерений содержания свободной углекислоты, у, мг/дм 3
Суммарная стандартная неопределенность, 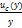
Расширенная неопределенность, k = 2, 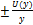
Контроль стабильности результатов измерений в лаборатории осуществляют, используя методы контроля стабильности стандартного отклонения повторяемости. Для этого используют приведенные к среднему значению результатов анализа значения расхождений (w‘) полученных результатов единичных измерений с1 и с2, которые сравнивают с рассчитанными при построений контрольных карт пределами предупреждения и действия
где UCL — пределы действия, UCLд = 3,686σr или
где σr — стандартное отклонение повторяемости результатов для значения у численно равного 1. Значение стандартного отклонения повторяемости приведено в таблице 2.
Диапазон измерений содержания свободной углекислоты, мг/дм 3
Стандартное отклонение повторяемости, σ r , %
Предел повторяемости, r , % ( n = 2)
Пример. За три дня получены результаты параллельных определений: 5,2 и 6,3 мг/дм 3 ; 23 и 25 мг/дм 3 ; 34 и 36 мг/дм 3 .
Значения расхождений наносят на контрольную карту.
Для расчета UCLп и UCLд из таблицы 2 берут σr = 9 %.
Расчет UCLп = 2,834∙0,09 = 0,26; UCLд = 3,686∙0,09 = 0,33, где 0,09 — абсолютное значение σr = 9 % для у = 1.
При неудовлетворительных результатах контроля, например, превышение предела действия или регулярное превышение предела предупреждения, выясняют причины этих отклонений, в том числе проверяют работу оператора.
Периодичность проведения контроля стабильности результатов измерений устанавливают индивидуально для каждой лаборатории в соответствии с документами по внутрилабораторному контролю качества результатов анализа.
После внедрения МВИ в практику работы лаборатории при необходимости проверки приемлемости результатов измерений, полученных в условиях воспроизводимости, проводят межлабораторные сравнительные испытания с использованием данной методики для оценки стандартного отклонения воспроизводимости. Для расчета стандартного отклонения воспроизводимости используют ГОСТ Р ИСО 5725-2-2002, пункт 7.4. Проверку приемлемости результатов измерений в условиях воспроизводимости осуществляют по ГОСТ Р ИСО 5725-6-2002, пункт 5.3.
При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 и ГОСТ 12.4.021.
При работе с электроустановками должны соблюдаться требования по электробезопасности по ГОСТ 12.1.019.
Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Исполнители должны быть проинструктированы о мерах безопасности при работе с нагревательными приборами. Организация обучения работающих безопасности труда производится по ГОСТ 12.0.004.
Измерения по методике может выполнять лаборант, имеющий навыки работы в химической лаборатории и освоивший данную методику.
При подготовке к выполнению измерений и при их проведении необходимо соблюдать условия, установленные в руководстве по эксплуатации или паспортах средств измерений и вспомогательных устройств. Измерение объема воды производится при температуре от 15 до 25 °С.
Рисунок 1А
Соотношения форм производных угольной кислоты от рН воды.
В зависимости от рН воды углекислота встречается в ней в свободном состоянии в виде углекислого газа СО2, в виде бикарбонат-ионов НСО — 3 и карбонат-ионов СО 2- 3. При рН — 3 и при рН выше 10,5 — только ионы СО 2- 3.
Находящиеся в воде ионы НСО — 3, СО 2- 3 и углекислый газ связаны углекислотным равновесием
Часть свободной углекислоты, находящаяся в равновесии с бикарбонатами, называется равновесной. Она как бы связана с бикарбонатами и поэтому не вступает в химические реакции. Избыточная свободная (или иначе агрессивная) углекислота в отличие от равновесной является очень активной и реакционно-способной.
В водах открытых водоемов вследствие низкого содержания углекислоты в воздухе наличие агрессивной углекислоты маловероятно. В подземных водах содержание агрессивной углекислоты иногда бывает довольно значительным.
Центр Исследования и Контроля Воды
аккредитован в Системе аккредитации аналитических лабораторий (центров)
Госстандарта России, № Госреестра РОСС RU.0001.510045
Метрологическая служба аккредитована на право аттестации методик выполнения
измерений и проведения метрологической экспертизы документов, в том числе
применяемых в сферах распространения государственного метрологического
контроля и надзора,
№ Госреестра 01.00031-2002
195009, Санкт-Петербург, ул. Комсомола, 9
Факс (812) 542-72-38
о метрологической аттестации
методики выполнения измерений содержания свободной углекислоты
в пробах питьевых и природных вод
Методика выполнения измерений содержания свободной углекислоты в пробах питьевых и природных вод,
разработанная Центром исследования и контроля воды,
регламентированная в документе:
«Качество воды. Методика выполнения измерений содержания свободной углекислоты в пробах питьевых и природных вод. Титриметрический метод. ЦВ 1.01.17-2004»
аттестована в соответствии с ГОСТ Р 8.563-96.
Аттестация осуществлена по результатам экспериментального исследования МВИ и метрологической экспертизы материалов по ее разработке.
В результате аттестации установлено, что МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Диапазон измерений содержания свободной углекислоты, у, мг/дм 3
Суммарная стандартная неопределенность, 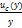
Расширенная неопределенность, вычисленная с применением коэффициента охвата k = 2, 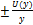
Дата выдачи свидетельства 22 октября 2004 года
источник
Конические колбы объёмом 200 мл, едкий натрий 0,1 N
Колбы с меткой 100-150 мл — 4 шт., фенолфталеин 1%
Мерный цилиндр на 200 мл, соляная кислота 0,1 N
Пипетки 1-2,25-50 мл метилоранжевый 0,1 %
Ход анализа
Способ определения свободной углекислоты сводится к следующему. Исследуемую воду, в которую добавлен фенолфталеин, титруют раствором щелочи определенной концентрации. Пока вся свободная углекислота не будет нейтрализована щелочью, раствор остается бесцветным. Как только свободная углекислота перейдет в бикарбонатную, раствор окрасится в розовый, а при дальнейшем прибавлении щелочи – в красный цвет. Реакция связывания свободной углекислоты протекает по следующей схеме
Если вместо свободной углекислоты в воде присутствует монокарбонатная углекислота, то вода окрашивается в розовый цвет сразу после добавления фенолфталеина. В этом случае титруют не щелочью, а кислотой до тех пор, пока окраска жидкости не ослабеет до бледнорозовой, т.е. монокарбонатная углекислота не перейдет в бикарбонатную:
В колбу с меткой 150 мл наливают исследуемую воду, предварительно несколько раз ополоснув её. Затем добавляют 0,1 мл раствора фенолфталеина и титруют раствором едкого натрия. Количество свободной углекислоты вычисляется по формуле:
где n – число мл едкого натрия, пошедшего на титрование, N – нормальность едкого натрия, V – объем титровавшейся жидкости.
Количество растворенной в воде углекислоты зависит от ее температуры (табл. 5) и рассчитывается аналогично по формуле насыщения кислорода.
Таблица 5. Растворимость двуокиси углерода в дисциллированной воде для влажной атмосферы в пересчете на единицу объема сухих компонентов
воздуха на уровне моря, по Хатчинсону Д.
| Температура, ˚С | Содержание двуокиси углерода, % | |
| 0,03 | 0,033 | 0,044 |
| 1,00 | 1,10 | 1,47 |
| 0,96 | 1,06 | 1,41 |
| 0,93 | 1,02 | 1,36 |
| 0,89 | 0,99 | 1,30 |
| 0,86 | 0,94 | 1,26 |
| 0,83 | 0,91 | 1,22 |
| 0,80 | 0,88 | 1,17 |
| 0,78 | 0,86 | 1,14 |
| 0,75 | 0,82 | 1,10 |
| 0,72 | 0,79 | 1,06 |
| 0,70 | 0,76 | 1,02 |
| 0,67 | 0,74 | 0,98 |
| 0,65 | 0,72 | 0,95 |
| 0,63 | 0,69 | 0,92 |
| 0,61 | 0,67 | 0,89 |
| 0,59 | 0,65 | 0,87 |
| 0,57 | 0,62 | 0,84 |
| 0,55 | 0,60 | 0,81 |
| 0,54 | 0,59 | 0,79 |
| 0,52 | 0,58 | 0,76 |
| 0,51 | 0,56 | 0,74 |
| 0,49 | 0,54 | 0,72 |
| 0,48 | 0,52 | 0,70 |
| 0,46 | 0,51 | 0,68 |
| 0,45 | 0,50 | 0,66 |
| 0,44 | 0,48 | 0,64 |
| 0,42 | 0,46 | 0,62 |
| 0,41 | 0,45 | 0,60 |
| 0,40 | 0,44 | 0,59 |
| 0,39 | 0,43 | 0,57 |
| 0,38 | 0,42 | 0,56 |
Определение перманганатной окисляемости воды
Колбы конические – 4 шт., серная кислота 25 %
Мерный цилиндр, марганцовокислый калий 0,01 N
Пипетки 5,10 мл щавелевая кислота 0,01 N
Окисляемость воды является косвенным показателем загруженности воды органическими веществами и выражается количеством мг кислорода, идущего на разрушение части органических веществ, заключенных в 1л исследуемой воды в строго определенных условиях. При определении окисляемости разрушается около 30 % всех органических веществ. Определение окисляемости натуральной не фильтрованной воды дает представление как о растворенном, так и взвешенном органическом веществе. Определение же окисляемости фильтрованной воды – только о растворенном.
Окисляемость принято определять методом, основанным на способности марганцовокислого калия окислять органические вещества, отдавая им свой кислород. Окисление в кислой среде, которое особенно энергично протекает при прогревании, приводит к восстановлению марганца до двухвалентного иона:
* — идет на окисление органических веществ.
Марганцовокислый калий добавляется к исследуемой воде в избытке, избыток которого разрушается строго определенным количеством щавелевой кислоты. Количество щавелевой кислоты, оставшейся после восстановления избыточного марганцовокислого калия, определяется титрованием новой порции KMnO4. В конечном счете, чем больше марганцовокислого калия пошло на последнее титрование, тем больше кислорода израсходовалось на окисление органических веществ исследуемой воды. На этом основаны расчеты. Условность определения окисляемости заставляет требовать строгого соблюдения единообразия приемов анализа, в частности, точного десятиминутного кипячения исследуемой воды.
В колбу емкостью 200-300 мл отмерить 100 мл перемешанной исследуемой воды, добавить в нее пипеткой 5 мл 25 % серной кислоты и нагреть на ровном пламени. Как только жидкость закипит, колбу снимают и приливают в нее пипеткой 10 мл 0,01N раствора KMnO4 и снова ставят на нагревательный прибор, поддерживая слабое равномерное кипение жидкости точно 10 минут, считая с момента закипания после прибавления реактива. Для равномерного кипения колба закрывается пробкой. Если во время кипения жидкость совершенно обесцветится или вместо розовой станет светло – бурой, определения повторяют, разбавив исследуемую воду дистиллированной.
Если после кипячения жидкость не обесцветится, то колбу снимают и сразу добавляют 10 или 0,01 N раствора щавелевой кислоты. Жидкость размешивают, после чего она обесцвечивается. Обесцвеченную горячую жидкость титруют при энергичном помешивании. Для титрования используют 0,01 N раствора KMnO4. Титрование продолжают до появления устойчивости, но очень слабой розовой окраски. Сразу после этого приступают к установки титра раствора марганцовокислого калия, для чего в жидкость добавляют 10 мл 0,01 N раствора щавелевой и снова титруют KMnO4 до появления точно такой же слабой розовой окраски. Результаты анализа рассчитывают следующим образом::
где А – число мл 0,01 N раствора KMnO4, пошедшего на титрование избытка щавелевой кислоты, с – число мл 0,01 N раствора KMnO4, пошедшего на титрование для установления титра, V – объем испытуемой воды, N – нормальность раствора.
Все полученные в ходе титрования данные по определению кислорода и диоксида углерода заносятся в соответствующие таблицы полевого дневника. Затем результаты по концентрации кислорода и диоксида углерода пересчитываются на температуру воды водоема при взятии проб по приведенным формулам и таблицам Г.Г. Винберга (табл. 4) и Д. Хадчинсона (табл. 5). Температурная поправка по данным окисляемости НЕ рассчитывается.
Полученные Вами результаты составляют базу обсуждения и сравнения с данными других авторов, работавших в этой области. Если Вы выяснили, что Ваши работы оказываются повторением, то в этом случае Ваши результаты могут рассматриваться как мониторинговые и требуют выяснения возможных причин современного состояния водного объекта, что крайне важно. В случае первичности проведенной Вами работы полученные данные должны быть Вами проанализированы, по возможности объяснены или Вами выдвигается предположение (гипотеза) для объяснения. Полученные результаты могут быть проверены в течение следующего сезона или в лабораторном эксперименте, а также послужить отправной точкой для последующих мониторинговых исследований. В нашей области достаточно слабо изученных водных объектов, которые ждут Вас – пытливых исследователей. В добрый путь!
Рекомендуемый библиографический список
1. Алекин О.А. Основы гидрохимии. – Л.: Гидрометиздат, 1970. – 444 с.
2. Баканина Ф.М., Воротников В.П., Лукина Е.В., Фридман Б.И. Озера Нижегородской области. – Н.Новгород: ВООП, 2001. – 165 с.
3. Бакка С.В., Киселёва Н.Ю. Особо охраняемые природные территории Нижегородской области. – Н. Новгород: Минприроды Ниж. обл., 2008. — 560 с.
4. Богословский Б.Б. Озероведение. – М.: МГУ, 1960. – 325 с.
5. Доманицкий А.П., Дубровина Р.Г., Исаева А.И. Реки и озера Советского Союза. – Л.: Гидрометиздат, 1971. — 103 с.
6. Жизнь пресных вод СССР. Под ред. Жадина В.И. В 4-х т. — М.-Л.: АН СССР.
7. Константинов А.С. Общая гидробиология. – М.: Высшая школа, 1986. – 471 с.
8. Природа Горьковской области. Под ред. Н.В. Кузнецова. – Горький: Вол-го-Вятское кн. изд-во, 1974. – 416 с.
9. Станковская Т.П. К вопросу комплексного использования малых озер. / Вестник НГСХА — Н.Новгород: НГСХА, 2014, с. 270 -274. . (сайт НГСХА).
10. Станковская Т.П. Экологические основы рыбоводства. – Н.Новгород: НГСХА, 2005. – 169 с. (сайт и библиотека НГСХА).
11. Станковская Т.П. Гидробиологические основы прудово-озерного рыбоводства. – Н.Новгород: НГСХА, 2014. – 283 с. (библиотека НГСХА).
12. Унифицированные методы исследования качества вод. – М.: СЭВ, 1983. Часть III. Методы биологического анализа вод, с. 82-91, с. 250-265, с. 323-329.
13. Харитонычев А.Т. Физическая география Горьковской области.- Горький: ГГПИ, 1985. — 96 с.
— указанные издания могут быть представлены в Областной библиотеке имени В.И. Ленина, в Интернет, где помимо них можно найти и другие источники, а также карты, атлас Нижегородской области, сведения об отдельных водных объектах области и т.п.;
— в ходе оформления работы при использовании материалов Интернета указывать в библиографическом списке адрес сайта, информацией которого Вы пользовались.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
источник
1. В коническую колбу пипеткой внесите 100 мл анализируемой воды, сюда же добавьте 2-3 капли спиртовогораствора фенолфталеина, содержимое колбы перемешайте:
— если жидкость приобрела розовую окраску — это свидетельствует об отсутствии свободной углекислоты (обоснуйте это).
— если вода осталась бесцветной, то титруйте пробу раствором гидроксида натрия молярной концентрации 0,1 моль/л до тех пор, пока исчезающая вначале окраска не станет устойчивой, и жидкость приобретет розовый оттенок.
2. Рассчитайте содержание свободной углекислоты в воде по формуле:
V(NaOH)·c(NaOH)·44·1000

 |
с(СО2) — концентрация углекислого газа (мг/л);
с(NаОН) — концентрация гидроксида натрия (моль/л);
V(NaOH) — объем гидроксида натрия, пошедший на титрование(мл);
V (пробы) — oбъём пробы воды, взятой на исследование (мл);
44 — молярная масса углекислого газа.
Определение содержания карбонат-ионов.
В коническую колбу пипеткой внесите 100 мл воды, добавьте 2-3 капли фенолфталеина, титруйте пробу раствором соляной кислоты молярной концентрации 0,05 моль/л до тех пор, пока проба не приобретет слабый розовый цвет.
Рассчитайте содержание карбонат-ионов в воде по формуле:
V(НCl)·c(HCl)·11·1000

c (CO3 2- ) — концентрация карбонат-ионов (мг/л);
c(HCl) — концентрация соляной кислоты (моль/л);
V(НCl) — объём соляной кислоты, пошедший на титрование (мл);
V (пробы) — объем пробы воды, взятый на исследование (мл);
11 — коэффициент для пересчета на массу карбонат-ионов.
Определение содержания гидрокарбонат-ионов.
В коническую колбу пипеткой внесите 100 мл, добавьте 2-3 капли раствора метилового оранжевого, титруйте пробу раствором соляной кислоты молярной концентрации 0,05 моль/л до появления устойчивого розового окрашивания.
Рассчитайте содержание гидрокарбонат-ионов в воде по формуле:
V(НCl)·c(HCl)·22·1000

c (НCO3 — ) — концентрация гидрокарбонат-ионов (мг/л);
c(HCl) — концентрация соляной кислоты (моль/л);
V(НCl) — объём соляной кислоты, пошедший на титрование (мл);
V (пробы) — объем пробы воды, взятый на исследование (мл);
22 — коэффициент для пересчета на массу гидрокарбонат-ионов.
Контрольные вопросы
1. Какое существует равновесие между различными формами угольной кислоты?
2. Что называют стабильной, нестабильной, агрессивной водой?
3. Что такое индекс стабильности воды?
IV. ХИМИЯ ГИДРОСФЕРЫ
Лабораторная работа №1
Определение остаточного хлора
Теоретическая часть.
Классическое хлорирование является самым надежным способом обеззараживания, когда микробиологическое загрязнение воды является наиболее сильным. Внедрение хлорирования считается самым крупным событием в медицине XX века, остановившим распространение кишечных инфекций в городах. Хлорирование является обязательным при подаче воды в разводящую сеть.
При введении хлора в воду образуются хлорноватистая и соляная кислоты:

В сильнокислой среде равновесие этой реакции сдвинуто влево и в воде присутствует молекулярный хлор; при значении рН более 4 последний практически отсутствует. Наиболее сильными бактерицидными свойствами обладает молекулярный хлор и хлорноватистая кислота.
Основными обеззараживающими веществами при хлорировании являются Cl2, HClO, ClO — («свободный активный хлор») и NH2Cl, NHCl2 («свзанный активный хлор»).
Моно- и дихлорамины образуются при наличии в воде аммонийных солей или аммиака:
Бактерицидные свойства хлораминов значительно ниже, чем у хлора, но их действие более продолжительно.
Избыток активного хлора, который остался в воде после его взаимодействия с органическими и неорганическими веществами, называют остаточным активным хлором.
Концентрация остаточного свободного хлора (в воде должна быть не менее 0,3 мг/л и не более 0,5 мг/л.
Избыточный активный хлор может быть удален путем дехлорирования, за счет обработки воды восстановителями (сульфит или тиосульфат натрия, сернистый газ, активированный уголь).
Взаимодействие хлора с гумусовыми и другими органическими веществами приводит к образованию широкой гаммы хлорорганических продуктов — тригалометанов, хлоралканов, хлорированных кислот и фенолов. Находящийся в воде фенол (ПДК=0,001 мг/л)прихлорировании превращается в более токсичный 2,4,6-трихлорфенол (ПДК=0,0004 мг/л), обладающий специфическим запахом.
Основное возражение против хлорирования связывают с возможностью образования вредных соединений — хлороформа СНС13 (ПДК=0,2 мг/л) и других тригалометанов (СНСl2Вг, СНС1Вг2, СНВг3). Замена хлора на гипохлорит натрия (без аммонизации!) увеличивает вероятность образования тригалометанов. Опытным путем установлено, что при концентрации остаточного активного хлора в интервале 0,3-1,1 мг/л и наличии в воде органики, содержание образующегося СНС13 не превышает 0,06 мг/л. Дальнейшее повышение концентрации остаточного активного хлора приводит к повышенному образованию хлороформа.
Самое простое техническое решение, приводящее к уменьшению содержания тригалометанов в питьевой воде, состоит в хлорировании воды только после ее осветления и фильтрования. Снижение содержания органических веществ в воде на стадии предварительной очистки до операции хлорирования — наиболее рациональный путь улучшения качества воды при ее обеззараживании.
Существенно уменьшить концентрацию тригалометанов, а также других вредных хлорорганических соединений в питьевой воде можно за счет использования вместо хлора хлораминов, образующихся при обработке гипохлоритом натрия воды, содержащей ионы аммония.
При взаимодействии хлораминов с органикой не происходит образования канцерогенных веществ. Хлорамины по сравнению с молекулярным хлором органолептически менее ощутимы, а при наличии в воде фенолов, они не образуют хлорфенольных запахов. Аммонизация осуществляется технически просто, а использование гипохлорита натрия также снимает все опасные и вредные производственные факторы, присущие самому хлору.
Хлорирование воды, содержащей органические вещества, в структурах которых имеются бензольные кольца (лигнин, гуминовые и фульвокислоты, фенолы и др.), может также приводить к образованию высокотоксичных диоксинов и родственных им хлорорганических соединений. Комплексный характер действия этой группы соединений приводит к генетическим изменениям, подавлению иммунитета, канцерогенезу, поражению внутренних органов и истощению человека. Максимальной токсичностью обладает 2,3,7,8-тетрахлордибензодиоксин, а также 2,3,7,8-тетрахлордибензофуран. Эти соединения имеют токсичность на много порядков выше, чем, например, широко известный препарат ДДТ (дуст).
Коварство токсического действия диоксинов заключается в том, что они незаметно накапливаются в организме, совершенно не проявляя себя, а затем наносят удар по иммунной системе. Их воздействие на организм сводится к тому, что молекула диоксина входит в рецептор и вписывается в структуру ДНК в строго определенных местах. Структура ДНК при этом не повреждается, но искривляется и становится более податливой воздействиям химических веществ. Сам диоксин не вызывает болезни, а лишь способствует развитию некоторых изних, например рака, при наличии канцерогенных веществ. Все обычно начинается с раздражения кожи, за которым появляется фурункулез, злокачественные опухоли, психические расстройства, рождение детей-уродов и т. П (Мешалкин, 2007).
Принцип метода основан на окислении йодида активным хлором до йода, который титруют тиосульфатом натрия.
Нитриты, окись железа, озон и другие соединения в кислом растворе выделяют йод из йодида калия, поэтому пробы воды необходимо подкислить буферным раствором с рН 4,5.
Экспериментальная часть
Оборудование и реактивы:
3. 0,1 н. раствор тиосульфата натрия: 25 г тиосульфата натрия (Nа2S23•5Н20) растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0,2 г карбоната натрия (Nа2СО3) и доводят до объема 1 л;
4. 0,01 н. раствор тиосульфата натрия: 100 мг 0,1 н. раствора тиосульфата натрия разбавляют дистиллированной водой, добавляют 0,2 г карбоната натрия и доводят до объема 1 л;
5. 0,005 н. раствор тиосульфата натрия: 50 мл 0,1 н. раствора тиосульфата натрия разбавляют дистиллированной водой, добавляют 0,2 г карбоната натрия и доводят до объема 1 л;
6. 0,01 н. раствор двухромовокислого калия: 0,4904 г перекристаллизованного двухромовокислого калия (К2Сr27), взвешенного с точностью до 0,0002 г, растворяют в 1 л дистиллированной воды;
7. 0,5% — раствор крахмала: 0,5 г крахмала смешивают с небольшим объемом дистиллированной воды, приливают к 100 мл кипящей дистиллированной воды и кипятят несколько минут. Консервирование проводят после охлаждения, добавляя хлороформ или 0,1 г салициловой кислоты;
8. буферный раствор рН 4,5:102 мл 1 молярной уксусной кислоты и 98 мл 1 молярного раствора уксуснокислого натрия вносят в колбу емкостью 1 л и доводят до метки дистиллированной водой.
9. колба коническая емкостью 500 мл;
Определение поправочного коэффициента. В коническую колбу помещают 0,5 г йодида калия, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (1:4), затем 10 мл 0,01 н раствора К2Сr27, добавляют 80 мл дистиллированной воды, закрывают колбу пришлифованной пробкой, перемешивают и ставят в темное место на 5 мин.
Титрование проводят 0,01 н. раствором тиосульфата натрия в присутствии 1 мл крахмала, прибавленного в конце титрования.
Поправочный коэффициент (К) вычисляют по формуле:
где а — количество тиосульфата натрия, израсходованное на титрование, в миллилитрах.
0,5 г йодида калия помещают в коническую колбу и растворяют в 1 — 2 мл дистиллированной воды, затем добавляют буферный раствор в количестве, примерно равном полуторной величине щелочности исследуемой воды, после чего добавляют 250 мл исследуемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия до появления светло-желтой окраски. Затем прибавляют 1 мл 0,5% раствора крахмала и титруют до исчезновения синей окраски.
Содержание суммарного остаточного хлора (X);в миллиграммах на литр вычисляют по формуле:
где а — количество 0,005 н раствора тиосульфата натрия, израсходованное на титрование, в миллилитрах;
К — поправочный коэффициент нормального раствора тиосульфата натрия;
0,177 — количество хлора, соответствующее 1 мл 0,0005 н. раствора тиосульфата натрия;
V — объем исследуемой воды, в миллилитрах.
Контрольные вопросы
1. Какие Вам известны обеззараживающие вещества при хлорировании?
2. Что называют остаточным активным хлором?
3. Каким образом можно удалить избыточный активный хлор?
4. Какие существуют недостатки у такого метода обеззараживания воды?
Лабораторная работа №2
Определение железа
Теоретическая часть
Подземные воды часто содержат повышенные концентрации железа, которое придает ей неприятный металлический привкус. Чаще всего железо в подземных водах содержится в истинно растворенном состоянии в виде бикарбоната железа Fе(НСО3)2. Такая вода после излива из скважины в первое время остается бесцветной и прозрачной, но при стоянии в открытом сосуде постепенно мутнеет за счет выделения осадка Fе(ОН)3, образующегося в результате гидролиза соли и одновременного окисления Fе 2+ кислородом воздуха:

В поверхностных водах железо может находиться в виде тонкодисперсной взвеси Fе(ОН)3 или в виде комплексных органических соединений. В первом случае оно хорошо удаляется при осветлении воды коагуляцией, во втором случае для разрушения органических комплексов требуются окислители более сильные, чем кислород. При подпитке водоносного горизонта водами болот или рек железо в подземных водах может также находиться в виде комплексных органических соединений. Во всех случаях повышение рН способствует более глубокому удалению железа, и в большинстве случаев оно может быть удалено известкованием.
Железо относится к жизненно необходимым элементам. Основные его функции в организме человека связаны с переносом кислорода и с участием десятков железосодержащих ферментов в окислительных процессах
При продолжительном поступлении в организм человека относительно высоких концентраций железа (ПДКхп= 0,3 мг/л) его избыток накапливается в печени в коллоидной форме оксида железа (гемосидерин), разрушающе действующего на ее клетки. Период полувыведения железа из организма человека достаточно длителен и составляет около 5,5 лет.
Вода с повышенным содержанием железа непригодна для ряда производств, так как ухудшает качество выпускаемой продукции (производство шелковых или хлопчатобумажных тканей, искусственных волокон, оргстекла и др.). В системах оборотного водоснабжения при подпитке свежей железосодержащей водой происходит окисление железа на градирнях или в брызгательных бассейнах с последующим его отложением на стенках труб и сооружений, что нарушает их нормальную работу и выводит из строя. В паровых котлах при их питании железосодержащей водой наблюдается быстрое образование железоокисных накипей. Отложение гидроксида железа (III) в катионообменных фильтрах вызывает значительное снижение их ионообменной емкости, а для успешной эксплуатации электродиализных установок требуется, чтобы содержание железа в воде не превышало сотых долей мг/л.
Промышленные методы обезжелезивания основаны на выделении железосодержащих осадков, в первую очередь Fе(ОН)3, и их последующем отделении фильтрованием. Многообразие методов обезжелезивания воды исключает их равноценность в отношении надежности, технологичности, экономической целесообразности, простоты, области применения и т. п. Обезжелезивание поверхностных вод возможно лишь реагентными методами (известкование, обработка коагулянтами), а для удаления железа из подземных вод наибольшее распространение получили безреагентные методы, в частности метод глубокой аэрации.


Принцип метода определения железа основан на взаимодействии окисного железа в сильно кислой среде с роданидом аммония, с образованием окрашенного в красный цвет соединения. Интенсивность окраски сравнивают со стандартным раствором железо-аммониевых квасцов.
Экспериментальная часть
Оборудование и реактивы:
1. Стандартный раствор железоаммониевых квасцов NНFе4•12Н20, содержащий в 1 мл 0,1 мг железа. Растворяют в мерной литровой колбе в небольшом количестве дистиллированной воды 0,8636 г перекристаллизованных железоаммониевых квасцов, добавляют несколько капель соляной кислоты (отн. плотность 1,19) до получения прозрачного раствора и доводят дистиллированной водой до метки.
2. Аммония роданид или калия, 50% раствор.
4. Соляная кислота (отн. плотность 1,19), свободная от железа.
источник
Настоящий документ устанавливает титриметрический метод определения содержания свободной углекислоты в пробах питьевых и природных вод в диапазоне измерений от 5,0 до 300 мг/дм 3 .
Метод определения содержания свободной углекислоты включает три этапа:
1) определение общей кислотности;
2) определение свободной кислотности;
3) определение кислотности, обусловленной слабыми нелетучими кислотами.
Содержание свободной углекислоты определяют по общей кислотности за вычетом свободной кислотности и кислотности, обусловленной слабыми нелетучими кислотами. Соотношение форм углекислоты от рН воды приведено в Приложении А.
В настоящем документе использованы ссылки на следующие стандарты:
ГОСТ 12.0.004-90 ССБТ. Организация обучения безопасности труда. Общие положения.
ГОСТ 12.1.004-91 ССБТ. Пожарная безопасность. Общие требования.
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности.
ГОСТ 12.4.009-83 ССБТ. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание.
ГОСТ 12.1.019-79 ССБТ. Электробезопасность. Общие требования и номенклатура видов защиты.
ГОСТ 12.4.021-75 ССБТ. Системы вентиляционные. Общие требования.
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия.
ГОСТ 4328-77 Натрия гидроокись. Технические условия.
ГОСТ 6709-72. Вода дистиллированная. Технические условия.
ГОСТ 9147-80 Посуда и оборудование фарфоровые. Технические условия.
ГОСТ 10733-98 Часы наручные и карманные механические. Общие технические условия.
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия.
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия.
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования.
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры.
ГОСТ 27752-88 Часы электронно-механические кварцевые настольные, настенные и часы будильники. Общие технические условия.
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические условия. Методы испытания.
ГОСТ 29251-91 Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования.
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб.
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецезионность) методов и результатов измерений. Часть 6. Использование значений точности на практике.
Весы лабораторные по ГОСТ 24104, с ценой деления не более 10 мг и наибольшим пределом взвешивания не менее 500 г.
Термометр стеклянный лабораторный по ГОСТ 28498 с ценой деления 2 °С, с диапазоном измерений от 0 до 150 °С.
РН-метр с погрешностью измерения не более ±0,1 ед. рН.
Бюретки по ГОСТ 29251, 2 класса точности, номинальной вместимостью 2, 5, 10, 25 см 3 .
Пипетки градуированные по ГОСТ 29227.
Колбы мерные по ГОСТ 1770, 2 класса точности.
Цилиндры с носиком 2 класса точности или мензурки по ГОСТ 1770.
Часы любого типа, например, по ГОСТ 10733 или ГОСТ 27752.
Шкаф сушильный общелабораторного назначения, обеспечивающий поддержание температуры (105 ± 5) °С.
Электроплитки с закрытой спиралью по ГОСТ 14919.
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Стаканчики для взвешивания по ГОСТ 25336.
Натрия гидроокись по ГОСТ 4328, ч.д.а. или стандарт-титр, например, по ТУ-2642-001-0750062
Соляная кислота стандарт-титр, например, по ТУ 6-09-2540.
Фенолфталеин (индикатор), например, по ТУ-6-09-5360.
Допускается использование средств измерений, вспомогательного оборудования и реактивов с метрологическими и техническими характеристиками не хуже указанных.
Общие требования к отбору проб по ГОСТ Р 51592 и ГОС Р 51593.
Для измерения содержания свободной углекислоты пробы воды отбирают в посуду из стекла или полимерных материалов вместимостью не менее 500 см 3 так, чтобы между слоем воды и пробкой не было воздушного пространства. Пробы не консервируют, к анализу приступают как можно быстрее, но не позднее, чем через 6 ч.
5.1 Приготовление растворов
5.1.1 Раствор гидроксида натрия молярной концентрации С (NaOH) = 15 моль/дм 3
Растворяют 625 г гидроксида натрия в 800 см 3 дистиллированной воды и оставляют раствор для осветления не менее, чем на 48 часов. Хранят раствор в плотно закрытом полиэтиленовом сосуде не более 6 мес.
5.1.2 Раствор гидроксида натрия молярной концентрации С (NaOH) = 0,1 моль/дм 3
Для приготовления 1 дм 3 раствора 6,6 см 3 раствора гидроксида натрия, приготовленного по 5.1.1, вносят в мерную колбу вместимостью 1 дм 3 и доводят до метки прокипяченной дистиллированной водой. Раствор хранят в сосуде с закрытой пробкой с хлор-кальциевой трубкой. Срок хранения — не более 1 мес. с еженедельным определением титра раствора.
В случае применения стандарт-титра (фиксанала) раствор готовят в соответствии с инструкцией по приготовлению. Раствор хранят в плотно закрытом полиэтиленовом сосуде. Срок хранения — не более 1 мес.
Поправочный коэффициент устанавливают по раствору соляной кислоты молярной концентрации С (НСl) = 0,1 моль/дм 3 .
5.1.3 Раствор гидроксида натрия молярной концентрации С (NaOH) = 0,01 моль/дм 3
Для приготовления 1 дм 3 раствора 100 см 3 раствора гидроксида натрия, приготовленного по п. 5.1.2, вносят в мерную колбу вместимостью 1 дм 3 и доводят до метки прокипяченной дистиллированной водой.
Поправочный коэффициент устанавливают по раствору соляной кислоты молярной концентрации С (НСl) = 0,01 моль/дм 3 .
Хранят раствор в плотно закрытом полиэтиленовом сосуде. Срок хранения — не более 7 сут.
5.1.4 Раствор соляной кислоты молярной концентрации С (НСl) = 0,1 моль/дм 3
Раствор готовят из стандарт-титра (фиксанала) в соответствии с инструкцией по приготовлению. Раствор хранят в плотно закрытом стеклянном сосуде. Срок хранения — не более 6 мес.
5.1.5 Раствор соляной кислоты молярной концентрации С (НСl) = 0,01 моль/дм 3
Для приготовления 1 дм 3 раствора 100 см 3 раствора соляной кислоты, приготовленного по п. 5.1.4, вносят в мерную колбу вместимостью 1 дм 3 и доводят до метки прокипяченной дистиллированной водой. Срок хранения — не более 3 мес.
5.1.6 Раствор гидроксида натрия молярной концентрации С (NaOH) = 0,02 моль/дм 3
Для приготовления 1 дм 3 раствора 200 см 3 раствора гидроксида натрия, приготовленного по п. 5.1.2, помещают в мерную колбу вместимостью 1 дм 3 и доводят дистиллированной прокипяченной водой до метки. Хранят раствор в плотно закрытом полиэтиленовом сосуде. Срок хранения — не более 7 сут.
5.1.7 Приготовление индикаторов
5.1.7.1 Раствор метилового оранжевого
Для приготовления 1 дм 3 раствора 0,5 г метилового оранжевого растворяют в небольшом количестве дистиллированной воды, количественно переносят в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой. Срок хранения — не более 6 мес.
5.1.7.2 Раствор фенолфталеина
0,5 г фенолфталеина растворяют в 50 см 3 96 % этилового спирта и добавляют 50 см 3 дистиллированной воды. В раствор по каплям добавляют раствор гидрооксида натрия, приготовленный по 5.1.6, до появления слабой розовой окраски. Срок хранения — не более 1 года.
5.2 Установление поправочных коэффициентов растворов гидроксида натрия
В коническую колбу вместимостью 250 см 3 наливают 70 ÷ 80 см 3 прокипяченной дистиллированной воды, 10 см 3 соляной кислоты (VHCL), см 3 , добавляют 3 — 5 капель раствора фенолфталеина и титруют раствором гидроксида натрия, (VNaOH), см 3 , до бледно-розового окрашивания, не исчезающего в течение 10 ÷ 30 с. Титрование повторяют 1 — 3 раза. Из полученных результатов берут среднее. Поправочный коэффициент раствора гидроксида натрия вычисляют по формуле:
Значение поправочного коэффициента должно быть равным (1,00 ± 0,03). Если поправочный коэффициент выходит из указанных пределов, то раствор гидроксида натрия, соответственно, укрепляют или разбавляют. Поправочный коэффициент устанавливают при приготовлении растворов гидроксида натрия, но не реже 1 раза в неделю.
6.1 Определение общей кислотности
В коническую колбу вместимостью 250 см 3 помещают мензуркой или цилиндром 100 см 3 исследуемой пробы, добавляют 5 ÷ 10 капель раствора фенолфталеина и титруют раствором гидроксида натрия, приготовленным по 5.1.2 или 5.1.3, до появления слаборозовой окраски, не исчезающей в течение 2 ÷ 3 мин.
Конечную точку титрования можно определить потенциометрически, проводя титрование до получения устойчивого значения рН = (8,3 ± 0,1).
Если при добавлении фенолфталеина к исследуемой пробе раствор сразу приобретает розовую окраску, отмечают, что углекислота отсутствует.
При необходимости определение общей кислотности повторяют следующим образом: в коническую колбу вместимостью 250 см 3 помещают 5 ÷ 10 капель раствора фенолфталеина, почти весь объем титрованного раствора гидроксида натрия, затем 100 см 3 исследуемой пробы, после чего дотитровывают по каплям до устойчивого розового окрашивания, либо до рН (8,3 ± 0,1) при потенциометрическом титровании.
6.2 Определение свободной кислотности
В коническую колбу вместимостью 250 см 3 помещают мензуркой или цилиндром 100 см 3 исследуемой воды, добавляют 3 капли раствора метилового оранжевого и титруют раствором гидроксида натрия, приготовленным по 5.1.2 или 5.1.3 до перехода окраски в золотисто-розовую.
Конечную точку титрования можно определить потенциометрически, проводя титрование до получения устойчивого значения рН = (4,5 ± 0,1).
Если при добавлении раствора метилового оранжевого к исследуемой пробе раствор становится желтым, отмечают, что свободная кислотность отсутствует (значение содержания свободной кислотности равно нулю).
6.3 Определение кислотности, обусловленной слабыми нелетучими кислотами
Оттитрованную по 6.2 пробу воды кипятят в течение 2 мин для удаления свободной двуокиси углерода, быстро охлаждают, добавляют 5 ÷ 10 капель раствора фенолфталеина и титруют раствором гидроксида натрия, приготовленным по 5.1.2 или 5.1.3, до появления устойчивого слабо-розового окрашивания. Конечную точку титрования можно определить потенциометрически, проводя титрование до получения устойчивого значения рН = (8,3 ± 0,1).
7.1 Значение общей кислотности, соб ммоль/дм 3 , вычисляют по формуле:
где С — молярная концентрация раствора гидроксида натрия, моль/дм 3 ;
K — поправочный коэффициент раствора гидроксида натрия;
VToб — объем раствора гидроксида натрия, пошедшего на титрование, см 3 ;
1000 — коэффициент массового пересчета;
V — объем пробы, взятой для определения, см 3 .
7.2 Значение свободной кислотности, ссв, ммоль/дм 3 , вычисляют по формуле:
где С — молярная концентрация раствора гидроксида натрия, моль/дм 3 ;
K — поправочный коэффициент раствора гидроксида натрия;
VTcв — объем раствора гидроксида натрия, пошедшего на титрование, см 3 ;
1000 — коэффициент массового пересчета;
V — объем пробы, взятой для определения, см 3 .
7.3 Значение кислотности, обусловленной слабыми нелетучими кислотами, сснк, ммоль/дм 3 , вычисляют по формуле:
где С — молярная концентрация раствора гидроксида натрия, моль/дм 3 ;
K — поправочный коэффициент раствора гидроксида натрия;
VTснк — объем раствора гидроксида натрия, пошедшего на титрование, см 3 ;
1000 — коэффициент массового пересчета;
V — объем пробы, взятой для определения, см 3 .
7.4 Значение содержания свободной углекислоты, у, мг/дм 3 , вычисляют по формуле:
где 44 — коэффициент пересчета.
7.5 При необходимости проверки приемлемости результатов измерения в условиях повторяемости (например, по требованию заказчика или в случае анализа сложных проб) получают два результата измерений содержания свободной углекислоты в пробах природных и питьевых вод по разделу 6 в условиях повторяемости.
Проверяют приемлемость результатов измерений, сравнивания расхождение между ними с пределом повторяемости (r для n = 2, таблица 2). Если полученное значение расхождения не превышает предела повторяемости, то за результат измерений содержания свободной углекислоты в пробе принимают среднее из двух полученных значений. В противном случае процедуру повторяют.
Результаты измерений содержания свободной углекислоты в анализируемой пробе в документах, предусматривающих их использование, представляют в виде:
где U — расширенная неопределенность, вычисленная по формуле:
где 
Настоящая методика выполнения измерений обеспечивает получение результатов с расширенной неопределенностью, значения которой приведены в таблице 1.
Диапазон измерений содержания свободной углекислоты, у, мг/дм 3
Суммарная стандартная неопределенность, 
Расширенная неопределенность, k = 2, 
Контроль стабильности результатов измерений в лаборатории осуществляют, используя методы контроля стабильности стандартного отклонения повторяемости. Для этого используют приведенные к среднему значению результатов анализа значения расхождений (w‘) полученных результатов единичных измерений с1 и с2, которые сравнивают с рассчитанными при построений контрольных карт пределами предупреждения и действия
где UCL — пределы действия, UCLд = 3,686σr или
где σr — стандартное отклонение повторяемости результатов для значения у численно равного 1. Значение стандартного отклонения повторяемости приведено в таблице 2.
Диапазон измерений содержания свободной углекислоты, мг/дм 3
Стандартное отклонение повторяемости, σ r , %
Предел повторяемости, r , % ( n = 2)
Пример. За три дня получены результаты параллельных определений: 5,2 и 6,3 мг/дм 3 ; 23 и 25 мг/дм 3 ; 34 и 36 мг/дм 3 .
Значения расхождений наносят на контрольную карту.
Для расчета UCLп и UCLд из таблицы 2 берут σr = 9 %.
Расчет UCLп = 2,834∙0,09 = 0,26; UCLд = 3,686∙0,09 = 0,33, где 0,09 — абсолютное значение σr = 9 % для у = 1.
При неудовлетворительных результатах контроля, например, превышение предела действия или регулярное превышение предела предупреждения, выясняют причины этих отклонений, в том числе проверяют работу оператора.
Периодичность проведения контроля стабильности результатов измерений устанавливают индивидуально для каждой лаборатории в соответствии с документами по внутрилабораторному контролю качества результатов анализа.
После внедрения МВИ в практику работы лаборатории при необходимости проверки приемлемости результатов измерений, полученных в условиях воспроизводимости, проводят межлабораторные сравнительные испытания с использованием данной методики для оценки стандартного отклонения воспроизводимости. Для расчета стандартного отклонения воспроизводимости используют ГОСТ Р ИСО 5725-2-2002, пункт 7.4. Проверку приемлемости результатов измерений в условиях воспроизводимости осуществляют по ГОСТ Р ИСО 5725-6-2002, пункт 5.3.
При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 и ГОСТ 12.4.021.
При работе с электроустановками должны соблюдаться требования по электробезопасности по ГОСТ 12.1.019.
Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Исполнители должны быть проинструктированы о мерах безопасности при работе с нагревательными приборами. Организация обучения работающих безопасности труда производится по ГОСТ 12.0.004.
Измерения по методике может выполнять лаборант, имеющий навыки работы в химической лаборатории и освоивший данную методику.
При подготовке к выполнению измерений и при их проведении необходимо соблюдать условия, установленные в руководстве по эксплуатации или паспортах средств измерений и вспомогательных устройств. Измерение объема воды производится при температуре от 15 до 25 °С.
Рисунок 1А
Соотношения форм производных угольной кислоты от рН воды.
В зависимости от рН воды углекислота встречается в ней в свободном состоянии в виде углекислого газа СО2, в виде бикарбонат-ионов НСО — 3 и карбонат-ионов СО 2- 3. При рН — 3 и при рН выше 10,5 — только ионы СО 2- 3.
Находящиеся в воде ионы НСО — 3, СО 2- 3 и углекислый газ связаны углекислотным равновесием
Часть свободной углекислоты, находящаяся в равновесии с бикарбонатами, называется равновесной. Она как бы связана с бикарбонатами и поэтому не вступает в химические реакции. Избыточная свободная (или иначе агрессивная) углекислота в отличие от равновесной является очень активной и реакционно-способной.
В водах открытых водоемов вследствие низкого содержания углекислоты в воздухе наличие агрессивной углекислоты маловероятно. В подземных водах содержание агрессивной углекислоты иногда бывает довольно значительным.
Центр Исследования и Контроля Воды
аккредитован в Системе аккредитации аналитических лабораторий (центров)
Госстандарта России, № Госреестра РОСС RU.0001.510045
Метрологическая служба аккредитована на право аттестации методик выполнения
измерений и проведения метрологической экспертизы документов, в том числе
применяемых в сферах распространения государственного метрологического
контроля и надзора,
№ Госреестра 01.00031-2002
195009, Санкт-Петербург, ул. Комсомола, 9
Факс (812) 542-72-38
о метрологической аттестации
методики выполнения измерений содержания свободной углекислоты
в пробах питьевых и природных вод
Методика выполнения измерений содержания свободной углекислоты в пробах питьевых и природных вод,
разработанная Центром исследования и контроля воды,
регламентированная в документе:
«Качество воды. Методика выполнения измерений содержания свободной углекислоты в пробах питьевых и природных вод. Титриметрический метод. ЦВ 1.01.17-2004»
аттестована в соответствии с ГОСТ Р 8.563-96.
Аттестация осуществлена по результатам экспериментального исследования МВИ и метрологической экспертизы материалов по ее разработке.
В результате аттестации установлено, что МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Диапазон измерений содержания свободной углекислоты, у, мг/дм 3
Суммарная стандартная неопределенность, 
Расширенная неопределенность, вычисленная с применением коэффициента охвата k = 2, 
Дата выдачи свидетельства 22 октября 2004 года
источник