Настоящий документ устанавливает фотометрическую методику количественного химического анализа проб природных и очищенных сточных вод для определения в них ионов свинца при массовой концентрации от 0,002 до 0,03 мг/дм 3 .
Если массовая концентрация ионов свинца в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы концентрация ионов свинца соответствовала регламентированному диапазону.
Мешающие влияния, обусловленные присутствием в пробе органических веществ, ионов меди, цинка, кадмия, никеля, серебра, ртути, висмута устраняются специальной подготовкой пробы к анализу (п. 9).
Фотометрический метод определения массовой концентрации ионов свинца основан на взаимодействии свинца с дифенилтиокарбазоном (дитизоном) в четыреххлористом углероде с образованием комплексного соединения, окрашенного в красный цвет. Оптическую плотность раствора комплексного соединения измеряют при l = 520 нм.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Значения показателей точности, повторяемости и воспроизводимости методики
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± d , %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) s r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), s R, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоколориметр, позволяющий измерять оптическую плотность при длине волны l = 520 нм
Кюветы с толщиной поглощающего слоя 20 мм
Весы лабораторные 2 класса точности, ГОСТ 24104
ГСО с аттестованным содержанием ионов свинца
Воронки делительные ВД-3-1000 ХС, ГОСТ 25336.
Колбы конические Кн-1-1000-29/32, ГОСТ 25336.
Холодильники ХШ-1-200-29/32 ХС, ГОСТ 25336.
Бумага универсальная индикаторная, ТУ-6-09-1181.
Баня водяная, ТУ 46-22-606-75.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб и реактивов.
Феноловый красный, ГОСТ 4599.
Четыреххлористый углерод, ГОСТ 20288 (продажный реактив перегоняют, собирая фракцию, кипящую при 76 °С).
Натрий лимоннокислый, ТУ 6-09-2248-78.
Калий железистосинеродистый трехводный, ГОСТ 4207. ( * )
Аскорбиновая кислота, ГОСТ 4815. ( * )
Вес реактивы должны быть квалификации х.ч. или ч.д.а.
4.1 . При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 .
4.2 . Электробезопасность при работе с электроустановками по ГОСТ 12.1.019 .
4.3 . Организация обучения работающих безопасности труда по ГОСТ 12.0.004 .
4.4 . Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009 .
Выполнение измерений может производить химик аналитик, владеющий техникой экстракционно-фотометрического анализа и изучивший инструкцию по эксплуатации спектрофотометра или фотоколориметра.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм. рт. ст);
относительная влажность (80 ± 5) %;
напряжение сети (220 ± 10) В;
частота переменного тока (50 ± 1) Гц.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб». ( * )
7.1 . Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, обрабатывают хромовой смесью, тщательно промывают водопроводной, затем 3 — 4 раза дистиллированной водой.
7.2 . Пробы воды (объем не менее 1000 см 3 ) отбирают в полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
7.3 . Пробы анализируют не позднее, чем через 2 часа после отбора или консервируют следующим образом: к пробе добавляют 3 см 3 концентрированной HN О3 на 1 дм 3 воды, или 3 см 3 ледяной уксусной кислоты на 1 дм 3 воды. Срок хранения законсервированной пробы — 1 месяц.
Если требуется определить свинец в растворенной форме, пробу фильтруют через бумажный фильтр «синяя лента» до консервирования ( * ) .
7.4 . Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку прибора к работе и оптимизацию условий измерения производят в соответствии с рабочей инструкцией по эксплуатации прибора. Прибор должен быть поверен.
Дважды перегоняют воду в приборе из стекла, не содержащего свинца, и проверяют ее на отсутствие свинца раствором дитизона.
300 — 500 см 3 воды встряхивают с 20 см 3 раствора дитизона (по п. 8.2.9 ). Процедуру повторяют до тех пор пока цвет дитизона не будет оставаться зеленым. Избыток дитизона удаляют встряхиванием бидистиллированной воды с четыреххлористым углеродом. Дитизон считают полностью удаленным, если после очередного встряхивания слой растворителя остается бесцветным.
Для приготовления всех реактивов и растворов используют эту воду.
0 ,1 г индикатора растворяют в 100 см 3 20 %-ного раствора спирта-ректификата.
100 г натрия лимоннокислого растворяют в небольшом количестве воды, помещают в мерную колбу на 500 см 3 и доводят до метки бидистиллированной водой.
Очищают от микроэлементов экстракцией в делительной воронке раствором дитизона (по п. 8.2.9.) порциями по 5 — 10 см 3 до прекращения окраски дитизона. Продолжительность каждой экстракции 1 мин. После этого из раствора извлекают остатки дитизона экстракцией четыреххлористым углеродом порциями по 10 см 3 до полного удаления дитизона, т.е. пока очередная порция четыреххлористого углерода не станет бесцветной. Продолжительность каждой экстракции 1 мин.
500 см 3 соляной кислоты осторожно приливают к 500 см 3 бидистиллированной воды.
8.2.4 . Калий железистосинеродистый ( * ) , водный раствор.
Навеску (1 г) калия железистосинеродистого ( * ) помещают в мерную колбу на 50 см 3 , растворяют в небольшом количестве воды, перемешивают и доводят до метки бидистиллированной водой.
Навеску (10 г) гидроксиламина солянокислого помещают в мерную колбу на 500 см 3 , растворяют в небольшом количестве воды, перемешивают и доводят до метки бидистиллированной водой.
Раствор очищают экстракцией раствором дитизона (по п. 8.2.9.) порциями по 5 — 10 см 3 до прекращения изменения окраски дитизона. Продолжительность каждой экстракции 1 мин. После этого из раствора извлекают остатки дитизона экстракцией четыреххлористым углеродом порциями по 10 см 3 до полного удаления дитизона, т.е. пока очередная порция четыреххлористого углерода не станет бесцветной. Продолжительность каждой экстракции 1 мин.
8.2.6 . Приготовление основного градуировочного раствор свинца.
Раствор готовят из ГСО с аттестованным содержанием свинца в соответствии с прилагаемой к образцу инструкцией.
Раствор устойчив в течение года и хранится в склянке с притертой пробкой при комнатной температуре.
1 см 3 раствора должен содержать 0,1 мг свинца.
8.2.7 . Приготовление рабочего градуировочного раствора свинца.
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 100 раз бидистиллированной водой.
1 см 3 раствора должен содержать 0,001 мг свинца.
8.2.8 . Приготовление основного раствора дитизона.
0 ,05 г дитизона очищенного (см. приложение) растворяют в 500 см 3 четыреххлористого углерода. Раствор хранят в темной склянке при 3 — 5 °С в течение нескольких месяцев.
8.2.9 . Приготовление рабочего раствора дитизона.
25 см 3 основного раствора дитизона разбавляют четыреххлористым углеродом и объём доводят до 250 см 3 . Измеряют оптическую плотность полученного раствора ( l = 520 нм, кювета 20 мм) против четыреххлористого углерода. Прибавляя в колбу по каплям раствор дитизона (по п. 8.2.8) или четыреххлористого углерода, устанавливают оптическую плотность, равную 0,350. Раствор готовят в день определения и хранят в темной склянке ( * ) .
8.2.10 . Приготовление раствора аммиака, 17 %-ный раствор.
Раствор получают путем изопиестической дистилляции концентрированного раствора аммиака. Для этого на дно эксикатора наливают 1 дм 3 концентрированного аммиака, а на вкладыш ставят выпарительную чашку с 500 см 3 бидистиллированной воды. Через двое суток аммиак, полученный в чашке, будет иметь концентрацию примерно 17 %.
Для построения градуировочного графика необходимо приготовить образцы для градуировки определяемого компонента с концентрациями 0,002 — 0,03 мг/дм 3 . Условия анализа, его проведение должны соответствовать описанным в пунктах 6 и 9.
Состав и количество образцов для градуировки для построения градуировочного графика приведены в таблице 2. Погрешность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,8 %.
Состав и количество образцов для градуировки при анализе свинца
Массовая концентрация свинца в градуировочных растворах, мг/дм 3
Аликвотная часть рабочего раствора с концентрацией 0,001 мг/см 3 , помещенного в мерную колбу на 500 см 3
В качестве холостой пробы используют бидистиллированную воду (п. 8.2), которую проводят через весь ход анализа ( * ) .
Растворы готовят в мерных колбах вместимостью 500 см 3 . Полученные растворы переносят в конические колбы со шлифом емкостью 1 дм 3 , подкисляют 10 см 3 раствором соляной кислоты (по п. 8.2.3), прибавляют по 0,5 г персульфата аммония, вставляют в горла колб пробки-холодильники. Кипятят в течение 20 минут. Далее поступают как указано в п. 9.
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных. Из оптической плотности каждого градуировочного раствора вычитают оптическую плотность холостой пробы ( * ) .
Строят градуировочный график в координатах оптическая плотность — концентрация в мг/дм 3 .
Контроль стабильности градуировочной характеристики проводят не реже одного раза в месяц или при смене партии реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в таблице 2).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где Х — результат контрольного измерения массовой концентрации ионов свинца в образце для градуировки;
С — аттестованное значение массовой концентрации ионов свинца в образце для градуировки;
s Rл— среднеквадратическое отклонение внутрилабораторной прецизионности, установленное при реализации методики в лаборатории.
Примечание. Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: s Rл = 0,84 s R, с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Значения s R приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
0 ,5 дм 3 исследуемой воды, предварительно подкисленной (20 см 3 соляной кислоты по п. 8.2.3 на 1 дм 3 пробы), помещают в колбу на 1 дм 3 , прибавляют 0,5 г персульфата аммония и, вставив в горло колбы пробку-холодильник, кипятят на медленном огне в течение 20 мин., после чего пробу охлаждают под струей воды.
К охлажденной пробе приливают
15 см 3 аммиака (по п. 8.2.10), затем по каплям доводят кислотность среды до рН = 2 (контроль по универсальной индикаторной бумаге). Пробу переносят в делительную воронку емкостью 1 дм 3 и экстрагируют 10 см 3 раствора дитизона (по п. 8.2.9 ) в течение 2 минут. После расслоения водной и органической фаз экстракт сливают и отбрасывают. Повторяют экстракцию до тех пор, пока слой органического растворителя не перестанет изменять окраску.
К очищенной пробе прибавляют 5 — 6 капель раствора фенолового красного (по п. 8.2.1) и, приливая по каплям аммиак (по п. 8.2.10), нейтрализуют пробу до оранжевой окраски (рН = 6,8 — 7,3). Затем приливают 5 см 3 раствора калия железистосинеродистого ( * ) (по п. 8.2.4), 5 см 3 раствора солянокислого гидроксиламина (по п. 8.2.5), 5 см 3 раствора лимоннокислого натрия (по п. 8.2.2) и встряхивают содержимое воронки в течение 30 сек. Затем прибавляют по каплям аммиак (по п. 8.2.10) до появления малиновой окраски и избыток
5 капель (рН = 8,0 — 8,5). Приливают 10 см 3 раствора дитизона (по п. 8.2.9) и экстрагируют свинец в течение 2 минут. После расслоения сливают окрашенный слой органического растворителя в кювету, фильтруя его через воронку с небольшим слоем ваты. Измеряют оптическую плотность раствора при длине волны l = 520 нм в кювете с толщиной слоя 20 мм против четыреххлористого углерода. Вычитают оптическую плотность холостой пробы (см. п. 8.3) ( * ) . Содержание свинца находят по градуировочному графику.
Содержание ионов свинца (мг/дм 3 ) рассчитывают по формуле
где С — концентрация свинца, найденная по градуировочному графику, мг/дм 3 ;
500 — объем, до которого была разбавлена проба, см 3 ;
V — объем, взятый для анализа, см 3 .
За результат анализа Хсрпринимают среднее арифметическое значение двух параллельных определений Х1и Х2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
Значения предела повторяемости вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (1) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-3.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
11.1 . Результат анализа X ср в документах, предусматривающих его использование, может быть представлен в виде: Хср± D , Р = 0,95,
где D — показатель точности методики.
Значение D рассчитывают по формуле: D = 0,01 × d × Хср . Значение d приведено в таблице 1.
Допустимо результат анализа в документах, выдаваемых лабораторией, представлять в виде: Хср± D л , Р = 0,95, при условии D л D ,
где Хср— результат анализа, полученный в соответствии с прописью методики;
± D л — значение характеристики погрешности результатов анализа, установленное при реализации методики в лаборатории и обеспечиваемое контролем стабильности результатов анализа.
Примечание. При представлении результата анализа в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата анализа;
— способ определения результата анализа (среднее арифметическое значение или медиана результатов параллельных определений).
11.2 . В том случае, если массовая концентрация ионов свинца в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы массовая концентрация ионов свинца соответствовала регламентированному диапазону.
Результат анализа Хсрв документах, предусматривающих его использование, может быть представлен в виде: Хср± D ’, Р = 0,95,
где ± D ’ — значение характеристики погрешности результатов анализа, откорректированное на величину погрешности взятия аликвоты.
11.3 . Если массовая концентрация ионов свинца в анализируемой пробе ниже минимально определяемой по методике концентрации, то допускается концентрирование. В этом случае одновременно с анализируемой пробой ведут анализ аттестованного (стандартного) раствора с содержанием ионов свинца, соответствующим содержанию их в исходной рабочей пробе. Результат анализа исходной рабочей пробы признают удовлетворительным, если выполняется следующее условие:
где X — результат контрольного измерения массовой концентрации ионов свинца в образце для контроля (стандартном растворе);
С — аттестованное значение массовой концентрации ионов свинца в образце для контроля (стандартном растворе);
К — норматив оперативного контроля процедуры анализа.
D ” — значение характеристики погрешности результатов анализа, откорректированное на величину концентрирования пробы.
Контроль качества результатов анализа при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры анализа (на основе оценки погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов анализа (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
12.1 . Алгоритм оперативного контроля процедуры анализа с использованием метода добавок
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры Ккс нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
где Х ¢ ср — результат анализа массовой концентрации ионов свинца в пробе с известной добавкой — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 10;
Хср — результат анализа массовой концентрации ионов свинца в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 10.
Норматив контроля К рассчитывают по формуле
где 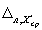
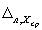
Примечание. Допустимо характеристику погрешности результатов анализа при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 · D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Процедуру анализа признают удовлетворительной, при выполнении условия:
При невыполнении условия (2) контрольную процедуру повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
12.2 . Алгоритм оперативного контроля процедуры анализа с применением образцов для контроля
Оперативный контроль процедуры анализа проводят путем сравнения результата отдельно взятой контрольной процедуры Ккс нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
где C ср — результат анализа массовой концентрации ионов свинца в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (1) раздела 10;
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле:
где ± D л — характеристика погрешности результатов анализа, соответствующая аттестованному значению образца для контроля.
Примечание. Допустимо характеристику погрешности результатов анализа при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 · D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Процедуру анализа признают удовлетворительной, при выполнении условия:
При невыполнении условия (3) контрольную процедуру повторяют. При повторном невыполнении условия (3) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Периодичность оперативного контроля процедуры анализа, а также реализуемые процедуры контроля стабильности результатов анализа регламентируют в Руководстве по качеству лаборатории.
В 100 см 3 четыреххлористого углерода растворяют 1,0 г дитизона. Раствор переносят в делительную воронку на 500 см 3 , приливают 100 см 3 раствора аммиака (1 см 3 концентрированного аммиака, разбавленного до 100 см 3 бидистиллированной водой) и 5 см 3 5 %-ного раствора аскорбиновой кислоты. Содержимое воронки встряхивают в течение 2 мин. После расслоения жидкости органический слой сливают в чистую делительную воронку. Водный раствор дитизона фильтруют в колбу на 1 дм 3 через бумажный фильтр, предварительно промытый раствором соляной кислоты (1:20) и бидистиллированной водой. К органическому раствору дитизона приливают новую порцию раствора аммиака и раствора аскорбиновой кислоты, и содержимое воронки встряхивают в течение 2 мин. Операцию очистки дитизона повторяют 5 — 6 раз до тех пор, пока водно-аммиачный раствор не будет окрашиваться в оранжевый цвет. Все порции водного раствора дитизона фильтруют в колбу на 1 дм 3 . Приливают соляную кислоту (1:1) до выпадения дитизона в осадок. При этом водный слой приобретает бледно-зеленоватый цвет. Осадок фильтруют через бумажный фильтр, промывают 3 раза 1 %-ным раствором аскорбиновой кислоты и сушат на воздухе. Дитизон хранят в темном месте.
источник
Свинец является природным минералом, встречающимся в различных рудах и минеральных отложениях. Хотя он является одним из важных среди минералов, но в то же время он является глобальным загрязнителем экологии.
Как свинец может оказаться в воде?
Способов оказаться в воде у свинца множество. Он и его различные соединения могут оказаться в водоемах посредством выпадения осадков, которые вымывают породы и почву. Но основная причина попадания свинца в воду кроется в деятельности человека. Промышленные предприятия, предприятия, связанные с горно-обогатительной деятельностью, зачастую осуществляют выбросы своего производства в природу, вследствие чего свинец совместно со стоками предприятий оказывается в водоемах. Широкое применение тетраэтиленсвинца в производстве автомобильного топлива, гальванических элементов, сжигание угля и различные бытовые отходы являются самыми распространенными способами распространения тяжелых металлов в открытых водоемах и грунтовых водах.
До сих пор можно обнаружить свинец в воде, подающейся в дома централизовано. В старых домах нередко можно встретить трубопроводы или его элементы, изготовленные из свинца, который в процессе коррозии поверхности труб попадает в краны. В одной из следующих статей мы более подробно рассмотрим вопрос о существующих в наше время свинцовых трубопроводов.
Какую опасность несет наличие свинца в воде?
Согласно требованиям Санитарных норм, количество свинца и его соединений не может быть выше 0,03 мг/л. Но даже очень небольшое количество свинца в воде, при постоянном ее употреблении опасно для здоровья человека. Так как он очень токсичен и обладает способностью накапливаться в различных органах нашего организма, то в результате чего могут возникнуть тяжелейшие отравления всего организма.
Первые признаки отравление свинцом сопровождаются бессонницей, вялостью, головной болью, головокружением, тошнотой, депрессией, слабостью в конечностях, снижением аппетита и другими малоприятными симптомами. Если игнорировать появление этих признаков интоксикации и вовремя не обратиться к врачу, то вполне возможно появление нарушений в речевом аппарате, судороги, боль в мышцах и нарушение координации. Дальнейшая интоксикация организма свинцом может привести к смертельному исходу.
При хронической форме интоксикации его соединениями могут развиться такие болезни, как энцефалопатия, при которой происходит повреждения коры головного мозга, кислородное голодание тканей, поражение почек, бесплодие. Свинец обладает негативным фактором, заключающимся в блокировании выработки нашим организмом витамина Д и препятствует усвоению из пищи кальция. Имея способность скапливаться в костях, он является виновником повышенной ломкости костей, зубов, ногтей и волос.
Особо опасно наличие свинца и его соединений в воде для беременных женщин и детей. Научные исследования доказали, что он отрицательно влияет на развитие плода в утробе матери, а также отрицательно сказывается на умственном развитии ребенка.
Поэтому не стоит пренебрегать очисткой воды от различных ядовитых веществ, которых не определить на вид, но которые могут принести огромный вред нашему здоровью. Определить наличие свинца в воде и его концентрацию можно только в лабораторных условиях, при проведении исследования пробы воды. Избавиться от наличия свинца в питьевой воде можно, если установить в доме систему обратного осмоса.
источник
ПНД Ф 14.1;2.54-96 Количественный химический анализ вод. Методика выполнения измерений массовой концентрации свинца в природных и очищенных сточных водах
МИНИСТЕРСТВО ОХРАНЫ ОКРУЖАЮЩЕЙ СРЕДЫ И ПРИРОДНЫХ
РЕСУРСОВ РОССИЙСКОЙ ФЕДЕРАЦИИ
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
МАССОВОЙ КОНЦЕНТРАЦИИ
СВИНЦА В ПРИРОДНЫХ И ОЧИЩЕННЫХ
СТОЧНЫХ ВОДАХ ФОТОМЕТРИЧЕСКИМ
МЕТОДОМ С ДИТИЗОНОМ
Методика допущена для целей государственного экологического контроля
Методика рассмотрена и одобрена Главным управлением аналитического контроля и метрологического обеспечения природоохранной деятельности (ГУАК) и Главным метрологом Минприроды РФ.
В соответствии с требованиями ГОСТ Р ИСО 5725-1-2002 ? ГОСТ Р ИСО 5725-6-2002 и на основании свидетельства о метрологической аттестации № 224.01.03.028/2004 в МВИ внесены изменения (Протокол № 1 заседания НТС ФГУ «ФЦАМ» МПР России от 03.03.2004).
Настоящий документ устанавливает фотометрическую методику количественного химического анализа проб природных и очищенных сточных вод для определения в них ионов свинца при массовой концентрации от 0,002 до 0,03 мг/дм 3 .
Если массовая концентрация ионов свинца в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы концентрация ионов свинца соответствовала регламентированному диапазону.
Мешающие влияния, обусловленные присутствием в пробе органических веществ, ионов меди, цинка, кадмия, никеля, серебра, ртути, висмута устраняются специальной подготовкой пробы к анализу (п. 9).
Фотометрический метод определения массовой концентрации ионов свинца основан на взаимодействии свинца с дифенилтиокарбазоном (дитизоном) в четыреххлористом углероде с образованием комплексного соединения, окрашенного в красный цвет. Оптическую плотность раствора комплексного соединения измеряют при l = 520 нм.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Значения показателей точности, повторяемости и воспроизводимости методики
Диапазон измерений, мг/дм 3
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± d, %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) sr, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), sR, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоколориметр, позволяющий измерять оптическую плотность при длине волны l = 520 нм
Кюветы с толщиной поглощающего слоя 20 мм
Весы лабораторные 2 класса точности, ГОСТ 24104
ГСО с аттестованным содержанием ионов свинца
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Воронки В-25-38 ХС, ГОСТ 25336.
Воронки делительные ВД-3-1000 ХС, ГОСТ 25336.
Бюретка 1(2)-2-25-0,1 ГОСТ 29251 ( * ) .
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Колбы конические Кн-1-1000-29/32, ГОСТ 25336.
Холодильники ХШ-1-200-29/32 ХС, ГОСТ 25336.
Бумага универсальная индикаторная, ТУ-6-09-1181.
Баня водяная, ТУ 46-22-606-75.
Выпарительная чаша № 8, ГОСТ 9147.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб и реактивов.
Феноловый красный, ГОСТ 4599.
Аммоний надсернокислый, ГОСТ 20478.
Гидроксиламина гидрохлорид, ГОСТ 5456.
Четыреххлористый углерод, ГОСТ 20288 (продажный реактив перегоняют, собирая фракцию, кипящую при 76 °С).
Натрий лимоннокислый, ТУ 6-09-2248-78.
Соляная кислота, ГОСТ 3118.
Калий железистосинеродистый трехводный, ГОСТ 4207. ( * )
Аскорбиновая кислота, ГОСТ 4815. ( * )
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Вода дистиллированная, ГОСТ 6709.
Вес реактивы должны быть квалификации х.ч. или ч.д.а.
4.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
4.2. Электробезопасность при работе с электроустановками по ГОСТ 12.1.019.
4.3. Организация обучения работающих безопасности труда по ГОСТ 12.0.004.
4.4. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Выполнение измерений может производить химик аналитик, владеющий техникой экстракционно-фотометрического анализа и изучивший инструкцию по эксплуатации спектрофотометра или фотоколориметра.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм. рт. ст);
относительная влажность (80 ± 5) %;
напряжение сети (220 ± 10) В;
частота переменного тока (50 ± 1) Гц.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб». ( * )
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
7.1. Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, обрабатывают хромовой смесью, тщательно промывают водопроводной, затем 3 — 4 раза дистиллированной водой.
7.2. Пробы воды (объем не менее 1000 см 3 ) отбирают в полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
7.3. Пробы анализируют не позднее, чем через 2 часа после отбора или консервируют следующим образом: к пробе добавляют 3 см 3 концентрированной HNО3 на 1 дм 3 воды, или 3 см 3 ледяной уксусной кислоты на 1 дм 3 воды. Срок хранения законсервированной пробы — 1 месяц.
Если требуется определить свинец в растворенной форме, пробу фильтруют через бумажный фильтр «синяя лента» до консервирования ( * ) .
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
7.4. Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку прибора к работе и оптимизацию условий измерения производят в соответствии с рабочей инструкцией по эксплуатации прибора. Прибор должен быть поверен.
Дважды перегоняют воду в приборе из стекла, не содержащего свинца, и проверяют ее на отсутствие свинца раствором дитизона.
300 — 500 см 3 воды встряхивают с 20 см 3 раствора дитизона (по п. 8.2.9). Процедуру повторяют до тех пор пока цвет дитизона не будет оставаться зеленым. Избыток дитизона удаляют встряхиванием бидистиллированной воды с четыреххлористым углеродом. Дитизон считают полностью удаленным, если после очередного встряхивания слой растворителя остается бесцветным.
Для приготовления всех реактивов и растворов используют эту воду.
8.2.1. Феноловый красный, спиртовой раствор.
0,1 г индикатора растворяют в 100 см 3 20 %-ного раствора спирта-ректификата.
8.2.2. Натрий лимоннокислый, водный раствор.
100 г натрия лимоннокислого растворяют в небольшом количестве воды, помещают в мерную колбу на 500 см 3 и доводят до метки бидистиллированной водой.
Очищают от микроэлементов экстракцией в делительной воронке раствором дитизона (по п. 8.2.9.) порциями по 5 — 10 см 3 до прекращения окраски дитизона. Продолжительность каждой экстракции 1 мин. После этого из раствора извлекают остатки дитизона экстракцией четыреххлористым углеродом порциями по 10 см 3 до полного удаления дитизона, т.е. пока очередная порция четыреххлористого углерода не станет бесцветной. Продолжительность каждой экстракции 1 мин.
500 см 3 соляной кислоты осторожно приливают к 500 см 3 бидистиллированной воды.
8.2.4. Калий железистосинеродистый ( * ) , водный раствор.
Навеску (1 г) калия железистосинеродистого ( * ) помещают в мерную колбу на 50 см 3 , растворяют в небольшом количестве воды, перемешивают и доводят до метки бидистиллированной водой.
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
8.2.5. Гидроксиламин солянокислый, раствор.
Навеску (10 г) гидроксиламина солянокислого помещают в мерную колбу на 500 см 3 , растворяют в небольшом количестве воды, перемешивают и доводят до метки бидистиллированной водой.
Раствор очищают экстракцией раствором дитизона (по п. 8.2.9.) порциями по 5 — 10 см 3 до прекращения изменения окраски дитизона. Продолжительность каждой экстракции 1 мин. После этого из раствора извлекают остатки дитизона экстракцией четыреххлористым углеродом порциями по 10 см 3 до полного удаления дитизона, т.е. пока очередная порция четыреххлористого углерода не станет бесцветной. Продолжительность каждой экстракции 1 мин.
8.2.6. Приготовление основного градуировочного раствор свинца.
Раствор готовят из ГСО с аттестованным содержанием свинца в соответствии с прилагаемой к образцу инструкцией.
Раствор устойчив в течение года и хранится в склянке с притертой пробкой при комнатной температуре.
1 см 3 раствора должен содержать 0,1 мг свинца.
8.2.7. Приготовление рабочего градуировочного раствора свинца.
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 100 раз бидистиллированной водой.
1 см 3 раствора должен содержать 0,001 мг свинца.
8.2.8. Приготовление основного раствора дитизона.
0,05 г дитизона очищенного (см. приложение) растворяют в 500 см 3 четыреххлористого углерода. Раствор хранят в темной склянке при 3 — 5 °С в течение нескольких месяцев.
8.2.9. Приготовление рабочего раствора дитизона.
25 см 3 основного раствора дитизона разбавляют четыреххлористым углеродом и объём доводят до 250 см 3 . Измеряют оптическую плотность полученного раствора (l = 520 нм, кювета 20 мм) против четыреххлористого углерода. Прибавляя в колбу по каплям раствор дитизона (по п. 8.2.8) или четыреххлористого углерода, устанавливают оптическую плотность, равную 0,350. Раствор готовят в день определения и хранят в темной склянке ( * ) .
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
8.2.10. Приготовление раствора аммиака, 17 %-ный раствор.
Раствор получают путем изопиестической дистилляции концентрированного раствора аммиака. Для этого на дно эксикатора наливают 1 дм 3 концентрированного аммиака, а на вкладыш ставят выпарительную чашку с 500 см 3 бидистиллированной воды. Через двое суток аммиак, полученный в чашке, будет иметь концентрацию примерно 17 %.
Для построения градуировочного графика необходимо приготовить образцы для градуировки определяемого компонента с концентрациями 0,002 — 0,03 мг/дм 3 . Условия анализа, его проведение должны соответствовать описанным в пунктах 6 и 9.
Состав и количество образцов для градуировки для построения градуировочного графика приведены в таблице 2. Погрешность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,8 %.
Состав и количество образцов для градуировки при анализе свинца
Массовая концентрация свинца в градуировочных растворах, мг/дм 3
Аликвотная часть рабочего раствора с концентрацией 0,001 мг/см 3 , помещенного в мерную колбу на 500 см 3
В качестве холостой пробы используют бидистиллированную воду (п. 8.2), которую проводят через весь ход анализа ( * ) .
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Растворы готовят в мерных колбах вместимостью 500 см 3 . Полученные растворы переносят в конические колбы со шлифом емкостью 1 дм 3 , подкисляют 10 см 3 раствором соляной кислоты (по п. 8.2.3), прибавляют по 0,5 г персульфата аммония, вставляют в горла колб пробки-холодильники. Кипятят в течение 20 минут. Далее поступают как указано в п. 9.
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных. Из оптической плотности каждого градуировочного раствора вычитают оптическую плотность холостой пробы ( * ) .
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Строят градуировочный график в координатах оптическая плотность — концентрация в мг/дм 3 .
Контроль стабильности градуировочной характеристики проводят не реже одного раза в месяц или при смене партии реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в таблице 2).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где Х — результат контрольного измерения массовой концентрации ионов свинца в образце для градуировки;
С — аттестованное значение массовой концентрации ионов свинца в образце для градуировки;
sRл— среднеквадратическое отклонение внутрилабораторной прецизионности, установленное при реализации методики в лаборатории.
Примечание. Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: ?Rл= 0,84 ?R, с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов анализа.
Значения sR приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
0,5 дм 3 исследуемой воды, предварительно подкисленной (20 см 3 соляной кислоты по п. 8.2.3 на 1 дм 3 пробы), помещают в колбу на 1 дм 3 , прибавляют 0,5 г персульфата аммония и, вставив в горло колбы пробку-холодильник, кипятят на медленном огне в течение 20 мин., после чего пробу охлаждают под струей воды.
К охлажденной пробе приливают
15 см 3 аммиака (по п. 8.2.10), затем по каплям доводят кислотность среды до рН = 2 (контроль по универсальной индикаторной бумаге). Пробу переносят в делительную воронку емкостью 1 дм 3 и экстрагируют 10 см 3 раствора дитизона (по п. 8.2.9) в течение 2 минут. После расслоения водной и органической фаз экстракт сливают и отбрасывают. Повторяют экстракцию до тех пор, пока слой органического растворителя не перестанет изменять окраску.
К очищенной пробе прибавляют 5 — 6 капель раствора фенолового красного (по п. 8.2.1) и, приливая по каплям аммиак (по п. 8.2.10), нейтрализуют пробу до оранжевой окраски (рН = 6,8 — 7,3). Затем приливают 5 см 3 раствора калия железистосинеродистого ( * ) (по п. 8.2.4), 5 см 3 раствора солянокислого гидроксиламина (по п. 8.2.5), 5 см 3 раствора лимоннокислого натрия (по п. 8.2.2) и встряхивают содержимое воронки в течение 30 сек. Затем прибавляют по каплям аммиак (по п. 8.2.10) до появления малиновой окраски и избыток
5 капель (рН = 8,0 — 8,5). Приливают 10 см 3 раствора дитизона (по п. 8.2.9) и экстрагируют свинец в течение 2 минут. После расслоения сливают окрашенный слой органического растворителя в кювету, фильтруя его через воронку с небольшим слоем ваты. Измеряют оптическую плотность раствора при длине волны ? = 520 нм в кювете с толщиной слоя 20 мм против четыреххлористого углерода. Вычитают оптическую плотность холостой пробы (см. п. 8.3) ( * ) . Содержание свинца находят по градуировочному графику.
ПНД Ф 14.1:2.54-96 ( * ) Внесены дополнения и изменения согласно протокола № 23заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Содержание ионов свинца (мг/дм 3 ) рассчитывают по формуле
где С — концентрация свинца, найденная по градуировочному графику, мг/дм 3 ;
500 — объем, до которого была разбавлена проба, см 3 ;
V — объем, взятый для анализа, см 3 .
За результат анализа Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
Значения предела повторяемости вероятности Р = 0,95
Диапазон измерений, мг/дм 3
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (1) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-3.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Значения предела воспроизводимости при вероятности Р = 0,95
Диапазон измерений, мг/дм 3
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
11.1. Результат анализа Xср в документах, предусматривающих его использование, может быть представлен в виде: Хср ± D, Р = 0,95,
где D — показатель точности методики.
Значение D рассчитывают по формуле: D = 0,01?d?Хср. Значение d приведено в таблице 1.
Допустимо результат анализа в документах, выдаваемых лабораторией, представлять в виде: Хср ± Dл, Р = 0,95, при условии Dл 3 четыреххлористого углерода растворяют 1,0 г дитизона. Раствор переносят в делительную воронку на 500 см 3 , приливают 100 см 3 раствора аммиака (1 см 3 концентрированного аммиака, разбавленного до 100 см 3 бидистиллированной водой) и 5 см 3 5 %-ного раствора аскорбиновой кислоты. Содержимое воронки встряхивают в течение 2 мин. После расслоения жидкости органический слой сливают в чистую делительную воронку. Водный раствор дитизона фильтруют в колбу на 1 дм 3 через бумажный фильтр, предварительно промытый раствором соляной кислоты (1:20) и бидистиллированной водой. К органическому раствору дитизона приливают новую порцию раствора аммиака и раствора аскорбиновой кислоты, и содержимое воронки встряхивают в течение 2 мин. Операцию очистки дитизона повторяют 5 — 6 раз до тех пор, пока водно-аммиачный раствор не будет окрашиваться в оранжевый цвет. Все порции водного раствора дитизона фильтруют в колбу на 1 дм 3 . Приливают соляную кислоту (1:1) до выпадения дитизона в осадок. При этом водный слой приобретает бледно-зеленоватый цвет. Осадок фильтруют через бумажный фильтр, промывают 3 раза 1 %-ным раствором аскорбиновой кислоты и сушат на воздухе. Дитизон хранят в темном месте.
2. Приписанные характеристики погрешности измерений и ее составляющих. 1
3. Средства измерений, вспомогательное оборудование, материалы, реактивы.. 2
3.1. Средства измерений, оборудование и материалы.. 2
4. Условия безопасного проведения работ. 3
5. Требования к квалификации операторов. 3
6. Условия выполнения измерений. 3
7. Отбор и хранение проб воды.. 3
8. Подготовка к выполнению измерений. 4
8.1. Подготовка прибора к работе. 4
8.2. Приготовление вспомогательных растворов. 4
8.3. Построение градуировочного графика. 5
8.4. Контроль стабильности градуировочной характеристики. 6
10. Обработка результатов измерений. 7
11. Оформление результатов анализа. 8
12. Контроль качества результатов анализа при реализации методики в лаборатории. 9
источник
Тяжелые металлы — очень опасные токсические вещества. В наши дни, мониторинг уровня разных таких веществ особо важен в промышленных и городских районах.
Хотя все знают, что такое тяжелые металлы, не все знают какие химические элементы всё-таки входят в эту категорию. Есть очень много критерий, по которому, разные учёные определяют тяжелые металлы: токсичность, плотность, атомная масса, биохимические и геохимические циклы, распространение в природе. По одним критериям в число тяжелых металлов входят мышьяк (металлоид) и висмут (хрупкий металл).
Известно более 40 элементов, которые относят к тяжелым металлам. Они имеют атомную массу больше 50 а.е. Как не странно именно эти элементы обладают большой токсичностью даже при малой кумуляции для живых организмов. V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo…Pb, Hg, U, Th…все они входят в эту категорию. Даже при их токсичности, многие из них являются важными микроэлементами, кроме кадмия, ртути, свинца и висмута для которых не нашли биологическую роль.
По другой классификации (а именно Н. Реймерса) тяжелые металлы — это элементы которые имеют плотность больше 8 г/см 3 . Таким образом получится меньше таких элементов: Pb, Zn, Bi, Sn, Cd, Cu, Ni, Co, Sb.
Теоретически, тяжелыми металлами можно назвать всю таблицу элементов Менделеева начиная с ванадия, но исследователи нам доказывают, что это не совсем так. Такая теория вызвана тем, что не все они присутствуют в природе в токсических пределах, да и замешательство в биологических процессах для многих минимальна. Вот почему в эту категорию многие включают только свинец, ртуть, кадмий и мышьяк. Европейская Экономическая Комиссия ООН не согласна с этим мнением и считает что тяжелые металлы это — цинк, мышьяк, селен и сурьма. Тот же Н. Реймерс считает, что удалив редкие и благородные элементы из таблицы Менделеева, остаются тяжелые металлы. Но и это тоже не правило, другие к этому классу добавляют и золото, платину, серебро, вольфрам, железо, марганец. Вот почему я вам говорю, что не всё ещё понятно по этой теме…
Обсуждая про баланс ионов различных веществ в растворе, мы обнаружим, что растворимость таких частиц связанно со многими факторами. Главные факторы солюбилизации являются рН, наличие лигандов в растворе и окислительно-восстановительный потенциал. Они причастны к процессам окисления этих элементов с одной степени окисления к другой, в которой растворимость иона в растворе выше.
В зависимости от природы ионов, в растворе могут происходить различные процессы:
- гидролиз,
- комплексообразование с разными лигандами;
- гидролитическая полимеризация.
Из-за этих процессов, ионы могут переходить в осадок или оставаться стабильными в растворе. От этого зависит и каталитические свойства определённого элемента, и его доступность для живых организмов.
Многие тяжелые металлы образуют с органическими веществами довольно стабильные комплексы. Эти комплексы входят в механизм миграции этих элементов в прудах. Почти все хелатные комплексы тяжелых металлов устойчивы в растворе. Также, комплексы почвенных кислот с солями разных металлов (молибден, медь, уран, алюминий, железо, титан, ванадий) имеют хорошую растворимость в нейтральной, слабощелочной и слабокислой среды. Это факт очень важен, потому что такие комплексы могут продвигаться в растворенном состоянии на большие расстояния. Самые подверженные водные ресурсы — это маломинерализованные и поверхностные водоёмы, где не происходит образование других таких комплексов. Для понимания факторов, которые регулируют уровень химического элемента в реках и озерах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю свободных и связанных форм металла.
В результате миграции тяжелых металлов в металлокомплексы в растворе могут произойти такие последствия:
- В первых, увеличивается кумуляция ионов химического элемента за счёт перехода этих из донных отложений в природные растворы;
- Во вторых, возникает возможность изменения мембранной проницаемости полученных комплексов в отличие от обычных ионов;
- Также, токсичность элемента в комплексной форме может отличаться от обычной ионной формы.
Например, кадмий, ртуть и медь в хелатные формы, имеют меньшую токсичность, чем свободные ионы. Вот почему не правильно говорить о токсичности, биологической доступности, химической реакционной способности только по общему содержанию определённого элемента, при этом, не учитывая долю свободных и связанных форм химического элемента.
Откуда же берутся тяжелые металлы в нашу среду обитания? Причины присутствия таких элементов могут быть сточные воды с разных промышленных объектов занимающийся черной и цветной металлургией, машиностроением, гальванизацией. Некоторые химические элементы входят в состав пестицидов и удобрений и таким образом могут быть источником загрязнения местных прудов.
А если войти в тайны химии, то самым главным виновником повышения уровня растворимых солей тяжелых металлов является кислотные дожди (закисление). Понижение кислотности среды (уменьшение рН) тянет за собою переход тяжелых металлов из малорастворимых соединений (гидроксиды, карбонаты, сульфаты) в более хорошо растворимые (нитраты, гидросульфаты, нитриты, гидрокарбонаты, хлориды) в почвенном растворе.
Надо отметить в первую очередь, что загрязнение этим элементом натуральными способами маловероятна, потому что этот элемент очень рассеян в Земной коре. В природе обнаруживается в асфальтах, битумах, углях, железных рудах. Важным источником загрязнения является нефть.
Природные водоёмы содержит ничтожное количество ванадия:
- в реках — 0,2 — 4,5 мкг/л,
- в морях (в среднем) — 2 мкг/л.
В процессах перехода ванадия в растворённом состоянии очень важны анионные комплексы (V10O26) 6- и (V4O12) 4- . Также очень важны растворимые ванадиевые комплексы с органическими веществами, типа гумусовых кислот.
Ванадий в повышенных дозах очень вреден для человека. Предельно-допустимая концентрация для водной среды (ПДК) составляет 0,1 мг/л, а в рыбохозяйственных прудах, ПДКрыбхоз ещё ниже — 0,001 мг/л.
Главным образом, висмут может поступать в реки и озера в результате процессов выщелачивания минералов содержащих висмут. Есть и техногенные источники загрязнения этим элементом. Это могут быть предприятия по производству стекла, парфюмерной продукций и фармацевтические фабрики.
- Реки и озера содержат меньше микрограмма висмута на литр.
- А вот подземные воды могут содержать даже 20 мкг/л.
- В морях висмут как правило не превышает 0,02 мкг/л.
ПДК висмута для водной среды — 0,1 мг/л.
Железо — химический элемент не редкий, оно содержится во многих минералах и пород и таким образом в природных водоёмах уровень этого элемента повыше других металлов. Оно может происходить в результате процессов выветривания горных пород, разрушения этих пород и растворением. Образуя разные комплексы с органическими веществами из раствора, железо может быть в коллоидальном, растворённом и в взвешенном состояниях. Нельзя не упомнить про антропогенные источники загрязнения железом. Сточные воды с металлургических, металлообрабатывающих, лакокрасочных и текстильных заводов зашкаливают иногда из-за избытка железа.
Количество железа в реках и озерах зависит от химического состава раствора, рН и частично от температуры. Взвешенные формы соединений железа имеют размер более 0,45 мкг. Основные вещества которые входят в состав этих частиц являются взвеси с сорбированными соединениями железа, гидрата оксида железа и других железосодержащих минералов. Более малые частицы, то есть коллоидальные формы железа, рассматриваются совместно с растворенными соединениями железа. Железо в растворённом состоянии состоит из ионов, гидроксокомплексов и комплексов. В зависимости от валентности замечено что Fe(II) мигрирует в ионной форме, а Fe(III) в отсутствии разных комплексов остаётся в растворённом состоянии.
В балансе соединений железа в водном растворе, очень важно и роль процессов окисления, так химического так и биохимического (железобактерии). Эти бактерии ответственны за переход ионов железа Fe(II) в состояние Fe(III). Соединения трехвалентного железа имеют склонность гидролизовать и выпадать в осадок Fe(OH)3. Как Fe(II), так и Fe(III) склоны к образованию гидроксокомплексов типа [Fe(OH)4] — , [Fe(OH)2] + , [Fe2(OH)3] 3+ , [Fe2(OH)2] 4+ , [Fe(OH)3] + , в зависимости от кислотности раствора. В нормальных условиях в реках и озерах, Fe(III) находятся в связи с разными растворёнными неорганическими и органическими веществами. При рН больше 8, Fe(III) переходит в Fe(OH)3. Коллоидные формы соединений железа самые малоизучены.
В реках и озерах уровень железа колеблется на уровне n*0,1 мг/л, но может повыситься вблизи болот до несколько мг/л. В болотах железо концентрируется в форме солей гуматов (соли гуминовых кислот).
Подземные водохранилища с низким рН содержат рекордные количества железа — до нескольких сотен миллиграммов на литр.
Железо — важный микроэлемент и от него зависят разные важные биологические процессы. Оно влияет на интенсивность развития фитопланктона и от него зависит качество микрофлоры в водоёмах.
Уровень железа в реках и озерах имеет сезонный характер. Самые высокие концентрации в водоёмах наблюдаются зимою и летом из-за стагнации вод, а вот весною и осенью заметно снижается уровень этого элемента по причине перемешивания водных масс.
Таким образом, большое количество кислорода ведёт к окислению железа с двухвалентной формы в трехвалентной, формируясь гидроксид железа, который падает в осадок.
Вода с большим количеством железа (больше 1-2 мг/л) характеризуется плохими вкусовыми качествами. Она имеет неприятный вяжущий вкус и непригодна для промышленных целей.
ПДК железа для водной среды — 0,3 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз — 0,1 мг/л.
Загрязнение кадмием может возникнуть во время выщелачивания почв, при разложения разных микроорганизмов которые его накапливают, а также из-за миграции из медных и полиметаллических руд.
Человек тоже виноват в загрязнении этим металлом. Сточные воды с разных предприятий занимающеюся рудообогащением, гальваническим, химическим, металлургическим производством могут содержать большие количества соединений кадмия.
Естественные процессы по снижению уровня соединений кадмия являются сорбция, его потребление микроорганизмами и выпадение в осадок малорастворимого карбоната кадмия.
В растворе, кадмий находится, как правило, в форме органо-минеральных и минеральных комплексов. Сорбированные вещества на базе кадмия — важнейшие взвешенные формы этого элемента. Очень важна миграция кадмия в живых организмов (гидробиониты).
Уровень кадмия в чистых реках и озерах колеблется на уровне меньше микрограмма на литр, в загрязнённых водах уровень этого элемента доходит до нескольких микрограммов на литр.
Некоторые исследователи считают, что кадмий, в малых количествах, может быть важным для нормального развития животных и человека. Повышенные концентрации кадмия очень опасных для живых организмов.
ПДК для водной среды не превышает 1 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз — меньше 0,5 мкг/л.
Реки и озера могут загрязниться кобальтом как следствие выщелачивания медных и других руд, из почв во время разложения вымерших организмов (животные и растения), ну и конечно же в результате активности химических, металлургических и металлообрабатывающих предприятии.
Главные формы соединений кобальта находится в растворенном и взвешенном состояниях. Вариации между этими двумя состояниями могут происходить, из-за изменений рН, температуры и состава раствора. В растворённом состоянии, кобальт содержится в виде органических комплексов. Реки и озера имеют характерность, что кобальт представлен двухвалентным катионом. При наличии большого количества окислителей в растворе, кобальт может окисляться до трехвалентного катиона.
Он входит в состав растений и животным, потому что играет важную роль в их развитии. Входит в число основных микроэлементов. Если в почве наблюдается дефицит кобальта, то его уровень в растениях будет меньше обычного и как следствие могут появиться проблемы со здоровьем у животных (возникает риск возникновения малокровия). Этот факт наблюдается особенно в таежно-лесной нечерноземной зоне. Он входит в состав витамина В12, регулирует усвоение азотистых веществ, повышает уровень хлорофилла и аскорбиновой кислоты. Без него растения не могут наращивать необходимое количество белка. Как и все тяжелые металлы, он может быть токсичным в больших количествах.
- Уровень кобальта в реках варьирует от несколько микрограммов до миллиграммов на литр.
- В морях в среднем уровень кадмия — 0,5 мкг/л.
ПДК кобальта для водной среды — 0,1 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз — 0,01 мг/л.
Марганец поступает в реки и озера по таким же механизмам, как и железо. Главным образом, освобождение этого элемента в растворе происходит при выщелачивании минералов и руд, которые содержат марганец (черная охра, браунит, пиролюзит, псиломелан). Также марганец может поступать вследствие разложения разных организмов. Промышленность имеет, думаю, самую большую роль в загрязнении марганцем (сточные воды с шахт, химическая промышленность, металлургия).
Снижение количества усваиваемого металла в растворе происходит, как и в случае с другими металлами при аэробных условиях. Mn(II) окисляется до Mn(IV), вследствие чего выпадает в осадок в форме MnO2. Важными факторами при таких процессах считаются температура, количество растворённого кислорода в растворе и рН. Снижение растворённого марганца в растворе может возникнуть при его употреблении водорослями.
Мигрирует марганец в основном в форме взвеси, которые, как правило, говорят о составе окружающих пород. В них он содержится как смесь с другими металлами в виде гидроксидов. Преобладание марганца в коллоидальной и растворенной форме говорят о том что он связан с органическими соединениями образуя комплексы. Стабильные комплексы замечаются с сульфатами и бикарбонатами. С хлором, марганец образует комплексы реже. В отличие от других металлов, он слабее удерживается в комплексах. Трехвалентный марганец образует подобные соединения только при присутствии агрессивных лигандов. Другие ионные формы (Mn 4+ , Mn 7+ )менее редки или вовсе не встречаются в обычных условиях в реках и озерах.
Самыми бедными в марганце считаются моря — 2 мкг/л, в реках содержание его больше — до 160 мкг/л, а вот подземные водохранилища и в этот раз являются рекордсменами — от 100 мкг до несколько мг/л.
Для марганца характерны сезонные колебания концентрации, как и у железа.
Выявлено множество факторов, которые влияют на уровень свободного марганца в растворе: связь рек и озер с подземными водохранилищами, наличие фотосинтезирующих организмов, аэробные условия, разложение биомассы (мертвые организмы и растения).
Немаловажная биохимическая роль этого элемента ведь он входит в группу микроэлементов. Многие процессы при дефиците марганца угнетаются. Он повышает интенсивность фотосинтеза, участвует в метаболизме азота, защищает клетки от негативного воздействия Fe(II) при этом окисляя его в трехвалентную форму.
ПДК марганца для водоёмов — 0,1 мг/л.
Такой важной роли для живых организмов не имеет ни один микроэлемент! Медь — один из самых востребованных микроэлементов. Он входит в состав многих ферментов. Без него почти ничего не работает в живом организме: нарушается синтез протеинов, витаминов и жиров. Без него растения не могут размножаться. Всё-таки избыточное количество меди вызывает большие интоксикации во всех типов живых организмов.
Содержание меди в реках, как правило, 2 — 30 мкг/л, в морях — 0,5 — 3,5 мкг/л. Высокий уровень меди в реках и озерах говорит о загрязнении.
Хотя медь имеет две ионные формы, чаще всего в растворе встречается Cu(II). Обычно, соединения Cu(I) трудно растворимые в растворе (Cu2S, CuCl, Cu2O). Могут возникнуть разные акваионны меди при наличии всяких лигандов.
При сегодняшнем высоком употреблении меди в промышленности и сельское хозяйство, этот металл может послужить причиной загрязнения окружающей среды. Химические, металлургические заводы, шахты могут быть источниками сточных вод с большим содержанием меди. Процессы эрозии трубопроводов тоже имеют свои вклад в загрязнении медью. Самыми важными минералами с большим содержанием меди считаются малахит, борнит, халькопирит, халькозин, азурит, бронтантин.
ПДК меди для водной среды считается 0,1 мг/л, в рыбохозяйственных прудах ПДКрыбхоз меди уменьшается до 0,001 мг/л.
Во время выщелачивания минералов с высоким содержанием молибдена, освобождаются разные соединения молибдена. Высокий уровень молибдена может замечаться в реках и озерах, которые находятся рядом с фабриками по обогащению и предприятиями занимающиеся цветной металлургией. Из-за разных процессов осаждения труднорастворимых соединений, адсорбции на поверхности разных пород, а также употребления водными водорослями и растениями, его количество может заметно уменьшится.
В основном в растворе, молибден может находиться в форме аниона MoO4 2- . Есть вероятность присутствия молибденоорганических комплексов. Из-за того что при окисления молибденита формируются рыхлые мелкодисперсные соединения, повышается уровень коллоидального молибдена.
Уровень молибдена в реках колеблется между 2,1 и 10,6 мкг/л. В морях и океанах его содержание — 10 мкг/л.
При малых концентрациях, молибден помогает нормальному развитию организма (так растительного, как и животного), ведь он входит в категорию микроэлементов. Также он является составной частью разных ферментов как ксантиноксилазы. При недостатке молибдена возникает дефицит этот фермента и таким образом могут проявляться отрицательные эффекты. Избыток этого элемента тоже не приветствуется, потому что нарушается нормальный обмен веществ.
ПДК молибдена в поверхностных водоёмах должен не превышать 0,25 мг/л.
Загрязнены мышьяком в основном районы, которые находятся близко к минеральным рудников с высоким содержанием этого элемента (вольфрамовые, медно-кобальтовые, полиметаллические руды). Очень малое количество мышьяка может произойти при разложении живых организмов. Благодаря водным организмам, он может усваиваться этими. Интенсивное усваивание мышьяка из раствора замечается в период бурного развития планктона.
Важнейшими загрязнителями мышьяком считаются обогатительная промышленность, предприятия по производству пестицидов, красителей, а также сельское хозяйство.
Озера и реки содержат мышьяк в два состояния: во взвешенном и растворённом. Пропорции между этими формами может меняться в зависимости от рН раствора и химической композиции раствора. В растворённом состоянии, мышьяк может быть трехвалентном или пятивалентном, входя в анионные формы.
В реках, как правило, содержание мышьяка очень низкое (на уровне мкг/л), а в морях — в среднем 3 мкг/л. Некоторые минеральные воды могут содержать большие количества мышьяка (до несколько миллиграммов на литр).
Больше всего мышьяка могут, содержат подземные водохранилища — до несколько десяток миллиграммов на литр.
Его соединения очень токсичны для всех животных и для человека. В больших количествах, нарушаются процессы окисления и транспорт кислорода к клеткам.
ПДК мышьяка для водной среды — 50 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз — тоже 50 мкг/л.
На содержание никеля в озерах и реках влияют местные породы. Если рядом с водоёмом находятся месторождения никелевых и железно-никелевых руд концентрации могут быть и ещё больше нормального. Никель может поступить в озера и реки при разложении растениях и животных. Сине-зеленые водоросли содержат рекордные количества никеля по сравнению с другими растительными организмами. Важные отходные воды с высоким содержанием никеля освобождаются при производстве синтетического каучука, при процессах никелирования. Также никель в больших количествах освобождается во время сжигания угля, нефти.
Высокий рН может послужить причиной осаждения никеля в форме сульфатов, цианидов, карбонатов или гидроксидов. Живые организмы могут снизить уровень подвижного никеля, употребляя его. Важны и процессы адсорбции на поверхности пород.
Вода может содержать никель в растворённой, коллоидальной и взвешенной формах (баланс между этими состояниями зависит от рН среды, температуры и состава воды). Гидроксид железа, карбонат кальция, глина хорошо сорбируют соединения содержащие никель. Растворённый никель находится в виде комплексов с фульвовой и гуминовой кислот, а также с аминокислотами и цианидами. Самой стабильной ионной формой считается Ni 2+ . Ni 3+ , как правило, формируется при большом рН.
В середине 50ых годов никель был внесён в список микроэлементов, потому что он играет важную роль в разных процессах как катализатор. В низких дозах он имеет положительный эффект на кроветворные процессы. Большие дозы всё-таки очень опасны для здоровья, ведь никель — канцерогенный химический элемент и может спровоцировать разные заболевания дыхательной системы. Свободный Ni 2+ более токсичный, чем в форме комплексов (примерно в 2 раза).
В реках, содержание никеля — 0,8 — 10 мкг/л, а при загрязнении даже несколько десяток микрограммов на литр. В морях в среднем содержание этого металла — 2 мкг/л, а в подземных водохранилищах даже несколько миллиграммов на литр воды. Рядом с породами содержащие никелевые минералы, подземные водохранилища могут содержать до 20 г/л.
ПДК никеля для водной среды — 0,1 мг/л, а вот в рыбохозяйственных прудах ПДКрыбхоз — 0,01 мг/л.
Природными источниками олова являются минералы, которые содержат этот элемент (станнин, касситерит). Антропогенными источниками считаются заводы и фабрики по производству разных органических красок и металлургическая отрасль работающая с добавлением олова.
Олово — малотоксичный металл, вот почему употребляя пищу из металлических консервов мы не рискуем своим здоровьем.
Озера и реки содержат меньше микрограмма олова на литр воды. Подземные водохранилища могут содержать и несколько микрограммов олова на литр.
ПДК олова для водной среды — 2 мг/л.
Главным образом, повышенный уровень ртути в воде замечается в районах где есть месторождения ртути. Самые частые минералы — ливингстонит, киноварь, метациннабарит. Сточная вода с предприятий по производству разных лекарств, пестицидов, красителей может содержать важные количества ртути. Другим важным источником загрязнения ртутью считаются тепловые электростанции (которые используют как горючее уголь).
Его уровень в растворе уменьшается главным образом за счёт морских животных и растений, которые накапливают и даже концентрировать ртуть! Иногда содержание ртути в морских обитателей поднимается в несколько раз больше чем в морской среде.
Природная вода содержит ртуть в две формы: взвешенную (в виде сорбированных соединений) и растворённую (комплексные, минеральные соединения ртути). В определённых зонах океанов, ртуть может появляться в виде метилртутных комплексов.
Содержание ртути в реках в среднем — десятки доли микрограмма на литр воды, в морях — 0,03 мкг/л. Самый большой уровень ртути содержится в подземной воде — 1 — 3 мкг/л.
Ртуть и его соединения очень токсичны. При больших концентрациях, имеет отрицательное действие на нервную систему, провоцирует изменения в крови, поражает секрецию пищеварительного тракта и двигательную функцию. Очень опасны продукты переработки ртути бактериями. Они могут синтезировать органические вещества на базе ртути, которые во много раз токсичнее неорганических соединений. При употреблении рыбы, соединения ртути могут попасть в наш организм.
ПДК ртути в обычной воде — 0,5 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз — меньше 0,1 мкг/л.
Реки и озера могут загрязняться свинцом натуральным путём при смывании минералов свинца (галенит, англезит, церуссит), так и антропогенным путём (сжигание угля, применение тетраэтилсвинца в топливе, сбросы фабрик по рудообогащению, сточные воды с шахт и металлургических заводов). Осаждение соединений свинца и адсорбция этих веществ на поверхности разных пород являются важнейшими натуральными методами понижения его уровня в растворе. Из биологических факторов, к уменьшению уровня свинца в растворе ведут гидробионты.
Свинец в реках и озерах находится во взвешенной и растворённой форме (минеральные и органоминеральные комплексы). Также свинец находится в виде нерастворимых веществ: сульфаты, карбонаты, сульфиды.
Содержание свинца в реках — несколько микрограммов на литр. В реках и озерах, находящийся рядом с полиметаллическими рудниками, уровень свинца может подниматься до несколько десятков миллиграммов на литр. Термальные хлорные воды тоже могут содержать до несколько миллиграммов свинца на литр.
Про токсичность этого тяжелого металла мы наслышаны. Он — очень опасный даже при малых количествах и может стать причиной интоксикации. Проникновение свинца в организм осуществляется через дыхательную и пищеварительную систему. Его выделение из организма протекает очень медленно, и он способен накапливаться в почках, костях и печени.
ПДК свинца для водной среды — 0,03 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз — 0,1 мг/л.
Он служит в качестве антидетонатора в моторном топливе. Таким образом, основными источниками загрязнения этим веществом — транспортные средства.
Это соединение — очень токсичное и может накапливаться в организме.
Предельно-допустимая концентрация тетраэтилсвинца для водной среды
Предельно-допустимый уровень этого вещества приближается к нулю.
Тетраэтилсвинец вообще не допускается в составе вод.
Серебро главным образом попадает в реки и озера из подземных водохранилищах и как следствие сброса сточных вод с предприятий (фотопредприятия, фабрики по обогащению) и рудников. Другим источником серебра могут быть альгицидные и бактерицидные средства.
В растворе, самые важные соединения являются галоидные соли серебра.
В чистых реках и озерах, содержание серебра — меньше микрограмма на литр, в морях — 0,3 мкг/л. Подземные водохранилища содержат до несколько десяток микрограммов на литр.
Серебро в ионной форме (при определённых концентрациях) имеет бактериостатический и бактерицидный эффект. Для того чтобы можно было стерилизовать воду при помощи серебра, его концентрация должна быть больше 2*10 -11 моль/л. Биологическая роль серебра в организм ещё недостаточно известна.
Предельно-допустимая серебра для водной среды — 0,05 мг/л.
источник

