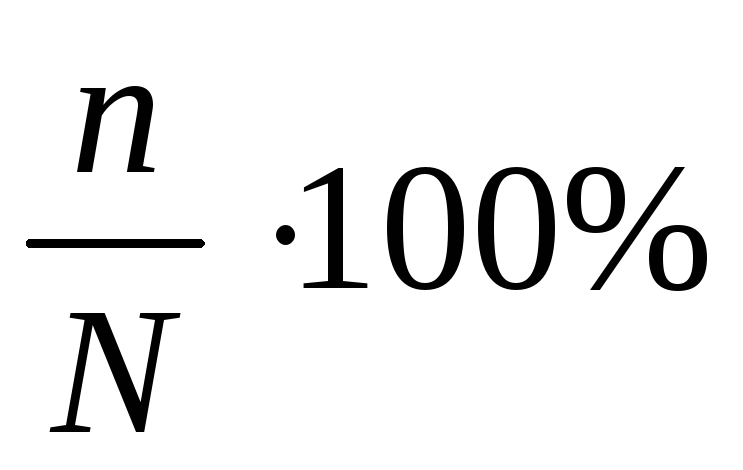ЗАКОН ДЕЙСТВУЮЩИХ МАСС КАК ТЕОРЕТИЧЕСКАЯ ОСНОВА КАЧЕСТВЕННОГО АНАЛИЗА ПРИ ИЗУЧЕНИИ ГЕТЕРОГЕННЫХ ПРОЦЕССОВ ГИДРОЛИЗА И АМФОТЕРНОСТИ
Зависимость скорости реакции от концентрации реагирующих веществ, сформулированная Гульдбергом Като Максимилианом (1836 — 1902) — норвежским физикохимиком и математиком и Петером Вааге (1833 — 1900) норвежским физикохимиком и минералогом в 1864 — 1867 г. г. получила название закона действующих масс: скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Для конкретных случаев гомогенных систем: NН 4 Сl + NаОН = NН 4 ОН + NаСl и 2КОН + Н 2 SО 4 = К 2 SО 4 + 2Н 2 О, т. е.
при взаимодействии этих веществ в растворах уравнения скоростей реакций пишут соответсвенно:
В гетерогенных системах с участием твердой фазы скоростьреакции не зависит от массы твердого вещества (при небольшой поверхности его), а изменяется лишь в зависимости от концентрации газообразных (или растворенных) веществ, например:
В случае обратимых реакций устанавливается подвижное и химическое равновесие, при котором в системе одновременно присутствуют как исходные, так и образующиеся вещества. Химическим равновесием называют такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны.
Для системы mА + nВ = рС + qD скорость прямой реакции v1 = k1 [А] m [В] n , а скорость обратной реакции v2 = k2 [С] р [D] q .
При химическом равновесии v1 = v2 .
Поэтому можно написать k1 [A] m [B] n = k2 [C] р [D] q .
После преобразования получим k1 / k2 = ([С] р [D] q ) / ([A] m [В] n ). Но отношение 2-х постоянных величин k1 / k2 есть величина постоянная, которую обозначают через К и называют константой равновесия: К = ([С] р [D] q ) / ([A] m [В] n ).
При химическом равновесии произведение молярных концентраций получающихся веществ (продуктов реакции), деленное на произведение молярных концентраций исходных веществ, представляет собой постоянную для данной реакции величину, называемую константой равновесия (значение концентрации каждого компонента возводят в степень, равную стехиометрическому коэффициенту его в уравнении реакции). Константа равновесия показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции k1 / k2 при данной температуре и одинаковых концентрациях.
Если константа равновесия равна К = 1, то скорости прямой и обратной реакций приблизительно равны.
Если величина К> 1, то преобладает прямая реакция и динамическое равновесие сдвинуто вправо. При К 2 / [N 2 ][Н 2 ] 3 .
Добавление в систему одного из реагирующих веществ вызывает смещение (сдвиг) химического равновесия, т. е. изменение равновесных концентраций. Равновесие вновь установится, но уже при других новых концентрациях исходных веществ и получающихся продуктов. В этом случае обязательно повышается скорость той реакции, при которой прибавленное вещество расходуется. Чтобы достичь более полного смещения (сдвига) химического равновесия нужно действовать избытком реагента, вызывающего это смещение.
В 1884 был сформулирован общий закон смещения химического равновесия, согласно которому при внешнем воздействии на равновесную систему химическое равновесие смещается в сторону, противоположную этому воздействию (принцип подвижного динамического равновесия, принцип Ле Шателье Анри Луи, 1850 — 1936, французский физикохимик и металловед). Уравнение константы химического равновесия является математическим выражение закона действующих масс. Именно Ле Шателье, независимо от Ф. Габера нашел (1901) условия синтеза аммиака.
3/2Н 2 + 1/2N 2 = NН 3 , реакция идет с выделением тепла -46,2 кДж/моль.
При увеличении концентрации азота или водорода происходит сдвиг реакции в сторону уменьшения концентрации этих веществ, т. е. в сторону образования аммиака и, наоборот; повышение температуры сместит реакцию в сторону образования исходных веществ, т. к. реакция идет с выделением тепла, понижение температуры — в сторону продолжения реакции. Повышение давления способствует уменьшению числа молекул, т. е. увеличению продуктов реакции, т. к. слева 2-ве молекулы, справа одна; уменьшение давления смещает равновесие реакции в сторону увеличения исходных продуктов. Если в реакции участвует одинаковое число молекул, то увеличение давления не дает результатов: N2 + О 2 = 2NО.
При выводе из сферы реакции образующихся веществ реакция идет в сторону их образования: СН 3 СООН + СН 2 ОН = СН 3 СООСН 3 + Н 2 О; добавлением в среду серной кислоты добиваются протекания реакции до конца, т. к. серная кислота поглощает воду и выводит ее из реакции. Таким образом, Обратимыми реакциями можно управлять сдвигая константу химического равновесия в сторону образования необходимого продукта и превращая обратимую реакцию в необратимую, т. е. реакцию, которая протекает до конца в одном направлении и завершается полным превращением исходных реагирующих веществ в конечный продукт. Принципы необратимости реакций:
образующиеся продукты уходят из сферы реакции в виде осадка или газа: ВаС1 2 + Н 2 SО 4 = ВаSО 4 + 2НС1.
- . образуется малодиссоциированное соединение, например, вода.
- . реакция идет с большим выделением тепла, например, горение магния: Мg + ½ О 2 = МgО; — 602,5 кДж/моль.
Обратимые реакции не идут до конца и заканчиваются установлением химического равновесия, которое можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой, т. е. прямая и обратная реакции не прекращаются и находятся в состоянии динамического равновесия. Видимых изменений реакции не происходит, концентрации веществ остаются постоянными и равновесными. Однако закон действующих масс и понятие о химическом равновесии применимы только к неэлектролитам и слабым электролитам в разбавленных водных (или неводных) растворах.
Слабые электролиты в концентрированных водных растворах и все сильные электролиты (кислоты, щелочи, соли) не вполне подчиняются закону действующих масс.
Закон действующих масс справедлив только для идеальных систем и идеальных растворов.
источник
7. Применение закона действующих масс в аналитической химии. Основные положения теории слабых электролитов Аррениуса. Константа диссоциации, степень диссоциации. Закон разведения Оствальда.
Закон действующих масс — скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Т.е, в состоянии химического равновесия отношение произведений активностей продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению активностей исходных веществ, есть величина постоянная при данных температуре, давлении и в данном растворителе.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Электролиты ― это вещества, способные в растворах и расплавах диссоциировать на ионы. К ним относятся соединения с ионным и ковалентным полярным типом связи (соли, кислоты, основания, вода).
Самопроизвольный распад электролитов на ионы, протекающий под воздействием растворителя, называется электролитической.
1. В растворах электролитов происходит самопроизвольный распад (диссоциация) молекул на ионы, в результате чего раствор становится электропроводным.
Степень диссоциации электролита (α) рассчитывается по формуле:
α =
где n – число молекул, распавшихся на ионы;
N – общее число молекул растворенного вещества в растворе.
2. В зависимости от степени диссоциации, электролиты делятся на сильные и слабые. Однако это деление условно, т.к. одно и то же вещество, в зависимости от природы растворителя, может быть как сильным, так и слабым электролитом.
3. Одноосновные кислоты и однокислотные основания диссоциируют одноступенчато, многоосновные кислоты и многокислотные основания – многоступенчато. Преимущественно диссоциация протекает по первой ступени.
Амфотерные электролиты (амфолиты) диссоциируют одновременно и по кислотному, и по основному типу. К ним относятся многие гидроксиды металлов: Al(OH)3, Cr(OH)3, Fe(OH)3, Zn(OH)2, Sn(OH)2, Pb(OH)2, Be(OH)2, а также вода.
К слабым электролитам относятся ковалентные соединения, обратимо (частично) диссоциирующие в водных растворах. К ним относятся:
а) почти все органические и многие неорганические кислоты: H2S, H2SO3, HNO2, HCN, и др;
б) труднорастворимые в воде основания, а также NH4OH,
В растворах слабых электролитов устанавливается равновесие между молекулами веществ и их ионами: KaтAн
Из-за высокой концентрации ионов, в растворе сильного электролита создается собственное электромагнитное поле, интенсивность которого определяется величиной ионной силы раствора (I). Ионная сила раствора рассчитывается по уравнению:
где Сi — молярная концентрация каждого иона, моль/л,
В растворе сильного электролита вокруг каждого иона создается ионная атмосфера, состоящая из ионов противоположного знака.
источник
ОБЩИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ. КАЧЕСТВЕННЫЙ АНАЛИЗ
Тема: Некоторые положения теории растворов электролитов и закона действующих масс, применяемых в аналитической химии
Цель: Ознакомить студентов с протолитической теорией, кислотности и основности органических соединений и влиянии на них различных факторов.
Методы, используемые на лекции:
1. По дидактическому назначению: лекция вводная, тематическая, объяснительная.
2. По роли в образовательном процессе: лекция вводная, установочная, обзорная, обобщающая.
3. По содержанию и системе построения: лекция информационная (традиционная).
4. По назначению лекция направлена на приобретение студентами знаний, на развитие творческой деятельности, а также на закрепление учебного материала. По типу познавательной деятельности на лекции применяются репродуктивные и проблемные методы изложения материала, используются наглядные методы обучения в виде презентации по данному разделу
1. Дидактические: презентация.
2. Материально технические: мел, доска, мультимедийный проектор, экран.
1. Организационный момент 3мин (название темы и плана лекции).
2. Традиционное прочитывание лекции 40 мин — I час лекции.
4. Второй час лекции 40 мин.
5. Заключительная часть лекции — проверка студентов на лекции 21ф, 22ф групп 5 мин.
1. Сильные и слабые электролиты.
2. Общая концентрация и активности ионов в растворе.
3. Ионная сила (ионная крепость раствора).
4. Влияние ионной силы раствора на коэффициенты активности ионов.
5. Характеристика pH водных растворов.
7. Константа химического равновесия (истинно термодинамическая, концентрационная, условная).
3. Форма организации лекции традиционная (тематическая, объяснительная).
4. Методы, используемые на лекции:
— словесные: объяснение, разъяснение;
— материально-технические: мел, доска, мультимедийный проектор.
1. Некоторые положения теории растворов электролитов, используемые в аналитической химии (в аналитике)
1.1. Сильные и слабые электролиты
Проводники, прохождение через которые электрического тока вызывает перемещение вещества в виде ионов (ионная проводимость) и химические превращения (электрохимические реакции), называются электролитами. Это могут быть индивидуальные вещества или растворы.
Упрощенная формулировка: электролиты — это вещества, способные распадаться на ионы в растворах. Правда, такая формулировка является менее общей и не охватывает твердые электролиты и расплавы электролитов.
Термин «ион» впервые ввел английский физик М. Фарадей (1791-1867).
Раствор — это гомогенная смесь двух или нескольких веществ, способная непрерывно изменять свои свойства. Растворы бывают жидкие и твердые. В аналитике используют в основном жидкие растворы.
В соответствии с теорией электролитической диссоциации (1883-1887) шведского ученого (1859-1927), который за создание этой теории был удостоен в 1902 г. Нобелевской премии, электролиты в растворах распадаются (диссоциируют) на ионы вследствие взаимодействия с молекулами растворителя.
Количественно ионизация (диссоциация на ионы) электролита в растворе характеризуется степенью диссоциации (ионизации) α, равной отношению числа продиссоциировавших молекул пдисс к исходному числу молекул писх:
Степень диссоциации (ионизации) α численно выражается либо в долях единицы, либо в процентах. Если α = 1 (т. е. 100%), то все исходные частицы в растворе распались на ионы (пдисс = писх); если α
источник
Закон действия масс. Катионы 1-й аналитической группы.
Взаимодействие между различными веществами происходит в различных условиях и с различной скоростью. Понятие о скорости химических реакций является одним из важнейших в химии. Скоросгь химических реакций характеризуется изменением концентрации, реагирующих веществ эа единицу времени. При этом концентрация выражается числом молей в литре, время — секундами, минутами или часами в зависимости от природы реагирующих веществ.
Для того чтобы произошло химическое взаимодействие веществ, их молекулы или ионы должны столкнуться. Только при этом станет возможным образование молекул новых веществ — продуктов реакции. Ясно, что скорость реакции пропорциональна числу столкновений, которое тем больше, чем выше концентрация реагирующих веществ.
В 1867 г. К. Гульдберг и П. Вааге открыли так называемый закон действия масс, устанавливающий зависимость скорости химической реакции от концентрации. Согласно этому закону, при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Так, в случае реакции:
выражение для скорости реакции имеет вид:
υ – скорость реакции; [А] — концентрация вещества А; [В] — концентрация вещества В; k — коэффициент пропорциональности, или константа скорости.
Если [А] = 1 моль/л и [В] = 1 моль/л, то скорость данной реакции υ = k1 * 1 = k.
Таким образом, константа скорости k численно равна скорости данной реакции, если концентрации реагирующих веществ или их произведение равны единице.
Скорость химической реакции зависит от температуры — с повышением температуры скорость большинства реакций увеличивается. Это объясняется тем, что при повышении температуры увеличивается скорость движения молекул, а следовательно, число столкновений между ними.
Кроме того, следует учитывать, что не всякое столкновение частиц (атомов, молекул) приводит к их взаимодействию и образованию продукта реакции. Прохождение реакции обеспечивается столкновением только тех частиц, которые обладают достаточной энергией, чтобы ослабить или разрушить связь между частицами исходного вещества. Увеличение температуры приводит к увеличению числа таких молекул с избыточной энергией — энергией активации.
Энергия активации неодинакова для различных реакций. Ее величина, а соответственно и скорость химической реакции определяются природой реагирующих веществ. Так, энергия активации ионных реакций очень мала и такие реакции протекают почти мгновенно. Примером реакции с низкой скоростью прохождения может служить реакция синтеза аммиака N2 + 3H2 = 2NH3, для осуществления которой необходима высокая энергия активации (более 120 кДж/моль).
Таким образом, скорость химической реакции зависит от температуры и природы реагирующих веществ.
На скорость многих химических реакций влияет присутствие катализатора. Катализаторами называются вещества, увеличивающие скорость химической реакции и не расходующиеся в ходе реакции. Катализатор облегчает прохождение реакции за счет образования промежуточного продукта реакции, для образования которого необходима меньшая энергия активации, чем для образования конечного продукта реакции. В свою очередь молекулы промежуточного продукта активнее молекул исходного вещества и легко вступают во взаимодействие с молекулами другого исходного вещества, образуя конечный продукт реакции. Катализатор при этом освобождается и вновь участвует в образовании промежуточного продукта. Таким образом, для прохождения реакции достаточно даже незначительного количества катализатора. Схематично этот процесс можно изобразить следующим образом:
где А и В – исходные продукты, АВ – конечный продукт реакции, К – катализатор.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Скорость химической реакции зависит от различных факторов (природы реагирующих веществ, температуры, давления, катализаторов и т. п.). Впервые на зависимость скорости реакции от концентрации реагирующих веществ указал Н. Н. Бекетов.
Эта закономерность, получившая впоследствии название закона действия масс, была сформулирована норвежскими учеными Гульдбергом и Вааге (1867) следующим образом: скорость химической реакции прямо пропорциональна действующим массам, т. е. концентрациям реагирующих веществ.
Скорость реакции не остается постоянной, а изменяется во времени по мере взаимодействия исходных веществ.
Истинную скорость реакции в данный момент рассматривают как производную от концентрации по времени:
Энергия активации. Реакция протекает за счет активных молекул, обладающих избыточной энергией, что проявляется в повышенной скорости их движения, усиленных колебаниях атомов в молекуле или в повышенных электронных уровнях энергии (возбужденное состояние). Переход исходной молекулы в активную называют активацией. Энергия, необходимая для активации, называется энергией активации. Она равна разности между средней энергией активизированных частиц и средней энергией исходных молекул при температуре реакции.
Скорость химической реакции возрастает с увеличением температуры, это объясняется тем, что число активных молекул с повышением температуры увеличивается.
Логарифм константы скорости реакции находится в линейной зависимости от обратного значения абсолютной температуры .
При химическом взаимодействии система должна перейти от исходного состояния до активированного состояния через энергетический барьер.
Энергия активации реакций, протекающих между ионами, которые взаимодействуют практически при каждом столкновении, сопровождающемся перераспределением электронной плотности и возникновением новых химических связей (например, ), очень мала или практически равна нулю. Поэтому большинство химических реакций ионов, сопровождающихся образованием соединений типа сульфида ртути, протекают без нагревания. Подробное изложение теории энергии активации не входит в нашу задачу; поэтому мы отсылаем интересующихся этим вопросом читателей к курсам физической химии, в которых этот вопрос рассматривается с различных точек зрения.
Химическое равновесие. Для обратимой реакции
скорость прямой реакции взаимодействия вещества А с веществом В при постоянной температуре прямо пропорциональна концентрациям этих веществ
где — коэффициент пропорциональности (константа скорости), зависящий от природы реагирующих веществ, температуры и давления;
— молярные концентрации веществ А и В.
Для обратного процесса скорость взаимодействия вещества D с веществом Е равна:
где — коэффициент пропорциональности (константа скорости) для данного процесса; — молярные концентрации веществ D и Е.
По мере взаимодействия исходных веществ А и В их начальные концентрации уменьшаются; следовательно, постепенно уменьшается начальная скорость прямой реакции . По мере накопления продуктов реакции D и Е концентрации их увеличиваются; следовательно, скорость обратной реакции постепенно увеличивается. Наконец, наступает такой момент, когда скорость прямой реакции становится равной скорости обратной реакции .
При установившемся равенстве скоростей прямой и обратной реакций наступает химическое равновесие. Состояние химического равновесия характеризуется тем, что концентрация исходных и конечных продуктов реакции при данных температуре и давлении остается постоянной. Иными словами, при установлении равновесия в единицу времени образуется такое количество веществ D и Е, какое в это же время распадается с образованием веществ А и В.
Таким образом, химическое равновесие является динамическим (подвижным): в момент равновесия химическое взаимодействие не прекращается, а продолжает идти с одинаковой скоростью в обоих направлениях— слева направо и справа налево.
Константа равновесия реакции. В момент химического равновесия скорости прямой и обратной реакций равны , поэтому
Таким образом, отношение произведения концентраций конечных продуктов реакции к произведению концентраций исходных продуктов реакции достигает определенной величины, когда устанавливается химическое равновесие. Эту величину, постоянную для данной реакции при данной температуре, называют константой равновесия реакции (К).
Константа равновесия реакции представляет собой отношение констант скоростей прямой и обратной реакций
и меняется с изменением температуры и давления.
Константа равновесия реакции К определяет относительные количества компонентов, составляющих равновесную систему. Она показывает, что на состояние равновесия влияет каждое из участвующих в реакции веществ. Если изменить концентрацию одного из них, то равновесие нарушится. Чтобы величина К оставалась постоянной, должна измениться концентрация и другого компонента данной равновесной системы.
Всякое нарушение равновесия, при неизменных температуре и давлении, путем увеличения или уменьшения концентрации одного или нескольких реагирующих веществ немедленно приводит к новому состоянию равновесия.
Пользуясь константами равновесия реакций, можно теоретически предсказывать и математически рассчитывать направление разнообразных химических реакций, стремящихся к определенному состоянию химического равновесия.
Например, если константа равновесия реакции, выражаемой уравнением
равна , т. е. согласно закону действия масс
то это означает, что произведение равновесных концентраций продуктов реакции в 1000000 раз меньше произведения концентраций исходных продуктов реакции.
Следовательно, равновесие сдвинуто в левую сторону, т. е. указанная выше реакция протекает справа налево.
Если К равно , то это означает, что произведение концентраций конечных продуктов реакции в 1000000 раз больше произведения концентраций исходных продуктов реакции. Следовательно, равновесие в этом случае будет сдвинуто в правую сторону, т. е. указанная выше реакция протекает слева направо.
уравнение, выражающее константу равновесия, представляют следующим образом:
т. е. коэффициенты молекулярных соотношений стехиометрического уравнения становятся показателями степени величин концентраций.
В общем виде закон действия масс в применении к обратимым реакциям можно сформулировать следующим образом.
При установившемся химическом равновесии в обратимой реакции отношение произведения равновесных концентраций конечных продуктов этой реакции к произведению равновесных концентраций исходных продуктов реакции есть величина постоянная.
Если коэффициенты a, b, d, e не равны единице, то численные значения концентраций должны быть возведены в соответствующие степени.
источник
Теоретические вопросы контрольной работы
Предмет, задачи и методы качественного анализа
1. Аналитическая химия и её задачи
2. Предмет и задачи качественного анализа
3. Методы качественного анализа
4. Краткий очерк развития аналитической химии
5. Системы качественного анализа
8. Аналитические группы катионов и периодическая система элементов Д.И. Менделеева
9. Аналитические группы анионов
10. Чувствительность аналитических реакций
11. Основные условия обнаружения ионов в растворе
Закон действия масс как основа качественного анализа
12. Применение закона действия масс к обратимым реакциям
13. Основные положения теории электролитической диссоциации
14. Взаимосвязь между степенью и константой диссоциации. Ионизация слабых электролитов
15. Смещение ионных равновесий
16. Действие одноименного нона на смещение ионных равновесий
17. Основные положения теории сильных электролитов
18. Активность и коэффициент активности
20.Уравнения, применяемые к неидеальным (реальным) растворам.
Термодинамическая константа ионизации.
21 .Значение теории электролитической диссоциации в качественном анализе
22. Ионное произведение воды и водородный показатель
23. Буферные системы и их значение в анализе
24. Современные представления о природе кислот и оснований
26. Диссоциация оснований взаимодействие
Закон действия масс и гетерогенные процессы
28. Произведение растворимости
29. Влияние одноименных и других ионов на растворимость электролитов.
32. Образование и растворение осадков
33. Превращение одних малорастворимых электролитов в другие
34. Условия протекания реакций обмена
Закон действия масс и процессы гидролиза и амфотерности
36.Постоянная и степень гидролиза
37. Значение гидролиза в качественном анализе
Окислительно- восстановительные процессы
39.Значение реакций окисления- восстановления
40. Стандартный водородный электрод
41 Стандартные электродные потенциалы
42. Стандартные окислительно-восстановительные потенциалы
43. Направления окислительно-восстановительных реакций
44. Составление уравнений окислительно-восстановительных реакций.
Комплексообразование в химическом анализе
45.Диссоциация комплексных ионов
46 Вычисление концентраций различных продуктов диссоциации комплексных ионов
47.Маскировка комплексных ионов
48. Разрушение комплексных ионов
49.Органические реагенты. их классификация и применение в анализе Анионы и анализ сухого вещества
50.Классификадия анионов и групповые реактивы
51 Общая характеристика анионов третьей группы
52.Предмет и методы количественного анализа
Гравиметрический (весовой) анализ
53.Сущность гравиметрического анализа
57.Точность количественного анализа
58.Вычисления в гравиметрическом анализе
59.Сущность титриметрического анализа
60.Особенности титриметрического анализа
61 Методы титриметрического анализа
62.Выражение концентрации растворов в титриметрическом анализе
63. Приготовление исходных (стандартных) растворов
64. Приготовление рабочих титрованных растворов
66.Калибровка и проверка вместимости посуды
67.Проверка и калибровка мерных колб
68.Калибрование и проверка вместимости бюреток
69.Вычисления в титриметрическом анализе Методы кислотно-основного титрования (нейтрализации)
73. Индикаторы метода нейтрализации
74. Интервал перехода индикаторов
75. Показатель индикатора рК, показатель титрования рТ
77. Индикаторные ошибки титрования
78. Титрование в неводных средах
79. Методы редоксметрии (окисления-восстановления)
81. Классификация методов редоксметрии
83. Направление реакций редоксметрии
84. Константы равновесия редокс-реакций
85. Кривые титрования редокс-методов
90.Сущность методов осаждения
91. Теоретические основы методов осаждения
92. Классификация методов осаждения
95. Сущность комплексонометрии
96. Определение эквивалентной точки
97. Методы комплексонометрического титрования
Физико-химические и физические методы анализа
Электрохимические методы анализа
102. Амперометрическое титрование
Оптические методы анализа
104. Общая характеристика методов
108. Эмиссионный спектральный анализ
Задачи для выполнения контрольной работы
1. Вычислить молярную и нормальную концентрацию 20%-го раствора
2. Вычислить нормальную концентрацию 30%-го раствора N аОН
плотностью 1,328г/мл. К 1 литру этого раствора прибавили 5л воды.
Вычислить процентную концентрацию полученного раствора. Ответ:
3. К 3л. 10%-го раствора Н N О3 , плотностью 1,054г/мл прибавили 5л 2%-го
раствора этой же кислоты плотностью 1,009 г/мл. Вычислить процентную и
молярную концентрацию полученного раствора, объем которого равен 8
4. Вычислить нормальную и молярную концентрацию 20,8%-го раствора HNO 3 плотностью1,12г/мл. Сколько г кислоты содержится в 4л этого
5. Какой объем 50%-го раствора HN О3 , плотностью 1,538 г/мл требуется для
приготовления Зл 6%-го раствора плотностью 1,048 г/мл. Ответ: 245,5мл.
6. Вычислить молярную, нормальную, моляльную концентрации 16%-го
раствора AlCl 3 с плотностью 1,149 г/мл.
7. Сколько и какого вещества останется в из бытке, если к 75 мл 0,Зн раствора
8. Для осаждения в виде AgCl всего серебра, содержащегося в 100 мл
раствора AgNO 3 , потребовалось 50мл 0,2н раствора HCl . Какова
нормальность раствора AgNO 3 ? Какая масса AgCl выпала в осадке?
9. Какой объем 20,01%-го раствора HCl плотностью 1, I г/мл требуется для
приготовления 1л 10,17% раствора плотностью 1,050г/мл.
10. Смешали 10мл 10%-го раствора HN О3 , плотностью 1,056 г/мл и 100 ил
30%-го раствора HN О3 , плотностью 1,184г/мл. Вычислить процентную
концентрацию полученного раствора.
11. Какой объем 10%-го раствора карбоната натрия Na 2 СО3 , плотностью
1,105г/мл требуется для приготовления 5л 2%-го раствора плотностью
12. На нейтрализацию 31 мл 0,16н раствора щелочи NaOH требуется 217 мл
13. Какой объем 0,3н раствора кислоты H 2 SO 4 требуется для нейтрализации
раствора, содержащего 0,32г NaOH в 40 мл?
14. На нейтрализацию 1л раствора, содержащего 1,4г. КОН, требуется 50мл
раствора кислоты H 2 SO 4 . Вычислить нормальность раствора кислоты.
15. Какая масса HN О3 , содержалась в растворе, если на нейтрализацию его
потребовалось З5мл 0,4н раствора NaOH ? Каков титр раствора NaOH ?
16. Какую массу NaNO 3 , нужно растворить в 400г воды, чтобы приготовить
17. Смешали З00г 20%-го раствора и 500г 40%-го раствора NaCl . Чему равна
процентная концентрация полученного раствора?
18. Смешали 247г 62%-го и 145г 18%-го раствора H 2 SO 4 . Какова процентная
концентрация полученного раствора?
19. Из 700г 60%-го раствора H 2 SO 4 выпарили 200г воды. Чему равна
процентная концентрация оставшегося раствора?
20. Из 10кг 20%-го раствора при охлаждении выделилось 400г соли. Чему
равна процентная концентрация охлажденного раствора.
21. Вычислить активность ионов в растворе, содержащем в 1 л 0,001 моль
22. Чему равна ионная сила раствора 0,001м раствора CaCl 2 ? Вычислите
активность Ca 2+ и по и .
23. Чему равна ионная сила раствора, содержащего в 1 л 0,01 моля HCl и
24. Чему равна ионная сила раствора, содержащего в 1 л 0,01 ноля K 2 SO 4 ?
Найдите f к + , f для соответствующей ионной силы, вычислите
25. Чему равна активность ионов Ca 2+ и ? Вычислите ионную силу
раствора, по ней найдите в соответствующей таблице f Ca 2+ и f .
26. Чему равна ионная сила раствора, содержащего в 1 л 0,1м KCl ? Найдите
f к + и f для соответствующей и онной силы и вычислите активность
27. Чему равна ионная сила раствора, содержащего в 1 л 0,01 моля HCl и
0,002 моля CaCl 2 ? Найдите и для соответствующей и онной силы и
вычислите активность и онов.
28. Найдите ионную силу раствора FeCl 3 , если молярная концентрация равна
0,0083 моля в 1 литра раствора, найдите активность , если = 0,2, а
= 0,8.
29 Вычислить ионную силу раствора, содержащего в 1 л 0,01 моль СаС l 2 , и 0,1
30. Чему равна ионная сила раствора, содержащего в 1 л 0.01 моль AlCl 3 ?
31. Найдите ионную силу раствора 0,001м раствора Al 2 ( SO 4 ) 3 . Найдите .
и их активность.
32. Чему равна ионная сила раствора, содержащего в 1 л 0,001 моль K 2 SO 4 ?
Найдите коэффициенты активности и активности ионов К + , .
33. Вычислите ионную силу 0,005 м раствора нитрата бария Ва( NO 3 )2 .
34. Вычислите ионную силу 0,002м раствора сульфата цинка ZnSO 4 .
35. Вычислите ионную силу раствора, содержащего в 1 л 0,005 моль нитрата
36. Как будет меняться кажущаяся степень диссоциации 0,1 м NH 4 OH при
разбавлении водой до 0,001 моль/л?
37. Константа диссоциации HClO равно 4*. Найти кажущуюся степень
диссоциации раствора кислоты в 0,5м раствора.
38. Константа диссоциации НСОО равно 4*. Найти кажущуюся степень
диссоциации раствора кислоты в 0,05м раствора.
39. Как будет меняться кажущаяся степень диссоциации 0,01 м раствора
NH 4 OH при разбавлении водой до 0,001 моль/л?
40. Как будет меняться кажущаяся степень диссоциации 0,1 м раствора
NH 4 OH при разбавлении водой до 0,02 моль/л?
41. Составьте электронные уравнения и укажите, какой процесс (окисления
или восстановления) происходит при следующих превращениях:
→
→
→ ( MnO 4 ) 2-
42. Какие из следующих реакций относятся к Окислительно-восстановительным?
43. Указать, какая реакция является окислительно-восстановительной:
K 2 Cr 2 O 7 . Указать, какое вещество может быть только восстановителем.
45. Указать окислительно-восстановительную реакцию.
46. Указать. окислителем или восстановителем является пероксид (Н2 O 2 ) в реакции:
47. Определить степень окисления хрома в молекуле:
Na С r О2 и в ионе (С r О4) 2-
48. Какие из указанных веществ и ионов могут проявлять: только окислительные свойства, только восстановительные свойства, либо двоя кие свойства (окислительные и восстановительные):
49. Указать окислитель в приведенных уравнениях
50. Написать электронные уравнения и указать, какой процесс представляет собой окисление, а какой восстановление:
→ О2
→2О 2-
51. Определить степень окисления йода в ионе ( J О4). Какая это степень
окисления: высшая, низшая или промежуточная?
52. Определить степень окисления азота в нонах:
( N Н4) и ( N О2)
53. Вычислить степень окисления азота, хрома, алюминия и кислорода в предложенных соединениях: N 2 Н4, N 2 , HNO 2 , Al ( NO 3 )3, Cr , CrO 3 , O 2 ., H 2 O 2 , OF 2 , As 2 O 3
54. Какие свойства (окислителя или восстановителя) будут проявлять следующие соединения: КС l О4, КМ n О4, К2С r О4, К2С r 2 О7, Р2О5, Ca 3 ( PO 4 )2
55. Составить электронные уравнения для предложенных переходов:
а) F е 2+ → F е 3+ б) С l→ Cl в) М n 2+ → М n 6+
S -2 → 2S 4+ Br→ Br 7+ Mn 7+ → Mn 6+
O 2→ 2 O
57. Указать тип ОВР и подобрать коэффициенты методом электронного баланса в следующем уравнении
58. Как изменяется степень окисления в результате процесса: окислитель это или восстановитель?
− 8→
Mn 7+ 3→
S 6+ + 8→
59. К какому типу ОВР относится реакция? Укажите окислитель и восстановитель. Расставьте коэффициенты.
60. Какое вещество (Н2 или С l 2 ) обладает большими окислительными
61. Определить химическую формулу минерала, содержащего 24.95% « F е»;
62. Родонит (орлец) в основном имеет следующий состав: Mn – 41,98%,
« Si »-21,43%; « O »-36.63%. Определить его химическую формулу.
63. В состав минерала волластонита, в основном, входят: «С a »-34,5%; « Si »-24,18%, « O »-41,32%. Определить его химическую формулу.
64. Какую химическую формулу имеет вещество, состоящее из 62,53% «Са»
65. Кристаллогидрат сульфата цинка состоит из 56,14% ZnS О4 и 43.8% Н2О.
Найти формулу кристаллогидрата.
66. Пиролюзит содержит 63,19% ‘ Mn ” и 36,81% «О». Какой химической
формуле соответствует его состав?
67. Какова химическая формула вещества, если оно содержит 75,26% « Ag » и 24,74% «С1»?
68. В состав вещества входит 36,23% М g О и 63,77% Р2О5. Какой химической формулой выражается его состав?
69. Мирабилит содержит 44,09% Na 2 S О4 и 55,91% Н2О. Какую формулу имеет этот минерал? Каково соотношение компонентов в минерале?
70. Определить химическую формулу минерала, содержащего 24,95% « F е»,
46,46% «Сr», 28,59% «О» и соотношение элементов.
71. Какую валентность имеет комплексный ион
72. Какую валентность имеет комплексообразователь в соединении
73. Назвать комплексное соединение [ Ni ( NH 3 )4](ОН2).
74. Написать формулу: хлорид тетрааммин-диаквокобальта ( III ).
75. Представить координационную формулу:
76. Написать математическое выражение константы нестойкости комплекса
[А g С l 2 ] .
77. Какую валентность имеет комплексный ион: [А g ( NH 3 )2] ?
78. Написать математические выражение константы нестойкости комплекса
[ F е(С N )6] .
79. Назвать комплексное соединение К3[Со( N О2)6].
80. Написать формулу: нитрат карбонатотетраамминхрома ( III ).
81. Написать математическое выражение константы нестойкости комплекса
[Н g В r 4 ].
82. Найти заряды комплексных частиц и указать среди них катионы, анионы
83. Определить концентрацию Ag + — ионов и N Н3 в 0,1 м раствора
84. Написать формулы всех возможных соединений, которые могут
получиться из соединения [Р t ( N Н3)6]С l 4 путем замены частиц аммиака во
внутренней координационной сфере ионами хлора внешней среды.
85. Чему равны к.ч. комплексообразователя в
б) хлориде аммиаката серебра;
в) сульфате аммиаката меди?
86. Какую валентность имеет комплексообразователь в соединениях:
87. Написать математическое выражение константы нестойкости комплексов:
а) [ F е(С N )6]
б) [Н g ( N Н3)4]
88. В каком растворе (при одинаковой концентрации и объем) содержится
больше ионов А g + : в растворе К [А g С l 2 ] или N а[А g (С N )2] и во сколько раз?
89. Написать формулу: нитрат гексааквоникеля ( II ).
90. Найти заряды комплексных частиц и указать среди них катионы, анионы
91. Написать выражение для константы нестойкости ( k нест ) комплексного
92. Назвать комплексные соединение Са[А l (ОН)5Н2О].
93. Привести примеры катионных и анионных комплексных соединений для
С r 3+ и назвать их (к.ч. С r 3+ =6).
94. В растворе [ H + ] = 0,001 моль/л. Чему равен pH раствор?
95. THCL = 0,003646 г/моль. Найти нормальность раствора.
96. В растворе [ H + ] = 0,00001 моль/л. Чему равен pH раствор?
97. Рассчитать эквивалент ионов и веществ в реакции с перманганатом калия в кислой среде:
98. Определить содержание серы в г в 0.2854г Ва S О4. Ответы:
а) 0,03921; б)0,07842; в) 0,019605;
а) 0,003647; б) 0.0018235; в) 0,007294.
100. Определить [ H + ] раствора, если рН=8. Ответы:
а) 10 б) 10 в) 10.
101. = 0.01702 г/моль. Определить . Ответы:
а) 0.005856; б) 0,002928; в) 0,008345
а) 0,002805; б) 0,005611; в) 0,011222
103. Определить содержание серебра в 0.3652г AgCL . Ответы:
104. В растворе [ H + ] =0,0001 моль/л. Определить рН и рОН.
105. Т KOH = 0,005842. г/мл. Найти . Ответы:
а) 0,002553; б)0,005106; в) 0,010212;
106. Определить содержание хлора в 0,3652г AgCl ( MAgCl = 143,5). Ответы:
а) 0,04517 б)0,022585 в) 0,09034
а) 0,002805 б) 0,005611 в) 0,011222
108. = 0.01702 г/мл. Определить . Ответы:
а) 0,005856 б) 0,002928 в) 0,004252
109. Определить [ H + ] раствора, если рН=8. Ответы:
а) 10 б) в)
110. THCl = 0.003646 г/мл. Найти нормальность раствора. Ответы:
111. Определить содержание серы в г в 0,2854г Ва SO 4 . Ответы:
а) 0,03921 б) 0,07842 в) 0,019605
а) 0,003647 б) 0,0018235 в) 0,007294
113. Титр = 0,004615. Найти нормальность раствора. Ответы:
а) 0,024495 б) 0,09798 в) 0,04899
114. = 0.01882 г/мл. Найти . Ответы:
а) 0,000982 б) 0.003928 в) 0.001964
115. Т NaOH = 0.003882 г/мл. Найти нормальность раствора. Ответы:
а) 0,0242625 б) 210,09705 в) 0,048525
а) 0,0021775 б)0,00871 в) 0.004335
117. Титр раствора AgNO 3 = 0.01702 г/мл. Чему равен его титр по NaCl ? Ответы:
а) 0,005856 б)0.002928 в) 0,001464
118. Указать реакцию среды при полном гидролизе раствора соли ZnCl 2 .
119. Указать реакцию среды при полном гидролизе раствора соли NH 4 NO 3 .
120. Указать реакцию среды при полном гидролизе соли Cr ( NO 3 )3 .
121. Указать реакцию среды при полном гидролизе раствора соли CH 3 COONa .
1 22.Указать реакцию среды при полном гидролизе раствора соли Al 2 ( SO 4 )3 .
123. Указать реакцию среды при полном гидролизе раствора соли Ni ( NO 3 )2.
124. Указать реакцию среды при полном гидролизе раствора соли Na 2 SO 4 .
125. Указать реакцию среды при полном гидролизе раствора соли CuSO 4 .
126. Указать реакцию среды при полном гидролизе раствора соли Zn ( NO 3 )2.
127. Указать реакцию среды при полном гидролизе раствора соли KCNS .
128. Рассчитать ПР AgCl , зная, что насыщенный раствор AgCl при 25°С
содержит 1,8*10 г соли в 1л.
129. Найти, ПР зная, что насыщенный при 25° раствор содержит около
4,3*10 г соли в 1л.
130. По растворимости Са SO 4 , равной 2 г/л (при комнатной температуре),
вычислить ПР.
131. Вычислить растворимость Mg ( OH )2 при 25°С, если его ПР=5*10,
132. Зная, ПР= 5,77 *10 (при 25°С), найти растворимость этой соли?
133. Вычислить растворимость Ва SO 4 в 0,01м растворе Na 2 SO 4 по упрощенной
формуле для ПРи сопоставить ее с растворимостью этой соли в воде.
135. Вычислить величину константы гидролиза следующих солей (по всем ступеням):
принимая концентрацию соли, равной 0.1 м.
137. Вычислить равновесные концентрации ионов, образующихся при
гидролизе в 0,1 растворе ( N Н4)2 S и величину рН раствора.
138. Вычислить равновесные концентрации ионов, образующихся при
гидролизе 0.1 м раствора ( N Н4)2СО3 и р H раствора.
источник