Биомолекулы. Пептиды и белки
Методы выделения и анализа белков
Препараты высокоочищенных белков находят разнообразное применение в научных исследованиях, медицине и биотехнологии. Так как многие белки, и в особенности глобулярные, высоколабильны (см. с. 80), выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С). К таким методам относится ионообменная хроматография , которая обсуждалась на с. 68. Другие методы выделения белков представлены в этом разделе.
Растворимость белков сильно зависит от концентрации солей (от ионной силы ). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации ( засаливание ). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок ( высаливание ). Используя различие в растворимости, можно с помощью обычных солей, например (NН 4 ) 2 SО 4 , разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны , в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул . Разделение проводят в хроматографических колонках , заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов ( 1а ). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков ( 1б ) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля ( 1в ). На выходе колонки элюат собирают в виде отдельных фракций ( 2 ). Объем выхода того или иного белка зависит в основном от его молекулярной массы ( 3 ).
Г. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)] является общепринятым методом определения гомогенности белковых препаратов. Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля (см. с. 270). Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C 12 H 25 OSO 3 Na), который представляет собой детергент с сильно выраженными амфифильными свойствами (см. с. 34). Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики ( 1 ).
Электрофорез проводят в тонком слое полиакриламида ( 2 ). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков ( а ); выделенного из экстракта гомогенного белка ( б ); контрольной смеси белков с известными молекулярными массами ( в ).
источник
Выделение и очистка белков осуществляется поэтапно.
1. Гомогенизация – это тщательное измельчение объектов биохимического исследования до однородного, то есть гомогенного состояния, то есть белки подвергаются тщательной дезинтеграции вплоть до разрушения клеточной стенки.
а) ножевые гомогенизаторы типа Уорринга;
б) пестиковые гомогенизаторы Поттера — Эльвегейма;
в) шаровые и валковые мельницы – для более плотных объектов;
г) метод попеременного замораживания и оттаивания, при этом разрыв клеточной стенки происходит под действием кристалликов льда;
д) метод «азотной бомбы» – под высоким давлением клетки насыщаются азотом, затем давление резко сбрасывают, выделяется газообразный азот, который как бы взрывает клетку изнутри;
е) УЗ, различные пресс — методы, переваривание клеточных стенок ферментами. В большинстве случаев при гомогенизации выделяется тепло, при этом многие белки могут инактивироваться, поэтому все процедуры проводятся в холодных помещениях при t° 0° или охлаждают сырье с помощью льда. При этом тщательно контролируют объем и время разрушения клеток, рабочее давление. Идеальным считается такой гомогенизат, который может подвергнуться дальнейшему экстрагированию.
2. Экстракция белков, то есть их перевод в растворенное состояние; чаще всего экстракцию проводят вместе с измельчением одновременно. Экстракцию проводят:
а) растворением в 8-10% растворах солей;
б) с использованием буферных растворов с рН от кислых до слабощелочных (боратных, фосфатных, цитратных, трис — буферных: смесь трисаминометана с NH2 – CH3 + HCl;
в) осаждение белков органическими растворителями (этанол, метанол, бутанол, ацетон и их комбинациями), при этом происходит расщепление белково-липидных и белково-белковых компонентов, то есть разрушение ЧСБ.
3. Очистка и фракционирование белков. После экстрагирования производят разделение или фракционирование смеси на индивидуальные белки и их дальнейшую очистку:
а) высаливание – это процесс осаждения белков нейтральными солевыми растворами щелочных и щелочноземельных металлов.
Механизм высаливания – добавляемые анионы и катионы разрушают гидратную белковую оболочку белков, являющуюся одним из факторов устойчивости белковых растворов. Чаще всего применяются растворы сульфатов Na и аммония. Многие белки отличаются по размеру гидратной оболочки и величине заряда. Для каждого белка есть своя зона высаливания. После удаления высаливающего агента белок сохраняет свою биологическую активность и физико-химические свойства. В клинической практике применяется метод высаливания для разделения глобулинов ( при добавлении 50% раствора сульфата аммония (NH4)2SO4 выпадает осадок) и альбуминов ( при добавлении 100% раствора сульфата аммония (NH4)2SO4 выпадает осадок).
На величину высаливания оказывают влияние:
1) природа и концентрация соли;
Главную роль при этом играют валентности ионов. Поэтому действие соли оценивают по ионной силе раствора μ: 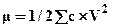
Метод Кона является разновидностью высаливания. Одновременно происходит экстракция и осаждения компонентов. Изменяя последовательно температуру (обычно низкие t° –0+8°С), рН раствора и концентрированного этанола, из плазмы крови последовательно выделяют до 18 фракций белков.
Метод Кона применяют в фармацевтическом производстве при получении кровезаменителей;
б) методы хроматографии. Основоположником разработки хроматографических методов анализа считается русский ученый Михаил Цвет (1903). В настоящее время существует много ее разновидностей. В основе метода лежит способность веществ специфически адсорбироваться на адсорбенте, заключенном в колонку или помещенном на каком-либо носителе. При этом происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают соответствующие элюенты (растворители), которые ослабляют силы адсорбции и вымывают адсорбированные вещества из колонки. Вещества собираются в коллекторе фракций.
Основополагающим в хроматографии является коэффициент распределения, который равен отношению концентрации вещества в подвижной фазе к концентрации вещества в неподвижной фазе (или стационарной фазе).
Неподвижная стационарная фаза – может быть твердой или жидкой или смесью твердой и жидкой.
Подвижная фаза – жидкая или газообразная, она течет по стационарной, или пропускается через нее.
В зависимости от вида стационарной и подвижной фазы бывают различные модификации хроматографического анализа.
Адсорбционная – основана на различной степени адсорбции белков адсорбентом и растворимости их в соответствующем растворителе.
Применяемые адсорбенты – кремниевая кислота, Al2О 3 , CaCO 3 , MgO, древесный уголь. Адсорбент в виде суспензии с растворителем (чаще с буферным раствором) упаковывают в колонке (стеклянная вертикальная трубка). Образец наносят на колонку, затем через нее пропускают растворитель или смесь растворителей.
Разделение основано на том, что вещества с более высоким Краспр. (Б), продвигаются по колонке с большей скоростью. Сбор фракций осуществляется с помощью коллектора фракций.
Распределительная хроматография – основана на распределении смеси белков между двумя жидкими фазами. Разделение может происходить на специальной хроматографической бумаге, а также в колонках, как в адсорбционной. Твердая фаза в данном случае служит только опорой для жидкой стационарной фазы. Хроматографическая бумага обладает свойством задерживать воду между своими целлюлозными волокнами. Эта вода — неподвижная стационарная фаза. Когда по бумаге под действием капиллярных сил движется неводный растворитель (подвижная фаза), молекулы вещества, нанесенного на бумагу, распределяются между двумя фазами в соответствии с их коэффициентом распределения. Чем выше растворимость вещества в подвижной фазе, тем дальше оно продвинется по бумаге вместе с растворителем.
В случае распределения хроматографии на колонке – носители – это целлюлоза, крахмал, силикагель и др., неподвижная фаза – вода. При нанесении на колонку вещества смеси движутся по колонке с разной скоростью с учетом Краспр.
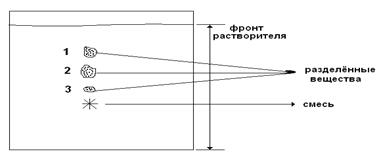 | 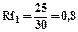 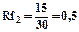 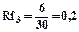 |
Rf для каждого соединения в стандартных условиях величина постоянная.
Ионообменная хроматография – основана на притяжении противоположно заряженных частиц. Для этого используют различные ионообменные смолы: катионообменные – содержат отрицательно заряженные группы – сульфированные стиролы 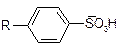
Анионообменные смолы, или основные ионообменники, содержат положительно заряженные группы, притягивающие отрицательно заряженные молекулы белков
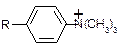
В зависимости от q разделяемых белков используют соответствующие ионообменники, с которыми взаимодействуют определенные белки, а другие беспрепятственно выходят из колонки. «Осажденные» на колонке белки снимают, используя более концентрированные солевые растворы или изменяя рН элюента.
Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков или других макромолекул с иммобилизованными на носителях специфическими веществами – лигандами (это может быть кофермент, если выделяют фермент, антитело антиген и др. Благодаря высокой специфичности белков к иммобилизованным лигандам к нему присоединяется только один белок из смеси. Смывается буферными смесями с измененным рН или измененной ионной силой.
Достоинство – возможность одноэтапно выделить заданное вещество высокой степени чистоты.
Метод гель — фильтрации или метод молекулярных «сит» — это разновидность проникающей хроматографии.
Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которые обладают многие пористые материалы, например органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Гель фильтрация – это разделение веществ с помощью гелей, основанное на различиях в размере молекул (сефароза, сефадекс, сефакрил, биогели и т.д.). Под действием эпихлоргидрина полисахаридные цепочки декстрана (синтезируется микроорганизмами) сшиваются в сетчатую структуру, становятся нерастворимыми в воде, но сохраняют к ней большое сродство. Благодаря этой гидрофильности полученные зерна (называемые сефадексом) сильно набухают с образованием геля, которым заполняют колонку. Метод основан на том, что крупные молекулы не проникают во внутреннюю водную фазу, а более мелкие молекулы сперва проникают в поры «сита», как бы застревают в них, а поэтому движутся с меньшей скоростью. Соответственно белки с большей Mr первыми поступают в приемник. В последнее время в проникающей хроматографии все чаще используют в качестве молекулярного сита пористые стеклянные гранулы.
Электрофоретический метод в биохимии – основан на различии скорости передвижения молекул в электрическом поле (аминокислоты, пептиды, белки, нуклеиновые кислоты).
Различие скорости движения зависит:
1. от q молекулы: подвижность молекул тем больше, чем больше суммарный q. Величина q зависит от рН;
2. от размеров молекул: чем крупнее молекулы, тем меньше их подвижность. Это связано с возрастанием сил трения и электростатических взаимодействий крупных молекул с окружающей средой;
3. от формы молекул: молекулы одинакового размера, но различной формы, например, фибрилл и глобул белка обладают различной скоростью. Это связано с различиями в силах трения и электростатического взаимодействия.
Виды электрофореза
а) Изоэлектрическое фокусирование. Разделение происходит на вертикальной колонке в град. как рН, так и напряжения. С помощью специальных носителей амфолитов в колонке устанавливается град. рН от 0 до 14. В колонку помещают смесь веществ, подключаю электроток. Каждый из компонентов движется к той части колонки, где значение рН соответствует его изоэлектрической точке и там останавливается, то есть фокусируется.
Достоинство: происходит разделение, очистка и идентификация белков в один прием. У метода высокая разрешительная способность (0,02 pI).
б) Изотахофорез – это электрофорез на поддерживающих средах. После включения электротока ионы с самой высокой подвижностью движутся к соответствующему электроду первыми, с самой низкой – последними, обладающие промежуточной подвижностью – располагаются посередине.
в) Диск-электрофорез – прибор состоит из двух сосудов с буфером – верхнего и нижнего, соединенных вертикальными трубками, содержащими разнопористый гель. По мере движения ионизированных частиц под действием электротока. Более высокая пористость – в верхней части геля.
г) Иммуноэлектрофорез – метод сочетающий электрофорез с иммунодиффузией (для обнаружения антигенов в сложных физиологических смесях). На специальный носитель перпендикулярно друг другу помещают смесь антигенов и смесь антител. При включении электротока они разделяются на индивидуальные вещества и диффундируют на гелевом носителе. В месте встречи антигена с соответствующим антителом происходит специфическая реакция преципитации в форме дуги. Количеств образовавшихся дуг соответствует количеству антигенов.
Дата добавления: 2015-12-22 ; просмотров: 1545 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Характеристикапростых белков.
К простым белкам относят гистоны, протамины, альбумины и глобулины, проламины и глютелины, протеиноиды.
Гистоны — тканевые белки многочисленных организмов, связаны с ДНК хроматина. По электрохимическим свойствам относятся к белкам с резко выраженными основными свойствами. Гистоны имеют только третичную структуру, сосредоточены в основном в ядрах клеток. Гистоны связаны с ДНК в составе дезоксирибонуклеопротеинов. Выделяют 5 типов гистонов. Деление основано на ряде признаков, главным из которых является соотношение лизина и аргинина во фракциях, четыре гистона Н2А, Н2В, Н3 и Н4 образуют октамерный белковый комплекс, который называют «нуклеосомный кор». Молекула ДНК «накручивается» на поверхность гистонового октамера, совершая 1,75 оборота (около 146 пар нуклеотидов). Такой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, ее называют «нуклеосома».
Основная функция гистонов — структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей.
Разделение белков по молекулярной массе
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Ультрацентрифугирование
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия).
Электрофорез
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда.
Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
ДДС-Na является дифильным веществом и содержит заряженную группу и гидрофобную. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
Додецилсульфат натрия (ДДС-Na)
Методы выделения и анализа белков
Препараты высокоочищенных белков находят разнообразное применение в научных исследованиях, медицине и биотехнологии. Так как многие белки, и в особенности глобулярные, высоколабильны (см. с. 80), выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С). К таким методам относится ионообменная хроматография, которая обсуждалась на с. 68. Другие методы выделения белков представлены в этом разделе.
A. Высаливание-Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов . Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля . На выходе колонки элюат собирают в виде отдельных фракций . Объем выхода того или иного белка зависит в основном от его молекулярной массы .
5. Принцип и описание процедуры гель-фильтрациии. Применение в биохимической практике.
Метод позволяет разделить вешества с разной молекулярнйо массой. В хроматографическую колонку помещают гель, через который пропускают буферный растворю частицы геля имеют поры определенного размераю крупные молекулы не проникают в поры геля и поэтому свободно проходят межд частицами геля и первыми вымываются из колонки буферным раствором. Маленькие же частицы задерживаются и дольше находятся в колонке. При гель-хроматографии измеряют оббьем элюирования для каждого вида молекул. Чем больше оббьем элюирования тем меньше молекулярная масса молекул. Молекулярную массу исследуемого вещества можно определить с помощью калибровочного графика.
Дата добавления: 2017-01-28 ; просмотров: 430 | Нарушение авторских прав
источник
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ТАМБОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ Г.Р. ДЕРЖАВИНА
С.Е. Синютина
советом ТГУ имени Г.Р. Державина в качестве
учебного пособия для студентов,
обучающихся по специальностям
Тамбов 2014
Доктор медицинских наук, профессор С.Н. Симонов
Доктор биологических наук, профессор Е.В. Малышева
| С | Гулин, А.В. Биохимия (часть 1): Учебное пособие для студентов университетов, обучающихся по специальностям «Лечебное дело», «Педиатрия», «Стоматология» / А.В. Гулин, С.Е. Синютина, А.г. Шубина; Министерство образования и науки РФ, Тамб. гос. ун-т им. Г.Р. Державина, Тамбов: Издательский дом ТГУ им. Г.Р. Державина, 2014. — с. |
| УДК ББК © Тамбовский государственный университет им. Г.Р. Державина, 2014 |
| С. |
| Предмет биохимии |
| 1. Химия белков |
| 1.1. Методы выделения и очистки белков |
| 1.2. Функции белков |
| 1.3. Аминокислотный состав белков |
| 1.4. Структурная организация белков |
| 1.5. Физико-химические свойства белков |
| 1.6. Классификация белков |
| 1.6.1. Простые белки |
| 1.6.2. Сложные белки |
| 2. Ферменты |
| 2.1. Химическая природа ферментов |
| 2.2.Механизм действия ферментов |
| 2.3. Кинетика ферментативных реакций |
| 2.4. Свойства ферментов |
| 2.5. Регуляция активности ферментов |
| 2.6. Классификация и номенклатура ферментов |
| 2.7. Ферменты в медицине |
| 3. Витамины |
| 3.1. Жирорастворимые витамины |
| 3.2. Водорастворимые витамины |
| 4. Основные принципы организации биомембран |
| 4.1. Строение и функции мембран |
| 4.2. Транспорт веществ через мембрану |
| 5. Механизмы передачи гормонального сигнала |
| 6. Введение в метаболизм |
| 6.1. Общая схема катаболизма |
| 6.2. Биоэнергетика |
| 6.3. Организация и функционирование дыхательной цепи |
| 6.4. Разобщение дыхания и фосфорилирования |
| 6.5. Микросомальное окисление |
| 6.6. Антиоксидантная система |
| 6.7. Реакции общего пути катаболизма |
| 6.7.1. Окислительное декарбоксилирование ПВК |
| 6.7.2. Цикл трикарбоновых кислот |
| 7. Обмен углеводов |
| 7.1. Переваривание углеводов |
| 7.2. Обмен гликогена |
| 7.3. Гликолиз |
| 7.4. Включение фруктозы и галактозы в гликолиз |
| 7.5. Челночные механизмы |
| 7.6. Цикл Кори |
| 7.7. Спиртовое брожение |
| 7.8. Пентозофосфатный путь превращения глюкозы |
| 7.9. Глюконеогенез |
| 7.10. Регуляция обмена углеводов |
| 7.11. Нарушения углеводного обмена |
| Литература |
ПРЕДМЕТ БИОХИМИИ
Биохимия– наука, изучающая химические основы процессов жизнедеятельности, химические компоненты живых клеток, а также реакции и процессы, протекающие с их участием. Предметом медицинской биохимии являются химические процессы, происходящие в организме человека в норме и при патологии.
Основная цель биохимии — изучение молекулярных основ физиологических функций человека в норме с учетом онтогенеза, молекулярных механизмов развития патологических процессов, предупреждения и лечения болезней, биохимических методов диагностики болезней и контроля состояния здоровья человека.
Ряд выдающихся открытий в биохимии и в некоторых ее разделах –молекулярной биологии, энзимологии, биоэнергетике, биохимической генетике и др., — выдвинули ее в раздел фундаментальных научных дисциплин, сделав орудием решения важных биологическх и медицинских проблем.
ХИМИЯ БЕЛКОВ
Белки — высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот, соединенных пептидными связями. Используют также термин «протеины» (от греч. рrotos – первый). Белки получили свое название, когда в тканях животных и растений были обнаружены вещества, схожие с белком куриного яйца.
Белки являются основой структуры и функций живых организмов. Природные белки построены из 20 различных аминокислот. Эти аминокислоты чередуются в разнличной последовательности, поэтому способны образовывать порядка 10 18 разнообразных белков. Белки обеспечивают существование сотен тысяч видов живых организмов — от простейших вирусов до человека. Каждый организм характеризуется уникальным набором белков.
Содержание белков в тканях даже одного организма различается. Так, содержание белков в организме человека в % сухой массы: в мышцах – 80, в мозге – 45, в костях – 20.
Элементный состав белков в пересчете на сухое вещество, %: С — 50-54; Н — 6,5-7,3; О — 21-23; N — 15-17; S — до 0,5. Некоторые белки содержат небольшие количества фосфора, железоа, марганеца, магния, йода и др. Содержание азота в белках относительно постоянно — около 16%, поэтому по белковому азоту можно определять количество белка в биологических объектах.
МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ
Белки под действием различных факторов (действие химических реагентов, нагревание и др.) легко подвергаются денатурации: происходит разрушение нативной структуры белков, приводящее к потере некоторых природных свойств, например, растворимости, биологической активности. Поэтому для выделения белков используют специальные приемы.
Процесс начинают с гомогенизациибиологического материала – измельчения до разрушения клеток и клеточных структур. Используют гомогенизаторы (пестиковые или ножевые), ультразвук, шаровые мельницы, метод попеременного замораживания и оттаивания ткани, метод «азотной бомбы».
Следующий этап — экстракция белков буферными смесями с определенными значениями рН, органическими растворителями. Большинство белков хорошо растворимо в 8-10% растворах солей.
Следующий этап — фракционированиеи очистка белков с использованием различных методов.
Высаливание – осаждение белков из раствора при добавлении растворов солей щелочных и щелочноземельных металлов. Метод применяется в клинической практике при анализе белков сыворотки крови. Так проводят разделение глобулинов (выпадают в осадок при 50% насыщении раствора сульфатом аммония) и альбуминов (осаждаются при 100% насыщении).
Электрофорез основан на различной подвижности белков в электрическом поле в зависимости от значений рН и ионной силы раствора. Используется в медицинской практике для анализа состава сыворотки крови, белковых и пептидных смесей.
Ультрацентрифугирование — метод разделения жидких дисперсных сред на компоненты под действием центробежной силы.
Хроматография — физико-химический метод разделения и анализа смесей веществ, основанный на распределении их компонентов между двумя несмешивающимися фазами – неподвижной (сорбент) и подвижной (элюент). В клинических лабораториях хроматографию применяют для разделения и анализа аминокислот, белков, углеводов, фосфолипидов, стероидов в плазме крови, тканевых экстрактах, моче.
Различают следующие виды хроматографии:
— адсорбционная– компоненты смеси разделяются в зависимости от их сорбируемости на твердом адсорбенте;
— распределительная — твердая фаза является опорой для стационарной жидкой фазы (бумажная хроматография);
— ионообменная — используют ионообменную смолу. Часть белков обменивается с функциональными группами ионообменной смолы и задерживается на колонке, в то время как другие белки элюируются из колонки;
— гель-хроматография или метод молекулярных сит позволяет разделить белки с разной молекулярной массой: небольшие молекулы проникают в поры геля, тогда как большие молекулы остаются снаружи и передвигаются вместе с подвижной фазой через хроматографическую колонку.
Перспективными видами хроматографии являются в настоящее время высокоэффективная жидкостная хроматография (ВЭЖХ) и газовая хроматография.
ФУНКЦИИ БЕЛКОВ
Структурная функция. В комплексе с липидами белки участвуют в образовании биомембран клеток. Структурные белки цитоскелета придают форму клеткам и многим органоидам. Примерами структурных белков являются коллаген в соединительной ткани, кератин в волосах, коже, ногтях.
Сократительная (двигательная) функция.Сократительную функцию выполняют мышечные белки (актин и миозин). Белки цитоскелета необходимы для расхождения хромосом в процессе митоза.
Питательная (резервная) функция. Овальбумины(белки яйца) — источники питания для плода. Казеин — белок молока — также выполняет питательную функцию.
Каталитическая функция. Большинство известных в настоящее время ферментов (биологических катализаторов) является белками.
Транспортная функция. Белок эритроцитов гемоглобин участвует в переносе кислорода и углекислого газа, выполняя дыхательную функцию. Альбумины сыворотки крови участвуют в транспорте липидов.
Защитная функция. В ответ на поступление в организм вирусов, бактерий, чужеродных белков, токсинов образуются защитные белки — антитела (иммунная защита). Специфические белки плазмы крови способны к свертыванию, что предохраняет от кровопотери при кровотечениях (физическая защита).
Рецепторная функция. Клеточные белки образуют специфические рецепторы и участвуют в передаче гормонального сигнала.
Гормональная функция. Группа гормонов являются белками или полипептидами, например, гормон гипофиза вазопрессин.
Другие важные функции белков — буферные свойства (обеспечение физиологического значенияе рН внутренней среды), поддержаниеь онкотического давлениея в клетках и крови, и др.
источник
Изучение химической структуры белков начинается с их гидролиза. Выделенные из органов и тканей белки гидролизуются в
- 6.. .12N H2S04 или НС1 в течение 6. 20 ч при 100. ПО °С. В этих условиях белки распадаются с образованием аминокислот. Однако при кислотном гидролизе разрушаются триптофан, частично серин и треонин. Для предохранения этих аминокислот от разрушения прибегают к гидролизу белков в 2N щелочи при
- 100.. . 110 °С. В свою очередь, щелочной гидролиз разрушает и ряд других аминокислот (аргинин, цистин, серин и треонин), а также приводит к рацемизации (потере оптической активности) аминокислот.
Более надежный метод, позаимствованный у живой природы, — гидролиз с помощью протеолитических ферментов. В организме расщепление белка катализируется ферментами — протеазами. Ферментативные методы гидролиза особенно ценны благодаря присущей им во многих случаях специфичности. Например, фермент трипсин расщепляет только те пептидные связи, у которых карбонильная группа принадлежит одной из основных аминокислот (лизину, аргинину) (табл. 3.4).
Сведения о свойствах наиболее важных протеолитических ферментов
Специфичность (атакуемые связи)
. R-Phe . R-Туг . Leu — Gin . Leu — Val
Комбинируя методы кислотного, щелочного и ферментативного гидролиза, с помощью различных методов анализа аминокислот можно установить аминокислотную последовательность белка.
Аминокислотную последовательность белка принято обозначать цепью из трехбуквенных или однобуквенных символов соответствующих аминокислот. Первым природным полипептидом, чья аминокислотная последовательность была установлена, стал инсулин:
Наличие ионизированных групп в боковых цепях полипептида обусловливает электролитную природу белков. Доля ионизированных концевых групп полипептидной цепи черезвычайно мала. Степень ионизации боковых групп зависит от pH среды. Значение pH, при котором белковая молекула имеет одинаковое число положительных и отрицательных ионизированных групп, носит название изоэлектрической точки белка (ИЭТ). В ИЭТ растворимость белка минимальна; белок остается неподвижным в электрическом поле постоянного тока. Каждый индивидуальный белок характеризуется своим значением ИЭТ.
При добавлении водородных ионов снижается pH среды, и белок вследствие подавления диссоциации карбоксильных групп находится в форме катиона. При добавлении щелочи повышается pH, заряд белковой молекулы меняется на отрицательный и молекула белка становится анионом. Таким образом, белки относятся к полиамфолитам.
Титрование. Метод титрования, описанный в гл. 2 как способ определения рКа слабых кислот, оснований и аминокислот, используется также как метод идентификации и определения изо- электрических точек белков.
Графическая зависимость величины pH среды от количества добавленных кислоты или щелочи (ионов Н + или ОН — ) называется кривой титрования белка. Для каждого белка кривая титрования индивидуальна и зависит от набора и количества в составе белка аминокислотных радикалов и значений их рКа. Буферная емкость белков зависит от количества имеющихся одинаково ионизирующих функциональных групп аминокислотных радикалов. На базе кривых титрования разработаны аминокислотные анализаторы pH, с помощью которых проводится анализ биологических жидкостей на содержание различных аминокислот.
Для того чтобы провести анализ биологической жидкости на содержание различных аминокислот, необходимо знать значение их рКа.
источник
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Физико-химические свойства белков обусловлены их структурной организацией и зависят от факторов внешней среды.
1. Высокая молекулярная масса — от 6000 до нескольких миллионов Дальтон.
2. Амфотерность – способность белка проявлять кислотные и основные свойства.В молекуле белка есть катионообразующие группы (аминогруппы) и анионообразующие (карбоксильные группы). Если преобладают карбоксильные группы, то заряд молекулы отрицательный (слабокислые свойства), если аминогруппы – то положительный (основные свойства). Заряд белка также зависит от рН среды. В кислой среде молекула приобретает положительный заряд, в щелочной – отрицательный.
3. Гидратация и растворимость. Зависит от сродства аминокислотных остатков на поверхности белковой молекулы к воде.
4. Способность к ионизации. Благодаря наличию аминогрупп и карбоксильных групп белки – амфотерные полиэлетролиты. В растворах находятся в виде биполярных ионов.
5. Способность радикалов аминокислот к химическим превращениям и взаимодействиям.
6. Способность к денатурации и ренатурации.
7. Способность к гидролизу. Благодаря пептидной связи белки подвергаются кислотному, щелочному и ферментативному гидролизу. При этом образуются свободные аминокислоты.
Факторы стабилизации белка в растворе.
1. Гидратная оболочка – слой молекул воды на поверхности белковой молекулы. Вода связана с белковой молекулой слабыми связями («связанная вода»). Гидратная оболочка не дает белковым молекулам сближаться и выпадать в осадок.
2. Заряд белковой молекулы. На поверхности белковой молекулы есть положительно и отрицательно заряженные радикалы аминокислот. Количество этих групп и, следовательно, заряд белков зависят от рН среды. Значение рН, при котором белок имеет нулевой заряд, называется изоэлектрической точкой (ИЭТ). В ИЭТ белки наименее устойчивы. При потере заряда в ИЭТ белки агрегируют и выпадают в осадок.
Денатурация– нарушение нативной конформации белка. При денатурация изменяются физико-химические свойства и теряется биологическая активность белка. При денатурации не изменяется первичная структура, но изменяется вторичная, третичная и, если есть, четвертичная структура.
1. Физические (высокая температура, вибрация, радиация, УФО, ультразвук и др.).
2. Химические (мочевина, кислоты и щелочи, соли тяжелых металлов, растительные алкалоиды, органические растворители и др.).
При денатурации уменьшается растворимость, изменяется электрофоретическая подвижность, изменяется число реакционных групп.
Способность белков к денатурации используется в медицине.
- Пастеризация продуктов.
- Стерилизация шовного материала.
Ренатурация– восстановление нативной конформации денатурированного белка. При ренатурации восстанавливаются физико-химические свойства белков и их активность. В организме происходит быстрая ренатурация при помощи специфических белков — шаперонов. Шапероны присоединяются к денатурированному белку слабыми связями и создают условия для ренатурации.
Классификации белков.
1.По растворимости — водорастворимые (альбумины), солерастворимые (глобулины), спирторастворимые (протамины), нерастворимые (склеропротеины).
2.По форме белковой молекулы – фибриллярные, глобулярные, мембраносвязанные.
3.По химическому строению – простые белки (состоят только из аминокислот) и сложные (состоят из аминокислот и небелковой части – липидов, углеводов, металлов, нуклеиновых кислот).
4.По функциям – структурная, каталитическая, регуляторная, двигательная, транспортная, рецепторная, защитная, резервная, опорная.
Методы исследования белков.
Дата добавления: 2016-11-23; просмотров: 573 | Нарушение авторских прав
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы.
При этом все большее количество гидратированных неорганических ионов связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание).
Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ.
Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков вносят в колонку с гелем и элюируют буферным раствором.
Белковые молекулы, не способные проникать в гранулы геля, будут перемещаться с высокой скоростью. Средние и небольшие белки будут в той или иной степени удерживаться гранулами геля. На выходе колонки элюат собирают в виде отдельных фракций. Объем выхода того или иного белка зависит в основном от его молекулярной массы.
Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) является общепринятым методом определения гомогенности белковых препаратов.
Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы.
Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют.
Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики.
Электрофорез проводят в тонком слое полиакриламида.
После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков; выделенного из экстракта гомогенного белка; контрольной смеси белков с известными молекулярными массами.
Изменение белкового состава организма. В процессе развития организма белковый состав значительно меняется. В специализированных тканях появляются специфические белки. Например, гемоглобин в эритроцитах, родопсин в клетках сетчатки глаза. Специализированные клетки отличаются и по количеству белков, присутствующих во всех или во многих тканях организма. Белковый состав организма здорового взрослого человека относительно постоянен.
Вариации количества отдельных белков могут определяться составом пищи, режимом питания, физиологической активностью.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называют протеинопатиями. Различают наследственные и приобретенные протеинопатии. Пример наследственной протеинопатии – гемоглобинопатии. В зависимости от роли дефектного белка в жизнедеятельности организма наследственные протеинопатии могут вызывать болезни или летальный исход.
При наследственных протеинопатиях нарушается первичная структура белка.
Приобретенные протеинопатии развиваются в результате болезни. В этом случае первичная структура белка не нарушается, а происходит
количественное изменение белков в пораженном органе или ткани.
2. изменение биологической активности белков из-за нарушения нативной конформации:
– при сдвигах рН среды в щелочную или кислую сторону;
– при присоединении низкомолекулярных веществ к белкам, например, при сахарном диабете к белкам крови присоединяется глюкоза;
Изменение белкового состава крови и мочи используется для диагностики ряда заболеваний.
Ультрацентрифугирование,метод разделения и исследования высокомолекулярных соединений, вирусов и субклеточных частиц с помощью ультрацентрифуги.
Идея ультрацентрифугирования была предложена А. В. Думанским в 1913, однако разработка современной теории седиментационного анализа стала возможной только после того, как Т. Сведберг в 1926 сконструировал высокоскоростную ультрацентрифугу, обеспечивавшую ускорение 105 g.
Принято различать 2 типа ультрацентрифугирования: препаративное и аналитическое. Препаративное ультрацентрифугирование применяют для фракционирования и выделения биополимеров в количествах, достаточных для практических целей.
Широко используют ультрацентрифугирование в градиенте плотности растворовсахарозы, глицерина, декстринов; оно позволяет разделять смеси веществ на отдельные компоненты, различающиеся эффективной массой и коэффициентом трения частиц или молекул.
Применение зональных и проточных роторов дало возможность значительно повысить объёмы растворов фракционируемых частиц и использовать их для очистки вируса гриппа при изготовлении вакцин.
Аналитическое ультрацентрифугирование используют для исследования гомогенности (чистоты) препаратов биополимеров (белков, нуклеиновых кислот, полисахаридов), а также для определения константседиментации, молекулярной массы, констант ассоциации и размеров макромолекул. Ультрацентрифугирование применяется в медицине при клинической диагностике, для приготовления кровезаменителей и т.п.
В., Методы исследования биополимеров с помощью аналитической ультрацентрифуги, в кн.: Современные методы в биохимии, М., 1964; Боуэн Т., Введение в ультрацентрифугирование, пер.
с англ., М., 1973; Schachman Н.
К., Ultra centrifugation in biochemistry, N. Y. — L., 1959.
84-85
Биомолекулы. Пептиды и белки

с. 80), выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С). К таким методам относится ионообменная хроматография, которая обсуждалась на с. 68. Другие методы выделения белков представлены в этом разделе.
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание).
При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Для отделения низкомолекулярных примесей или замены состава среды используют диализ.
Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул.
Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а).
Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью.
Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в).
На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3).
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)] является общепринятым методом определения гомогенности белковых препаратов.
Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля (см. с. 270). Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда.
Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами (см. с. 34). Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют.
Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики (1).
Электрофорез проводят в тонком слое полиакриламида (2). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков (а); выделенного из экстракта гомогенного белка (б); контрольной смеси белков с известными молекулярными массами (в).
источник
Среди методов, используемых в биохимии, ключевое значение имеют выделение веществ из биологических источников и, как правило, их очистка с целью получения индивидуальных соединений.
Следует отметить три главные проблемы выделения в индивидуальном виде компонентов из живых организмов:
1) Исходный материал биомасса состоит из многих сотен и даже тысяч различных соединений. Разделение таких смесей чрезвычайно сложно, кроме того многие компоненты этих смесей построены довольно однотипно (например, иммуноглобулины). В связи с этим они мало различаются между собой по физико-химическим характеристикам — растворимости или способности к сорбции на определенном типе сорбента.
2) Работа с биохимическими объектами зачастую сопровождается необходимостью манипулировать с очень небольшими количествами исходного вещества. При ничтожно малом количестве используемого материала методы их детекции должны быть высокочувствительными. Такими методами являются спектрофотометрические методы, основанные на измерении поглощения видимого или ультрафиолетового света, радиохимические методы, основанные на изменении радиоактивности, и люминесцентные, основанные на изменении флуоресценции, био- и хемилюминесценции.
3) Многие компоненты обладают очень низкой устойчивостью. Часто задача состоит в том, чтобы выделить белок в нативном, т.е. сохраняющим биологическую активность состоянии. Между тем многие белки при умеренных температурах и незначительных изменениях рН среды подвержены денатурации, которая обычно сопровождается потерей биологической активности -инактивацией. Кроме того, в клетках часто имеются ферменты (в неповрежденных клетках в лизосомах) способные разрушить те или иные вещества, в первую очередь белки.
Традиционные методы выделения и очистки белков
Все методы разделения смесей основаны на том, что разделяемые компоненты в результате каких-либо манипуляций оказываются в разных участках системы и могут быть механически отделены друг от друга.
Выделение индивидуальных белков является ступенчатым процессом, т.к. на первых этапах очистки фракции содержат множество примесей. На каждой ступени разделения должна получаться фракция, более богатая необходимым веществом, чем предыдущая. Такой процесс часто называют фракционированием.
На каждой стадии разделения белок находится либо в виде раствора, либо в виде осадка.
1) Осаждение . Для осаждения необходимо понизить каким-либо способом растворимость белка. Растворимость белка зависит от их способности к гидратации. У глобулярных водорастворимых белков высокий уровень гидратации обеспечивается расположением гидрофильных групп на поверхности. Добавление органических растворителей понижает степень гидратации и приводит к осаждению белка. В качестве таких растворителей используют ацетон. Осаждают белки также с помощью солей, например, сульфата аммония. Принцип этого метода основан на том, что при повышении концентрации соли в растворе происходит сжатие ионных атмосфер, образуемых противоионами белка, что способствует сближению их до критического расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения перевешивают кулоновские силы отталкивания противоионов. Это приводит к слипанию белковых частиц и их выпадению в осадок.
2) Изоэлектрическое осаждение . Заряд белков обусловлен в первую очередь остатками аспаратата и глутамата (отрицательный заряд) и остатками лизина и аргинина (положительный заряд). По мере повышения рН различными способами заряд белков проходит от положительных к отрицательным значениям и в изоэлектрической точке оказывается равен нулю. В результате белок лишается своей ионной атмосферы и его частицы слипаются, выпадая в осадок.
3) Центрифугирование . Выпавший осадок белка можно выделить фильтрованием. Для этого часто пользуются центрифугами. Частицы осажденного вещества под действием центробежной силы оседают на дне центрифужных стаканов и сжимаются в плотный осадок, с которого оставшийся раствор (надосадочная жидкость, или супернатант) легко сливается или отсасывается. Скоростные центрифуги (ультрацентрифуги) создают центробежное ускорение порядка 100000g (т.е. 100000 ускорений свободного падения), что позволяет осаждать даже некоторые крупные надмолекулярные агрегаты — рибосомы и вирусы.
4) Сорбция . Основана на различном сродстве компонентов смесей к определенным веществам сорбентам. Наиболее часто используемый сорбент гель фосфата кальция (гидроксиапатит) или активированный уголь. Эффективную сорбцию можно получить на ионитах сорбентах, имеющих на поверхности заряженные группы. В исходном состоянии эти заряды скомпенсированы какими-либо подвижными противоионами. Практически при сорбции на ионитах происходит обмен этих противоионов. Если на поверхности сорбента находятся отрицательно заряженные группы, то он связывает катионы и его называют катионитом, соответственно сорбент с положительно заряженными группами называют анионитом. В качестве ионитов чаще всего используют материалы (после соответствующей химической обработки) на гидрофильной основе — целлюлозе, декстране, силикагеле или пористых стеклах.
5) Ситовой эффект . Молекулярные сита представляют собой материалы с очень маленькими порами определенного размера. Следует отметить отличие этих «сит»: крупные частицы не остаются на поверхности материала сита, а обтекают его частички (гранулы), тогда как мелкие вещества примесей диффундируют в частицы сита и таким образом задерживаются. Материалом для молекулярных сит может служить сефадекс (полисахарид декстран, у которого после соответствующей обработки цепи оказываются сшитыми трехуглеродными мостиками) или полиакриламид, линейные цепи которого сшиты метиленовыми мостиками.
В перечисленных методах в конечной смеси остаются вспомогательные низкомолекулярные вещества органические растворители, соли и кислоты. Для очищения от них используется метод диализа. Диализ основан на применении мембран проницаемых для воды и низкомолекулярных веществ и непроницаемых для белков. Чаще всего с этой целью используют пленки из целлофана (нитрат целлюлозы). В лаборатории подлежащий диализу раствор белка помещают в мешок из целлофана и погружаю последний в сосуд с водой. Непрерывный ток воды через сосуд приводит к полному переходу в него всех проходящих через целлофан веществ, а белки остаются внутри.
Методы зонального разделения
Эти методы основаны на том, что создается некоторая система, в которой компоненты смеси перемещаются с различными скоростями. Если в такую систему ввести разделяемую смесь в виде некоторой зоны, то по мере ее перемещения компоненты смеси, движущиеся с разными скоростями, будут формировать отдельные зоны, которые затем можно разнести в разные приемники.
1) Хроматография . При разделении белков и их анализе используется жидкостная хроматография. В жидкостной хроматографии зона разделяемых веществ с помощью тока элюирующей (вымывающей) жидкости перемещается относительно неподвижной фазы, которая обладает разным сродством к разделяемым компонентам. При перемещении зоны с помощью тока элюента каждый из разделяемых компонентов проводит некоторую часть времени на неподвижной фазе. Чем больше это время, тем медленнее перемещается зона с разделяемой смесью.
В зависимости от природы физико-химического явления, лежащего в основе разделения веществ, различают адсорбционную, ионообменную, распределительную и гель-хроматографию (эксклюзивную хроматографию). В адсорбционной чаще всего используют оксид алюминия в качестве неподвижной фазы. В ионообменной используются те же типы ионитов, что в ионообменной сорбции. Распределительная хроматогрфия основана на разделении веществ между двумя несмешивающимися жидкими фазами. Неподвижная жидкая фаза образуется в результате ее закрепления на пористом нерастворимом носителе.
2) Электрофорез . В этом случае зоны создаются в результате того, что разные компоненты смеси с различной скоростью перемещаются в электрическом поле. После специальной обработки разделяемые смеси наносят на гель (декстроновый, полиакриламидный, или другой) а затем подключают но определенное время постоянный электрический ток. Белки в зависимости от своей молекулярной массы и заряда начинают двигаться с различной скоростью. После отключения тока гель помещают в специальный раствор, где интересующие исследователя белки окрашиваются. Существует электрофорез в растворе, но он имеет ограниченное применение, т.к. исследуемые белки часто подвергаются значительному диффузионному размыванию. Однако сейчас стало возможным применять этот метод в условиях невесомости в космосе, что устраняет конвекционные токи, обуславливающие диффузионную размывку.
Все описанные выше методы зонального разделения являются одномерными, разделение в них происходит в одной координате. Наряду с этим применяются двумерные системы разделения на пластинах. При этом разделяемую смесь в виде пятна наносят на один из углов и разделяют в одном направлении. Затем какие-либо параметры, определяющие разделяющую способность системы изменяют и проводят разделение в перпендикулярном направлении. При удачном подборе системы и условий разделения удается разделить те компоненты, которые не разделились при первой процедуре. Комбинации методов могут быть довольно разнообразны: двумерная хроматография с использованием в разных направлениях разных элюентов, хроматография в одном и электрофорез в другом направлениях.
Определение первичной структуры белков
Определение первичной структуры белков сводится к выяснению порядка расположения аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода секвенирования (от англ. sequence последовательность).
Собственно секвенирование на его сегодняшнем уровне позволяет определить аминокислотную последовательность а полипептидах, размер которых не превышает несколько десятков аминокислотных остатков. В то же время исследуемые полипептидные фрагменты значительно короче тех природных белков, с которыми приходится иметь дело. Поэтому необходимо предварительное разрезание исходного полипептида на короткие фрагменты. После секвенирования полученных фрагментов их необходимо снова сшить в первоначальной последовательности.
Таким образом определение первичной последовательности белка сводится к следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной, доступной для секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных структур его фрагментов.
Для специфического расщепления белков по определенным точкам применяются как ферментативные, так и химические методы. Из ферментов, катализирующих гидролиз белков по определенным точкам, наиболее широко используют трипсин и химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет белки после остатков ароматических аминокислот — фенилаланина, тирозина и триптофана. При необходимости специфичность трипсина может быть повышена или изменена. Например, обработка цитраконовым ангидридом исследуемого белка приводит к ацилированию остатков лизина. В таком модифицированном белке расщепление будет проходить только по остаткам аргинина.
источник



