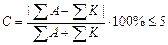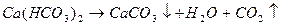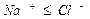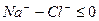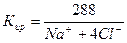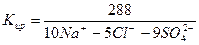Обработку анализа выполнить в следующей последовательности:
Перевести анализ воды из весовой в эквивалентную и процент-эквивалентную формы.
Вычислить погрешность анализа по формуле:
Определить минерализацию воды. Вычислить жесткость воды. Оценить пригодность воды для питья. Оценить агрессивность воды по отношению к бетонным и металлическим конструкциям.
Результаты химического анализа природных вод, мг/дм 3
Предельно-допустимые концентрации на питьевую воду. (СанПиН 2.1.4.559-96)
Анализ химического состава подземных вод открывает пути для изучения генезиса, пригодности для различных потребителей, определения уровня их агрессивности для бетонных и металлических конструкций. Результаты химических анализов воды могут быть выражены в весовой, эквивалентной и процент — эквивалентной форме.
Перевести анализ воды из весовой в эквивалентную и процент — эквивалентную формы.
Эквивалентная форма записи состава вод позволяет определить соотношение между ионами с точки зрения их способности участвовать в химических реакциях, оценить качество анализа, установить генезис вод. В расчетах используется форма записи:
где Э-химический эквивалент иона.
Процент — эквивалентная форма показывает относительную долю участие того или иного иона в формировании ионно — солевого состава воды.
Анализ воды в эквивалентной и процент — эквивалентной форме.
Вычисление погрешности анализа.
На основе эквивалентной формы выражения состава можно определить погрешность анализа воды. Эта оценка основана на принципе электронейтральности раствора: сумма концентраций катионов (мг-экв/дм 3 ) равна сумме концентраций анионов. Анализ воды считается удовлетворительным, если погрешность определения менее 5%.
Вывод: Анализ воды считается удовлетворительным, т.к. погрешность определения составляет Е = 2,37 % и это меньше 5%.
Определение минерализации воды.
Минерализация воды (М) — это сумма минеральных веществ, в граммах или миллиграммах, содержащихся в 1 дм 3 воды.
М = К + + Nа + + Са 2+ + Мg 2+ + НСО3 — + SО4 2 — + СI — +Аs + Fе + Рb + Zn + Нg + Си + F — + NО3 — + Мn
М=1+7+59+16+163+63+19,5+0,02+0,2+0,7+0,1+0,001+1,0+0,5+10,0+0,07=341,091 мг/дм 3
Вычисление жесткости воды.
Жесткость воды — это совокупность свойств, обусловленных содержанием в воде катионов кальция Са 2+ и катионов магния Мg 2+ .
Если концентрация этих катионов велика (Жо > 7 мг-экв/дм 3) , то воду называют жесткой, если мала (Жо 3 ) — мягкой.
Различают: общую, карбонатную, временную (устранимую), некарбонатную, неустранимую (постоянную) жесткости.
Общая жесткость определяется как сумма мг-экв ионов Са 2+ + Мg 2+ в 1дм 3 воды и слагается из Жк карбонатной и Жнк некарбонатной жесткости.
Жо = 2,809524+1,311475=4,120999 мг-экв/дм 3 .
Вывод: При расчете результата анализа жесткости грунтовых вод было выявлено, что данная вода является мягкой и дополнительного умягчения не требует.
Оценка пригодности воды для питья.
Согласно СанПиН 2.1.4.559-96 (Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества.) данная грунтовая вода не пригодна для питья, т.к. не отвечает выше указанному документу и имеет превышение по 2 компонентам: ртуть, свинец.
Оценка агрессивности воды по отношению к бетонным и металлическим конструкциям.
Агрессивность воды связана с присутствием в ней ионов водорода, свободного диоксида углерода, сульфатов и магния. Агрессивные свойства воды проявляются по отношению к бетону и металлам.
Агрессивность воды по отношению к бетону выражается в разрушительном воздействии подземных вод определенного состава. Оценка качества воды производится по нормам и техническим условиям. Эти нормы учитывают воздействие следующих видов агрессивности: выщелачивающую, углекислую, общекислотную, сульфатную и магнезиальную.
1) Выщелачивающую агрессивность связана с выщелачиванием карбонатов, главным образом кальция. Если вода, контактирующая с бетоном, содержит низкие концентрации Са 2+ , НСО3 — и СО3 2-, то карбонат кальция бетона переходит в раствор. Для бетона вода считается агрессивная при карбонатной жесткости меньше 0,54 — 2,14 мг-экв/дм 3 .
Так как, данная грунтовая вода имеет карбонатную жесткость (НСО3 — 61мг-экв/дм 3 ), и низкую концентрацию катионов кальция (Са 2+ — 59 мг/дм 3) , то вода является не агрессивной для бетонных сооружений.
2) Углекислотная агрессивность обусловлена высокими концентрациями растворенной в воде углекислоты СО2. Эта агрессивность проявляется как в отношении металла (коррозия), так и бетона. Воды, обладающие карбонатной жесткостью менее 1,4 мг-экв/дм 3 , следует считать агрессивными.
Так как, данная грунтовая вода имеет карбонатную жесткость (НСО3 — 61мг-экв/дм 3 ), то вода является не агрессивной для бетонных сооружений.
3) Общекислотная агрессивность воды связана с повышенной концентрацией ионов водорода Н + (пониженная величина рН). При этом бетон разрушается из-за растворения в кислой среде защитной карбонатной корки. Вода считается агрессивной для всех типов цементов: при рН 3 , при рН 3 .
Грунтовая вода имеет кислую среду (рН — 7,7) и карбонатной жесткость (НСО3 — 61 мг-экв/дм 3 ), тем самым не разрушает бетонные конструкции и не является агрессивной средой.
4) Сульфатная агрессивность обусловлена присутствием в воде иона SО4 2- . Этот вид агрессии проявляется в кристаллизации в бетоне новых соединений и выщелачивании бетона. По сульфатной агрессии для обычных цементов воду относят к слабоагрессивной при содержании иона SО4 2 — от 250 — 800 мг/дм 3 и к агрессивной при содержании более 800 мг/дм 3 .
Так как, данная грунтовая вода имеет слабую сульфатную агрессивность (SО4 2 — 63 мг/дм 3 ), то вода является не агрессивной для бетонных сооружений.
5) Магнезиальная агрессивность вызывает разрушение и вспучивание бетонных конструкций.
Так как, данная грунтовая вода имеет слабую магнезиальную агрессивность (Мg 2+ 16 мг/дм 3 ), то вода является не агрессивной для бетонных сооружений.
6) Агрессивность воды по отношению к металлу связана с коррозирующей способностью вод. Агрессивные по отношению к металлу являются воды: углекислые; сероводородные кислые; обогащенные кислородом. Корродирующая способность воды определяется при помощи коэффициента коррозии:
Кк= 1,311475 — 56,597500 = — 55,286025 мг-экв/дм 3
По величине коэффициента коррозии различают следующие группы вод (содержание Са 2+ в мг/дм 3 ):
Кк + 0,05 Са 2+ 3 загрязненной воды.
Данная грунтовая вода не пригодна для питья, так как имеет превышение по 2 компонентам: ртуть, свинец.
Для нейтрализации ионов ртути применяют Na2S (двукратный избыток от стехиометрического соотношения).
Ответ: Для удаления ионов ртути необходимо 0,0007 килограмм сульфида натрия. Для удаления ионов свинца применяют щелочные агенты (СаО, Са (ОН) 2, Nа2СО3, NаОН).
Ответ: Для удаления ионов свинца необходимо 0,189 килограмм СаО.
грунтовая вода очистка загрязненный
Ответ: Для удаления ионов свинца необходимо 0,252 килограмм Са (ОН) 2.
Ответ: Для удаления ионов свинца необходимо 0,357 килограмм Nа2СО3.
Ответ: Для удаления ионов свинца необходимо 0,266 килограмм NаОН. Обработка результатов химического анализа сточной воды, взятой из скважин также показала, что данная сточная вода не имеет превышения по жесткости и кислотности. Поэтому по жесткости и кислотности расчетов не требуется.
источник
С целью определения химического состава растворенных в воде веществ производят химический анализ воды.
Полнота и характер анализа могут быть различными. В практике применяются общие, сокращенные и специальные анализы воды в зависимости от задач и целей исследований. Анализы производятся в полевых и стационарных условиях.
Результаты химического анализа воды могут быть представлены в различных формах. Различают ионно-весовую, эквивалентную и процент-эквивалентную формы выражения химических анализов.
Ионно-весовая форма – основная форма выражения результатов анализа, представляет собой выражение ионно-солевого состава подземных вод в виде весовых количеств отдельных ионов в миллиграммах или граммах на 1 л воды, а для минерализованных вод и рассолов – на 1 кг воды.
Однако для полной характеристики свойств воды ионная форма выражения анализа недостаточна. Поэтому наряду с ионной формой пользуются миллиграмм-эквивалентной (мг-экв) формой выражения анализа, наиболее полно отражающей внутреннюю химическую природу входящих в состав воды веществ и ее важнейшие свойства.
Эквивалентная форма основана на том положении, что ионы в растворе реагируют между собой не в равных весовых количествах, а в эквивалентных количествах, зависящих от массы иона и их валентности. Эквивалентным весом иона называется частное от деления его ионной массы на валентность, например: эквивалент Nа + равен 23/1; Сl — – 35,5/1; Са 2+ – 40/2. Следовательно, при реакции реагируют не 1 грамм Nа с 1 граммом Сl, а 1 эквивалент Nа + с 1 эквивалентом Сl — .
Для перехода от ионно-весовой формы к мг-экв форме необходимо число миллиграммов каждого иона разделить на его эквивалентный вес, или умножить на коэффициент, представляющий величину, обратную эквивалентному весу. В таблице 14 представлены пересчетные коэффициенты для наиболее распространенных в подземных водах ионов. Если содержание какого-либо иона выражают в эквивалентной форме, то перед символом ставят знак «r» (реагирующая величина).
Согласно правилу Фрезениуса, все химические соединения, растворенные в водном растворе, реагируют между собой в эквивалентных количествах, т. е.
Практически в полном анализе, когда все ионы определяются аналитически, точного совпадения цифр ввиду погрешностей анализа не бывает.
Для сопоставления химического состава природных вод различной минерализации и более ясного представления о соотношениях между ионами одной и той же воды проводится пересчет результатов анализа воды в процент-эквивалентную (%-экв) форму.
Эквивалентные массы и пересчетные коэффициенты
| Анионы А | Эквивалентная масса | Пересчетный коэффициент | Катионы, К | Эквивалентная масса | Пересчетный коэффициент |
| Сl — | 35,457 | 0,02820 | Na + | 22,997 | 0,04348 |
| SO4 2- | 48,033 | 0,02082 | К + | 39,098 | 0,02558 |
| НСО3 — | 61,018 | 0,01639 | Мg 2+ | 12,160 | 0,08224 |
| СО3 2- | 30,005 | 0,03333 | Са 2+ | 20,040 | 0,04990 |
| NO2 — | 46,008 | 0,02174 | NH4 + | 18,040 | 0,05543 |
| NО3 — | 62,008 | 0,01613 | Fe 2+ | 27,925 | 0,03581 |
| PO4 3- | 31,658 | 0,03159 | Fе 3+ | 18,617 | 0,05371 |
Для вычисления %-экв принимают сумму мг-экв анионов (∑гА), содержащихся в 1 л воды за 100 % и вычисляют процент содержания каждого аниона в мг-экв по отношению к этой сумме. Аналогично поступают и с катионами:
%-экв А = 100∙гА/∑гА; %-экв К = 100∙гК/∑гК (8)
Результат анализа воды, выраженный в различных формах, представляют в виде табл. 15.
Пример выражения результатов химического анализа воды
| Катионы | Содержание | Анионы | Содержание | ||
| мг/л | мг-экв/л | %-экв/л | мг/л | мг-экв/л | %-экв/л |
| Nа + | 3,39 | Сl — | 3,53 | ||
| К + | 0,23 | SО4 2- | 1,73 | ||
| Са 2+ | 4,44 | NО3 — | 0,08 | ||
| Мg 2+ | 1,97 | НСО3 — | 4,62 | ||
| Итого | 10,03 | Итого | 9,96 | ||
| рН=7,8 |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9265 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Внутрилабораторный контроль качества результатов химического анализа воды в экоаналитической лаборатории.
Внутрилабораторный контроль качества результатов химического анализа воды в экоаналитической лаборатории.
Согласно определениям экспертов Международного Союза чистой и прикладной химии (1993), под внутрилабораторным контролем качества понимают систему осуществляемых персоналом лаборатории мероприятий, которые направлены как на оценку того, достаточна ли надежность получаемых результатов химического анализа воды для выдачи их лабораторией, так и на устранение причин неудовлетворительных характеристик этих результатов. Погрешность химического анализа воды включает погрешности лаборанта, отбора пробы, дозирования, измерения и т.д. Составляющие погрешности анализа определяются конкретной технологией проведения исследования, его этапами. Погрешность прибора входит в общую погрешность анализа. Все измерительные приборы, применяемые в лаборатории анализа воды, подлежат поверке в соответствии с ГОСТ 8002—71. В соответствии с руководством по метрологическому обеспечению средств измерений определен порядок и сроки поверки измерительных приборов в лаборатории анализа воды. Измерительные приборы поверяются ведомственными метрологическими органами в соответствии с инструкцией, в которой указываются производимые операции и средства проверки. Проверке подлежат все технические и метрологические показатели, записанные в паспорте, прилагаемом к прибору. В общую составляющую лабораторной погрешности при химическом анализе воды, входит погрешность дозирования. Поэтому совершенно особой проблемой является проверка применяемых дозирующих и мерных средств в лаборатории на точность показаний. Из практики известно, что около 30—40% всей мерной посуды приходится отбраковывать ввиду ее плохого качества. Порядок и содержание работ по внутрилабораторному контролю качества результатов количественного химического анализа приведены в следующих нормативных документах:
ГОСТ Р ИСО 5725-1-2002 Точность (правильность и прецизионность) методов и результатов измерений. ГОСТ Р ИСО 5725-6-2002,ГОСТ Р 8.563-2009 РМГ 76-2014 (РМГ 76-2004)
При проведении контроля качества лабораторных исследований используются следующие термины с соответствующими им определениями :
Методика анализа (измерений): совокупность конкретно описанных операций, выполнение которых обеспечивает получение результатов анализа (измерений) с установленными показателями точности. ,
Показатель точности результатов анализа: значение неопределенности или характеристики погрешности, установленное для любого результата анализа, полученного при соблюдении требований и правил данной методики при ее реализации в конкретной лаборатории.
Результат единичного анализа: содержание компонента в пробе, полученное при однократной реализации процедуры анализа.
Результат анализа: среднее значение (среднее арифметическое или медиана) единичных результатов анализа. В нормативном документе на методику анализа указывается, сколько результатов единичного анализа (параллельных определений) необходимо получить для расчета результата анализа. Чаще всего в методиках регламентируется получение двух единичных результатов анализа.
Погрешность анализа определяется сравнением результатов анализа с истинным содержанием определяемого компонента в пробе. Истинное содержание компонента в пробе, как правило, неизвестно. Поэтому вместо него рекомендуется использовать принятое опорное значение.
Принятое опорное значение: значение содержания компонента в пробе, полученное экспериментальным или теоретическим путем и настолько близкое к истинному значению, что может быть использовано вместо него.
источник
О чём расскажут результаты анализа воды? Как читать химический анализ питьевой воды? Как понимать термины и сокращения в анализах воды. Разновидности химического анализа воды и его назначение. Расшифровка и предельно-допустимые значения исследуемых показателей согласно действующим нормативным документам. Для непосвящённого человека результаты анализа воды напоминают шифровку. Чтобы понять, как читать химический анализ питьевой воды, необходимо разобраться в значении и особенностях всех составляющих.
Обычно в результате анализов указывается не только количество найденных веществ, но и их предельно допустимая концентрация. Сокращённое название этого показателя ПДК. В данном случае имеют ввиду самый большой объём компонента, при котором он не будет оказывать негативное влияние на человеческий организм при условии, что поступление данного элемента будет продолжаться на протяжении всей жизни человека. Также данные компоненты в предельно-допустимой концентрации не будут ухудшать условия водопотребления.
Обычно все предельно-допустимые концентрации тех или иных веществ оговариваются действующими нормативными документами, а именно ГОСТ 2874-82 и СанПиН 2.1.4.1074-01. Кроме этого при расшифровке результатов анализов можно руководствоваться рекомендациями Всемирной Организации Здравоохранения. Также в результатах обычно оговаривается класс опасности искомого компонента. Так, выделяют следующие классы опасности:
1 К – чрезвычайно опасные элементы:
2 К – высоко опасные составляющие;
4 К – вещества умеренной опасности.
Различные химические соединения способны оказывать разную степень токсичности. Все эти вещества, попадая в водную среду, могут оказывать разное токсическое действие на наш организм. В связи с этим есть ещё один показатель вредности составляющих водной среды. По этому признаку все элементы могут подразделяться на такие группы:
- Группа санитарно-токсикологических признаков, обозначаемая «с-т».
- Группа органолептических признаков. В данной группе даётся расшифровка воздействия компонента на те или иные органолептические показатели (сокращение «зап» говорит о способности вещества изменят запах водной среды, «окр» указывает на возможное изменение окраски, «пен» говорит о способности вещества вызывать пенообразование, сокращение «привк» указывает на изменения во вкусовых качествах при присутствии данного элемента, «оп» — это способность вещества вызывать опалесценцию).
Результаты анализа воды могут содержать единицу измерения КОЕ. Расшифровывается данная аббревиатура как колониеобразующие единицы. Данный показатель указывает на единичные бактерии и дрожжевые грибки, которые в состоянии создавать целые колонии в благоприятной среде через определённый промежуток времени.
Любой анализ воды может проводиться для получения достоверного результата о чистоте и качестве воды, а также для выбора подходящих мероприятий по её очистке. Так может выполняться несколько видов анализов:
- Расширенный химический анализ по 25 показателям.
- Сокращённый химический анализ по 12 компонентам.
Результаты расширенного химического анализа воды могут понадобиться в следующем случае:
- если требуется провести анализ химических составляющих воды;
- в ситуации, когда необходимо правильно подобрать оборудование для фильтрации;
- для проверки состояния воды после проведённой фильтрации;
- такой анализ позволит сделать выводы об эффективности фильтрующих установок;
- если требуется проверить воду на присутствие в ней вредных микроорганизмов.
Сокращённый анализ может заказать потребитель для проверки качества питьевой воды, также данный анализ позволяет оценить качество работы фильтров. Для точности проведения анализа отбор проб воды должен выполняться с соблюдением следующих условий:
- Воду нужно набирать либо в специально подготовленные пробирки, либо в чистые пластиковые бутылки от питьевой столовой воды.
- Перед тем как делается забор жидкости, ёмкость ополаскивается набираемой водой и из неё удаляются остатки воздуха.
- При транспортировке образец с водой лучше скрыть от попадания солнечных лучей на него. Также не рекомендуется транспортировать воду в тёплом месте. Иначе результаты анализов будут недостоверными.
- Тара с водой для анализа должна быть доставлена в лабораторию не более чем за 2-3 часа.
Обычно результаты анализов питьевой воды указываются по каждому показателю в цифрах и единицах измерения. Зная нормы по каждому показателю, вы сами можете сделать выводы о пригодности воды для питья. Если все показатели не превышают норму, то воду можно считать чистой и качественной. При превышении каких-то значений требуется провести дополнительную фильтрацию.
Показатели чистоты воды, нормируемые регламентирующими документами РФ
источник Лабораторно-производственный контроль качества воды в системах хозяйственно-питьевого и производственного водоснабженияКачество питьевой воды оценивается комплексом различных показателей, определяемых санитарно-химическим и гидробиологическим анализом. Полный санитарно-химический анализ воды включает несколько десятков определений: температуры, запаха, цветности, мутности, взвешенных веществ и их зольности (для исходной воды); жесткости общей, карбонатной и некарбонатной; щелочности; содержания сульфатов, хлоридов, нитритов, нитратов, фосфатов, силикатов, аммиака солевого и альбуминоидного; ионов Са 2+ , Mg 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Al 3+ (остаточный), Cu 2+ , Zn 2+ , F — ; плотного остатка; углекислоты свободной и связанной; растворенного кислорода; окисляемости, БПК5 (для исходной воды), рН, общего числа бактерий; числа бактерий группы кишечной палочки. Кроме перечисленных определений исходная вода не реже 1 раза в год анализируется на содержание радиоактивных веществ, соединений селена, стронция, ионов Мо 2+ , Ве 2+ , Pb 2+ , As 3+ , As 5+ , и в случае их постоянного обнаружения эти определения включаются в полный анализ. Повседневный контроль качества воды обеспечивается значительно меньшим числом анализов. Характер и число показателей, по которым осуществляется повседневный контроль, могут значительно изменяться в зависимости от вида водоисточника, методов обработки воды и требований, предъявляемых к воде потребителем. Требования к качеству воды, используемой для нужд промышленных и сельскохозяйственных предприятий или другими потребителями, в каждом конкретном случае обосновываются специалистами, отвечающими за качество производимой продукции или оказываемых услуг. Для каждой централизованной системы питьевого водоснабжения эксплуатационной организацией разрабатывается специальная программа, в которой обосновывается перечень контролируемых показателей и регламент проведения контроля. Программа согласовывается с органами Госсанэпидемнадзора. Общие требования к организации и методам контроля качества воды определены в ГОСТ Р51232-98. Необходимость и частота определения того или иного показателя зависят от цели, с которой выполняется анализ. Основные показатели, быстро изменяющиеся в процессе очистки, например мутность и цветность, по которым нормируется качество воды, определяются часто. Для их определения на крупных станциях применяют автоматические регистрирующие приборы. Если на очистной станции предусмотрено кондиционирование ионного состава воды, постоянно контролируется показатель, по которому осуществляется кондиционирование. Часто определяются и показатели, характеризующие санитарное состояние воды. Часть технологических показателей определяют с целью контроля за условиями протекания процесса обработки воды. К их числу относятся, например, температура, рН, щелочность. Функцией температуры является вязкость воды, а, следовательно, и силы сопротивления частицам в процессе их осаждения. От температуры зависит растворимость в воде газов и скорость окислительных процессов. Температура существенным образом влияет на скорость и глубину процесса умягчения. Резкие колебания температуры даже на 1-2 °С осложняют работу осветлителей водоумягчительных установок. Активная реакция среды является технологическим параметром при процессах коагуляции, умягчения, обезжелезивания. Значением рН определяется состояние химических равновесий в воде, растворимость гидроксидов алюминия и железа. Величина рН — важнейший показатель при оценке коррозионных свойств воды и ее стабильности. Определение щелочности является одним из вариантов техно¬логического контроля некоторых процессов. От величины щелочности исходной воды зависят дозы реагентов. При обработке воды ее качество зависит и от остаточных концентраций применяемых реагентов. Концентрации алюминия, полиакриламида, железа и других соединений строго нормируются в питьевой воде. Определение остаточных концентраций хлора и озона проводится непрерывно автоматическими регистрирующими приборами, а в случае невозможности такого конт¬роля — 1 раз в час. Столь частое выполнение этих анализов диктуется необходимостью поддержания определенной остаточной концентрации окислителя для достижения требуемого бактерицидного эффекта. Кроме того, по этим показателям контролируется доза окислителя. Однако для исходной воды данные полного санитарно-химического анализа еще не могут дать полного представления о свойствах воды. В связи с этим в практике водоподготовки широко применяют технологические анализы воды, позволяющие оценить ее качество с точки зрения возможности обработки воды тем или иным методом и выбрать оптимальные дозы реагентов. К числу таких анализов относятся пробные коагулирование, углевание, хлорирование, обезжелезивание, стабилизация воды и т.д. Как правило, качество воды контролируют на всех этапах ее обработки, поэтому перед каждым сооружением и после него должны быть предусмотрены приспособления для отбора проб. Качество воды контролируют не только на очистной станции, но и в распределительной сети. При этом места отбора проб выбирают с таким расчетом, чтобы можно было оценить качество воды во всех основных магистральных водопроводных линиях и в наи¬более возвышенных и тупиковых участках уличной распределительной сети. Общее число анализируемых проб должно быть при численно¬сти обслуживаемого населения: до 10 тыс. человек — не менее 2; до 20 тыс. человек — не менее 10; до 50 тыс. человек — не менее 30; до 100 тыс. человек — не менее 100 и при большей численности населения — не менее 200 анализов в месяц. Во всех отобранных пробах определяется общее микробное число, количество общих и термотолерантных колиформных бактерий, содержание колифагов, мутность, цветность, запах и привкус воды. Контроль водоподготовки и водного режима в промышленности состоит:
Рисунок 1 — Трубчатый индикатор коррозии и накипеобразования: 1 — корпус-патрон; 2 — индикатор; 3 — резиновые прокладки между индикаторами; 4 — то же между концами индикаторов и патроном; 5 — фланцы Трубчатые индикаторы устанавливают на байпасе к обследуемому трубопроводу для периодического контроля состояния его внутренней поверхности с возможностью их извлечения, осмотра и измерения без отключения трубопровода от сети. Производственный контроль может быть местным и централизованным. Он должен обеспечивать нормальный ход технологического процесса и своевременно оповещать об изменениях качества исходной и обрабатываемой воды. Контроль осуществляют круглосуточно и его разделяют: на гидравлический, химико-бактериологический и гидробиологический, выполняемый лабораторией водоподготовительной станции (за проведение анализов отвечает заведующий лабораторией станции); технологический, производимый дежурным персоналом по станции под наблюдением главного инженера или начальника станции и включающий контроль за своевременной заготовкой растворов реагентов, их концентрацией и подачей в сооружения станции, а также за работой всех сооружений, включая хлораторные и аммонизаторные. Для этого на водоподготовительных станциях любого назначения необходимо предусматривать установку приборов с целью контроля:
Контрольные замеры, обходы и наблюдения за работой сооружений осуществляют в определенные сроки, устанавливаемые эксплуатационными инструкциями. О периодичности химического контроля можно судить на приведенном ниже примере производственного регламента взятия проб воды в схеме ее ионитового обессоливания (цифры указывают интервал в часах между взятием проб воды на анализ). Таблица 1 – Периодичность химического контроля
Для получения представительных результатов при проведении анализа необходимо, чтобы свойства воды в отобранной пробе не изменялись в промежутке времени от момента взятия пробы до ее поступления на анализ. источник ПНД Ф 14.1:2.100-97 |
| Дата введения | 01.12.2016 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.12.2016 |
| Актуализация | 01.01.2019 |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
ГОСУДАРСТВЕННЫЙ КОМИТЕТ РОССИЙСКОЙ
ФЕДЕРАЦИИ ПО ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ
Государственного комитета РФ
по охране окружающей среды
_____________ А.А. Соловьянов
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ХИМИЧЕСКОГО ПОТРЕБЛЕНИЯ КИСЛОРОДА
В ПРОБАХ ПРИРОДНЫХ И ОЧИЩЕННЫХ СТОЧНЫХ ВОД
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
Методика допущена для целей государственного экологического контроля
МОСКВА 1997 г.
(издание 2004 г.)
Настоящий документ устанавливает методику количественного химического анализа проб природных и очищенных сточных вод для определения в них величины химического потребления кислорода (ХПК) при содержании органических веществ, эквивалентном потреблению молекулярного кислорода в диапазоне от 4,0 до 80,0 мг/дм 3 титриметрическим методом без концентрирования пробы.
При величине ХПК > 50 мг/дм 3 определение следует проводить при соответствующем разбавлении пробы дистиллированной водой.
Определению мешают хлориды, сульфиды, соединения железа(II), нитриты и другие неорганические вещества, способные окисляться бихроматом в кислой среде.
Мешающие влияния устраняют в соответствии с п. 10.
Титриметрический метод определения ХПК основан на окислении органических веществ избытком бихромата калия в растворе серной кислоты при нагревании в присутствии катализатора — сульфата серебра. Остаток бихромата калия находят титрованием раствором соли Мора и по разности определяют количество K2Cr2O7, израсходованное на окисление органических веществ.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Диапазон измерений, значения показателей точности, повторяемости, воспроизводимости
Диапазон измерений величины ХПК, мг/дм 3
Показатель точности (границы относительной погрешности при вероятности Р = 0,95),
±d, %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости),
sr, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости),
sR, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Весы лабораторные общего назначения с наибольшим пределом
взвешивания 200 г и ценой наименьшего деления 0,1 мг любого типа
Весы лабораторные общего назначения с наибольшим пределом
взвешивания 200 г и ценой наименьшего деления 10 мг любого типа
СО с аттестованным содержанием ХПК с погрешностью не более 1 % при Р = 0,95
Цилиндры мерные или мензурки
4.2. Вспомогательные устройства
Плитки электрические с закрытой спиралью и регулируемой
мощностью нагрева
Шкаф сушильный лабораторный с температурой нагрева до 130 °С
Стаканчики для взвешивания (бюксы)
Установки для определения ХПК в составе:
Колба К-1-250-29/32 ТС или колба Гр-250-29/32
Обратный холодильник ХПТ-2-400-29/32 ХС
Прибор вакуумного фильтрования ПВФ-35 или ПВФ-47
Средства измерений должны быть поверены в установленные сроки.
Допускается использование других, в том числе импортных, средств измерений и вспомогательных устройств с характеристиками не хуже, чем у приведенных в п.п. 4.1 и 4.2.
Бихромат калия (калий двухромовокислый)
N-фенилантраниловая кислота или
Бумага индикаторная универсальная
Фильтры мембранные Владипор типа МФАС-МА или МФАС-ОС-2 (0,45 мкм)
или фильтры бумажные обеззоленные «синяя лента»
Все реактивы, используемые для анализа, должны быть квалификации ч.д.а. или х.ч.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже ч.д.а.
5.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
5.2. Электробезопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019.
5.3. Организация обучения работающих безопасности труда проводится по ГОСТ 12.0.004.
5.4. Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Выполнение измерений может производить химик-аналитик, владеющий техникой титриметрического метода анализа.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
· температура окружающего воздуха (22 ± 6) °С;
· атмосферное давление (84 — 106) кПа;
· относительная влажность не более 80 % при температуре 25 °С;
· частота переменного тока (50 ± 1) Гц;
· напряжение в сети (220 ± 22) В.
8.1. Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
8.2. Посуду, предназначенную для отбора и хранения проб, моют хромовой смесью, затем тщательно (не менее 10 раз) промывают водопроводной и ополаскивают дистиллированной водой.
8.3. Пробы воды отбирают в стеклянную посуду с пробками, не загрязняющими пробу органическими соединениями.
В зависимости от целей анализа определение ХПК можно проводить в нефильтрованной или фильтрованной пробе. В последнем случае пробу предварительно фильтруют через мембранный фильтр 0,45 мкм, очищенный двухкратным кипячением в дистиллированной воде. Допустимо использование бумажных фильтров «синяя лента», промытых дистиллированной водой. При фильтровании через любой фильтр первые порции фильтрата отбрасывают.
Объем отбираемой пробы должен быть не менее 100 см 3 .
8.4. Определение ХПК, особенно в загрязненных водах, следует проводить как можно скорее после отбора пробы. Допускается хранение пробы при температуре не выше 4 °С не более суток при консервации добавлением раствора серной кислоты (1:2) из расчета 2 см 3 на каждые 100 см 3 пробы воды.
8.5. При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
9.1. Приготовление растворов и реактивов
9.1.1. Раствор бихромата калия с концентрацией 0,25 моль/дм 3 эквивалента.
6,129 г бихромата калия, предварительно высушенного в течение 2 ч при 105 °С, количественно переносят его в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде, доводят до метки и перемешивают. Раствор устойчив при хранении в плотно закрытой темной склянке в течение 6 мес.
9.1.2. Раствор бихромата калия с концентрацией 0,025 моль/дм 3 эквивалента.
50 см 3 раствора бихромата калия с концентрацией 0,25 моль/дм 3 эквивалента помещают в мерную колбу вместимостью 500 см 3 и доводят объем раствора до метки дистиллированной водой. Хранят в склянке с притертой пробкой в темном месте не более 6 мес.
9.1.3. Раствор соли Мора с концентрацией 0,25 моль/дм 3 эквивалента.
49,0 г соли Мора переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде, осторожно добавляют 10 см 3 концентрированной серной кислоты и после охлаждения доводят объем раствора до метки дистиллированной водой. Хранят в плотно закрытой посуде не более 6 мес.
9.1.4. Раствор соли Мора с концентрацией 0,025 моль/дм 3 эквивалента.
50 см 3 раствора соли Мора с концентрацией 0,25 моль/дм 3 эквивалента помещают в мерную колбу вместимостью 500 см 3 и доводят объем раствора до метки дистиллированной водой. Хранят в плотно закрытой посуде не более 3 мес.
Точную концентрацию раствора устанавливают ежедневно или перед серией определений в соответствии с п. 10.2.
В качестве индикатора используют раствор N-фенилантраниловой кислоты или ферроина (комплекс сульфата железа(II) с 1,10-фенантролином).
Для приготовления раствора N-фенилантраниловой кислоты 0,25 г реактива растворяют в 12 см 3 раствора гидрооксида натрия (для ускорения процесса раствор можно слегка подогреть) и разбавляют дистиллированной водой до 250 см 3 .
Для приготовления раствора ферроина 2,43 г индикатора растворяют в 100 см 3 дистиллированной воды.
При приготовлении раствора ферроина на основе 1,10-фенантролина растворяют 0,980 г соли Мора (NH4)2Fe(SO4)2 · 6H2O в 100 см 3 дистиллированной воды, добавляют 2,085 г 1,10-фенантролина моногидрата или 2,93 г сульфата и перемешивают до растворения последнего.
Раствор индикатора хранят в плотно закрытой склянке из темного стекла не более 3 мес.
9.1.6. Раствор гидроксида натрия, 0,4 %.
0,4 г NaOH растворяют в 100 см 3 дистиллированной воды. Раствор устойчив при хранении в плотно закрытой полиэтиленовой посуде не более 2 мес.
9.1.7. Раствор сульфата серебра.
5,0 г Ag2SO4 растворяют в 1 дм 3 концентрированной серной кислоты. Раствор устойчив в склянке из темного стекла в течение 6 мес.
9.2. Установление точной концентрации раствора соли Мора
Пипеткой вместимостью 10 см 3 отбирают 10 см 3 раствора бихромата калия с концентрацией 0,025 моль/дм 3 эквивалента (п. 9.1.2), переносят в коническую колбу, добавляют 180 см 3 дистиллированной воды и 20 см 3 концентрированной серной кислоты. После охлаждения добавляют в пробу 3 — 4 капли индикатора ферроина или 10 капель раствора N-фенилантраниловой кислоты и титруют раствором соли Мора с концентрацией 0,025 моль/дм 3 эквивалента (п. 9.1.4) до перехода окраски из синевато-зеленой в красно-коричневую при использовании в качестве индикатора ферроина и из красно-фиолетовой в синевато-зеленую при использовании N-фенилантраниловой кислоты.
Титрование повторяют и при отсутствии расхождения в объемах титранта более 0,05 см 3 за результат принимают среднее значение. В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 .
Точную концентрацию раствора соли Мора находят по формуле:
где См — концентрация раствора соли Мора, моль/дм 3 эквивалента;
Сб — концентрация раствора бихромата калия, моль/дм 3 эквивалента;
Vб — объем раствора бихромата калия, взятый для титрования, см 3 ;
Vм — объем раствора соли Мора, пошедший на титрование см 3 .
Мешающее влияние хлоридов при концентрациях менее 300 мг/дм 3 устраняется за счет присутствия в пробе катализатора (сульфата серебра). При больших содержаниях хлоридов к пробе добавляют сульфат ртути (II) из расчета 100 мг на 10 мг хлоридов.
Мешающее влияние сульфидов и соединений железа (II) устраняют предварительной продувкой пробы воды воздухом, если она не содержит летучих органических соединений, или учитывают при расчете ХПК. В последнем случае определяют их концентрации и пересчитывают на величины ХПК, исходя из того, что 1 мг H2S и 1 мг Fe 2+ эквивалентны соответственно 0,47 и 0,14 мг O2. Таким же образом учитывают влияние нитритов (1 мг NО2 эквивалентен 0,35 мг O2).
11.1. Выполнение измерений в водах с низкой концентрацией хлоридов
Если концентрация хлоридов в пробе анализируемой воды составляет менее 300 мг/дм 3 , в колбу со шлифом установки для определения ХПК вносят с помощью пипетки 20 см 3 воды (или аликвоту, доведенную дистиллированной водой до 20 см 3 ), добавляют 10,0 см 3 раствора бихромата калия с концентрацией 0,025 моль/дм 3 эквивалента (п. 9.1.2) и 30 см 3 раствора сульфата серебра в концентрированной серной кислоте. Для равномерного кипения в колбу бросают 2 — 3 капилляра, присоединяют к ней обратный холодильник и кипятят содержимое на песчаной бане в течение 2 ч.
После охлаждения установки промывают холодильник дистиллированной водой (около 50 см 3 ), отсоединяют его, добавляют в колбу, обмывая ее стенки, еще 50 см 3 дистиллированной воды, вновь охлаждают, переносят пробу в коническую колбу, дважды споласкивая колбу, где кипятилась проба, дистиллированной водой (по 20 — 30 см 3 ). Добавляют 3 — 4 капли раствора ферроина (или 10 капель раствора фенилантраниловой кислоты) и титруют избыток непрореагировавшего бихромата калия раствором соли Мора (п. 9.1.4) до перехода окраски индикатора из синевато-зеленой в красно-коричневую при использовании в качестве индикатора ферроина и из красно-фиолетовой в синевато-зеленую при использовании N-фенилантраниловой кислоты.
Аналогичным образом проводят холостой опыт с 20 см 3 дистиллированной воды.
11.2. Выполнение измерений в водах с высокой концентрацией хлоридов
Если концентрация хлоридов в воде превышает 300 мг/дм 3 , к отобранной для анализа пробе (20 см 3 или меньшей аликвоте, доведенной до 20 см 3 дистиллированной водой) добавляют сульфат ртути из расчета 100 мг на каждые 10 мг содержащихся в пробе хлоридов и тщательно перемешивают. Далее выполняют определение, как описано в п. 11.1. Наличие небольшого количества осадка, образовавшегося после добавления сульфата ртути, не мешает определению.
12.1. Величину ХПК (бихроматной окисляемости) анализируемой пробы воды X находят по формуле:
где Vмх — объем раствора соли Мора, израсходованный на титрование в холостом опыте, см 3 ;
Vм — объем раствора соли Мора, израсходованный на титрование в пробы воды, см 3 ;
См — концентрация раствора соли Мора, моль/дм 3 эквивалента;
V — объем пробы воды, взятый для определения, см 3 ;
8,0 — масса миллиграмм-эквивалента кислорода, мг.
Если величина ХПК в анализируемой пробе превышает верхнюю границу диапазона (80 мг/дм 3 ), разбавляют пробу с таким расчетом, чтобы величина ХПК входила в регламентированный диапазон, и выполняют определение в соответствии с п. 11.2.
В этом случае величину ХПК в анализируемой пробе воды X находят по формуле:
где ХV — величина ХПК в разбавленной пробе воды, мг/дм 3 ;
VV— объем пробы воды после разбавления, см 3 ;
v — объем аликвоты пробы воды, взятой для разбавления, см 3 .
12.2. Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 2.
Значения предела воспроизводимости при вероятности Р = 0,95
Диапазон измерений величины ХПК, мг/дм 3
Предел воспроизводимости (относительное значение допускаемого расхождения
между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6.
Результат анализа X в документах, предусматривающих его использование, может быть представлен в виде:
где D — показатель точности методики.
Значение D рассчитывают по формуле:
Значение d приведено в таблице 1.
Если проводилось разбавление пробы воды из-за превышения величины ХПК верхней границы диапазона, значение d выбирают из таблицы 1 для величины ХПК в разбавленной пробе воды ХV.
Допустимо результат анализа в документах, выдаваемых лабораторией, представлять в виде:
источник
Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 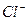 , мг/дм 3 , мг/дм 3 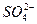 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


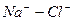
 |
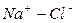

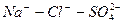
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды |
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник |