Присутствие в воде хлоридов натрия, магния, кальция и др. ухудшают свойства воды в случае ее использования для технических нужд, а также для питьевых целей. Хлорид-ион может присутствовать в воде природных источников и образовываться в процессе хлорирования перед доставкой воды в водопроводную сеть по реакции:
Анализ воды на хлорид-ион осуществляется методом аргентометрии при содержании ионов Сl — более 0,25 мг/л.
Цель работы: использование метода осаждения и методики титрования для определения нормальной концентрации ионов хлора в воде по закону эквивалентов.
Необходимое оборудование: установка для титрования: штатив, бюретка на 25 или 50 мл, пипетка вместимостью 10 мл с резиновой «грушей», мерная колба на 100 или 250 мл, химический стакан, конические колбы на 100 мл, воронка.
Необходимые реактивы: рабочий раствор нитрата серебра (концентрация может быть разной в зависимости от содержания в воде хлорид-ионов), раствор хромата калия в качестве индикатора, дистиллированная вода.
Сущность метода и методика выполнения работы.
Определение концентрации Сl — основано на образовании нерастворимой соли хлорида серебра по реакции:
Зная объем и концентрацию рабочего раствора нитрата серебра, идущего на титрование пробы воды, и, пользуясь законом эквивалентов, можно рассчитать содержание ионов хлора. Индикатором в этой реакции является К2CrO4— хромат калия, который реагирует с рабочим раствором по реакции:
Осадок Аg2CrO4 имеет кирпично-красную окраску. Выпадение осадков происходит последовательно: сначала выпадает белый нерастворимый хлорид серебра (ПР = 1,610 -12 ) – менее растворимый, чем хромат серебра ( ПР = 10 -10 ). Когда все ионы хлора будут связаны в осадок, т.е. основная реакция пройдет до конца, начнется выпадение Аg2CrO4. Раствор от одной капли титранта (нитрата серебра) приобретает кирпично-красный оттенок, и титрование прекращают.
Содержание ионов хлора в [мг/л] рассчитывают по формуле:
[Сl — ]= С(AgNO3)V(AgNO3)1000Э(Сl — )/V(пробы) [мг/л], где
С(AgNO3) – нормальная концентрация рабочего раствора в моль/л;
V(AgNO3) –объем рабочего раствора, израсходованного на титрование
Э(Сl — ) –эквивалентная масса хлорид-ионов, Э(Сl — ) = 35.5 г/моль.
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ
К физико-химическим методам исследования относятся все электрохимические методы (кондуктометрия, потенциометрия, полярография, амперометрия и др.), калориметрические (методы определения теплоемкости и тепловых эффектов фазовых и химических превращений), оптические (фотометрическое титрование, колориметрия и нефелометрия и др.), хроматографические, основанные на избирательной адсорбции различных веществ и пр. Перечисление и рассмотрение всех методов не входит в задачу данного пособия. В отдельный раздел физико-химических исследований выделен физико-химический анализ, методики которого применяются практически во всех методах.
Проведение качественного и количественного анализа позволяет точно установить химический состав вещества. В течение длительного периода развития химических наук основным объектом исследования было изолированное индивидуальное вещество с постоянным составом. Вещества, которые невозможно было выделить чистом виде (фазы переменного состава – шлаки, керамические материалы, сплавы, растворы и пр.), долгое время исключались как объект исследования, ввиду невозможности с помощью известных методов анализа точно установить их состав. В конце XIX и в начале XX века формируется новый раздел – физико-химический анализ. Физико-химический анализ изучает зависимость между составом и свойствами макроскопических равновесных систем, составленных из нескольких веществ (компонентов). Для физико-химического анализа характерно представление этих зависимостей графически, в виде диаграммы состав – свойство. Основоположниками нового направления были Д. Гиббс, Я. Ван-дер-Ваальс, Х. Розебом, Г. Тамман, Д.И. Менделеев, Д.П. Коновалов. Особая заслуга в развитии физико-химического анализа и выделении его в самостоятельную дисциплину принадлежит Н.С. Курнакову, который разработал основы геометрического анализа диаграмм состояния и создал крупнейшую в мире школу физико-химического анализа.
Основная задача этого раздела химии состоит в измерении физического свойства системы, находящейся в состоянии равновесия, при последовательном изменении ее состава. Результатом такого исследования является диаграмма состав–свойство, представляющая собой геометрическое отражение процессов, которые протекают в системе. Зависимость между составом системы и ее свойствами в принципе может быть выражена аналитическим уравнением состояния. Однако явный вид функции обычно неизвестен. Геометрический анализ диаграмм состав-свойство, сочетая в себе наглядность и универсальность, позволяет определить количество образующихся в системе фаз, их природу, области их существования и особенности взаимодействия между ними. Это дает возможность наблюдения за изменениями в системе в процессе химического взаимодействия, не выделяя образующиеся фазы для исследования.
Физико-химический анализ позволяет количественно исследовать ход изменения какого-либо физического свойства (давления пара, температуры плавления, плотности, вязкости, твердости, электрической проводимости и т.п.) системы, образованной двумя компонентами при непрерывно меняющемся ее составе. Если функцией состава служит, например, температура фазовых превращений, то получающийся геометрический образ называется диаграммой состояния или фазовой диаграммой, поскольку измеряемое свойство является термодинамическим. В качестве примера фазовой диаграммы представлена диаграмма состояния однокомпонентной системой — воды (рис.1). Однокомпонентной системой является любое простое вещество или химическое соединение, обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Фазовые диаграммы обычно строят на плоскости в координатах температура-давление. Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния – температуры и давления.
Рис. 1. Диаграмма состояния однокомпонентной системы. S, L и V — области существования твердой, жидкой и паровой фаз; 1, 2 и 3 кривые кипения (испарения), плавления и возгонки (сублимации); К – критическая точка; в которой исчезает различие между жидкостью и насыщенным паром; А — тройная точка, соответствующая равновесному сосуществованию твердой, жидкой и газообразной фазы.
Диаграммы, отражающие зависимость физических свойств (электрических, магнитных и пр.) от состава, которые не могут быть представлены в виде функции только давления, температуры и концентраций, называются диаграммами состав-свойство. Результаты исследования наносят на диаграмму состав-свойство, причем состав всегда откладывают по вертикальной оси и выражают в процентах (или долях) одного из компонентов системы, а свойство, выраженное числовым значением какой-либо физической величины (плотности, вязкости, электрической проводимости, твердости и др.), измеренные при постоянной температуре — по вертикальной оси. Такие диаграммы позволяют по виду полученных кривых обнаружить происходящие в системе превращения, а также дают указания относительно характера этих превращений, состава получающихся продуктов, свидетельствуя об образования твердых растворов, химических соединений или других фаз переменного состава.
Термический анализ
Из всех видов физико-химического анализа при изучении сплавов чаще всего применяется термический анализ, начало которому было положено в шестидесятых годах XIX века русским металлургом Д.К. Черновым. Термический анализ – совокупность методов определения температур, при которых происходят процессы, сопровождающиеся выделением тепла (например, кристаллизация из жидкости), либо его поглощением (например, плавление, термическая диссоциация). С помощью термического анализа решается задача получения количественных характеристик (например, фазовый состав, теплота реакций) при нагревании или охлаждении исследуемых объектов. Термический анализ широко применяется при изучении сплавов металлов, минералов и других геологических пород. Результатом термического анализа металлических систем является построение и изучение диаграмм плавкости, которые выражают зависимость температуры плавления сплава от процентного содержания металлов, входящих в его состав. Многочисленные работы Н.С. Курнакова по выяснению природы металлических сплавов внесли ясность в понимание процессов, происходящих при затвердевании сплавов. Им были открыты химические соединения, состав которых может меняться в довольно широких пределах. Эти соединения переменного состава Курнаков назвал бертоллидами, по имени французского ученого Бертолле (1748-1822), допускавшего их существование, предложив для обычных соединений постоянного состава со стехиометрическим соотношением компонентов название дальтониды. Стехиометрическое соотношение компонентов, образующих соединение, соблюдается только в парообразном состоянии, в молекулярных кристаллах и жидкостях. При образовании твердых фаз с координационной решеткой (кристаллических веществах) эти соотношения не соблюдаются, к ним неприменим закон постоянства состава и, следовательно, их следует отнести к бертоллидам.
Диаграммы плавкости обычно строят, исходя из кривых охлаждения сплавов, используя метод термического анализа. Для получения этих кривых берут два чистых металла и готовят из них ряд смесей (сплавов) различного состава (двухкомпонентные системы). Каждую из приготовленных смесей расплавляют и медленно охлаждают, отмечая через точно определенные промежутки времени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая по оси абсцисс — время, а по оси ординат – температуру (рис. 2, кривые а). При отсутствии превращений кривая нагревания (охлаждения) идёт плавно; превращения отражаются появлением на кривой изломов или горизонтальных участков («остановок»). В точке излома (кривая 1 – кривая охлаждения чистого металла) начинается образование твердой фазы, сопровождающееся выделением тепла, вследствие чего температура остается некоторое время постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затвердеет, опять начинается равномерное понижение температуры.
Расплав чистого компонента (металла) можно рассматривать как растворитель. Согласно закону Рауля, добавление второго компонента (растворенного вещества) вызывает понижение температуры кристаллизации системы (раствора). При охлаждении расплава, пока в охлаждаемой системе не происходит фазовых превращений, температура расплава падает с определенной скоростью. Появление кристаллов сопровождается выделением теплоты кристаллизации и замедляет или приостанавливает падение температуры, вызывая излом или площадку на кривой охлаждения (рис.2а — кривые 2,3,5,6). При этом состав остающегося в жидком состоянии сплава изменяется, и температура его затвердевания непрерывно понижается во время кристаллизации. Выпадение кристаллов и равномерное понижение температуры происходят до тех пор, пока состав сплава не достигнет эвтектического состава. Эвтектика или эвтектическая смесь — это сплав, имеющий самую низкую температуру плавления. Температура, отвечающая точке (Е) на рисунке 2б представляет собой самую низкую температуру плавления, которую может иметь сплав данных двух металлов. Когда сплав достигнет эвтектического состава, падение температуры приостанавливается, так как эвтектика выделяется при постоянной температуре. После выделения эвтектики температура снова начинает падать (кривые 2-6). Кривые 1 и 7 характеризуют затвердевание чистых металлов. Все остальные кривые отражают процесс охлаждения сплавов, в которых уменьшается содержание металла А. Кривая (4) отвечает процессу затвердевания сплава эвтектического состава (примерно 60% металла Б и 40% металла А).
Из анализа кривых охлаждения (рис. 2а) следует, что смесь двух металлов при охлаждении претерпевает два фазовых превращения. Изломы на кривых характеризуют начало выделения из расплава кристаллов вещества A (кривая 2, 3) или вещества B (кривая 5,6), а площадки в нижней части кривых – выделение эвтектической смеси, насыщенной в отношении обоих компонентов. Таким образом, кристаллизация жидкой смеси двух металлов (кривые 2-6), в отличие от кристаллизации чистых металлов (кривые 1,7), сопровождается изменением состава жидкой фазы и лежит в некотором температурном интервале. Смесь эвтектического состава (кривая 4) кристаллизуется подобно чистым компонентам при постоянной температуре, поэтому дает монотонную кривую охлаждения с горизонтальным участком при эвтектической, наименьшей для данной системы температуре. После окончания кристаллизации идет охлаждение отвердевшей системы до температуры окружающей среды.
Определив с помощью кривых охлаждения температуры кристаллизации для смесей различных составов, строят диаграмму состояния (плавкости), схематичное построение которой показано на рисунке 2б.
| 1 |
| Рис. 2. Построение диаграммы плавкости для двух металлов А и В, полностью растворяющихся в жидком и нерастворимых в твердом состояниях и образующие сплавы эвтектического состава: а) кривые охлаждения; б) диаграмма плавкости. I – гомофазная область (расплав двух металлов А и В) |
II, III – гетерофазные области (расплав + твердая фаза)
IV – гетерофазная область (Aтв + Втв)
E – эвтектика (состав с наименьшей tпл)
tАE – линия ликвидуса (liquid – жидкий) – геометрическое место точек, отвечающих температурам начала кристаллизации компонента A
tВE – линия ликвидуса – геометрическое место точек, отвечающих температурам начала кристаллизации компонента B
tAtEEtB – линия солидуса (solid – твердый), ниже которой существуют твердые фазы.
Диаграммы плавкости можно получить с помощью более точного дифференциально-термического метода анализа, по которому нагревание (охлаждение) исследуемого объекта ведут вместе и в одних и тех же условиях с веществом-эталоном, которое в условиях опыта не имеет превращений. В этом случае на одном и том же графике записывают и кривую «время — температура», и кривую «время — разность температур» объекта и эталона. Эта разность появляется при любом превращении исследуемого объекта, протекающем с поглощением (выделением) тепла. О характере превращений судят не по виду простой кривой нагревания (охлаждения), а по дифференциальной кривой, имеющей резко выраженные максимумы и минимумы в точках фазовых переходов, поэтому более точно определяется температуру превращений. Для записи кривых нагревания и охлаждения используют самопишущие приборы (например, пирометр Н.С.Курнакова), электронные потенциометры, оптические пирометры. Рассмотрим основные типы диаграмм плавкости.
5.2. Диаграмма плавкости двух металлов с неограниченной растворимостью в жидком и полной нерастворимостью в твердом состоянии
Пример построения такого вида диаграммы по кривым охлаждения рассмотрен на рисунке 2 и соответствует случаю, когда два компонента образуют одну жидкую фазу (расплав), при охлаждении которой выделяются (кристаллизуются) индивидуальные вещества и образуется сплав эвтектического состава, при этом сплавляемые металлы не образуют ни химических соединений, ни твердого раствора. Примером подобных сплавов могут служить сплавы: висмут-кадмий (эвтектика содержит 60% висмута и 40% кадмия), свинца с сурьмой (эвтектика содержит 13% сурьмы и 87% свинца), меди с серебром (эвтектика содержит 28% меди и 72% серебра) и др.
На рисунке 3 изображена диаграмма плавкости системы двух металлов Аи В. По горизонтальной оси указан состав сплава (стрелка указывает на увеличение содержания металла В); по вертикальной – температуры плавления. Точка ТА соответствует температуре плавления чистого металла А. По мере прибавления к нему металла В, температура плавления понижается, вплоть до некоторой точки Е, соответствующей самой низкой температуре плавления сплава состава эвтектической смеси. В этой точке оба металла начинают кристаллизоваться одновременно, образуя эвтектику. При исследовании эвтектики под микроскопом она оказывается состоящей из мельчайших кристалликов двух металлов, тесно перемешанных друг с другом. Затем по мере увеличения содержания в сплаве металла В температура плавления снова начинает расти по кривой ЕТВ, пока не достигнет точки ТВ, показывающей температуру плавления чистого металла В.
Рис. 3. Диаграмма плавкости двойной системы, компоненты которой А и В не образуют твердых растворов и химических соединений. L — область существования жидкости (расплава); (L + SA) и (L + SB) — области сосуществования жидкой фазы и твердых металлов А и В соответственно; (SA + SB) — область существования механической смеси твердых А, В и эвтектики; ТАETВ – линия ликвидуса; MEN — линия солидуса; E-эвтектическая точка; С, D, F, G, О и Q примеры фигуративных точек.
Если исходить из металла В, постепенно прибавляя к смеси все больше металл А, то сначала температура плавления будет понижаться до точки Е, а затем возрастать до точки ТА. Всоответствии с вышесказанным на диаграмме можно выделить пять областей: L– жидкий сплав металлов А и В (гомофазная жидкая область); (L + SA) – смесь жидкого сплава и кристаллов А; (L + SB) – смесь жидкого сплава и кристаллов (гетерофазные области — расплав + твердая фаза); (SA + Е) – смесь эвтектики и кристаллов А; (Е + SB) – смесь эвтектики и кристаллов В — гетерофазные области (смесь двух твердых фаз).
Точка на диаграмме состояния, отвечающая составу образца при определенной температуре, называется фигуративной. Например, если фигуративная точка С, находится в гомогенной области L, никакие фазовые превращения не происходят. Если охлаждать жидкий сплав состава, который соответствует точке G на оси абсцисс, от фигуративной точки С (область расплава L), то из него сначала будут выделяться кристаллы металла В(от кривой ЕОТВ до точки D и ниже). По мере их выделения температура будет снижаться, и когда упадет до температуры, которая соответствует точке N, вся оставшаяся еще жидкой часть сплава в точке F начнет при постоянной температуре затвердевать, образуя эвтектическую смесь с мельчайшими кристалликами металла В.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
источник
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы определения содержания хлоридов
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы определения содержания хлоридов
Drinking water.
Method for determination
of chloride content
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания хлоридов (хлор-иона).
Определение содержания хлор-иона в питьевой воде производят:
при содержании хлор-иона от 10 мг/дм 3 и выше титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора;
при содержании хлор-иона до 10 мг/дм 3 титрованием азотнокислой ртутью в присутствии индикатора дифенилкарбазона.
1.1. Отбор проб производят по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения содержания хлоридов должен быть не менее 250 см 3 .
1.3. Пробы воды, предназначенные для определения хлоридов, не консервируют.
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм 3 .
2.2 Аппаратура, материалы и реактивы
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100, 50 и 10 см 3 без делений; пипетка 1 см 3 с делением через 0,01 см 3 ; цилиндр мерный 100 см 3 ; бюретка 25 см 3 со стеклянным краном.
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Пробирки колориметрические с отметкой на 5 см 3 .
Воронки стеклянные по ГОСТ 25336.
Фильтры беззольные «белая лента».
Серебро азотнокислое по ГОСТ 1277.
Натрий хлористый по ГОСТ 4233.
Квасцы алюмокалиевые (алюминий-калий сернокислый) по ГОСТ 4329.
Калий хромовокислый по ГОСТ 4459.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
2.3.1. Приготовление титрованного раствора азотнокислого серебра.
2,40 г химически чистого AgNO 3 растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм 3 .
1 см 3 раствора эквивалентен 0,5 мг С l — .
Раствор хранят в склянке из темного стекла.
2.3.2. Приготовление 10%-ного раствора (подкисленного азотной кислотой) азотнокислого серебра
10 г AgNO 3 растворяют в 90 см 3 дистиллированной воды и добавляют 1-2 капли HNO 3 .
2.3.3. Приготовление титрованного раствора хлористого натрия
0,8245 г химически чистого NaCl , высушенного при 105 °С, растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм 3 .
1 см 3 раствора содержит 0,5 мг С l — .
2.3.4. Приготовление гидроокиси алюминия
125 г алюмокалиевых квасцов [ AlK ( SO 4 )2 × 12H2O] растворяют в 1 дм 3 дистиллированной воды, нагревают до 60 °С и постепенно прибавляют 55 см 3 концентрированного раствора аммиака при постоянном перемешивании. После отстаивания в течение 1 ч осадок переносят в большой стакан и промывают декантацией дистиллированной водой до исчезновения реакции на хлориды.
2.3.5. Приготовление 5 %-ного раствора хромовокислого калия
50 г К2С r О4 растворяют в небольшом объеме дистиллированной воды и доводят объем раствора дистиллированной водой до 1 дм 3 .
2.3.6. Установка поправочного коэффициента к раствору азотнокислого серебра.
В коническую колбу вносят пипеткой 10 см 3 раствора хлористого натрия и 90 см 3 дистиллированной воды, добавляют 1 см 3 раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода лимонно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15-20 с. Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют 1-2 капли раствора хлористого натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Для этого отбирают новую порцию раствора хлористого натрия и титруют азотнокислым серебром до получения незначительной разницы оттенков слабо-оранжевого в титруемом растворе и желтого в контрольной пробе. Поправочный коэффициент ( К) вычисляют по формуле
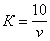
где v — количество азотнокислого серебра, израсходованное на титрование, см 3 .
2.4.1. Качественное определение
В колориметрическую пробирку наливают 5 см 3 воды и добавляют три капли 10 %-ного раствора азотнокислого серебра. Примерное содержание хлор-иона определяют по осадку или мути в соответствии с требованиями таблицы.
Характеристика осадка или мути
1. Опалесценция или слабая муть
3. Образуются хлопья, осаждаются не сразу
2.4.2. Количественное определение
В зависимости от результатов качественного определения отбирают 100 см 3 испытуемой воды или меньший ее объем (10-50 см 3 ) и доводят до 100 см 3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм 3 . p Н титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см 3 пробы добавляют 6 см 3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через беззольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см 3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок AgCl , мешающий определению. В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.
Определению мешают: ортофосфаты в концентрации, превышающей 25 мг/дм 3 ; железо в концентрации более 10 мг/дм 3 . Бромиды и йодиды определяются в концентрациях, эквивалентных С l — . При обычном содержании в водопроводной воде они не мешают определению.
Содержание хлор-иона ( X), мг/дм 3 , вычисляют по формуле
где v — количество азотнокислого серебра, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к титру раствора нитрата серебра;
g — количество хлор-иона, соответствующее 1 см 3 раствора азотнокислого серебра, мг;
V — объем пробы, взятый для определения, см 3 .
Расхождения между результатами повторных определений при содержании С l — от 20 до 200 мг/дм 3 — 2 мг/дм 3 ; при более высоком содержании — 2 отн. %.
3. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ХЛОР-ИОНА В ВОДЕ ТИТРОВАНИЕМ АЗОТНОКИСЛОЙ РТУТЬЮ В ПРИСУТСТВИИ ИНДИКАТОРА ДИФЕНИЛКАРВАЗОНА
Хлориды титруют в кислой среде раствором азотнокислой ртути в присутствии дифенилкарбазона, при этом образуется растворимая, почти диссоциирующая хлорная ртуть. В конце титрования избыточные ионы ртути с дифенилкарбазоном образуют окрашенное в фиолетовый цвет комплексное соединение. Изменение окраски в эквивалентной точке выражено четко, в связи с этим конец титрования определяется с большой точностью.
Точность метода 0,5 мг/дм 3 .
3.2. Аппаратура, материалы и реактивы.
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100 и 50 см 3 без делений, цилиндр мерный 100 см 3 микробюретка 2 см 3 .
Колбы конические по ГОСТ 25336, вместимостью 250 см 3 .
Ртуть азотнокислая окисная по ГОСТ 4520.
Натрий хлористый по ГОСТ 4233.
Кислота азотная по ГОСТ 4461.
Спирт этиловый ректификованный по ГОСТ 5962.
Бромфеноловый синий (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3.1. Приготовление 0,0141 н. раствора азотнокислой ртути
2,42 г Hg ( N О3)2 × 1 /2Н2 O растворяют в 20 см 3 дистиллированной воды к которой прибавлено 0,25 см 3 концентрированной азотной кислоты, затем объем раствора доводят дистиллированной водой до 1 дм 3 .
1 см 3 этого раствора эквивалентен 0,5 мг С l — .
Раствор устойчив в течение четырех месяцев.
Поправочный коэффициент к титру раствора азотнокислой ртути определяют титрованием 5 см 3 хлористого натрия (1 см 3 — 0,5 мг С l — ), разбавленного до 100 см 3 дистиллированной водой, в тех же условиях, как при анализе пробы воды.
3.3.2. Приготовление дифенилкарбазона, спиртового раствора смешанного индикатора
0,5 г дифенилкарбазона и 0,05 г бромфенолового синего растворяют в 100 см 3 95 %-ного этилового спирта. Хранят в склянке из темного стекла.
3.3.3. Приготовление 0,2 н. раствора азотной кислоты
12.8 мл концентрированной азотной кислоты разводят дистиллированной водой до 1 дм 3
Все растворы готовят на дважды перегнанной дистиллированной воде.
Отбирают 100 см 3 испытуемой воды, прибавляют 10 капель смешанного индикатора и по каплям 0,2 н. раствор HNO 3 до появления желтой окраски (рН 3,6), после чего прибавляют еще пять капель 0,2 н. раствора HNO 3 и титруют из микробюретки раствором азотнокислой ртути. К концу титрования окраска раствора приобретает оранжевый оттенок. Титрование продолжают медленно, по каплям добавляя раствор азотнокислой ртути, сильно взбалтывая пробу до появления слабо-фиолетового оттенка.
Для определения более четкого конца титрования используют контрольную пробу, в которой к 100 см 3 дистиллированной воды прибавляют индикатор, 0,2 н. раствор азотной кислоты и одну каплю раствора азотнокислой ртути.
Метод может быть использован для определения и более высоких концентраций хлоридов в воде (более 10 мг/дм 3 ). В этом случае отбирают меньший объем воды (содержание С l — в отобранном объеме должно быть не менее 10 мг) и разбавляют дистиллированной водой до 100 см 3 прибавляют те же реактивы и в том же количестве и титруют из бюретки раствором азотнокислой ртути, как описано выше.
Определению не мешают цветность воды выше 30° и железо в концентрации, превышающей 10 мг/дм 3 . Йодиды и бромиды определяют в концентрациях, эквивалентных С l — .
Содержание хлор-иона ( X) в мг/дм 3 вычисляют по формуле
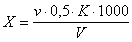
где v — количество азотнокислой ртути, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к титру раствора азотнокислой ртути;
V — объем воды, взятый для определения, см 3 .
Расхождения между результатами повторных определений при содержании С l — в воде до 10 мг/дм 3 — 0,5 мг/дм 3 .
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
источник
Свободный хлор- хлор, присутствующий в воде в виде хлорноватистой кислоты ион гипохлоритов или растворенного элементарного хлора.
Связанный хлор-часть общего хлора присутствующая в воде в виде хлораминов и органических хлораминов.
Общий хлор— хлор, присутствующий в воде в виде свободного хлораили связанного или обоих вместе.
Хлорамины- производные аммиака, образованные путём замещения одного, двух или трех атомов водорода атомами хлора (монохлорамин NH2Cl, дихлорамин NHCl2 , трихлорид азота NCl3) и все хлорированные производные соединения органического азота определённые по ИСО 7393-1
Термины и их синонимы, относящиеся к соединениям хлора в воде
Элементарный хлор, хлорноватистая кислота
Потенциально свободный хлор
Элементарный хлор, хлорноватистая кислота, гипохлорит, хлорамины
ИСО 7393-1 устанавливает титриметрический метод с использованием N2N-диэтил-1,4-фенилендиаминсульфата (ЦПВ-1) для определения свободного и общего хлора в воде (от 0,0004 до 0,07 ммоль/л или от 0,03 до 5 мг/л).
Морская вода и вода, содержащая бромиды и йодиды, составляют группу веществ, для анализа которых необходимы особенные методики.
Данный метод применяют для обычных концентраций общего хлора в питьевой воде в пересчете на хлор (Cl2),а при более высоких концентрациях контроль проводят путем разбавления проб.
Для концентраций свыше 0,07 ммоль/л можно применять метод, описанный в ИСО 7393-3
Сущность метода заключается во взаимодействии свободного хлора с ЦПВ-1 с образованием при рН 6,2-6,5 соединения красного цвета. Затем проводят титрирование соединения стандартным раствором соли Мора до исчезновения красного цвета.
Вода, не содержащая окисляющих и восстанавливающих веществ. Чтобы получить воду нужного качества, деминерализованную или дистиллированную, воду сначала хлорируют до концентрации хлора 0,14 ммоль/л (10 мг/л) и хранят в плотно закрываемой стеклянной бутыли для кислот. Затем воду дехлорируют ультрафиолетовым излучением или солнечным светом в течение нескольких часов или активированным углём. Окончательно проверяют качество, применяя методику описанную ниже:
в две конические колбы вместимостью 250 мл помещают последовательно: а) в первую — 100 мл воды, качество которой нужно определить, и около 1 г иодида калия; перемешивают и через 1 мин добавляют 5 мл буферного раствора или 5 мл реактива ЦВП-1.
б) во вторую — 100 мл воды, качество которой необходимо проверить, добавив одну или две капли раствора гипохлорита натрия, затем через 2 мин 5 мл буферного раствора или 5 мл реактива ЦВП-1.
В первой колбе не должно происходить окрашивание, в то время как во второй появляется бледно-розовая окраска.
Буферный раствор рН 6,5 . Последовательно растворяют в воде 24 г безводного двухзамещенного фосфорита натрия (Na2 НPO4) или 60,5 г двенадцативодного двухзамещенного фосфорита натрия (Na2 PO4 *12H2O) или 46 г однозамещенного фосфата калия (KH2PO4). Добавляют 100 мл раствора трилона Б концентрацией 8 г/л (или 0,8 г твердого вещества).
Если нужно добавляют 0,020 г хлорида ртути (II)(HgCl2), чтобы предотвратить рост плесени и мешающее влияние следов иодида в реактивах при проведении испытаний на имеющийся свободный хлор.
Полученный раствор разбавляют до 1 л перемешивают.
Раствор ЦВП-1, 1,1 г/л. Смешивают 250 мл воды, 2,1 мл серной кислоты (g=1,84) и 25 г раствора трилона Б концентрацией 8 г/л (или 0,2 твердого вещества). В этой смеси растворяют 1,1 г безводного ЦВП-1 или 1,5 г пентагидрата ЦВП-1, разбавляют водой до 1 л и перемешивают.
Реактив хранят в темной бутылке, защищенной от нагревания. Раствор обновляют через месяц хранения или после его обесцвечивания.
Соль Мора, основной раствор [Fe(NH4)2(SO4)2*6H2O] — 0,056 моль/л. Растворяют 22 г гексагидрата аммоний-сернокислого железа (II) (соли Мора) приблизительно в 250 мл воды, содержащей примерно 5 мл серной кислоты (g=1,84) в мерной колбе вместимостью 1 л. Разбавляют водой до метки и перемешивают. Хранят в затемненной склянке.
Стандартный раствор перед использованием или ежедневно при большом количестве определений готовят следующим образом:
в мерную коническую колбу 250 мл помещают 50 мл основного раствора соли Мора, приблизительно 50 мл воды, 5 мл ортофосфорной кислоты (g=1,71), и 4 капли индикатора дефениламинсульфоната бария. Титруют раствором бихромата калия. Конечная точка титрования наступает, когда одна капля вызывает интенсивное темно-красное окрашивание, которе не изменяется после последующего добавления раствора бихромата калия.
Концентрацию (C1) Cl2, выраженную в ммоль/л, вычисляют по формуле:
где C2 — концентрация стандартного раствора бихромата калия, в данном случае 100 ммоль/л;
V1 — объем основного раствора соли Мора, мл; в данном случае 50 мл;
V2 — объем стандартного раствора бихромата калия, использованный при титровании, мл.
Примечание. Когда V2 становится меньше чем 22 мл, готовят свежий раствор.
Помещают 50 мл свежестандартизированного основного раствора в мерную колбу вместимостью 1 л. Разбавляют до метки и перемешивают. Помечают темную бутылку.
Такой раствор готовят по мере необходимости или ежедневно, если делают большое количество определений.
Концентрацию (C1) Cl2, выраженную в ммоль/л, вычисляют по уравнению:
Раствор арсената натрия (NaAsO2) c=2г/л, или раствором тиоацетамида (CH3CSNH2).
Раствор хлорноватистого натрия, с(Cl2), около 0,1 г/л. Готовят путем разбавления концентрированного раствора хлорноватистого натрия.
Раствор индикатора дефениламинсульфоната бария, 3 г/л. Разбавляют дефениламин-сульфонат бария [(C2H5-NH-C2H4SO3)Ba] в 100 мл воды.
Стандартный раствор бихромата калия, с(1/6K2Cr2O7)=100 ммоль/л. Взвешивают в точности до миллиграмма 4,904 г безводного бихромата калия. Растворяют в мерной колбе вместимостью 1 л.
Используется обычное лабораторное оборудование и микробюретку вместимостью до 5 мл с делением 0,02 мл.
Необходимую посуду готовят путем заполнения ее хлорноватистого натрия, затем через 1 час тщательно ополаскиваю водой. Во время исследований одну партия посуды следует иметь для определения свободного хлора, а другую для определения общего хлора, чтобы избежать загрязнения.
Определение начинают сразу же после отбора проб. Во всех случаях следует избегать яркого света, взбалтывания, подогрева.
Берут две исследуемые порции, каждую по 100 мл. Если концентрация превышает 0,07 ммоль/л (5 мг/л), необходимо брать меньший объем исследуемой пробы или разбавлять водой до 100 мл.
Определение свободного хлора
Быстро помещают в коническую колбу вместимостью 250 мл, последовательно 5 мл буферного раствора, 5 мл реактивного раствора ЦВП-1 и первую исследуемую порцию. Перемешивают и сразу же титруют до обесцвечивания раствором соли Мора. Записывают объем V3 мл, использованный при титрировании.
Если качество воды не известно, возможна сильно кислая или сльно щелочная, или же вода с высоким содержанием солей, то следует убедиться, что объем добавленного буферного раствора достаточно для доведения рН воды до 6,2-6,5. Если же этого нет, используют большой объем буферного раствора.
Быстро помещают в коническую колбу вместимостью 250 мл, последовательно 5 мл буферного раствора, 5 мл реактивного раствора ЦВП-1, вторую порцию и около 1 г иодида калия.
Перемешивают и через 2 мин титруют до обесцвечивания раствором соли Мора. Если в течении 2 мин наблюдается изменения окраски, то продолжают титровать до обесцвечивания. Записывают объем V4 мл, использованный при титрировании.
Если качество воды не известно, возможна сильно кислая или сльно щелочная, или же вода с высоким содержанием солей, то следует убедиться, что объем добавленного буферного раствора достаточно для доведения рН воды до 6,2-6,5. Если же этого нет, используют большой объем буферного раствора.
Если в пробе присутствует марганец, то определяют влияние окисленного марганца, выполняя дополнительное определение. Используют порцию исследуемой пробы, предварительно обработанной раствором арсенита натрия или тиоацетамида, чтобы нейтрализовать все окисленные соединения, кроме окисленных соединений марганца. Для этого исследуемую порцию помещают в коническую колбу вместимостью 250 мл, добавляют 1 мл раствора арсенита натрия или раствором тиоацетамидаи перемешивают. Вновь добавляют 5 мл буферного раствора и 5 мл реактива ЦВП-1. Сразу же титруют до обесцвечивания раствором соли Мора. Записывают объем V5, мл, соответствующий окисленному марганцу.
Расчет концентрации свободного хлора
Концентрацию свободного хлора c(Cl2), выраженную в ммоль/л, вычисляю по уравнению:
где c3 -концентрация раствора соли Мора, ммоль/л;
V3 — объем раствора соли Мора, используемый при титрировании, мл;
V5 — объем соли Мора, используемый для устранения влияния марганца. При отсутствии марганца V5=0 мл.
Расчет концентрации общего хлора
Концентрацию общего хлора c(Cl2), выраженную в ммоль/л, вычисляю по уравнению:
где V4 — объем раствора соли Мора, используемый при титровании, мл.
Переход от молярной концентрации к массовой. Концентрация хлора, выраженная в моль/л, может быть выражена в г/л умножением на коэффициент пересчета 70,91.
Могут быть выделены два вида мешающих влияний.
- 1)Мешающее влияние соединений хлора, содержащих диоксид хлора. Эти влияния могут корректироваться путем определения диоксида хлора в воде.
- 2)Мешающее влияние других соединений, кроме соединений хлора. Окисление ЦВП-1 вызывается не только соединениями хлора. В зависимости от концентрации и потенциала химического окисления реактив подвергается воздействию и других окислителей. Особенно следует упомянуть следующие вещества: бром, йод, бромамиды, иодамиды, озон, перекись водорода, хромат, окисленный марганец, нитрат, железо (III) и медь. При наличии меди (II) (менее 8 мг/л) и ионов железа (III) (менее 20 мг/л) помехи устраняют добавлением трилона Б в буферный раствор и в раствор ЦВП-1.
Отчет об определении должен содержать следующую информацию:
- а) ссылку на международный стандарт ИСО 7393-1
- б) всю информацию, необходимую для полной идентификации пробы
- в) результаты и использованный метод их выражения
- г) детали какого-либо процесса, не включенные в данный стандарт или рассматриваемые как не обязательные совместно с какими-либо подробностями, которые могут повлиять на результат.
Метод иодиметрического титрирования
ИСО 7393-3 устанавливает метод иодиметрического титрирования для определения общего хлора в воде.
Данный метод рекомендуется для измерений концентраций хлора c(Cl2) от 0,01 до 0,21 ммоль/л (0,71 — 15 мг/л).
Некоторые вещества оказывают мешающие в ходе определения, о чем будет сказано ниже.
В приложении стандарта представлен метод прямого титрирования. Его обычно применяют для определения концентраций хлора выше 7 мкмоль/л (0,5 мг/л) в обработанной питьевой воде.
Сущность метода заключается во взаимодействии проб воды с общим хлором и раствором иодида калия с выделением свободно йода, который сразу же восстанавливается известным избытком стандартного раствора тиосульфата, предварительно добавленного в раствор. Затем титруют избытком тиосульфата стандартным раствором иодида калия.
Вода, не содержащая хлора и других восстанавливающих веществ.
Раствор фосфорной кислоты(H3PO4), приблизительно 0,87 моль/л. Растворяют 64 г фосфорной кислоты, охлаждают и разбавляют до 1 л.
Стандартный титрированный раствор иодида калия, с(1/6KIO3)=10 ммоль/л. Взвешивают 0,36 г с точностью до 1 г сухого иодида калия.
Стандартный титрированный раствор тиосульфата натрия с(Na2S2O3*5H2O)=10ммоль/л. Растворяют 2,48г тиосульфата натрия приблизительно в 250мл воды в мерной колбе вместимостью 1л, разбавляют до метки водой и перемешивают.
Проверку титра раствора проводят ежедневно или непосредственно перед использованием следующим образом: помещают 200мл воды в коническую колбу вместимостью 500 мл. Добавляют приблизительно 1г иодида калия, затем вводят с помощью пипетки 10мл раствора тиосульфата натрия, 2мл фосфорной кислоты и 1 мл раствора крахмала. Сразу же титруют стандартным титрованным раствором иодида калия до появления синей окраски, сопровождающейся не менее 30с. Записывают объем иодида калия, использованный на титрирование. Титр С1 раствора тиосульфата натрия, выраженный в ммоль/л вычисляют по уравнению
Где С2 — концентрация стандартного титрированного раствора иодида калия, ммоль/л
V1 — объем раствора тиосульфата натрия, использованный при установлении титра, мл (V1=10мл)
V2 — объем стандартного титрированного раствора иодида калия, использованного при титрировании, мл
Раствор крахмала, 5 г/л или подобный индикатор, выпускаемый в промышленности.
Используют обычное лабораторное оборудование и бюретку с тонким наконечником со скоростью подачи 30капель/мл, объемом до 25мл с ценой деления 0,05мл.
Нужную посуду готовят, заполняя её раствором гипохлорита натрия с=0,1г/л, затем через 1 час тщательно ополаскивают дистиллированной водой и водой, не содержащей хлора.
Определение начинает сразу же после отбора проб. При проведении анализа следует избегать воздействия на пробу яркого света, перемешивания, подогрева.
Отбирают исследуемую порцию (V6), объем котрого не превышает 200мл, содержащую не более чем 0,21 ммоль/л (15г/л) общего хлора. Если количество общего хлора превышает эту концентрацию, разбавляют исследуемую порцию водой и отбирают часть исследуемой порции, объем которой не превышает 200мл.
Помещают исследуемую порцию в коническую колбу вместимостью 500мл. Добавляют поочередно 1г иодида калия, 2мл фосфорной кислоты и с помощью пипетки 10мл (V4) стандартного раствора тиосульфата натрия и затем 1мл раствора крахмала. Реагенты должны вводиться в строго определенной последовательности, так как в противном случае может иметь место нестехиометрическое превращение гипохлорита при воздействии тиосульфата.
Сразу же титруют стандартным титрированным раствором иодида калия до установления постоянной синей окраски в течении 30с., записывают объем иодида калия использованный на титрирование (V3)
Концентрация общего хлора c(Cl2), выраженную ммоль/л, вычисляют по формуле
где С1 — фактическая концентрация стандартного титрированного раствора тиосульфата натрия, ммоль/л
V2 — объем исследуемой порции перед разбавлением (если оно было), мл
V3 — объем стандартного раствора иодида калия, используемый на титрирование, мл
V4 — объем стандартного раствора тиосульфата натрия, использованный на титрирование, мл (V4=10).
Окисление иодида-иона до иона вызывается не только хлором. В зависимости от концентрации и химического потенциала окисления вызывают все окислители. Поэтому данный метод может применяться только при отсутствии других окисляющих веществ; особо следует отметить бром, йод, бромамины, йодамины, озон, перекись водорода, перманганат, иодат, бромат, хромат, диоксид хлора, хлорит, окисленный марганец, нитрит, ионы железа (III), ионы меди ( II) и марганца (III).
Отчет об определении должен содержать следующую информацию:
- а) ссылку на международный стандарт ИСО 7393-1
- б) всю информацию, необходимую для полной идентификации пробы
- в) результаты и использованный метод их выражения
- г) детали какого-либо процесса, не включенные в данный стандарт или рассматриваемые как не обязательные совместно с какими-либо подробностями, которые могут повлиять на результат.
источник
Йодометрический метод
Метод основан на окислении йодида активным хлором до йода, который титруют тиосульфатом натрия. Окислы, содержащиеся в воде, выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с рН 4,5.
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/л. Метод может использоваться также для окрашенных и мутных вод.
Используемые реактивы и оборудование.
· Колбы конические с притертыми крышками вместимостью 250 мл.
· Калий йодистый KJ по ГОСТ 4232 х.ч., 10% водный раствор.
· Натрий серноватистокислый (тиосульфат натрия) Na2S2O3 водный по ТУ 6-09-2540, 0,005 н раствор.
· Крахмал водорастворимый по ГОСТ 10163, 0,5%-ный раствор, приготовленный по ГОСТ 4919.1.
· Вода дистиллированная по ГОСТ 6709-72.
В 3 конические колбы с притертой пробкой вместимостью 250 мл вносят:
· 100 мл анализируемой водопроводной воды
· 5 мл 10%-ного раствора йодистого калия
· 5 мл ацетатной буферной смеси.
Содержимое колбы перемешивают. Выделившийся йод титруют 0,005 н. раствором серноватистокислого натрия до светло-желтой окраски, после чего прибавляют 1 мл 0,5%-ного раствора крахмала и раствор титруют до исчезновения синей окраски.
Результаты занести в таблицу
| № пробы | Начальный объем серноватистокислого натрия в бюретке Vнач | Конечный объем серноватистокислого натрия в бюретке Vкон | V= Vкон-Vнач |
| V ср= |
Обработка результатов.
Концентрацию Сах в мг/л вычисляют по формуле:
Сах =
где: V – средний объем 0,005 н. раствора серноватистокислого натрия, израсходованный на титрование пробы воды, мл; N – эквивалентная концентрация рабочего раствора серноватистокислого натрия; 35,45 – эквивалентная масса хлора, Vв — объем анализируемой пробы воды, мл.
За результат анализа принимают среднее арифметическое трех параллельных определений.
Сделайте вывод о соответствии полученной концентрации остаточного хлора в воде ПДК ГОСТ 2874-82
1. Приготовление 10%-ного раствора йодистого калия: 10 г йодистого калия растворяют в 90 мл свежеприготовленной и охлажденной дистиллированной воды.
2. Приготовление раствора буферной смеси: 102 1М уксусной кислоты ( 60г уксусной кислоты в 1 л воды) и 98 1М раствора уксуснокислого натрия (136,1 г уксуснокислого натрия в 1 л воды) наливают в мерную колбу вместимостью 1 л и доводят до метки дистиллированной водой.
3. Приготовление 0,1н раствора раствора серноватистокислого натрия: 25 г тиосульфата натрия растворяют в дистиллированной воде, добавляют 0,2 г углекислого натрия ( Na2CO3)доводят объем до 1л. Приготовление 0,005н раствора раствора серноватистокислого натрия: 50 мл 0,1 н раствора тиосульфата натрия разбавляют дистиллированной водой, добавляют 0,2 г углекислого натрия ( Na2CO3). доводят объем до 1л.
Определение свободного остаточного хлора титрованием метиловым оранжевым
Метод основан на окислении свободным хлором метилового оранжевого, в отличии от хлораминов, окислительный потенциал которых недостаточен для разрушения метилового оранжевого.
Используемые реактивы и оборудование.
· Колбы конические с притертыми крышками вместимостью 250 мл.
· Кислота соляная по ГОСТ 3118-67 плотностью1,19 г/см 3 .
· Метиловый оранжевый по ГОСТ 10816-64
· Вода дистиллированная по ГОСТ 6709-72.
Приготовление 0,005-ного раствора метилового оранжевого: 50 мг метилового оранжевого растворяют в дистиллированной воде, доводят до объема 1 л. 1 мл этого раствора соответствует 0,0217 мг свободного хлора.
Приготовление 5 н раствора соляной кислоты: в мерную колбу наливают дистиллированную воду, затем медленно добавляют 400 мл соляной кислоты и доводят дистиллированной водой до 1 л.
1. Заполнить бюретку 0,005 н раствором метилового оранжевого.
2. В 3 колбы отмерить по 100 мл анализируемой воды мерным сосудом.
3. Добавить в одну из колб с анализируемой водой 2-3 капли 5 н раствора соляной кислоты, перемешать.
4. Быстро оттитровать воду раствором метилового оранжевого до появления неисчезающей розовой окраски.
5. Повторить п.п 3 и 4 для двух оставшихся колб с анализируемыми пробами.
6.Полученные данные занести в таблицу
| № пробы | Начальный объем метилового оранжевого в бюретке Vнач | Конечный объем метилового оранжевого в бюретке Vкон | Vмо= Vкон-Vнач |
| Vмо ср= |
Обработка результатов
Содержание свободного остаточного хлора Сах в мг/л вычисляют по формуле
гдеVмо – объем раствора метилового оранжевого, израсходованного на титрование, мл;
0,0217 – титр раствора метилового оранжевого;
0,04 – эмпирический коэффициент;
Vв – объем воды, взятый для анализа, мл
Сделайте вывод о соответствии полученной концентрации остаточного хлора в воде ПДК ГОСТ 2874-82
источник
Во многих областях Украины водопроводная вода обрабатывается хлором. Хлорирование воды – распространённая практика в коммунальном хозяйстве, так как позволяет дезинфицировать воду и избежать размножения инфекций. Многие считают, что единственный недостаток хлорированной воды – неприятный запах. Но превышение хлоридов в воде может негативно отразиться на здоровье. Именно поэтому в спорных случаях необходим анализ воды на хлор. Почему норма хлоридов в питьевой воде может быть превышена и насколько это опасно – узнаете из нашей статьи.
Хлор – один из элементов необходимых для нормальной жизнедеятельности человеческого организма. Дефицит хлора может спровоцировать общую слабость, снижение давления, ухудшение аппетита и т.п. В основном суточная потребность в хлоридах восполняется организмом за счёт обыкновенной поваренной соли. Содержится хлор и в ряде продуктов нашего повседневного рациона (хлеб, масло, сыр, яйца и т.п.). Также хлор может попадать в организм и с питьевой водой. Предельно допустимая концентрация хлоридов в воде устанавливается по органолептическому показателю – вкусовым качествам. При концентрации хлорида натрия больше 250 мг/л вода уже имеет солоноватый вкус. А вот хлоридов кальция или магния для такого же эффекта нужно не менее 1000 мг/л. Усреднённая норма хлоридов в питьевой воде составляет не более 250 мг/л. (В отдельных случаях, связанных с природными условиями и технологией подготовки воды в Украине до 2020 года допускается концентрация до 350 мг/л).
Если же анализ воды на хлор показывает превышение нормы, употребление её может негативно отразиться на здоровье.
Вообще, хлориды в воде в природе содержатся как в поверхностных, так и в грунтовых водах. В коммунальном хозяйстве хлор широко применяется для дезинфекции воды и уничтожения бактерий, но вместе с тем это достаточно опасное токсичное вещество. Среди наиболее распространённых хлоридов: хлорид натрия (обычная поваренная соль), хлорид водорода, хлорид магния, диоксид хлора и т.д. Анализ воды на хлориды и хлор обязательно входит в перечень показателей химического анализа, помогающего определить качество воды. С одной стороны, хлор эффективно борется с бактериями и решает проблему чистоты воды. Но, в то же время, в воде после добавления хлора могут возникать так называемые тригалометаны. Это токсины, которые образуются при реакции хлора с природными элементами в воде. Вот эти-то вещества, попадая в наш организм с водопроводной водой, могут привести к серьёзным проблемам со здоровьем. Например, таким как:
- астма
- кожные заболевания
- заболевания сердечнососудистой системы
Но самое опасное, что эти вещества являются канцерогенами и провоцируют развитие онкологических заболеваний. Украинские учёные пришли к выводу, что для оценки концентрации тригалометанов, которые образуются в процессе водоподготовки, можно использовать такой показатель как общий органический углерод. Он также, как и хлориды, определяется при химическом анализе воды.
Если анализ воды на хлориды и хлор показал превышение нормы, то опасно не только пить такую воду, но и купаться в ней. Поскольку хлор легко проникает в организм и через кожу.
Повышенное содержание хлора и хлоридов в воде не только делает её неприятной на вкус, при этом она становится практически непригодной для многих хозяйственных нужд (в частности, для полива).
Существенное превышение хлоридов в воде говорит о том, что, скорее всего, где-то была нарушена технология водоподготовки. Поскольку постоянное использование воды с превышенным уровнем хора может негативно отразиться на здоровье, не лишним будет перестраховаться и при малейшем подозрении сдать воду на анализ. Заподозрить неладное можно, например, если вы почувствовали, что характерный запах хлора усилился.
При заборе пробы для анализа воды на хлор обратите внимание, что для получения объективных результатов образец должен оказаться в лаборатории максимум через два часа.
Что же делать, если лабораторные исследования подтвердили превышение хлоридов в воде? Сразу отметим, что кипячение никоим образом не помогает снизить уровень хлора. Более того, при нагревании хлор реагирует с солями находящимися в воде и образует ещё более опасные вещества. Поэтому к способам, которые «реально работают» стоит отнести два:
- отстаивание (хлор очень летучий и на воздухе его содержание в воде резко снижается)
- фильтрация
Это может показаться парадоксальным, но даже установка недешёвого фильтра окупится достаточно быстро. Не говоря уже об удобстве. Ведь отстаивать воду для того, чтобы принять ванну – занятие хлопотное, а покупка бутилированной воды для питья и готовки влетит «в копеечку». При этом с проблемой избыточного хлора справляются даже недорогие угольные фильтры.
Заботьтесь о здоровье и следите за качеством питьевой воды!
источник
Данный йодометрический метод основан на свойстве всех содержащих ак тивный хлор соединений в кислой среде выделять из йодида калия свободный йод:
С1О — +2Н + +2 I — = I 2 +С l — +Н2О
НС1О+Н + + 2 I — = I 2 + С l — +Н2О
Свободный йод оттитровывают тиосульфатом натрия в при сутствии крахмала как описано при определении растворенного кислорода. Реакцию проводят в буферном растворе при рН 4,5, и тогда определению не мешают нитриты, озон и другие соединения. Однако мешающими определению веществами являются другие силь ные окислители, которые также выделяют йод из йодида калия – хроматы, хлораты и др. Концентрации, в которых указанные окис лители оказывают мешающее действие, могут присутствовать в сточ ных водах, но маловероятны в питьевой и природной воде. Метод может использоваться для анализа также мутных и окрашенных вод.
Концентрацию активного хлора (САХ) в мг/л рассчитывают по результатам титрования, для которого обычно использует ся раствор тиосульфата натрия с концентрацией 0,005 г-экв /л. Расчет проводят по формуле:
,
где VT – количество раствора тиосульфата натрия с концентрацией 0,005 г-экв /л, израсходованного на титрование, мл;
К – поправочный коэффициент, учитывающий отклонение точной фактической концентрации тиосульфата от значения 0,005 г-экв /л (для большинства случаев значение К принимается равным 1);
0,177 – содержание активного хлора в мг, соответствующее 1 мл раствора тиосульфата с концентрацией 0,005 г-экв /л;
VA – объем пробы воды, взятой для анализа, мл;
1000 – коэффициент пересчета единиц измерения из миллилитров в литры.
Чувствительность метода – 0,3 мг/л при объеме пробы 250 мл, однако при использовании растворов тиосульфата с различной концентрацией объем пробы может составлять, в зависимости от требуемой чувствительности определения, от 500 до 50 мл воды и менее. Лимитирующий показатель вредности для активного хлора – общесанитарный .
Колба коническая на 250-500 мл с градуировкой по объе му (если колба не отградуирована, тогда необходим также мер ный цилиндр), бюретка или пипетка градуированная на 2-5 мл со шприцем и соединительной трубкой, шприц-дозатор (пипетка) на 1 мл (2 шт.), ножницы.
Калий йодистый в капсулах по 0,5 г , раствор буферный ацетатный ( рН 4,5), раствор тиосульфата натрия титрованный (0,005 г-экв /л), раствор крахмала (0,5 %).
1. Налейте в коническую колбу анализируемую воду до метки (например, 50 мл) либо с помощью мерного цилиндра. Колбу предварительно ополосните анализируемой водой.
2. Поместите в колбу при помощи шприца-дозатора или пипетки 1,0 мл ацетатного буферного раствора, содержимое колбы перемешайте.
3. Добавьте в коническую колбу содержимое одной капсулы (около 0,5 г ) йодида калия. Перемешайте содержимое колбы до растворения соли.
4. Оттитровывайте выделившийся йод раствором тиосульфата. Для этого в бюретку (пипетку), закреплен ную в штативе и соединенную через трубку со шприцем, наберите 2-5 мл раствора тиосульфата и титруйте пробу до слабожелтой окраски.
5. Добавьте другим шприцем-дозатором (пипеткой) 1 мл раствора крахмала (раствор в колбе синеет) и продолжайте титрование до полного обесцвечивания ра створа.
ПРИМЕЧАНИЕ: после изменения окраски пробу необходимо выдержать еще 0,5 мин. для полного протекания реакции. В случае восстановления окрас ки необходимо добавить еще некоторое количество раствора титранта .
6.Определите общий объем раствора тиосульфата, и зрасходованный на титрование (как до, так и после добавления раствора крахмала).
7. Рассчитайте концентрацию суммарного остаточного активного хлора (САХ) в мг/л по формуле, приведенной выше.
При необходимости анализ повторите, уменьшив (увели чив) объем пробы.
В качестве экспрессной портативной полевой модификации метода с чувствительностью не менее 0,3-0,5 мг/л для опреде ления активного хлора в питьевой, водопроводной и природной воде может быть рекомендовано использование раствора тиосуль фата с концентрацией 0,0025 г-экв /л, при отборе пробы 50 мл и титрование с помощью калиброванной пипетки-капельницы. В этом случае концентрация активного хлора (САХ) в мг/л рассчитывается по формуле:
где N – количество капель раствора тиосульфата натрия, израсхо дованного на титрование;
0,1 – количество остаточного активного хлора в мг, соответству ющее содержанию в 1 капле раствора тиосульфата натрия с концентрацией 0,0025 г-экв /л с учетом титрования пробы воды объемом 50 мл;
К – поправочный коэффициент для данной пипетки-капельницы, установленный экспериментальным путем и учитывающий разницу в объемах капель, отрывающийся от разных пипеток (обычно значение К близко 1).
источник
