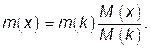Электрохимические методы анализа основаны на измерении потенциалов, силы тока и других характеристик при взаимодействии анализируемого вещества с электрическим током.
Электрохимические методы делятся на три группы:
¨ методы, основанные на электродных реакциях, протекающих в отсутствии тока (потенциометрия);
¨ методы, основанные на электродных реакциях, протекающих под действием тока (вольтамперометрия, кулонометрия, электрогравиметрия);
¨ методы, основанные на измерениях без протекания электродной реакции (кондуктометрия – низкочастотное титрование и осциллометрия – высокочастотное титрование).
По приемам применения электрохимические методы классифицируются на прямые, основанные на непосредственной зависимости аналитического сигнала от концентрации вещества, и косвенные (установление точки эквивалентности при титровании).
Для регистрации аналитического сигнала необходимы два электрода – индикаторный и сравнения. Электрод, потенциал которого зависит от активности определяемых ионов, называется индикаторным. Он должен быстро и обратимо реагировать на изменение концентрации определяемых ионов в растворе. Электрод, потенциал которого не зависит от активности определяемых ионов и остается постоянным, называется электродом сравнения.
ПОТЕНЦИОМЕТРИЯ
Потенциометрический метод основан на измерении электродвижущих сил обратимых гальванических элементов и применяется для определения концентрации ионов в растворе.
Метод был разработан в конце прошлого столетия, после того, как в 1889 г. Вальтер Нернст вывел уравнение, связывающее потенциал электрода с активностью (концентрацией веществ):

где 





При погружении металлической пластинки в раствор, на границе металл-раствор устанавливается равновесие
и возникает электродный потенциал. Измерить этот потенциал нельзя, но можно измерить электродвижущую силу гальванического элемента.
Исследуемый гальванический элемент состоит из двух электродов, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом).
Электрод, потенциал которого зависит от активности определяемых ионов, называется индикаторным: Е= f(с). Электрод, потенциал которого не зависит от концентрации определяемых ионов и остается постоянным называется электродом сравнения. Его применяют для измерения потенциала индикаторного электрода.
 | Рис. 9. Прибор для измерения ЭДС гальванического элемента: 1 – электролитическая ячейка с раствором; 2 – индикаторный электрод; 3 – электрод сравнения; 4 – потенциометр. |
ЭДС исследуемого элемента выражается как разность между потенциалом электрода сравнения и потенциалом индикаторного электрода:
При постоянном потенциале Ест., измерив на приборе ЭДС элемента, можно рассчитать потенциал индикаторного электрода.
Для измерения электродвижущей силы применяют систему двух электродов – индикаторного и электрода сравнения.
В соответствии с механизмом возникновения или изменения потенциала электроды классифицируются на металлические, электроды II рода и ионоселективные (мембранные) электроды (рис. 10). Металлические электроды делятся на активные I рода и индифферентные:
Рис. 10. Классификация индикаторных электродов
Требования к индикаторным электродам
1. Равновесный потенциал электрода должен устанавливаться быстро;
2. Электрод должен быть обратим (потенциал изменяется с изменением концентрации определяемого вещества). Свойство обратимости присуще не всем электродам (Al покрывается окисной пленкой, нельзя использовать электроды из Fe, Cr…);
3. Электрод должен обладать воспроизводимостью;
4. Электрод должен обладать химической устойчивостью (например, Zn – электрод не пригоден в кислой среде, т.к. металл растворяется в кислоте).
Активные металлические электроды I рода. Представляет собой металлическую пластину или проволоку, погруженную в раствор хорошо растворимой соли этого металла. Например, серебряная проволока, погруженная в раствор нитрата серебра (рис. 11).
 | Рис. 11. Серебряный электрод. |
На поверхности электрода возникает двойной электрический слой, и устанавливается равновесный потенциал Е, который зависит от активности ионов Ag + в растворе:
К катионобменным электродам относятся медный, ртутный, серебряный, кадмиевый, амальгамные электроды (раствор металла в ртути, к амальгамным электродам относятся цинковый, свинцовый).
Металлические индифферентные электроды не участвуют в электрохимической реакции, а только обеспечивают перенос электронов для окислительно-восстановительной реакции, протекающей в растворе. Такие электроды представляют собой проволоку, пластину или сетку, изготовленную из инертных металлов (платина, золото, палладий), а также графит, погруженные в раствор, содержащий сопряженную редокс-пару. Потенциал такого электрода зависит от активности окисленной и восстановленной форм данной редокс-пары. Например, редокс-потенциал платинового электрода, погруженного в раствор, содержащий Fe +3 и Fe +2 :

Электроды II рода представляют системы, в которых металл электрода покрыт труднорастворимой солью этого металла и находится в растворе, содержащем хорошо растворимую соль с теми же анионами. Эти электроды обратимы относительно анионов, их потенциал зависит от активности анионов труднорастворимого соединения, входящего в состав электрода. Электроды II рода применяются, как правило, в качестве электродов сравнения (потенциал таких электродов при измерениях остается постоянным).
К электродам II рода относится хлоридсеребряный электрод. Он представляет собой серебряную проволоку, покрытую труднорастворимой солью AgCl и погруженную в насыщенный раствор хорошо растворимой соли с одноименным анионом – KCl (рис. 12).
Потенциал электрода зависит от активности (концентрации) хлорид-ионов в растворе:

где 

 | Рис. 12. Хлоридсеребряный электрод: 1 – серебряная проволока; 2 – AgCl; 3 – насыщенный раствор KCl; 4 – дренаж (асбестовое волокно) |
Потенциал электрода при измерениях остается постоянным и не зависит от состава анализируемого раствора, т. к. внутренний раствор KCl насыщен, и концентрация Cl – не изменяется. Если внутренний раствор KCl ненасыщен, электрод применяется как индикаторный для определения концентрации Cl – .
Ионоселективные электроды (ИСЭ) – сенсоры (чувствительные элементы, датчики), потенциал которых линейно зависит от lg а определяемого иона в растворе. Важнейшей составной частью ИСЭ является полупроницаемая мембрана, способная пропускать только определенные ионы. Мембраны изготавливаются из специальных сортов стекла, монокристаллов, органических полимеров, пленок ферментов, жидких ионообменников. На границе мембрана – раствор устанавливается равновесие обмена ионами и возникает разность потенциалов. Потенциал ИСЭ зависит от активности определяемого иона в анализируемом растворе а1и во внутреннем растворе электрода а2:

Важной характеристикой ИСЭ является потенциометрический коэффициент селективности, показывающий во сколько раз электрод более чувствителен к определяемым ионам, чем к посторонним. Коэффициент селективности (К) характеризует способность мембраны различать ионы. Чем меньше К, тем выше селективность. Например, коэффициент селективности рNа электрода 


Наибольшее применение находит стеклянный электрод, селективный на Н + (рН–стеклянный электрод). В 1909 г. он был предложен Ф. Габером для определения рН.
Он представляет собой тонкостенный стеклянный шарик (рис. 13), заполненный стандартным 0,1 моль/дм 3 раствором HCl или буферным раствором. Внутренний электрод – серебряная проволока, покрытая труднорастворимой солью AgCl. Устройство закрыто защитной трубкой. Мембрана изготовлена из алюмосиликатного стекла с массовой долей до 22 % Na2O, 72 % SiO2 и 6 % CaO.
Высокое содержание Na + в мембране способствует обмену ионами Na + мембраны и Н + из раствора; на поверхности электрода устанавливается равновесие: Na + стекло↔ Н + раствор. За счет различия концентрации ионов Н + по обе стороны от мембраны возникает двойной электрический слой и ЭДС: Н + раствор↔ Н + стекло.
Потенциал стеклянного электрода зависит от активности (концентрации) ионов Н + в растворе:

где 
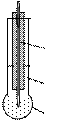 | Рис. 13. Стеклянный электрод: 1 – мембрана; 2 – стандартный раствор HCl; 3 – хлоридсеребряный электрод |
Преимущества рН-стеклянного электрода: электрохимическое равновесие устанавливается мгновенно; не адсорбирует поверхностно-активные вещества; применим в широком диапазоне рН; отсутствует влияние окислителей и восстановителей на работу электрода. Недостатки электрода: не рекомендуется применение при рН > 10 (нарушаются функции электрода), в присутствии плавиковой кислоты (стекло растворяется), кроме того, такой электрод весьма хрупок, что создает известные затруднения при его использовании.
С другим составом стекла электроды селективны на другие ионы. Например, в аналитической практике применяются рNa–, pK–, pLi–, pAg–, pCa–, pMg–, pBa–, pNH4–, рNО3–, рСl– стеклянные электроды.
Электрод с кристаллической мембраной представляет собой трубку, на конце которой находится мембрана из малорастворимого кристаллического вещества с ионным характером проводимости. Трубка заполнена раствором сравнения (0,1 М раствор определяемого иона и КСl), рис. 14. Электродом сравнения служит хлоридсеребряный электрод. Мембрана изготовлена из сульфида серебра Аg2S (сульфидный электрод) или фторида лантана – LaF3 (фторидный). Электрод применяется для определения ионов F – , Ag + , S 2– ,Cl – , Br – , J – и т.д.
 | Рис. 14. ИСЭ с кристаллической мембраной: 1– мембрана; 2 – раствор сравнения; 3 – хлоридсеребряный электрод |
Электрод с жидкой мембраной. Хлоридсеребряный электрод погружен в раствор хорошо растворимой соли хлорида определяемого катиона (рис. 15). Исследуемый раствор отделен от раствора сравнения тонким слоем жидкого ионита. Электроды применяются для определения Са 2+ , К + , Nа + , NН4 + и т.д.
 | Рис. 15. ИСЭ с жидкой мембраной: 1 – хлоридсеребряный электрод; 2 – раствор МеCl2; 3 – ионит; 4 – дренаж |
Потенциометрический анализ. Различают два вида потенциометрического анализа:
Не нашли то, что искали? Воспользуйтесь поиском:
источник
1. Электрохимические методы анализа
3.Кондуктометрия. Кондуктометрическое титрование
4.Кулонометрия. Кулонометрическое титрование
5. Список используемой литературы
Электрохимические методы анализа
Классификация электрохимических методов анализа
Электрохимические методы основаны на измерении электрических параметров электрохимических явлений, возникающих в исследуемом растворе. Такое измерение осуществляют с помощью электрохимической ячейки, представляющей собой сосуд с исследуемым раствором, в который помещены электроды. Электрохимические процессы в растворе сопровождаются появлением или изменением разности потенциалов между электродами или изменение величины тока, проходящего через раствор.
Электрохимические методы классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. В общем случае различают две группы электрохимических методов:
1. Методы без наложения постороннего потенциала, основанные на измерении разности потенциалов, который возникает в электрохимической ячейке, состоящей из электрода и сосуда с исследуемым раствором. Эту группу методов называют потенциометрическими. В потенциометрических методах используют зависимость равновесного потенциала электродов от концентрации ионов, участвующих в электрохимической реакции на электродах.
2. Методы с наложением постороннего потенциала, основанные на измерении: а) электрической проводимости растворов – кондуктометрия ; б) количества электричества, прошедшего через раствор – кулонометрия ; в) зависимости величины тока от приложенного потенциала – вольт-амперометрия ; г) времени, необходимого для прохождения электрохимической реакции – хроноэлектрохимические методы (хроновольтамперометрия, хронокондуктометрия). В методах этой группы на электроды электрохимической ячейки налагают посторонний потенциал.
Основным элементом приборов для электрохимического анализа является электрохимическая ячейка. В методах без наложения постороннего потенциала она представляет собой гальванический элемент , в котором вследствие протекания химических окислительно-восстановительных реакций возникает электрический ток. В ячейке типа гальванического элемента в контакте с анализируемым раствором находятся два электрода – индикаторный электрод, потенциал которого зависит от концентрации вещества, и электрод с постоянным потенциалом – электрод сравнения, относительно которого измеряют потенциал индикаторного электрода. Измерение разности потенциалов производят специальными приборами – потенциометрами.
В методах с наложением постороннего потенциала применяют электрохимическую ячейку , названную так потому, что на электродах ячейки под действием наложенного потенциала происходит электролиз – окисление или восстановление вещества. В кондуктометрическом анализе используют кондуктометрическую ячейку, в которой замеряют электрическую проводимость раствора. По способу применения электрохимические методы можно классифицировать на прямые, в которых концентрацию веществ измеряют по показанию прибора, и электрохимическое титрование, где индикацию точки эквивалентности фиксируют с помощью электрохимических измерений. В соответствии с этой классификацией различают потенциометрию и потенциометрическое титрование, кондуктометрию и кондуктометрическое титрование и т.д.
Приборы для электрохимических определений кроме электрохимической ячейки, мешалки, нагрузочного сопротивления включают устройства для измерения разности потенциалов, тока, сопротивление раствора, количества электричества. Эти измерения могут осуществляться стрелочными приборами (вольтметр или микроамперметр), осциллографами, автоматическими самопишущими потенциометрами. Если электрический сигнал от ячейки очень слабый, то его усиливают с помощью радиотехнических усилителей. В приборах методов с наложением постороннего потенциала важной частью являются устройства для подачи на ячейку соответствующего потенциала стабилизированного постоянного или переменного тока (зависит от типа метода). Блок электропитания приборов электрохимического анализа включает обычно выпрямитель и стабилизатор напряжения, который обеспечивает постоянство работы прибора.
Потенциометрия основана на измерении разности электрических потенциалов, возникающих между разнородными электродами, опущенными в раствор с определяемым веществом. Электрический потенциал возникает на электродах при прохождении на них окислительно-восстановительной (электрохимической) реакции. Окислительно-восстановительные реакции протекают между окислителем и восстановителем с образованием окислительно-восстановительных пар, потенциал Е которых определяется по уравнению Нернста концентрациями компонентов пар [ок] и [вос]:
Потенциометрические измерения проводят, опуская в раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и стандартный электрод или электрод сравнения, относительно которого измеряется потенциал индикаторного. Применяют несколько видов индикаторных и стандартных электродов.
Электроды первого рода обратимы относительно ионов металла, из которого состоит электрод. При опускании такого электрода в раствор, содержащий катионы металла, образуется электродная пара
Электроды второго рода чувствительны к анионам и представляют собой металл М, покрытый слоем нерастворимой его соли МА с анионом
Электродами второго рода являются хлорсеребряный и каломельный. Насыщенные хлорсеребряный и каломельный электроды поддерживают постоянный потенциал и применяют в качестве электродов сравнения, по отношению к которым измеряется потенциал индикаторного электрода.
Инертные электроды – пластина или проволока, изготовленная из трудноокисляемых металлов – платины, золота, палладия. Применяются они для измерения Е в растворах, содержащих окислительно-восстановительную пару (например,
Мембранные электроды различного типа имеют мембрану, на которой возникает мембранный потенциал Е. Величина Е зависит от разности концентраций одного и того же иона по разным сторонам мембраны. Простейшим и наиболее употребляемым мембранным электродом является стеклянный электрод.
Смешивание нерастворимых солей типа AgBr, AgCl, AgI и других с некоторыми пластмассами (каучуки, полиэтилен, полистирол) привело к созданию ион-селективных электродов на
Для проведения потенциометрических определений собирают электрохимическую ячейку из индикаторного электрода сравнения, который опускают в анализируемый раствор и подсоединяют к потенциометру. Применяемые в потенциометрии электроды имеют большое внутреннее сопротивление (500-1000 МОм), поэтому существуют типы потенциометров представляют собой сложные электронные высокоомные вольтметры. Для измерения ЭДС электродной системы в потенциометрах применяют компенсационную схему, позволяющую уменьшить ток в цепи ячейки.
Наиболее часто потенциометры применяют для прямых измерений рН, показатели концентраций других ионов pNa, pK, pNH₄, pCl и мВ. Измерения проводят, используя соответствующие ион-селективные электроды.
Для измерения рН применяют стеклянный электрод и электрод сравнения – хлорсеребряный. Перед проведением анализов необходимо проверить калибровку рН-метров по стандартным буферным растворам, фиксаналы которых прикладываются к прибору.
рН-метры помимо прямых определений рН, pNa, pK, pNH₄, pCl и других позволяют проводить потенциометрическое титрование определяемого иона.
Потенциометрическое титрование проводят в тех случаях, когда химические индикаторы использовать нельзя или при отсутствии подходящего индикатора.
В потенциометрическом титровании в качестве индикаторов используют электроды потенциометра, опушенные в титруемый раствор. При этом применяют электроды, чувствительные к титруемым ионам. В процессе титрования изменяется концентрация ионов, что регистрируется на шкале измерительного пробора потенциометра. Записав показания потенциометра в единицах рН или мВ, строят график их зависимости от объема титранта (кривую титрования), определяют точку эквивалентности и объем титранта, израсходованный на титрование. По полученным данным строят кривую потенциометрического титрования.
Кривая потенциометрического титрования имеет вид, аналогичный кривой титрования в титриметрическом анализе. По кривой титрования определяют точку эквивалентности, которая находится в середине скачка титрования. Для этого проводят касательные к участкам кривой титрования и по середине касательной скачка титрования определяют точку эквивалентности. Наибольшее значение изменения ∆рН/∆V приобретает в точке эквивалентности.
источник
Электрохимические методы анализа. Электрохимические методы – наиболее динамично развивающиеся с точки зрения их применения в экологическом мониторинге
Электрохимические методы – наиболее динамично развивающиеся с точки зрения их применения в экологическом мониторинге. Наиболее часто в системах МОС используют вольтамперометрию (включая полярографию), потенциометрию (в т.ч. ионометрию), кулонометрию и кондуктометрию.
Электрохимические методы анализа используют зависимость различных электрических свойств среды от количественного содержания и качественного состава анализируемых в ней веществ:
· изменение потенциала электрода в зависимости от физико-химических процессов, протекающих в веществе (потенциометрический метод), в т.ч. селективные реакции ионоселективных электродов, индивидуально чувствительных к большому числу катионов и анионов (ионометрический метод);
· изменение электропроводности (тока) и диэлектрической проницаемости вещества в зависимости от природы среды и концентрации ее компонентов (кондуктометрический и амперометрический методы);
· изменения количества электричества при попадании определяемого вещества в электрохимическую ячейку (кулонометрический метод);
· восстановление анализируемого соединения на ртутном капающем или вращающемся электроде, как правило, при анализе следовых количеств веществ, находящихся в разных агрегатных состояниях (полярографический или вольтамперометрический метод).
Полярографы из всех приборов этой группы имеют наивысшую чувствительность, равную 0,005–1 мкг/мл пробы.
Вольтамперометрия включает в себя группу электрохимических методов анализа, основанных на изучении поляризационных кривых. Эти методы – полярография и амперометрическое титрование– имеют множество разновидностей и модификаций. Наиболее распространена постоянно-токовая полярография.
Полярографическая установка состоит из источника постоянного тока, делителя напряжения, капельного (обычно ртутного) или вращающегося электрода и вспомогательного (обычно тоже ртутного или другого) электрода. Дляизмерения силы тока в систему подключают микроамперметр. Электроды помещены вместе с исследуемым раствором в электролизер (ячейку).
Наложенное на электролитическую ячейку напряжение вызывает поляризацию анода и катода E = fa – fk +iR, где i – сила тока; К – сопротивление раствора; fa и fk – потенциалы анода и катода.
Если уменьшить сопротивление раствора, добавив сильный электролит (фон), то величиной iR (падение потенциала в растворе) можно пренебречь.
Потенциал анода практически остается постоянным во время работы электролизера, таккак плотность тока мала и относительно большая поверхность анода не поляризуется. Тогда потенциал капающего поляризующего катода с небольшой поверхностью будет равен: Е = -fk. Часто в полярографических измерениях вместо слоя ртути на дне сосуда применяют неполяризующийся насыщенный каломелевый электрод, потенциал которого принимают равным нулю.
Полярографические данные получают путем измерения тока, проходящего через электролитическую ячейку, как функции потенциала, налагаемого на электроды. Графическую зависимость силы тока от потенциала называют полярографической волной (рис. 2).
В начале электролиза при небольших значениях наложенной ЭДС сила тока будет почти постоянной и лишь очень медленно возрастать. Это так называемый остаточный ток, который сохраняется во все время электролиза.
Рис. 2. Полярограмма 10 –3 М раствора хлорида цинка и 1 М раствора хлорида калия (кривая 1) и 1 М раствора хлорида калия (кривая 2)
Как только будет достигнут потенциал восстановления ионов (например, для определяемых ионов цинка он равен -1,0 В), начинается их разряд на капле ртути:
Zn 2+ + 2 
На катоде образуется разбавленная амальгама цинка Zn (Hg), которая разлагается насвои составляющие, как только падающая капля соприкоснется с анодом:
Zn (Hg) – 2 
При потенциале восстановления ионов цинка сила тока резко возрастает (рис. 2), но после достижения определенной величины, несмотря на увеличение приложенной ЭДС, она остается почти постоянной. Этот ток называется предельным или диффузионным, его величина,как правило, пропорциональна концентрации определяемого вещества.
При снятии полярограмм к исследуемому электролиту добавляют индифферентный электролит с катионами, восстанавливающимися гораздо труднее анализируемого катиона, например, КСl, KNO3, NH4Cl; при концентрации в 100–1000 раз превышающей концентрацию определяемого вещества. Такой электролит называют «фоновым». Его создают в исследуемом растворе для увеличения электропроводности и для экранирования электрического поля индикаторного электрода (катода). Поэтому катионы определяемого вещества не притягиваются электрическим полем катода, а двигаются к нему за счет диффузии.
Важнейшей характеристикой полярограммы является потенциал полуволны Е1/2 и высота полярографической волны h (предельный диффузионный ток). Потенциал полуволны используют в качественном полярографическом анализе. Потенциалы полуволны различных веществ, расположенные в порядке возрастанияих отрицательного значения, составляют так называемый «полярографический спектр». Поскольку потенциал полуволны существенно зависит от состава раствора (анализируемой среды), в полярографических таблицах всегда указывается фон.
В количественном полярографическом анализе для измерения концентрации используют методы градуировочного графика, добавок, сравнения и расчетный метод.
Среди различных вариантов полярографии метод дифференциальной импульсной полярографии (ДИП) наиболее эффективен для решения задач экологического мониторинга, главным образом благодаря высокой чувствительности. Метод ДИП позволяет оценивать содержание всех веществ, определяемых методом классической полярографии. Среди других полярографических методов, особенно удобна для следового анализа квадратно-волновая полярография, которая обеспечивает предел обнаружения, близкий к пределу обнаружения ДИП, но только в случае обратимых электродных процессов, и поэтому этот метод часто используется для определения следов тяжелых металлов. Метод ДИП может использоваться и для определения поверхностно-активных веществ, изменяющих емкость двойного электрического слоя электрода.
Для определения микросодержаний ионов тяжелых металлов могут быть использованы методы инверсионною электрохимического анализа (ИЭА) или по-другому, инверсионного вольтамперометрического анализа (ИВА), в которых определяемые металлы предварительно осаждают на электроде и затем растворяют при полярографическом контроле. Этот вариант в сочетании с ДИП относится к наиболее чувствительным методам электрохимического анализа. Аппаратурное оформление ИЭА (ИВА) относительно несложное, что позволяет проводить анализы в полевых условиях, причем автоматизированные станции непрерывного контроля (мониторинга) также могут работать на этом принципе.
Методы ИЭА (ИВА) обеспечивают определение ионов Сu, РЬ, Bi, Sb, As, Sn In, Ga, Ag, Tl, Cd, Zn, Hg, Аu, Ge, Те, Ni, Со и многих анионов. Важным преимуществом методов ИЭА (ИВА) является (в отличие от других методов, например, таких, как атомно-абсорбционная спектрометрия) способность отличать свободные ионы oт их связанных химических форм, что важно и для оценки физико-химических свойств анализируемых веществ с точки зрения экоаналитического контроля (например, при оценке качества воды). Многие органические вещества также могут быть определены методами ИЭА (ИВА) после их адсорбционного накопления на поверхности электрода.
Полярографическими методами можно также определять аэрозоли различных металлов в атмосфере и воздухе производственных помещений после их улавливания на соответствующих фильтрах с последующим переведением концентратов в раствор. Органические соединения, находящиеся в виде газов и паров в атмосфере, могут быть определены полярографически после их поглощения специально подобранными растворами. Металлы и различные соединения в биологических материалах обычно определяют полярографически после их экстракции. Все полярографические измерения, в т. ч. ИЭА (ИВА), могут быть полностью автоматизированы, что существенно при выполнении серийных анализов.
Одной из важнейших областей применения полярографии является определение кислорода в воде. Для этого используют амперометрические детекторы, генерирующие ток, пропорциональный концентрации кислорода в растворе.
Нанося фермент на поверхность мембраны детектора можно получать различные ферментные амперометрические сенсоры, удобные для биохимических и клинических анализов. Такие сенсоры применяют и в системах экологического мониторинга [3].
Электроды, работающие по электрокаталитическому принципу [4], пригодны для мониторинга различных газов (SО2, H2S, CO, NOx) в воздухе производственных помещений. Электрохимические реакции этих газов (играют роль катализатора), протекающие на поверхности электрода, генерируют в электродной системе ток, функционально связанный с концентрацией газов в воздухе.
Применение полярографии не ограничивается анализом дискретных проб, и метод постепенно переходит на принципы непрерывного анализа газов и жидкостей.
Вольтамперометрические полярографические детекторы успешно применяются в высокоэффективной жидкостной хроматографии (ВЭЖХ). В этом случае сочетание высокоселективного способа разделения с чувствительным способом детектирования приводит к заметному расширению номенклатуры веществ, определяемых хроматографическим методом (следы высокотоксичных веществ, гербициды, лекарственные препараты, стимуляторы роста и др.).
Подробности метода можно уточнить в специальной литературе [5],[6],[7],[8],[9].
Потенциометрия – метод определения концентрации веществ, основанный на измерении ЭДС обратимых гальванических элементов.
На практике используют два аналитических метода: прямую потенциометриюдля определения активности частиц, которую можно рассчитать с помощью уравнения Нернста по ЭДС гальванического элемента, и потенциометрическое титрование, в котором изменение активностей химических веществ в процессе титрования приводит к изменению ЭДС гальванического элемента.
Аппаратура для проведения потенциометрических титрований и для прямой потенциометрии одна и та же. В схему потенциометрических измерений входят индикаторный электрод и электрод сравнения, обладающий устойчивым постоянным потенциалом, в также вторичный прибор. Принципиальная схема метода показана на рис. 3.
1 – индикаторный электрод; 2 — электрод сравнения
Рис. 3. Потенциометрическая ячейка
Потенциал пары электродов постоянен. Изменение концентрации анализируемого вещества в растворе изменяет ЭДС цепи. Индикаторные электроды обычно бывают четырех типов, в зависимости от применяемой мембраны которая отделяет раствор электрода от исследуемого раствора: 1) электроды с гомогенной мембраной из порошкообразного или кристаллического материала; 2) электроды с гетерогенной мембраной, в которых электродно активное вещество распределено, например, в силиконовой резине; 3) электроды с жидкой мембраной, в которых мембрана – это раствор, нанесенный на нейтральное вещество, например, пористое стекло; 4) стеклянные электроды с различным химическим составом стекла.
Индикаторные электроды приобретают потенциал раствора, в который они помещены. Различают два вида индикаторных электродов:
1) электроды индифферентные (неразрушаемые в ходе электролиза);
2) электроды изменяющиеся (окисляющиеся или восстанавливающиеся) во время измерений.
Роль индифферентных электродов (их иногда называют электродами третьего рода) заключается в том, чтобы отдавать или присоединять электроны, т.е. быть проводниками электричества. Такие электроды могут быть изготовлены из золота, полированной платины, графита других материалов. Примерами изменяющихся электродов (иногда их называют электродами первого рода) могут быть пластины из меди, цинка и других металлов, а также хингидронный и водородный индикаторный электроды. Индикаторными электродами могут быть, кроме того, ионселективные мембранные электроды для определения многочисленных катионов: Li + , Рb + , Cs + , Тl + , NH + , Na + , К + , Аg + и др. В качестве электродов сравнения (стандартные электроды), потенциал которых остается постоянным на протяжении измерения, чаще всего используется, например, нормальный и децинормальный каломелевые (каломельные) электроды с потенциалами +0,282 В и +0,334 В, соответственно, а также насыщенный хлорсеребряный электрод с потенциалом +0,201 В.
В идеальном случае прямое потенциометрическое измерение ЭДС гальванического элемента может быть связано через уравнение Нернста с активностью определяемой частицы, либо с концентрацией, если известны соответствующие коэффициенты активности:
где Е– стандартный потенциал электрода, В; R – газовая постоянная; T – абсолютная температура; F – число Фарадея; n – число теряемых или получаемых электронов; [oкисл.], [восст.] – равновесные концентрации окисленной, восстановленной форм соответственно, моль/дм 3 .
Если подставить эталонные значения констант и перейти от натурального логарифма к десятичному, то для температуры 25°С получим;
Важнейшим показателем при характеристике состоянии ОС является значение рН этой среды, определение которого (рН–метрия) в настоящее время обычно проводят с помощью стеклянных индикаторных (измерительных) электродов. Для долговременных измерений разработаны специальные конструкции стеклянных электродов с дополнительными устройствами, обеспечивающими очистку стеклянной мембраны. Стеклянные электроды, покрытые полупроницаемой мембраной с пленкой электролита, служат также основой различных типов зондов (сенсоров), применяемых в анализе вод и воздуха в условиях производства на ряд загрязнений (NH3, СО2, NOx ,SО2, H2S и др.).
Процесс в области создания ион-селективных электродов (ИСЭ) позволяет осуществлять контроль ионов F – , I – , Br – , Cl – , CN – , SCN – , NO3 – , NO2 – , ClO4 – , S 2– , Na + , К + Са 2+ , Аg + , Си 2+ , Cd 2+ , РЬ 2+ в интервалах концентрации от 10 –2 до 10 –7 моль/л (примерно 1– 10 –5 мг/мл). Контроль с помощью ИСЭ отличается экспрессностью, простотой и большими возможностями проведения непрерывных измерений. Разработаны ИСЭ, селективные к широкому классу органических веществ, а также изомеров в их массе, поверхностно-активных и моющих веществ, находящихся в воздухе производственной зоны и водно-хозяйственного режима промышленных предприятий.
Потенциометрию используют и при измерениях окислительно-восстановительных потенциалов различных окислительно-восстановительных (О/В) систем в воде. Как правило, результаты измерения соответствуют смешанному потенциалу, так как обычно в воде одновременно сосуществуют несколько О/В систем.
Следует отметить перспективность использования сенсоров на основе полупроводниковых металлоксидных химически селективных и ион-селективных полевых транзисторов (ХСПТ, ИСПТ). Селективность в этих системах достигается выбором состава мембраны и слоя, осажденного на затвор транзистора. Систему погружают в анализируемый раствор, и разностью потенциалов между электродом сравнения и затвором транзистора модулируют ток, протекающий между его истоком и стоком. Вследствие селективности мембраны или осажденного слоя, модулированный ток становится функцией активности соответствующего компонента раствора. Полупроводниковые сенсоры составляют основу мониторов–анализаторов различных газов и паров. Малые размеры таких сенсоров позволяют объединять их совокупности в виде мозаики на единой подложке, так что получается анализатор, способный контролировать целый набор вредных веществ. Сигналы от отдельных сенсоров, входящих в мозаику могут последовательно и периодически регистрироваться измерительным центром аналитической системы.
Развитие микроэлектроники делает возможным конструирование компактных анализаторов типа зондов с использованием современных ИСЭ. При этом в ручке зонда может быть смонтирована схема, обрабатывающая отклик с объекта экологического контроля, и даже дисплей.
В специальной литературе можно ознакомиться с подробностями метода [10], [11], [12], [13].
Кулонометрический метод анализа представляет собой измерение тока электродной реакции, в которую вступает исследуемое вещество, попадающее в кулонометрическую ячейку с анализируемым потоком. Принципиальная схема кулонометрической ячейки показана на рис. 4.
1 – катодная камера; 2 – анодная камера; 3 – микроамперметр
Рис. 4. Схема кулонометрической ячейки
Кулонометрический анализ основан на измерении количества электричества, затраченного на количественное проведение данного электрохимического процесса в данной пробе, т.е. при условии, что выход по току равен 100%. Это количество электричества при помощи включенного в цепь последовательно с измерительной ячейкой интегратора ток-время, либо кулонометра-электролизера, в котором осуществляется электрохимический процесс со стопроцентным выходом по току, сопровождающийся выделением вещества, количество которого можно легко и точно восстановить.
В соответствии с законом Фарадея:
где m(x), m(k) – массы определяемого вещества х и вещества, выделяемого в кулонометре, соответственно; M(x), M(k) – молярная масса эквивалентов вещества х и вещества, выделяемого в кулонометре, г/моль.
Расчет можно также производить по уравнению, описывающему закон Фарадея:
если при проведении анализа измеряют силу тока i, А и время t, с, затраченные на проведение электрохимического процесса.
В другой модификации данного метода, называемой
кулонометрическим титрованием, титрант генерируют электролитически в анализируемом растворе при заданном токе. Потребление титранта в аналитической реакции восполняют зарядом, протекающим через раствор при генерировании титранта вплоть до достижения точки эквивалентности.
Одним из преимуществ кулонометрических методов является то, что процесс стандартизации титранта часто не является обязательным, так как расчеты основаны на постоянной Фарадея, т.е. метод является абсолютным и позволяет оценивать количество определяемого вещества, а не его концентрацию. Недостатком кулонометрии с заданным потенциалом является длительность процедуры анализа, связанная с необходимостью полного завершения электролиза. Вычислительная техника дает возможность сократить это время, предсказывая момент конца электролиза путем математической обработки кривой «ток–время» для начальных стадий электролиза и путем расчета количества электричества или концентрации вещества в растворе. При анализе многокомпонентных проб может быть использована сканирующая кулонометрия, в которой потенциал электролиза изменяют непрерывно или ступенчато. Для таких систем кулонометрическое титрование предпочтительнее прямой кулонометрии, так как 100%-ную эффективность тока при генерировании титранта достаточно просто достичь правильным выбором титрант–реагента и состава рабочей среды. Кулонометрическое титрование применимо для определения от 0,01 до 100 мг веществ (иногда ниже 1 мкг). Рабочий объем проб обычно составляет от 10 до 50 мл. Метод характеризуется высокой точностью, относительная погрешность не превышает нескольких десятых долей % даже при кулонометрическом титровании микрограммовых содержаний. В оптимальных условиях титрование может быть выполнено с очень малой суммарной погрешностью на уровне 0,01% (отн.). Различные кислотно-основные, окислительно-восстановительные; осади-тельные и комплексонометрические варианты титрования можно проводить кулонометрически.
Разработаны и выпускаются кулонометрические газоанализаторы и аква-анализаторы («кулонометры») для определения диоксида серы и сероводорода (сульфатов и сульфидов), озона (и перекиси водорода), хлора в воздухе (и активного хлора в воде), оксида углерода и диоксида азота в воздухе (нитратов и нитритов в воде). Кулонометрия используется также как средство электрохимического детектирования в жидкостной хроматографии.
С подробностями метода можно познакомиться в специальной литературе [14].
Кондуктометрический метод анализа основан на измерении электропроводности раствора. Кондуктометрический метод анализа заключается в измерении изменения сопротивления раствора электролита при поглощении компонента смеси. Кондуктометрические установки применяются, например, для определения оксида и диоксида углерода, паров бензина, аммиака и других.
Электропроводностью называют величину обратную сопротивлению R, ее размерность См (сименс) т.е. æ = 1/R.
Электропроводность раствора зависит от числа ионов в единице объема раствора, т.е. от концентрации С, от подвижности этих ионов – V. На основании известных соотношений
где Z – расстояние между электродами; S – площадь электродов; k –коэффициент пропорциональности.
Для конкретной пары электродов при неизменном расстоянии между ними S/Z = const. Тогда
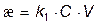
При расчетах в кондуктометрии используют понятие «удельная электрическая проводимость» æ:
В расчетах удобно пользоваться эквивалентной электропроводностью, которая равна:
где п – число молей эквивалента в 1 см 3 раствора. Эквивалентная электропроводность l¥ при бесконечном разбавлении равна сумме подвижностей катиона U и аниона V.
Отношение эквивалентной электропроводности раствора слабого электролита к эквивалентной электропроводности этого электролита при бесконечном разбавлении равно степени диссоциации a этого электролита:
Подробнее о методе можно прочитать в специальном учебном пособии [15].
Несмотря на неспецифичность, этот метод довольно часто, по сравнению с другими электрохимическими методами, используются в системах экологического мониторинга. Это объясняется тем, что при оценке загрязненности, например, воды и атмосферы, возможен не постадийный, а выходной (конечный) контроль промышленных процессов. Из-за крайне низкой электропроводности воды чаще всего вполне достаточно оценить общее содержание загрязнений, что и обеспечивает кондуктометрия. Типичными примерами использования кондуктометрических методов в контроле окружающей среды являются анализаторы детергентов в сточных водах, концентрации синтетических компонентов в оросительных системах, качества (солености) питьевой воды. Кондуктометрические анализаторы используются для непрерывного контроля загрязнений воздуха и атмосферных осадков, например SO2 и H2SO4. В дополнение к прямой кондуктометрии дляопределения некоторых видов загрязнения могут быть использованы косвенные методы, что обеспечивает весьма эффективные оценки содержания перечисленных выше веществ, которые взаимодействуют перед измерением со специально подобранными реагентами и регистрируемоеизменение электропроводности вызывается только присутствием соответствующих продуктов в реакции. Так можно определять оксиды азота послеих каталитического восстановления доаммиака, а также НСl, НВг и СО2 после предварительной реакции с Ва(ОН)2 или NaOH. Описанный принцип определении СО2 может быть использован и для косвенного определения органических веществ в воде.
В дополнение к классической кондуктометрии имеется иее высокочастотный вариант (осциллометрия), в котором индикаторная электродная система не контактирует с пробой. Этот принцип часто реализуется в кондуктометрических анализаторах непрерывного действия.
Электрохимические методы анализа также описаны еще в целом ряде учебных и специальных изданий [16], [17], [18], [19].
1. Другов Ю.С., Родин А.А. Экологическая аналитическая химия.
С.-Петербург: 2002. – 464 с.
2. Пашкевич М.А., Шуйский В.Ф. Экологический мониторинг. Учебное пособие. СПбГГУ. – СПб., 2002. – 90 с.
3. Каттралл Роберт В. Химические сенсоры. М.: Научный мир, 2000. – 144 с.
4. Турьян Я.И., Рувинский О.Е., Зайцев П.М. Полярографическая каталиметрия. М.: Химия, 1998. – 272 с.
5. Будников Г.К., Майстренко В.Н., Муринов Ю.И. Вольтамперометрия с модифицированными и ультрамикроэлектродами.М.: Наука,1994. – 239с.
6. Брайнина Х.З., Нейман Е.Я., Слепушкин В.В. Инверсионные электроаналитические методы. М.: 1988. – 240 с.
7. Салихджанова Р.Ф. и др. Полярографы и их эксплуатация в практическом анализе и исследованиях. М.: Химия, 1988. – 192 с.
8. Каплан Б.Я., Пац Р.Г., Салихджанова Р.Ф. Вольтамперометрия переменного тока. М.: Химия, 1985. – 264.
9. Бонд А.М. Полярографические методы в аналитической химии. М.: Химия, 1983.
10. Ефременко О.А. Потенциометрический анализ. М.: ММА им. И.М. Сеченова, 1998.
11. Справочное руководство по применению ионселективных электродов. М.: Мир, 1986.
12. Корыта И. Ионы, электроды, мембраны. М.: Мир, 1983.
13. Никольский Б.В., Матерова Е.А. Ионселективные электроды. Л.: Химия, 1980.
14. Ефременко О.А. Кулонометрическое титрование. М.: ММА им. И.М. Сеченова, 1990.
15. Худякова Т.А., Корешков А.П. Кондуктометрический метод анализа. Учеб пособие для вузов. М.: Высшая школа, 1975. – 207 с.
16. Будников Г.К., Майстренко В.Н., Вяселев М.Р. Основы современного электроанализа. М.: Химия, 2000.
17. Прохорова Г.В. Введение в электрохимические методы анализа. М.: Изд-во МГУ, 1991. – 97 с.
18. Электроаналитические методы в контроле окружающей среды. /Под ред. Р. Кальвода, Р. Зыка, К. Штулик и др. М.: Химия, 1990. – 240 с.
19. Плэмбек Дж. Электрохимические методы анализа. Основы теории и применения. /Пер. с англ. М.: Мир, 1986.
Дата добавления: 2016-01-09 ; просмотров: 1975 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Электрохимические методы – наиболее динамично развивающиеся с точки зрения их применения в экологическом мониторинге. Наиболее часто в системах МОС используют вольтамперометрию (включая полярографию), потенциометрию (в т.ч. ионометрию), кулонометрию и кондуктометрию.
Электрохимические методы анализа используют зависимость различных электрических свойств среды от количественного содержания и качественного состава анализируемых в ней веществ:
· изменение потенциала электрода в зависимости от физико-химических процессов, протекающих в веществе (потенциометрический метод), в т.ч. селективные реакции ионоселективных электродов, индивидуально чувствительных к большому числу катионов и анионов (ионометрический метод);
· изменение электропроводности (тока) и диэлектрической проницаемости вещества в зависимости от природы среды и концентрации ее компонентов (кондуктометрический и амперометрический методы);
· изменения количества электричества при попадании определяемого вещества в электрохимическую ячейку (кулонометрический метод);
· восстановление анализируемого соединения на ртутном капающем или вращающемся электроде, как правило, при анализе следовых количеств веществ, находящихся в разных агрегатных состояниях (полярографический или вольтамперометрический метод).
Полярографы из всех приборов этой группы имеют наивысшую чувствительность, равную 0,005–1 мкг/мл пробы.
Вольтамперометрия включает в себя группу электрохимических методов анализа, основанных на изучении поляризационных кривых. Эти методы – полярография и амперометрическое титрование– имеют множество разновидностей и модификаций. Наиболее распространена постоянно-токовая полярография.
Полярографическая установка состоит из источника постоянного тока, делителя напряжения, капельного (обычно ртутного) или вращающегося электрода и вспомогательного (обычно тоже ртутного или другого) электрода. Дляизмерения силы тока в систему подключают микроамперметр. Электроды помещены вместе с исследуемым раствором в электролизер (ячейку).
Наложенное на электролитическую ячейку напряжение вызывает поляризацию анода и катода E = fa – fk +iR, где i – сила тока; К – сопротивление раствора; fa и fk – потенциалы анода и катода.
Если уменьшить сопротивление раствора, добавив сильный электролит (фон), то величиной iR (падение потенциала в растворе) можно пренебречь.
Потенциал анода практически остается постоянным во время работы электролизера, таккак плотность тока мала и относительно большая поверхность анода не поляризуется. Тогда потенциал капающего поляризующего катода с небольшой поверхностью будет равен: Е = -fk. Часто в полярографических измерениях вместо слоя ртути на дне сосуда применяют неполяризующийся насыщенный каломелевый электрод, потенциал которого принимают равным нулю.
Полярографические данные получают путем измерения тока, проходящего через электролитическую ячейку, как функции потенциала, налагаемого на электроды. Графическую зависимость силы тока от потенциала называют полярографической волной (рис. 2).
В начале электролиза при небольших значениях наложенной ЭДС сила тока будет почти постоянной и лишь очень медленно возрастать. Это так называемый остаточный ток, который сохраняется во все время электролиза.
Рис. 2. Полярограмма 10 –3 М раствора хлорида цинка и 1 М раствора хлорида калия (кривая 1) и 1 М раствора хлорида калия (кривая 2)
Как только будет достигнут потенциал восстановления ионов (например, для определяемых ионов цинка он равен -1,0 В), начинается их разряд на капле ртути:
Zn 2+ + 2 +Hg ® Zn (Hg).
На катоде образуется разбавленная амальгама цинка Zn (Hg), которая разлагается насвои составляющие, как только падающая капля соприкоснется с анодом:
Zn (Hg) – 2 ® Zn 2+ +Hg.
При потенциале восстановления ионов цинка сила тока резко возрастает (рис. 2), но после достижения определенной величины, несмотря на увеличение приложенной ЭДС, она остается почти постоянной. Этот ток называется предельным или диффузионным, его величина,как правило, пропорциональна концентрации определяемого вещества.
При снятии полярограмм к исследуемому электролиту добавляют индифферентный электролит с катионами, восстанавливающимися гораздо труднее анализируемого катиона, например, КСl, KNO3, NH4Cl; при концентрации в 100–1000 раз превышающей концентрацию определяемого вещества. Такой электролит называют «фоновым». Его создают в исследуемом растворе для увеличения электропроводности и для экранирования электрического поля индикаторного электрода (катода). Поэтому катионы определяемого вещества не притягиваются электрическим полем катода, а двигаются к нему за счет диффузии.
Важнейшей характеристикой полярограммы является потенциал полуволны Е1/2 и высота полярографической волны h (предельный диффузионный ток). Потенциал полуволны используют в качественном полярографическом анализе. Потенциалы полуволны различных веществ, расположенные в порядке возрастанияих отрицательного значения, составляют так называемый «полярографический спектр». Поскольку потенциал полуволны существенно зависит от состава раствора (анализируемой среды), в полярографических таблицах всегда указывается фон.
В количественном полярографическом анализе для измерения концентрации используют методы градуировочного графика, добавок, сравнения и расчетный метод.
Среди различных вариантов полярографии метод дифференциальной импульсной полярографии (ДИП) наиболее эффективен для решения задач экологического мониторинга, главным образом благодаря высокой чувствительности. Метод ДИП позволяет оценивать содержание всех веществ, определяемых методом классической полярографии. Среди других полярографических методов, особенно удобна для следового анализа квадратно-волновая полярография, которая обеспечивает предел обнаружения, близкий к пределу обнаружения ДИП, но только в случае обратимых электродных процессов, и поэтому этот метод часто используется для определения следов тяжелых металлов. Метод ДИП может использоваться и для определения поверхностно-активных веществ, изменяющих емкость двойного электрического слоя электрода.
Для определения микросодержаний ионов тяжелых металлов могут быть использованы методы инверсионною электрохимического анализа (ИЭА) или по-другому, инверсионного вольтамперометрического анализа (ИВА), в которых определяемые металлы предварительно осаждают на электроде и затем растворяют при полярографическом контроле. Этот вариант в сочетании с ДИП относится к наиболее чувствительным методам электрохимического анализа. Аппаратурное оформление ИЭА (ИВА) относительно несложное, что позволяет проводить анализы в полевых условиях, причем автоматизированные станции непрерывного контроля (мониторинга) также могут работать на этом принципе.
Методы ИЭА (ИВА) обеспечивают определение ионов Сu, РЬ, Bi, Sb, As, Sn In, Ga, Ag, Tl, Cd, Zn, Hg, Аu, Ge, Те, Ni, Со и многих анионов. Важным преимуществом методов ИЭА (ИВА) является (в отличие от других методов, например, таких, как атомно-абсорбционная спектрометрия) способность отличать свободные ионы oт их связанных химических форм, что важно и для оценки физико-химических свойств анализируемых веществ с точки зрения экоаналитического контроля (например, при оценке качества воды). Многие органические вещества также могут быть определены методами ИЭА (ИВА) после их адсорбционного накопления на поверхности электрода.
Полярографическими методами можно также определять аэрозоли различных металлов в атмосфере и воздухе производственных помещений после их улавливания на соответствующих фильтрах с последующим переведением концентратов в раствор. Органические соединения, находящиеся в виде газов и паров в атмосфере, могут быть определены полярографически после их поглощения специально подобранными растворами. Металлы и различные соединения в биологических материалах обычно определяют полярографически после их экстракции. Все полярографические измерения, в т. ч. ИЭА (ИВА), могут быть полностью автоматизированы, что существенно при выполнении серийных анализов.
Одной из важнейших областей применения полярографии является определение кислорода в воде. Для этого используют амперометрические детекторы, генерирующие ток, пропорциональный концентрации кислорода в растворе.
Нанося фермент на поверхность мембраны детектора можно получать различные ферментные амперометрические сенсоры, удобные для биохимических и клинических анализов. Такие сенсоры применяют и в системах экологического мониторинга [3].
Электроды, работающие по электрокаталитическому принципу [4], пригодны для мониторинга различных газов (SО2, H2S, CO, NOx) в воздухе производственных помещений. Электрохимические реакции этих газов (играют роль катализатора), протекающие на поверхности электрода, генерируют в электродной системе ток, функционально связанный с концентрацией газов в воздухе.
Применение полярографии не ограничивается анализом дискретных проб, и метод постепенно переходит на принципы непрерывного анализа газов и жидкостей.
Вольтамперометрические полярографические детекторы успешно применяются в высокоэффективной жидкостной хроматографии (ВЭЖХ). В этом случае сочетание высокоселективного способа разделения с чувствительным способом детектирования приводит к заметному расширению номенклатуры веществ, определяемых хроматографическим методом (следы высокотоксичных веществ, гербициды, лекарственные препараты, стимуляторы роста и др.).
Подробности метода можно уточнить в специальной литературе [5],[6],[7],[8],[9].
Потенциометрия – метод определения концентрации веществ, основанный на измерении ЭДС обратимых гальванических элементов.
На практике используют два аналитических метода: прямую потенциометриюдля определения активности частиц, которую можно рассчитать с помощью уравнения Нернста по ЭДС гальванического элемента, и потенциометрическое титрование, в котором изменение активностей химических веществ в процессе титрования приводит к изменению ЭДС гальванического элемента.
Аппаратура для проведения потенциометрических титрований и для прямой потенциометрии одна и та же. В схему потенциометрических измерений входят индикаторный электрод и электрод сравнения, обладающий устойчивым постоянным потенциалом, в также вторичный прибор. Принципиальная схема метода показана на рис. 3.
1 – индикаторный электрод; 2 — электрод сравнения
Рис. 3. Потенциометрическая ячейка
Потенциал пары электродов постоянен. Изменение концентрации анализируемого вещества в растворе изменяет ЭДС цепи. Индикаторные электроды обычно бывают четырех типов, в зависимости от применяемой мембраны которая отделяет раствор электрода от исследуемого раствора: 1) электроды с гомогенной мембраной из порошкообразного или кристаллического материала; 2) электроды с гетерогенной мембраной, в которых электродно активное вещество распределено, например, в силиконовой резине; 3) электроды с жидкой мембраной, в которых мембрана – это раствор, нанесенный на нейтральное вещество, например, пористое стекло; 4) стеклянные электроды с различным химическим составом стекла.
Индикаторные электроды приобретают потенциал раствора, в который они помещены. Различают два вида индикаторных электродов:
1) электроды индифферентные (неразрушаемые в ходе электролиза);
2) электроды изменяющиеся (окисляющиеся или восстанавливающиеся) во время измерений.
Роль индифферентных электродов (их иногда называют электродами третьего рода) заключается в том, чтобы отдавать или присоединять электроны, т.е. быть проводниками электричества. Такие электроды могут быть изготовлены из золота, полированной платины, графита других материалов. Примерами изменяющихся электродов (иногда их называют электродами первого рода) могут быть пластины из меди, цинка и других металлов, а также хингидронный и водородный индикаторный электроды. Индикаторными электродами могут быть, кроме того, ионселективные мембранные электроды для определения многочисленных катионов: Li + , Рb + , Cs + , Тl + , NH + , Na + , К + , Аg + и др. В качестве электродов сравнения (стандартные электроды), потенциал которых остается постоянным на протяжении измерения, чаще всего используется, например, нормальный и децинормальный каломелевые (каломельные) электроды с потенциалами +0,282 В и +0,334 В, соответственно, а также насыщенный хлорсеребряный электрод с потенциалом +0,201 В.
В идеальном случае прямое потенциометрическое измерение ЭДС гальванического элемента может быть связано через уравнение Нернста с активностью определяемой частицы, либо с концентрацией, если известны соответствующие коэффициенты активности:
где Е– стандартный потенциал электрода, В; R – газовая постоянная; T – абсолютная температура; F – число Фарадея; n – число теряемых или получаемых электронов; [oкисл.], [восст.] – равновесные концентрации окисленной, восстановленной форм соответственно, моль/дм 3 .
Если подставить эталонные значения констант и перейти от натурального логарифма к десятичному, то для температуры 25°С получим;
Важнейшим показателем при характеристике состоянии ОС является значение рН этой среды, определение которого (рН–метрия) в настоящее время обычно проводят с помощью стеклянных индикаторных (измерительных) электродов. Для долговременных измерений разработаны специальные конструкции стеклянных электродов с дополнительными устройствами, обеспечивающими очистку стеклянной мембраны. Стеклянные электроды, покрытые полупроницаемой мембраной с пленкой электролита, служат также основой различных типов зондов (сенсоров), применяемых в анализе вод и воздуха в условиях производства на ряд загрязнений (NH3, СО2, NOx ,SО2, H2S и др.).
Процесс в области создания ион-селективных электродов (ИСЭ) позволяет осуществлять контроль ионов F – , I – , Br – , Cl – , CN – , SCN – , NO3 – , NO2 – , ClO4 – , S 2– , Na + , К + Са 2+ , Аg + , Си 2+ , Cd 2+ , РЬ 2+ в интервалах концентрации от 10 –2 до 10 –7 моль/л (примерно 1– 10 –5 мг/мл). Контроль с помощью ИСЭ отличается экспрессностью, простотой и большими возможностями проведения непрерывных измерений. Разработаны ИСЭ, селективные к широкому классу органических веществ, а также изомеров в их массе, поверхностно-активных и моющих веществ, находящихся в воздухе производственной зоны и водно-хозяйственного режима промышленных предприятий.
Потенциометрию используют и при измерениях окислительно-восстановительных потенциалов различных окислительно-восстановительных (О/В) систем в воде. Как правило, результаты измерения соответствуют смешанному потенциалу, так как обычно в воде одновременно сосуществуют несколько О/В систем.
Следует отметить перспективность использования сенсоров на основе полупроводниковых металлоксидных химически селективных и ион-селективных полевых транзисторов (ХСПТ, ИСПТ). Селективность в этих системах достигается выбором состава мембраны и слоя, осажденного на затвор транзистора. Систему погружают в анализируемый раствор, и разностью потенциалов между электродом сравнения и затвором транзистора модулируют ток, протекающий между его истоком и стоком. Вследствие селективности мембраны или осажденного слоя, модулированный ток становится функцией активности соответствующего компонента раствора. Полупроводниковые сенсоры составляют основу мониторов–анализаторов различных газов и паров. Малые размеры таких сенсоров позволяют объединять их совокупности в виде мозаики на единой подложке, так что получается анализатор, способный контролировать целый набор вредных веществ. Сигналы от отдельных сенсоров, входящих в мозаику могут последовательно и периодически регистрироваться измерительным центром аналитической системы.
Развитие микроэлектроники делает возможным конструирование компактных анализаторов типа зондов с использованием современных ИСЭ. При этом в ручке зонда может быть смонтирована схема, обрабатывающая отклик с объекта экологического контроля, и даже дисплей.
В специальной литературе можно ознакомиться с подробностями метода [10], [11], [12], [13].
Кулонометрический метод анализа представляет собой измерение тока электродной реакции, в которую вступает исследуемое вещество, попадающее в кулонометрическую ячейку с анализируемым потоком. Принципиальная схема кулонометрической ячейки показана на рис. 4.
1 – катодная камера; 2 – анодная камера; 3 – микроамперметр
Рис. 4. Схема кулонометрической ячейки
Кулонометрический анализ основан на измерении количества электричества, затраченного на количественное проведение данного электрохимического процесса в данной пробе, т.е. при условии, что выход по току равен 100%. Это количество электричества при помощи включенного в цепь последовательно с измерительной ячейкой интегратора ток-время, либо кулонометра-электролизера, в котором осуществляется электрохимический процесс со стопроцентным выходом по току, сопровождающийся выделением вещества, количество которого можно легко и точно восстановить.
В соответствии с законом Фарадея:
где m(x), m(k) – массы определяемого вещества х и вещества, выделяемого в кулонометре, соответственно; M(x), M(k) – молярная масса эквивалентов вещества х и вещества, выделяемого в кулонометре, г/моль.
Расчет можно также производить по уравнению, описывающему закон Фарадея:
если при проведении анализа измеряют силу тока i, А и время t, с, затраченные на проведение электрохимического процесса.
В другой модификации данного метода, называемой
кулонометрическим титрованием, титрант генерируют электролитически в анализируемом растворе при заданном токе. Потребление титранта в аналитической реакции восполняют зарядом, протекающим через раствор при генерировании титранта вплоть до достижения точки эквивалентности.
Одним из преимуществ кулонометрических методов является то, что процесс стандартизации титранта часто не является обязательным, так как расчеты основаны на постоянной Фарадея, т.е. метод является абсолютным и позволяет оценивать количество определяемого вещества, а не его концентрацию. Недостатком кулонометрии с заданным потенциалом является длительность процедуры анализа, связанная с необходимостью полного завершения электролиза. Вычислительная техника дает возможность сократить это время, предсказывая момент конца электролиза путем математической обработки кривой «ток–время» для начальных стадий электролиза и путем расчета количества электричества или концентрации вещества в растворе. При анализе многокомпонентных проб может быть использована сканирующая кулонометрия, в которой потенциал электролиза изменяют непрерывно или ступенчато. Для таких систем кулонометрическое титрование предпочтительнее прямой кулонометрии, так как 100%-ную эффективность тока при генерировании титранта достаточно просто достичь правильным выбором титрант–реагента и состава рабочей среды. Кулонометрическое титрование применимо для определения от 0,01 до 100 мг веществ (иногда ниже 1 мкг). Рабочий объем проб обычно составляет от 10 до 50 мл. Метод характеризуется высокой точностью, относительная погрешность не превышает нескольких десятых долей % даже при кулонометрическом титровании микрограммовых содержаний. В оптимальных условиях титрование может быть выполнено с очень малой суммарной погрешностью на уровне 0,01% (отн.). Различные кислотно-основные, окислительно-восстановительные; осади-тельные и комплексонометрические варианты титрования можно проводить кулонометрически.
Разработаны и выпускаются кулонометрические газоанализаторы и аква-анализаторы («кулонометры») для определения диоксида серы и сероводорода (сульфатов и сульфидов), озона (и перекиси водорода), хлора в воздухе (и активного хлора в воде), оксида углерода и диоксида азота в воздухе (нитратов и нитритов в воде). Кулонометрия используется также как средство электрохимического детектирования в жидкостной хроматографии.
С подробностями метода можно познакомиться в специальной литературе [14].
Кондуктометрический метод анализа основан на измерении электропроводности раствора. Кондуктометрический метод анализа заключается в измерении изменения сопротивления раствора электролита при поглощении компонента смеси. Кондуктометрические установки применяются, например, для определения оксида и диоксида углерода, паров бензина, аммиака и других.
Электропроводностью называют величину обратную сопротивлению R, ее размерность См (сименс) т.е. æ = 1/R.
Электропроводность раствора зависит от числа ионов в единице объема раствора, т.е. от концентрации С, от подвижности этих ионов – V. На основании известных соотношений
где Z – расстояние между электродами; S – площадь электродов; k –коэффициент пропорциональности.
Для конкретной пары электродов при неизменном расстоянии между ними S/Z = const. Тогда
,
При расчетах в кондуктометрии используют понятие «удельная электрическая проводимость» æ:
В расчетах удобно пользоваться эквивалентной электропроводностью, которая равна:
где п – число молей эквивалента в 1 см 3 раствора. Эквивалентная электропроводность l¥ при бесконечном разбавлении равна сумме подвижностей катиона U и аниона V.
Отношение эквивалентной электропроводности раствора слабого электролита к эквивалентной электропроводности этого электролита при бесконечном разбавлении равно степени диссоциации a этого электролита:
Подробнее о методе можно прочитать в специальном учебном пособии [15].
Несмотря на неспецифичность, этот метод довольно часто, по сравнению с другими электрохимическими методами, используются в системах экологического мониторинга. Это объясняется тем, что при оценке загрязненности, например, воды и атмосферы, возможен не постадийный, а выходной (конечный) контроль промышленных процессов. Из-за крайне низкой электропроводности воды чаще всего вполне достаточно оценить общее содержание загрязнений, что и обеспечивает кондуктометрия. Типичными примерами использования кондуктометрических методов в контроле окружающей среды являются анализаторы детергентов в сточных водах, концентрации синтетических компонентов в оросительных системах, качества (солености) питьевой воды. Кондуктометрические анализаторы используются для непрерывного контроля загрязнений воздуха и атмосферных осадков, например SO2 и H2SO4. В дополнение к прямой кондуктометрии дляопределения некоторых видов загрязнения могут быть использованы косвенные методы, что обеспечивает весьма эффективные оценки содержания перечисленных выше веществ, которые взаимодействуют перед измерением со специально подобранными реагентами и регистрируемоеизменение электропроводности вызывается только присутствием соответствующих продуктов в реакции. Так можно определять оксиды азота послеих каталитического восстановления доаммиака, а также НСl, НВг и СО2 после предварительной реакции с Ва(ОН)2 или NaOH. Описанный принцип определении СО2 может быть использован и для косвенного определения органических веществ в воде.
В дополнение к классической кондуктометрии имеется иее высокочастотный вариант (осциллометрия), в котором индикаторная электродная система не контактирует с пробой. Этот принцип часто реализуется в кондуктометрических анализаторах непрерывного действия.
Электрохимические методы анализа также описаны еще в целом ряде учебных и специальных изданий [16], [17], [18], [19].
1. Другов Ю.С., Родин А.А. Экологическая аналитическая химия.
С.-Петербург: 2002. – 464 с.
2. Пашкевич М.А., Шуйский В.Ф. Экологический мониторинг. Учебное пособие. СПбГГУ. – СПб., 2002. – 90 с.
3. Каттралл Роберт В. Химические сенсоры. М.: Научный мир, 2000. – 144 с.
4. Турьян Я.И., Рувинский О.Е., Зайцев П.М. Полярографическая каталиметрия. М.: Химия, 1998. – 272 с.
5. Будников Г.К., Майстренко В.Н., Муринов Ю.И. Вольтамперометрия с модифицированными и ультрамикроэлектродами.М.: Наука,1994. – 239с.
6. Брайнина Х.З., Нейман Е.Я., Слепушкин В.В. Инверсионные электроаналитические методы. М.: 1988. – 240 с.
7. Салихджанова Р.Ф. и др. Полярографы и их эксплуатация в практическом анализе и исследованиях. М.: Химия, 1988. – 192 с.
8. Каплан Б.Я., Пац Р.Г., Салихджанова Р.Ф. Вольтамперометрия переменного тока. М.: Химия, 1985. – 264.
9. Бонд А.М. Полярографические методы в аналитической химии. М.: Химия, 1983.
10. Ефременко О.А. Потенциометрический анализ. М.: ММА им. И.М. Сеченова, 1998.
11. Справочное руководство по применению ионселективных электродов. М.: Мир, 1986.
12. Корыта И. Ионы, электроды, мембраны. М.: Мир, 1983.
13. Никольский Б.В., Матерова Е.А. Ионселективные электроды. Л.: Химия, 1980.
14. Ефременко О.А. Кулонометрическое титрование. М.: ММА им. И.М. Сеченова, 1990.
15. Худякова Т.А., Корешков А.П. Кондуктометрический метод анализа. Учеб пособие для вузов. М.: Высшая школа, 1975. – 207 с.
16. Будников Г.К., Майстренко В.Н., Вяселев М.Р. Основы современного электроанализа. М.: Химия, 2000.
17. Прохорова Г.В. Введение в электрохимические методы анализа. М.: Изд-во МГУ, 1991. – 97 с.
18. Электроаналитические методы в контроле окружающей среды. /Под ред. Р. Кальвода, Р. Зыка, К. Штулик и др. М.: Химия, 1990. – 240 с.
19. Плэмбек Дж. Электрохимические методы анализа. Основы теории и применения. /Пер. с англ. М.: Мир, 1986.
Дата добавления: 2014-12-26 ; Просмотров: 2743 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник