Общая информация об исследовании
Колоректальный рак (рак толстой и прямой кишок) – одно из самых распространенных онкологических заболеваний в мире. Около 10 % населения имеет генетическую предрасположенность к нему. Прежде всего в группу риска входят люди, в семье которых были онкопатологии.
Симптомы колоректального рака многочисленны и неспецифичны. Зачастую он развивается из образовавшихся ранее аденоматозных полипов. Своевременное выявление и удаление полипов толстой кишки может предотвратить развитие рака и характеризуется благоприятным прогнозом, поэтому регулярное обследование так важно. Из диагностических инструментальных исследований используются ирригоскопия или колоноскопия с биопсией для подтверждения ткани опухоли. Лечение колоректального рака зависит от его расположения, размера и степени распространения, а также возраста и состояния здоровья пациента. Хирургическая операция является распространенным методом лечения колоректального рака.
Генетическое исследование заключается в анализе состояния генетического маркера LOC727677 G(g.41686854)T, характеризующего риск колоректального рака. Анализ выявляет общую предрасположенность и не связан с диагностикой редких форм раннего семейного рака прямой кишки, ассоциированных с генами MSH2 и MLH1 (наследственный неполипозный рак толстого кишечника, синдром Линча). Локус LOC727677 (8q24) – это область, непосредственно взаимодействующая с геном MYC, который часто играет ведущую роль в развитии злокачественных новообразований, вследствие нарушения регуляции синтеза протоонкогенов (они кодируют белки, участвующие в контроле роста, деления и дифференцировки клеток).
Внутренняя поверхность толстой кишки контактирует с большим количеством факторов, способных приводить к повреждению клеток. Поэтому клетки, выстилающие стенку кишечника, постоянно обновляются. Мутация, которая затрагивает ген, контролирующий рост клеток, может привести к их неконтролируемому делению, что, как правило, вызывает предраковую опухоль (аденоматозный полип). Если вовремя не начать лечение, в конечном итоге она может перерасти в рак.
При выявлении генетического риска при отсутствии патологии основным методом профилактики является длительное диспансерное наблюдение, своевременное лечение всех предопухолевых состояний и устранение факторов, повышающих риск рака.
Факторы, способствующие развитию колоректального рака:
- особенности питания (высокое содержание в рационе мяса и продуктов, богатых животными жирами, и низкое содержание растительной пищи);
- чрезмерное употребление алкоголя;
- курение;
- возраст старше 55 лет;
- малоподвижный образ жизни;
- наследственность (возможность наследственной передачи болезни доказывает наличие семейных полипозных синдромов; отмечается возрастание риска развития колоректального рака приблизительно в 3 раза среди родственников первой степени родства больных раком или полипами толстой кишки);
- воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона, панколит с давностью заболевания более 10 лет);
- аденома толстой кишки в анамнезе;
- диффузный семейный полипоз, одиночные и множественные полипы, ворсинчатые опухоли;
- рак внутренних половых органов или молочной железы в анамнезе у женщин;
- синдромы семейного рака;
- иммунодефицитные состояния;
- работа на вредном производстве (высокая частота колоректального рака среди работников асбестных производств).
Когда назначается исследование?
- При семейном анамнезе по заболеванию (наличие у близких родственников диагностированного колоректального рака или аденоматозного полипоза).
- При первичных опухолях, локализованных как в пределах толстой кишки, так и в других органах (молочных железах, матке, простате).
источник
Рак толстой кишки занимает 2-е место по смертности от злокачественных новообразований. По мере старения общества показатель летальности от рака этой локализации будет увеличиваться. Это неудивительно, если вспомнить об этиологии заболевания и особенностях патоморфологических изменений толстой кишки: ее слизистая оболочка представлена одноклеточным эпителием с быстрым периодом полного обновления и постоянной экспозицией к воздействию канцерогенных факторов.
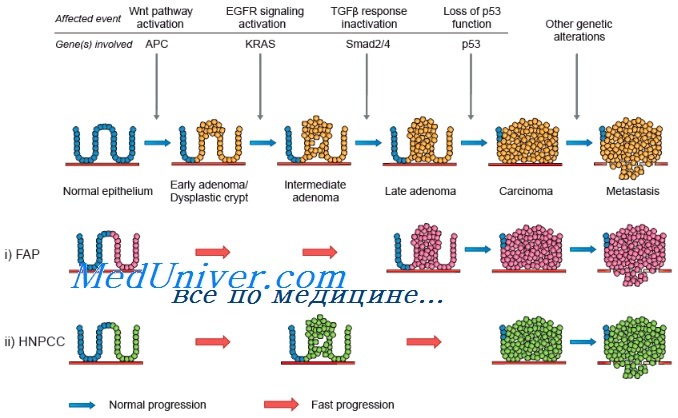
Следовательно, ДНК этих клеток постоянно и быстро делится и реплицируется. В результате вероятность накопления ошибок и злокачественной трансформации со временем увеличивается. Модель рака толстой кишки, разработанная Vogelstein и соавт., иллюстрирует эти механизмы. Мутации гена-супрессора аденоматозного полипоза толстой кишки (adenomatous polyposis coli, АРС) ведут к разрастанию полипов толстой кишки в раннем возрасте. Для уточнения характера любого заболевания толстой кишки можно легко получить образец ткани путем биопсии. По мере роста полипа он становится доступен для обследования гастроэнтерологом с использованием ряда исследований. Рак толстой кишки хорошо изучен также потому, что существуют семьи, члены которых подвержены редкому заболеванию — семейному аденоматозному полипозу толстой кишки. У этих больных толстая кишка покрывается сотнями и тысячами полипов, один или несколько из которых, как правило, малигнизируются в зрелом возрасте.
Именно у этой категории больных впервые был обнаружен ген АРС. В большинстве спорадических опухолей толстой кишки выявляют соматические мутации гена АРС. В более редких семейных случаях отмечается мутация гена АРС, передающаяся по наследству и в связи с этим присутствующая во всех эпителиальных клетках кишечника, что и предрасполагает к развитию полипов. Соматическая мутация ведет к активации онкогена ras и ускорению роста полипа, который, тем не менее, еще остается доброкачественным. Однако с годами полип может приобрести мутации генов-супрессоров DCC и ТР53, которые ведут к автономному неконтролируемому росту злокачественных клеток рака толстой кишки.
Семейная предрасположенность к раку толстой кишки достаточно широко распространена и делится на две группы: с образованием полипов и без них. Полипозы включают семейный аденоматозный полипоз толстой кишки, синдром Пейтца— Егерса, семейный ювенильный полипоз и гиперпластический полипоз. Риск рака толстой кишки у всех больных с названными синдромами повышен. Например, медиана возраста появления рака толстой кишки при семейном аденоматозном полипозе составляет 40 лет.
К синдромам без полипоза относится наследственный неполипозный колоректальный рак (ННПКРР). У этих пациентов злокачественную опухоль толстой или прямой кишки выявляют в возрасте около 40 лет. У большинства больных ННПКРР идентифицируют генетические дефекты в системе репарации ДНК. Мутации происходят в основном в гене MLH1, однако результаты последних исследований свидетельствуют о частом поражении таких генов, как MSH2 и MSH6. ННПКРР сопровождается и другими онкологическими заболеваниями: раком эндометрия (РЭ), раком яичника (РЯ), раком молочной железы (РМЖ) и опухолями нервной системы.
Семейный рак толстой кишки составляет примерно 3—5 % всех случаев рака этой локализации. Однако риск рака толстой кишки также повышен у родственников больных любой формой этого заболевания. Поэтому в большинстве случаев рака толстой кишки можно наблюдать, по крайней мере отчасти, наследственный компонент. Факторы окружающей среды играют важную роль в развитии заболевания; полученные данные указывают, что диета с высоким содержанием клетчатки может снижать вероятность развития рака толстой кишки. Фактор риска — рацион питания с высоким содержанием жира и красного мяса.
Молекулярные изменения, происходящие при раке толстой кишки, хорошо исследованы Vogelstein и соавт., подробно описавшими прогрессию нормального эпителия в рак. Первыми генами, для которых была установлена связь с раком толстой кишки, стали гены семейства ras, изначально выявленные в вирусах саркомы крыс. Эти гены наиболее часто обнаруживают в промежуточных полипах толстой кишки без дисплазии. В аденомах на ранних стадиях мутации ras встречаются редко, но в промежуточных полипах — регулярно, что свидетельствует о важной роли этих генов в раннем развитии рака толстой кишки.
Опухолевый ген-супрессор АРС принимает участие на самых первых этапах канцерогенеза при раке толстой кишки и был выявлен в исследованиях по изучению утраты гетерозиготности, показавших часто встречающуюся утрату длинного плеча хромосомы 5 (5q). Еще один ген, связанный с развитием рака толстой кишки, — ген-супрессор ТР53, расположенный на коротком плече хромосомы 17 (17р). Мутация этого гена — относительно позднее событие при раке толстой кишки. ТР53 — важный ген в контроле клеточного цикла и апоптоза. Утрата гена-супрессора DCC на длинном плече хромосомы 18 (18q) происходит на промежуточных и поздних этапах канцерогенеза при раке толстой кишки. Этот ген кодирует белок, ответственный за клеточную адгезию.
Ген DPC4, также расположенный на длинном плече хромосомы 18, вовлечен в сигнальную систему, связанную с трансформирующим фактором роста b.
При развитии рака толстой кишки происходит последовательное приобретение ряда мутаций. Для развития злокачественной опухоли обязательного прохождения всех этапов не требуется, однако предполагается, что необходимо по меньшей мере 6 или 7 генетических событий. У больных наследственным неполипозным колоректальным раком (ННПКРР) эти мутации развиваются вследствие неспособности эпителиальных клеток слизистой оболочки кишечника выявлять и устранять ошибки, происходящие во время нормального клеточного деления. Исследования Vogelstein и соавт. продемонстрировали модель, которая может быть применена и к другим опухолям.
Эта работа подробно иллюстрирует поэтапную природу канцерогенеза и взаимодействие генов-супрессоров и онкогенов, однако не объясняет поздних механизмов прогрессии опухоли, в частности приобретения ею инвазивности и способности к метастазированию. Данные свойства опухолевых клеток могут быть объяснены мутациями в других генах, которые еще только предстоит выявить. Тем не менее рак толстой кишки представляет удобную модель для исследователей, изучающих различные опухоли. Цель исследований — описать естественное течение опухолевого заболевания как ряд генетических событий, происходящих в определенной относительно небольшой группе генов. Такая «генетическая история» даст четкие представления всех молекулярных изменений, необходимых для трансформации нормальной клетки в опухолевую, и, в свою очередь, определит мишени для будущих диагностических и терапевтических методов.
С недавних пор для исследования генетических изменений при широком спектре злокачественных новообразований используют технологию биочипов. Определение «молекулярной» стадии онкологического заболевания позволяет выявлять генетические нарушения, связанные с прогрессированием опухоли. Информацию о типах этих молекулярных изменений (на генном или белковом уровне) можно использовать для определения прогноза заболевания и его лечения. Биочипы применяют при раке толстой кишки для получения полных сведений о генетических изменениях, связанных с заболеванием. Сообщение Eschrich и соавт. свидетельствует о том, что в скором будущем исследование молекулярных особенностей рака толстой кишки приобретет клиническое значение.
источник
У четверти людей с онкологическими заболеваниями кишечника обнаруживается отягощенный семейный анамнез. Примерно 10 % эпизодов рака толстой кишки связаны с наследственным фактором. Риск развития опухоли высок при наличии у пациента аденоматозного полипоза и синдрома Линча.
Причины наследственного рака толстой кишки
Перерождение нормального эпителия в раковые образования связано с определенными мутациями в генах, которые могут быть врожденными (в гене АРС) и приобретенными (амплификация гена MYC, точечные мутации гена KRAS, делеции определенных участков хромосом 5, 8, 17, 18).
В 50 % случаев наследственного рака и крупных аденоматозных образований толстой кишки выявляют точечные мутации гена KRAS. В 75 % случаев аденокарционом обнаруживается делеция 17р (в гене TP53), при 30 % крупных аденоматозных полипов и аденокарцином — делеция длинного плеча 5q (в гене APC).
Наследственный аденоматозный полипоз, связанный с мутацией гена-супрессора опухолевого роста APC (в локусе 5q21), грозит развитием рака толстой кишки к 55 годам. Синдром Линча, обусловленный мутациями в генах MSH2 , MLH1 и MSH6 (хромосомы 2 и 3) или гена PMS2 (хромосома 7), характеризуется ранним развитием новообразований (20 лет) и менее агрессивным течением болезни.
Симптомы заболевания включают в себя: кровь в кале, признаки анемии, кишечной непроходимости, болевой синдром. Больной теряет вес, ухудшается аппетит, появляется слабость, повышается температура тела.
Опухоль обнаруживается во время колоноскопии с биопсией. О присутствии опухолевого процесса могут рассказать исследование кала на скрытую кровь, анализы крови на онкомаркеры, а также гастроскопия, УЗИ, рентгенография, сцинтиграфия.
Для постановки диагноза «наследственный рак толстой кишки» необходимо существование хотя бы одного из нижеследующих признаков:
- возраст пациента на момент обнаружения новообразования — не старше 50 лет;
- множественные раковые образования в кишечнике или других органах, которые характерны для наследственного неполипозного рака толстой кишки;
- наличие у больного признаков генетической нестабильности — Microsatellite Instability (MSI);
- в семье пациента имеется минимум 2 случая опухолей кишечника родственников младше 50 лет;
- минимум 3 случая онкообразований кишечника в семье, вне зависимости от возраста обнаружения патологии.
Опухоль, удаленная во время операции, подлежит обследованию на предмет:
- генетической нестабильности MSI;
- иммуногистохимического анализа белков Mismatch Repair (MR).
Если результаты одного из этих анализов указывают на наследственный рак толстой кишки, назначают генетическое тестирование (анализ крови на мутации в генах DNA Mismatch Repair Genes). Если тест подтверждает присутствие патологии, то такое исследование рекомендуется и родственникам больного.
Проктоколэктомия — предпочтительный метод терапии заболевания. При поражении лимфоузлов показана лимфаденэктомия, в случае отдаленных метастазов — паллиативные вмешательства.
Носители мутации находятся в группе риска по наследственному раку толстой кишки и нуждаются в регулярных скрининговых обследованиях для раннего выявления онкопатологии (колоноскопия, анализы на онкомаркеры СА125, СА19-9, карциноэмбриональный антиген и др.).
Пройти исследование на наличие наследственного рака толстой кишки можно в медико-генетическом центре «Геномед».
источник
Изменения в генах, отвечающих за деление клеток, вызывают различные виды опухолей. Для колоректального рака характерны мутации в генах, участвующих в сигнальной системе. Одними из регуляторов эпидермального фактора роста являются гены семейства RAS.
Семейство генов RAS включает в себя три гена, участвующие в сигнальной системе – KRAS, NRAS, HRAS. Белки этой системы могут находиться в активной и неактивной форме, эти периоды сменяют друг друга и регулируются с помощью молекулы ГТФ.
В нормальном состоянии RAS находится в неактивной форме. Для включения механизма требуется сложное взаимодействие молекул, которое приводит к делению или дифференциации клеток.
Изменение в структуре какого-либо гена ведет к нарушению сигнального пути и приводит к злокачественному перерождению клеток.
Мутация KRAS при колоректальном раке – это изменение последовательности нуклеотидов в определенном участке гена, нарушающие функционирование гена. Чаще всего такое нарушение наблюдается во 2 экзоне в 12 и 13 кодоне. Мутантный участок ДНК запускает активное и неконтролируемое деление клеток, приводящее к образованию опухоли.
Статус KRAS определяется в ходе генетического теста на рак кишечника и является важным показателем при лечении. Наличие изменений в данном гене помогает определить верную стратегию лечения и подобрать комплекс препаратов, которые будут эффективны при терапии.
Основной метод лечения болезни – прием моноклональных антител, которые связываются с рецептором. Мутантный ген KRAS препятствует связыванию препарата с определенными участками генов и не приносит результата при лечении.
Наличие KRAS и NRAS мутаций при раке толстого кишечника осложняет подбор терапии и исключает прием таргетных препаратов. При наличии данных мутаций применяется хирургическое лечение, а также курсы химио- и лучевой терапии на ранних стадиях. В запущенных случаях лечение считается нецелесообразным и больной получает лекарства, купирующие болевой синдром и поддерживающие жизненные показатели на оптимальном уровне.
Под колоректальным раком понимается как рак прямой кишки, так и рак ободочной кишки. По медицинской статистике в России среди онкологической заболеваемости рак ободочной кишки занимает 5 место, рак прямой кишки – 6-е. При этом мутации в гене KRAS встречаются у 30-60% пациентов с подтвержденным диагнозом.
Одной из причин возникновения злокачественного новообразования является следственная предрасположенность к образованию опухоли (так называемые генеративные мутации генов). Генетический фактор составляет меньшую часть всех случаев заболеваемости, в отличие от остальных.
Знание онко-статуса позволяет предотвратить возникновение онкологического заболевания и выявить опухоль на ранней стадии.
Пациенты из группы риска должны провести обследование как можно скорее, чтобы вовремя начать лечение или профилактику рака ободочной и толстой кишки. Анализ назначается следующим пациентам:
в ближайшем окружении которых были случаи подобного вида заболевания;
рак у родственников был выявлен достаточно рано (до 50 лет);
у пациента есть подтвержденный диагноз;
больной имеет другие формы рака.
Наличие мутации не гарантирует возникновение опухоли. Своевременная диагностика онко-статуса позволяет снизить риск возникновения заболевания и выявить его на ранней стадии. Это значительно улучшает качество жизни больного и дает благоприятные прогнозы на выздоровление.
источник
Три эксперта в области онкологии о раке, наследственности и генетическом тестировании
Онкологические заболевания ежегодно уносят миллионы жизней. Среди причин смерти рак занимает второе место после сердечно-сосудистых заболеваний, а по сопровождающему его страху — определённо первое. Такая ситуация сложилась из-за представления, что рак сложно диагностировать и практически невозможно предотвратить.
Однако каждый десятый случай заболеваемости раком — это проявление мутаций, заложенных в наших генах с самого рождения. Современная наука позволяет их отловить и значительно уменьшить риск возникновения заболевания.
Эксперты в области онкологии рассказывают, что такое рак, как сильно на нас влияет наследственность, кому показано генетическое тестирование в качестве меры профилактики и как оно может помочь, если рак уже обнаружен.
Рак — это, по сути, генетическое заболевание. Мутации, вызывающие онкологические заболевания, либо наследуются, и тогда они есть во всех клетках организма, либо появляются в какой-то ткани или конкретной клетке. Человек может унаследовать от родителей определённую мутацию в гене, который защищает от рака, или мутацию которая сама по себе может привести к раку.
Ненаследственные мутации возникают в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения.
В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет. Этот путь люди проходят гораздо быстрее, если уже при рождении они унаследовали поломку. Поэтому при опухолевых синдромах рак возникает в гораздо более молодом возрасте.
Прошлой весной вышла замечательная статья в Science — о случайных ошибках, которые возникают в ходе удвоения молекул ДНК и являются основным источником появления онкогенных мутаций. При таких видах рака, как рак простаты, их вклад может достигать 95%.
Чаще всего причиной возникновения рака являются именно ненаследственные мутации: когда никаких генетических поломок человек не унаследовал, но в течение жизни в клетках накапливаются ошибки, которые рано или поздно приводят к возникновению опухоли. Дальнейшее накопление этих поломок уже внутри опухоли может сделать её более злокачественной или привести к возникновению новых свойств.
Несмотря на то, что в большинстве случаев онкологические заболевания возникают из-за случайных мутаций, надо очень серьёзно относиться к наследственному фактору. Если человек знает об имеющихся у него унаследованных мутациях, он сможет предотвратить развитие конкретного заболевания, риск возникновения которого у него очень велик.
Есть опухоли с ярко выраженным наследственным фактором. Это, например, рак молочной железы и рак яичников. До 10% случаев заболеваемости этими видами рака связаны с мутациями в генах BRCA1 и BRCA2. Самый распространенный среди нашего мужского населения вид рака — рак лёгкого — в основной массе вызывается внешними факторами, а конкретнее — курением.
Но если предположить, что внешние причины исчезли, то роль наследственности стала бы примерно такой же, как и у рака молочной железы. То есть, в относительном соотношении для рака лёгкого наследственные мутации видны довольно слабо, но в абсолютных числах это всё же вполне существенно.
Кроме того, наследственный компонент довольно значительно проявляет себя в раке желудка и поджелудочной железы, колоректальном раке, опухолях головного мозга.
Большая часть онкологических заболеваний возникает за счёт сочетания случайных событий на клеточном уровне и внешних факторов. Однако в 5-10% случаев предопределяющую роль в возникновении рака играет наследственность.
Представим себе, что одна из онкогенных мутаций появилась в половой клетке, которой повезло стать человеком. Каждая из примерно 40 триллионов клеток этого человека (а также его потомков) будет содержать мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой, а риск заболеть определённым видом рака у носителя мутации будет существенно выше.
Повышенный риск развития рака передаётся из поколения в поколение вместе с мутацией и называется наследственным опухолевым синдромом. Опухолевые синдромы встречаются достаточно часто — у 2-4% людей, и вызывают 5-10% случаев рака.
Анджелина Джоли сделала профилактические операции, поскольку три её близких родственницы умерли от рака молочных желез и яичников (источник: fs.kinomania.ru)
Благодаря Анджелине Джоли самым известным опухолевым синдромом стал наследственный рак молочной железы и яичников, который вызывается мутациями в генах BRCA1 и BRCA2. У женщин с этим синдромом риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания гораздо ниже — 5,6%. Увеличивается вероятность развития рака и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин еще и предстательной железе.
Наследственные формы есть практически у любого онкологического заболевания. Известны опухолевые синдромы, которые вызывают рак желудка, кишечника, мозга, кожи, щитовидной железы, матки и другие, менее распространённые типы опухолей.
Знать о том, что у вас или и у ваших родственников есть наследственный опухолевый синдром, может быть очень полезно для того, чтобы снизить риск развития рака, диагностировать его на ранней стадии, и эффективнее лечить заболевание.
Носительство синдрома можно определить с помощью генетического теста, а на то, что вам стоит сдать тест, укажут следующие особенности семейной истории.
- Несколько случаев одного вида рака в семье;
- Заболевания в раннем для данного показания возрасте (для большинства показаний – раньше 50 лет);
- Единичный случай определенного вида рака (например, рак яичников);
- Рак в каждом из парных органов;
- Больше одного типа рака у родственника.
Если для вашей семьи характерно что-либо из вышеперечисленного, вам следует проконсультироваться у врача-генетика, который определит, есть ли медицинские показания для того, чтобы сдавать генетический тест. Носителям наследственных опухолевых синдромов следует проходить тщательный скрининг на онкологические заболевания для того, чтобы обнаружить рак на ранней стадии. А в некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Несмотря на то, что наследственные опухолевые синдромы встречаются очень часто, западные национальные системы здравоохранения пока не ввели генетическое тестирование на носительство мутаций в широкую практику. Тесты рекомендуется сдавать лишь при наличии определённой семейной истории, указывающей на определённый синдром, и только в том случае, если известно, что тестирование может принести человеку пользу.
К сожалению, такой консервативный подход пропускает множество носителей синдромов: слишком мало людей и врачей подозревает о существовании наследственных форм рака; высокий риск заболевания далеко не всегда проявляется в семейной истории; многие пациенты не знают о заболеваниях своих родственников, даже когда есть, кого спросить.
Всё это — проявление современной медицинской этики, которая гласит, что знать человеку стоит только то, что принесет ему больше пользы, чем вреда.
Причём право судить о том, что такое польза, что такое вред, и как они соотносятся друг с другом, врачи оставляют исключительно себе. Медицинское знание — такое же вмешательство в мирскую жизнь, как таблетки и операции, и поэтому меру знания должны определять профессионалы в светлых одеждах, а то как бы чего не вышло.
Я, как и мои коллеги, считаю, что право на знание о собственном здоровье принадлежит людям, а не врачебному сообществу. Мы делаем генетический тест на наследственные опухолевые синдромы, чтобы те, кто хочет узнать о своих рисках развития рака, могли реализовать это право, и взять на себя ответственность за собственную жизнь и здоровье.
В процессе развития рака клетки изменяются и теряют свой первоначальный генетический «вид», унаследованный от родителей. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Чтобы узнать слабые места опухоли, нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
Нестабильность генома позволяет опухоли копить генетические нарушения, которые могут быть выгодными для самой опухоли. К ним относятся мутации в онкогенах — генах, которые регулируют деление клеток. Такие мутации могут многократно повышать активность белков, делать их нечувствительными к тормозящим сигналам или вызывать повышенную выработку ферментов. Это приводит к неконтролируемому делению клеток, а впоследствии и к метастазированию.
Некоторые мутации имеют известные эффекты: мы знаем, как именно они меняют структуру белков. Это даёт возможность разработать лекарственные молекулы, которые будут действовать только на опухолевые клетки, и при этом не будут уничтожать нормальные клетки организма. Такие препараты называют таргетными. Чтобы современная таргетная терапия работала, нужно до назначения лечения знать, какие мутации есть в опухоли.
Эти мутации могут различаться даже в пределах одного типа рака (нозологии) у разных пациентов, и даже в опухоли одного пациента. Поэтому для некоторых лекарств молекулярно-генетическое тестирование рекомендовано в инструкции к препарату.
Определение молекулярных изменений опухоли (молекулярное профилирование) — важное звено в цепочке принятия клинических решений, а его значимость будет только расти со временем.
На сегодняшний день в мире проводится более 30 000 исследований противоопухолевой терапии. По разным данным, до половины из них используют молекулярные биомаркеры для включения больных в исследование или для наблюдения в ходе лечения.
Но что даст пациенту молекулярное профилирование? Где его место в клинической практике сегодня? Хотя для ряда лекарств тестирование является обязательным, это всего лишь «надводная часть айсберга» современных возможностей молекулярного тестирования. Результаты исследований подтверждают влияние различных мутаций на эффективность лекарств, а некоторые из них можно встретить в рекомендациях международных клинических сообществ.
Однако известно ещё не менее 50 дополнительных генов и биомаркеров, анализ которых может быть полезным в выборе лекарственной терапии (Chakravarty et al., JCO PO 2017). Их определение требует использования современных методов генетического анализа, таких как высокопроизводительное секвенирование (NGS). Секвенирование позволяет обнаружить не только распространенные мутации, но «прочитать» полную последовательность клинически значимых генов. Это позволяет выявить все возможные генетические изменения.
На этапе анализа результатов используются специальные биоинформатические методы, которые помогают выявить отклонения от нормального генома даже если важное изменение встречается в небольшом проценте клеток. Интерпретация полученного результата должна опираться на принципы доказательной медицины, так как не всегда ожидаемый биологический эффект подтверждается в клинических исследованиях.
Из-за сложности процесса проведения исследований и интерпретации результатов молекулярное профилирование пока не стало «золотым стандартом» в клинической онкологии.
Однако есть ситуации, в которых этот анализ может существенно повлиять на выбор лечения:
К сожалению, даже на фоне правильно подобранного лечения заболевание может прогрессировать, и не всегда есть выбор альтернативной терапии в рамках стандартов для данного онкологического заболевания. В этом случае молекулярное профилирование может выявить «мишени» для экспериментальной терапии, в том числе в рамках клинических исследований (например TAPUR).
Некоторые виды рака, например, немелкоклеточный рак лёгкого или меланома, известны множеством генетических изменений, многие из которых могут быть мишенями для таргетной терапии. В таком случае молекулярное профилирование может не только расширить выбор возможных вариантов лечения, но и помочь расставить приоритеты при выборе препаратов.
Молекулярное исследование в таких случаях помогает на начальном этапе определить более полный спектр возможных вариантов лечения.
Молекулярное профилирование и персонализация лечения требуют сотрудничества специалистов из нескольких областей: молекулярной биологии, биоинформатики и клинической онкологии.
Поэтому такое исследование, как правило, стоит дороже обычных лабораторных тестов, а его ценность в каждом конкретном случае может определить только специалист.
источник
Поскольку препараты становятся более целенаправленными, новые анализы при раке кишечника играют важную роль в эффективном лечении заболевания.
Для диагностики рака толстой кишки (колоректального рака) пациенту приходится пройти через множество анализов.
Без них невозможно узнать тип опухоли и выбрать оптимальную терапию.
В последние годы список анализов при раке кишечника расширился.
Последние достижения в лабораторной диагностике колоректального рака позволяют онкологам прогнозировать, как будет вести себя опухоль у конкретного пациента. Этот подход носит название «персонализированная медицина».
Большинство рекомендаций по лечению требуют такой важной информации, как молекулярно-генетический тип рака, стадия и локализация процесса.
Анализ мутаций в гене KRAS. За рубежом этот лабораторный анализ уже активно назначается пациентам с метастатическим колоректальным раком.
Он определяет мутации в гене под названием KRAS. Статистика показывает, что KRAS мутирует у 40% больных колоректальным раком. Больных, у которых не выявлено таких мутаций, называют носителями гена KRAS «дикого типа».
Анализ на онкотип DX. Этот лабораторный анализ предназначен для пациентов с раком толстой кишки II стадии. Он включает исследование 12 разных генов с целью определить «показатель рецидива» заболевания.
Показатель рецидива (число от 0 до 100) характеризует риск возвращения рака после хирургической операции. Низкий балл означает низкий риск рецидива, и наоборот.
Анализ мутаций в гене KRAS определяет, насколько хорошо опухоль реагирует на ингибиторы EGFR, одну из групп таргетных препаратов.
Исследования показывают, что пациенты с мутацией гена KRAS не реагируют на такие таргетные препараты, как цетуксимаб (Erbitux) и панитумумаб (Vectibix).
Таким образом, если у вас обнаружен ген KRAS «дикого типа», ингибиторы EGFR могут подойти. Если у вас есть мутация KRAS, онколог должен порекомендовать другие методы лечения метастатического колоректального рака.
Анализ на онкотип DX помогает врачу решить, требуется ли вам химиотерапия.
Адъювантная химиотерапия после удаления опухолей кишечника обычно назначается для повышения эффективности лечения при высоком риске рецидива. Раньше врачи принимали во внимание только стадию и локализацию опухоли.
Новый анализ на онкотип DX дает онкологу бесценную информацию для решения о проведении адъювантной химиотерапии. Он подскажет, у каких пациентов с колоректальным раком II стадии высокий риск рецидива. Таким образом, простой анализ указывает подходящих кандидатов для химиотерапии.
Пациенты с низким риском могут избежать химиотерапии и ее побочных эффектов.
Эти современные анализы при раке кишечника требуют наличия опухолевых клеток. Выполняются они на образце ткани, удаленном во время операции.
В клиниках США полученные образцы отправляются вашим врачом в компанию, которая разработала конкретный анализ. Результаты могут быть готовы через несколько дней или недель, в зависимости от специфики исследования.
Лабораторные анализы на онкотип DX и мутации гена KRAS не могут сказать, вернется ли болезнь, и какое лечение будет самым лучшим. Здесь нужно учитывать многие факторы.
Цель этих исследований — предоставить дополнительную информацию о конкретной опухоли, чтобы помочь вам и вашим врачам в принятии объективного решения о терапии.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
источник
Рак начинается с мутации – изменения генотипа. Иногда этот измененный ген передается по наследству. И человек даже не подозревает, что носит в себе маленькую бомбу замедленного действия, часовой механизм которой может запустить любой неблагоприятный фактор. Выявить такие мутации и помогает тест на генетическую предрасположенность к раку.
Важно понимать, что не все генетические мутации являются наследственными, и их наличие не означает автоматическое появление рака, но оно может значительно увеличить риск развития онкопатологии.
Они присутствуют в репродуктивных клетках родителя (сперматозоидов или яйцеклеток) и поэтому передаются ребенку. Такая поломка гена обнаруживается во всех клетках ребенка и может передаваться из поколения в поколение.
Они встречаются в клетке того или иного органа, передаются только клеткам, которые образовались из измененной исходной клетки, и не могут передаваться из поколения в поколение. эта разновидность генных сбоев составляет подавляющее большинство случаев.
Генетическое тестирование не предлагается, если в семье обнаружен единичный случай рака. Оно необходимо людям, чья семейная история свидетельствует о наличии наследственной формы рака.
Вам стоит задуматься о генетическом тесте на рак, если были выявлены:
- три или более случаев рака одного вида в одной и той же ветви семьи;
- хотя бы один случай рака у довольно молодого родственника (например, до 50 лет для рака толстой кишки);
- разные виды рака (груди и яичника) у двух родственных женщин.
В этих случаях риск оказаться носителем такого гена довольно высок, и вы можете сами столкнуться с онкологическим диагнозом, а также с множественными опухолями (например, злокачественной опухолью груди и яичников в возрасте до 50 лет). Тест на генетическую предрасположенность к раку поможет выявить наличие или отсутствие наследственного онкологического заболевания, благодаря чему сможете принимать важные решения о профилактике и лечении.
Генетический скрининг взрослых поможет выявить предрасположенность к:
- Некоторым вида рака молочной железы и яичников. При этом выявляется наследственная генетическая мутация BRCA1 или BRCA2.
- Семейный аденоматозный полипозный колит. Этот вид патологии составляет менее 1% всех видов рака толстой кишки. Он характеризуется наличием сотен полипов в толстой кишке. У таких людей в возрасте от 25 до 40 лет полипы обычно вырождаются в рак кишечника.
- Синдром фон Хиппель-Линдау – редкое наследственное генетическое заболевание, характеризующееся развитием доброкачественных опухолей в кровеносных сосудах мозжечка, спинного мозга и сетчатки (несет нарушения зрения). В почках эти кисты могут дегенерировать рак у людей в среднем возрасте.
- Ксеродерма пигментная – наследственная редкая генетическая болезнь, ответственная за исключительную чувствительность к ультрафиолетовым лучам солнца. Эти мутации приводят к возникновению очень ранних раковых заболеваний кожи.
- Медуллярный рак щитовидной железы – редкий наследственный рак развивается из клеток C щитовидной железы, выделяя кальцитонин (гормон), который регулирует уровень кальция в крови.
В рамках одной семьи чаще передаются:
- ретинобластома (рак глаз наблюдается у детей);
- синдром Ли Фраумени (носители предрасположены к различным опухолям);
- опухоль Вильмса (опухоль почек у детей).
Порядок прохождения исследования включает несколько важных этапов:
- Знакомство с врачом и создание генеалогического древа.
- Составление медицинской истории с использованием медицинских документов.
- В зависимости от ситуации: клинический осмотр.
- В зависимости от ситуации: анализ крови для лабораторного анализа.
- Критическая оценка всех клинических и лабораторных данных
- Установление диагноза
- Оценка генетического риска для самого человека, для его потомства
- Беседа о психологической и / или социальной среде, имеющей отношение к диагнозу, причинам, рискам и профилактике
Анализ генов может занять несколько месяцев. Это может показаться длинным периодом, но такая длительность иллюстрирует сложность и тщательность работы лабораторного анализа.
Когда мутация идентифицирована, проверяется (анализом крови), была ли аномалия передана потомкам этого человека.
Генетический скрининг на рак молочной железы и другие наследственные онкопатологии можно пройти в одном из 8 аккредитованных центров генетики
В результате теста вы можете:
- Удостовериться в отсутствии мутировавших генов . Это хороший результат, однако, отсутствие мутации не означает, что вы не заболеете на рак. Вы просто подвержены тому же риску, что и население в целом.
- Обнаружить носительство измененного гена . В этом случае врач предложит различные решения в зависимости от типа рака, начиная от тщательного мониторинга и заканчивая профилактическими операциями.
Бельгия – европейская страна с наиболее развитым уровнем медицины.
Решив пройти генетическое тестирование в бельгийской клинике, вы можете рассчитывать на:
- Высокий профессионализм всех специалистов. Он обусловлен и более длительным периодом обучения, и более высокими требованиями сертификации, и постоянным контролем качества выполняемой работы.
- Максимально точный результат скрининга. Практически все генетические лаборатории бельгийских центров аккредитованы в соответствии с ISO 15189 , что позволяет проследить весь цикл исследования – начиная от сбора материала до выдачи результата анализа.
- Грамотную консультацию специалиста в случае обнаружения риска развития того или иного вида рака. Вам будут выданы самые полные рекомендации о дальнейшем образе жизни, предложат эффективные меры профилактики и последующих периодических скринингов.
- Приемлемые цены. При практически одинаковом уровне медицины, стоимость тестирования здесь гораздо ниже, чем в Германии, Англии и др. странах Европы
источник
Высокая заболеваемость раком заставляет онкологов ежедневно трудиться над вопросами ранней диагностики и эффективного лечения. Генетический анализ на рак – это один из современных способов профилактики онкозаболеваний. Однако, так ли достоверно это исследование и всем ли оно должно назначаться? – вопрос, который беспокоит и ученых, и врачей, и пациентов.
Сегодня генетический анализ на рак позволяет выявить риск развития онкопатологий:
- молочной железы;
- яичников;
- шейки матки;
- простаты;
- легких;
- кишечника и толстой кишки в частности.
Также, существует генетическая диагностика на некоторые врожденные синдромы, существование которых повышает вероятность развития рака нескольких органов. Например, синдром Ли-Фраумени говорит о риске рака мозга, надпочечников, поджелудочной железы и крови, а синдром Пейтца-Егерса говорит о вероятности онкопатологий пищеварительной системы (пищевод, желудок, кишечник, печень, поджелудочная железа).
На сегодня ученые обнаружили ряд генов, изменения в которых в большинстве случаев приводят к развитию онкологии. Ежедневно в нашем организме развиваются десятки злокачественных клеток, но иммунная система, благодаря особым генам, способна с ними справиться. А при поломках в тех или иных структурах ДНК, эти гены работают неправильно, что дает шанс развитию онкологии.
Так, гены BRCA1 и BRCA2 защищают женщин от развития рака яичников и молочных желез, а мужчин – от рака предстательной железы. Поломки в этих генах напротив показывают, что имеется риск развития карциномы данной локализации. Анализ на генетическую предрасположенность к раку как раз дает информацию об изменениях в этих и других генах.
Поломки в этих генах передаются по наследству. Всем известен случай Анджелины Джоли. В ее семье был случай рака молочной железы, поэтому актриса решила пройти генетическую диагностику, которая и выявила мутации в генах BRCA1 и BRCA2. Правда, единственное, чем смогли помочь врачи в этом случае – провести операцию по удалению груди и яичников, чтобы не было точки приложения для мутировавших генов.
Противопоказаний к сдаче данного анализа не существует. Однако, не стоит его делать в качестве рутинного обследования и приравнивать к анализу крови. Ведь не известно, как результат диагностики повлияет на психологическое состояние пациента. Поэтому назначаться анализ должен только при наличии строгих к тому показаний, а именно зарегистрированных случаев рака у кровных родственников или при имеющемся у пациента предраковом состоянии (например, доброкачественное образование молочной железы).
Генетический анализ достаточно прост для пациента, так как проводится путем одного забора крови. После кровь подвергается молекулярно-генетическому исследованию, что позволяет определить мутации в генах.
В лаборатории имеется несколько реактивов, специфичных для той или иной структуры. За один забор крови может проводиться обследование на поломки в нескольких генах.
Специальной подготовки исследование не требует, однако следовать общепринятым правилам при сдаче крови не помешает. К таким требованиям относится:
- Исключение алкоголя за неделю до диагностики.
- Не курить в течение 3-5 дней перед сдачей крови.
- За 10 часов до обследования не есть.
- В течение 3-5 дней до сдачи крови придерживаться диеты с исключением жирных, острых и копченых продуктов.
Наиболее изученным является обнаружение поломок в генах BRCA1 и BRCA2. Однако, с течением времени врачи стали замечать, что годы генетического исследования значительно не повлияли на смертность женщин от рака молочной железы и яичников. Поэтому в качестве скринингового метода диагностики (проводимого каждому человеку) метод не годиться. А как обследование групп риска генетическая диагностика имеет место.
Основной акцент анализа на генетическую предрасположенность к раку состоит в том, что при поломке в определенном гене человек имеет риск развития рака или же риск передачи этого гена своим детям.
Доверять или нет полученным результатам – личное дело каждого пациента. Возможно, не следует при отрицательном результате проводить превентивное лечение (удаление органа). Однако, если поломки в генах обнаружены, то пристально следить за своим здоровьем и регулярно проводить профилактическую диагностику определенно стоит.
Чувствительность и специфичность – это понятия, которые показывают достоверность теста. Чувствительность говорит о том, сколько процентов пациентов с дефектным геном будет выявлено данным тестом. А показатель специфичности говорит о том, что с помощью данного теста будет обнаружена именно та поломка гена, которая кодирует предрасположенность к онкологии, а не к другим заболеваниям.
Определить процентные показатели для генетической диагностики рака достаточно сложно, так как исследовать нужно много случаев положительных и отрицательных результатов. Возможно, позже ученые смогут дать ответ на данный вопрос, но уже сегодня можно с точностью утверждать, что обследование имеет высокую чувствительность и специфичность, и на его результаты можно полагаться.
Полученный ответ не может на 100% уверить пациента в том, что он заболеет или не заболеет раком. Отрицательный результат генетического тестирования говорит о том, что риск развития рака не превышает средних цифр в популяции. Положительный ответ дает более точную информацию. Так, у женщин с мутациями в генах BRCA1 и BRCA2 риск карциномы груди составляет 60-90%, а карциномой яичников – 40-60%.
Данный анализ не имеет четких показаний к сдаче, будь то определенный возраст или состояние здоровья больного. Если у матери 20-ти летней девушки был обнаружен рак молочной железы, то ей не стоит ждать 10 или 20 лет чтобы обследоваться. Рекомендовано тут же пройти генетическое исследование на рак, чтобы подтвердить или исключить мутацию генов, кодирующих развитие онкопатологий.
Касательно опухолей предстательной железы, каждому мужчине после 50 лет с аденомой простаты или хроническим простатитом полезно будет провести генетическую диагностику, чтобы так же оценить риск. А вот выполнять диагностику лицам, в семье которых не было случаев злокачественной болезни, скорее всего неуместно.
Вы не уверены в правильности поставленного диагноза и назначенного Вам лечения? Ваши сомнения поможет развеять видеоконсультация специалиста мирового уровня. Это реальная возможность воспользоваться квалифицированной помощью лучших из лучших и при этом ни за что не переплачивать.
Показанием к проведению генетического анализа на рак являются случаи выявления злокачественных новообразований у кровных родственников. А назначаться обследование должно врачом-генетиком, который после и оценит результат. Возраст пациента для сдачи теста не имеет никакого значения, так как поломка в генах заложена с рождения, поэтому если в 20 лет гены BRCA1 и BRCA2 в норме, то выполнять то же исследование через 10 и более лет смысла нет.
При правильном проведении диагностики каких-либо экзогенных факторов, которые могут повлиять на результат нет. Однако, у небольшого количества пациентов в ходе обследования могут обнаруживаться генетические поломки, интерпретация которых невозможна по причине недостаточной изученности. И в сочетании неизвестных изменений с мутациями в раковых генах, могут повлиять на результат тестирования (т.е. снижается специфичность метода).
Генетический анализ на рак – это не исследование с четкими нормами, не стоит надеяться, что пациент получит на руки результат, где будет четко написано “низкий”, “средний” или “высокий” риск развития рака. Результаты обследования могут оцениваться только врачом-генетиком. На окончательный вывод влияет история семьи пациента:
- Развитие злокачественных патологий у родственников до 50 лет.
- Возникновение опухолей одной и той же локализации в нескольких поколениях.
- Повторные случаи рака у одного и того же человека.
Сегодня подобная диагностика не оплачивается страховыми компаниями и фондами, поэтому все расходы пациент вынужден брать на себя.
В Украине исследование одной мутации стоит около 250 грн. Однако, для достоверности данных должно быть исследовано несколько мутаций. Например, для рака молочной железы и яичников исследуется 7 мутаций (1750 грн.), для рака легких – 4 мутации (1000 грн.).
В России генетический анализ на рак молочной железы и яичников стоит порядка 4500 руб.
источник
Рак кишечника – одна из самых распространенных форм онкологических заболеваний на нашей планете. Примерно 10 человек из каждых 100 000 имеют записи об этом недуге в своих медицинских картах. Осложняет его течение тот факт, что в процессе развития заболевания может быть затронут не один отдел кишечного тракта. И на последних стадиях это доставляет немало проблем и врачам, и самому пациенту.
По этой причине вопрос раннего диагностирования выходит на первое место. Что проблематично, ведь ранние симптомы схожи с десятками других заболеваний желудочно-кишечной области. А чем позже начато лечение, тем сложнее избавиться от онкологии. Особенно, если процесс метастазирования (проникновения опухолевых клеток в другие органы), уже начался.
Верную диагностику осложняет тот факт, что опухоль может возникнуть в любом месте достаточно протяженного кишечного тракта. От этого сильно зависит симптоматика и последующее лечение.
В настоящее время медицина лишь строит предположения о причинах этого онкологического заболевания, основываясь на многолетних статистических данных. Это позволяет определить группы риска и назвать следующие факторы, провоцирующие появления раковых клеток в кишечнике:
- Рацион питания – неверно организованный процесс потребления пищи, когда в рационе преобладают белки и жирыища, может привести к образованию в кишечнике каловых масс, его закупоривающих. В свою очередь, это может привести к механической травме его стенок и последующему возникновению онкологии.
- Генетика — если среди родственников выявлялись случаи кишечного рака, то риск его развития существенно выше. Однако по настоящее время не выделены гены, ответственные за возникновение онкологических заболеваний, не смотря на все успехи генетиков в последние годы.
- Заболевания желудочно-кишечного тракта – к группе риска можно отнести людей, болеющих аденомой, полипами, язвенными колитами или болезнью Крона. Иногда эти болезни оказываются предвестниками раковых состояний. Особенно если пациент по различным причинам запускает их течение. Так, например, полипы, имеющие изначально доброкачественный характер, при отсутствии должного лечения, могут стать злокачественной опухолью.
- Глютен – об этом веществе стало широко известно в последнее десятилетие. Проведенные исследования показывают, что люди с его непереносимостью рискуют заболеть онкологией кишечника при слишком высоком уровне потребления глютена.
Проблема практически всех онкологических заболеваний заключается в том, что ранних стадиях их диагностируют только случайно, при обследовании по другим причинам. Из-за этого заболевший теряет драгоценное время, когда недуг можно было бы устранить в зародыше. Существует даже предположение, что раковые клетки выделяют небольшое количество обезболивающих веществ, способствуя позднему их обнаружению. Тем не менее можно выделить следующие первые признаки рака кишечника:
- Энтероколитический – характеризует расстройством стула, которое может выражать в длительных запорах, сменяемых поносом. Живот постоянно вздут, а процесс образования каловых масс нарушен. Этот признак характерен для онкологии левой половины слепой или ободочной кишки.
- Стеноз – это состояние, когда уже сама опухоль препятствует нормальному выведению кала. И поход в туалет представляется проблематичным, а запоры, вздутие и боли в области брюшины становятся постоянными спутниками пациента после акта дефекации.
- Диспепсия – нарушение нормального пищеварительного процесса, когда пациент мучается изжогой, горьким вкусом в полости рта, рвотой.
- Превдоспастия – воспаление в области брюшины, ведущее к изменению нормальной температуры тела, болям и токсикации. Последнее становится причиной плохого самочувствия и постоянной усталости.
- Цистит – наблюдается на более поздних стадиях, когда опухолевые ткани интегрируются в близлежащие органы, в том числе, мочевой пузырь и репродуктивные органы. В этом случаи отмечается болевой синдром при мочеиспускании.
- Иные признаки – человек становится слабым и легко утомляемым, отмечается сухость и бледность кожи, слизистых, изменение температуры тела. При дефекации чувство опустошения кишечника не наступает, а в кале могут наблюдаться следы крови.
Наблюдение данных симптомов не дает четкого диагноза, однако является поводом немедленного обращения к врачу для проведения дополнительной диагностики. Она заключается в сборе соответствующих анализов, а также аппаратном обследовании кишечного тракта.
Человеческий кишечник делится на несколько отделов, которые называются прямой, толстой и тонкой кишкой. И опухолевые процессы в различных отделах протекают по-разному, со своими симптомами и способами диагностики.
Прямая кишка соседствует с такими органами, как мочевой пузырь, матка и яичники. Поэтому наличие онкологии в этом отделе вызывает позывы к мочеиспусканию и дефекации, которые чаще всего оказываются ложными. Также может наблюдаться недержание и боли при походе в туалет.
Другими симптомами могут быть выделения из анального прохода и сильные боли перед дефекацией, вызванные поражением нервных окончаний злокачественным новообразованием.
На позднейших стадиях онкология может проникнуть дальше в мышечные волокна, вызывая недержание мочи, каловых масс, газов. А при блокировке опухолью прохода каловых масс наблюдается сильнейшая интоксикация организма, из-за чего болит голова, пациента тошнит.
Начинается с ноющей боли в подреберье слева или справа. Из-за поражения стенок толстого кишечника вздувается и бурлит живот, а стул становится жидким. С развитием заболевания появляется кишечная непроходимость, так как опухоль перекрывает ход каловых масс. А также наблюдаются тошнота и рвота, причем рвотные массы могут содержать следы каловых. В брюшине концентрируется жидкость, препятствующая нормальной работе близлежащих органов, такое состояние называется асцитом
Симптоматика характеризуется потемнением каловых масс и появлением в них обильных следов крови. У больного меняются вкус и обоняние, теряется аппетит, его тошнит и рвет. Живот постоянно болит, а в кишечнике наблюдаются сильные спазмы. Лечение начинается со строгой диеты, но если симптомы не уходят, врач проводит детальное обследование организма.
Рак кишечника у женщин и у мужчин могут протекать по-разному. В женском теле рядом с ним расположена матка, поэтому при онкологии одного органа может быть затронут и другой. Тогда в моче наблюдается кровь или следы кала, а само мочеиспускание сопровождается болевым синдромом.
Такой же болевой синдром при мочеиспускании может наблюдаться и у мужчин, но связан он с тем, что раковые клетки проникают в предстательную железу.
Онкологические заболевания кишечника традиционно делятся на пять стадий. И чем раньше дан старт лечению, тем выше шансы полностью избавиться от онкологии. Но симптомы, заставляющие заболевших обратиться к врачу, появляются только на II или III стадии. А на данных стадиях вылечить пациента гораздо сложнее, так как в опухоли уже запущен процесс метастазирования.
Эта стадия считается предраковой и характеризуется появлением в кишечнике быстро делящихся клеток. Появляются они после перенесенных заболеваний кишечника и раковыми еще не считаются. Превратятся ли они в раковые, зависит от образа жизни пациента и сочетания других факторов. Происходит это примерно в трети случаев.
Протекает практически бессимптомно, так как опухоль только-только образовалась и не беспокоит соседние органы. Единственными внешними проявлениями могут быть лишь небольшое расстройство желудочно-кишечного тракта и жидкий стул.
Опухоль разрастается, поражая ткани кишечника на всю глубину, но метастазы еще не отмечаются. На этой стадии уже возможно появлений болей в брюшине, которые с раком пока не ассоциируются.
Ткани, лимфоузлы и органы, расположенные рядом с очагом заболевания уже затронуты, а болевой синдром выражен гораздо сильнее. Появляются и другие характерные симптомы, которые зависят от конкретной формы и места расположения.
Данную стадию диагностируют в момент появление метастазов, распространяющихся по всему организму. Опухоль достигает настолько больших размеров, что полностью перекрывает кишечный проход. Каловые массы не могут исторгнуться из организма естественным путем, поэтому токсинами отравляют организм, нарушая, в том числе, нормальную работу других органов.
Выживаемость коррелирует с двумя факторами: стадией и пораженностью печени. Так, если печень затронута онкологией, а в очаге заболевания диагностирована IV стадия, то выживает не более 5% пациентов, а срок жизни редко превышает полгода.
Если же болезнь была обнаружена (чаще всего это происходит случайно) на первоначальном этапе, то выживает до 95%, а на II стадии – от 52% до 83%. Третья стадия онкологического заболевания дает 50-процентные шансы на успешное излечение. Все зависит от правильно и вовремя назначенного лечения.
Чем раньше начинается лечение, тем выше шанс полностью выздороветь от кишечной онкологии. Различные народные методы могут лишь облегчить симптоматику заболевания на короткий период, никак не замедляя его развитие. Единственный эффективный метод – обратиться к доктору. Да, существует вероятность полностью выздороветь и на последней стадии, но такая вероятность составляет не более 5% от общего числа наблюдений.
Наиболее действенно на первых стадиях. Оперативное вмешательство заключается в удалении пораженного участка кишечника, а места срезов затем сращиваются, и функционал кишечника полностью восстанавливается.
Больший размер новообразования предполагает удаление значительной части кишечника. Здоровая часть выводится наружу с наложением колостомы. Такое состояние пациента дискомфортно и может доставлять болевые ощущения.
Применяется в том случае, когда хирургическое вмешательство уже неэффективно. Задача подобных видов терапии заключается в воздействии на раковые клетки с целью уменьшения их роста и скорости распространения по организму. Недостатками таких методов является ряд побочных эффектов, среди которых тошнота, рвота и выпадение волос.
Профилактика однозначно рекомендована людям в группе риска, но и всем прочим будет нелишне соблюдать правила предупреждения онкологии кишечника.
Основой профилактики является здоровый образ жизни. Это включает в себя двигательную активность и здоровое питание, а также отсутствие вредных привычек. Если говорить о здоровом питании, то для кишечника полезно потребление клетчатки в продуктах, ее содержащих. Особо полезными считаются капуста, цитрусовые, яблоки и различные ягоды. В них содержится клетчатка первого вида, которая бережнее всего относится к желудку и кишечнику.
Другой мерой, если не профилактики, то предупреждения болезни, является периодическое обследование у гастроэнтеролога. Особенно это касается людей из группы риска и людей пожилого возраста.
Ассоциация «Здравствуй!» совместно со специалистами-онкологами разработала серию брошюр, из которых пациенты и их близкие могут получить актуальную информацию о современной диагностике и лечении: опухоли головы и шеи, рака почки, рака легкого, рака молочной железы, меланомы, возможностях иммуно-онкологии, а так же о психологической и юридической поддержке. Рекомендации по образу жизни во время лечения. Таргетная терапия при меланоме кожи издание
источник