Формула Курлова, название воды. Графические изображения химического состава подземных вод.
1. Пересчет результатов химических анализов.Для выяснения количественных соотношений между ионами данные химических анализов, выполненные химической лабораторией, должны быть представлены в миллиграмм-эквивалентной форме, т.к. ионы в растворе реагируют между собой в эквивалентных количествах.
Пересчет из ионной формы, выраженной в мг/л в моль-экв, осуществляется делением числа кг каждого иона на его эквивалентный вес (ионный вес, деленный на валентность) или умножением на пересчетный коэффициент. Наиболее просто находить моль-экв.. пользуясь пересчетной таблицей.
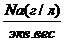
Na(мг/л)* К=Na моль- экв,.
где Кпересчетный коэффициент.
2.Пересчет результатов анализов. Пересчет результатов анализов заканчивается выражением его в процентах моль-эквивалентов. Для этого принимают каждую из вычисленных сумм мг/экв. катионов и анионов за 100% и по формулам

x = 
определяют процентное содержание каждого из катионов и анионов в отдельности. Все данные записывают в соответствующую ведомость химических анализов.
Ведомость химических анализов.
Содержание воды.
1. Вычисление видов жесткости. Жесткость воды обуславливается присутствием в воде ионов кальция,железа, алюминия, марганца, бария, стронция. Для вод , используемых в хозяйственных и технических целях, жесткость воды не учитывать нельзя. Жесткая вода требует больше мыла для получения пены, в ней медленнее развариваются овощи, мясо, образуется накипь на стенках труб и паровых котлов, что уменьшает теплоотдачу и требует большего потребления тепла. Различают жесткость воды общую, временную (устранимую, карбонатную) и постоянную (неустранимую, остаточную).
Общая жесткость определяется суммарным содержанием в воде иона Ca** и Mg**, так как содержание других элементов в воде ничтожно мало. Величина карбонатной жесткости соответствует количеству иона НСО 
Эта величина является расчетной и определяется по количеству ионов Са** Мg**, связанных с ионами НСО 



Временную жесткость определяют ионы Са** и Мg**, осаживающиеся при кипячении воды в виде карбонатов вследствие разрушения гидрокарбонат – иона.
Постоянную жесткость определяют ионы Са** и Мg**, остающиеся в воде после кипячения. Это есть разность между общей карбонатной жесткостью (в моль-экв).
Жесткость воды О.А.Алекин рекомендует следующее подразделение подземных вод по степени жесткости.
Классификация подземных вод по величине жесткости.
Для питьевых целей большей частью используются подземные воды с общей жесткостью до 7 моль-экв/л (около 20 нем. град.), но в некоторых местностях для питья потребляются и более жесткие воды.
2. Для наглядного изображения химического состава можно применять запись в виде формулы Курлова. Эта запись имеет структуру в виде дроби. В числителе в убывающем порядке (по абсолютному содержанию в % экв) записываются анионы, а в знаменателе в таком же порядке – катионы. Слева от дроби в кг/л становится газовый состав (СО 
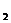


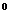

[CO 





В наименование состава воды включаются анионы и катионы, содержание которых превышает 25%-экв, название включает и специфические элементы, а также газовый состав.
Основные ионы Курлов М.Г. предлагает назвать в убывающем порядке, причем, первыми называются анионы, а вторыми , в таком же порядке – катионы. В приведенном примере название состава воды, выраженной формулой Курлова, будет борная, углекислая, железистая, фтористая, хлоридно- сульфатная натриево-магниевое.
Как видно из указанного примера, основные ионы определяют химический состав воды, а газовый и специфические элементы – специфическое содержание. При составлении химического названия воды необходимо соблюдать элементарные правила русского языка, согласно которым основное прилагательное пишется полностью а прилагательное, указывающее на второстепенное свойство предмета, пишется сокращенно. Если в химическом составе воды преобладают анионы хлоридный и сульфатный, причем сульфатного больше, чем хлоридного, то воду следует называть хлоридно-сульфатной, а не сульфатно-хлоридной.
Приведем два примера. Химический состав вод изображен в виде формул Курлова, причем скобками второстепенные ионы отделены от главных.
Здесь мы имеем пресную, гидрокарбонатную магниево-кальциевую воду с повышенным содержанием сульфатов. По классификации О. А. Алекина, данная вода принадлежит к гидрокарбонатному классу, группе кальция и магния и второму типу (CII Ca , Mg 0.4).
Вода солоноватая, сульфатно-хлоридная магниево-натриевая.
Как установлено, ионная форма свойственна в полной мере лишь водам низкой минерализации. При увеличении концентрации растворенных солей между ионами усиливается взаимодействие, причем развивается процесс, обратный диссоциации, т. е. ассоциация. В растворе образуются ассоциированные пары: нейтральные ( СаSО4 0 , МgSО4 0 , СаСО3 0 ) или несущие заряд (Mg(HCO3)2 Са(НСО3)2 + ).Ввиду сложности химического состава природных растворов во многих случаях нельзя предугадать, какие соли в каком порядке будут выпадать из данного раствора, так как на ход кристаллизации влияет температура и другие факторы. Поэтому наши пересчеты из ионной в солевую форму принято называть гипотетическими. При оценке питьевых, лечебных, технических и других качеств воды полезно принимать во внимание не только абсолютное содержание отдельных ионов, но
и предполагаемые ассоциации анионов с катионами (соли). Изображение химического состава вод в виде солей следует рассматривать как очень удобную рабочую гипотезу, позволяющую лучше разобраться в химических свойствах и происхождении природных вод.Пересчет из ионной формы в солевую производится в соответствии с растворимостью солей. В первую очередь комбинируются малорастворимые, а затем все более и более растворимые.
Простейшим для изображения единичных анализов является график-прямоугольник химического состава воды. График строится в виде двух прямоугольников, на одном из которых в масштабе нанесены %-эквиваленты анионов, на другом %-эквивалента катионов в последовательности, определяемой правилом Фрезениуса, т.е. в порядке их химической активности: К*, Na*, Mg**, Fe, Mg, H, NO , Cl, Br, I, SO, НCO, CO, OH. .
Графически изображать единичные анализы можно также с помощью круглой диаграммой Н.И.Толстихина.
Горизонтальной линией круг делится на две части. В верхней части по секторам откладываются в масштабе катионы слева направо в обратном порядке , чем на прямоугольной диаграмме, а в нижней — в таком же порядке анионы. Диаметр круга в масштабе отвечает минерализации воды, точно также и ширина прямоугольной диаграммы в масштабе соответствует величине минерализации воды.
Классификация Алекина О.А. сочетает принцип преобладающего иона и соотношение между ионами. За основу взято шесть главных иона (3 катиона, 3 аниона), содержание которых выражено в моль- эквивалентах:
По преобладающему аниону воды подразделяются на три класса: гидрокарбонатные и карбонатные (НСО 

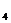
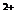
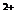


Каждая группа по соотношению между ионами подразделяются на три типа. Всего выделено четыре типа:
I) НСО 

II) НСО
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9360 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Химический, микробиологический анализы воды из скважин, и центрального водоснабжения, с примером допустимых показателей
Исследования помогают установить химический состав и свойства воды и выявить концентрацию всех вредных примесей. Это необходимо для обеспечения любого объекта строительства качественной питьевой водой, а также для расчетов и выбора подходящего очистительного и распределительного оборудования. От состава и свойств воды зависит расчетный срок службы прокладываемых коммуникаций и здоровье людей, использующих ее для питьевых или бытовых нужд. Именно по этой причине одним из основных этапов геоизысканий является обязательное проведение различных анализов воды из скважины, которое назначается застройщиками любых объектов, в том числе и промышленных.
Емкости, используемые для анализа воды
При этом стоит учесть, что подобные лабораторные исследования рекомендуется проводить систематически, так как химический состав воды подвержен изменениям под действием внешней среды.
Выделяют 3 основных вида показателей:
- Физические показатели, которые позволяют оценить основные свойства воды, а именно ее вкус, цвет, мутность, температурные данные, запах и информацию о взвешенных частицах в составе.
- Химические показатели. Они позволяют охарактеризовать состав воды за счет оценки концентрации основных ионов. Также в процессе исследования определяют основные показатели жесткости, уровень pH, число общей минерализации и содержание отдельных ионов, отвечающих за качество воды, фтора, железа, калия и т. д. Стоит отметить, что избыток железа влияет на цвет воды и вызывает образование осадка в трубах, который может негативно влиять на сантехническое оборудование и трубы. В то время как избыток меди влияет на вкусовые качества.
- Бактериологические показатели также отвечают за качество воды и позволяют своевременно определить заражение различными микроорганизмами. Чаще всего бактерии попадают в жидкость под воздействием внешних факторов и человеческой жизнедеятельности. Например, заражение может произойти при попадании сточных вод, при контакте воды с животными и при загрязнении различными промышленными отходами.
Показатели качества воды определяются:
- химическим анализом;
- органолептическим исследованием, в результате которого определяется жесткость и наличие железа;
- токсическим анализом, направленным на определение наличия опасных веществ;
- микробиологическим исследованием, позволяющим определить содержание бактерий в скважине, водоеме или колодце.
Результаты проверки указывают на количество определенных веществ в разных единицах измерения. При знании норм можно самостоятельно оценить основные показатели. Если все в норме, то жидкость можно считать чистой и пригодной к использованию. В противном случае нужно проводить дополнительную фильтрацию. Обычно в результатах указывают предельно допустимую концентрацию (ПДК) примесей. Этот показатель говорит, что количество определенного вещества не несет негативного воздействия. ПДК прописываются в нормативных документах.
Исследование производят для установления точного химического состава воды, а также для оценки основных свойств. Характер исследования может отличаться в зависимости от поставленных задач. Химический анализ воды подразделяют на общий и специальный. Во время общего анализа воды определяется ее общая характеристика, необходимая для ее классификации, а также для получения информации о содержании отдельных солей и ионов. Данные результаты имеют широкое назначение.
Согласно СанПиН 2.1.4.559-96, на сегодняшний день в результате исследования воды обязательно устанавливают концентрацию ионов кальция, магния, натрия, которые наряду с другими составляют основу шестикомпонентного анализа, также позволяющего определить содержание железа и уровень pH. Исследование не включает в себя определение газового состава.
Краткое описание основных исследуемых в процессе химического анализа показателей:
- Водородный коэффициент (pH) зависит от концентрации ионов.
- Жесткость воды определяют исходя из концентрации в ней солей кальция и магния.
- Щелочность базируется содержанием гидроксидов, анионов слабых кислот, бикарбонатов и карбонатов.
- Хлориды связаны с присутствием в жидкости обычной соли. При наличии с хлоридами азотсодержащих веществ есть угроза загрязнения централизованного водоснабжения бытовыми отходами.
- Сульфаты могут вызывать проблемы пищеварительной системы.
- Элементы, содержащие азот, показывают присутствие в жидкости животной органики. К ним относится аммиак, нитриты, нитраты.
- Фтор и йод. Оба вещества несут негативные последствия как при избытке, так и при дефиците. Первое вещество может вызвать рахит, заболевания зубов и крови. Второе – проблемы щитовидной железы.
- Железо в составе воды может находиться в растворенном, нерастворенном, коллоидном состоянии, а также в виде органических примесей и бактерий.
- Марганец вместе с железом оставляют желтые потеки труб, аналогичные следы остаются и на чистом белье, а также вызывают характерный привкус. Это пагубно действует на печень.
- Сероводород можно встретить в подземных водах, проводя анализ колодезной воды. Вещество относится к ядам, серьезно влияющим на здоровье людей. В воде, используемой для бытовых и питьевых нужд, присутствие сероводорода крайне опасно и запрещено.
- Хлор – наиболее распространенное средство санитарной обработки водопроводной воды. Вещество оказывает пагубное воздействие на организм и является одной из причин генетических мутаций, тяжелых отравлений, онкологических болезней. Однако в воде часто наблюдается остаточный хлор, используемый для ее обеззараживания, в безопасной концентрации.
- Натрий и калий – следствие растворения коренных пород.
Среди специальных анализов подземных вод важное место занимают:
- Санитарный, направленный на определения уровня жесткости и кислотности, содержания солей и ионов NH4, NO2, NO3. Анализ выявляют в целях определения пригодности воды для питья и бытового использования и уровня ее загрязненности.
- Бальнеологический анализ – кроме главных ионов, позволяет выявить уровень газовых компонентов, радиоактивность, число сульфатов, железо, мышьяк, литий и ряд иных показателей качества. Он считается наиболее полным и применяется для нормирования целебных источников минеральной воды, установленных требованиям ГОСТ Р 54316-2011, расположенных , например, в Карловых Варах, Ессентуках, Железноводске, Трускавце.
- Технический анализ производят для того, чтобы оценить коррозионные и агрессивные свойства воды, а также определить ее пригодность для использования в нефтедобыче, для питания паровых котельных установок или в иной технической сфере.
- Поисковый анализ питьевой воды используют наряду с техническим анализом для поиска агрессивных примесей и оценки способов ее дальнейшего использования.
Анализы воды из скважины проводят как в стационарных лабораторных условиях, так и с использованием полевых лабораторных установок непосредственно на объекте строительства. В полевых условиях часто используют исследовательские лаборатории и передвижные конструкции для анализа, разработанные учеными А. А. Резниковым (ПЛАВ), И. Ю. Соколовой и другими. Данный вид оборудования обычно состоит из упакованных смонтированных комплектов оборудования, посуды и реактивов, которые предназначены для исследований объемным, колориметрическим и нефелометрическим методами.
Химическая экспертиза воды имеет широкий спектр действия и применяется для:
- анализа питьевой воды;
- определения чистоты промышленных источников;
- подбора фильтров на производстве.
Для точности результатов рекомендуют соблюдать следующие требования:
- Емкость для пробы воды на анализ должна быть стерильной. Объем тары – 500 гр. Простерилизовать посуду может лаборатория, проводящая исследование, но процедуру несложно провести и дома. Для этой цели пробирку необходимо простерилизовать кипятком или паром. Также можно подержать емкость 10-15 мин в духовке или над открытым огнем.
- Перед забором нужно продезинфицировать кран открытым пламенем и обтереть спиртом. После этих манипуляций нужно спустить воду на полной мощности в течение 5-7 мин. Запрещается притрагиваться к крышке и горловине тары.
- Жидкость необходимо оградить от тепла и прямых солнечных лучей, так как такое воздействие способно нарушить качество, и результаты будут недостоверными. Лучше во время перевозки поместить пробирку в холодное место.
- Образец нужно передать в лабораторию и приступить к определениям максимум через 3 часа после забора.
К образцу прилагают документацию, содержащую информацию о виде источника (колодец, скважина, природный водоем и т. д.), место пробы, правильную дату и время забора, а также точный юридический адрес источника.
Качество воды из скважины и ее состав можно определить несколькими методиками. Каждая из них устанавливает определенный показатель. Химический состав воды из скважины, водоема или колодца обычно изображают в ионной, процент-эквивалентной или эквивалентной форме. Ионная форма позволяет выразить химический состав питьевой воды в виде отдельных ионов, содержащихся в ней. Они выражаются в миллиграммах (мг) или же в граммах (гр), изредка данные могут быть предоставлены как отношение к массе и объему исследуемой жидкости.
Вода в процессе визуального исследования
Сегодня все сертифицированные лаборатории, куда доставляются пробы, предоставляют результаты гидрохимических исследований в ионной форме, которая является основным изображением состава воды. Ионная форма считается основной и используется для дальнейших переходов. Если надо выполнить перевод результатов, изображенных в виде отношения к единице объема, к составу, отнесенному к единице массы, количество отдельных ионов нужно поделить на плотность, а в случае обратного перехода — помножить.
Эквивалентная форма изображения результатов и получила значительное распространение. Она дает развернутое представление о свойствах воды, позволяет определить содержание ионов и установить происхождение вод. Форма используется в аналитических целях и позволяет контролировать результаты.
Чистая водопроводная вода
Эквивалент иона представляет собой частное от деления ионной массы на валентность иона. В качестве примера можно рассмотреть содержание иона натрия в эквивалентном виде иона: Na+ = 23/1, а эквивалент иона С = 35,5/1, из этого следует вывод, что на 23 единицы массы иона Na+ приходится 35,5 единицы иона, выраженных в эквивалентах. Исходя из этого, нужно отметить, что для перехода от ионной формы к эквивалентному изображению результатов нужно разделить количество иона, выраженное в миллиграммах (мг) или граммах (гр), на величину эквивалента иона.
Вода с избыточным содержанием железа и меди
Процент-эквивалентная форма позволяет более наглядно показать ионно-солевой состав, соотношение между ионами, а также определяет черты сходства вод с различной величиной минерализации, что делает данную форму наиболее распространенной. Но изображение содержания солей в составе исследуемых жидкостей только в одной из вышеперечисленных форм не дает возможности установить абсолютное содержание ионов в воде. По этой причине желательно предоставить результаты исследований, изобразив их в эквивалентной и ионной формах.
Многообразные химические соединения имеют разную степень токсичности и могут негативно влиять на работу органов человеческого организма, а в некоторых случаях становятся причиной летального исхода. Влияние на человеческий организм.
Образец готовых результатов лабораторного протокола анализа воды
В связи с этим фактом принимают еще один показатель вредности воды – колониеобразующие единицы КОЕ. Показатель КОЕ в воде выявляет единичные микроорганизмы, способные образовывать колонии.
Все предельно допустимые концентрации (ПДК) веществ, содержащихся в составе воды, нормируются по ГОСТ 2874-82 и СанПиН 2.1.4.1074-01. При этом для расшифровки результатов возможно использовать нормативные документы, одобренные Всемирной организации здравоохранения (ВОЗ). Результат анализа в обязательном порядке должен содержать информацию о классе опасности каждого из компонентов.
Широко используют метод микробиологического анализа. Он позволяет установить качество воды из скважины и водопроводной жидкости благодаря способу мембранной фильтрации. Вода пропускается через специальную мембрану с размером сетки 0,65 мкм. Все микроорганизмы остаются на фильтре.
Для каких источников может быть назначен данный вид исследования:
- Централизованный водопровод. Исследование проводят, если имеется информация о вероятном заражении воды.
- Автономные источники, такие как скважины или колодцы. Анализ необходим в обязательном порядке и требует регулярного проведения для своевременной очистки и дезинфекции.
- Жидкости, расфасованные в тару (бутилированная вода), проверяют микробиологическим исследованием для поддержания и повышения качества.
- Стоки рекомендуется исследовать для оценки воздействия человеческой деятельности на внешнюю среду.
Микробиологическое загрязнение обычно происходит из-за воздействия промышленности, фермерских хозяйств и канализационных стоков. Анализ дает возможность своевременно провести мероприятия по очистке и предотвратить негативное воздействие на человека.
При обустройстве новой скважины микробиологический анализ необходимо выполнить дважды. Первый забор производят сразу после бурения скважины – для определения типа очистного оборудования. После подбора и установки фильтра, а также настройки систем водоподготовки проверка воды на качество нужна для того, чтобы дать оценку эффективности используемого оборудования и определить качество очищенной воды.
В дальнейшем в течение первого года работы рекомендуется проводить исследования не реже чем один раз в квартал (3 месяца). В дальнейшем как минимум раз в 12 месяцев. Своевременный контроль качества позволяет снизить риск заболеваемости и смертности, так как состав воды постоянно меняется, просочившиеся загрязненные грунтовые воды могут содержать бактерии и иные вредные примеси. Воду из колодца необходимо проверять бактериологическим методом как минимум 1 раз в 10-12 месяцев.
Забор пробы на микробиологические исследования имеет ряд отличий от забора для проведения химического исследования. Для получения наиболее точного результата рекомендуется придерживаться следующих требований:
- Использовать для забора только стерильную емкость, такую же как для химического анализа. Обычно объем тары не превышает 0,5 литра. Оптимальным вариантом будет использование емкости, приобретенной в лаборатории, в которой будет проводиться исследование.
- При использовании собственной тары необходимо заранее ее подготовить. Для этого емкость стерилизуют при помощи пара, кипятка или духового шкафа.
- Перед тем как сдать воду на анализ водопроводный кран необходимо обеззаразить спиртом и огнем, так как состав водопроводной воды подвержен изменениям под действием внешних бактерий. Затем нужно спустить воду в течение 5-6 минут, чтобы избавиться от застоявшейся в трубах воды.
- После забора емкость плотно закрывают.
- Запрещено прикасаться к горловине и внутренней стороне крышки емкости.
Стандартный средний состав морской воды с солесодержанием 35 г/л
Необходимо как можно быстрее доставить образец в лабораторию, если нет возможности сделать анализ воды в течение двух часов, пробу помещают в холодильник, где она может сохранить свои свойства на протяжении одного дня. Так же как и образец для химического анализа, пробу для микробиологического исследования в обязательном порядке сопровождает соответствующая документация. Образец для исследования доставляют в лабораторию ближайшего отделения СЭС, где можно сделать развернутый анализ. Для наиболее быстрого получения результатов желательно заранее договориться с выбранной лабораторией.
Особое место в исследовании должно занимать качество воды, критерии качества воды должны соответствовать нормативным рамкам, установленным действующим ГОСТом. Согласно формулировке ГОСТ 27065-86, под критериями качества воды понимают один или группу характерных признаков, позволяющих дать оценку ее качества. Исходя из предполагаемого назначения скважины, водоема или колодца выделяют несколько критериев, согласно которым производят оценку качества воды, основными из них являются:
- Гигиенический критерий, согласно которому учитывают общую безопасность, в том числе с точки зрения токсикологии, эпидемиологии и радиологии. Также критерий позволяет оценить благоприятные свойства и влияние на организм человека.
- Экологический критерий позволяет оценить воздействие колодца или скважины на окружающую среду и рассчитать ориентировочный срок службы водного объекта.
- Экономический критерий оценивает финансовую прибыльность источника.
- Рыбохозяйственный – дает возможность оценить качество воды различных предприятий рыбного промысла или при выборе воды для аквариумов и рыбных вольеров, что позволяет оценить возможность развития рыб и других водных животных.
Основным критерием качества принято считать гигиенический. Показатели этого критерия качества оценивают на всех этапах строительства, а также для определения качества водопроводной и питьевой (в том числе бутилированной) воды.
Гигиенические требования к питьевой воде централизованного водоснабжения устанавливаются СанПиН 2.1.4.559-96. Согласно нормативному документу, вода должна иметь безвредный химический состав и отвечать всем критериям радиационной и эпидемической безопасности.
Все данные нормативов были приняты по требованиям ВОЗ.
источник
Химический анализ воды на 13 показателей. 1. Мутность — показатель содержания в воде различных взвешенных веществ (минерального происхождения) песок, глина, карбонатов различных металлов, гидроокиси железа. 2. Цветность — Сильно влияет на эту характеристику в воде вымываемых из почвы органических веществ (гуминовых и фульвовых кислот, в основном) железа и других металлов. 3. Запах — за счет присутствия в ней растворенных газов, органических веществ, минеральных солей, химических техногенных загрязнений. 4. Общее железо — Суммарное железо в воде двух и трехвалентного на 1 литр 5. Железо двухвалентное — растворенное в воде железо не должно быть больше 0,3 миллиграмма на литр, то пить такую воду не безопасно для организма. 6. Железо трехвалентное — не растворенное в воде выпавшее в момент соприкосновения воды с атмосферным кислородом. Выпадение в качестве осадка. 7. Общая жесткость — суммарное количество солей жесткости в воде на 1 литр 8. Кальций -количество в миллиграммах на 1 литр 9. Магний -количество в миллиграммах на 1 литр 10. Марганец -количество в миллиграммах на 1 литр как правило присутствует в воде вместе с железом 11. PH воды — общая щелочность и кислотность воды 12. Перманганатная окисляемость воды — наличие в воде вредной органики, бактерий, гуминовых соединений, не должна превышать 5 мг О2/л 3 13. Сухой остаток — Общая минерализация — количественный показатель растворенных в 1 л воды веществ (неорганических солей, органических веществ — кроме газов).
Стоимость 950 рублей. Выдается протокол образца СанПиН 2.1.4.1074-01, 2.1.4.1175-02 Для чего делается именно анализ на 12 показателей? Ответ: Для того, чтобы правильно подобрать засыпку или систему, которая будет очищать вашу воду максимально эффективно, здесь играют очень важную роль такие показатели как:(pH, марганец, соли жесткости, перманганатная окисляемость, наличие двух и трех валентного железа, сероводород). Каждая засыпка по разному себя проявляет при наличии в воде данных соединений и может оказаться бесполезной тратой денег, что повлечет в последствии лишние траты на переделку системы. Каждый дополнительный показатель + 140 рублей к общему анализу воды.Перечень дополнительных показателей, входящих в расширенный анализ воды из скважины или колодца, включает в себя:
- Алюминий, мг/д м³
- Кадмий, мг/д м³
- Медь, мг/д м³
- Мышьяк, мг/д м³
- Ртуть, мг/д м³
- Свинец, мг/д м³
- Натрий, мг/д м³
- Калий, мг/д м³
- Нитраты, мг/д м³
- Нитриты, мг/д м³
- Щелочность, ммоль/д м³
- Гидрокарбонаты, мг/д м³
- Нефтепродукты, мг/д м³
- Аммиак (по азоту), мг/д м³
- Сульфаты, мг/д м³
- Хлориды, мг/д м³
- Фториды, мг/д м³
- Сульфиды (сероводород), мг/д м³
Традиционно показатели качества воды подразделяют на физические (температура, цветность, вкус, запах, мутность и т.д.). Химические (водородный показатель воды pH, щелочность, жесткость, общее железо, железо двух валентное, трехвалентное, окисляемость, общая минерализация сухой остаток и другие). И санитарно-бактериологические (общая бактериальная загрязненность воды, количество-индекс, содержание в воде токсичных и радиоактивных компонентов и др.). Для определения, насколько вода соответствует требуемым нормам, документально устанавливаются численные значения показателей качества воды, с которыми производится сравнение измеренных показателей. Нормативно-техническая литература, составляющая водно-санитарное законодательство, предъявляет конкретные требования к качеству воды – в зависимости от ее назначения. К таким документам относятся «Питьевая вода» СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения».. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества», СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды не централизованного водоснабжения. Санитарная охрана источников». Согласно требованиям СанПиН питьевая вода должна быть безвредной по своему химическому составу, безопасной в радиационном и эпидемиологическом отношении, а также обладать приятным вкусом и запахом. Поэтому для сохранения собственного здоровья так важно знать, что за воду вы пьете. Для этого ее надо сдать на анализ – проверить, насколько вода соответствует требованиям санитарных норм и правил. Рассмотрим подробно параметры, по которым оценивается качество воды. Физические показатели качества воды: Температура воды поверхностных источников определяется температурой воздуха, его влажностью, скоростью и характером движения воды (а также рядом других факторов). В зависимости от времени года она может претерпевать значительные изменения (от 0,1 до 18º С). Для подземных источников температура воды отличается большей стабильностью (4-12 º С). Оптимальная температура воды для питьевых целей составляет 6-12 ºС. Мутность – Показатель содержания в воде различных взвешенных веществ (минерального происхождения – частиц глины, ржавчины, осадочного железа, песка, ила; неорганического происхождения – карбонатов различных металлов, гидроокиси железа; органического происхождения — планктона, водорослей и др.). Попадание взвешенных веществ в воду колодцев происходит вследствие размыва берегов и дна реки, поступления их с талыми, дождевыми и сточными водами. В летнем трубопроводе на зимний период отключают воду, труба ржавеет, и впервые месяцы вымывается большое количество не растворенного железа. Подземные источники глубокого происхождения, имеют, как правило, небольшую мутность воды за счет наличия в ней взвеси гидроксида железа. Для поверхностных вод мутность чаще обуславливается присутствием ЗОО — и фитопланктона, илистых или глинистых частиц; ее величина колеблется в течение года. Мутность воды обычно выражается в миллиграммах на литр (мг/л); ее величина для питьевой воды по нормам СанПиН 2.1.4.559-96 не должна превышать 1,5 мг/л. Для ряда производств пищевой, медицинской, химической, электронной промышленности используется вода такого же или более высокого качества. В то же время во многих производственных процессах допустимо использование воды с повышенным содержанием взвешенных веществ. Цветность воды — показатель, характеризующий интенсивность окраски воды. Он измеряется в градусах по платиново-кобальтовой шкале, при этом исследуемая проба воды сравнивается по окраске с эталонными растворами. Цветность воды обуславливается присутствием в ней примесей как органической, так и неорганической природы. Сильно влияет на эту характеристику наличие в воде вымываемых из почвы органических веществ (гуминовых и фульвовых кислот, в основном); железа и других металлов прошедших окисление атмосферным воздухом ; техногенных загрязнений из промышленных сточных вод. Требование СанПиН2.1.4.1074-01 «Питьевая вода – цветность питьевой воды должна быть не более 20º. Отдельные виды промышленности ужесточают требования к величине цветности воды. Запах и привкус воды – эта характеристика определяется органолептическим (с помощью органов чувств), поэтому она достаточно субъективна. Запахи и привкус, которыми может обладать вода, появляются за счет присутствия в ней растворенных газов, органических веществ, минеральных солей, химических техногенных загрязнений. Интенсивность запахов и привкусов определяются по пятибалльной шкале или по «порогу разбавления» испытуемой пробы воды дистиллированной водой. При этом устанавливается кратность разбавления, необходимая для исчезновения запаха или привкуса. Определение запаха и вкуса происходит с помощью непосредственного дегустирования при комнатной температуре, а также при температуре 60º С, вызывающей их усиление. Питьевая вода при 60º С не должна иметь привкус и запах более 2-х баллов ( требования ГОСТ 2874-82). В соответствии с 5-ти бальной шкалой: при 0 баллов — запах и привкус не обнаруживается; при 1 балле вода имеет очень слабые запах или привкус, обнаруживаемые только опытным исследователем; при 2-х баллах имеются слабые запах или привкус, очевидные и для неспециалиста; при 3-х баллах легко обнаруживаются заметные запах или привкус (что и является причиной жалоб на качество воды); при 4-х баллах различаются отчётливые запах или привкус, могущие заставить воздержаться от употребления воды; при 5-ти баллах вода имеет такие сильные запах или привкус, что становится совершенно непригодной для питья. Вкус воды обусловлен наличием в ней растворенных веществ, придающий ей определенный привкус, который может быть солоноватым, горьковатым, сладковатым и кисловатым. Природные воды имеют, как правило, только солоноватый и горьковатый привкус. Причем солоноватый привкус появляется у воды, содержащей хлорид натрия, а горьковатый привкус дает избыток сульфата магния. Вода с большим количеством растворённой углекислоты (т.н. минеральные воды) имеет кислый вкус. Вода с чернильным или железистым привкусом насыщена солями железа и марганца; вяжущий привкус ей придает сульфат кальция, перманганат калия; щелочной привкус вызывается содержанием в воде соды, поташи, щелочи. Привкус может иметь естественное происхождение (присутствие марганца, железа, метана, сероводорода и т.д.) и искусственное происхождение (при сбросе промышленных стоков). Требования СанПиН 2.1.4. 1074-01 «Питьевая вода» — привкус не более 2 баллов. Запахи воде придают различные живущие и отмершие организмы, растительные остатки, специфические веществами, выделяемые некоторыми водорослями и микроорганизмами, а также присутствие в воде растворенных газов, таких как хлор, аммиак, сероводород, меркаптаны или органических и хлорорганических загрязнений. Запахи бывают природного (естественного) и искусственного происхождения. К первым относятся такие запахи, как древесный, ароматический, землистый, болотный, плесневый, гнилостный, травянистый, рыбный, неопределённый и сероводородный и др. Запахи искусственного происхождения получают свое название по определяющим их веществам: камфорный, фенольный, хлорный, смолистый, аптечный, хлор-фенольный, запах нефтепродуктов и т. д. Требования СанПиН 2.1.4. 1074-01 к питьевой воде — запах не более 2 баллов. Химические показатели качества воды Общая минерализация (сухой остаток). Общая минерализация — количественный показатель растворенных в 1 л воды веществ (неорганических солей, органических веществ — кроме газов). Этот показатель также называют общим солесодержанием. Его характеристикой является сухой остаток, получаемый в результате выпаривания профильтрованной воды и высушивании задержанного остатка до постоянной массы. Российскими нормативами допускается минерализация воды, используемой для хозяйственно-питьевых целей, не более 1000 — 1500 мг/л. Сухой остаток для питьевой воды не должен превышать 1000 мг/л. Активная реакция воды pH (степень её кислотности или щёлочности) определяется соотношением существующих в ней кислых (водородных) и щелочных (гидроксильных) ионов. При ее характеристике пользуются рН – водородным и гидроксильным показателями, определяющими, соответственно, кислотность и щелочность воды. Величина водородного показателя pH равна отрицательному десятичному логарифму концентрации водородных ионов в воде. При равном количестве кислотных и щелочных ионов, реакция воды нейтральная, а значение pH=7. При рН 7,0 – щелочную. Нормы СанПиН 2.1.4. 1074-01 требуют, чтобы значение рН питьевой воды находилось в пределах 6,0. 9,0. Большинство природных источников имеют значение рН в указанных пределах. Однако активная обработка воды реагентами может вызвать существенное изменение значения рН. Правильная оценка качества воды и точный выбор способа ее очистки предполагает знание рН воды источников в различные периоды года. Вода с низкими значениями рН оказывает сильное коррозирующее воздействие на сталь и бетон. Часто качество воды описывается через такой термин, как жесткость. Требования к качеству воды по показателю жесткости в России и Европе очень сильно различаются: 7 мг-экв/л (по российским нормам) и 1 мг-экв/л (директива Совета ЕС). Повышенная жесткость представляет собой самую распространенную проблему качества воды. Пример: Кронштадт, Ломоносов, Красное Село, Гатчина, высокое содержание кальция в воде и невозможность употребления такой воды не в технических не в пищевых целях без специальной фильтрации воды или использования ионообменных смол и полифосфатов. Жесткость воды – показатель, характеризующий содержание в воде солей жесткости (главным образом, кальция и магния). Он измеряется в миллиграмм-эквивалентах на литр (мг-экв/л). Различают такие понятия как карбонатная (временная) жесткость, не карбонатная (постоянная) жесткость и общая жесткость воды. Карбонатная жесткость (устранимая) – показатель наличия в воде гидрокарбоната кальция и магния. При кипячении воды происходит его разложение с образованием малорастворимых солей и углекислого газа. Некарбонатная или постоянная жесткость определяется содержанием в воде некарбонатных солей кальция и магния — сульфатов, хлоридов, нитратов. При кипячении воды они не выпадают в осадок и остаются в растворе. Общая жесткость – суммарная величина содержания в воде солей кальция и магния; представляет собой сумму карбонатной и некарбонатной жесткости. В зависимости от величины жесткости вода характеризуется как: Величина жесткости воды значительно варьирует в зависимости от того, какие типы пород и почв слагают бассейн водосбора; от погодных условий и сезона года. Так, в поверхностных источниках вода, как правило, относительно мягкая (3. 6 мг-экв/л) и зависит от расположения — чем южнее, тем выше жесткость воды. Жесткость подземных вод меняется в зависимости от глубины и расположения горизонта водоносного слоя и величины годового объема осадков. В слое известняка жесткость воды обычно составляет 6 мг-экв/л и более. Жесткость питьевой воды (по нормам СанПиН 2.1.4. 1074-01 )-не должна превышать 7,0 мг-экв/л. Жесткая вода из-за избытка кальция обладает неприятным вкусом. Опасность постоянного употребления воды с повышенной жесткостью — в снижении моторики желудка, накоплении солей в организме, риске заболевания суставов (артриты, полиартриты) и образования камней в почках и желчных путях. Правда, очень мягкая вода также не полезна. Мягкая вода, обладающая большой активностью, способна вымывать кальций из костей, что ведет к их ломкости; развитию рахита у детей. Еще одним неприятным свойством мягкой воды является ее способность при прохождении через пищеварительный тракт вымывать также полезные органические вещества, в том числе и полезные бактерии. Оптимальный вариант — вода жесткостью 1,5-2 мг-экв/л. Уже общеизвестно, что нежелательно использовать жесткую воду для хозяйственных целей. Такие последствия, как налет на сантехнических приборах и арматуре, образование накипи в водонагревательных системах и приборах – очевидны! Образование осадка кальциевых и магниевых солей жирных кислот при хозяйственно-бытовом использовании жесткой воды приводит к значительному росту расхода моющих средств и замедлению процесса приготовления пищи, что проблемно для пищевой промышленности. В ряде случаев использование жесткой воды в производственных целях (в текстильной бумажной промышленности, на предприятиях искусственного волокна, для питания паровых котлов и др.) запрещается из-за нежелательных последствий. Использование жесткой воды уменьшает срок службы водонагревательной техники (бойлеров, батарей центрального водоснабжения и др.). Отложение солей жесткости (гидрокарбонатов Ca и Mg) на внутренних стенках труб, накипные отложения в водонагревательных и охлаждающих системах уменьшают проходное сечение, снижают теплоотдачу. В системах оборотного водоснабжения не допускается использовать воду с высокой карбонатной жесткостью. Щёлочность воды. Общая щёлочность воды – это сумма содержащихся в ней гидратов и анионов слабых кислот (кремниевой, угольной, фосфорной и т.д.). При характеристике подземных вод в подавляющем большинстве случаев используют гидрокарбонатную щёлочность, то есть содержание в воде гидрокарбонатов. Формы щелочности: бикарбонатная, карбонатная и гидратная. Определение щелочности (мг-экв/л) производится в целях контроля качества питьевой воды; для определения пригодности воды для полива; для расчета содержания карбонатов, для последующей очистки сточных вод. ПДК по щелочности 0,5 — 6,5 ммоль / дм3. Содержание сульфатов и хлоридов. Сульфаты и хлориды кальция и магния образуют соли некарбонатной жесткости. Хлориды – их присутствие наблюдается практически во всех водах. Их наличие в воде объясняется вымыванием из горных пород хлорида натрия (поваренной соли), очень распространённой на Земле соли. Значительное количество хлоридов натрия содержится в морской воде, а также в воде некоторых озер и подземных источников. В зависимости от стандарта ПДК хлоридов в питьевой воде равняется 300. 350 мг/л. Повышенное содержание хлоридов с одновременным присутствием в воде нитритов, нитратов и аммиака встречается в случае загрязнённости источника бытовыми сточными водами. Сульфаты наличествуют в подземных водах, как результат растворения гипса, имеющегося в пластах. При избыточном содержании сульфатов в воде у человека возникает расстройство желудочно-кишечного тракта (эти соли обладают слабящим эффектом). ПДК сульфатов в питьевой воде составляет 500 мг/л. Содержание кремниевых кислот. Кремниевые кислоты различной формы (от коллоидной до ионодисперсной) встречаются в воде подземных и поверхностных источников. Кремний имеет малую растворимость, и его содержание в воде, как правило, невелико. Попадание кремния в воду происходит также с промышленными стоками предприятий, осуществляющих производство керамики, цемента, стекольных изделий, силикатных красок. ПДК кремния составляет 10 мг/л. Использование воды, содержащей кремниевые кислоты, запрещено для питания котлов высокого давления – из-за образования силикатной накипи на стенках. Фосфатов в воде обычно немного, поэтому их повышенное содержание сигналит о возможном загрязнении промышленными стоками или стоками с сельскохозяйственных полей. При повышенном содержании фосфатов усиленно развиваются сине-зелёные водоросли, выделяющие токсины в воду при отмирании. ПДК соединений фосфора в питьевой воде — 3,5 мг/л. Фториды и йодиды. Фториды и йодиды имеют некоторую схожесть. Недостаток или избыток этих элементов в организме человека приводит к серьёзным заболеваниям. Например, недостаток (избыток) йода провоцирует заболевания щитовидной железы («зоб»), развивающиеся, когда суточный рацион йода менее 0,003 мг или более 0,01 мг. Фториды содержатся в минералах — солях фтора. Содержание фтора в питьевой воде для сохранения здоровья человека должно находиться в пределах 0,7 — 1,5 мг/л (зависит от климата). Поверхностные источники имеют, преимущественно, низкое содержание фтора (0,3-0,4 мг/л). Содержание фтора в поверхностных водах повышается следствие сброса промышленных фторсодержащих сточных вод или при контакте вод с почвами, насыщенными соединениями фтора. Так, артезианские и минеральные воды, контактирующие со фторсодержащими водовмещающими породами, имеют максимальную концентрацию фтора 5-27 мг/л и более. Важной характеристикой для здоровья человека является количество фтора в его суточном рационе. Обычно содержание фтора в суточном рационе составляет от 0,54 до 1,6 мг фтора (усреднено — 0,81 мг). Стоит отметить, что в организм человека с пищевыми продуктами поступает в 4-6 раз меньше фтора, чем с питьевой водой, имеющей оптимальное его содержание (1 мг/л). При повышенном содержании фтора в воде (более 1,5 мг/л) появляется опасность развития у населения эндемического флюороза (т.н. «пятнистой эмали зубов»), рахита и малокровия. Эти заболевания сопровождаются характерным поражением зубов, нарушением процессов окостенения скелета, истощением организма. Поэтому в питьевой воде содержание фтора лимитируется. Фактом является и то, некоторое содержание фтора в воде необходимо для снижения уровня заболеваний, определяемых последствиями одонтогенной инфекции (сердечнососудистая патология, ревматизм, заболевания почек и др.). При употреблении воды с содержанием фтора менее 0,5 мг/л развивается кариес зубов, поэтому в таких случаях врачи рекомендуют пользоваться фторсодержащей зубной пастой. Фтор лучше усваивается организмом из воды. Исходя из вышеизложенного, оптимальной дозой фтора в питьевой воде является величина 0,7. 1,2 мг/л. ПДК фтора — 1,5 мг/л. Окисляемость Перманганатная – параметр, обусловленный присутствием в воде органических веществ; отчасти он может сигнализировать о загрязнённости источника сточными водами. Количественное значение этих показателей и их соотношение позволяет косвенно судить о природе присутствующих в воде органических соединениях, веществ, а так же способах и эффективности очистки воды. Этот показатель отражает общую концентрацию органики в воде. Природа органических веществ может быть самой разной — и гуминовые кислоты почв, и сложная органика растений, и химические соединения антропогенного происхождения. Для определения конкретных соединений используются другие методы. Перманганатная окисляемость выражается в миллиграммах кислорода, пошедшего на окисление этих веществ, содержащихся в 1 дм3 воды. Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную. Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах — как правило, бихроматную окисляемость (ХПК — «химическое потребление кислорода»). Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными. Это понятно — органика из почвы и растительного легче попадает в поверхностные воды, чем в грунтовые, чаще всего ограниченные глинистыми водоупорами. Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием — десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2 /дм3. Хотя подземные воды в районах нефтегазовых месторождений, и торфяников могут иметь очень высокую окисляемость. По требованиям СанПиН: величина перманганатной окисляемости воды не должна превышать 5,0 мг О2/л. Вода с перманганатной окисляемостью менее 5 мг О2/л считается чистой, так как СЭС оставляет определенные допуски по нормам для различных районов с превышениями, более 5 мг О2/л грязной. Но лучше по возможности снизить ее до минимума. Содержание соединений железа. В природных водах железо может встречаться в следующих видах: — в истинно растворённом виде (двухвалентное железо Fe2+). Содержится обычно в артезианских скважинах (отсутствует растворенный кислород). Вода прозрачная бесцветная. Если содержание такого железа в ней высокое, то при отстаивании или нагреве вода становится желтовато-бурой; — в нерастворённом виде (трёхвалентное железо Fe3+ ) содержится в поверхностных источниках водоснабжения. Вода прозрачная — с коричневато-бурым осадком или ярко выраженными хлопьями; — в коллоидном состоянии или виде тонкодисперсной взвеси. Вода мутная, окрашенная, желтовато-коричневая опалесцирующая. Коллоидные частицы, находясь во взвешенном состоянии, не выпадают в осадок даже при длительном отстаивании; — в виде так называемой железоорганики — солей железа и гуминовых и фульвокислот. Вода прозрачная, желтовато-коричневая; — железобактерии, образующие коричневую слизь на водопроводных трубах. Содержание железа в поверхностных водах средней полосы России — от 0,1 до 1,0 мг/дм 3 железа; в подземных водах эта величина достигает 15-20 мг/дм 3 и более. Важно проведение анализа на содержание железа в сточных водах. Особенно «засоряют» водоемы железом сточные воды предприятий металлообрабатывающей, металлургической, лакокрасочной промышленности, текстильной, а также сельскохозяйственные стоки. На концентрацию железа в воде влияют величина рН и содержание кислорода в воде. В колодезной и скважинной воде железо может находиться в окисленной и в восстановленной форме, двух и трех валентное, однако при отстаивании воды оно всегда окисляется и может выпадать в осадок. СанПиН 2.1.4. 1074-01 допускают общее содержание железа не более 0,3 мг/л. Считается, что железо не токсично для человеческого организма, но при длительном употреблении воды с избыточным содержанием железа может произойти отложение его соединений в тканях и органах человека. Вода, загрязненная железом, имеет неприятный вкус, приносит неудобства в быту. На ряде промышленных предприятий, использующих воду для промывки продукта при его изготовлении, например, в текстильной промышленности, даже небольшое содержание железа в воде значительно снижает качество продукции. Марганец Встречается в воде в аналогичных модификациях. Марганец – это металл, активизирующий ряд ферментов, участвующий в процессах дыхания, фотосинтеза, влияющий на кроветворение и минеральный обмен. При недостатке марганца в почве у растений наблюдаются хлорозы, некрозы, пятнистости. Поэтому почвы, бедные марганцем (карбонатные и пере известкованные), обогащаются марганцевыми удобрениями. Для животных недостаток этого элемента в кормах приводит к замедлению роста и развития, нарушению минерального обмена, развитию анемии. Человек страдает как от недостатка, так и от переизбытка марганца. Нормы СанПиН 2.1.4. 1074-01 допускают содержание марганца в питьевой воде не более 0,1 мг/л. Переизбыток марганца в воде может вызвать заболевание костной системы человека. Такая вода имеет неприятный металлический привкус. Ее длительное употребление приводит к отложению марганца в печени. Присутствие в воде марганца и железа способствует образованию железистых и марганцевых бактерий, продукты жизнедеятельности которых в трубах и теплообменных аппаратах вызывают уменьшение их сечения, иногда и полную их закупорку. Вода, используемая в пищевой, текстильной промышленности, при производстве пластмасс и др., должна содержать строго ограниченное количество железа и марганца. Также переизбыток марганца приводит к окрашиванию белья при стирке, образованию черных пятен на сантехнике и посуде. Натрий и калий — попадание этих элементов в подземные воды происходит в процессе растворения коренных пород. Основной источник натрия в природных водах — залежи поваренной соли NaCl, возникшие в местах нахождения древних морей. Калий в водах встречается реже – из-за его поглощения почвой и растениями. Натрий играет важную биологическую роль для большинства форм жизни на Земле, в том числе и для человека. Человеческий организм содержит примерно 100 г натрия. Ионами натрия выполняется задача активизации ферментативного обмена в организме человека. По нормам СанПиН 2.1.4. 1074-01 ПДК натрия — 200 мг/л. Избыток натрия в воде и пище провоцирует у человека развитие гипертензии и гипертонии. Калий способствует усилению выведения воды из организма. Это его свойство используется для облегчения функционирования сердечнососудистой системы при ее недостаточности, исчезновения или существенного уменьшения отеков. Недостаток калия в организме приводит к нарушениям функций нервно-мышечной (параличи и парезы) и сердечнососудистой систем и способствует депрессии, дискоординации движений, мышечной гипотонии, судорогам, артериальной гипотонии, изменениям на ЭКГ, нефритам, энтеритам и др. ПДК калия — 20 мг/л. Медь, цинк, кадмий, мышьяк, свинец, никель, хром и ртуть – попадание этих элементов в источники водоснабжения происходит преимущественно с промышленными стоками. Рост содержания меди и цинка может также являться следствием коррозии оцинкованных и медных водопроводных труб в случае повышенного содержания агрессивной углекислоты. По нормам СанПиН ПДК этих элементов составляет: для меди — 1,0 мг/л; цинка — 5,0 мг/л; свинца — 0,03 мг/л; кадмия — 0,001 мг/л; никеля — 0,1 мг/л (в странах ЕС — 0,05 мг/л), мышьяка — 0,05 мг/л; хрома Cr3+ — 0,5 мг/л, ртути — 0,0005 мг/л; хрома Cr4+ — 0,05 мг/л. Все эти соединения — тяжёлые металлы, обладающие кумулятивным действием, то есть они имеют свойство накапливаться в организме. Кадмий очень токсичен. Накопление кадмия в организме может приводить к таким заболеваниям, как анемия, поражение печени, почек и легких, кардиопатия, эмфизема легких, остеопороз, деформация скелета, гипертония. Избыток этого элемента провоцирует и усиливает дефицит Se и Zn. Симптомами кадмиевого отравления являются поражение центральной нервной системы, белок в моче, острые костные боли, дисфункция половых органов. Все химические формы кадмия представляют опасность. Алюминий – легкий металл серебристо-белого цвета. В первую очередь его попадание в воду происходит в процессе водоподготовки — в составе коагулянтов и при сбросе сточных вод переработки бокситов. В воде ПДК солей алюминия составляет 0,5 мг/л. При избытке алюминия в воде происходит повреждение центральной нервной системы человека. Бор и селен – присутствие этих элементов в некоторых природных водах обнаруживается в весьма незначительной концентрации. Необходимо помнить, что их повышенная концентрация приводит к серьёзному отравлению. Содержание газов. Вода природных источников содержит чаще всего следующие газы: кислород О2, диоксид углерода (углекислый газ) СО2 , сероводород Н2S. Кислород пребывает в воде в растворенном виде. В подземных водах растворенный кислород отсутствует. Его содержание в поверхностных водах зависит от температуры воды, а также определяется интенсивностью процессов обогащения или обеднения воды кислородом, достигая до 14 мг/л. Даже значительное содержание кислорода и двуокиси углерода не ухудшает качество питьевой воды, способствуя, в то же время, росту коррозии металла. Повышение температуры воды, а также ее подвижность усиливают процесс коррозии. Повышенное содержание в воде агрессивной двуокиси углерода делает подверженными коррозии также стенки бетонных труб и резервуаров. Присутствие кислорода не допустимо в питательной воде паровых котлов среднего и высокого давления. Сероводород имеет свойство придавать воде характерный неприятный запах и вызывать коррозию металлических стенок котлов, баков и труб. Из-за этого не допускается присутствие сероводорода в воде хозяйственно-питьевого назначения и в воде для большинства производственных нужд. Вещества, содержащиеся в воде и их свойства, ухудшающие качество питьевой воды и вредно влияющие на организм человека. Соединения азота. К азотосодержащим веществам относятся нитриты NO2 — , нитраты NO3 — и аммонийные соли NH4 + , почти всегда присутствующие во всех водах, в том числе подземных. Их наличие свидетельствует о том, что в воде имеются органические вещества животного происхождения. Эти вещества образуются в результате распада органических примесей, преимущественно — мочевины и белков, которые попадают в воду с бытовыми сточными водами. Рассматриваемая группа ионов находится в тесной взаимосвязи. Первый продукт распада — аммиак (аммонийный азот), образуется в результате распада белков и является показателем свежего фекального загрязнения. Окисление ионов аммония до нитратов и нитритов в природной воде осуществляется бактериями Nitrobacter и Nitrosomonas. Нитриты — лучший показатель свежего фекального загрязнения воды, особенно если одновременно повышенно содержание аммиака и нитритов. Нитраты -показатель более давнего органического фекального загрязнения воды. Содержание нитратов вместе с аммиаком и нитритами недопустимо. Таким образом, наличие, количество и соотношение в воде азотсодержащих соединений позволяет судить о том, как сильно и как давно вода заражена продуктами жизнедеятельности человека. При отсутствии в воде аммиака и, в то же время, наличии нитритов и особенно нитратов можно сделать вывод, что водоем подвергся загрязнению давно, и за это время произошло самоочищение воды. Если в водоеме присутствует аммиак и нет нитратов, значит, загрязнение воды органическими веществами случилось недавно. В питьевой воде не допускается содержание аммиака и нитритов. ПДК в воде: аммоний — 2,0 мг/л; нитриты — 3,0 мг/л; нитраты — 45,0 мг/л. Если концентрация иона аммония в воде превышает фоновые значения, значит, загрязнение произошло недавно, а источник загрязнения находится близко. Это могут быть животноводческие фермы, коммунальные очистные сооружения, скопления азотных удобрений, навоза, поселения, отстойники промышленных отходов и др. При употреблении воды с повышенным содержанием нитратов и нитритов у человека нарушается окислительная функция крови. Хлор вводится в питьевую воду при её обеззараживание. Обеззараживающее действие хлор проявляет, окисляя или хлорируя (замещая) молекулы веществ, входящие в состав цитоплазмы клеток бактерий, в результате чего бактерии гибнут. Чрезвычайно чувствительными к хлору являются возбудители дизентерии, брюшного тифа, холеры и паратифов. Сравнительно малые дозы хлора дезинфицируют даже сильно заражённую бактериями воду. Однако не происходит полной стерилизации воды из-за сохраняющих жизнеспособность отдельных хлоррезистентных особей. Свободный хлор — вредное для здоровья человека вещество, поэтому в питьевой воде централизованного водоснабжения гигиеническими нормами СанПиН строго регламентируется содержание остаточного свободного хлора. СанПиН устанавливает верхнюю и минимально-допустимую границы содержания свободного остаточного хлора. Проблема в том, что, хотя воду и обеззараживают на станции водоочистки, на пути к потребителю она подвергается риску вторичного заражения. Например, в стальной подземной магистрали могут быть свищи, через которые в магистральную воду попадают почвенные загрязнения. Поэтому нормы СанПиН2.1.4. 1074-01 предусматривают содержание остаточного хлора в водопроводной воде не менее 0,3 мг/л и не более 0,5 мг/л. Хлор токсичен и является сильным аллергиком, поэтому хлорированная вода оказывает неблагоприятное воздействие на кожу и слизистые оболочки. Это и покраснения различных участков кожи, и проявления аллергического конъюктевита (отек век, жжение, слезотечение, болевые ощущения в области глаз). Хлор также вредно воздействует на дыхательную систему: в результате пребывания в бассейне с хлорированной водой в течение нескольких минут у 60% пловцов наблюдается проявление бронхоспазма. Около 10% хлора, применяющегося при хлорировании воды, образуют хлорсодержащие соединения, такие как хлороформ, дихлорэтан, четырёххлористый углерод, тетрахлоэтилен, трихлорэтан. 70 — 90 % образующихся при водоподготовке хлорсодержащих веществ составляет хлороформ. Хлороформ способствует профессиональным хроническим отравлениям с преимущественным поражением печени и центральной нервной системы. Также при хлорировании существует вероятность образования диоксинов, являющихся чрезвычайно токсичными соединениями. Высокая степень токсичности хлорированной воды многократно увеличивает риск развития онкологии. Так, американские эксперты считают хлорсодержащие вещества в питьевой воде косвенно или непосредственно виновными в 20 онкозаболеваниях на 1 млн. жителей. Сероводород встречается в подземных водах и имеет преимущественно неорганическое происхождение. В природе происходит постоянное образование этого газа при разложении белковых веществ. Он имеет характерный неприятный запах; провоцирует коррозию металлических стенок баков, котлов и труб; является общеклеточным и каталитическим ядом. При соединении с железом образует черный осадок сернистого железа FeS. Все вышесказанное является основанием для полного удаления сероводорода из воды хозяйственно-питьевого назначения. Микробиологические показатели. Общее микробное число (ОМЧ) определяется количеством бактерий, содержащихся в 1 мл воды. Согласно требованиям ГОСТ, в питьевой воде не должно содержаться более 100 бактерий в 1 мл. Количество бактерий группы кишечной палочки представляет особую важность для санитарной оценки воды. Наличие в воде кишечной палочки — свидетельство загрязнении ее фекальными стоками и, как следствие, риска попадания в нее болезнетворных бактерий. Определение наличия патогенных бактерий при биологическом анализе воды затруднено, и бактериологические исследования сводятся к определению общего числа бактерий в 1 мл воды, растущих при 37ºС, и кишечной палочки — бактерии коли. Наличие последней сигнализирует о загрязнении воды выделениями людей, животных и т.п. Минимальный объем испытуемой воды, мл, приходящейся на одну кишечную палочку, называется колититром, а количество кишечных палочек в 1 л воды — коли-индексом. По ГОСТ 2874-82 допускается коли-индекс до 3, колититр — не менее 300, а общее число бактерий в 1 мл — до 100. По нормам СанПиН допустимо общее микробное число 50 КОЕ/мл, общие колиформные бактерии (ОКБ) КОЕ/100мл и термотолетарные колиформные бактерии (ТКБ) КОЕ/100мл — не допускаются.
Патогенные бактерии и вирусы, находящиеся в воде, могут вызвать заболевания дизентерией, брюшным тифом, паратифом, амебиазом, холерой, диареей, бруцеллезом, инфекционным гепатитом, туберкулезом, острым гастроэнтеритом, сибирской язвой, полиомиелитом, туляремией и др.
источник




