HER2: биомаркер, меняющий подходы к терапии распространенного рака желудка и пищеводно–желудочного перехода
Рецептор эпидермального фактора роста 2-го типа (HER2) имеет важную прогностическую ценность при лечении распространенного рака желудка и пищеводно-желудочного перехода
- В настоящее время существует колоссальная потребность в повышении эффективности терапии распространенного рака желудка и пищеводно-желудочного перехода. Существующие стандартные методы лечения не позволяют увеличить медиану общей выживаемости пациентов более, чем на 1 год (по данным крупных международных исследований)
- В исследовании ToGA впервые было продемонстрировано беспрецедентное увеличение медианы общей выживаемости больных HER2-положительным распространенным раком желудка и пищеводно-желудочного перехода. Исследование ToGA было разработано для оценки эффективности и безопасности Герцептина в комбинации со стандартной химиотерапией в 1-й линии лечения HER2-положительного распространенного рака желудка и пищеводно-желудочного перехода
Рандомизированное исследование III фазы: дизайн исследования ToGA (n=594)
† ИГХ3+ и/или FISH+
* Кселода или в/в введение 5-ФУ на усмотрение исследователя;
ИГХ – иммуногистохимия; FISH – флуоресцентная гибридизация in situ;
РЖ – рак желудка; ПЖ переход – пищеводно-желудочный переход
- В общей популяции больных метастатическим раком желудка и пищеводно-желудочного перехода 22% опухолей являются HER2-положительными (ИГХ3+ и/или FISH+). В 16% случаев определяется гиперэкспрессия HER2 (ИГХ3+ или ИГХ2+ /FISH+)³
Герцептин увеличивает медиану общей выживаемости (ОВ) больных с гиперэкспрессией HER2 (ИГХ3+ или ИГХ2+/FISH+) до 16 месяцев
- Герцептин в сочетании с химиотерапией достоверно увеличивает общую выживаемость всех пациентов с HER2-положительным статусом опухоли (ИГХ3+ и/или FISH+)³
| Медиана | |||||
| Количество пациентов | ОВ | ОР | 95%-ный ДИ | p | |
| Химиотерапия + Герцептин | 167 | 13.8 | 0.74 | 0.60, 0.91 | 0.0046 |
| Химиотерапия | 182 | 11.1 | |||
- Наибольшее увеличение медианы общей выживаемости (ОВ) (до 16 месяцев) выявлено в подгруппе пациентов с гиперэкспрессией HER2 (ИГХ3+ или ИГХ2+/FISH+)³
| Медиана | ||||
| Количество пациентов | ОВ | ОР | 95%-ный ДИ | |
| Химиотерапия + Герцептин | 120 | 16.0 | 0.65 | 0.5, 0.83 |
| Химиотерапия | 136 | 11.8 | ||
Иммуногистохимические критерии оценки статуса HER2 при раке молочной железы не могут применяться при распространенном раке желудка и пищеводно- желудочного перехода
- Иммуногистохимические критерии оценки статуса HER2 при раке молочной железы не могут применяться при распространенном раке желудка и пищеводно- желудочного перехода 4
 |  |
| Гетерогенное окрашивание клеток опухоли желудка, экспрессирующих HER2 | Полное, базолатеральное или латеральное мембранное окрашивание |
Стандартизированные тесты для оценки статуса HER2 при распространенном раке желудка и пищеводно- желудочного перехода
Иммуногистохимический анализ (ИГХ)
- Анти HER-2/neu (4B5) (Ventana)
- HercepTest™ (Dako)
Гибридизация in situ (in situ hybridization)
- Флуоресцентная гибридизация in situ HER2 pharmDx™ (HER2 FISH pharmDx™ (Dako))
- Усиленная серебром гибридизация in situ (SISH) (INFORM™ HER2 SISH (Ventana))
- Тестовые системы CONFIRM™ anti-HER2/neu (4B5, Ventana) и INFORM™ HER2 SISH (Ventana) так же достоверно выявляют гиперэкспрессию HER2/neu и/или амплификацию гена HER2/ neu, как и тестовые системы HercepTest™ (Dako) и HER2 FISH pharmDx™ (Dako), применявшиеся для оценки HER2 статуса в исследовании ToGA 5
| Шкала | Образец, полученный при операции – характер окрашивания | Образец, полученный при биопсии – характер окрашивания | Оценка гиперэкспрессии HER2 | |
 | Нет окрашивания или мембранное окрашивание менее чем в 10% опухолевых клеток | Нет окрашивания или полное отсутствие мембранного окрашивания | Результат отрицательный | |
 | 1+ | Слабое/едва различимое частичное мембранное окрашивание в ≥10%опухолевых клеток | Слабое/едва различимое мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат отрицательный |
 | 2+ | Слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание в ≥10% опухолевых клеток | Слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат сомнительный (требуется подтверждение ISH) |
 | 3+ | Выраженное полное, базолатеральное или латеральное мембранное окрашивание в ≥10% опухолевых клеток | Выраженное полное, базолатеральное или латеральное мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат положительный |
Алгоритм определения статуса HER2 при распространенном раке желудка и пищеводно- желудочного перехода 3,4
- Все образцы опухолей больных раком желудка и пищеводно- желудочного перехода следует исследовать на статус HER2 ИГХ является методом выбора для первоначальной оценки статуса HER2
- Пациенты с уровнем экспрессии HER2 в опухоли 3+ (методом ИГХ) расцениваются как HER2-положительные. Им может быть назначен Герцептин
- Образцы с уровнем экспрессии HER2 (ИГХ2+) должны исследоваться методом гибридизации in situ (ISH) для подтверждения статуса HER2
- Пациенты с уровнем экспрессии ИГХ 2+/ISH+ в опухоли расцениваются как HER2-положительные. Им может быть назначен Герцептин
Список сокращений: ИГХ — иммуногистохимический анализ; SISH — усиленная серебром гибридизация in situ; ISH — гибридизация in situ; ОР — относительный риск; ХТ — химиотерапия
Ссылки: 1. Gravalos C, et al. Ann Oncol 2008; 19: 1523-29; 2. Tanner M, et al. Ann Oncol 2005; 16: 273-78; 3. Bang Y-J, Cutsem E, et al. The Lancet 2010; 376: 687-697; 4. — Hoffman M, et al. Histopathology 2008; 52: 797-805; 5. Powell et al. poster presented at ASCO GI 2010
Показание при раке желудка. Распространенная аденокарцинома желудка или ПЖ перехода с опухолевой гиперэкспрессией HER2 в комбинации с капецитабином или в/в введением 5-ФУ и препаратом платины в случае отсутствия предшествующей противоопухолевой терапии по по- воду метастатической болезни. Противопоказания. Повышенная чувствительность к трасту- зумабу или любому другому компоненту препарата. Побочное действие со стороны организма в целом: боли в животе, слабость, боли в грудной клетке, озноб, лихорадка, головные боли, боли; со стороны системы пищеварения: диарея, тошнота, рвота; со стороны костно-мышечной системы: артралгия, миалгия; со стороны кожи и подкожно-жировой клетчатки: сыпь. Полная информация о препарате представлена в инструкции по медицинскому применению.
источник
Карциномы ЖКТ
Колоректальный рак является третьим по частоте диагностируемым раком в Соединенных Штатах (за исключением рака кожи) среди мужского и женского населения. Показатели заболеваемости колоректальным раком снижаются на протяжении последних двух десятилетий (с 66,3 случаев на 100000 человек в 1985 году до 45,5 случаев в 2006 году). Это связывают с увеличением использования колоректальных скрининг-тестов, которые позволяют обнаруживать и удалять полипы ЖКТ до их перерождения в рак. В отличие от общего сокращения, среди взрослого молодого населения в возрасте до 50 лет, для которого скрининг не рекомендуется из-за средней степени риска, заболеваемость раком ободочной и прямой кишки увеличивались с 1994 года примерно на 2% в год у мужчин и женщин.
В 2016 году США смертность от колоректального рака ожидается на уровне 49500 случаев. Смертность от колоректального рака снизились в обоих группах мужчин и женщин за последние несколько десятилетий, с более крутым снижением в последний период времени. Это снижение отражает снижение показателей заболеваемости и улучшение ранней диагностики и лечения.
Признаки и симптомы
Ранние стадии рака ободочной и прямой кишки обычно не имеют симптомов, поэтому, чтобы выявить заболевание на этой ранней стадии часто необходим скрининг. Прогрессирование болезни может вызвать кровотечение из прямой кишки, появление крови в кале, изменение в опорожнении кишечника, схваткообразные боли в нижней части живота.
Иммуногистохимия (ИГХ) при раке толстой кишки
Применение ИГХ при раках толстого кишечника рассматривается на нескольких уровнях: для характеристики опухолей (эндокринный или эпителиальный тип), наследственной предрасположенности и для целей прогноза. Преобладающее использование ИГХ это определение возможных или предполагаемых метастазов, в которых толстой кишки является возможным первичным. Типичной локализацией для метастазов толстой кишки являются печень и легкие, оба органа, которые могут производить морфологию рака идентичную метастазам из толстой кишки. ИГХ, ( класс I правил регулирования FDA), используется после первичной диагностики опухоли путем гистопатологического исследования и не включается для клиницистов как независимое исследование.
Метастатическая карцинома
Наиболее часто применение иммуногистохимии в изучени опухолей печени – это определение источника метастаза, когда первичная локализация опухоли не известна. Развитие и применение панели для иммунных окрашиваний может помочь решить почти все диагностические проблемы. 2-6 Цитокератины (CK) 7 и CK 20 – первая ступень в идентификации многих опухолей и с дополнительными иммунными реакциями относительно специфичными для опухолей женского и мужского полового тракта, нередко дает возможность идентифицировать первичную локализацию метастатической опухоли.
Иммуногистохимические исследования (ИГХ) , как правило, не требуются для оценки доброкачественных и злокачественных эпителиальных опухолей желудка, так как гистопатология, как правило, обеспечивает диагностику, но ИГХ нужна при изучении метастатического рака желудка, когда источник происхождения опухоли не ясен, или когда макроскопические / рентгенологическое проявления опухоли сбивают с толку (например, рак желудка напрямую и широко прорастает в печень и гистологически неотличим от холангиокарциномой). К тому же, ИГХ может быть полезна для идентификации некоторых вариантов желудочных карцином, включая гепатоидную аденокарциному, в которой печеночная дифференцировка может быть подтверждена позитивной реакцией на альфа-фетопротеин AFP.
Аденокарцинома
Нейроэндокринная карцинома
Нейроэндокринная карцинома характеризуется положительным окрашиванием на синаптофизин, хромогранин, виллин и CD57.17-18 В отличие от аденокарциномы желудка, раки, происходящие во второй части двенадца-типерстной кишки могут быть отрицательными для обоих маркеров- синаптофизина и хромогранина, но часто вступают в реакцию с антителами против соматостатина. Маркер пролиферации Ki-67 и молекула адгезии Е-кадгерин, были использованы для оценки агрессивности нейроэндокринных carcinoma.19 Увеличение индекса пролиферации Ki-67 ( 20% для G1, G2, G3 и поражений соответственно) 20 предсказывает агрессивное поведение, и потеря Е-кадгерина может предсказать развитие метастазов в лимфатических узлах.
Желудочно-кишечная аденокарцинома с нейроэндокринной дифференцировкой
Аденокарцинома желудка, как кишечного типа, так и типа перстневидноклеточной карциномы, могут иметь нейроэндокринную дифференцировку и что может быть не очевидно по гистологической картине, но проявляться по окрашиванию хромогранином и /или синаптофизином.
ГИСТ — гастроинтестинальные стромальные опухоли
Антитело против CD117 окрашивает большинство случаев гастроинтестинальных стромальных опухолей (ГИСТ), в том числе метастазов.21-25 Хотя могут быть вариации в распределении CD117(+) клеток в пределах данной опухоли, в большинстве случаев окрашивание является диффузным. Когда реакция на CD117 положительна в опухолях отличных от ГИСТ, окрашивание почти всегда неоднородно. Окрашивание на CD34 также можно увидеть в ГИСТ. ГИСТ негативны на CD117 в 10 -15% случаев. Антитело Dog1, как было показано, маркирует большинство CD117 отрицательных ГИСТ.26 Кроме того, потеря SDHB, как было доказано, — постоянный признак ГИСТ с дефицитом SDHB, что ,таким образом, может быть полезным для выявления особого варианта этого заболевания.
Толстый кишечник. Аденома и аденокарцинома.
Аденомы (трубчатые аденомы, тубулярные аденомы, аденомы ворсинок) демонстрируют те же иммуногистохимические реакции, что и аденокарцинома кишки. Почти все они реагируют с антителами, направленными против CK 20 и меньшинство также окрашивается очагово с CK 7, в отличие от панкреатических аденокарцином, большинство из которых являются CK 20 отрицательными и положительными по СК 7. Дифференциальная диагностика метастатической колоректальногй аденокарциномы и аденокарциномы, возникающей в других местах зачастую представляет из себя сложную задачу.
Легочная аденокарцинома может напоминать колоректальную. CK 7 и CK 20 могут быть полезными в этой ситуации, поскольку CK 7, как правило, сильно положителен в аденокарциноме легкого, а CK 20 обычно отрицателен; обратная картина наблюдается с колоректальными аденокарциномами. Кроме того, транскрипционный фактор щитовидной железы 1 (TTF-1) обычно положителен в раковых заболеваниях легких, а CDX-2 и бета-катенин как правило положительны в колоректальном раке. Карциномы эндометриоидного типа могут также гистологически быть неотличимы от колоректальной карциномы. Здесь, опять же, CK 7 положителен почти во всех эндометриоидных аденокарциномах и лишь слегка реактивен в колоректальной аденокарциноме. CK 20, как правило, негативен для первичных опухолей легких, но дает положительный результат на ободочной и прямой кишке.
Аденокарцинома аппендикса
Аденокарциномы аппендикса, как правило, показывают окрашивание на MUC5AC, в отличие от аденокарциномы ободочной кишки, в которой данное антитело редко реактивно. Это особенно полезно при изучении муцинозных аденокарцином, которые образуют метастазы в брюшной полости. Бета-катенин является еще одной мишенью дифференцировочных антител, положительных почти во всех ободочных аденокарциномах и отрицательных в аденокарциноме аппендикса.
У женщин с абдоминальным муцинозным карциноматозом, различие ободочной и аппендикулярной аденокарциномы из яичников играет важную роль. В ободочной опухоли, часто экспрессируются виллин и бета-катенин; в метастазах в аппендиксе часто экспрессирован виллин, но бета-катенин является редким и в овариальных муцинозных аденокарциномах ни виллин, ни бета-катенин не выявляются.
Подобно поражениям аппендикса, аденокарциномы экспрессируют MUC5AC и подобно колоректальным аденокарциномам, яичниковые муцинозные аденокарциномы экспрессируют CDX-2. Полезными добавками к основным панелям для неизвестных первичных опухолей, в которых подозреваются аппендикулярные или муцинозные опухоли яичников, являются MUC5AC и бета-катенин. Виллин также может быть полезным, поскольку он обычно имеет “brush-border” картину окрашивания и в ободочной и в аппендикулярной аденокарциномах и, как правило, цитоплазматическую в поражениях яичников и поджелудочной железы.
Инвазивная аденокарцинома протоков
Аденокарциномы поджелудочной железы, как правило, происходят из предшествующих стадий дисплазии протока поджелудочной железы. Иммуногистохимический паттерн высокодифференцированных панкреатических интраэпителиальных неоплазий такой же, как у инвазивной аденокарциномы поджелудочной железы и не может быть использован для их дифференциальной диагностики.
Аденокарцинома протока поджелудочной железы напоминают аденокарциному желчных протоков и желчного пузыря по картине световой микроскопии, а также по иммунофенотипическим проявлениям. Панкреатические аденокарциномы реагируют с антителами к различным цитокератинам, в том числе CK 8, CK 17, CK 18, CK 19, CAM 5.2 и AE1 & AE3.5,32. Аденокарциномы поджелудочной железы, как правило, являются CK 7 и CK 20 положительными. Поджелудочная аденокарцинома также может быть слабо позитивной по CDX-2.
Почти все аденокарциномы поджелудочной железы являются CEA и СА-125 положительными. Они также могут иметь незначительную составляющую нейроэндокринных клеток, которые будут реагировать с антителами к соматостатину, синаптофизину, хромогранину или другим нейроэндокринным маркерам. Терапия также может быть предсказана при положительном окрашивании на фактор роста эндотелия сосудов и отрицательном — на SMAD4 (DPC4). Потеря экспрессии SMAD4 в эпителии желчных протоков также была показана в случае хронической желчнокаменной болезни. Хорошо дифференцированные метастатические аденокарциномы поджелудочной железы в печени могут быть сложно отличимы от доброкачественных поражений желчных протоков при исследовании биопсийного материала. Тем не менее, в отличие от доброкачественных поражений, они как правило, экспрессируют р53, цитоплазматический mCEA, и другие маркеры, включая CA-125.
Нейроэндокринные опухоли и опухоли из эндокринных клеток, низкодифференцированные и высокодифференцированные.
Низко- и высокого дифференцированные нейроэндокринные опухоли, как правило, оцениваются по иммунофенотипическим проявлениям, однако в целом, интенсивность окрашивания меньше у полноценных опухолей.
Они могут быть сгруппированы по преобладанию секретируется гормона (например: соматостатин, гастрин), но, как правило, также окрашиваются антителами к синаптофизину и хромогранину, а также к различным кератинам, в том числе CK 8, CK 18, CK и 35betaH11. CK 7 и CK 20, как правило, негативны. CD56 и CD57, как правило, окрашиваются более интенсивно в высокодифференцированных нейроэндокринных опухолях, чем в низкодифференцированных; в мембранном рисунке CD56 также будет положительным в большей степени, нежели SATB2. Поэтому SATB2 является хорошим маркером идентификации рака ободочного происхождения при работе с опухолью неизвестного происхождения. Другим потенциальным полезным свойством полезность SATB2 является выявление нейроэндокринных опухолей и карцином левой толстой и прямой кишки, так как SATB2 как правило, отрицателен в других нейроэндокринных новообразованиях ЖКТ, поджелудочной железы и легких.
2003–2018 © ООО «Микротесты в биологии, медицине и ветеринарии». Официальный дистрибьютор ведущих производителей.
+7 (495) 969-98-26
источник
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами — антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR — протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны — эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu — это рецептор эпидермального фактора роста раковой клетки. Это — ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.
Ki-67 — это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот — чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке — активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется — индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.
VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF — для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Иммунотерапия в онкологии появилась сравнительно недавно, но уже успела показать удивительные результаты в лечении опухолей. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету увидеть опухоль и уничтожить её. Ответственные за «видимость» опухоли белки PD-1, PDL-1 и PDL-2 в достаточном количестве присутствуют не во всех опухолях. Именно поэтому одним пациентам иммунотерапия помогает, а другим нет.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
источник
Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.
Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1941 году американский иммунолог Альберт Кунс впервые решил использовать антитела в лаборатории, чтобы «распознавать» с помощью них белки бактерий. В 1984 году биохимик из Аргентины Сезар Мильштейн получил Нобелевскую премию за то, что создал гибрид опухолевой клетки с лимфоцитом, которая могла синтезировать моноклональные антитела. После этого началось производство моноклональных антител для диагностических и лечебных целей.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
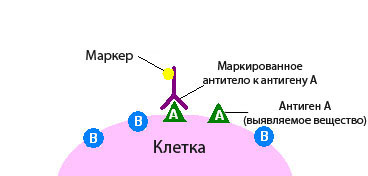
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
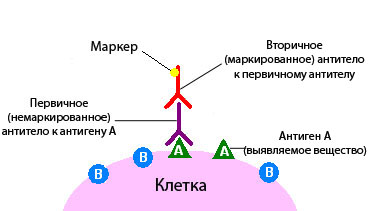
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
- Он обладает более высокой чувствительностью, потому что с одним первичным антителом (тем, которое связывается с белком-мишенью) может связаться несколько вторичных антител.
- Исследование занимает немного времени: для того, чтобы произошла реакция, нужно примерно 3 часа.
- Непрямая иммуногистохимия требует небольшого количества антител. Например, вторичное антитело, направленное на иммуноглобулины кролика, будет реагировать на любое первичное антитело «кроличьего» происхождения. Не нужно создавать много разных видов вторичных антител с окрашивающей или флуоресцентной меткой.
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
источник
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
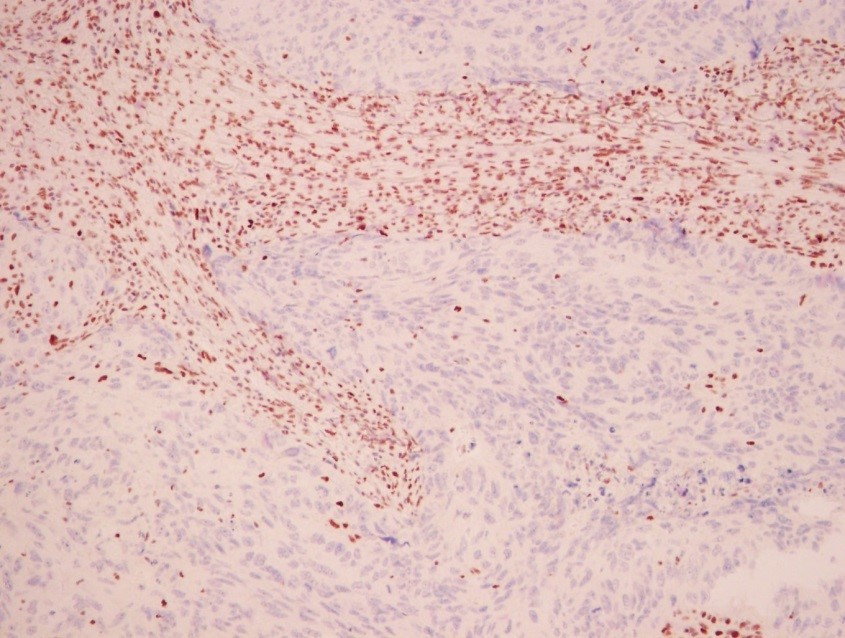
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
источник
На вопросы о профилактике, диагностике и лечении рака желудка и пищевода отвечает руководитель онкологического центра комбинированных методов лечения клиники высоких медицинских технологий им. Н. И. Пирогова СПбГУ Андрей Павленко.
Нет, это не так. Рак желудка и рак пищевода — заболевания, которые входят в разные группы риска и провоцируются разными факторами.
Рак пищевода могут спровоцировать: многолетнее курение, любовь к горячим напиткам, частое (несколько раз в неделю) употребление крепких спиртных напитков. Почему? Они травмируют слизистую оболочку пищевода, провоцируют предраковые состояния. От курения никотин и смолы растворяются в слюне, крепкий алкоголь раздражает и вызывает воспалительные процессы.
Не так давно типичным эндемическим районом была Средняя Азия с ее любовью к горячему чаю. Его пили не остужая, и это приводило к заболеваниям среднегрудного отдела пищевода. Так что стоит пить и есть горячее, предварительно остудив во рту, либо охладив заранее до приемлемой температуры.
Рак желудка может быть вызван возбудителем helicobacter pylori. Он может довести слизистые оболочки до воспаления, которые потом трансформируются в метаплазии (изменения эпителия). Также в группу риска входят люди, употребляющие необработанные мясо и рыбу. Стоит помнить, что жареное и жирное скорее увеличит вероятность колоректального рака, нежели рака желудка.
По большей части — да. Если говорить о пищеводе, 99% больных — люди старше пятидесяти, многолетние курильщики, употребляющие много крепкого алкоголя. Если каждый день употреблять крепкий алкоголь, слизистая оболочка не будет успевать восстанавливаться. А со временем репаративные процессы замедляются. Но если ваши близкие не пьют, но при этом много и давно курят, то это тоже повод провериться.
Порядка 15-20% заболевших раком желудка — пациенты до 50 лет. Есть совсем ранние формы — у тридцатилетних. Достаточно часто молодой возраст сочетается с агрессивными формами рака. Как правило, выживаемость у таких больных достаточно низкая. Это преимущественно недифференцированные формы рака — перстневидноклеточные, диффузные и так далее.
Если опухоль агрессивна, то на любой стадии может произойти ее генерализация. В таких случаях прогноз практически всегда неблагоприятен. Если говорить о нашей диагностике, она, как правило, запаздывает.
Большинство больных приходит к нам на третьей стадии заболевания (когда лимфоузлы уже поражены опухолевыми клетками). Это касается как рака пищевода, так и рака желудка. Это происходит потому, что в России нет государственных программ скрининга, которые позволяли бы выявлять ранние формы рака среди большого количества обследуемых. У нас же, пока не начнутся боли, никто не идет к врачам.
Если у человека возникают симптомы: боль, стеноз выходного отдела желудка, дисфагия, кровотечение из опухоли, это означает, что болезнь уже запущена и опухоль большая. Рак пищевода проявляет себя тогда, когда опухоль перекрывает просвет и человек не в состоянии проглатывать пищу. С вероятностью 95% можно говорить о том, что болезнь запущена и третья стадия как минимум. Однако бывает и вторая стадия — когда опухоль большая, но поражения лимфоузлов нет, но это происходит довольно редко. 60% больных приходят к нам уже на третьей стадии. Ранние формы рака можно выявить в тот момент, когда человека ничего не беспокоит.
ФГДС (фиброэзофагогастродуоденоскопия) — исследование, на которое нужно получить направление при любом желудочном дискомфорте. Именно ФГДС — первая ступень в диагностике рака желудка или пищевода после того, как выявлена принадлежность к группам риска. Опытный специалист не будет смотреть желудок не осмотрев пищевод. Пищевод смотрится как при вхождении, так и на «обратной дороге».
При любых проявлениях желудочного дискомфорта или боли. Это относится абсолютно к любому возрасту, ждать сорока лет не нужно.
Вы приходите с определенной жалобой к терапевту и пожеланием выполнить ФГДС. Грамотный доктор не будет настаивать на том, чтобы была проведена просто тест-терапия, без визуального и морфологического подтверждения.
Желудочный дискомфорт четко связан с приемом пищи. Это тяжесть в желудке, тощаковые боли. Если на ФГДС ничего не находится, значит проблема не с желудком, и следует сделать УЗИ.
Настаивать. Нужно понимать, что людей, которые делают эндоскопию профессионально, меньше, чем необходимо. Понять это, пока вы не придете в клинику, невозможно.
Нет, слизистая оболочка желудка не имеет болевых рецепторов.
Гастрит с обсеменением helicobacter pylory входит в группу риска, также как и атрофический гастрит. Диагностировать это можно с помощью правильно выполненной гастроскопии. Необходимо делать во время ФГДС множественную биопсию, потому что диагноз «гастрит» ставится только на основании морфологического исследования. Если вам выполнили ФГДС, не взяв биопсию и сказали, что у вас гастрит — уходите от такого доктора. На приеме для этого необходимо просто спросить у эндоскописта, будет ли он делать вам биопсию. Множественная биопсия сейчас входит в официальные стандарты гастроэнтерологии. Кроме этого, нужно провести тест на обсеменение helicobacter pylory либо наиболее точный уразный тест. Вы дышите в трубочку, а прибор регистрирует уровень вырабатываемого бактерией фермента уразы.
Правильная ФГДС делается за 20 минут в несколько этапов, обязательными являются хромогастроскопия, биопсия, инверсия и осмотр в специальном спектре (например NBI). Необходимо использование красителя метиленового синего для окрашивания стенок. Именно с этим красителем можно выявить ранние формы заболевания. Через инструментальный канал эндоскопа при каждой ФГДС обязательно вводят краситель (хромогастроскопия). Также при проведении процедуры эндоскопист должен сделать инверсию — развернуть эндоскоп в сторону кардии. Также есть различные варианты другого спектра, когда рассматриваются слизистые, строение сосудистого рисунка.
Да, сейчас часто делают ФГДС в дневных стационарах поликлиник с использованием наркоза — седации. Человек спит, но аппарата искусственной вентиляции легких не требуется.
Прежде чем дать человеку прогноз, нам необходимо его правильно отстадировать. Во-первых, мы определяем степень прорастания опухоли в стенку органа, во-вторых, выясняем, есть ли поражение лимфоузлов, в-третьих — наличие отдаленных метастазов.
Первая стадия при раке желудка: 85% вероятности прожить 5 лет и более. Надо понимать, что 15% заболевших начнут прогрессировать и с первой стадией. 100% выживаемости нельзя достичь, несмотря на раннюю стадию. Вторая стадия — показатель пятилетней выживаемости от 55 до 60%. Третья стадия — 35-40%. То есть, почти 70% больных погибают при третьей стадии, не перешагнув пятилетний рубеж. Большинство из этих 70% на третьей стадии умирают в первые два года болезни.
Рак пищевода протекает, как правило, агрессивнее рака желудка. Самый распространенный вид рака для пищевода — плоскоклеточный. Он и наиболее агрессивный.Так, 80% с первой стадией переживут пятилетний рубеж. Из тех, кому диагностировали заболевание на второй стадии, при существующих видах лечения выживает только половина. Менее 20% при третьей стадии рака пищевода смогут пережить пятилетний рубеж. Самое важное, что пока опухоль не перекроет просвет, каких-либо симптомов и затруднений не будет.
В целом, да. Основная профилактика очень проста: нужно не курить, не употреблять спиртное, особенно крепкие напитки, а также избегать очень горячих жидкостей. Однако даже если убрать все факторы, никто не даст гарантии, что этих двух заболеваний удастся избежать.
Вариант первый (опухоль не найдена). Цепочка терапевт — эндоскопист (ФГДС) — гастроэнтеролог — лечение. Прийти к терапевту, описать свои опасения и жалобы, взять направление на ФГДС. На приеме у эндоскописта получаете рекомендацию вернуться за результатами гистологического исследования (от 10 дней до трех недель). Результаты необходимо показать гастроэнтерологу. Гастроэнтеролог проводит лечение в случае, если оно требуется.
Вариант второй (опухоль есть). Цепочка терапевт — эндоскопист (по направлению) — гистологическое исследование (две недели в среднем) — онкологическая поликлиника (стадирование рака) — КТ, УЗИ, колоноскопия (по направлению, около трех недель) — онкодиспансер (запись на две недели вперед).
Вы получили направление на эндоскопию. Эндоскопист подозревает по явным признакам, что рак есть. Его задача — взять информативную биопсию из разных участков пораженной слизистой и отправить гистологию в нормальную лабораторию. Очень много зависит от того, как качественно сделают гистологическое исследование. После того, как диагноз «рак» подтверждается в лаборатории, необходимо идти в онкологическую поликлинику. Там заболевание должны адекватно стадировать, проведя ряд диагностических тестов. Обязательно назначаются компьютерная томография грудной клетки и брюшной полости (ожидание 1-1,5 месяца), УЗИ малого таза, обязательным исследованием также является колоноскопия. Дело в том, что у 5% больных на фоне рака желудка может быть рак кишечника (колоректальный рак). Как только на руках есть все данные, можно идти к онкологу в онкодиспансер или в федеральный центр. На основании этих данных определяется дальнейшая тактика лечения. На комиссии решается, какое лечение пациенту необходимо и куда его необходимо госпитализировать.
От похода к терапевту до получения всех результатов, проводимых по ОМС, проходит в среднем около двух месяцев. Нужно понимать, что эти два месяца на течение опухоли не повлияют.
По новому приказу Минздрава мы не можем проводить этап диагностики дольше 30 дней. Это абсолютно утопическая цифра. Во-первых, большой поток людей. Во-вторых, нехватка грамотных специалистов — тех же морфологов, чтобы был поставлен диагноз. Так что ожидание результатов гистологического исследования длиной в две-три недели — это, увы, реальный срок.
Проблем много. Иногда люди приходят после всех тестов в онкодиспансер, его результаты пересматривают, но процентах в тридцати исследования на дисках оказываются неинформативными. Может быть недостаточно контраста, или его вообще нет. Почему это происходит — объяснить сложно. Нюансов много, и срыв может произойти на любом этапе. Иногда он бывает и счастливым — при повторном исследовании оказывается, что рака нет, но это бывает редко.
Основным методом лечения для рака желудка является хирургический. Это удаление больного органа, лимфодиссекция — удаление лимфоколлекторов вокруг желудка (области, которая потенциально обладает метастазами). Удаление лимфоузлов — диагностическая процедура, позволяющая дополнительно уточнить стадию заболевания. Для этого необходимо изучить не менее 22 лимфоузлов. Отсутствие метастазов в лимфоузлах — благоприятная ситуация, означает вторую стадию и увеличенные шансы для больного.
Да, есть. Малоинвазивные вмешательства возможны при ранних формах рака. Когда опухоль находится в пределах слизистой оболочки желудка, можно даже оставить орган полностью, оперировав его эндоскопически (эндоскопическая диссекция в подслизистом слое). Удаляется пораженный участок слизистой при отступлением от края опухоли. Если операция проходит успешно и по данным морфологического исследования, опухоль действительно не проросла сквозь слизистую, то больному больше не требуется дополнительного лечения. Однако не каждый онкоцентр обладает возможностями таких высокотехнологичных операций. Они делаются за счет федеральной квоты по показаниям.
Если рак проник сквозь слизистую оболочку и прорастет в подслизистый слой, и объем опухоли небольшой, есть возможность сделать лапароскопию. Всего делается пять небольших разрезов и пятисантиметровый небольшой разрез над пупком, чтобы «вытащить» удаленный материал.
Химиотерапия, как правило, используется на четвертой стадии либо на третьей стадии — для борьбы с отдаленными метастазами или уменьшения вероятности прогрессирования опухоли.
Метастазирование обычно происходит в печень, брюшину, параортальные лимфоузлы. При отдаленных метастазах оперировать желудок не следует. Прогноз для больного это не улучшит, а качество жизни ухудшит катастрофически.
Если опухоль расположена на границе желудка с двенадцатиперстной кишкой, если есть возможность отступить от края опухоли необходимое расстояние, то можно сохранить желудок частично. Однако объем лимфоаденэктомии остается прежним.
Если есть массивное поражение лимфоузлов или опухоль вышла за стенки желудка, идти на операцию сразу нельзя. Больному должны предложить вариант дооперационной (неоадъювантной) химиотерапии. При этом нужно понимать, что иногда даже ранние формы рака могут быть диссеминированными — распространенными по брюшине. Чтобы это понять при осмотре брюшной полости, делается смыв с брюшины, оправляется цитологу на исследование. Если находятся свободные опухолевые клетки, то человек попадает в ту же группу, что и пациенты с отдаленными метастазами. Эта группа пациентов вместе с обладателями продвинутых форм рака желудка рассматриваются как кандидаты для неоадъювантной формы химиотерапии.
Во время операции кишку сшивают с пищеводом. Человек продолжает есть естественным путем, однако диета назначается пожизненная с заместительной ферментной терапией. Нужно чаще есть, однако качество жизни будет нормальным.
Если не удалить больной желудок, вероятность того, что вы переживет пятилетний рубеж — 5-7%. Если его удалить, то даже на третьей стадии пережить пятилетний рубеж можно с вероятностью 50%. В нормальных специализированных центрах частота осложнений на превышает 12-15%, а летальность после таких операций не превышает 2-3%. Так что, если лечиться, шансов выжить спустя пять лет в 10 раз больше, чем если прийти, развести руками и не делать ничего.
источник
На вопросы о профилактике, диагностике и лечении рака желудка и пищевода отвечает руководитель онкологического центра комбинированных методов лечения клиники высоких медицинских технологий им. Н. И. Пирогова СПбГУ Андрей Павленко.
Нет, это не так. Рак желудка и рак пищевода — заболевания, которые входят в разные группы риска и провоцируются разными факторами.
Рак пищевода могут спровоцировать: многолетнее курение, любовь к горячим напиткам, частое (несколько раз в неделю) употребление крепких спиртных напитков. Почему? Они травмируют слизистую оболочку пищевода, провоцируют предраковые состояния. От курения никотин и смолы растворяются в слюне, крепкий алкоголь раздражает и вызывает воспалительные процессы.
Не так давно типичным эндемическим районом была Средняя Азия с ее любовью к горячему чаю. Его пили не остужая, и это приводило к заболеваниям среднегрудного отдела пищевода. Так что стоит пить и есть горячее, предварительно остудив во рту, либо охладив заранее до приемлемой температуры.
Рак желудка может быть вызван возбудителем helicobacter pylori. Он может довести слизистые оболочки до воспаления, которые потом трансформируются в метаплазии (изменения эпителия). Также в группу риска входят люди, употребляющие необработанные мясо и рыбу. Стоит помнить, что жареное и жирное скорее увеличит вероятность колоректального рака, нежели рака желудка.
По большей части — да. Если говорить о пищеводе, 99% больных — люди старше пятидесяти, многолетние курильщики, употребляющие много крепкого алкоголя. Если каждый день употреблять крепкий алкоголь, слизистая оболочка не будет успевать восстанавливаться. А со временем репаративные процессы замедляются. Но если ваши близкие не пьют, но при этом много и давно курят, то это тоже повод провериться.
Порядка 15-20% заболевших раком желудка — пациенты до 50 лет. Есть совсем ранние формы — у тридцатилетних. Достаточно часто молодой возраст сочетается с агрессивными формами рака. Как правило, выживаемость у таких больных достаточно низкая. Это преимущественно недифференцированные формы рака — перстневидноклеточные, диффузные и так далее.
Если опухоль агрессивна, то на любой стадии может произойти ее генерализация. В таких случаях прогноз практически всегда неблагоприятен. Если говорить о нашей диагностике, она, как правило, запаздывает.
Большинство больных приходит к нам на третьей стадии заболевания (когда лимфоузлы уже поражены опухолевыми клетками). Это касается как рака пищевода, так и рака желудка. Это происходит потому, что в России нет государственных программ скрининга, которые позволяли бы выявлять ранние формы рака среди большого количества обследуемых. У нас же, пока не начнутся боли, никто не идет к врачам.
Если у человека возникают симптомы: боль, стеноз выходного отдела желудка, дисфагия, кровотечение из опухоли, это означает, что болезнь уже запущена и опухоль большая. Рак пищевода проявляет себя тогда, когда опухоль перекрывает просвет и человек не в состоянии проглатывать пищу. С вероятностью 95% можно говорить о том, что болезнь запущена и третья стадия как минимум. Однако бывает и вторая стадия — когда опухоль большая, но поражения лимфоузлов нет, но это происходит довольно редко. 60% больных приходят к нам уже на третьей стадии. Ранние формы рака можно выявить в тот момент, когда человека ничего не беспокоит.
ФГДС (фиброэзофагогастродуоденоскопия) — исследование, на которое нужно получить направление при любом желудочном дискомфорте. Именно ФГДС — первая ступень в диагностике рака желудка или пищевода после того, как выявлена принадлежность к группам риска. Опытный специалист не будет смотреть желудок не осмотрев пищевод. Пищевод смотрится как при вхождении, так и на «обратной дороге».
При любых проявлениях желудочного дискомфорта или боли. Это относится абсолютно к любому возрасту, ждать сорока лет не нужно.
Вы приходите с определенной жалобой к терапевту и пожеланием выполнить ФГДС. Грамотный доктор не будет настаивать на том, чтобы была проведена просто тест-терапия, без визуального и морфологического подтверждения.
Желудочный дискомфорт четко связан с приемом пищи. Это тяжесть в желудке, тощаковые боли. Если на ФГДС ничего не находится, значит проблема не с желудком, и следует сделать УЗИ.
Настаивать. Нужно понимать, что людей, которые делают эндоскопию профессионально, меньше, чем необходимо. Понять это, пока вы не придете в клинику, невозможно.
Нет, слизистая оболочка желудка не имеет болевых рецепторов.
Гастрит с обсеменением helicobacter pylory входит в группу риска, также как и атрофический гастрит. Диагностировать это можно с помощью правильно выполненной гастроскопии. Необходимо делать во время ФГДС множественную биопсию, потому что диагноз «гастрит» ставится только на основании морфологического исследования. Если вам выполнили ФГДС, не взяв биопсию и сказали, что у вас гастрит — уходите от такого доктора. На приеме для этого необходимо просто спросить у эндоскописта, будет ли он делать вам биопсию. Множественная биопсия сейчас входит в официальные стандарты гастроэнтерологии. Кроме этого, нужно провести тест на обсеменение helicobacter pylory либо наиболее точный уразный тест. Вы дышите в трубочку, а прибор регистрирует уровень вырабатываемого бактерией фермента уразы.
Правильная ФГДС делается за 20 минут в несколько этапов, обязательными являются хромогастроскопия, биопсия, инверсия и осмотр в специальном спектре (например NBI). Необходимо использование красителя метиленового синего для окрашивания стенок. Именно с этим красителем можно выявить ранние формы заболевания. Через инструментальный канал эндоскопа при каждой ФГДС обязательно вводят краситель (хромогастроскопия). Также при проведении процедуры эндоскопист должен сделать инверсию — развернуть эндоскоп в сторону кардии. Также есть различные варианты другого спектра, когда рассматриваются слизистые, строение сосудистого рисунка.
Да, сейчас часто делают ФГДС в дневных стационарах поликлиник с использованием наркоза — седации. Человек спит, но аппарата искусственной вентиляции легких не требуется.
Прежде чем дать человеку прогноз, нам необходимо его правильно отстадировать. Во-первых, мы определяем степень прорастания опухоли в стенку органа, во-вторых, выясняем, есть ли поражение лимфоузлов, в-третьих — наличие отдаленных метастазов.
Первая стадия при раке желудка: 85% вероятности прожить 5 лет и более. Надо понимать, что 15% заболевших начнут прогрессировать и с первой стадией. 100% выживаемости нельзя достичь, несмотря на раннюю стадию. Вторая стадия — показатель пятилетней выживаемости от 55 до 60%. Третья стадия — 35-40%. То есть, почти 70% больных погибают при третьей стадии, не перешагнув пятилетний рубеж. Большинство из этих 70% на третьей стадии умирают в первые два года болезни.
Рак пищевода протекает, как правило, агрессивнее рака желудка. Самый распространенный вид рака для пищевода — плоскоклеточный. Он и наиболее агрессивный.Так, 80% с первой стадией переживут пятилетний рубеж. Из тех, кому диагностировали заболевание на второй стадии, при существующих видах лечения выживает только половина. Менее 20% при третьей стадии рака пищевода смогут пережить пятилетний рубеж. Самое важное, что пока опухоль не перекроет просвет, каких-либо симптомов и затруднений не будет.
В целом, да. Основная профилактика очень проста: нужно не курить, не употреблять спиртное, особенно крепкие напитки, а также избегать очень горячих жидкостей. Однако даже если убрать все факторы, никто не даст гарантии, что этих двух заболеваний удастся избежать.
Вариант первый (опухоль не найдена). Цепочка терапевт — эндоскопист (ФГДС) — гастроэнтеролог — лечение. Прийти к терапевту, описать свои опасения и жалобы, взять направление на ФГДС. На приеме у эндоскописта получаете рекомендацию вернуться за результатами гистологического исследования (от 10 дней до трех недель). Результаты необходимо показать гастроэнтерологу. Гастроэнтеролог проводит лечение в случае, если оно требуется.
Вариант второй (опухоль есть). Цепочка терапевт — эндоскопист (по направлению) — гистологическое исследование (две недели в среднем) — онкологическая поликлиника (стадирование рака) — КТ, УЗИ, колоноскопия (по направлению, около трех недель) — онкодиспансер (запись на две недели вперед).
Вы получили направление на эндоскопию. Эндоскопист подозревает по явным признакам, что рак есть. Его задача — взять информативную биопсию из разных участков пораженной слизистой и отправить гистологию в нормальную лабораторию. Очень много зависит от того, как качественно сделают гистологическое исследование. После того, как диагноз «рак» подтверждается в лаборатории, необходимо идти в онкологическую поликлинику. Там заболевание должны адекватно стадировать, проведя ряд диагностических тестов. Обязательно назначаются компьютерная томография грудной клетки и брюшной полости (ожидание 1-1,5 месяца), УЗИ малого таза, обязательным исследованием также является колоноскопия. Дело в том, что у 5% больных на фоне рака желудка может быть рак кишечника (колоректальный рак). Как только на руках есть все данные, можно идти к онкологу в онкодиспансер или в федеральный центр. На основании этих данных определяется дальнейшая тактика лечения. На комиссии решается, какое лечение пациенту необходимо и куда его необходимо госпитализировать.
От похода к терапевту до получения всех результатов, проводимых по ОМС, проходит в среднем около двух месяцев. Нужно понимать, что эти два месяца на течение опухоли не повлияют.
По новому приказу Минздрава мы не можем проводить этап диагностики дольше 30 дней. Это абсолютно утопическая цифра. Во-первых, большой поток людей. Во-вторых, нехватка грамотных специалистов — тех же морфологов, чтобы был поставлен диагноз. Так что ожидание результатов гистологического исследования длиной в две-три недели — это, увы, реальный срок.
Проблем много. Иногда люди приходят после всех тестов в онкодиспансер, его результаты пересматривают, но процентах в тридцати исследования на дисках оказываются неинформативными. Может быть недостаточно контраста, или его вообще нет. Почему это происходит — объяснить сложно. Нюансов много, и срыв может произойти на любом этапе. Иногда он бывает и счастливым — при повторном исследовании оказывается, что рака нет, но это бывает редко.
Основным методом лечения для рака желудка является хирургический. Это удаление больного органа, лимфодиссекция — удаление лимфоколлекторов вокруг желудка (области, которая потенциально обладает метастазами). Удаление лимфоузлов — диагностическая процедура, позволяющая дополнительно уточнить стадию заболевания. Для этого необходимо изучить не менее 22 лимфоузлов. Отсутствие метастазов в лимфоузлах — благоприятная ситуация, означает вторую стадию и увеличенные шансы для больного.
Да, есть. Малоинвазивные вмешательства возможны при ранних формах рака. Когда опухоль находится в пределах слизистой оболочки желудка, можно даже оставить орган полностью, оперировав его эндоскопически (эндоскопическая диссекция в подслизистом слое). Удаляется пораженный участок слизистой при отступлением от края опухоли. Если операция проходит успешно и по данным морфологического исследования, опухоль действительно не проросла сквозь слизистую, то больному больше не требуется дополнительного лечения. Однако не каждый онкоцентр обладает возможностями таких высокотехнологичных операций. Они делаются за счет федеральной квоты по показаниям.
Если рак проник сквозь слизистую оболочку и прорастет в подслизистый слой, и объем опухоли небольшой, есть возможность сделать лапароскопию. Всего делается пять небольших разрезов и пятисантиметровый небольшой разрез над пупком, чтобы «вытащить» удаленный материал.
Химиотерапия, как правило, используется на четвертой стадии либо на третьей стадии — для борьбы с отдаленными метастазами или уменьшения вероятности прогрессирования опухоли.
Метастазирование обычно происходит в печень, брюшину, параортальные лимфоузлы. При отдаленных метастазах оперировать желудок не следует. Прогноз для больного это не улучшит, а качество жизни ухудшит катастрофически.
Если опухоль расположена на границе желудка с двенадцатиперстной кишкой, если есть возможность отступить от края опухоли необходимое расстояние, то можно сохранить желудок частично. Однако объем лимфоаденэктомии остается прежним.
Если есть массивное поражение лимфоузлов или опухоль вышла за стенки желудка, идти на операцию сразу нельзя. Больному должны предложить вариант дооперационной (неоадъювантной) химиотерапии. При этом нужно понимать, что иногда даже ранние формы рака могут быть диссеминированными — распространенными по брюшине. Чтобы это понять при осмотре брюшной полости, делается смыв с брюшины, оправляется цитологу на исследование. Если находятся свободные опухолевые клетки, то человек попадает в ту же группу, что и пациенты с отдаленными метастазами. Эта группа пациентов вместе с обладателями продвинутых форм рака желудка рассматриваются как кандидаты для неоадъювантной формы химиотерапии.
Во время операции кишку сшивают с пищеводом. Человек продолжает есть естественным путем, однако диета назначается пожизненная с заместительной ферментной терапией. Нужно чаще есть, однако качество жизни будет нормальным.
Если не удалить больной желудок, вероятность того, что вы переживет пятилетний рубеж — 5-7%. Если его удалить, то даже на третьей стадии пережить пятилетний рубеж можно с вероятностью 50%. В нормальных специализированных центрах частота осложнений на превышает 12-15%, а летальность после таких операций не превышает 2-3%. Так что, если лечиться, шансов выжить спустя пять лет в 10 раз больше, чем если прийти, развести руками и не делать ничего.
источник