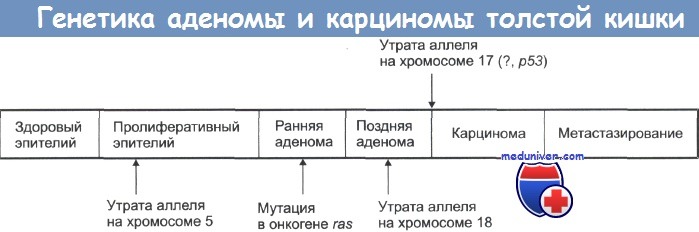
|
| Стадии колоректального рака |
Скрининг колоректального рака (англ. screening for colorectal cancer) — комплекс мероприятий, нацеленных на раннее выявление рака прямой и толстой кишки. При скрининге пациенту не ставится какой-либо диагноз, а только определяется, относится ли он к группе риска в отношении этих заболеваний, надо ли ему проходить углублённые исследования или какое-то время можно не заниматься этим.
Колоректальный рак встречается, в основном, у пожилых людей, ежегодная заболеваемость достигает 1 миллиона случаев, а ежегодная смертность превышает 500 000. По прогнозам абсолютное число случаев колоректального рака в мире в ближайшие два десятилетия увеличится в результате роста населения в целом и его старения как в развитых, так и в развивающихся странах.
Колоректальный рак занимает второе место по смертности от злокачественных новообразований. Чаще всего колоректальный рак возникает из аденом толстой кишки, и в отдельных случаях у пациентов с генетически обусловленными синдромами полипоза или воспалительными заболеваниями кишечника. Термин «полип» означает наличие отдельного участка ткани, который выдается в просвет кишки. При проведении колоноскопии в рамках скрининга аденоматозные полипы обнаруживаются у 18-36% пациентов [1].
Основные два класса скрининговых тестов, применяемых в настоящее время, это:
- Исследование кала: на скрытую кровь или ДНК
- Методы на основе прямой визуализации: эндоскопические тесты (колоноскопия или сигмоскопия) или компьютерная томография кишечника (КТ-колонография)
Колоректальный рак может служить источником выделения крови и других компонентов ткани, выявляемые в кале до появления клинических симптомов. Это делает возможным проведение таких анализов кала (копро-тестов), которые могут помочь раннему выявлению рака и проведению скрининга колоректального рака у бессимптомных пациентов. Наиболее часто применяющимся методом для этих целей является определение скрытой крови в кале. Такие исследования снижают смертность от колоректального рака на 15-45%, в зависимости от типа используемого анализа и частоты проведения исследования [1].
Из копро-тестов наибольшее распространение получили биохимические: гваяковый и бензидиновый (англ. gFOBT — guaiac fecal occult-blood test) и иммуноферментные (англ. iFOBT — immunochemical fecal occult-blood test). Иммуноферментные тесты, в отличие от биохимических, не предъявляют значительных требований к подготовке пациента и обладают лучшей точностью.
 |
| Колоноскопия — одна из процедур, применяемых при скрининге колоректального рака |
Гибкая сигмоскопия (или ректороманоскопия) позволяет непосредственно обследовать внутреннюю поверхность толстой кишки на расстоянии до 60 см от ануса. С её помощью можно обнаружить колоректальные полипы и опухоли, во время её можно удалить полипы или взять образцы ткани для гистологического исследования. Преимуществом гибкой сигмоскопии является то, что её проведение требует меньшего времени, чем проведение колоноскопии, подготовка к исследованию кишечника также более простая и быстрая. Колоноскопия позволяет выявить и удалить полипы, провести биопсию опухоли, расположенной в толстой кишке. Как специфичность, так и чувствительность колоноскопии при выявлении полипов и новообразований высоки (по меньшей мере 95% при больших полипах; см. ниже). По результатам проводимых друг за другом колоноскопий аденомы диаметром меньше 5 мм исследователи пропускают в 15-25% случаев, а аденомы диаметром 10 мм или больше лишь в 0-6% случаев [1].
КТ-колонография — вид компьютерной томографии (КТ), которая используется для получения изображений внутренней поверхности толстой и прямой кишки. Требует подготовки кишечника.
Несмотря на высокую специфичность, возможность визуализации и взятия биоптата, фиброколоноскопия как скрининговый метод обладает рядом недостатков — большой сложностью, высокой стоимостью и главное недостаточной чувствительностью. Поэтому при разработке первых этапов скрининговых программ в настоящее время акцент смещается в сторону копро-тестов, центральное место среди которых занимают методики обнаружения скрытой крови в кале [3].
Ряд исследователей считают перспективными для скрининга и диагностики на ранних стадиях колоректального рака некоторые другие фекальные тесты:
- fTu M2PK-тесты — тесты на наличие в кале опухолевой формы пируваткиназы М2-типа [3]
- фекальный лактоферрин [6]
Обновлённые US Preventive Services Task Force 2016 года [2] рекомендуют скрининг колоректального рака лицам в возрасте от 50 до 85 лет, не имеющим никаких симптомов колоректального рака. Эти рекомендации не распространяются на лиц из группы высокого риска колоректального рака, к которой относятся пациенты с соответствующим семейным анамнезом, воспалительными заболеваниями кишечника или полипами толстой кишки в анамнезе. Рекомендации для лиц в возрастных группах от 50 до 75 лет и от 76 до 85 лет различаются. USPSTF не рекомендует проведение регулярного скрининга колоректального рака у пациентов 86 лет и старше.
 |
| Гваяковый тест Hemoccult SENSA |
Для лиц от 50 до 75 лет, не входящих в группы риска, рекомендуются следующие скрининговые тесты (на выбор):
Исследования кала:
- гваяковая проба на скрытую кровь (gFOBT) — необходимая частота проведения: раз в год
- иммунохимический тест на скрытую кровь (FIT) — раз в год
- определение в кале генетических опухолевых маркеров (FIT-DNA) — раз в один-три года
Визуализирующие методы:
- колоноскопия — раз в 10 лет
- компьютерная томография кишечника — раз в 5 лет
- ректоманоскопия (гибкая сигмоскопия) — раз в 5 лет
- ректоманоскопия и имуннохимический тест кала на скрытую кровь (FIT) — ректоманоскопия раз в 10 лет и FIT раз в год.
источник
- повышенное потребление животных белков и жиров
- потребление рафинированных углеводов
- малое употребление клетчатки
- изменение секреции желчи и состава желчных кислот
- изменение кишечной флоры
- дефицит витаминов А и С
Роль наследственности в развитии рака ободочной кишки изучена недостаточно. Первичные генетические факторы являются значимыми у 5-10% больных.
- Полипозом толстой кишки
- Одиночными и групповыми полипами толстой кишки
- Язвенным колитом
- Болезнь Крона
- Предшествующая операция по поводу рака толстой кишки
- Предшествующая операция на молочной железе и яичниках
В настоящее время большинство исследователей выделяют 3 основные гистологические формы рака ободочной кишки: железистый рак, или аденокарциному (70-75% случаев), солидный рак (до 20%) и коллоидный или слизистый рак (8-17% случаев). В соответствии с классификацией ВОЗ по степени дифференцировки различают высоко дифференцированные (низкая степень злокачественности), среднюю степень дифференцировки и злокачественности и низко дифференцированные опухоли (высокая степень злокачественности).
Стадия 0 — Tis (рак in situ)
Стадия I — T1N0M0, T2N0M0
Стадия II — T3N0M0,T4N0M0
Стадия III — все значения T, N1-3M0
Стадия IV — все значения T и N, M1
Т1- опухоль прорастает слизистую оболочку и подслизистую основу кишки
Т2 — опухоль прорастает мышечный слой стенки кишки
Т3 — опухоль прорастает субсерозную ткань или неперитонезированные участки
кишки
Т4 — инвазия опухоли в периректальные ткани и соседние органы.
Тx — первичная опухоль не может быть оценена
N1 — один — три пораженных метастазами регионарных лимфатических узла
N2 — более трех пораженных лимфатических узла
N3 — поражение лимфатических узлов вдоль магистральных сосудов прямой кишки
M0 — отдаленных метастазов нет
M1 — есть отдаленные метастазы
Основным методом лечения рака ободочной кишки является хирургический . Он позволяет выполнить полное удаление опухоли в пределах здоровых тканей. Решить задачу подавления последующего опухолевого роста призваны лучевая , химио- , иммуномодулирующая терапии.
Хирургическое лечение
Хирургические операции в зависимости от распространенности опухоли и объема операции делятся на радикальные и паллиативные. Паллиативные операции могут выполняться в объеме радикальных резекций кишки или быть симптоматическими.
При радикальной операции удаляется пораженный опухолью отдел ободочной кишки одним блоком с регионарным лимфатическим аппаратом.
Паллиативные резекции выполняются при отдаленных метастазах рака и помогают предупредить в послеоперационном периоде такие осложнения, как выраженный болевой синдром, кровотечения из распадающейся опухоли, зловонные, раздражающие ткани кишечные выделения. Тем самым улучшается качество жизни запущенных онкологических больных.
Симптоматические операции без резекции кишки выполняются в объеме разгрузочных колостомий или обходных анастомозов у больных с далеко зашедшим опухолевым процессом по поводу осложнений рака.
По способу завершения различают операции с первичным восстановлением кишечной непрерывности и с наложением колостомы. Последние используются как первый этап в лечении рака, осложненного кишечной непроходимостью (с дальнейшим восстановлением) и при паллиативном лечении.
Химиотерапия
Одним из методов комбинированного лечения рака ободочной кишки является адьювантная (дополнительная) химиотерапия. Чувствительность рака ободочной кишки к ней выявлена у 25-30% больных. Адьювантная терапия проводится после операции при поражении опухолью регионарных лимфатических узлов.
Иммуномодулирующая терапия
В последнее время появляются сообщения о достоверном снижении количества рецидивов и отдаленных метастазов после проведения химиоиммунопрофилактики. Метод заключается в назначении пациентам после хирургического лечения при отсутствии метастазов в регионарных лимфоузлах в течение года еженедельно цитостатика и иммуномодулятора.
Лучевая терапия используется:
— Как предоперационный метод лечения рака прямой кишки (для уменьшения стадийности рака)
— Для послеоперационного облучения больных раком прямой кишки для сокращения частоты рецидивов
— Как основной метод лечения неоперабильного местнораспространенного рака прямой кишки.
Еще раз подчеркиваем, что только выявление колоректального рака на ранних стадиях позволяет максимально использовать весь спектр современных методов лечения и добиться хороших результатов. Рак на ранних стадиях может вызывать минимум жалоб и протекать под маской многих других проктологических и хирургических заболеваний. Поэтому своевременно обращайтесь к специалистам.
источник
Симптомы колоректального рака (КРР) не способствуют его ранней диагностике. Это обусловливает необходимость выполнения скрининговых программ, выверенных в отношении риска рака толстой кишки, для лиц в возрасте не старше 50 лет при отсутствии симптомов, а у лиц с высоким риском — в более раннем возрасте. Четкие критерии прекращения программы скрининга отсутствуют.
Эффективный скрининг:
• Основан на понимании последовательности аденома — рак: от первых молекулярных изменений до клинической манифестации опухоли требуется 5-10 лет (внимание: более сжатые сроки при ННПРТК).
• Основан на индивидуальном, генетическом, возрастном или обусловленном заболеванием риске возникновения рака толстой кишки.
• Высоко чувствительный.
• Практичный, легкий для выполнения, недорогой.
Термин скрининг употребим только при отсутствии симптомов; исследование, выполняемое у лиц с симптомами, следует называть не «скрининг», а метод «диагностики».
Распространенность полипов: 20-30% среди лиц старше 50 лет в популяции среднего риска. Первая колоноскопия приносит наибольшую пользу при полипэкто-мии; риск развития КРР у больных с небольшими аденомами не выше, чем в популяции среднего риска. В настоящее время уровень охвата скринингом популяции среднего риска неприемлемо низок: 20-50%. Напротив, более 50% гастроэнтерологов и проктологов выполняют колоноскопию чаще, чем рекомендуется в руководствах — экономически невыгодно, отвлекает средства от первичного скрининга, приносящего большую пользу.
Дифференциальная оценка риска рака толстой кишки:
• Низкий и средний риск (65-75%): отсутствие факторов риска, отсутствие рака толстой кишки у родственников первой степени.
• Средний риск (20-30%): рак толстой кишки у одного родственника первой степени родства в возрасте моложе 60 лет или у 2 и более родственников первой степени любого возраста, наличие в анамнезе радикальной операции по поводу рака толстой кишки, крупного полипа (> 1 см) или множественных полипов толстой кишки любого размера.
• Высокий риск (6-8%): САТК, ННПРТК, ВЗК.
а) Анализ кала на скрытую кровь:
• За: неинвазивный, простой, удобный, безопасный метод.
• Против: осмотр толстой кишки не производится, низкая и средняя чувствительность/специфичность, положительный результат требует выполнения коло-носкопии или других исследований. Низкая специфичность: КРР выявляется только у 2% больных с положительным тестом на скрытую кровь, то есть, чтобы выявить одного больного с КРР необходимо выполнить 50 колоноскопий, а чтобы спасти одного больного требуется выполнить 100 колоноскопий.
• Меры предосторожности: необходимо повторять ежегодно, ограничения в диете (исключение красного мяса, хрена, витамина С и т.д.).
• Факты: ежегодный анализ кала на скрытую кровь снижает смертность от КРР на 20-33%; чувствительность в отношении крупных аденом и КРР составляет только 24%.
б) Фибросигмоидоскопия:
• За: более безопасна, чем колоноскопия, более удобна, не требует подготовки кишечника, обычно не требует седации.
• Против: не позволяет осмотреть всю толстую кишку, выявленные изменения требуют выполнения полной колоноскопий.
• Меры предосторожности: необходимо повторять каждые 5 лет.
• Факты: снижает смертность от КРР на 60%, от КРР дистальных отделов — на 70%; 2% больных с нормальной картиной при фибросигмоидоскопии имеют значимые изменения проксимальнее селезеночного изгиба.
Комбинация анализа кала на скрытую кровь и фибросигмоидоскопии. Факты: несмотря на теоретические преимущества, на практике польза от комбинации обоих методов остается неясной: более высокий уровень выявления, однако снижение смертности от КРР по сравнению с фибросигмоидоскопией не доказано.
в) Колоноскопия:
• За: «золотой» стандарт с полной визуализацией всей толстой кишки, лечебные возможности.
• Против: более высокий риск по сравнению с фибросигмоидоскопией, необходимость в подготовке кишки, седации больного.
• Меры предосторожности: необходимо повторять каждые 10 лет.
• Факты: Национальная программа исследований полипов выявила снижение заболеваемости КРР на 76-90% после колоноскопий и удаления всех видимых полипов в сравнении с предшествующим контрольным уровнем.
г) Ирригоскопия:
• За: полная визуализация толстой кишки даже при наличии частично или почти полностью обтурирующих образований, отсутствие необходимости в седации, лучше переносится.
• Против: отсутствие лечебных возможностей, чувствительность ниже, чем при колоноскопий, наличие образований или неясные находки требуют выполнения колоноскопий, по-прежнему необходима подготовка кишки.
• Меры предосторожности: необходимо повторять каждые 5 лет.
• Факты: чувствительность при колоректальном раке 80-85% и 50% при больших полипах (> 1 см).
д) КТ колонография:
• За: полная визуализация толстой кишки, отсутствие необходимости в седации.
• Против: отсутствие лечебных возможностей, по-прежнему необходима подготовка кишки, более выраженный дискомфорт (инсуффляция воздуха, отсутствие седации), дополнительные обследования/вмешательства при случайных находках.
• Меры предосторожности: интерпретация результатов и рекомендации точно не определены.
• Факты: необходимы дальнейшие подтверждения. Полученные данные противоречивы: имеются сообщения о чувствительности/специфичности в отношении крупных образований от сопоставимой с колоноскопией до умеренной.
е) Исследование ДНК в кале:
• За: неинвазивный, удобный, безопасный метод.
• Против: осмотр толстой кишки не производится, низкая и умеренная чувствительность/специфичность, положительный результат требует выполнения колоноскопии или других исследований.
• Меры предосторожности: необходимо повторять ежегодно.
• Факты: чувствительность выше, чем при анализе кала на скрытую кровь; 50% -при инвазивном КРР, 15-20% — при больших аденомах.
а) Начальный скрининг (при отсутствии находок) на рак толстой кишки
Цель: выявление и удаление образований-предшественников, выявление больных группы риска для стратификации частоты скрининга/дальнейшего наблюдения.
1. Лица среднего риска, без симптомов заболевания, не афроамериканцы => начало в возрасте 50 лет.
а. Колоноскопия каждые 10 лет (метод выбора).
б. Ежегодный анализ кала на скрытую кровь; если положительный => колоноскопия.
в. Скрининговая сигмоидоскопия каждые 5 лет.
г. Ирригоскопия с двойным контрастированием каждые 5 лет.
2. Лица с повышенным индивидуальным риском => специальные руководства:
а. Афроамериканцы: начало скрининга в возрасте 45 лет.
б. Наличие семейного анамнеза (группа повышенного риска): начало в возрасте 40 лет или на 10-15 лет раньше возраста наиболее молодого члена семьи с раком толстой кишки.
в. Язвенный колит: через 7 лет после начала заболевания ежегодная (дважды в год) колоноскопия с множественными биопсиями.
г. САТК: начало в подростковом возрасте (или генетическое тестирование).
д. ННПРТК: начало в возрасте около 25 лет (или генетическое тестирование); затем повторные колоноскопии каждые 1-3 года из-за более короткой последовательности «аденома — рак».
б) Повторная колоноскопия после полипэктомии для исключения рака толстой кишки
Цель: выявление и удаление аденом, пропущенных при первичном осмотре (10-20% полипов размером 6 мм остаются невыявленными); оценка предрасположенности к образованию новых аденом с неблагоприятными патоморфологическими признаками.
1. Короткий интервал (основанный на клиническом суждении):
а. Множественные аденомы.
б. Малигнизированные полипы (рак в полипе).
в. Большие сидячие полипы.
г. Неполная колоноскопия или неполное удаление.
2. Трехлетний интервал:
а. Большие или множественные полипы (>3).
3. Пятилетний интервал:
а. Один или два небольших полипа (тубулярная аденома).
4. Не требуется наблюдение:
а. Гиперпластические полипы (исключение: больные с гиперпластическими полипозными синдромами).
в) Повторная колоноскопия при спорадическом раке толстой кишки (не при ННПРТК/аттенуированном САТК)
Цель: выявление синхронного/метахронного рака толстой кишки; выявление истинных рецидивов в области анастомоза (риск полная колоноскопия должна быть выполнена в течение 6 месяцев.
2. Годичный интервал: а. После операции.
3. Трехлетний интервал:
а. Если ничего не выявлено при предоперационной или первой послеоперационной колоноскопии.
4. Пятилетний интервал
а. В дальнейшем, если ничего не выявлено. ННПРТК/АСАТК: ежегодное наблюдение за оставшимися отделами толстой кишки.
Наблюдение за пациентом в динамике:
— Результаты патоморфологического исследования.
— Побочные эффекты полипэктомии: полипэктомический синдром, перфорация, кровотечения.
— Операции по поводу больших полипов или рака. Профилактические операции?
— Вторичная профилактика?
источник
Скрининг колоректального рака необходим для выявления лиц с факторами риска колоректального рака, а также лиц, имеющих бессимптомное или малосимптомное течение заболевания. Проведение скрининговых мероприятий помогает своевременно выявить заболевание, провести диагностику и лечение, что в значительной степени предотвращает развитие заболевания.
В первую очередь скрининг рекомендован людям с высоким риском заболевания. К этой группе относятся лица, у которых есть:
- семейная история заболевания, когда ближайшие родственники страдали/страдают раком толстой и/или прямой кишки;
- генетически-детерминированные синдромы в анамнезе — аденоматозный полипоз, синдром Линча, MUTYH-ассоциированный полипоз (МАП);
- в прошлом верифицирован диагноз колоректальный рак или были обнаружены определённые типы полипов;
- воспалительные заболевания кишечника в анамнезе: язвенный колит или болезнь Крона;
- радиационное облучение области таза и брюшной полости по поводу рака в прошлом.
Таким пациентам рекомендовано:
- Начинать обследования лучше до 40 лет, если у родственника был диагностирован колоректальный рак в возрасте до 60 лет.
- Начинать скрининговые мероприятия на 10–15 лет раньше срока, когда был выявлен самый молодой случай заболевания в семье.
Основная задача скрининга для этой группы пациентов сводится к длительному наблюдению.
Второй составляющей задачей скрининга является выявление заболевания на ранней стадии. Поскольку вероятность рака толстой и прямой кишки увеличивается после 50 лет, даже при условии отсутствия факторов риска, то лицам из группы среднего риска рекомендовано:
- Проведение скрининговых исследований в возрасте 50–75 лет. Риск и польза различных методов скрининга варьируют между собой, но главным остаётся тот факт, что скрининговые исследования должны быть пройдены.
Проведение скрининга в возрастной группе 76–85 лет должно определяться строго индивидуально, исходя из состояния здоровья человека и истории предварительного скрининга, если таковой имел место. Скрининговые исследования у данной группы лиц скорее всего принесут пользу тем, кто ранее не участвовал в программах обследования по поводу колоректального рака.
Характеристика различных методов, используемых при скрининге
Скрининг проводится с помощью специальных методов диагностики. Существует два варианта скрининга: инвазивный и неинвазивный. В зависимости от применяемых методов он может быть одноэтапным и двухэтапным. Одноэтапный скрининг заключается в выполнении только инвазивных процедур диагностики. Двухэтапный скрининг проводится с помощью двух групп методов — лабораторных исследований и методов визуализации.
Для скрининга колоректального рака доступно несколько вариантов лабораторных тестов, которые относятся к неинвазивным методам диагностики:
- Высокочувствительный фекальный иммунохимический тест (FIT). Иммуноферментный тест, в основе которого лежит реакция взаимодействия специфичных антител с гемоглобином или комплексом гемоглобин с гаптоглобином, поэтому снижена вероятность получения ложноположительных результатов. Определение комплекса гемоглобин-гаптоглобин высокочувствительно по отношению к опухолям нижних отделов желудочно-кишечного тракта. Рекомендуется проводить FIT-тест каждый год.
- Высокочувствительный анализ фекальной оккультной крови на основе гваяка (gFOBT). Биохимический тест, основан на выявлении гемоглобина в кале, который способен вступать в окислительно-восстановительные реакции. Проба положительна при кровотечении объёмом 30–50 мл. Многократное выполнение пробы позволяет исключить ложноположительные результаты и своевременно выявить начальные этапы малигнизации. Требует соблюдения диеты перед выполнением. Чувствительность и специфичность теста в отношении выявления колоректального рака составляет 30%, поскольку тест диагностирует скрытые кровотечения из различных отделов желудочно-кишечного тракта при отсутствии колоректального рака. Рекомендуется проводить анализ каждый год.
- Многоцелевой анализ ДНК стула (MT-sDNA). Метод полимеразной цепной реакции, основан на выявлении клеточной ДНК, относящейся к опухолевой, которая выводится со стулом. Подходит для выявления крупных аденом и ранних стадий колоректального рака. Не требует специальной подготовки. Результат теста может привести к чрезмерному интенсивному наблюдению и опасению пациента из-за генетической составляющей. Рекомендуется проводить каждые 3 года.
Визуальные (структурные) методы обследования толстой кишки и прямой кишки подразумевают инвазивный вариант диагностики:
- Колоноскопия. «Золотой стандарт» диагностики колоректального рака. С помощью метода можно исследовать весь просвет толстого кишечника, проводить биопсию новообразований и полипов. Чувствительность и специфичность метода в отношении выявления заболевания составляет 95%. Рекомендуется проводить каждые 10 лет.
- КТ-колонография (виртуальная колоноскопия). Метод позволяет проводить осмотр толстого кишечника на всём протяжении и выявлять полипы, имеющие размер свыше 10 мм. Не позволяет проводить биопсию полипов и новообразований, для этой цели прибегают к колоноскопии. Проведение исследования сопряжено с раздуванием кишечника, поэтому процедура может доставить неприятные ощущения пациенту. Рекомендуется проводить каждые 5 лет.
- Гибкая сигмоидоскопия (ФСИГ). Более щадящая методика по сравнению с колоноскопией, легче переносится пациентом. Ограничением является выполнение осмотра лишь ограниченного анатомического участка — слизистой оболочки прямой и сигмовидной ободочной кишок. Рекомендуется проводить каждые 5 лет.
Для решения вопроса о скрининге требуется поиск оптимального метода тестирования с учётом предпочтений пациента, точности, частоты исследования и инвазивности.
Ключевые рекомендации
- В качестве первого этапа скрининга рекомендовано выполнение FIT-теста.
- Чувствительность обнаружения колоректального рака при однократном проведении FIT-теста составляет 80%, аденом — 20%. Для обнаружения аденом необходимо выполнить FIT-тест дважды.
- Использование FIT-теста предпочтительно по сравнению с гваяковым тестом из-за высокой чувствительности к колоректальному раку и прогрессирующим неоплазиям.
- При выборе между качественным и количественным FIT-тестом, предпочтение следует отдать количественному.
- Положительный FIT-тест требует выполнения колоноскопии.
- В случае положительного FIT-теста и последующего отрицательного результата при проведении колоноскопии, не следует проводить оценку состояния верхних отделов желудочно-кишечного тракта, при условии отсутствия других симптомов.
- FIT-тест выполняется в анализе кала, полученном при самостоятельной дефекации, но не при ректальных исследованиях.
- Подготовка к выполнению FIT-тест не требует соблюдения диеты пациентом и не накладывает ограничения на приём лекарственных средств накануне выполнения исследования.
Наиболее частый результат скрининга колоректального рака — это выявление аденом. После их удаления пациенты должны находиться под наблюдением, аналогично пациентам, у которых выявили и провели лечение по поводу рака. То бишь относящиеся к группе высокого риска.
источник
Рассматриваемая онкопатология занимает третье место по шкале распространенности раковых заболеваний в мире. Кроме того, уровень смертности от указанного недуга, особенно в западных странах, достаточно высок. Чтобы исправить сложившуюся ситуацию, специалисты рекомендуют проводить скрининг колоректального рака лицам со средним и высоким уровнем риска.
Указанная процедура предусматривает две основных стратегии: исследование кала и эндоскопические методики. Такие мероприятия способствуют выявлению предраковых изменений у практически здоровых людей.
Показания к выполнению тестов на рак прямой кишки и толстой кишки – кому необходимо пройти колоректальный скрининг прямо сейчас?
Рассматриваемая процедура показана лицам с высоким риском развития колоректального рака.
- Пациенты, у которых в истории болезни имеются сведения о наличии аденоматозных полипов.
- Те, кто перенес полноценное хирургическое лечение раковой опухоли тонкого/толстого кишечника.
- Семейный анамнез колоректальных новообразований (опухоли, аденоматозные полипы) у родственников 1-й линии родства если указанная онкопатология была диагностирована у них до пересечения 60-летнего рубежа. К повышенной группе риска также относят лиц, у которых у двоих и более родственников первой линии не зависимо от их возраста был диагностирован КРР.
- Воспалительные заболевания кишечника: болезнь Крона и неспецифический язвенный колит.
- Наследственные синдромы. В первую очередь, это касается:
— Семейного аденоматозного полипоза.
— Синдрома Пейтца-Егерса. Помимо полипоза органов жкт, диагностируется также пигментация кожных покровов и слизистых оболочек.
— Наследственного неполипозного колоректального рака.
— Синдрома множественных гамартом. Указанные новообразования являются доброкачественными, и они могут располагаться в отделах жкт, щитовидке, головном мозге, органах мочевыделительной и репродуктивной системы.
Семейный анамнез и колоректальный рак
Противопоказания к колоноскопии, входящей в программу колоректального скрининга — кому не назначат это исследование?
Рассматриваемая процедура применяется только по отношению к здоровым людям. Если же у пациента недуг кишечника уже выявлен, надобности в проведении колоректального скрининга у него нет.
- Период вынашивания ребенка.
- Аллергические реакции, либо плохая переносимость анестетических средств.
- Патологии жкт, при которых у пациента наблюдается резкое беспричинное снижение веса за последние полгода, наличие крови в каловых массах согласно проведенным тестам, а также железодефицитная анемия.
- Болезни крови, что связанны с ее свертываемостью.
- Диагностирование у пациента сопутствующих недугов, при которых колоноскопия представляет опасность для здоровья и даже жизни. К подобным заболеваниям относят:
— Сахарный диабет, что сопровождается сосудистыми обострениями.
— Злоупотребления алкогольными напитками.
— Серьезные сбои в работе сердца и/или печени.
— Нарушение мозгового кровообращения, на фоне которого развивается кислородное голодание ГМ.
Кроме того, колоноскопию не назначают, если в течение года был сделан анализ кала на скрытую кровь, либо проводились следующие диагностические мероприятия:
Начало проведения скрининга, если речь идет о наследственном факторе, будет определяться возрастом самого пациента, а также возрастом родственников, у которых была выявлена та или иная патология кишечника:
- После 40-летнего возраста назначают колоноскопию, которую в дальнейшем повторяют раз в 5 лет при диагностировании колоректального рака у родителей, братьев/сестер, детей пациента до достижения ими 60 лет. Этот же принцип распространяется на тот случай, если указанная онкопатология была диагностирована у двух и более родственников первой степени не зависимо от их возраста. Доктор также может назначить прохождение скрининга пациенту на 10 лет раньше возраста, при котором колоректальный рак/аденоматозные полипы были выявлены у первого ближайшего родственника.
- После достижения 10-12 лет ежегодно рекомендуется проводить сигмоскопию при диагностировании — либо при повышенном риске развития — семейного аденоматозного полипоза.
- Начиная с 20-летнего возраста, каждые 2 года следует проводить колоноскопию в случае повышенного риска появления либо при генетическом/клиническом диагностировании наследственного неполипозного колоректального рака. Допускается также начинать проводить скрининг на 10 лет раньше возраста, при котором рассматриваемый тип онкопатологии был диагностирован у самого первого родственника.
- После пересечения 50-летнего рубежа при отсутствии отягощающего семейного анамнеза и иных факторов, что могут привести к увеличению степени риска развития КРР, колоноскопию проводят единожды в жизни. При наличии противопоказаний к указанной процедуре, выбор делают в пользу гибкой сигмоскопии (1 раз на протяжении жизни, если в ходе обследования не выявлено каких-либо дегенеративных изменений). Если же сигмоскопия также нежелательна, такой группе пациентов проводят ежегодное тестирование кала на скрытую кровь.
- Каждые 1-2 года в специализированных медицинских центрах проводят колоноскопию пациентам, у которых диагностирована болезнь Крона, либо неспецифический язвенный колит. Начинать скрининг рекомендуется через 8-10 лет после начала развития указанных патологий.
Периодичность проведения скрининговой колоноскопии у пациентов с колоректальными полипами будет зависеть от типа новообразования:
- Каждые 10 лет в случае выявления гиперпластического полипа. Начинать скрининг рекомендуется через 3-6 лет после полипэктомии. Исключением является гиперпластический полипозный синдром в анамнезе, — скрининг в подобных ситуациях проводят намного чаще.
- Каждые 5-10 лет при выявлении максимум двух тубулярных аденом, параметр которых не превышает 10 мм, и которые имеют низкую степень дисплазии. Периодичность проведения колоноскопии определяется доктором на основании предыдущих результатов диагностики. Первый скрининг следует проводить не позже, чем через 3 года после удаления аденомы.
- Раз в пять лет при наличии от 3 до 10 аденом, либо при наличии одного большого аденоматозного полипа (от 1 см в диаметре). При этом, первая колоноскопия проводится не позже чем через 3 года после хирургического удаления всех аденом.
- Каждые 3 года в случае выявления более 10 колоректальных полипов. В этом случае пациенту в обязательном порядке необходимо пройти генетическое тестирование на семейный аденоматозный полипоз!
В случае резекции толстого кишечника по поводу лечения КРР, первая колоноскопия проводится в течение года после хирургической манипуляции.
Этапы колоректального скрининга – все тесты, анализы и диагностические мероприятия на выявление рака прямой и толской кишки
Скрининговые тесты на предупреждение колоректального рака включают:
- Определение скрытой крови в кале. Дает возможность выявить указанную онкопатологию у бессимптомных пациентов. Зачастую прибегают к гваяковой пробе Вебера. Достоверность результатов данного теста повышается при его проведение каждые 1-2 года в течение длительного периода. Но в этом и заключается вся загвоздка: далеко не все лица согласны активно участвовать в проведении повторных анализов на протяжении длительного времени учитывая тот момент, что к обследованию нужно готовиться. Кроме того, данный анализ может давать как ложноположительные, так и ложноотрицательные результаты. В первом случае пациентов посылают на весьма инвазивную для организма колоноскопию, которая в конечном счете оказывается ненужной. Альтернативной гваяковой пробы является иммунохимический метод определения крови в кале (FIT). Положительная сторона таких тестов – отсутствие необходимости соблюдать диету при подготовке к обследованию. Как и предыдущий анализ FIT нужно повторять каждый год, а для большей информативности его следует сочетать с инструментальными методами диагностики.
- Анализ кала на содержание ДНК.
- Гибкая сигмоскопия. Исследуемая площадь составляет 60 см, начиная от анального отверстия и до толстого кишечника. С ее помощью доктор может осмотреть левую часть толстой кишки, прямую кишку, и при необходимости взять образец патологического элемента для лабораторного исследования. Подготовка к данной манипуляции несложная, а длится она меньше, чем колоноскопия.
- Колоноскопия. Является золотым стандартом в выявлении колоректального рака. Однако такая процедура требует тщательной и длительной подготовки, а риск развития осложнений после ее проведения значительно выше, чем при гибкой сигмоскопии.
- Ирригоскопия с двойным контрастированием (ИДК). К ней прибегают при невозможности применения более информативных методик исследования толстой кишки. Минусом данной процедуры является большое количество ложноположительных результатов: артефакты кишечника могут определяться как аденомы. Однако, в половине случаев посредством рассматриваемой манипуляции удается обнаружить большие полипы.
- Компьютерно-томографическая колонография (КТК). Дает возможность получения двух- и трехмерного изображения просвета толстого кишечника. Данная скрининговая процедура нечувствительна в отношении плоских новообразований. Ее эффективность также снижается при наличии в толстой кишке нескольких полипов, что отличаются по своим параметрам. Не самой лучшей перспективой является также получение пациентом в ходе КТК определенной дозы ионизирующего излучения. С целью минимизации радиоактивного излучения европейскими странами изучается возможность использования магнитнорезонансной колонографии.
- Гваяковая смола, что используется, как основной ингредиент при тестировании каловых масс на скрытую кровь, может реагировать на некоторые овощи, фрукты, красное мясо, что может спровоцировать ложноположительные результаты. В связи с этим, за несколько дней до анализа пациентам нужно придерживаться определенной диеты.
- Женской части населения иммунохимический тест кала на скрытую кровь следует проходить после завершения менструации.
- Также за несколько дней до тестирования следует отказаться от приема препаратов, способствующих разжижению крови: варфарина, аспирина и пр.
- Перед колоноскопией и компьютерно-томографической колонографией пациенту нужно принимать слабительные средства и ставить очистительные клизмы: требуется полная подготовка кишечника.

источник
«Колоректальный рак» — собирательное понятие для рака (опухоли) различных отделов толстой (colon) и прямой (rectum) кишки. Среди множества онкологических заболеваний эта патология остается наименее освещенной и наиболее покрытой мифами и страхами пациентов, но, тем не менее, современные возможности ранней диагностики дают основания считать КРР на

В России колоректальный рак занимает одну из ведущих позиций. Среди мужчин, заболевших злокачественными новообразованиями, КРР находится на 3-м место после рака легкого и желудка, а у женщин, соответственно, после рака молочной железы и рака кожи. Тревожным фактом является высокий уровень летальности на 1-м году жизни после установления диагноза, обусловленный тем, что при первичном обращении пациентов к врачу запущенные формы рака (III-IV стадии) уже имеют более 70% пациентов с раком ободочной кишки и более 60% пациентов с раком прямой кишки, при этом хирургическому лечению подвергается около 40% больных.
В США ежегодно регистрируется приблизительно 140 000 новых случаев болезни и около 50 000 летальных исходов по поводу КРР. Удивительно, но именно в США отмечается медленная, но постоянная тенденция снижения заболеваемости КРР, а показатели выживаемости при КРР – одни из самых высоких в мире. Данные отчетности Национального института рака США показывают, что 61% пациентов с данным диагнозом преодолел пятилетнюю выживаемость.
В США и многих других западных странах улучшение результатов достигнуто, в частности, своевременным обнаружением и удалением полипов толстой кишки, диагностикой КРР на ранней стадии и более эффективным лечением. К сожалению, во многих странах с ограниченными ресурсами и иной инфраструктурой здравоохранения, особенно в Центральной и Южной Америке и Восточной Европе, смертность от КРР продолжает расти.
Колоректальный рак чаще всего развивается как перерождение аденоматозных (железистых) полипов.
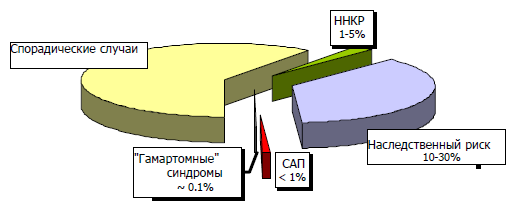
Несмотря на то, что наследственная предрасположенность значительно увеличивает риск развития КРР, большинство случаев является спорадическими (иными словами — непредсказуемыми, эпизодическими), а не семейными: приблизительно 80-95 % случаев спорадических против 5-20%, имеющих наследственную причину. Но среди всех других видов рака у человека КРР проявляет наибольшую связь с семейной заболеваемостью. Исследования молекулярных механизмов развития колоректального рака выявили ряд генетических нарушений, большинство из которых наследуется по аутосомно-доминантному типу и значительно повышает риск развития рака. Семейный аденоматозный полипоз и синдром Линча (наследственный неполипозный колоректальный рак) являются наиболее распространенными из семейных видов рака с изученными генетическими дефектами, вместе на их долю приходится лишь около 5% случаев колоректального рака.
Из других наиболее известных предрасполагающих факторов стоит отметить воспалительные заболевания кишечника (язвенный колит, болезнь Крона) — риск рака увеличивается с продолжительностью течения этих заболеваний. Общая заболеваемость колоректального рака начинает увеличиваться примерно через 8 –10 лет после возникновения воспалительного заболевания кишечника и возрастает до 15-20% через 30 лет. Главными факторами риска являются длительность заболевания, распространенность поражения, молодой возраст и наличие осложнений.
Возраст является значимым фактором риска: колоректальный рак является редкостью до 40 лет, однако частота колоректального рака увеличивается в каждом последующем десятилетии и достигает максимума в 60-75 лет.
Существуют факторы, которые повышают риск развития колоректального рака. Установлено, что популяции людей, в которых заболеваемость колоректального рака высока, употребляют пищу, бедную клетчаткой, но при этом с высоким содержанием животного белка, жира и рафинированных углеводов. Ожирение примерно в 1,5 раза увеличивает риск развития колоректального рака, причем в большей степени у мужчин. Избыточное употребление алкоголя и курение также находятся в числе факторов, повышающих спорадическую заболеваемость полипозом толстого кишечника и колоректального рака, и значительно увеличивают риск рака у пациентов с наследственными заболеваниями толстого кишечника (например, с синдромом Линча).
Это методы активного выявления лиц с факторами риска развития КРР или с бессимптомно протекающим КРР, основанные на применении специальных методов диагностики. Скрининговые исследования при колоректальном раке помогают значительно уменьшить вероятность его развития, так как позволяют выявить предраковое заболевание кишечника или рак на ранней стадии и своевременно оказать лечебную помощь.
В первую очередь скринингу подлежат лица, у которых среди родственников первой линии (у детей, родителей, братьев и сестер) имеются случаи рака толстой или прямой кишки, аденомы и воспалительные заболевания кишечника. Наличие у родственника такого диагноза увеличивает риск примерно в 2 раза по сравнению с популяцией в целом.
Рекомендации ряда научных сообществ по изучению колоректального рака (American College of Gastroenterology, Multisociety Task Force on Colorectal Cancer from the American Cancer Society, American College of Radiology) содержат указания по срокам проведения первой колоноскопии у следующих пациентов:
раннее, до 40 лет, у пациентов, имеющих ближайших родственников с аденомой кишечника, диагностированной в возрасте до 60 лет;
в срок на 10-15 лет раньше, чем был выявлен самый «молодой» КРР в семье, и/или этот диагноз был установлен в 60 лет и моложе.
Сроки скрининговых исследований могут быть изменены, если пациент имеет дополнительные факторы риска КРР: радиационные облучения брюшной полости в раннем возрасте по поводу рака, диагноз акромегалии (при котором возможно развитие аденоматоза толстой кишки), перенесенная трансплантация почки (как причина долгосрочной иммуносупрессивной терапии).
Правый отдел толстой кишки имеет большой диаметр, тонкую стенку и ее содержимое – это жидкость, поэтому закупорка просвета кишки (обтурация) развивается в последнюю очередь. Чаще пациентов беспокоит желудочно-кишечный дискомфорт, обусловленный расстройствами функций соседних органов — желудка, желчного пузыря, печени, поджелудочной железы. Кровотечение из опухоли обычно скрытое, и утомляемость и утренняя слабость, вызванные анемией, могут быть единственными жалобами. Опухоли иногда становятся достаточно большими, что позволяет прощупать их через брюшную стенку, прежде чем появятся другие признаки.
Левый отдел толстой кишки имеет меньший просвет, каловые массы в нем — полутвердой консистенции, и опухоль имеет тенденцию по кругу суживать просвет кишки, вызывая кишечную непроходимость. Застой кишечного содержимого активирует процессы гниения и брожения, что сопровождается вздутием кишечника, урчанием в животе. Запор сменяется обильным жидким, зловонным стулом. Больного беспокоят коликообразные боли в животе. Стул может быть смешан с кровью: кровотечение при раке толстой кишки наиболее часто связано уже с распадом или изъязвлением опухоли. У некоторых пациентов наблюдаются симптомы прободения кишки с развитием перитонита.
При раке прямой кишки основным признаком является кровотечение при дефекации. Всякий раз, когда наблюдается кровотечение или выделение крови из заднего прохода, даже при наличии выраженного геморроя или дивертикулярной болезни, должен быть исключен сопутствующий рак. Могут присутствовать позывы на дефекацию и ощущение неполного опорожнения кишечника. Боль появляется при вовлечении тканей, окружающих прямую кишку.
В ряде случаев, еще до появления кишечных симптомов у пациентов могут обнаруживаться признаки метастатического поражения – распространения опухоли в другие органы, например, увеличение печени, асцит (скопление жидкости в брюшной полости), увеличение надключичных лимфатических узлов.
Нарушение общего состояния больных может наблюдаться и на ранних стадиях и проявляется признаками анемии без видимого кровотечения, общим недомоганием, слабостью, иногда повышением температуры тела. Эти симптомы характерны для множества заболеваний, но их появление стать поводом для немедленного обращения к врачу общей практики.
У колоректального рака существует много «масок», поэтому следует обратиться к врачу за консультацией:
при повышенной утомляемости, одышке, нехарактерной для пациента бледности, если ранее их не было;
при длительных запорах или поносах;
при частых/постоянных болях в области живота;
при наличии видимой крови в кале после дефекации;
при наличии скрытой крови в анализе кала.
При острой боли в области живота, при вздутии или асимметрии живота, при отсутствии отхождения стула и газов следует вызвать «скорую помощь» или срочно обратиться за медицинской помощью.
Как только диагностирован рак, пациентам необходимо выполнить компьютерную томографию брюшной полости и грудной клетки с целью выявления метастатических поражений, а также лабораторные исследования для оценки выраженности анемии.
У 70 % пациентов с колоректальным раком наблюдается повышение уровня раково-эмбрионального антигена сыворотки (РЭА) и онкомаркера СА19.9. В дальнейшем мониторинг РЭА и СА19.9 может быть полезным для ранней диагностики рецидива опухоли. По показаниям исследуются и другие маркеры колоректального рака.
Основным скрининговым исследованием у пациентов старше 50 лет со средней степенью риска является колоноскопия. При наличии полипов или другой патологии в толстой и прямой кишке регулярность исследований может возрастать до ежегодных или каждые 3-10 лет. Оценивая степень риска развития колоректального рака у пациентов с заболеваниями кишечника, врач принимает решение о частоте проведения исследований индивидуально для каждого больного.
Лишь только такая активная позиция врачей по поводу ранней диагностики полипов и профилактике опухолей толстой и прямой кишки привела к замедлению темпов роста заболеваемости колоректального рака в США.
Хирургическое лечение колоректального рака может быть проведено у 70-95 % пациентов без признаков метастатической болезни. Хирургическое лечение заключается в удалении сегмента кишки с опухолью с местным лимфатическим аппаратом с последующим соединением концов кишки (созданием анастомоза) для сохранения естественной способности к опорожнению кишечника. При раке прямой кишки объем операции зависит от того, на каком расстоянии от анального отверстия расположена опухоль. Если необходимо полностью удалить прямую кишку, формируется постоянная колостома (хирургически созданное отверстие в передней брюшной стенке для выведения кишки), через которую содержимое кишечника будет опорожняться в калоприемник. Учитывая современные достижения медицины и приспособления для ухода за колостомой, негативные последствия этой операции сводятся к минимуму.
При наличии метастазов в печени у неистощенных пациентов рекомендуется удаление ограниченного числа метастазов в качестве дальнейшего метода хирургического лечения. Эта операция выполняется, если первичная опухоль была полностью удалена, метастаз печени находится в одной доле печени и отсутствуют внепеченочные метастазы. Выживаемость после операции в течение 5 лет составляет 6- 25 %.
Эффективность лечения колоректального рака зависит от того, на какой стадии болезни пациент обратился к врачу. Только ранняя диагностика колоректального рака позволяет максимально использовать весь спектр современных методов лечения и добиться удовлетворительных результатов.
Внимательное отношение к своему организму и своевременное обращение за квалифицированной медицинской помощью увеличивает шансы на продолжение активной жизни даже при таком серьезном онкологическом заболевании.
источник
Практическое руководство Всемирного гастроэнтерологического общества (WGO) и Международного союза по профилактике рака пищеварительной системы
Колоректальный рак (КРР) – широко распространенная во всем мире патология, которой каждый год заболевает 1 млн человек, а ежегодное количество смертей превышает 500 тыс. По прогнозам экспертов, в следующие два десятилетия абсолютное число случаев КРР в мире увеличится в результате роста населения в целом и его старения как в развитых, так и развивающихся странах.
КРР занимает второе место по смертности от злокачественных новообразований среди мужчин и женщин. Чаще всего КРР возникает из аденом толстой кишки, в отдельных случаях – у пациентов с генетически детерминированными синдромами полипоза или воспалительными заболеваниями кишечника (ВЗК). Термин «полип» означает наличие отдельного участка ткани, который выдается в просвет кишки. Согласно данным, полученным при проведении колоноскопии в рамках скрининга, распространенность аденоматозных полипов составляет 18-36%.
Риск возникновения КРР значительно варьирует даже в пределах одной страны и различается между отдельными лицами в зависимости от особенностей диеты, стиля жизни и наследственных факторов.
Наиболее частый результат скрининга КРР – выявление аденомы. После удаления аденомы пациенты должны находиться под наблюдением точно так же, как и пациенты, у которых выявили и провели лечение рака.
Это руководство посвящено скринингу – обследованию бессимптомных мужчин и женщин с высокой вероятностью наличия аденоматозных полипов или рака. Скрининг входит в программу, включающую первичную профилактику (диету, определенный стиль жизни), своевременное обследование с применением колоноскопии у лиц с положительным результатом скрининга (где это доступно и в соответствии с уровнем программы скрининга) и своевременное лечение (полипэктомия, хирургическое вмешательство).
Скрининг КРР – достаточно сложное мероприятие, имеющее различные варианты организации, требующее определенных усилий от пациентов (сбор образцов кала для определения в них скрытой крови, подготовка к проведению колоноскопии и др.), включающее применение седативных препаратов и требующее наличие помощника для проведения некоторых исследований (колоноскопия). Для успешного проведения скрининга должен произойти ряд последовательный событий: встреча пациента с осведомленным врачом общей практики и получение от него рекомендаций о необходимости проведения скрининга, получение согласия пациента на обследование, наличие финансовых возможностей, определение группы риска, проведение обследования, своевременная диагностика и лечение, осуществление соответствующего последующего наблюдения. Если хотя бы одно из указанных событий выпадет или будет выполнено на недостаточно квалифицированном уровне, скрининг окажется неудачным.
Методология и литературный обзор
В руководствах WGO суммируются все данные, опубликованные в систематических обзорах, руководствах, отвечающих требованиям доказательной медицины, результатах качественно организованных исследований. Эта информация обрабатывается таким образом, чтобы составленное итоговое руководство было адекватным, понятным и применимым во всем мире, содержащим различные подходы с учетом местных ресурсов, культурных предпочтений и существующих порядков в той или иной стране. Руководства WGO не являются систематическими обзорами, основанными на других систематических и исчерпывающих обзорах всех доступных источников и руководств. Глобальное руководство пытается выявить различия между отдельными регионами с различными ресурсами и эпидемиологической обстановкой.
Это руководство было создано коллективом авторов на основе анализа литературных данных с целью выявления изменений и новшеств, появившихся со времени публикации в 2002 г. первого положения, отражающего позицию WGO относительно проблемы скрининга КРР. Каждый член авторского коллектива работал в отдельной секции, а международные эксперты проверили каждый раздел на конечном этапе составления руководства.
Эпидемиология колоректального рака
Согласно базе данных Globocan Международного агентства по изучению рака (IARC) в 2002 г. заболеваемость КРР в мире среди мужчин составила 550 тыс., смертность – 278 тыс. случаев, среди женщин – 473 и 255 тыс. соответственно. В 2002 г. КРР составил 9,4% всех случаев рака в мире у лиц обоего пола. Чаще всего эта патология регистрируется в Северной Америке, Австралии, Новой Зеландии и странах Европы.
Стандартизированный по возрасту уровень смертности от КРР у мужчин и женщин в западных странах оставался стабильным на протяжении всего ХХ века, и только в последнее время наметился небольшой его спад. В то же время в странах с прежде невысоким риском КРР смертность от этой патологии стала быстро увеличиваться.
В Европе стандартизированный по возрасту уровень смертности уменьшается в большинстве стран Северной и Центральной Европы, но увеличивается в восточных и южных регионах. В последние годы тенденции смертности от КРР систематически оказываются более «благоприятными» для женщин, чем для мужчин.
По данным регистров Surveillance Epidemiology & End Results (SEER), в США с 1973 по 1989 год стандартизированный по возрасту уровень заболеваемости раком толстой кишки у белых мужчин увеличился на 11%, у черных – на 39%, тогда как заболеваемость раком прямой кишки у белых мужчин уменьшилась на 5%, а у черных – увеличилась на 27%. Заболеваемость раком толстой кишки у белых женщин снизилась на 3%, а у черных – увеличилась на 26%, при этом данные показатели рака прямой кишки уменьшились на 7 и 10% соответственно. Начиная с 1990 г. стандартизированный по возрасту уровень заболеваемости раком толстой кишки начал снижаться, что, вероятно, обусловлено внедрением практики проведения превентивной полипэктомии.
В Японии стандартизированный по возрасту уровень смертности от КРР в середине ХХ века был низким, однако в периоды между 1955-1974 и 1975-1984 гг. увеличился примерно в 3 раза у лиц обоего пола.
В связи с постарением населения во всем мире ожидается значительное увеличение количества случаев КРР.
Факторы риска развития КРР
Средний уровень риска. Риск КРР возрастает с увеличением возраста и наличием семейного анамнеза. КРР редко возникает до 50 лет, но после этого рубежа его частота резко увеличивается. Лица старше 50 лет при отсутствии семейного анамнеза входят в группу среднего риска.
Уровень риска при наличии семейного анамнеза. КРР, возможно, демонстрирует наибольшую связь с семейным анамнезом среди всех видов онкологических паталогий. Примерная доля КРР, в основе которого лежат наследственные причины, колеблется в пределах от 5 до 30%. Наследственные синдромы с известными генетическими дефектами составляют только 1-5% всего количества КРР. У 10-30% пациентов с КРР имеется семейный анамнез этого заболевания, однако они не имеют ни одного из известных наследственных синдромов. Наличие КРР у членов одной семьи – частое явление, повышающее риск развития этой патологии. У родственников первой степени пациента с КРР риск возникновения этого заболевания превышает в 2-3 раза риск развития КРР в контрольной группе и показатели среди населения в целом. Более того, риск повышается с увеличением количества родственников с КРР, родственной близости и более молодым возрастом членов семьи при развитии у них КРР. У лиц с КРР в последующем повышается риск развития рака. Таким образом, риск КРР увеличивается у лиц с семейным анамнезом несиндромного КРР, а также у лиц, у близких родственников которых были выявлены аденомы в возрасте до 60 лет (табл.).
Риск при наличии наследственных синдромов. Семейный аденоматозный полипоз (САП) – аутосомно-доминантное заболевание. Одна треть всех новых случаев КРР возникает вследствие мутации de novo.
Наследственный неполипозный колоректальный рак (ННКР), или синдром Линча, – наиболее распространенная форма синдромного семейного КРР. Был разработан список критериев (критерии Amsterdam II), позволяющих установить наличие фенотипа ННКР.
Критерии наследственного неполипозного колоректального рака Amsterdam II
• Имеется, по крайней мере, три родственника с КРР или другими видами рака, имеющими отношение к ННКР (эндометрий, желудок, почка, мочеточник, желчные пути, тонкий кишечник), когда один из них является родственником первой степени двух остальных
• Заболевание имеется хотя бы у двух последующих поколений.
• КРР выявлен у одного из родственников до достижения им 50-летнего возраста.
Другие семейные синдромы КРР (менее частые):
– ювенильный полипоз;
– синдром Пейтца-Егерса;
– синдром Коудена.
Повышение риска развития КРР у пациентов с ВЗК убедительно доказано. Общая заболеваемость КРР начинает увеличиваться примерно через 8-10 лет после возникновения ВЗК и возрастает до 15% через 30 лет. Факторы риска включают такие показатели, как длительность заболевания, распространенность поражения, дебют заболевания в молодом возрасте и наличие таких осложнений, как первичный склерозирующий холангит или стенозирование. Неадекватная медикаментозная терапия и отсутствие наблюдения за больным также могут повышать риск.
Скрининговые тесты и их диагностическая ценность
Задолго до появления клинических симптомов заболевания в каловых массах могут быть выявлены кровь и другие компоненты ткани, поэтому такие анализы могут помочь раннему выявлению и проведению скрининга колоректального рака у бессимптомных пациентов. Чаще всего с этой целью проводят определение скрытой крови в каловых массах. Как показано в нескольких рандомизированных исследованиях, такие анализы улучшают диагностику и снижают смертность от КРР на 15-33% в общей популяции и на 45% у участников в зависимости от типа используемого анализа и частоты проведения исследования.
Анализы кала на скрытую кровь (АКСК). Для выявления скрытой крови в кале наиболее часто используется гваяковая проба Вебера. Гваяковая смола меняет свой цвет в присутствии пероксидазы гема, однако это ее свойство приводит к тому, что она вступает в реакцию и с другими пероксидазами, которые могут присутствовать в каловых массах, – овощей, фруктов и красного мяса. В связи с этим во избежание ложноположительных результатов необходимо соблюдение определенной диеты.
При одноразовом проведении чувствительность АКСК достигает всего 50-60%, в то же время она может составлять 90% при проведении анализа один раз в 1-2 года в течение длительного периода времени. Хотя чувствительность теста можно увеличить за счет регидратации, это приводит к столь значительной вариабельности результатов анализа, что делает его неприемлемым для проведения скрининга. Низкая чувствительность метода обусловливает большое количество ложноотрицательных результатов и появление эффекта «ложного благополучия». Множество случаев «выявления» скрытой крови в каловых массах оказывается ложноположительным, что ведет к последующему направлению пациентов на дополнительные обследования, обычно – колоноскопию. Другой проблемой проведения скрининга с использованием АКСК является то, что для его эффективности требуется согласие и активное участие обследуемого при проведении повторных исследований в течение многих лет.
В настоящее время во многих странах АКСК с использованием гваяковой пробы Вебера заменяется иммунохимическими анализами кала (ИАК), при проведении которых для определения гемоглобина применяют чувствительные и специфичные методы. Такие исследования позволяют устранить необходимость соблюдения диеты. Приемлемый минимальный уровень чувствительности для ИАК, при котором они смогут быть широко использованы, еще изучается.
Анализ кала на содержание ДНК в скрининге КРР. Предполагается, что выявление измененной ДНК в образцах кала может стать методом раннего выявления КРР. Однако оптимальное количество молекулярных маркеров предстоит еще установить, как и пригодность таких тестов для обследования больших групп населения. В одном из исследований сравнивали тестовую систему для анализа кала на содержание ДНК, содержащую набор из 21 мутации, с АКСК при помощи гваяковой пробы Вебера у 2507 лиц. Чувствительность анализа кала на ДНК в выявлении КРР составила 52% по сравнению с 13% при проведении гваяковой пробы Вебера, при этом специфичность тестов была одинаковой – 94,4 против 95,2%. Таким образом, результаты гваяковой пробы были исключительно низкими. В нескольких других небольших исследованиях было показано, что чувствительность данного метода в среднем может достичь 65, а специфичность – 95%. Новые версии такого анализа с использованием наборов с меньшим количеством мутаций могут увеличить его чувствительность до 80% и более.
Эндоскопические скрининговые исследования
Гибкая сигмоскопия позволяет непосредственно обследовать внутреннюю поверхность толстой кишки на расстоянии до 60 см от анального отверстия. С помощью этого метода можно выявлять колоректальные полипы и опухоли, а также удалять полипы и брать образцы ткани для гистологического исследования. Преимущества гибкой сигмоскопии:
– процедуру может проводить как врач, так и исследователь доврачебной категории;
– меньшие затраты времени, чем при колоноскопии;
– более простая и быстрая подготовка кишечника к исследованию;
– незначительная частота осложнений при исследовании, не сопровождающемся проведением полипэктомии;
– нет необходимости в применении седативных препаратов.
Однако очевидным недостатком этого метода является возможность обследования только левой части толстой кишки. Специфичность гибкой сигмоскопии составляет 98-100% (при нескольких ложноположительных результатах), однако ее чувствительность в отношении всей толстой кишки – всего 35-70% из-за наличия большого количества правосторонних аденом, которые встречаются при отсутствии дистально расположенных опухолей и могут быть пропущены при проведении гибкой сигмоскопии.
Сигмоскопия применяется для скрининга, раннего выявления и предупреждения рака у бессимптомных лиц. Исследования случай-контроль показывают, что скрининг с использованием сигмоскопии снижает смертность от рака толстой кишки на 60-70% в популяции в исследуемом районе. Серьезные осложнения возникают в одном из 10 тыс. случаев.
Колоноскопия позволяет выявлять и удалять полипы, проводить биопсию опухоли, расположенной в толстой кишке. Специфичность и чувствительность колоноскопии при выявлении полипов и новообразований составляют около 95%. Согласно результатам последовательно проводимых колоноскопий аденомы диаметром
На сегодня не проведено проспективных рандомизированных исследований, в которых бы оценивалось влияние колоноскопии на заболеваемость или уровень смертности. Однако по данным математического моделирования отдаленные результаты полипэктомии (United States National Polyp Study) показывают почти 90% снижение случаев заболеваемости КРР и смертельных исходов от него.
В идеале скрининговое исследование должно быть простым, недорогим и легко проводимым в группах риска КРР. Несмотря на то что эти критерии для колоноскопии выполняются не полностью, она является золотым стандартом в выявлении КРР, поэтому пациенты с положительным результатом других скрининговых исследований (АКСК, сигмоскопия, компьютерно-томографическая колонография) должны быть в последующем направлены на колоноскопию (при наличии такой возможности). Серьезные осложнения при ее проведении возникают в 1-2 из 1000 случаев.
Ирригоскопия с двойным контрастированием (ИДК) позволяет исследовать всю толстую кишку, однако ее чувствительность и специфичность ниже диагностических показателей, получаемых при проведении колоноскопии и компьютерно-томографической колонографии. Даже при наличии больших полипов и опухолей ИДК обладает существенно более низкой чувствительностью (48%), чем колоноскопия. Кроме того, ИДК дает больше, чем колоноскопия, ложноположительных результатов (артефакты, определяемые как полипы). Пациентам, у которых при ИДК была выявлена патология, в последующем необходимо проводить колоноскопию. Несмотря на эти недостатки, ИДК широко распространена, и тот факт, что с ее помощью можно выявить до 50% больших полипов, будет и в дальнейшем обусловливать ее применение при отсутствии возможности проведения более точных исследований.
Компьютерно-томографическая колонография (КТК). Послойное спиральное компьютерно-томографическое сканирование брюшной полости и таза с последующей цифровой обработкой и анализом изображений может создать как дву-, так и трехмерную реконструкции просвета толстой кишки («виртуальная колоноскопия»). Проведение этого исследования требует инсуфляции воздуха для раздувания кишки до максимально возможного объема (примерно 2 л комнатного воздуха или углекислого газа) и предварительного очищения кишки с помощью слабительных средств.
Метаанализ исследований, в которых КТК использовали для выявления колоректальных полипов и рака, показал, что при наличии полипов больших размеров (?10 мм) чувствительность и специфичность составили 93 и 97% соответственно. Однако при комбинации полипов больших и средних размеров (?6 мм) чувствительность и специфичность метода снижались до 86%. При исследовании полипов разных размеров разброс показателей чувствительности (45-97%) и специфичности (26-97%) становился значительным. В то время как чувствительность КТК при выявлении рака и больших полипов является вполне удовлетворительной, при определении полипов размерами 6-9 мм ее нельзя признать таковой. Серьезным препятствием для использования КТК в скрининге пациентов с высоким риском являются затруднения в диагностике плоских образований в кишке. Кроме того, для проведения КТК в качестве скрининговой процедуры пациента необходимо подвергнуть повторному воздействию ионизирующего излучения. Недавно появившаяся многоканальная, или многослойная, технология позволила сократить время сканирования и уменьшить дозу радиации, сохранив при этом высокую разрешающую способность метода. В Европе с этой же целью изучается магнитно-резонансная колонография.
Следует отметить, что до сих пор не определен размер полипов, выявляемых при КТК, при котором пациента необходимо направлять на колоноскопию. Это значительно повышает стоимость скрининга. Еще одним недостатком является то, что КТК требует проведения полной подготовки кишечника. Если же пациентам назначается еще и колоноскопия, а существующие возможности не позволяют провести оба исследования в один и тот же день, необходимо провести повторную полную подготовку кишечника. К тому же экстраинтестинальные находки могут потребовать проведения дополнительного радиологического и хирургического обследований, что также приведет к увеличению затрат. Серьезные осложнения при проведении КТК возникают редко.
Стандартные возможности проведения скрининга КРР у лиц со средним риском делают его экономически выгодным. Проведение систематического скрининга с помощью колоноскопии у родственников первой степени пациентов с КРР, начатое в возрасте 40 лет, демонстрирует экономическое преимущество. По сравнению со стоимостью проведения интенсивной химиотерапии запущенного рака с использованием большого количества лекарственных препаратов скрининг является более дешевым мероприятием.
Многоуровневый подход к скринингу – механизм его реализации
В данном разделе представлен обзор различных методов исследования для проведения скрининга у мужчин и женщин в возрасте 50 лет и старше со средним или высоким риском развития КРР. Применение тех или иных методов исследования определяется доступностью колоноскопии, гибкой сигмоскопии, АКСК и ИДК. Если средства для проведения скрининга значительно ограничены, один раз в 1-2 года проводят АКСК у мужчин и женщин со средним риском возникновения КРР начиная с 50 лет. При этом способ проведения АКСК зависит от материальных возможностей и диетических пристрастий населения.
Оптимальными являются иммунохимические тесты, так как они проводятся в течение 2-3 дней и не требуют специальной диеты, однако они более дорогие, что необходимо учитывать при ограниченных финансовых возможностях.
При повышенном риске диагностическое исследование может включать колоноскопию или ирригоскопию, если колоноскопия менее доступна.
Многоуровневый подход к скринингу КРР состоит из набора рекомендаций, применяемых в зависимости от различных уровней ресурсов, начиная с І (наивысшего) и заканчивая VI (минимальные ресурсы) уровнем.
Первый уровень. Приведенные ниже рекомендации применимы в странах с относительно высоким уровнем ресурсов (финансовых, профессиональных, инструментальных) и повышенным риском КРР в популяции (данные IARC), в которых решение этой проблемы является приоритетным для общественного здравоохранения.
Рекомендации по проведению скрининга у лиц со средним риском. Колоноскопия для мужчин и женщин со средним риском начиная с 50 лет и каждые 10 лет при отсутствии факторов, которые могут привести к увеличению риска.
Рекомендации по проведению скрининга у лиц c повышенным риском КРР:
• Лицам с семейным анамнезом КРР или аденоматозными полипами.
• Лицам, у которых имеются родственники первой степени (родители, братья или сестры, дети) с раком толстой кишки или аденоматозными полипами, выявленными до 60 лет, или два родственника первой степени, у которых КРР был выявлен в любом возрасте, рекомендуют проведение колоноскопии начиная с 40 лет или же в возрасте на 10 лет меньшем того возраста, в котором было установлено наличие КРР у первого родственника в их семье, с повторением этого исследования каждые 5 лет.
• Лицам, имеющим родственников первой степени родства, у которых КРР или аденоматозные полипы были выявлены в возрасте старше 60 лет, или двух родственников второй степени родства с КРР, рекомендуют проведение скрининга по такой же методике, что и лицам со средним риском, однако начиная с 40-летнего возраста.
• Лицам, имеющим одного родственника второй (бабушка или дедушка, тетя или дядя) или третьей (прадедушка или прабабушка, двоюродный брат или сестра) степени родства с КРР, рекомендуют проведение скрининга как лицам со средней степенью риска.
• Лицам, имеющим генетически диагностированный САП или риск его развития, которым не было выполнено генетическое тестирование, начиная с 10-12 лет необходимо ежегодно проводить сигмоскопию с целью своевременного установления возможных проявлений генетической патологии. Результаты генетического тестирования должны быть особенно внимательно проанализированы у лиц, имеющих родственников из группы риска. Отделения генетической консультации должны руководить процессом генетического обследования и обсуждением необходимости колостомии.
• Лицам с генетически или клинически диагностированным ННКР или повышенным риском его развития необходимо проводить колоноскопию каждые 1-2 года начиная с возраста 20-25 лет или же на 10 лет раньше самого молодого возраста, в котором был выявлен рак толстой кишки у любого члена семьи. Генетическое обследование для выявления ННКР должно быть проведено родственникам первой степени лиц с установленной наследственной дефектной репарацией генных мутаций. Это исследование следует проводить и в случаях, когда характер семейной мутации не известен, но имеет место один из трех первых модифицированных критериев Bethesda.
• Лица, в анамнезе которых имеются ВЗК, аденоматозный полипоз или КРР, в большей степени нуждаются в последующем врачебном наблюдении, чем в скрининге. В литературе опубликованы соответствующие руководства по методике проведения такого наблюдения.
Второй уровень. Рекомендации те же, что и для первого уровня, но используются при ограниченных возможностях проведения колоноскопии.
Рекомендации по проведению скрининга у лиц со средним риском. Колоноскопия для мужчин и женщин со средней степенью риска в возрасте 50 лет в случае отсутствия факторов, которые могут привести к его повышению, один раз в течение жизни.
Рекомендации по проведению скрининга у лиц с повышенным риском. Для проведения скрининга у таких лиц необходимо следовать тем же рекомендациям, что и на первом уровне.
Третий уровень. Используются те же рекомендации, что и для первого уровня, но применяются их при ограниченных возможностях проведения колоноскопии и доступности гибкой сигмоскопии.
Рекомендации для проведения скрининга при средней степени риска. Гибкая сигмоскопия мужчинам и женщинам со средней степенью риска начиная с 50-летнего возраста каждые 5 лет при отсутствии факторов, которые могут привести к повышению степени риска. При наличии находок при сигмоскопии проводят колоноскопию.
Рекомендации по проведению скрининга у лиц с повышенным риском. Используются те же рекомендации, что и на первом уровне.
Четвертый уровень. Используются те же рекомендации, что и для третьего уровня, но применяют при ограниченных возможностях проведения колоноскопии и гибкой сигмоскопии.
Рекомендации по проведению скрининга при средней степени риска. Гибкая сигмоскопия у мужчин и женщин со средним риском возникновения заболевания однократно в возрасте 50 лет при отсутствии факторов, которые могут увеличить степень риска. При доступности диагностической колоноскопии ее необходимо проводить в случае находок при проведении сигмоскопии или наличия КРР.
Рекомендации по проведению скрининга у лиц с повышенным риском. Используются те же рекомендации, что и на первом уровне.
Пятый уровень. Рекомендации те же, что и на четвертом уровне, но используются при крайне ограниченных возможностях проведения диагностической колоноскопии.
Рекомендации по проведению скрининга у лиц со средней степенью риска. Гибкая сигмоскопия у мужчин и женщин со средним риском один раз в возрасте 50 лет. Диагностическая колоноскопия проводится только в случае выявления рака.
Рекомендации по проведению скрининга лицам с повышенным риском заболевания. Рекомендации зависят от возможности проведения колоноскопии.
Шестой уровень. Рекомендации те же, что и для первого уровня, но применяются при крайне ограниченных возможностях проведения колоноскопии и сигмоскопии.
Рекомендации по проведению скрининга у лиц со средней степенью риска. АКСК ежегодно у мужчин и женщин со средней степенью риска начиная с 50 лет при отсутствии факторов, которые могут увеличить степень риска. Применение того или иного теста зависит от возможностей проведения колоноскопии и диетических пристрастий населения. Диагноз устанавливается на основании результатов колоноскопии или ирригоскопии.
Рекомендации по проведению скрининга лицам с повышенным риском заболевания. Принятие решения о проведении скрининга у лиц этой категории зависит от доступности проведения колоноскопии. В случае ее недоступности скрининг проводят так же, как и лицам со средней степенью риска.
КТК и анализ кала на содержание ДНК проводятся только в некоторых странах. Эти исследования можно использовать у мужчин и женщин со средней степенью риска заболевания с 50-летнего возраста, которые отказываются от проведения скрининга стандартными методами.
Рекомендации по применению программы скрининга
Общие рекомендации
• Необходимо развивать и распространять структурированные образовательные программы среди представителей общественных и медицинских учреждений, государственных деятелей и политических лидеров. Эффективные образовательные программы должны быть применены в отношении каждого участника в соответствующей форме.
• Следует развивать основанные на доказательствах стандарты качества каждого этапа процесса скрининга.
• Необходимо развивать и распространять недорогие и простые в применении клинические методы.
• Следует пропагандировать проведение скрининга в национальных и региональных масштабах.
• Важно развивать скрининг КРР как часть профилактической медицины в целом.
Планирование программы скрининга
• Определение целевой группы населения – бессимптомных мужчин и женщин определенного возраста с наличием факторов риска.
• Решение о проведении скрининга КРР должно основываться на оценке распространенности этой патологии среди населения, которому будет проводиться скрининг.
• Стратегия скрининга (проводимые тесты, их периодичность, возраст обследуемых) должна основываться на рекомендациях соответствующих медицинских руководств, доступности ресурсов, степени риска и культурном уровне населения.
• Чрезвычайно важна поддержка проведения скрининга авторитетными профессионалами, активными группами населения и СМИ.
• Следует оценить наличие и распределение ресурсов (финансовых, кадровых, диагностического оборудования).
• Важно учесть специфические культурные и языковые особенности населения.
Осуществление программы скрининга
• Следует определить места проведения скрининга и обеспечить взаимосвязь с врачами, которые будут осуществлять обследование (врачи общей практики и др.), и группами обследуемого населения.
• Важно развивать и распространять руководства по проведению скрининга, методам диагностики, лечения и наблюдения, ориентированные на пациентов.
• Необходимо совершенствовать методы привлечения пациентов в программу скрининга и дальнейшего наблюдения за ними.
Контроль программы скрининга
• Контроль уровня вовлечения в программу скрининга, организации повторного скрининга, последующего обследования пациентов с положительными результатами скрининга.
• Контроль соответствия программы рекомендациям по наблюдению за пациентами.
• Регулярная оценка качества программы.
• Анализ результатов скрининга, в том числе количества выявленных случаев КРР и распределения их по стадиям, выявленных аденом, осложнений и влияния проведения скрининга на заболеваемость и смертность от КРР в обследованной группе населения.
источник