Предлагаем нашим посетителям воспользоваться бесплатным программным обеспечением «StudentHelp» , которое позволит вам всего за несколько минут, выполнить повышение оригинальности любого файла в формате MS Word. После такого повышения оригинальности, ваша работа легко пройдете проверку в системах антиплагиат вуз, antiplagiat.ru, РУКОНТЕКСТ, etxt.ru. Программа «StudentHelp» работает по уникальной технологии так, что на внешний вид, файл с повышенной оригинальностью не отличается от исходного.

1.Общие свойства моноклональных антител.
Моноклональные антитела (монАТ), в отличие от поликлональных, являются продуктом секреции одной антитело- продуцирующей клетки, либо ее потомков (клона), образовавшихся в процессе деления этой клетки. Все монАТ, являющиеся продуктом одного клона, представлены идентичными молекулами, отсюда вытекают основные свойства моноклональных антител:
а) Все молекулы монАТ, являющиеся продуктом одного клона, имеют одинаковую специфичность, то есть, направлены против одинаковых мест связывания (антигенных детерминант) на каком-либо конкретном антигене, тогда как поликлональная сыворотка имеет в своем составе антитела к разным участкам связывания с антигенам и даже к разным антигенам.
б) Все молекулы монАТ, являющиеся продуктом одного клона, имеют одинаковое сродство к связываемому антигену (аффинность), то есть моноклональные антитела бывают высокоаффинными («прочно» связывающие антиген) и низкоаффинные (образующие легко диссоциирующий комплекс с антигеном). Поликлональная сыворотка всегда представлена антителами разной аффинности.
в) Все молекулы монАТ, являющиеся продуктом одного клона, имеют один изотип и субизотип иммуноглобулинов, чего нельзя сказать о поликлональной сыворотке.
2. Применение моноклональных антител.
Все вышеперечисленные свойства монАТ дают им преимущества перед поликлональными сыворотками в использовании их в диагностических целях, где монАТ нашли свое самое широкое применение.
2.1.Клиническая диагностика растворимых антигенов.
Почти все известные схемы анализа растворимых антигенов на основе монАТ можно отнести к двум типам: метод «двойного сэндвича» (рис.1.) и конкурентный анализ (рис.2.). В обоих случаях используют твердофазный носитель, на который прикрепляют (сорбируют) тем или иным способом монАТ. Далее, в случае «двойного сэндвича», этот носитель инкубируют с исследуемым раствором (чаще всего это биологические жидкости, которые хотят проверить на содержание в них какого-либо белка или низкомолекулярного соединения). Во время инкубации этот антиген (если он имеется в исследуемом растворе) связывается с монАТ, все несвязавшиеся компоненты образца удаляют, промывая твердый носитель буферными растворами или водой.Затем инкубируют со «вторыми» моноклональными антителами, которые, во-первых, должны быть направлены к другой части молекулы антигена, не экранированной первыми сорбированными монАТ, а, во-вторых, должны иметь на себе какую-либо метку, позволяющую регистрировать наличие или отсутствие присоединения «вторых» монАТ к твердому носителю и делать выводы о наличии и количественном содержании искомого антигена в растворе.
Недостатком этого метода является необходимость иметь два монАТ, направленных к разным участкам молекулы антигена и не мешающих друг другу связываться с антигеном. Существует ряд антигенов, как правило, низкомолекулярных, для которых невозможно получить такую пару монАТ по той причине, что антиген имеет только одну антигенную детерминанту, либо антигенные детерминанты расположены на недостаточном расстоянии друг от друга для того, чтобы две достаточно крупные молекулы антител могли независимо их связывать.
В таких случаях используют в среднем менее чувствительный конкурентный анализ. Для этого на твердофазный носитель прикрепляют монАТ, затем инкубируют его с исследуемым образцом, куда предварительно добавили меченый антиген, который хотят обнаружить в образце. При наличии в образце искомого антигена (естественно, немеченого) последний препятствует связыванию меченого антигена с сорбированными монАТ ( конкурирует с ним за связывание с монАТ). В результате самый сильный сигнал наблюдают при отсутствии в исследуемом растворе искомого антигена (отрицательный контроль), а о содержании антигена можно судить по уровню снижения сигнала по сравнению с отрицательным контролем.
2.2.Диагностика вирусов, бактерий и паразитов.
Для диагностики вирусов, бактерий и паразитов чаще применяют вышеописанный метод «двойного сэндвича». Все эти антигены относятся к крупным надмолекулярным образованиям, поэтому стерических проблем со связыванием антител не бывает, даже если и «первые», сорбированные, и «вторые» меченые монАТ направлены к одной и той же антигенной дереминанте, так как каждая антигенная детерминанта многократно повторена на целой клетке или вирусной частице.
Существуют некоторые особенности диагностики вирусов, бактерий и паразитов:
а) Многие из них могут представлять опасность для окружающей среды и людей, проводящих анализ, поэтому исследуемые образцы предварительно подвергают обработке, уменьшающую их возможную инфекционность.
б) Некоторые микроорганизмы представлены разными штаммами и линиями, среди которых могут быть и патогенные, и непатогенные (например, кишечная палочка Е.coli). Для диагностики конкретных патогенных штаммов необходимо использовать такие монАТ, которые избирательно связывают только искомые линии и штаммы. В этом случае применение моноклональных антител имеет особенную ценность, поскольку набор поверхностных антигенных детерминант у разных штаммов и линий микроорганизмов одного вида очень похож, и поликлональная сыворотка не в состоянии «отличать» патогенные штаммы одного вида от непатогенных.
в) Все грамотрицательные бактерии имеют на своей поверхности «шубу», состоящую из липополисахаридов (ЛПС) и предохраняющую бактериальную клетку от взаимодействия антител с бактериальными мембранными белками. Антитела против ЛПС являются не лучшими с точки зрения диагностики микроорганизмов, поскольку молекулы ЛПС очень похожи по структуре и даже часто идентичны не только у разных штаммов одного вида , но и у бактерий разных видов. В связи с этим для диагностики грамотрицательных бактерий необходимы монАТ со следующими свойствами: во-первых, они должны быть направлены против поверхностных бактериальных белков, а не ЛПС; во-вторых, избирательно связывать только искомые штаммы бактерий. Кроме того, иногда необходима предварительная обработка образца для того, чтобы удалить ЛПС и экспонировать белковые антигенные детерминанты.
2.3. Диагностика поверхностных антигенов эукариотических клеток, в частности CD антигенов.
В настоящее время только CD антигенов известно порядка сотни, кроме них на поверхности клеток имеются молекулы адгезии и разнообразные рецепторы. Качественный и количественный состав поверхностных антигенов может дать ценную информацию о функциях конкретной клетки, о ее принадлежности к опухолевым или вирус- инфицированным. Исследование поверхностных молекул клеток позволяет диагностировать ряд заболеваний человека или животного. И вновь моноклональные антитела оказываются незаменимыми в такой диагностике, так как направлены против конкретных поверхностных антигенов.
2.4. Персональные диагностические наборы.
Наиболее широко сейчас используются персональные наборы для определения беременности в домашних условиях. В их основе лежит цветная реакция взаимодействия хорионического гонадотропина мочи с соответствующими моноклональными антителами. Несомненно, большую перспективу могли бы иметь подобные наборы для ранней диагностики опухолевых и инфекционных заболеваний, для определения нежелательных примесей в воде, пищевых продуктах, лекарствах и парфюмерных товарах.
2.5. Использование моноклональных антител в препаративных целях.
С развитием методов генной инженерии особенно остро встал вопрос о необходимости наладить выделение генноинженерных продуктов из их источников (бактериальных и дрожжевых клеток и др.). Часто генноинженерные (или их еще называют рекомбинантные) белки используются в качестве компонентов фармакологических препаратов, производимых в промышленных масштабах, поэтому предъявляются особые требования к их чистоте и к стоимости их очистки . В этом случае выделение белков и пептидов с помощью моноклональных антител практически не имеет конкурентов, так как может производиться в один этап и с высокой степенью очистки.
Наиболее распространенным методом выделения белков с использованием моноклональных антител стала аффинная хроматография. Основной ее принцип заключается в следующем:
На полимерные гранулы (например, сефароза), называемые иначе сорбентом, химически пришивают молекулы моноклональных антител, и эти гранулы помещают в хроматографические колонки. Далее через эти колонки пропускают растворы (экстракты), из которых хотят выделить нужное вещество, при этом используют такие условия (величина ионной силы раствора, рН, температура и др.), когда с монАТ связываются только требуемые компоненты раствора, а все остальные вымываются. После тщательной промывки колонки от несвязавшихся веществ производят элюцию (смыв) тех веществ, которые специфически связались с монАТ на сорбенте, используя для этого предварительно подобранные условия элюции (изменяют рН раствора, ионную силу и др.). В результате относительно несложной процедуры получают практически чистый препарат белка или пептида. Примерно такой же подход применяют и в исследовательских целях, когда хотят обогатить образец конкретным веществом для последующего его использования в других методиках.
2.6. Применение моноклональных антител в терапии.
По сравнению с диагностикой и препаративным выделением, моноклональные антитела пока не очень широко используются для лечения заболеваний, и этому есть целый ряд причин:
а) бактериальные инфекции удобней лечить с помощью таких более доступных средств, как антибиотиков или солевых растворов (как, например, при лечении холеры);
б) вирусы, являясь внутриклеточными паразитами, плохо доступны для моноклональных антител.
Пожалуй, наиболее перспективным направлением для использования моноклональных антител в терапии- это нейтрализация токсинов и терапия опухолей, где антитела против опухоле-ассоциированных антигенов пытаются использовать в целенаправленной транспортировке лекарственных средств к раковым клеткам. В последнее время появились сообщения о получении человеческих монАТ, избирательно вызывающих апоптоз опухолевых клеток, и не действующих на здоровые.
Помимо этого ведутся работы по разработке вакцин на основе моноклональных антител. Теоретическая основа существования таких вакцин основана на концепции антиидиотипических антител «внутреннего образа»: если моноклональные антитела направлены против антиген- связывающего участка других моноклональных антител, они иногда копируют участок антигена, то есть несут «внутренний образ» этого антигена и способны вызывать антиген-специфический иммунный ответ. (Рис. 3). Именно такие антитела или их Fv-фрагменты и предложено использовать в составе вакцин вместо антигена.
Еще одним возможным аспектом применения моноклональных антител в терапии является использование антител, обладающих самостоятельной ферментативной активностью, либо способных влиять на активность различных ферментов. Механизм действия таких антител (иначе их называют абзимы) заключается в том, что а) антитело может быть направлено к активному участку фермента и мешать (помогать) осуществлению ферментом своей функции; б) антитело может быть направлено против молекулы субстрата или к переходному от субстрата к продукту соединению и таким образом может понижать (или повышать) энергетический барьер превращения субстрата в продукт (то есть фактически самостоятельно выполнять функции фермента).
Методы анализа на основе моноклональных антител : иммуноферментный (ИФА), иммунолюминесцентный, иммунорадиологический.
Высокая специфичность антител в отношении антигена превращает их в мощный инструмент для идентификации различных веществ, будь то макромолекулы, клеточные фрагменты или целые клетки.
Начало широкому использованию антител в диагностических целях положил в 1955 году американский иммунолог А. Кунс. Он присоединил к антителам светящийся краситель. Флюоресцирующие антитела сделали видимыми места расположения интересующих его молекул в клетке. Этот метод получил название иммунофлюоресцентного. Чувствительность метода можно повысить несколькими путями.
В первом случае иммунный ответ усиливается за счет применения антител нескольких порядков:
Антиген иммобилизуется на подложке, к нему добавляются антитела 1-го порядка, связывающиеся непосредственно с антигеном. В исследуемый образец добавляются антитела 2-го порядка, связывающиеся с антигенными детерминантами антител 1-го порядка. Антитела 2-го порядка имеют флюоресцирующую (или другую) метку. Поскольку участков связывания может быть несколько, то реакция проявляется более отчетливо.
Другая система усиления сигнала основана на высоком сродстве биотина (низкомолекулярного растворимого витамина) к стрептавидину (бактериальному белку). Здесь возможны два варианта:
А. Если возможно ковалентно связать биотин непосредственно с антителами, то стрептавидин метят маркером и используют аналогично антителам второго порядка:
Б. Система “биотин-антитело + стрептавидин + меченый биотин”:
В этом случае образуется целая сеть из молекул стрептавидина, связанного с меченым биотином. Следовательно, происходит многократное усиление сигнала.
Применение антител второго и третьего порядков позволяет также упрощать процедуру определения микроорганизмов в мазке. При этом не обязательно иметь меченые антитела против всех бактерий. Достаточно иметь обычные антитела кролика или мыши против интересующего микроорганизма и меченые МКА против этих иммуноглобулинов. Если микроорганизм в мазке присутствует, то к нему “приклеятся” специфические антитела, а к ним уже — меченые. В результате мазок будет светится при люминесцентной микроскопии. Фотометрические или флуоресцентные методы могут быть использованы не во всех случаях, например, если измерение проводят очень мутной среде.
Кроме красителя в качестве метки можно использовать фермент (иммуноферментный анализ) или радиоактивный изотоп (иммунорадиологический). От чувствительности детекции маркера зависит чувствительность метода анализа.
Радиоактивные метки.
Выбор маркера и способа его «привязки» к антигену является одним из важных этапов в проведении анализа. Первоначально широко применялись радиоизотопные метки (радиоиммунный анализ — РИА), предложенные американскими исследователями (С. А. Берсон, Р. С. Ялоу, 1959). Однако в последние годы все более широкое использование в Качестве маркеров находят ферменты. Это обусловлено рядом принципиальных трудностей, связанных с применением изотопныx маркеров. Так, изотоп 125 I имеет время полураспада 60 суток, чем ограничивается срок его использования. Изотоп 3 Н имеет длительное время жизни (12.5 лет), однако под действием бэта-излучения происходит распад молекул антигена, в результате чего время жизни меченых 3 Н-соединений тоже ограничено. Кроме того, эффективность счета трития существенно ниже, чем 125 I. Ограничивающими факторами РИА являются сложность и высокая стоимость оборудования, необходимость централизованной системы распределения иммунохимических наборов, меченных радиоактивными изотопами, определенная опасность изотопов для окружающей среды.
Учитывая трудности использования радиоизотопных меток, были предложены в качестве маркеров ферменты.
При иммуноферментном анализе антиген связывается с поверхностью лунки полистирольного планшета. В лунку добавляют антитела, несущие фермент в качестве метки, инкубируют и отмывают. Далее приливают субстрат, который меняет окраску при взаимодействии с этим ферментом. Изменение окраски можно измерить с помощью спектрофотометрии. Таким способом проводится индикация и количественная оценка биоорганических соединений с чувствительностью до 10 -12 г/литр.
В настоящее время известно более 2000 разных ферментов, однако только некоторые находят применение в иммуноферментном анализе. Это объясняется высокими требованиями, предъявляемыми к свойствам ферментов. Фермент должен быть высоко активен, а продукты его реакции детектироваться с высокой чувствительностью, он должен быть стабилен, так чтобы его активность сохранялась не менее одного года. Содержание фермента-маркера в определяемом образце должно быть минимальным. Именно из-за этого для разных объектов используют разные ферменты.
Во многих случаях, когда необходим качественный результат, оценка иммунохимической реакции может быть проведена визуально.
Для введения ферментативной метки разработано много разных химических, биохимических и иммунологических способов.
Первым реагентом, использованным для синтеза иммуноферментных конъюгатов, был глутаровый альдегид, реагирующий с аминогруппами лизина белковых молекул. С помощью глутарового альдегида получены конъюгаты антител и антигенов с пероксидазой, щелочной фосфатазой, глюкоамилазой. В настоящее время широко используются иммунопероксидазные конъюгаты и конъюгаты с бэта-галактозидазой.
Ковалентные методы получения иммуноферментных конъюгатов нашли весьма широкое распространение, однако к некоторых случаях действие сшивающего реагента отрицательно сказывается на ферментативной и иммунологической активности компонентов гибридной макромолекулы. В связи с этим определенный интерес представляют иммунологические методы введения ферментной метки.
Один из подходов получил название метода «гибридных антител». Ферментативным гидролизом получают Fab-фрагменты молекул антител против определяемого антигена и используемого фермента. Затем смесь продуктов гидролиза подвергают восстановлению меркаптоэтанодом; при этом Fab-фрагменты обратимо диссоциируют на симметричные части. После удаления восстанавливающего агента молекулы снова ассоциируют, образуя гибридные молекулы антител, специфичные к определяемому антигену и ферменту. При добавлении фермента образуется комплекс антитело—фермент (рис. 19, а). Гибридомная технология открывает принципиально новый путь получения гибридных антител, который заключается в том, что сливаются моноклональные клетки, специфичные против данного антигена и фермента-маркера, в результате чего образуются гибридомы второго поколения, синтезирующие антитела, с двумя специфичностями.
Другой путь заключается в том, что получают антитела одного и того же вида животного (например, кролика) против определяемого антигена и фермента, которые соединяют между собой через антитела другого вида животных (антитела барана против кролика). Добавление фермента к такой тройной молекуле также приводит к образованию комплекса антитело—фермент. В настоящее время разрабатываются подходы получения гибридных антител методами клеточной и генной инженерии, что позволит существенно упростить способ их получения.
Стабильность иммуноферментных конъюгатов при хранении — важнейший параметр, обусловливающий возможность их практического использования. Методы направленной стабилизации конъюгатов пока еще не разработаны. Не существует также корреляции между стабильностью конъюгатов и методом их получения. Однако высокая стабильность гибридных молекул обеспечивает их применение на практике и значительно превосходит стабильность антител и антигенов, меченных радиоактивными изотопами. В лиофилизованном состоянии ферментные конъюгаты сохраняют свои свойства до двух лет.
Кроме ферментов в качестве маркеров могут быть использованы субстраты. В частности, в иммунокофакторном анализе применяются в качестве меток АТФ и НАД, которые могут быть «пришиты» к молекуле антигена через адениновый остаток таким образом, что сохраняется их способность взаимодействовать с ферментом. Аналогично были использованы субстраты пероксидазы (люминол, изолюминол), которые могут быть окислены пероксидом водорода в реакции хемилюминесценции, катализируемой пероксидазой.
Основные проблемы, возникающие при использовании монАТ в терапии:
а) Подавляющее большинство получаемых монАТ имеет животное происхождение (мышиные или крысиные), в результате чего иммунная система человека воспринимает их как чужеродный белок и быстро разрушает. МонАТ при этом не успевают проявить свое лекарственное действие.
б) Некоторые монАТ нечеловеческого происхождения могут связывать и выводить из строя жизненно важные молекулы в организме человека, иногда это может привести к летальному исходу (например, агглютинация (склеивание) клеток крови под воздействием антител против поверхностных антигенов).
в) Мышиные и крысиные монАТ являются для человека сильным иммуногеном, и введение их в терапевтических дозах может вызывать аллергические реакции вплоть до анафилактического шока.
Во избежание всех этих неприятностей необходимо использовать для лечения антитела не животного, а человеческого происхождения.
Масштаб использования моноклональных антител в современном мире таков, что, если бы создатели технологии по получению монАТ запатентовали свое открытие, то суммарный патентный сбор превысил бы годовой бюджет всей Великобритании.
3.Основные этапы получения моноклональных антител методом гибридомной технологии.
Долгое время единственным источником монАТ были опухолевые линии антитело- продуцирующих клеток миеломы и плазмацитомы, выделенные из больных людей и животных. Такие клетки могли быть адаптированы к росту в культуральных средах и секретировать моноклональные антитела, но было очень трудно и зачастую даже невозможно определить антиген, к которому эти антитела были направлены. Понятно, что использование таких монАТ было очень ограничено. Ситуация кардинально изменилась в 1975 году, когда ученые Kohler и Milshtein предложили метод получения моноклональных антител предопределенной специфичности, за что позднее были удостоены Нобелевской премии.
Смысл гибридомной технологии заключается в создании гибридной клетки (получившей название «гибридома»), получаемой путем слияния антитело- продуцирующего В-лимфоцита и опухолевой клетки миеломного или плазмацитомного ряда. (Рис.4). Такая гибридома обладает свойством секретировать антитела, взятой у В-лимфоцита, и способностью к бесконечному делению, взятой у опухолевой клетки.
Источником В-лимфоцитов для получения гибридомы служат лимфоидные органы животного, гипериммунизированного тем антигеном, против которого хотят получить монАТ. Гипериммунизация сильно повышает процентное содержание В-лимфоцитов, продуцирующих антитела желаемой специфичности, в общей популяции клеток лимфоидного органа. Лимфоциты, выделенные из тканей селезенки, лимфоузлов, периферической крови, не способны к самостоятельному делению и живут в культуре всего 10-14 дней. Миеломные клетки, напротив, могут жить и делиться в культуре сколь угодно долго, но не продуцируют антитела нужной специфичности (чаще используют линии миелом или плазмацитом, вообще не продуцирующие никаких антител).
В результате процедуры гибридизации (слияния) образуется гетерогенная популяция клеток, состоящая, во-первых, из неслившихся клеток лимфоидного органа; во-вторых, изнеслившихся клеток миеломы; в-третьих, из гибридов лимфоцит+лимфоцит и миелома+миелома; в четвертых, из гибридов лимфоцит+миелома, из которых лишь часть (часто весьма небольшая) стабильно продуцирует антитела нужной специфичности. Понятно, что необходимо отделить интересующие клетки от всех остальных. От неслившихся лимфоцитов и гибридов лимфоцит+лимфоцит избавляться не нужно: через несколько дней они умрут сами; от неслившихся опухолевых клеток и гибридов миелома+ миелома избавляются с помощью селективных сред (подробности ниже); среди оставшихся клеток (гибридов лимфоцит+миелома) отбирают нужные путем клонирования, когда из одной клетки выращивают популяцию клеток (клеточный клон) и отбирают среди таких клонов лишь те, которые стабильно продуцируют антитела требуемой специфичности.
Секрецию антител определяют различными методами скрининга супернатантов гибридом, другими словами, проводят анализ той культуральной среды, в которой рос конкретный клон. При наличии в супернатанте желаемых антител проводят еще одно или несколько клонирований, затем клетки нарабатывают для получения большего количества антител либо в культуре, либо в перитонеальной полости мышей (крыс). Далее антитела выделяют из культуральной или асцитной жидкости и проводят более детальные исследования на предмет их пригодности для использования в тех целях, для которых монАТ были получены. Клетки–продуценты можно заморозить и хранить в жидком азоте долгое время.
Рассмотрим теперь подробнее каждый из этапов получения монАТ:
3.1. Иммунизация.
Иммунизация — самый «творческий» этап в процессе получения моноклональных антител, именно эффективностью иммунизации определяется в наибольшей степени конечный успех всего предприятия. Тут невозможно дать какой-то единый рецепт, поскольку выбор схемы иммунизации и использование различных приемов, повышающих эффективность иммунизации, целиком зависят от свойств конкретного антигена.
3.1.1.Выбор объекта иммунизации.
В первую очередь необходимо выбрать объект иммунизации. На сегодняшний день известны три вида гибридомных систем: мышиная, крысиная и человеческая. Самой распространенной сегодня является мышиная гибридома, а самая редкая- человеческая, чему имеется ряд причин:
а) Мыши- наиболее хорошо изученный и доступный объект для работы в лаборатории, то же относится и к линиям мышиных миелом, используемых для слияния.
б) Все линии крысиных миелом, адаптированные для гибридомных работ, запатентованы, поэтому коммерческое использование крысиных гибридом регламентируется соответствующими патентами. Все мышиные линии миелом свободны от патентных ограничений.
в) Гипериммунизацию грызунов провести проще, чем иммунизацию человека. В большинстве случаев гипериммунизация человека вообще невозможна по этическим соображениям.
г) Источником иммунных В-лимфоцитов грызунов могут служить ткани любых лимфоидных органов, тогда как у человека возможно лишь взять периферическую кровь, где общее содержание В-лимфоцитов не превышает 20% от всех клеток. В редких случаях можно использовать удаленные миндалины пациентов, где содержание В-лимфоцитов может достигать 60%, но они, как правило, инфицированы и секретируют антитела именно против этого инфекционного агента.
д) При получении человеческой гибридомы существует проблема гистосовместимости клеток миеломы и В-лимфоцитов: у грызунов для слияния берутся В-лимфоциты и клетки миеломы, полученные от одной линии животных, и поэтому имеющих сходный репертуар антигенов гистосовместимости на клеточных поверхностях. Для человека это условие недостижимо, что в конечном итоге выражается очень низкой эффективностью слияния и крайне нестабильной антителопродукцией человеческих гибридом.
е) Мышиные и крысиные антитела достаточно просто нарабатывать в асцитных жидкостях; для человеческих гибридом возможна наработка лишь в культуре, либо с применением генноинженерных методов.
Для иммунизации мышей чаще всего используют линию BALB/c, все линии мышиных миелом происходят от этой линии. В случае низкоиммуногенных антигенов можно попытаться иммунизировать мышей другой линии, к некоторым антигенам они дают более сильный иммунный ответ по сравнению с BALB/c. Наработку таких гибридом в асцитных жидкостях производят на потомках первого поколения, полученных от скрещивания BALB/c и линии, использованной для иммунизации.
Для иммунизации крыс литература настойчиво рекомендует линию LOU/C, но вполне удовлетворительные результаты получаются с более доступными в нашей стране крысами линииWISTAR.
4.1.Схемы иммунизации мышей.
4.1.1.Короткая схема иммунизации.
Наиболее любима нашей лабораторией короткая схема иммунизации, когда антиген вводят дважды с двухнедельным интервалом в подушечки задних лап. Количество вводимого антигена берут в пределах от 5 до 200мкг на мышь в зависимости от его доступности и иммуногенности, для токсичных антигенов доза может быть понижена до 0,1мкг. Для первого введения антигена (раунда иммунизации) раствор антигена объемом 50-200 мкл смешивают с полным адъювантом Фрейнда (ПАФ), представляющего собой минеральное масло со взвесью убитых микобактерий. При активном перемешивании раствора антигена с ПАФ получается мелкодисперсная эмульсия, призванная замедлить и пролонгировать поступление антигена в ткани. Считается, что убитые микобактерии усиливают иммунный ответ, что, однако, у многих исследователей вызывает сомнение. Второй раунд иммунизации проводят так же, как и первый, но с использованием неполного адъюванта Фрейнда (НАФ), в котором отсутствуют микобактерии.
В случае проблемных антигенов полезно иммунизировать группу животных разными дозами антигена и с использованием разных схем иммунизации. На третий или четвертый день после второго раунда иммунизации нужно взять пробы крови и проанализировать их на содержание антител против требуемого антигена. Для дальнейшей работы выбирают животное с максимальным титром, исключение составляют антигены- белковые токсины, где иногда высокий титр специфических антител сочетается с большим процентом убитых токсином В-лимфоцитов. В таких случаях нужно брать животное, имеющее не самый высокий титр и/или обращать внимание на жизнеспособность клеток, берущихся для слияния.
На четвертый день после второго раунда иммунизации животное забивают, и клетки подколенных лимфоузлов сливают с клетками миеломы.
4.1.2. Длинные схемы иммунизации.
В случае неэффективности короткой схемы иммунизации пробуют различные виды длинных схем. При этом обычно животных иммунизируют с интервалом 2-4 недели либо внутрибрюшинно, либо подкожно (реже внутривенно или орально), используя для первого раунда иммунизации ПАФ, а для последующих- НАФ.
На 10-14 день после каждого раунда иммунизации (начиная со второго) кровь иммунизируемых животных проверяют на содержание специфических антител. Если титр антител достиг желаемого уровня, проводят последний раунд иммунизации (называемый бустированием), вводя раствор антигена внутривенно без адъювантов, в количестве 1/10 от предыдущих доз. В результате бустирования избирательно стимулируются клоны, продуцирующие антитела высокой аффинности к антигену.
4.2. Некоторые приемы, позволяющие усилить иммунный ответ.
4.2.1. Конъюгация (химическая сшивка) низкомолекулярного антигена (гаптена) с белком- носителем.
Существует целый ряд низкомолекулярных соединений, не способных самостоятельно вызвать иммунный ответ по причине малого размера молекулы. В таких случаях гаптен конъюгируют с белком- носителем (часто в качестве белка- носителя берут бычий сывороточный альбумин, яичный альбумин или гемоцианин улитки) и такой конъюгат используют для иммунизации. При этом возникает целый ряд проблем:
а) Основной иммунный ответ будет направлен на белок- носитель, а не на молекулу гаптена, и это нужно будет учитывать при тестировании сывороток иммунизируемых животных и супернатантов гибридом. Тестирование должно отражать содержание антител именно к гаптену, а не к конъюгату в целом.
б) Пространственное строение гаптена (конформация), как правило, существенно изменяется в процессе конъюгирования с носителем, иногда настолько, что все антитела против участков гаптена, находящегося в составе конъюгата, не способны узнавать свободную молекулу гаптена. В таких случаях пробуют разные варианты конъюгирования, которые затрагивают при сшивке разные функциональные группы молекулы гаптена, либо используют разные «линкеры»- органические соединения, связывающие функциональные группы гаптена и белка- носителя и увеличивающие экспонированность гаптена на поверхности носителя.
В целом метод конъюгирования хорошо зарекомендовал себя при получении антител против низкомолекулярных соединений.
4.2.2. Иммунизация иммунными комплексами ( антиген- антитело).
Метод применяют, когда антигеном является консервативный низкоиммуногенный белок, либо, когда хотят получить антитела против минорных антигенных детерминант, на которые при иммунном ответе направлен очень низкий процент всех специфических антител. В первом случае антительным компонентом иммунного комплекса могут служить монАТ с неудовлетворительной аффинностью, полученные ранее после обычной иммунизации. Во втором случае берут монАТ против сильных антигенных детерминант, получение которых не представляет большой сложности.
Примером успешного использования такого подхода может служить получение антител против человеческого эритропоэтина, ? и ? интерферонов, иммуноглобулинов близкородственных видов (крысиные монАТ против IgG мыши).
4.2.3. Конъюгация с адъювантным белком (hsp70).
Встречаются антигены, которые в силу своей сверх-консервативности не способны вызвать сколько-нибудь заметный иммунный ответ, несмотря на свою белковую природу и достаточный молекулярный вес (например, гемоглобин, некоторые ферменты). Выходом здесь может стать конъюгирование их с белком теплового шока (heat shock protein 70kDa, hsp70). Имеются данные, что hsp70 облегчает презентацию пептидных фрагментов, экспонируя их определенным образом, на практике же конъюгирование белков и пептидов с hsp70 приводит, как правило, к резкому усилению выработки антител против этих белков и пептидов.
Однако, случается полное подавление иммунного ответа в результате конъюгирования с hsp70, которое мы неоднократно наблюдали при иммунизации конъюгатом hsp70- интерферон ?.
4.3. Предварительная обработка антигенов перед иммунизацией.
а) Токсичные антигены часто подвергают денатурации нагреванием или добавлением денатурирующих агентов (мочевины, гуанидилхлорида и др.). Токсичность при этом снижается (не всегда), но утрачиваются многие антигенные детерминанты, присущие неденатурированному (нативному) антигену. В результате получаемые монАТ узнают лучше денатурированный антиген.
б) Иногда молекулы антигена сшивают друг с другом (полимеризуют) с целью увеличения молекулярного веса и/или уменьшения токсичности.
в) Вирусы и бактерии перед иммунизацией, как правило, инактивируют нагреванием, либо обработкой фенолом, формальдегидом, глутаральдегидом и др. для уменьшения их токсичности и эпидемиологической опасности. Грамотрицательные бактерии, кроме того, иногда обрабатывают лизоцимом, чтобы убрать ЛПС с их поверхности и обеспечить иммунный ответ против бактериальных белков.
5. Гибридизация В-лимфоцита с клеткой миеломы.
«Отцы» гибридомной технологии Келер и Мильштейн добивались слияния клеток при помощи вируса Сендай. Сейчас для этой цели все используют полиэтиленгликоль (ПЭГ), как более удобное, эффективное и безопасное средство. Формула ПЭГ:
HO(CH2CH2O)n CH2CH2OH , молекулярный вес ПЭГ, пригодного для слияния, от 20 до 20000, но чаще используют ПЭГ массой 600-6 000.
Полиэтиленгликоль токсичен для клеток, и его токсичность возрастает с уменьшением молекулярного веса. Слияние клеток происходит во время инкубации их в 35-50% ПЭГ, время инкубации зависит от концентрации ПЭГ и от его молекулярного веса (для 50% ПЭГ мол. веса 1 500 это приблизительно 1 минута). Недостаточное время инкубации приведут к очень низкому проценту слившихся клеток, а избыточное- к большому проценту погибших клеток вследствие токсичности ПЭГ. Хорошо работает такой компромиссный вариант, когда клетки сначала инкубируются при мягком перемешивании в 50% ПЭГ в течение 1 мин, затем процент ПЭГ снижается до 35% медленным добавлением бессывороточной среды, и клетки инкубируются еще 5-7 минут. Затем медленно, но с нарастающим темпом и при аккуратном перемешивании суспензия клеток далее разбавляется средой, потом центрифугируется и высевается на культуральные планшеты.
Точный механизм гибридизации клеток еще недостаточно изучен. Вначале, по-видимому, происходит агглютинация (склеивание) клеток, затем слияние клеточных мембран и, наконец, слияние ядер и перестройки хромосомного материала. Имеются данные, что сливаются, в основном, клетки, находящиеся в стадии интенсивного деления. По этой причине клетки миеломы за 12-24 часа до гибридизации переводят в условия, способствующие максимальной скорости роста клеток (повышение содержания фетальной сыворотки, витаминов и ростовых факторов в культуральной среде). Иммунизация в свою очередь стимулирует рост клонов В-лимфоцитов- продуцентов специфических к антигену антител.
Обычные условия культивирования миеломных и гибридомных клеток- 37°С и 5% СО2. Основа культуральной среды- это разные варианты предлагаемых на рынке сред DMEM или RPMI1640, представляющих собой раствор солей, аминокислот, витаминов, углеводов и питательных добавок в разных концентрациях и цветового индикатора кислотности (как правило, феноловый красный). Кроме этого к среде добавляют эмбриональную телячью сыворотку или ее синтетические или полусинтетические заменители до концентрации 3-20% как источник белка и ростовых факторов. Качество сыворотки в наибольшей степени влияет на скорость роста клеток, особенно гибридомных, как более капризных по сравнению с миеломными. Помимо сыворотки в среду добавляют пируват натрия, антибиотики, глутамин (если он не содержался в исходной среде), реже- оксалоацетат, бета-меркаптоэтанол, инсулин и др.
Для культивирования клеток при низкой клеточной плотности (особенно при клонировании, когда из одной- единственной клетки в лунке необходимо вырастить целый клон) используют так называемый фидерный слой клеток (или просто фидер), облегчающий эту задачу. Клетки фидера не должны самостоятельно делиться, они призваны обеспечивать гибридомные клетки необходимыми для роста цитокинами и создавать клеточные контакты. В качестве фидера можно использовать клетки тимуса, селезенки, лимфоузлов, перитонеальной полости животных того вида, который использовался для получения иммунных В-лимфоцитов. Фидер от животных другого вида тоже может быть использован, но с меньшей эффективностью.
Культивирование клеток необходимо проводить в условиях, максимально приближенных к стерильным. Попавшие в культуру клеток бактерии и грибы, опережая гибридомы в скорости роста, очень быстро исчерпают питательные вещества ростовой среды и насытят ее своими токсинами. Это приведет к неизбежной гибели гибридомных клеток. Во избежание инфицирования пользуются стерильными ростовыми средами и стерильной культуральной посудой, применяют антибиотики, а все манипуляции с клетками проводят в условиях минимальной осемененности микробами (в ламинарном боксе с принудительной подачей стерильного воздуха).
Особую проблему представляет заражение клеток внутриклеточными паразитами- вирусами и микоплазмой. Детектировать их достаточно сложно, они, как правило, не убивают всю культуру гибридомных клеток и с легкостью переносятся от одной культуры к другой. Вирусы и микоплазма фильтруются сквозь бактериальные фильтры, поэтому фильтрование ростовых сред и воздуха в ламинарном боксе становятся неэффективными при борьбе с ними. Заражение клеток вирусами или микоплазмой приводит к резкому замедлению роста клеток, особенно в малой их плотности, а также к усиленной потере гибридомами их способности секретировать антитела. Против микоплазмы существуют специальные антибиотики, а против вирусов- интерфероны, но они помогают лишь снизить степень инфицированности клеток, не избавляя их от инфекции полностью. Более действенным является сочетание антибиотиков с неоднократным проведением зараженной культуры через организм животного, где клетки могут расти в виде асцитной жидкости и использовать иммунную систему животного против инфекции.
7. Методы селекции слившихся клеток.
7.1. Использование селективных сред.
Считается неплохим результатом гибридизации, когда сливается одна пара клеток из 10 000. Для удаления неслившихся миеломных клеток (неслившиеся В-лимфоциты отмирают сами через несколько дней) чаще всего используют негативную селекцию на селективных средах, смысл которой заключается в следующем: В клетках млекопитающих имеется два пути синтеза пуринов (предшественников нуклеотидов)- основной и запасной. Для осуществления запасного пути требуется фермент гипоксантинфосфорибозилтрансфе раза (ГФРТ), который отсутствует у миеломных клеток. Линии миеломных клеток, пригодные для гибридомной технологии, имеют мутацию, в результате которой клетки не способны синтезировать ГФРТ и осуществлять запасной путь синтеза пуринов. Отбор мутантов и удаление спонтанно возникающих нормальных миеломных клеток производят с помощью 8-азагуанина или 6-тиогуанина. В-лимфоциты, как изначально нормальные, способны использовать оба пути синтеза пуринов.
После процедуры гибридизации клетки высевают в среде, содержащей аминоптерин, который блокирует основной путь синтеза пуринов. В результате неслившиеся клетки миеломы (и гибриды миелома+миелома) погибают, так как оказываются лишенными и основного (блокированного аминоптерином) и запасного (потерянного в результате мутации) путей синтеза пуринов. Способными к росту оказываются лишь гибриды миелома+лимфоцит, взявшие у исходных лимфоцитов способность к осуществлению запасного пути синтеза пуринов.
После отмирания основной массы неслившихся клеток ростовую среду постепенно заменяют на свежую, не содержащую аминоптерин, так как он мешает нормальному функционированию клеток.
7.2.Использование проточного цитофлуориметра.
Проточный цитофлуориметр позволяет отсортировывать клетки, которые несут на своей поверхности флуоресцентную метку. Использование проточного цитофлуориметра для отбора гибридных клеток состоит в следующем: Смесь иммунных лимфоцитов и клеток миеломы подвергают стандартной процедуре слияния; затем полученную суспензию клеток инкубируют с раствором антигена, против которого хотят получить монАТ, предварительно конъюгированного с флуоресцентной меткой (например, ФИТЦ- флуоресцеинизотиоцианат) . В-лимфоциты и гибриды лимфоцит+миелома имеют на своей поверхности молекулы иммуноглобулинов. В том случае, когда эти иммуноглобулины направлены против требуемого антигена, происходит связывание несущих их клеток с антигеном, а через него с флуоресцентной меткой. Затем с помощью прибора отсортировывают меченые клетки от всех остальных и получают популяцию клеток, состоящую в основном из гибридом, секретирующих антитела против желаемого антигена, и неслившихся В-лимфоцитов, не способных к делению.
Достоинства этого метода селекции по сравнению с методом селективных сред состоят в следующем:
и т.д.
* Примечание. Уникальность работы указана на дату публикации, текущее значение может отличаться от указанного.
источник
— иммунологические анализы биологических жидкостей и клеток организма, микроорганизмов, вирусов и т.п.;
— иммуногистохимическиие методы анализа;
— типирование групп крови и тканей;
— воздействие на отдельные клеточные популяции;
— влияние на иммунные регуляторные механизмы с помощью антител к лимфокинам;
— иммунорегуляция с помощью антиидиотипических антител;
— направленный транспорт лекарственных веществ;
— элиминация токсинов, иммунотоксинов и аллергенспецифичных антител.
— очистка молекул и клеток, несущих специфический антиген;
— исследования этиологии и патогенеза различных заболеваний;
— исследование системных и межсистемных механизмов регуляции;
— создание новых лекарственных средств и биопрепаратов.
Рассмотрим некоторые примеры практического использования моноклональных антител:
Поскольку гибридомы можно хранить в замороженном состоянии, в некоторых институтах и лабораториях для научных целей создаются так называемые гибридомные банки.
Многие фармацевтические фирмы кровно заинтересованы в увеличении масштабов производства моноклональных антител, поскольку сфера их применения помимо количественного определения различных веществ включает разнообразную диагностику(например, идентификация определенного гормона, вирусных или бактериальных антигенов, антигенов группы крови и тканевых антигенов).
Благодаря использованию моноклональных антител стало возможным определение дозы лекарственных средств. Надежность и экономичность такой иммунодозировки следует считать существенным достижением. В мае 1981 г. Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств США впервые утвердило к продаже набор для диагностического скрининга на основе гибридом, предназначенный для установления аллергена. Такие же наборы разрабатываются для тестирования гормонов, диагностики вирусных заболеваний, обнаружения некоторых видов рака и т.п.
Еще одним направлением применения моноклональных антител является устранение неблагоприятных последствий, вызванных передозировкой лекарственными средствами. Антитела против лекарственных препаратов, например, дигоксина, могут оказаться полезными для снятия неблагоприятных последствий, вызванных его передозировкой, хотя сегодня до конца и не ясно, нужно ли применять их экстракорпорально, связанными с твердым носителем, через который циркулирует кровь, или вводить непосредственно в кровоток.
Диагностика злокачественных новообразований и наблюдение за ними:
На сегодняшний день известно несколько специфических опухолевых маркеров, которые используются в диагностике, прогнозировании и выявлении распространения опухолей.
Некоторые из них обнаруживаются в крови, а другие находят в препаратах опухолей. Так, например, L-фетопротеин является главным белком сыворотки плода: его содержание уменьшается в течение первого года жизни. Таким образом, определяя содержание L-фетопротеина в плазме при помощи метода РИА (радиоиммунологического анализа), было обнаружено, что оно повышается у многих больных гипатомой, а также при раке семенников.
У многих больных, страдающих раком прямой кишки, в плазме отмечается повышенное содержание карциноэмбрионального антигена. Дальнейшее его увеличение может служить указанием на неэффективность химио- и лучевой терапии.
Помимо того, что моноклональные тела применяются, как специфические реагенты в стандартных тестах, они могут использоваться и для идентификации новых, более специфических маркеров опухолей.
Так, например, Ритсу и его сотрудникам удалось получить моноклональные антитела к антигену клеток при остром лимфолейкозе человека.
Развитию новых способов лечения может способствовать направленное введение лекарственных препаратов, присоединяемых к антителам против других опухолей.
Направленное введение лекарственных препаратов.
Моноклональные антитела могут найти применение для введения лекарственных веществ и токсинов в определенную часть тела (например, в опухоль): либо путем их непосредственного присоединения к таким веществам, либо путем связывания с поверхностью липосом, содержащих внутри эти вещества.
Были получены комплексы антител к поверхностным антигенам раковых клеток со многими неспецифическими противораковыми средствами, но далеко не всегда они оказывались эффективными. Наиболее многообещающим является использование сильнодействующих растительных или бактериальных токсинов, одна молекула которых может вызывать гибель клетки.
Так, например, молекула токсина дифтерии: образована двумя полипептидными цепями, связанными дисульфидными мостиками. Цепь В связывается с клеточной поверхностью, а цепь А, обладающая ферментативной активностью, проникает внутрь клетки и нарушает работу механизма биосинтеза белка. Были предприняты попытки, заменить В-цепь токсина специфическими антителами, преимущественно гомогенными. Также недавно был получен препарат моноклональных антител к антигену раковых клеток прямой кишки, ассоциированных с А-цепью токсина, который избирательно действует на эти клетки в культуре.
С помощью моноклональных антител возможно также выделение биологически активных веществ (таких, например, как белки, гормоны, токсины) из сложных смесей. В случае интерферона Сичер и Берк из Уорвикского университета (Великобритания) с помощью метода иммуноадсорбции получили препарат со степенью около чистоты 1 %.
По этому методу антитела были пришиты к углеводным гранулам и исследованы для приготовления колонки с иммуносорбентом, на которой очищали грубый препарат интерферона. После одного пассажа через такую колонку с иммобилизованными моноклональными антителами препарат очищается в 5000 раз лучше.
Можно также использовать моноклональные антитела точной идентификации специализированных клеток, таких, например, как нейтроны, чтобы глубже изучить способы их взаимодействия и функционирование (т.е. локализацию химических нейромедиаторов).
Очень ценна техника моноклональных антител и для изучения клеточных мембран. Мембранные белки трудно выделить в чистом виде. Они присутствуют в клетках в малом количестве, их биологическую активность трудно измерить или же она и вовсе исчезает при растворении мембран в аналитических экспериментах. Эти трудности можно преодолеть, если прибегнуть к иммунологическим методам изучения мембранных белков, как это было сделано в случае антигенов клеточной поверхности, являющихся маркерами разных стадий дифференцировки тканей. Обычные препараты антител против клеточных антигенов, как правило, сложные и не способные распознавать отдельные молекулы.
Кроме того, еще одной сферой применения моноклональных антител является терапия различных заболеваний, так, например, эффективность серотерапии может быть увеличена благодаря применению моноклональных антител.
Также с помощью моноклональных антител можно изготовлять высокоспецифичные вакцины, особенно против определенных штаммов и паразитов.
Моноклональные антитела способны также нейтрализовать действие лимфоцитов, ответственных за отторжение трансплантата. В сочетании с лекарственными средствами они могут значительно усиливать эффективность действия последних на клетки-мишени, позволяя при этом избегать серьезных побочных явлений, столь обычных при химиотерапии рака.
Дата добавления: 2018-04-04 ; просмотров: 772 ; ЗАКАЗАТЬ РАБОТУ
источник
Роза Ягудина о значении моноклональных антител в современной медицине и перспективах их применения
Моноклональные антитела (МАТ) сегодня применяются при лечении заболеваний, большинство из которых еще несколько десятков лет назад считались неизлечимыми. Это онкологические, аутоиммунные, сердечно-сосудистые и инфекционные заболевания, воспалительные реакции различного генеза, системный склероз, идиопатический фиброз легких, гепатит В, СПИД, ревматоидный артрит, системная красная волчанка, аллергические реакции, мышечная дистрофия, болезнь Альцгеймера, астма, диабет и другие заболевания.
Препараты, изготовленные на основе моноклональных антител, относятся к новейшим в современной медицине. С середины 90-х годов до сегодняшнего дня на мировом фармацевтическом рынке одобрено более 30 лекарственных средств, имеющих в составе моноклональные антитела. Первоначально надежность методов и технологий производства моноклональных антител и безопасность их применения вызывали опасения у фармацевтических производителей. Однако сегодня научный и медицинский опыт показал возможность их эффективного и безопасного применения в медицине. Сейчас большинство фармацевтических компаний работают над разработкой новых препаратов и лекарственных средств на основе моноклональных антител. На этапе разработки в мире находится около 300 МАТ.
В чем же уникальность и специфика применения моноклональных антител?
Роза Исмаиловна Ягудина , доктор фармацевтических наук, профессор, зав. кафедрой организации лекарственного обеспечения и фармакоэкономики, зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова, г. Москва, главный редактор журналов «Фармакоэкономика» и «Современная организация лекарственного обеспечения».
Иллюстрации и примеры в статье взяты из: Ягудина Р.И., Тихомирова А.В. История развития моноклональных антител, их настоящее и будущее // Современная организация лекарственного обеспечения. – 2013. – №1. – 6–27
История получения и применения моноклональных антител уходит своими корнями в исследования конца 19 века. С тех пор, за прошедшие более чем сто лет, моноклональные антитела успели несколько раз совершить революцию в медицине, полностью перевернув представления о возможностях лекарственной терапии.
Ученых с давних пор интересовал вопрос о том, каким образом организм создает множество различных антител, обладающих уникальной специфичностью в отношении чужеродных веществ (антигенов), и каким образом эти антитела работают. Один из первых шагов к ответу на этот вопрос был сделан группой ученых, работавших в Институте инфекционных болезней в Берлине и открывших методы лечения дифтерии. В конце XIX века дифтерия у детей считалась смертельным неизлечимым заболеванием. Врач иммунолог-бактериолог Эмиль Беринг (Emil Behring) предположил, что лечение дифтерии может быть успешным в случае проявления естественной защитной реакции человеческого организма, а именно, если секретируемый дифтерийными бактериями токсин нейтрализовать. В 1890 г. Беринг совместно с японским ученым Сибасабуро Китасато установили, что неиммунизированные животные могут быть защищены от токсина дифтерийных бактерий с помощью инъекции антитоксина (антитоксической сыворотки) иммунизированных животных. В 1894 г. в период эпидемии дифтерии, унесшей жизни 50 000 детей в Германии, были произведены первые 25 000 доз антитоксина для применения в лечении людей. В 1901 г. Эмилю Берингу была присуждена Нобелевская премия за работу по сывороточной терапии. Однако на тот момент эффективность сыворотки была достаточно низкой, поскольку антитела в сыворотке вырабатывались клетками животных, а не самого пациента и вызывали лишь пассивный иммунитет. Антитоксин необходимо было вводить сразу после инфицирования, иначе было слишком поздно.
Еще одним примером использования антисыворотки в терапии людей стали исследования Чарльза Ричета (Charles Richet) и Жюля Эрикура (Jules Héricourt), применявших для лечения онкологических заболеваний антисыворотку, полученную путем иммунизации животных тканями саркомы. С середины 30-х годов практика пассивной иммунизации сошла на нет в связи с открытием антибиотиков широкого спектра действия.
В 30-х гг. появились ультрацентрифуги, позволявшие разделять антитела по размеру и форме. В 40-х гг. ученые научились сортировать антитела по электрическому заряду и размеру. Однако дальнейшая расшифровка структуры антитела была пока недоступна из-за их большого размера, в 20 раз превышавшего размер молекул белков, структуры которых к тому времени уже были расшифрованы. Только в 1962 г. на базе многочисленных исследований, проводившихся различными учеными, Родни Портер (Rodney Porter) расшифровал основную структуру антител, стало известно, что антитело состоит из легкой и тяжелой цепи. Позже Родни Портеру совместно с Джеральдом Эдельманом (Gerald Edelman) удалось определить последовательность 1300 аминокислот, входящих в белковую цепь антитела, производимого клетками раковой опухоли миеломы. В то время это была самая большая расшифровка аминокислотной последовательности, за что в 1972 году ученые получили Нобелевскую премию. В результате исследований Портера и Эдельмана стало известно, что антитело имеет форму буквы Y, в которой нижняя часть (тяжелая цепь) имеет постоянную структуру для разных антител, а плечи (легкие цепи) значительно различаются у различных антител. Именно эти плечи отвечают за связывание антитела с антигеном и его нейтрализацию.
(Рисунок 1. Структура антитела, за которую ученые Родни Портер и Джеральд Эдельман в 1972 г. получили Нобелевскую премию по физиологии и медицине)
К 1970-м годам уже были известны некоторые важные моменты о том, каким образом в организме человека вырабатываются антитела. В частности, было известно, что за продуцирование антител отвечают В-лимфоциты, причем каждый В-лимфоцит может вырабатывать только одно специфическое антитело, при этом он редуплицируется и за счет этого быстро производит большое количество идентичных по структуре антител — так называемых моноклональных, то есть произошедших от одной клетки-предшественницы.
Добиться столь же быстрой выработки антител в лабораторных условиях удалось в 1975 году ученым Георгу Кёлеру (Georges Köhler) и Сезару Мильштейну (César Milstein). На тот момент была исследована способность клеток раковой опухоли миеломы быстро производить идентичные самим себе клетки. Кроме того, существовала возможность выделения антителопродуцирующих клеток из организма животных. Технология Кёлера и Мильштейна включала несколько этапов: у мыши вырабатывался иммунитет к известному антигену, затем из ее селезенки выделялись антителопродуцирующие клетки, эти клетки с помощью особой технологии соединялись с клетками миеломы с получением гибридомы, клетки которой непрерывно в большом количестве синтезировали антитела против известного антигена. Эта методика произвела переворот в изучении антител, поскольку позволила получать антитела с удивительно точным соответствием определенной структуре. В дальнейшем технология была усовершенствована, и в 1984 году Кёлер, Мильштейн и датский иммунолог Нильс Ерне (Niels Jerne) получили Нобелевскую премию за участие в создании антител, которые можно использовать для диагностических исследований и создания лекарственных средств. В дальнейшем было разработано множество технологий, позволивших усовершенствовать синтез антител за счет развития технологий рекомбинации ДНК, технологий клонирования клеток и других достижений генной инженерии.
При первых попытках применения для лечения людей антител, искусственно синтезированных из клеток животных, ученые столкнулись с трудностями. В 1979 г. впервые в мире ученые Филип Сташенко (Philip Stashenko) и Ли Надлер (Lee Nadler) применили искусственно синтезированные моноклональные антитела, полученные из клеток мышей, против антигенов, которые вырабатываются на поверхности клеток раковых опухолей. Однако было выявлено, что мышиные антитела в незначительной степени связывались с опухолевыми антигенами и воспринимались организмом как чужеродные клетки.
С 1986 г. на фармацевтическом рынке началась реализация препарата компании Janssen «Ортоклон ОКТ3» (муромонаб), который позволяет купировать реакцию отторжения трансплантата почки, оказывая избирательное иммуноподавляющее действие. Препарат имеет полностью мышиное происхождение, то есть синтезируется мышиными гибридомами, полученными слиянием мышиной миеломы и мышиных В-лимфоцитов. Вскоре после выхода препарата на рынок стало ясно, что при длительном применении мышиных моноклональных антител в качестве лекарственных средств их эффективность снижалась. Это связано с тем, что мышиные белки являются иммуногенными для организма человека, то есть воспринимаются как чужеродные объекты. В связи с этим у пациентов, которым вводят мышиные антитела, быстро образуются человеческие антимышиные антитела (human antimurine antibody – HAMA). Образующиеся HAMA-антитела нейтрализуют эффект мышиных антител.
В начале 90-х гг. с использованием молекулярно-биологических методов, основанных на применении рекомбинантной ДНК, были созданы химерные антитела. В химерных антителах часть «мышиной» молекулы с помощью методов генной инженерии заменялась на участок человеческого происхождения, а часть оставалась фрагментом мышиного происхождения. Поскольку белковая последовательность химерных антител на 75% состояла из «человеческих» последовательностей аминокислот, то у пациентов, получавших химерные антитела, HAMA-антитела образовывались в значительно меньшем количестве, и это сделало препараты на основе химерных антител значительно более эффективными, чем на основе мышиных. В дальнейшем был выпущен целый ряд лекарственных средств на основе химерных антител: ритуксимаб, выпускаемый под брендами «Мабтера» и «Ритуксан», — для лечения раковых опухолей, «Ремикейд» (инфликсимаб) — для лечения болезни Крона, «Симулект» (базиликсимаб) — для профилактики острого отторжения трансплантата почки, «Реопро» (абциксимаб) — для профилактики стенокардии и острого инфаркта миокарда, а также другие препараты.
Разработка химерных антител позволила практически полностью отказаться от использования мышиных антител. Однако в некоторых случаях использование мышиных антител и сегодня остается оправданным. Из одобренных к применению лекарственных средств сегодня лишь три являются мышиными: «Ортоклон-ОКТ3» (муромонаб-CD3), «Зевалин» (ибритумомаб тиуксетан) и «Бексар» (тозитумомаб-йод 131). Два последних являются радиоактивно мечеными мышиными МАТ. Их функция заключается в доставке радиоизотопов к клеткам лимфомы. Наличие радиоактивной метки позволяет применять эти антитела в очень небольших количествах, поэтому иммуногенность, обусловленная мышиными последовательностями, в этом случае не так значима. То, что эти препараты включают именно мышиные, а не гуманизированные или человеческие формы делает их более эффективными, потому что гуманизированные формы могли бы связываться одновременно не только с клетками-мишенями, но и со здоровыми клетками, нанося им вред. Также к применению сегодня одобрен один препарат на основе крысино-мышиного МАТ — это препарат «Ремоваб» (катумаксомаб) для лечения злокачественного асцита.
Шестой шаг — создание гуманизированных и человеческих моноклональных антител (конец 90-х гг. XX в. — 2000-е гг. XXI в.)
В конце 90-х гг. с помощью методов генной инженерии удалось свести к минимуму процент мышиных последовательностей аминокислот в искусственно синтезируемых антителах, благодаря чему были получены гуманизированные антитела, еще в меньше степени вызывающие образование HAMA-антител у человека. Начиная с конца 90-х гг. на рынок было выпущено множество препаратов на основе гуманизированных антител.
Примеры препаратов на основе моноклональных антител:
- «Зенапакс» (даклизумаб) — для профилактики отторжения после трансплантации почки,
- «Герцептин» (трастузумаб) — для лечения рака молочной железы и рака желудка,
- «Ксолар» (омализумаб) — для лечения атопической бронхиальной астмы и сезонного аллергического ринита,
- «Раптива» (эфализумаб) — для лечения псориаза, а также многие другие.
В 2000-х годах усовершенствованные методы генной инженерии наконец позволили добиться долгожданного результата и получить человеческие МАТ. В настоящее время человеческие МАТ чаще всего получают с помощью технологии трансгенных мышей (мышей, выведенных с использованием фрагментов чужеродной ДНК) или фагового дисплея (особый метод генной инженерии с использованием вирусов-бактериофагов). Например, сегодня для клинического применения одобрены такие препараты, созданные на основе человеческих МАТ, как «Бенлиста» (белимумаб) — для лечения красной волчанки, «Ервой» (ипилимумаб) — для лечения меланомы, «Симпони» (голимумаб) — для лечения ревматоидного артрита, псориатического артрита, болезни Бехтерева, а также другие препараты.
Еще один тип веществ, созданных методами генной инженерии для лечения пациентов, — это так называемые «белки слияния», в которых искусственно соединены два отдельных белка, зачастую с различными функциями. Например, на основе такого вещества создан препарат «Амевив» (алефацепт) моноклональные антитела при псориазе, орфанный препарат «Аркалист» (рилонацепт) — для лечения редких генетических аутовоспалительных заболеваний, относящихся к группе криопинсвязанных периодических синдромов, и другие препараты.
Разработка лекарственного средства с использованием моноклональных антител — это очень длительный и дорогостоящий процесс. Например, первый препарат на основе мышиных антител «Ортоклон OKT3» был зарегистрирован в 1986 г., только через 11 лет после того, как мышиные антитела были впервые описаны. Первый препарат на основе химерного МАТ «Реопро» был одобрен в 1994 г., через 10 лет после первых работ по изучению химерных МАТ. Первый препарат на основе гуманизированного МАТ «Зенапакс» был утвержден в 1997 г., через 11 лет после первого доклада о конструкции гена гуманизированного антитела. Препарат «Энбрел» на основе слитых белков был одобрен в 1998 г., через 10 лет после описания «белков слияния». Препарат «Хумира» на основе человеческих МАТ был одобрен в 2002 году, через 12 лет после первой статьи о подобных МАТ.
Сегодня интерес к разработке новых препаратов на основе моноклональных антител со стороны производителей очень высок. В настоящее время на территории Российской Федерации стадию клинических исследований проходит более 10 препаратов на основе МАТ. Общее количество препаратов, находящихся на стадии разработки в мире, исчисляется сотнями.
Перед современными учеными, исследующими моноклональные антитела, стоит множество актуальных задач. В частности, поиск решения проблемы иммуногенности препаратов, изготовленных на основе МАТ. Большинство препаратов на основе МАТ, которые сегодня проходят стадию клинических исследований, включают в состав человеческие антитела. Использование этого типа антител снизило иммуногенность препаратов, однако не устранило проблему полностью, поскольку иммунная система человека способна вырабатывать антитела против любого терапевтического белка.
Еще одна проблема, связанная с применением препаратов на основе моноклональных антител, обусловлена тем, что МАТ представляют собой крупные молекулы, которые не способны проникать внутрь клетки или глубоко в ткани. Сегодня МАТ нельзя применять внутрь, так как их концентрация для достижения эффекта должна в несколько тысяч раз превышать концентрацию молекул-мишеней. В связи с этими особенностями, сегодня ученые озабочены созданием нового поколения лекарственных средств, которые объединят в себе преимущества МАТ и мелкомолекулярных препаратов. На этом пути сделано уже несколько важных научных открытий. Первое из них — создание шведской компанией Affibody особых «аффител», которые обладают свойствами обычных антител, но имеют в десятки раз меньшую молекулярную массу, что позволяет им лучше проникать в ткани. Еще одно достижение науки — разработка «нанотел» бельгийской компанией Ablynx. Эти препараты характеризуются высокой стабильностью, что позволяет использовать их внутрь и местно. Кроме того, они просты в производстве. Сейчас на стадии клинических исследований у пациентов с тромбозами и остеопорозом находятся четыре «нанотела». Наконец, еще одно сверхсовременное направление — разработка доменовых антител американской компанией Domantis. Эти антитела должны соответствовать различным отделам тяжелой и легкой цепи антител человека и быть в десять раз меньше обычного антитела, что позволит применять их внутрь и ингаляционно.
Пока что длительность и высокая стоимость производства лекарственных средств с использованием моноклональных антител делает их не всегда доступными для пациентов. Однако ученые работают над созданием новых технологий, которые позволят выпускать новые препараты быстрее и по более низкой стоимости. Благодаря современным технологиям, уже сегодня многие препараты стали доступными для большого количества пациентов и позволили излечить заболевания, ранее считавшиеся неизлечимыми. Можно надеяться, что в будущем спектр излечимых заболеваний еще более расширится, а лекарственные средства на основе моноклональных антител станут еще более эффективными.
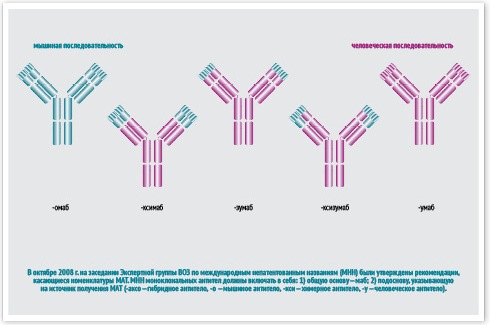
В октябре 2008 г. на заседании Экспертной группы ВОЗ по международным непатентованным названиям (МНН) были утверждены рекомендации, касающиеся номенклатуры МАТ. МНН моноклональных антител должны включать в себя:
- общую основу – маб;
- подоснову, указывающую на источник получения МАТ (-аксо — гибридное антитело, -о — мышиное антитело, -кси — химерное антитело, -у — человеческое антитело).
источник