В том, что вода состоит из кислорода и водорода, мы убедились, получив ее путем соединения водорода с кислородом. Подтвердим это путем разложения воды на водород и кислород.
Вода – прочное вещество. Она разлагается лишь при очень высоких температурах, например при температуре электрической искры. При пропускании электрической искры через дистиллированную воду появляются пузырьки газа. Их можно собрать по методу вытеснения воды в пробирку. Когда газа в пробирке накопится достаточно, вынем ее из воды, закрыв отверстие под водой пальцем, и поднесем к отверстию горящую лучинку. Газ взорвется. Это смесь водорода с кислородом. Реакция разложения воды выражается уравнением:
Можно разложить воду и так, что водород и кислород соберутся отдельно. Для этого опустим в воду две металлические пластинки, присоединенные к источнику постоянного тока, и включим ток. На обеих пластинках начнется выделение пузырьков газа. Газы можно собрать в опрокинутые над той и другой пластинками пробирки, как в опыте с искрой, или воспользоваться прибором для разложения воды электрическим током.
В одной из трубок прибора (или пробирки) соберется вдвое больший объем газа, чем в другой. Поднеся зажженную лучинку к отверстию трубки (или пробирки), в которой газа собралось больше, мы заметим, что газ загорелся. Это водород. Поднеся вместо горящей лучинки тлеющую лучинку к отверстию трубки (или пробирки), где газа собралось меньше, мы увидим, что лучинка вспыхнет. Это кислород.
Водород и кислород соединяются с образованием воды в тех же объемных отношениях (2:1), в каких они выделяются при ее разложении. Это можно подтвердить опытом в приборе, называемом эвдиометром. Эвдиометр представляет собой толстостенную трубку, плотно закрытую резиновой пробкой, в которую вставлены медные проволочки. С наружной стороны трубки нанесены деления на равном расстоянии друг от друга. Эвдиометр заполняют прокипяченной водой, опускают открытым концом в чашку с водой так, чтобы из него не выливалась вода, и укрепляют в лапке штатива. В эвдиометр вводят столько кислорода, чтобы он заполнил трубку до второго деления (два объема), а следующие два объема заполняют водородом. Свободные концы медных проволочек эвдиометра соединяют проводами с индукционной катушкой, а последнюю с источником электрического тока. При включении тока между медными проволочками внутри трубки проскакивает электрическая искра, от которой происходит взрыв смеси водорода с кислородом. Вода в эвдиометре поднимается ровно на три деления. Чтобы узнать, какой газ остался в эвдиометре после взрыва, открытый конец трубки закрывают пробкой, эвдиометр из лапки штатива освобождают и перевертывают. Пробку вынимают и в открытый конец трубки быстро вносят тлеющую лучинку, она вспыхивает. Следовательно, в эвдиометре после взрыва остался один объем кислорода. Значит, во время взрыва израсходовались на образование воды два объема водорода и один объем кислорода.
Реакция образования сложного вещества путем соединения простых веществ называется синтезом. В эвдиометре нами был произведен синтез воды.
Разложение вещества с целью выяснения его состава называется анализом.
Таким образом, состав воды нами был установлен анализом и синтезом. Эти два метода определения состава веществ широко применяются в химии.
Знание того, что при разложении воды выделяется 2 объема водорода и один объем кислорода и что при синтезе воды расходуются эти же газы в тех же объемных отношениях, позволяет вычислить весовой состав воды. Допустим, что при разложении воды выделился 1 л кислорода, тогда водорода образовалось 2 л. Зная, что 1 л водорода весит 0,089 г, а 1 л кислорода 1,429 г, получаем весовые отношения выделившихся газов: 1,429 : 0,178 = 8 : 1, т. е. в воде на 1 весовую часть водорода приходится 8 весовых частей кислорода.
источник
ТЕМА. Вода, строение молекулы. Методы определения состава воды – анализ и синтез. Вода в природе и способы ее очистки
Тип урока: комбинированный урок.
Цель урока: сформировать представление о строении молекулы воды, об анализе и синтезе на примере изучения состава воды.
1. Предметные. Знать качественный и количественный состав воды. Уметь объяснять понятия «анализ» и «синтез». Знать способы очистки воды.
2. Метапредметные. Развивать умения устанавливать аналогии, причинно-следственные связи, строить умозаключение и делать выводы, владеть устной речью, формулировать, аргументировать и отстаивать свое мнение.
3. Личностные. Формировать и развивать экологическое мышление и основы экологической культуры, мировоззрение, соответствующее современному уровню развития науки.
Межпредметные связи: биология, география.
Ресурсы урока (оборудование): ноутбук, проектор.
I. Организация класса
2. Определение отсутствующих.
3. Проверка готовности учащихся к уроку.
II. Проверка домашнего задания
III. Актуализация опорных знаний
Перед вами 3 стакана с водой. Подумайте, почему они здесь?
IV. Организация познавательной деятельности
Вода занимает 2/3 поверхности земного шара, и лишь 1/3 приходится на сушу. Вода в океанах, морях, реках, озёрах, под землёй и в почве. Ледники и айсберги — тоже вода, но замёрзшая. Много воды в атмосфере: это облака, туман, пар, дождь, снег. Поэтому с высоты космического пространства наша планета имеет голубой оттенок. Мы не удивляемся обилию воды. На земле она окружает нас всюду. Вода — самое обыденное и в то же время самое удивительное вещество на нашей планете. Она обладает рядом необычных свойств.
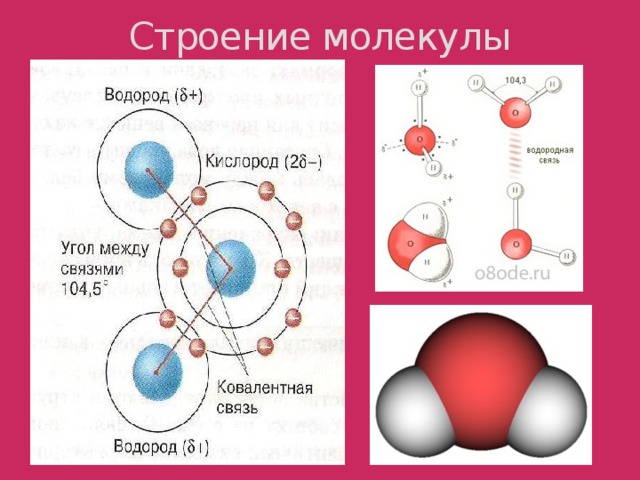
1. Строение молекулы воды
Молекула воды представляет собой маленький диполь, содержащий положительный и отрицательный заряды на полюсах. Так как масса и заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. При этом ядра водорода оголяются. Таким образом, электронное облако имеет неоднородную плотность. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр.
2. Тяжелая вода
Тяжёлая вода (оксид дейтерия) — имеет ту же химическую формулу, что и обычная вода, но вместо атомов водорода содержит два тяжёлых изотопа водорода — атомы дейтерия. Формула тяжёловодородной воды обычно записывается как: D2О или 2H2О. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха.
По своим свойствам тяжелая вода заметно отличается от обычной воды. Реакции с тяжелой водой протекают медленнее, чем с обычной, константы диссоциации молекулы тяжёлой воды меньше таковых для обычной воды.
3. Методы определения состава воды: анализ и синтез.
Получение сложных веществ из более простых называют синтезом (от греч. «синдезис» соединение).
В химии для определения состава веществ и вывода их химических формул пользуются как анализом, так и синтезом. Результаты одного метода проверяются другим.
Вода в природе и способы ее очистки. Вода — самое распространенное на земле вещество. Ею заполнены океаны, моря, озера и реки; пары воды входят в состав воздуха. Вода содержится в организмах животных и растений. Так, например, в организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%.
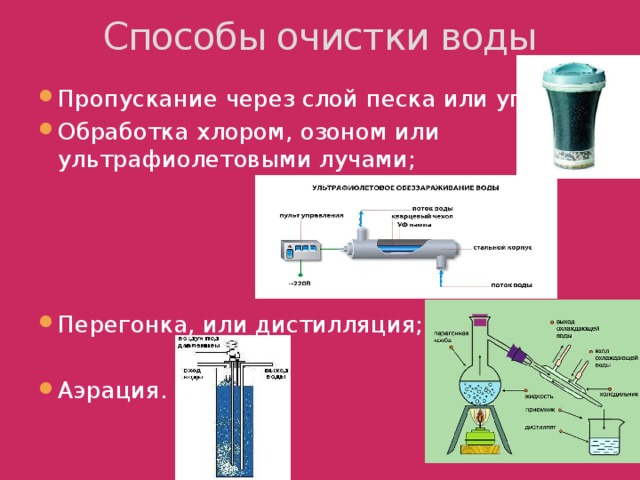
4. Способы очистки воды (слайд 7)
VI. Рефлексия
Как я усвоил сегодняшний материал:
VII. Домашнее задание
Вода. Строение молекулы воды. Анализ и синтез воды.
Относительная молекулярная масса:
Максимальная плотность: 1 г/мг
Впервые обнаружена в 1932 г. Гарольдом Юри.
В природных водах соотношение между тяжелой и обычной водой составляет
Методы определения состава воды
Анализ – (от греч. — разложение) метод определения состава веществ путем их разложения на более простые.
Методы определения состава воды
получение сложных веществ из более простых.
- Пропускание через слой песка или угля;
- Обработка хлором, озоном или ультрафиолетовыми лучами;
- Перегонка, или дистилляция;
- Аэрация.
Как я усвоил сегодняшний материал
Мусорная корзина – сегодняшний материал я скоро забуду, в жизни он мне не пригодится
Чемодан – материал я хорошо запомнил, буду его применять на практике
Мясорубка – материал я запомнил, но нужно его обдумать, усвоить
источник
При разложении воды электрическим током образуются газы: водород H 2 – два объёма и кислород О2 – один объём.
Зная, что плотность водорода ρ(Н2) = 0,089г/л, а плотность кислорода ρ(О2) = 1,429г/л, можно вычислить массовые отношения выделившихся газов m =ρ· V :
m ( H 2) : m ( O 2) = (0,089г/л · 2 л) : (1,429г/л · 1 л) = 1 : 8
Это соотношение соответствует следующим отношениям атомных масс:
2 Ar ( H ) : Ar ( O ) =( 2 · 1): 16 = 1: 8
Следовательно, молекула воды должна иметь состав: Н2О
Метод определения состава веществ путём их разложения на более простые называют анализом (от греч. «анализис» — разложение).
Получение сложных веществ из более простых называют синтезом (от греч. «синтезис» — соединение).
Синтез воды можно осуществить в эвдиометре:
Вода в природе и способы её очистки
Вода — наиболее распространенное соединение на Земле. Она покрывает приблизительно четыре пятых земной поверхности – это океаны, моря; озера, ледники. В довольно больших количествах вода находится в атмосфере, а также в земной коре. Общие запасы свободной воды на Земле составляют 1,4 млрд км 3 . Основное количество воды содержится в океанах (около 97,6%), в виде льда на нашей планете воды имеется 2,14%. Вода рек и озер составляет всего лишь 0,29% и атмосферная вода – 0,0005%.
Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды).
Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды. Чистая вода в природе не существует, она всегда «загрязнена» различными солями, растворенными в ней.
Люди всегда селились около воды, и первые нарушения биохимического равновесия связаны с водой. Однако на заре своего развития человек был частью природы, как и другие живые организмы. Создаваемые им загрязнения имели близкие к естественным концентрации, а воздействие на природу не нарушало естественных процессов. В дальнейшем с развитием земледелия и животноводства, ростом поселений и концентрацией населения на небольших территориях – появились ареалы, где уровни загрязнения стали превышать естественно-допустимые. За тысячелетия люди свыклись с загрязнениями природы и, как это ни противоестественно сбрасывали грязь и нечистоты туда, откуда брали воду для питья. Это нашло отражение даже в мифологии – вспомним шестой подвиг Геракла. Древнегреческий герой для очистки от навоза громадного скотного двора царя Авгия направил в него воду двух рек, которая в один день унесла весь навоз с конюшен. «Всюду, где пьет толпа – писал в XIX в. Ф. Ницше – родники отравлены».
Уже давно выявлена зависимость, что пропорционально ухудшению воды слабнет и здоровье людей.
Питьевая вода не должна содержать нерастворённых примесей и болезнетворных бактерий. Основные этапы по очистке питьевой воды:
1. Отстаивание (от крупного мусора);
2. Фильтрование через слой песка (от мелких примесей);
3. Обработка хлором или озоном (от микроорганизмов).
Подробно об очистке воды рассказано в следующем видео – сюжете: «Процесс очистки сточных вод».
Возможные вещества – загрязнители представлены в таблице:
Вещество, загрязняющее воду
Последствия повышенного содержания в воде определенного загрязнителя
Меры по снижению содержания в воде определенного загрязнителя
Ограничивает доступ кислорода и света в водоемы, тормозит рост и развитие организмов, может привести к их гибели
Сжигание или обработка специальными химическими веществами
Изменяют рН среды, вызывают бурное размножение планктона, цветение воды
Желательно в составе СМС вместо полифосфатов использовать цитраты – соли лимонной кислоты
Зарастание водоемов, явная и закрытая интоксикация людей и животных. Чрезмерное развитие водорослей. Ухудшает качество воды, её цвет, вкус, запах
Производство минеральных удобрений в капсулах из пленки, обладающей свойствами мембраны. Использование по нормативам, оговоренным в инструкции
В пределах дозы 0,3 г в сутки безопасен. При превышении концентрации происходит отравление, которое может сопровождаться рвотой, болями в подложечной области, выделением зеленой мочи. Фенол, попадая в организм, связывается с белками и подавляет работу ферментов.
Фильтрация через активированный уголь
Для очистки воды от растворённых в ней веществ, применяют перегонку, или дистилляцию, полученный продукт называется дистиллированной водой .
Большие количества дистиллированной воды используют в аптеках, химических лабораториях, в охладительных системах автомашин. А полезна ли такая вода организму человека?
«Можно ли живые организмы использовать для индикации поверхностных вод?»
Японцы впервые использовали рыб для индикации чистоты поверхностных вод. Указатель самой чистой воды – форель (в природе она обитает в чистой проточной воде), а самой грязной –карп (живет в стоячей воде). По наличию состояния животных организмов можно судить о качестве воды. Наибольшее разнообразие видов характерно для чистых водоемов. По мере загрязнения водоема многие из них гибнут, а те, что остаются начинают усиленно размножаться. Например, массовое размножение мотыля, червей – трубочников, дафний указывает на сильное загрязнение водоемов. Показатели чистоты водоема – кувшинка белая, кубышка желтая, ольха. В чистом водоеме живут и размножаются окунь, ерш, судак, щука, жерех. Пропали в реке раки – первый сигнал тревоги: воду чистой не назовешь. Пропали лягушки совсем плохо, река мертва.
Всякий естественный водоем обладает способностью к самоочищению. К огромной армии санитаров относятся бактерии, грибы, водоросли. Бактерии, например, очень быстро размножаются. За 10 часов из одной бактерии образуется 1 млн новых. Они могут поглощать в сто раз большее количество вещества, чем весят сами. Что же касается водорослей, то они еще, кроме того, что обогащают воду кислородом. Очищаться от вредных примесей водоемам помогают друзья из мира растений суши. Ива и ольха своими корнями извлекают из воды попавшие туда из полей минеральные удобрения. Кроме того, прибрежная зелень обогащает слой воздуха над водной поверхностью кислородом, который необходим для процессов самоочищения воды, кроны деревьев затеняют реку ветвями и благодаря этому уменьшается испарение воды.
источник





Т ема 1: “Первоначальные химические понятия”
| 1 | Предмет и задачи химии. Когда и как возникла химическая наука. Методы познания в химии |
| 2 | Понятие “вещество” в химии и физике. Свойства веществ. Описание физических свойств веществ |
| 3,4 | Практическая работа №1 по теме: “Правила техники безопасности в кабинете химии. Правила обращения с лабораторным оборудованием. Строение пламени” |
| 5,6 | Чистые вещества и смеси |
| 7 | Практическая работа №2 по теме: “Очистка загрязненной поваренной соли” |
| 7 | Практическая работа №2 по теме: “Разделение смесей” (микролаборатория) |
| 8 | Физические и химические явления |
| 9,10 | Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения. Кристаллическое состояние веществ. Кристаллические решетки. |
| 11 | Простые и сложные вещества. Химический элемент |
| 12 | Язык химии. Знаки химических элементов. Относительная атомная масса |
| 13 | Закон постоянства состава вещества |
| 14 | Химические формулы. Относительная молекулярная масса |
| 15 | Вычисления по химическим формулам. Массовая доля химического элемента в соединении |
| 16, 17 | Валентность химических элементов |
| 18 | Тестирование по теме: “Валентность” |
| 19 | Атомно-молекулярное учение |
| 20 | Закон сохранения массы веществ и энергии |
| 21 | Признаки и условия протекания химических реакций |
| 22 | Составление уравнений химических реакций |
| 23 | Типы химических реакций |
| 24 | Повторение, обобщение. Подготовка к контрольной работе |
| 25 | Контрольный тест №1 по теме: “Первоначальные химические понятия” |
| 25 | К.Р. №1 по теме: “Первоначальные химические понятия” |
Тема 2: “Кислород. Горение”
| 1 | Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства |
| 2 | Химические свойства кислорода. Оксиды. Применение кислорода. Круговорот кислорода в природе |
| 3 | Практическая работа № 3 по теме: “Получение кислорода и изучение его свойств” |
| 4 | Озон. Аллотропия кислорода |
| 5 | Воздух и его состав. Защита атмосферного воздуха от загрязнения |
| 6 | Горение и медленное окисление. Решение задач на тепловой эффект химической реакции. Тепловой эффект химической реакции. Решение задач |
| 6 | Контрольный тест по теме: “Кислород” |
Тема 3: “Водород”
| 1 | Водород, его общая характеристика, нахождение в природе. Получение водорода и его физические свойства |
| 2 | Химические свойства водорода. Применение |
| 3 | П.Р. №4 по теме: “Получение водорода и изучение его свойств” |
Тема 4: “Вода. Растворы”
| 1 | Вода: анализ и синтез. Вода в природе и способы ее очистки. |
| 2 | Физические и химические свойства воды |
| 3 | Растворы. Растворимость веществ в воде |
| 4 | Массовая доля растворенного вещества в растворе |
| 5,6 | Повторение, обобщение по пройденной теме |
| 7 | Практическая работа №5 по теме: “Приготовление растворов с определенной массовой долей растворенного вещества в растворе” |
Тема 5: “Количественные отношения в химии”
| 1 | Моль. Молярная масса |
| 2 | Закон Авогадро. Молярный объем газов |
| 3 | Объемные отношения газов при химических реакциях . Относительная плотность газов |
| 4,5 | Решение расчетных задач по уравнению химических реакций |
| 6 | К.Р. №2 по теме: “Кислород. Водород. Вода. Растворы. Количественные отношения в химии” |
Тема 6: “Основные классы неорганических соединений”
| 1,2 | Оксиды: классификация, номенклатура, свойства оксидов, получение, применение |
| 3 | Основания: классификация, номенклатура, получение |
| 4 | Физические и химические свойства оснований. Реакция нейтрализации |
| 5 | Амфотерные оксиды и гидроксиды |
| 6,7 | Кислоты: классификация, номенклатура, физические и химические свойства |
| 8 | Соли: классификация, номенклатура, способы получения |
| 9 | Физические и химические свойства солей |
| 10,11 | Генетическая связь между основными классами неорганических соединений |
| 12 | Практическая работа №6. Решение экспериментальных задач по теме: “Важнейшие классы неорганических соединений” |
| 13 | Повторение, обобщение и систематизация знаний по теме «Классы неорганических соединений» |
| 14 | Контрольная работа №3 «Классы неорганических соединений» |
Тема 7: “Периодический закон и строение атома”
| 1 | Классификация химических элементов. Система химических элементов и периодический закон Д.И. Менделеева |
| 1 | Строение атома. Состав атомных ядер. Изотопы. Химический элемент |
| 2,3 | Строение электронных оболоческ атомов. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ |
| 4 | Характеристика химического элемента по положению его в ПСХЭ. Повторение и обобщение |
Тема 8: “Строение вещества. Химическая связь”
| 1 | Электроотрицательность химических элементов . Классификация химических связей |
| 2 | Ковалентная связь. Полярная и неполярная ковалентная связь |
| 3 | Ионная связь |
| 4 | Степень окисления и валентность |
| 5 | Повторение и обобщение по теме: “Строение вещества. ОВР” |
| 6 | К.Р. №4 по теме: “ПЗ и строение атома. Химическая связь. ОВР” |
Тема 9: “Повторение, обобщение”
При создании уроков использованы ресурсы и материалы:
источник
Конспект урока» Вода. Методы определения состава воды — анализ и синтез. Вода в природе и способы ее очистки»
план-конспект урока (8 класс) на тему
Конспект урока с презентацией по ФГОС
МОУ «Арсеньевская cредняя общеобразовательная школа»
«Вода. Методы определения состава воды — анализ и синтез. Вода в природе и способы её очистки»
Тип урока: урок изучения нового материала и первичного закрепления.
Дидактическая цель урока: создание условий для осознанного изучения нового материала и включение знаний учащихся в процесс познания.
- Образовательная – углубить знания о физических свойствах воды, её распространении и значении в природе, показать взаимосвязь строения молекул воды и её свойств, изучить методы определения состава воды и способы её очистки.
- Развивающая – создать условия для развития творческих и исследовательских навыков, формировать умения выделять главное, сопоставлять, делать выводы; развивать речь, совершенствовать интеллектуальные способности; работать с дополнительной литературой.
- Воспитательная – способствовать привитию культуры умственного труда, создать условия для повышения интереса к изучаемому материалу, воспитание бережного отношения к природным ресурсам и своему здоровью.
- состав молекулы воды;
- строение ее молекул;
- вид межмолекулярных связей;
- физические свойства воды;
- методы определения состава молекул;
- распространение воды в природе;
- значение её для живых организмов;
- способы очистки природной воды;
- Определять органолептические свойства питьевой воды;
- Применять способы очистки воды в быту;
- Научиться делать самоанализ урока;
Приобретаемые навыки детей:
- учащиеся учатся работать в группах, обобщать, сопоставлять, проводить исследования;
- развивают логическое мышление, память, речь;
- повышается уровень восприятия, осмысления и запоминания;
- воспитание внимательного отношения к окружающим, друг к другу, учебной дисциплины;
- подводить итоги своей работы, анализировать свою деятельность.
Формы организации работы детей: индивидуальная, фронтальная, групповая, парная.
Формы организации работы учителя:
- используется словесно-иллюстративный метод, репродуктивный метод, практический метод, проблемный метод, беседа-сообщение, метод письменного текущего контроля;
- проверка ранее изученного материала, организация восприятия новой информации;
- постановка цели занятия перед учащимися;
- обобщение изучаемого на уроке и введение его в систему ранее усвоенных знаний.
Оборудование: компьютер, проектор, экран, прозрачный мерный цилиндр, шрифт, линейка, плоскодонные колбы с пробками, лист белой бумаги, универсальная индикаторная бумага, презентация. ( Приложение 1 )
Используемые ресурсы из других общедоступных источников:
- Аликберова Л.Ю. Занимательная химия: Книга для учащихся, учителей, родителей.- М.: АСТ- ПРЕСС, 1999
- Рудзитис Г.Е., Фельдман Ф.Г. Химия .8 класс.: Учебник для общеобразовательных учебных учреждений. М.: Просвещение , 2013
- Книга для чтения по неорганической химии. Часть1. Составитель Буцкус П.Ф. М.: Просвещение, 1993
2. Подготовка к восприятию нового материала
Учитель: Послушайте загадку:
«А ну, скорей снимите шляпу!
Я дочь космического папы!
Я вездесуща и легка, —
Я лёд, я пот, я — облака,
Я иней, чай, бульон, туман,
Река, ручей и океан.
Когда я злюсь — я закипаю,
Когда мороз — я застываю».
О каком веществе идёт речь?
Как вы думаете, какова же тема нашего урока?
Да, сегодня на уроке мы будем говорить о воде. Тема урока «Вода. Методы определения состава воды – анализ и синтез. Вода в природе и способы её очистки»
- Постановка цели занятия перед учащимися: Какие цели урока?
- состав молекулы воды;
- строение ее молекул;
- вид межмолекулярных связей;
- физические свойства воды;
- методы определения состава молекул;
- распространение воды в природе;
- значение её для живых организмов;
- способы очистки природной воды;
- обобщить знания о физических свойствах воды, закрепить изученный материал;
- проверить и закрепить полученные знания.
- Актуализация знаний учащихся
Учитель: Вода — самая популярная и самая загадочная из всех жидкостей, существующих на земле. И действительно попробуем представить себе, что вода внезапно исчезла с поверхности земли. Как бы выглядела наша планета?
Ученик: пересохшие русла рек, пустые впадины морских и океанских впадин, покрытые толстым слоем солей; земля мертва – ни кустика, ни цветочка, ни одного живого существа; небо безоблачное, большое количество пыли. Ужасная картина!
Учитель: Вода не просто необходима для жизни, она — сама жизнь. Тысячи лет человек восхищается, любуется, наслаждается водой. И всё это время ищет ответа на вопрос: Что такое вода? Почему вода обладает столь удивительными свойствами? Сколько воды на Земле? Сегодня на уроке мы попытаемся ответить на эти вопросы.
5. Изложение нового материала
Учитель: Ребята! Разделимся на группы. Каждая группа получила задание.
Работа учащихся по группам
1 группа. Изучила распространение воды ( слайд 1 )
Вывод: Сообщение учащегося.
«Безбрежная ширь океана
И тихая заводь пруда,
Струя водопада и брызги фонтана,
И всё это — только вода».
Вода — самое распространённое на Земле вещество. Она заполняет впадины земной поверхности, образуя моря и океаны. На их долю приходится 95,7%. 2,14% воды находится в реках и озёрах. Громадными массами снега и льда она покрывает полярные страны и вершины гор. 2,14% воды заключено в горных ледниках и ледниках Арктики и Антарктики. Тучи, облака, туман — это тоже вода, содержащаяся в атмосфере — 0,0005%.
В.И. Вернадский говорил: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества — минерала, горной породы, живого тела, которое её не заключало бы. Всё земное вещество ею проникнуто и охвачено».
2 группа. Исследовала значение воды для живых организмов ( слайд 2)
Ученик: Сообщение учащегося о значении воды для живых организмов.
Жизнь человека тесно связана с водой и зависит от неё. Вода — обязательный компонент живой клетки. Мышцы человека содержат 75%, стекловидное тело глаза — 99%, кости — 25%, зубная эмаль и та содержит воду — 0,2%. Слёзы, слюна, желудочный сок — так же содержат воду.
Вода участвует во всех процессах жизнедеятельности: транспорт питательных веществ и кислорода, выводит продукты распада, участвует в дыхании и терморегуляции — испаряясь, вода способствует охлаждению. Поэтому для обеспечения нормального существования человек ежедневно должен потреблять воды в 2 раза больше, чем питательных веществ: 2,5 — 6 л.
Потеря человеком воды на 12 — 15% приводит к нарушению обмена веществ, а потеря 25% воды ведёт к гибели организма. Без пищи человек может прожить 30-50 дней, а без воды не более 3-х дней. Вода также является средой обитания для многих животных и растений.
Учитель: Почему вода так широко распространена на земле и присутствует повсеместно в виде жидкости, твёрдого тела или газа. Чтобы ответить на этот вопрос изучим физические свойства воды.
3 группа. Сообщение учащегося ( слайд 3)
Чистая вода бесцветная, легкоподвижная жидкость без цвета, без вкуса, без запаха. Плотность жидкой воды (при температуре 4 С ) = 1 г/см 3 .
Вода может находиться в трёх агрегатных состояниях: Каких? Сделайте вывод из данного стихотворения.
И стеклянной быть могу!» Ответ учащихся…
Действительно, при 100 0 С и атмосферном давлении 101,3 кПа вода переходит в парообразное состояние. Именно в таком состоянии она входит в состав воздуха. При 0 0 С вода кристаллизуется и переходит в твердое состояние — лед.
Вода обладает многими удивительными свойствами. Ее с полным правом можно назвать чудом природы. Глубокие моря, озера, реки не промерзают до дна, а лед находится на поверхности воды. Это явление можно объяснить тем, что при замерзании вода расширяется, лед имеет меньшую плотность и массу, чем жидкая вода, поэтому он плавает на поверхности. Благодаря этому свойству воды в водоемах и зимой сохраняется жизнь.
Вода обладает большой теплоемкостью — 42 Дж/г град — поэтому она медленно нагревается и медленно остывает, являясь хорошим теплоносителем. А водные бассейны регулируют температуру на нашей планете: летом не дают ей перегреваться, а зимой снабжают материки теплом. А от космического холода предохраняют те капли воды, которые рассеяны в атмосфере.
Еще одно свойство — вода является универсальным растворителем. В ней растворяются многие вещества.
Существование воды на Земле в трех агрегатных состояниях — газообразном, жидком и твердом обязано очень важному обстоятельству: вращению Земли вокруг Солнца на расстоянии 149,6 млн.км. Если бы расстояние от Земли до Солнца было бы меньше 134 млн км — вся вода океанов, морей и рек испарилась бы. Если бы расстояние между Землей и Солнцем было более 166 млн км, то жидкая вода превратилась бы в лед.
4 группа. Проведите исследование по изучению органолептических свойств воды по инструктивной карточке ( слайд 4)
Опыт№1. Определение прозрачности
Условия проведения: комнатная температура.
Оборудование: прозрачный мерный цилиндр, шрифт, линейка
2. под цилиндр на расстоянии 4 см от его дна положите шрифт;
3. Сливайте воду до тех пор, пока сверху через слой воды не будет виден этот шрифт;
4. Измерьте высоту столба оставшейся воды линейкой;
5. Выразите степень прозрачности в см.
Условия исследования: комнатная температура.
Оборудование: стеклянный сосуд, лист белой бумаги
1.Возьмите стеклянный сосуд и лист белой бумаги;
2.В сосуд наберите воду и на белом фоне бумаги на уровне глаз определите цвет воды.
Условия проведения: комнатная температура.
1.Опустите универсальную индикаторную бумагу в сосуд с водой;
2.Сравните изменение окраски индикаторной бумаги со шкалой.
Учитель: Познакомимся с составом воды ( слайд 5 )
Такая короткая запись, а сколько трудов положено учеными разных стран, чтобы установить состав воды. Очень долгое время считалось, что вода — это элемент, пока однажды французский ученый Антуан Лоран Лавуазье не пропустил водяные пары через раскаленный ружейный ствол и не разложил воду на составные элементы — водород и кислород, тем самым доказав, что вода — это сложное вещество. А английские ученые Генри Кавендиш и Джозеф Пристли синтезировали воду, сжигая водород в кислороде, тем самым подтвердив состав воды.
В молекуле воды на один атом кислорода приходится два атома водорода.
Массовые отношения в молекуле 2:16 или 1:8.
Относительная молекулярная масса =18.
Учитель: Молекулы воды чрезвычайно просты в своем строении, но вместе с тем необычайны. Благодаря силам межмолекулярного притяжения атом кислорода одной молекулы воды притягивает атом водорода другой молекулы воды. Между соседними молекулами образуется связь, которая называется водородной ( слайд 6 )
За счет водородной связи образуются группы таких молекул. Наличие водородных связей обуславливает жидкое состояние воды. Когда вода закипает, водородная связь между ее молекулами разрушается, и вода из жидкого состояния переходит в газообразное. Чтобы разрушить водородные связи, необходимо приложить большую энергию, поэтому жидкая вода имеет высокую температуру кипения. С понижением температуры между молекулами воды увеличивается число водородных связей. Молекулы воды располагаются таким образом, что между ними образуются пустоты, поэтому при замерзании вода расширяется и лед «легче» воды.
Кристаллическая структура льда имеет ажурное строение ( слайд 7 )
Из-за наличия водородных связей между молекулами воды, она обладает аномальными свойствами: вода – жидкость ( слайд 8 )
При нагревании вода сжимается, при замерзании расширяется( слайд 9 )
Плотность льда меньше плотности воды, поэтому зимой водоемы покрываются слоем льда, что имеет важное биологическое значение в природе ( слайд 10 )
Учитель: Вода — самое распространенное вещество на Земле. И в то же время, мы вправе сказать, что на Земле нет чистой воды. Почему?
Сообщение учащихся о распространении воды.
Все что мы называем водой, на самом деле — растворы тех или иных веществ в воде. Вода — один из лучших растворителей, поэтому природная вода содержит примеси:
- морская вода содержит примеси солей;
- дождевая вода содержит примеси растворенных газов атмосферы (азота, кислорода, углекислого газа);
- колодезная вода содержит сульфаты и карбонаты кальция, магния, натрия, калия.
На долю пресной воды приходится только 3%. Большая часть пресной воды (85%) находится на полюсах Земли в виде ледников и айсбергов.
Учитель: Чтобы использовать воду для питья, а также в промышленности и сельском хозяйстве ее необходимо очищать.
Сообщение учащегося о способах очистки воды ( слайд 11 )
Природная вода всегда содержит примеси. В зависимости от целей ее использования применяют различные приемы очистки.
Питьевая вода не должна содержать нерастворенных примесей и болезнетворных микроорганизмов, которые обычно бывают в водоемах. Если воду для питья берут из озер и рек, то ей дают отстояться в специальных бассейнах и фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, а иногда озоном или ультрафиолетовыми лучами, которые убивают микроорганизмы.
Чтобы очистить воду от растворенных в ней веществ, применяют перегонку, или дистилляцию. Большие количества дистиллированной воды, которая используется в аптеках, химических лабораториях, охладительных автомашинах, получают в перегонных кубах или электрических дистилляторах.
Можно получить очень чистую воду даже в домашних условиях, используя способ вымораживания. Для этого наливают водопроводную воду в емкость и ставят ее в морозильную камеру. Как только в лед превратится примерно половина воды, незамерзшую часть надо слить, а льду дать растаять. Такая вода обладает высокой чистотой и ее считают полезной для здоровья.
В 16 веке королева Англии Елизавета I объявила премию за изобретение дешевого способа опреснения морской воды. Премия пока еще ни кому не вручена. В настоящее время для получения из морской воды 1 км пресной воды требуется 7 млн. т условного топлива, 2,8 т ядерного горючего.
6. Физическая пауза (слайд 12)
– Прежде, чем приступить к закреплению материала, проведем «Гимнастику для глаз».
- Закройте глаза, а потом откройте их. Повторите 5 раз.
- Делайте круговые движения глазами: налево – вверх – направо – вниз – направо – вверх – налево – вниз. Повторите 10 раз.
- Вытяните вперёд руку. Следите взглядом за ногтем пальца, медленно приближая его к носу, а потом медленно отодвиньте обратно. Повторите 5 раз.
- Посмотрите в окно вдаль 1 минуту.
7. Закрепление изученного материала (слайд 13)
Фронтальная беседа по вопросам.
Вы познакомились со свойствами воды, ее распространением и значением для живых организмов.
Какой состав имеет молекула воды? Какое строение имеют ее молекулы?
Перечислите физические свойства воды.
Назовите вид межмолекулярных связей.
Назовите методы определения состава молекул
Как получить воду без примесей? Где используется такая вода?
Какое значение имеет вода в жизни живых организмов?
1. Основной запас воды на Земле находится в:
а) морях и океанах;
б) атмосфере;
г) ледниках;
д) озерах, реках;
2. Глубокие водоемы не промерзают до дна, поскольку:
а) замерзает только верхний слой, т. к. плотность льда меньше плотности воды;
б) лед плавится при 0°С;
в) лед твердый;
г) лед тяжелее воды.
3. Физические свойства воды при комнатной температуре и атмосферном давлении:
а) жидкость;
б) газ;
в) твердое вещество;
г) температура кипения равна 0°С;
д) температура кипения равна 100 °С;
е) температура плавления равна 0 °С;
ж) хорошо проводит электрический ток;
з) температура плавления равна 100 °С;
и) не является растворителем;
к) хороший растворитель.
4 .Метод определения состава воды путем ее разложения на кислород и водород называется:
5 .Очистить воду от твердых примесей можно с помощью:
в) добавления кристаллов перманганата калия;
г) всеми приведенными способами.
6. Вода имеет большое значение для жизни:
а) голубая жидкость без запаха, сохраняет свою форму;
б) белая жидкость с приятным запахом, легко изменяет объем;
в) прозрачная, бесцветная жидкость, не имеет вкуса и запаха, текуча, принимает форму сосуда.
8 . Какие вещества растворяются в воде?
9. В классе вымыли пол. Почему через некоторое время он стал сухим?
а) вода впиталась в поверхность пола;
б) вода с поверхности пола испарилась;
в) вода осталась на подошвах обуви учеников, которые ходили по классу.
Проверка (по щелчку появляются правильные ответы) слайд 14
1.А 2.А 3.А Д К 4.А 5.Б 6.Г 7.В 8.А Б 9.Б
Учитель : Ответы вам предлагаются, и вы сами можете оценить свою работу ( слайд 15 ):
- 0 ошибок – 5
- 1-2 ошибки – 4
- 3-4 ошибки – 3
- 5-6 ошибок – 2
Учитель: Вода — самое распространенное вещество на поверхности нашей планеты. Она играет определяющую роль в формировании климата Земли. Вода — хороший растворитель. Вода содержится во всех частях живого организма, участвует в процессах жизнедеятельности, является средой обитания. При обезвоживании организм погибает.
10. Домашнее задание к следующему уроку
П.29, стр.82-84, стр.87 упр.1-4;Составить схему-конспект, рисунки о физических свойствах и распространении воды; подобрать стихотворения и загадки о воде.
Понравилось, не понравилось, равнодушен
Учитель: Спасибо за работу! Желаю удачи в выполнении домашнего задания.
источник
Конспект урока 8 класс по теме: «Вода. Методы определения состава воды: анализ и синтез. Вода в природе и способы ее очистки Аэрация воды.»
Вода. Методы определения состава воды: анализ и синтез. Вода в природе и способы ее очистки Аэрация воды.
Цель занятия: сформировать у учащихся понятия о строении, составе, свойствах воды, значении в жизни человека, о необходимости бережного отношения к водным ресурсам.
— обучающие : расширить знания учащихся о веществах, их свойствах на примере воды. Определить связь химии с другими естественными науками;
— развивающие : формировать у учащихся мышления о познаваемости мира; умения сравнивать, обобщать, устанавливать причинно-следственные связи;
— воспитывающие : воспитывать культуру химического эксперимента, развивать коммуникативные качества личности, содействовать воспитанию стойкого позитивного интереса к предмету.
Планируемые результаты занятия
оценивать свои личностные качества в совместной работе ;
формирование основ экологического сознания на основе ответственного, бережного отношения к окружающей среде, к своему здоровью.
нести о т ветственность за безопасные приемы работы
проводить посильные опыты с веществами и делать соответствующие выводы;
умение наблюдать за веществами и явлениями их сопровождающими;
умение эффективно сотрудничать и взаимодействовать на основе координации различных мнений.
Методы: проблемный, эвристический, экспериментальный
Предварительная работа: учащиеся заранее готовят небольшие блоки экспресс- информации для выступления на уроке
Реактивы и оборудование: спиртовка, химические стаканы, поваренная соль, порошок мела(карбоната кальция),фильтры, воронки, пробирки, вода, песок, , таблицы справочные.
На доске цитата, в которой пропущено слово «Вода»
(Вода! ) У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобою наслаждаешься, не понимая, что ты такое. Ты не просто необходима для жизни, ты и есть жизнь.
Ты — величайшее в мире богатство. Антуан де Сент-Экзюпери:
Учитель. Как вы думаете, о чем сегодня мы будем говорить?
Итог. Правильно, мы сегодня будем говорить о воде. А вы хорошо знакомы с этим веществом?
Общая характеристика воды
Учитель . Вставьте вместо точек необходимую информацию (работа в парах)
Химическая формула — … ( H 2 O )
Относительная молекулярная масса — …(18)
Чистая вода без …, без …, без … (цвета, запаха,вкуса)
Максимальная плотность — …(1г/см 3 )
Кипит при температуре — …(100 0 С)
Замерзает при температуре — …(0 0 С)
Вода обладает … теплоемкостью (большой)
Она …нагревается и …остывает (медленно)
Учитель. Познакомимся с составом воды Н 2 О. Сегодня на уроке у меня есть помощники: биологи, экологи, физики, историки, которые знают о воде много полезной информации.
Ученик — историк . Такая короткая запись, а сколько трудов положено учеными разных стран, чтобы установить состав воды. Очень долгое время считалось, что вода — это элемент, пока однажды французский ученый Антуан Лоран Лавуазье не пропустил водяные пары через раскаленный ружейный ствол и не разложил воду на составные элементы — водород и кислород, тем самым доказав, что вода — это сложное вещество. А английские ученые Генри Кавендиш и Джозеф Пристли синтезировали воду, сжигая водород в кислороде, тем самым подтвердив состав воды.
Учитель . А сможем ли мы определить состав воды? Задание уч-ся: ответить на вопросы (работа у доски методом «змейки» — кто выполнил первым , выходят к доске и записывают ответ; можно выполнять нескольким ученикам)
Написать уравнение реакции электролиза вод ы … ( 2 H2 O → 2 H2 + O2 )
Сколько объемов водорода и кислорода образуется? (2 V H 2 :1 V O 2 )
Сколько весит 1л водорода и 1л кислорода (уч-ся работают со справочной литературой) ( 1л Н 2 весит 0,089г, а 1л О 2 -1,429г).
Как вычислить массовые отношения выделившихся газов? (0,089г*2): 1,429 = 1:8 или другой вариант ответа учащихся: М r (Н 2 О) = 1*2 +16 = 2:16=1:8)
Почему формула воды — H 2 O (проблемный вопрос ).
а) т.к. в молекуле H 2 O не может быть меньше одного атома кислорода (16а.е.м.), а простейшее массовое соотношение водорода и кислорода равно 1: 8, то в молекуле воды должно быть 2 атома водорода (2а.е.м.). Следовательно, формула воды H 2 O
Метод определения состава вещества путем разложения на более простые называют анализом (от греч. «анализис» — разложение) .
Учитель . В таких же массовых отношениях (1:8) водород и кислород реагируют при образовании воды. Для проведения этой реакции используют эвдиометр.
Ученик – физик. Рассказывает принцип работы прибора эвдиометра.
Эвдиометр представляет собой толстостенную трубку с медными электродами внутри.
Трубку заполняют дистиллированной водой и вводят 2 объема водорода и 2 объема кислорода. Свободные концы проволочек соединяют с индукционной катушкой, а катушку- с источником электрического тока. Между сближенными концами проволочек проскакивает искра и происходит взрыв. Вода в трубке эвдиометра поднимается на три деления. Остается 1 V газа, в котором тлеющая лучинка вспыхивает.
Вопрос учащимся. Какие выводы можно сделать (предполагаемые ответы: оставшийся газ – кислород; при образовании воды 2 V H 2 реагируют с 1 V О 2 )
Учитель . Получение сложных веществ из более простых называют синтезом (от греч. «синтезис» — соединение).
В химии для определения состава веществ и вывода химических формул используют как анализ, так и синтез. Результаты одного метода проверяют другим методом.
Ученик – биолог. Вода – самое распространенное вещество на Земле вещество.
Она образует океаны, моря, реки, озера; входит в состав воздуха. Вода содержится в организмах человека, животных (65-70%) и растений. Вода используется для растворения питательных веществ и переноса их по всему организму, а также для регулирования температуры тела. Организм человека в течение суток расходует примерно 2-3 литра воды. До 20% от этого объема идет на кровоснабжение мозга. Без воды человек может прожить от 3 до 5-7 дней.
Исследовательская (лабораторная) работа в группах.
Проводится инструктаж. Каждому ряду выдаются задания; на каждый стол.
Налейте 1мл воды в выпарительную чашку и выпарьте на спиртовке.
Что наблюдаете? (налет соли)
Сделайте вывод (в воде содержатся растворимые соли)
Налейте в две пробирки по 2-3 мл воды. В первую пробирку добавить немного поваренной соли, а во вторую измельченный мел. Взболтать.
Что наблюдаете? (поваренная соль растворяется в воде, а мел – нет)
Сделайте вывод (вещества имеют разную растворимость в воде)
Очистите воду от примеси речного песка (используют воронку с фильтром)
Что наблюдаете? (часть песка оседает на дно, а часть после фильтрования остается на фильтре)
Сделайте вывод (разделить смесь можно методами отстаивания и фильтрования)
Учитель. Подведем итоги работы.
Чтобы использовать воду для питья, а также в промышленности и сельском хозяйстве ее необходимо очищать.
Природная вода всегда содержит примеси. В зависимости от целей ее использования применяют различные приемы очистки.
Питьевая вода не должна содержать нерастворенных примесей и болезнетворных микроорганизмов, которые обычно бывают в водоемах. Если воду для питья берут из озер и рек, то ей дают отстояться в специальных бассейнах и фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, а иногда озоном или ультрафиолетовыми лучами, которые убивают микроорганизмы.
Схема водоочистительной станции.
I. Река.
II.Отстойник.
III.Колодец.
IV.Фильтр.
V.Устройство для хлорирования.
VI.Насос.
VII.Водонапорная башня.
VIII.Подача очищенной воды в город.
Чтобы очистить воду от растворенных в ней веществ, применяют перегонку, или дистилляцию. Большие количества дистиллированной воды, которая используется в аптеках, химических лабораториях, охладительных автомашинах, получают в перегонных кубах или электрических дистилляторах.
Можно получить очень чистую воду даже в домашних условиях, используя способ вымораживания. Для этого наливают водопроводную воду в емкость и ставят ее в морозильную камеру. Как только в лед превратится примерно половина воды, незамерзшую часть надо слить, а льду дать растаять. Такая вода обладает высокой чистотой и ее считают полезной для здоровья.
Учитель. Для очистки воды используют аэрацию – насыщение воды кислородом с целью:
очистить воду от растворенных соединений металлов (чаще железа) и растворенных газов (сероводорода, углекислого газа и др.)
применяют в сооружениях для биологической очистки сточных вод (обеспечивает кислородом жизнедеятельность микроорганизмов, разлагающих растворенные в сточных водах органические вещества)
Ученик- эколог. Охрана окружающей среды, в том числе воды – большая проблема.
Назовите причины загрязнения воды ( соревнование между рядами).
промышленные сточные воды
выброс нефти при авариях нефтеналивных танкеров и т.д.
Назовите меры по охране воды.
К концу урока учащимся было предложено задание на синтез — написать синквейн по данной теме. Синквейн — способ творческой рефлексии
1 строка — одно существительное,
5-ая — одно существительное, которое выражает суть.
Вот, что из этого получилось:
Кипит, замерзает, испаряется
Дом. задание . Пар.31, с.106 вопр.1-4,тест
источник
вода состоит из кислорода и водорода. Вода – прочное вещество. Она разлагается лишь при очень высоких температурах, например при температуре электрической искры. Водород и кислород соединяются с образованием воды в тех же объемных отношениях (2:1), в каких они выделяются при ее разложении. Это можно подтвердить опытом в приборе, называемом эвдиометром. Эвдиометр представляет собой толстостенную трубку, плотно закрытую резиновой пробкой, в которую вставлены медные проволочки. С наружной стороны трубки нанесены деления на равном расстоянии друг от друга. Эвдиометр заполняют прокипяченной водой, опускают открытым концом в чашку с водой так, чтобы из него не выливалась вода, и укрепляют в лапке штатива. В эвдиометр вводят столько кислорода, чтобы он заполнил трубку до второго деления (два объема), а следующие два объема заполняют водородом. Свободные концы медных проволочек эвдиометра соединяют проводами с индукционной катушкой, а последнюю с источником электрического тока. При включении тока между медными проволочками внутри трубки проскакивает электрическая искра, от которой происходит взрыв смеси водорода с кислородом. Вода в эвдиометре поднимается ровно на три деления. Чтобы узнать, какой газ остался в эвдиометре после взрыва, открытый конец трубки закрывают пробкой, эвдиометр из лапки штатива освобождают и перевертывают. Пробку вынимают и в открытый конец трубки быстро вносят тлеющую лучинку, она вспыхивает. Следовательно, в эвдиометре после взрыва остался один объем кислорода. Значит, во время взрыва израсходовались на образование воды два объема водорода и один объем кислорода.Реакция образования сложного вещества путем соединения простых веществ называется синтезом. В эвдиометре нами был произведен синтез воды.Разложение вещества с целью выяснения его состава называется анализом.Таким образом, состав воды нами был установлен анализом и синтезом. Эти два метода определения состава веществ широко применяются в химии.Знание того, что при разложении воды выделяется 2 объема водорода и один объем кислорода и что при синтезе воды расходуются эти же газы в тех же объемных отношениях, позволяет вычислить весовой состав воды. Допустим, что при разложении воды выделился 1 л кислорода, тогда водорода образовалось 2 л. Зная, что 1 л водорода весит 0,089 г, а 1 л кислорода 1,429 г, получаем весовые отношения выделившихся газов: 1,429 : 0,178 = 8 : 1, т. е. в воде на 1 весовую часть водорода приходится 8 весовых частей кислорода.
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
источник