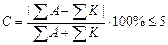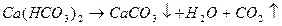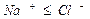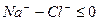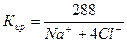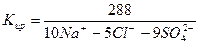Основными задачами химического анализа подземных вод в практике гидрогеологических исследований являются:
- изучение закономерностей формирования и распространения подземных вод различного состава;
- оценка состава и свойств подземных вод для питьевого, технического, сельскохозяйственного, лечебного и других видов исследования;
- исследования подземных вод как критерии при поисках месторождений полезных ископаемых — нефти, газа, солей, различных руд;
- оценка подземных вод как химического сырья для получения йода, брома, бора и других элементов.
Существует четыре типа химических анализов подземных вод: полевой, сокращенный, полный и специальный.
Полевой анализ наиболее прост, он применяется для предварительной характеристики подземных вод района. Его проводят в полевых условиях в походных гидрохимических лабораториях, часто упрощенными методами. При полевом анализе определяют: физические свойства воды, ее pH, наличие Сl — , SO 2- 4 , NO — 3, HCO — 3, СО3 2- , общую жесткость, присутствие Са 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, С02своб; вычисляют: Na + + К + , карбонатную жесткость, Mg 2+ и общую минерализацию.
Сокращенный анализ . Этот анализ производят более точными методами в стационарных лабораториях. При сокращенном анализе определяют: физические свойства воды, величину pH, содержание ионов и компонентов (Сl — , SO 2- 4 — , NO — 3, HCO — 3, СО3 2- , Na + , К + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, свободную и агрессивную углекислоту С02, Si02, окисляемость, сухой остаток, жесткость общую, карбонатную и некарбонатную.
Полный анализ применяется для подробной характеристики химического состава подземных вод. Он производится наиболее точными методами в стационарных лабораториях. Анализ позволяет произвести контроль определений как по сухому остатку, так и по суммам мг-экв катионов и анионов. При полном анализе определяют: физические свойства воды, ее pH, наличие Сl — , SO 2- 4 — , NO — 3, HCO — 3, СО3 2- , Na + , К + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH + 4 , N0 — 2, С02 своб и C0 2arpec, Si 0 2, окисляемость, сухой остаток; вычисляют: жесткость общую, карбонатную и некарбонатную, С0 2агрес.
Специальный анализ. Помимо характеристик, определяемых при перечисленных выше типах анализа, этот анализ включает установление специальных показателей (микрокомпонентов, органических веществ, газов, Eh и др.) по особому заданию в соответствии с целевым назначением исследований. Количество отбираемой для анализа воды зависит от точности и чувствительности анализа и минерализации воды. Чем выше требования к чувствительности и точности анализа, тем больше должен быть объем пробы; пресные и слабо минерализованные воды отбирают в ббльших объемах, чем сильно минерализованные. При полевом анализе обычно бывает достаточно 0,5 л воды, при сокращенном — от 0,5 до 1,0 л (в зависимости от минерализации), а при полном — от 1,0 до 2,0 л. Для определения неустойчивых (изменяющихся во времени) компонентов — С02, H 2 S, 02, Fe и др. — применяют специальные методы отбора и хранения проб.
Результаты химического анализа воды выражают в массовых количествах веществ, растворенных в 1 л (или в 1 кг воды), в эквивалентных количествах или в процент-эквивалентных количествах (%-экв) воды. В гидрогеологической практике принято массовые количества компонентов выражать в миллиграммах на 1 л (мг/л), а эквивалентные количества ионов — в миллиграмм-эквивалентах (мг-экв) каждого иона в 1 л воды.
Величину сухого (плотного) остатка получают взвешиванием пробы после выпаривания воды. Сумму ионов определяют суммированием массы всех ионов, содержащихся в исследуемой воде. Сумма минеральных веществ — более полное выражение, чем сумма ионов, так как она учитывает и недиссоциированные неорганические вещества Si0 2 и Fe 2 03.
В настоящее время принята ионная форма выражения химических анализов воды. Данные лабораторных анализов подземных
вод, выраженные в мг/л, подвергаются дальнейшей обработке (табл.ниже).
источник
Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 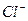 , мг/дм 3 , мг/дм 3 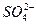 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


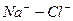
 |
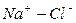

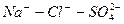
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды |
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник
Тел: +7 (495) 728-94-19 выполняем работы по г. Москве Геология Грунтовая лаборатория Библиотека ООО «Буровики»: Контакты |
Грунтовые воды относятся к разновидностям подземных вод, которые залегают на водоупоре, расположенном ближе к поверхности. На территориях с влажным климатом происходит развитие интенсивных процессов инфильтрации, а также подземного стока, что приводит к выщелачиванию грунтов и горных пород. В некоторых случаях происходит излишнее их испарение, что приводит к засолению почвы. Поэтому стандартный анализ грунтовой воды, когда выполняются инженерно-геологические изыскания для проектирования зданий (сооружений), считается обязательным.
Стандартный анализ грунтовой воды выполняется в условиях лаборатории для получения показателей минерализации образца, его жесткости, агрессивности по отношению к различным материалам строительства (в первую очередь к стали, бетону и алюминиевым оболочкам кабелей), электропроводность и т.д. Минерализацией следует считать сумму всех минеральных веществ, которые растворены в грунтовой воде. Данный показатель получается методом выпаривания исследуемого образца. Следует различать такие степени минерализации грунтовых вод:
Жёсткость грунтовой воды определяется исходя из наличия ионов кальция и магния. Эти химические показатели важны при бурении скважин для поиска пресной воды населению. Также под застройку домов (коттеджей, сооружений) геология участка исследуется на показатель чистоты и безопасности для проживания в данной местности. А, как известно грунтовые воды являются главными показателями чистоты грунта.
Проводя инженерные изыскания на отводимом участке (площадке) важно учитывать фактор агрессивности грунтовых вод. Грунтовые воды могут оказывать разрушающий эффект для бетона и других строительных материалов. Для этого в условиях лаборатории стандартный анализ грунтовой воды выполняется также для получения показателя агрессивности. Агрессивность грунтовых вод бывает таких типов:
- выщелачивающая;
- общекислотная;
- сульфатная;
- магнезиальная;
- углекислотная
СП 11-105-97 Часть I. Общие правила производства работ Приложение Н (обязательное)
Показатели химического состава подземных и поверхностных вод
и методы их лабораторных определений при инженерно-геологических изысканиях
Показатели химического состава воды
Коррозионная активность воды к оболочкам кабелей
Метод испытания или обозначение государственного
стандарта на методы определения
температура в момент взятия пробы, °С
вкус и привкус при температуре 20 °С
Примечание — При проведении комплексных изысканий состав определяемых компонентов следует устанавливать с учетом требований СП 11-102-97
Результаты анализа грунтовой воды позволяет определить уровень ее рН. Если он пребывает ниже уровня нейтрального значения, которое составляет 7 единиц, то вода является кислотной. В таком случае она может разрушать бетон, вне зависимости от того, какого типа портландцемент использован в нем. Степень разрушения также зависит от вида и концентрации кислоты, возможности непрерывного обновления кислоты, скорости течения и давление грунтовой воды на бетон, расхода цемента, непроницаемости бетона и типа заполнителя.
Сама по себе величина рН является определяющим фактором вида или концентрации присутствующей кислоты, ведь это всего лишь мера степени кислотности. В качестве предварительных данных измерения рН очень полезны и позволяют получить представление о наличии или отсутствии кислот. Однако в большинстве случаев необходимым является проведение химического анализа, при котором определяется характер и концентрация кислоты. Как правило, кислотность естественных грунтовых вод, которые имеют низкий рН, вызвана органическими кислотами и растворенной углекислотой, а также, в отдельных случаях, сернистой и серной кислотой, которая поступает из соединений серы в торфяных грунтах. По мере увеличения интенсивности агрессивного воздействия можно повышать качество бетона, например, увеличивать расход цемента с более низким водоцементным отношением.
В зависимости от типа агрессивности грунтовых вод проектировщик принимает решения по выбору материала для строительства строения, а также глубины фундамента.
Анализ грунтовой воды необходим для получения детальной информации об участке исследований. Зная особенности данной жидкости можно своевременно предотвратить неприятные последствия: разрушение, усадка фундамента, трещины на здании, сезонное подтопление и т.д. Для этого проектировщики на первоначальных стадиях проектирования объекта планируют защитные мероприятия (дренажную систему), а также по возможности выбирают более подходящий для данной среды тип фундамента. Для зданий, не имеющих подвальных помещений и при высоком уровне грунтовых вод достаточно просто изолировать стены строения от влаги (не дать возможности поднятию уровня грунтовых вод по стенам). В некоторых случаях выполняют гидроизоляцию фундамента. В любом случае, необходимо учитывать тот факт, что грунтовые воды неблагоприятно влияют на строение в разные времена года (особенно зимой и во время таяния) и заранее принимать меры по их устранению.
источник
Основными задачами химического анализа подземных вод в практике гидрогеологических исследований являются:
- • изучение закономерностей формирования и распространения подземных вод различного состава;
- • оценка состава и свойств подземных вод для питьевого, технического, сельскохозяйственного, лечебного и других видов исследования;
- • исследования подземных вод как критерии при поисках месторождений полезных ископаемых — нефти, газа, солей, различных руд;
- • оценка подземных вод как химического сырья для получения йода, брома, бора и других элементов.
Существует четыре типа химических анализов подземных вод: полевой, сокращенный, полный и специальный.
Полевой анализ наиболее прост, он применяется для предварительной характеристики подземных вод района. Его проводят в полевых условиях в походных гидрохимических лабораториях, часто упрощенными методами. При полевом анализе определяют: физические свойства воды, ее pH, наличие СГ, S04 _ , NO3, HCOj, СО 2- , общую жесткость, присутствие Са 2+ , Fe 2+ , Fe 3+ , NH4, N02, С02своб; вычисляют: Na + + К + , карбонатную жесткость, Mg 2+ и общую минерализацию.
Сокращенный анализ. Этот анализ производят более точными методами в стационарных лабораториях. При сокращенном анализе определяют: физические свойства воды, величину pH, содержание ионов и компонентов (СГ, S04
Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH4, N02, свободную и агрессивную углекислоту С02, Si02, окисляемость, сухой остаток, жесткость общую, карбонатную и некарбонатную.
Полный анализ применяется для подробной характеристики химического состава подземных вод. Он производится наиболее точными методами в стационарных лабораториях. Анализ позволяет произвести контроль определений как по сухому остатку, так и по суммам мг-экв катионов и анионов. При полном анализе определяют: физические свойства воды, ее pH, наличие СГ, SO4 — , NO3, HCOJ, СО3 2 -, Na + , К + , Са 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NHj, NOJ, С02своб и C02 arpec, Si02, окисляемость, сухой остаток; вычисляют: жесткость общую, карбонатную и некарбонатную, С02 агрес.
Специальный анализ. Помимо характеристик, определяемых при перечисленных выше типах анализа, этот анализ включает установление специальных показателей (микрокомпонентов, органических веществ, газов, Eh и др.) по особому заданию в соответствии с целевым назначением исследований. Количество отбираемой для анализа воды зависит от точности и чувствительности анализа и минерализации воды. Чем выше требования к чувствительности и точности анализа, тем больше должен быть объем пробы; пресные и слабо минерализованные воды отбирают в больших объемах, чем сильно минерализованные. При полевом анализе обычно бывает достаточно 0,5 л воды, при сокращенном — от 0,5 до 1,0 л (в зависимости от минерализации), а при полном — от 1,0 до 2,0 л. Для определения неустойчивых (изменяющихся во времени) компонентов — С02, H2S, 02, Fe и др. — применяют специальные методы отбора и хранения проб.
Результаты химического анализа воды выражают в массовых количествах веществ, растворенных в 1 л (или в 1 кг воды), в эквивалентных количествах или в процент-эквивалентных количествах (%-экв) воды. В гидрогеологической практике принято массовые количества компонентов выражать в миллиграммах на 1 л (мг/л), а эквивалентные количества ионов — в миллиграмм-эквивалентах (мг-экв) каждого иона в 1 л воды.
Величину сухого (плотного) остатка получают взвешиванием пробы после выпаривания воды. Сумму ионов определяют суммированием массы всех ионов, содержащихся в исследуемой воде. Сумма минеральных веществ — более полное выражение, чем сумма ионов, так как она учитывает и недиссоциированные неорганические вещества Si02 и Fe23.
В настоящее время принята ионная форма выражения химических анализов воды. Данные лабораторных анализов подземных вод, выраженные в мг/л, подвергаются дальнейшей обработке (табл. 7.1).
Результаты химического анализа подземных вод
Разнообразие химического состава подземных вод вызывает необходимость в их систематизации. Существуют различные формы и множество способов наглядного изображения химического состава вод (графики, формулы, коэффициенты и т.п.).
Формула Курлова. Принцип этой формулы — изображение содержащихся в воде ионов в убывающем порядке в виде псев- додроби, в числителе которой записаны анионы, а в знаменателе — катионы. Слева от дроби формулы приводятся следующие показатели: SP — микроэлементы (Br, I, As) и свободные газы (С02 и др.), мг/л, а также общая минерализация воды М в г/л; справа — pH, температура воды t и дебит D [14, 21].
Ионы, содержание которых в воде менее 10%, в формуле не указываются, однако некоторые исследователи считают, что следует указывать все ионы, входящие в состав подземных вод. В общем виде формула Курлова имеет вид:
Например, паспорт воды знаменитого кисловодского нарзана по формуле Курлова будет иметь следующий вид:
Формула Курлова была предложена в 1928 г., а затем претерпела некоторые изменения. Наиболее рациональным представляется вариант этой формулы, предложенный И.Ю. Соколовым в 1970 г. Он заключается в следующем.
- 1. В левой части формулы записывают (в мг/л) содержание газов, а затем микрокомпонентов, если их количество превышает норму для отнесения подземных вод к минеральным или представляет геохимический интерес.
- 2. Далее указывают величину минерализации воды М в виде дроби: в числителе — в г/л, с точностью до одного десятичного знака, в знаменателе — в эквивалентной форме, выраженной в мг-экв/л суммы анионов.
- 3. В знаменателе псевдодроби записывают в нисходящем порядке все катионы, в числителе — анионы, содержание которых составляет более 1%-экв (с точностью до целых процентов).
- 4. После псевдодроби указывают показатели, характеризующие состояние воды (pH и Eh) и ее температуру, а также перманга- натную окисляемость (в мг О/л). Для сильно минерализованных вод и рассолов в конце формулы проставляют плотность воды.
Формула Курлова позволяет полно отразить все важнейшие химические характеристики исследуемой воды и при этом считать эквивалентное и массовое содержание найденных при анализе ионов. Наименование воды по ее ионному составу, т.е. чтение этой формулы, согласно ГОСТу 13273—73 на минеральные воды таково: сначала называют подчиненные ионы, потом — преобладающие. Так, название воды, записанное в виде приведенной выше формулы, следующее: сульфатно-гидрокарбонатная, кальциево-натриевая вода (в названии обычно учитывают два катиона и два аниона или ионы, содержание которых равно или превышает 25%-экв).
Жесткость. Для пресной воды различают общую, временную (или устранимую) и постоянную жесткость. Общая жесткость обусловлена суммарным содержанием в воде ионов Са 2+ и Mg 2+ . Временную (устранимую) жесткость придают воде карбонаты кальция и магния, осаждающиеся при кипячении воды в виде накипи вследствие разрушения гидрокарбонат-иона:
Разность между общей и временной жесткостью называют постоянной жесткостью, она связана с присутствием сульфатов и галоидов кальция и магния. В настоящее время в России принято выражать жесткость в мг-экв/л (1 мг-экв/л соответствует содержанию 20,04 мг/л Са 2+ или 12,16 мг/л Mg 2+ ).
Для графического изображения химического состава вод пользуются различными геометрическими фигурами (квадратом, треугольником и т.д.), на сторонах которых откладываются преобладающие шесть катионов и анионов, а также различными химическими формулами, например, формулой Курлова, которую часто называют паспортом подземных вод (рис. 7.2).
Рис. 7.2. Способы графического изображения химического состава воды [20, 21]:
I, II — графики-прямоугольники (соответственно без учета и с учетом минерализации); III — график-круг; IV, V — графики-треугольники (соответственно катионного и анионного состава); 7 — К + ; 2 — Na + ; 3 — Mg 2+ ; 4 — Са 2+ ; 5 — NOj; 6 — Cl — ;
К основным видам гидрогеохимической графики относятся гидрогеохимические карты, профили, колонки, разрезы, которые позволяют комплексно изучать гидрохимический режим подземных вод и выявлять определенные закономерности формирования химического состава подземных вод.
источник
Формула Курлова, название воды. Графические изображения химического состава подземных вод.
1. Пересчет результатов химических анализов.Для выяснения количественных соотношений между ионами данные химических анализов, выполненные химической лабораторией, должны быть представлены в миллиграмм-эквивалентной форме, т.к. ионы в растворе реагируют между собой в эквивалентных количествах.
Пересчет из ионной формы, выраженной в мг/л в моль-экв, осуществляется делением числа кг каждого иона на его эквивалентный вес (ионный вес, деленный на валентность) или умножением на пересчетный коэффициент. Наиболее просто находить моль-экв.. пользуясь пересчетной таблицей.
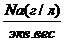
Na(мг/л)* К=Na моль- экв,.
где Кпересчетный коэффициент.
2.Пересчет результатов анализов. Пересчет результатов анализов заканчивается выражением его в процентах моль-эквивалентов. Для этого принимают каждую из вычисленных сумм мг/экв. катионов и анионов за 100% и по формулам

x = 
определяют процентное содержание каждого из катионов и анионов в отдельности. Все данные записывают в соответствующую ведомость химических анализов.
Ведомость химических анализов.
Содержание воды.
1. Вычисление видов жесткости. Жесткость воды обуславливается присутствием в воде ионов кальция,железа, алюминия, марганца, бария, стронция. Для вод , используемых в хозяйственных и технических целях, жесткость воды не учитывать нельзя. Жесткая вода требует больше мыла для получения пены, в ней медленнее развариваются овощи, мясо, образуется накипь на стенках труб и паровых котлов, что уменьшает теплоотдачу и требует большего потребления тепла. Различают жесткость воды общую, временную (устранимую, карбонатную) и постоянную (неустранимую, остаточную).
Общая жесткость определяется суммарным содержанием в воде иона Ca** и Mg**, так как содержание других элементов в воде ничтожно мало. Величина карбонатной жесткости соответствует количеству иона НСО 
Эта величина является расчетной и определяется по количеству ионов Са** Мg**, связанных с ионами НСО 



Временную жесткость определяют ионы Са** и Мg**, осаживающиеся при кипячении воды в виде карбонатов вследствие разрушения гидрокарбонат – иона.
Постоянную жесткость определяют ионы Са** и Мg**, остающиеся в воде после кипячения. Это есть разность между общей карбонатной жесткостью (в моль-экв).
Жесткость воды О.А.Алекин рекомендует следующее подразделение подземных вод по степени жесткости.
Классификация подземных вод по величине жесткости.
Для питьевых целей большей частью используются подземные воды с общей жесткостью до 7 моль-экв/л (около 20 нем. град.), но в некоторых местностях для питья потребляются и более жесткие воды.
2. Для наглядного изображения химического состава можно применять запись в виде формулы Курлова. Эта запись имеет структуру в виде дроби. В числителе в убывающем порядке (по абсолютному содержанию в % экв) записываются анионы, а в знаменателе в таком же порядке – катионы. Слева от дроби в кг/л становится газовый состав (СО 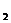
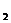


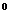

[CO 





В наименование состава воды включаются анионы и катионы, содержание которых превышает 25%-экв, название включает и специфические элементы, а также газовый состав.
Основные ионы Курлов М.Г. предлагает назвать в убывающем порядке, причем, первыми называются анионы, а вторыми , в таком же порядке – катионы. В приведенном примере название состава воды, выраженной формулой Курлова, будет борная, углекислая, железистая, фтористая, хлоридно- сульфатная натриево-магниевое.
Как видно из указанного примера, основные ионы определяют химический состав воды, а газовый и специфические элементы – специфическое содержание. При составлении химического названия воды необходимо соблюдать элементарные правила русского языка, согласно которым основное прилагательное пишется полностью а прилагательное, указывающее на второстепенное свойство предмета, пишется сокращенно. Если в химическом составе воды преобладают анионы хлоридный и сульфатный, причем сульфатного больше, чем хлоридного, то воду следует называть хлоридно-сульфатной, а не сульфатно-хлоридной.
Приведем два примера. Химический состав вод изображен в виде формул Курлова, причем скобками второстепенные ионы отделены от главных.
Здесь мы имеем пресную, гидрокарбонатную магниево-кальциевую воду с повышенным содержанием сульфатов. По классификации О. А. Алекина, данная вода принадлежит к гидрокарбонатному классу, группе кальция и магния и второму типу (CII Ca , Mg 0.4).
Вода солоноватая, сульфатно-хлоридная магниево-натриевая.
Как установлено, ионная форма свойственна в полной мере лишь водам низкой минерализации. При увеличении концентрации растворенных солей между ионами усиливается взаимодействие, причем развивается процесс, обратный диссоциации, т. е. ассоциация. В растворе образуются ассоциированные пары: нейтральные ( СаSО4 0 , МgSО4 0 , СаСО3 0 ) или несущие заряд (Mg(HCO3)2 Са(НСО3)2 + ).Ввиду сложности химического состава природных растворов во многих случаях нельзя предугадать, какие соли в каком порядке будут выпадать из данного раствора, так как на ход кристаллизации влияет температура и другие факторы. Поэтому наши пересчеты из ионной в солевую форму принято называть гипотетическими. При оценке питьевых, лечебных, технических и других качеств воды полезно принимать во внимание не только абсолютное содержание отдельных ионов, но
и предполагаемые ассоциации анионов с катионами (соли). Изображение химического состава вод в виде солей следует рассматривать как очень удобную рабочую гипотезу, позволяющую лучше разобраться в химических свойствах и происхождении природных вод.Пересчет из ионной формы в солевую производится в соответствии с растворимостью солей. В первую очередь комбинируются малорастворимые, а затем все более и более растворимые.
Простейшим для изображения единичных анализов является график-прямоугольник химического состава воды. График строится в виде двух прямоугольников, на одном из которых в масштабе нанесены %-эквиваленты анионов, на другом %-эквивалента катионов в последовательности, определяемой правилом Фрезениуса, т.е. в порядке их химической активности: К*, Na*, Mg**, Fe, Mg, H, NO , Cl, Br, I, SO, НCO, CO, OH. .
Графически изображать единичные анализы можно также с помощью круглой диаграммой Н.И.Толстихина.
Горизонтальной линией круг делится на две части. В верхней части по секторам откладываются в масштабе катионы слева направо в обратном порядке , чем на прямоугольной диаграмме, а в нижней — в таком же порядке анионы. Диаметр круга в масштабе отвечает минерализации воды, точно также и ширина прямоугольной диаграммы в масштабе соответствует величине минерализации воды.
Классификация Алекина О.А. сочетает принцип преобладающего иона и соотношение между ионами. За основу взято шесть главных иона (3 катиона, 3 аниона), содержание которых выражено в моль- эквивалентах:
По преобладающему аниону воды подразделяются на три класса: гидрокарбонатные и карбонатные (НСО 

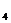
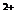


Каждая группа по соотношению между ионами подразделяются на три типа. Всего выделено четыре типа:
I) НСО 

II) НСО
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8396 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Типы химического анализа воды при гидрогеологических исследованиях. Химические классификации типов подземных вод
Химический анализ природных вод в практике гидрогеологических работ предусматривает следующие задачи:
а) изучение закономерностей формирования и распространения природных вод различного состава;
б) исследование природных вод как поискового критерия на месторождения полезных ископаемых – нефти, газа, солей, меди, свинца, молибдена и др.;
в) оценка природных вод как химического сырья для получения иода, брома, бора, меди и других веществ;
г) оценка состава и свойств природных вод для питьевого, технического, сельскохозяйственного, лечебного и других видов использования.
Для общей характеристики состава и свойств воды применяют три типа анализа воды – полевой, сокращенный и полный.
Полевой анализ включает определение физических свойств, pH, Cl — , SO4 2- , NO3 — , HCO3 — , СO3 2- , Ca 2+ , Mg 2+ , Fe 2+ , CO2, H2S, O2. Вычисляются Na + + K + , Mg 2+ или Ca 2+ , карбонатная жесткость, сумма минеральных веществ. Полевой анализ производится в полевых условиях с помощью походной лаборатории. Применяется при массовых определениях для предварительных характеристик вод изучаемого района.
Сокращенный анализ включает определение физических свойств, pH, Cl — , SO4 2- , NO3 — , HCO3 — , СO3 2- , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH4 + , NO2 — , H2S, CО2, H2SiО3, окисляемости, сухого остатка. Вычисляются Na + + К + , жесткость общая, карбонатная, СО2 агрессивная. Сокращенный анализ производится более точными методами в стационарной лаборатории. Он позволяет произвести контроль анализа. Применяется при массовых определениях для характеристики вод района.
Полный анализ включает определение физических свойств, pH, Cl — , SO4 2- , NO3 — , HCO3 — , СO3 2- , Na + , К + , Са 2+ , Mg 2+ , Fe 2+ , Fe 3+ , NH4 + , NO2 — , H2S, CО2, H2SiО3, окисляемости, сухого остатка. Вычисляются .жесткость общая, карбонатная, СО2 агрессивная. Полный анализ производится наиболее точными методами в стационарной лаборатории. Позволяет произвести контроль определений по сухому остатку и по суммам миллиграмм-эквивалентов катионов и анионов.
При проведений специальных исследований необходимы определения состава спонтанных и растворенных газов. В газах определяются: H2S + СО2,О2, СН4, N2+- редкие, Аr + Кr + Хе, Не + Ne и тяжелые углеводороды.
Гидрохимический метод поисков н разведки полезных ископаемых вызывает необходимость определений Li, Rb, Cs, Ва, Вr, I, F, Р, As, В, Сu, Pb, Zn, Cd, Ni, Со, V, Ra, Rn, органических веществ и т. д.
Разноообразие химического состава природных вод вызывает необходимость их систематизации и классификации. Ниже приводится краткое описание некоторых распространенных классификаций.
Классификация Пальмера по соотношению анионов и катионов. Классификация построена по принципу соотношения различных групп анионов и катионов, обусловливающих характерные свойства природных вод. Выделяются пять групп катионов и анионов и шесть характерных свойств воды. Данные анализа выражаются в процент-эквивалентной форме. Катионы и анионы, близкие по своим химическим свойствам, объединяются в следующие группы:
Группа а – сумма процент-эквивалентов катионов щелочных металлов (Na + + К + + Li + ).
Группа е – сумма процент-эквивалентов катионов щелочноземельных металлов (Са 2+ + Mg 2+ + Ва 2+ ).
Группа S – сумма процент-эквивалентов анионов сильных кислот (SO4 2- + Cl — + NO3 — )
Группа А – сумма процент-эквивалентов аиионов слабых кислот (СО3 2- + HCO3 — + HS — + HSiO3 — ).
Группа т – сумма процент-эквивалентов водород-иона и катионов тяжелых металлов (Н + + Fe 2+ + Fe 3+ + Сu 2+ и др.).
Характерные свойства воды, определяемые присутствующими в водах группами ионов, подразделяются на шесть следующих сочетаний:
| 1. | Первая щелочность (щелочность)………………………… | А1 | Гидрокарбонаты и карбонаты щелочных металлов |
| 2. 3. | Вторая щелочность (временная жесткость и щелочность) | A2 | Гидрокарбонаты и карбонаты щелочноземельных металлов |
| 3. | Третья щелочность (щелочность)………………………… | А3 | Гидрокарбонаты тяжелых металлов |
| 4. | Первая соленость (соленость)………………………….. | S1 | Сульфаты и хлориды щелочных металлов |
| 5. | Вторая соленость (соленость, постоянная жесткость)… | S2 | Сульфаты и хлориды щелочноземельных металлов |
| 6. | Третья соленость (кислотность)……………………….. | S3 | Сульфаты и хлориды тяжелых металлов |
На рис. 5.1 изображена схема свойств воды, иллюстрирующая шесть характеристик Пальмера.
По соотношению различных катионов и аниоиов (в процент-эквивалентах) выделяется, по Пальмеру, пять классов вод.
I. Сумма анионов сильных кислот меньше суммы катионов щелочных металлов: S S > а.
IV. Сумма анионов сильных кислот равна сумме катионов щелочных и щелочноземельных металлов: S = (а + е).
V. Сумма аиионов сильных кислот больше суммы катионов щелочных и щелочноземельных металлов: S > (а+ е).
Рис. 5.1. Схема химических свойств воды
Каждый из этих классов характеризует не более чем четыре свойства воды (табл. 5.1).
I класс – воды щелочные, образующиеся при растворении продуктов выветривания изверженных пород в результате процессов обменной адсорбции кальция на натрий. Характерны для вод нефтяных месторождений.
II класс – промежуточный между классами I и III
III класс – воды с постоянной и временной жесткостью. Воды коры выветривания.
IV класс – воды только с постоянной жесткостью. Содержат преимущественно хлориды и сульфаты щелочных металлов. Воды морей и соленых озер.
V класс – кислые воды. Содержат сульфаты железа, алюминия и тяжелых металлов. Воды окисленной зоны рудных месторождений.
Пересчет результатов анализа вод, по Пальмеру, производится путем комбинирования процент-эквивалентов катионов и анионов по вышеизложенному принципу. Ниже приводится пример пересчета данных анализа воды, приведенных в табл. 5.2.
Свойства воды в каждом из пяти классов, по Пальмеру
| Класс | Свойства |
| I | 1-я соленость S1; 1-я, 2-я и 3-я щелочность А1, А2, А3 |
| II | 1-я соленость S1; 2-я и 3-я щелочность А2, А3 |
| III | 1-я и 2-я соленость S1, S2; 2-я и 3-я щелочность А2, А3 |
| IV | 1-я и 2-я соленость S1, S2; 3-я щелочность А3 |
| V | 1-я, 2-я и 3-я соленость S1, S2и S3 |
| Ионы | Мг/л | Мг-экв/л | %-эквивалент |
| Ca 2+ | 95,3 | 4,75 | 44,86 |
| Mg 2+ | 42,4 | 3,48 | 32,86 |
| K + | 15,5 | 0,40 | 3,78 |
| Na + | 45,1 | 1,96 | 18,5 |
| Сумма катионов | 198,3 | 10,59 | 100,0 |
| SO4 2- | 18,9 | 0,39 | 3,68 |
| Cl — | 3.2 | 0,09 | 0,84 |
| HCO3 — | 617,0 | 10,11 | 95,48 |
| Сумма анионов | 639,1 | 10,59 | 100,0 |
| 1-я соленость S1: 3,68+0,84……………………………….. | 4,52 |
| 2-я и 3-я соленость S2и S3…………………………………. | Нет |
| 1-я щелочность А1: (18,5+3,78) – 4,52…………………….. | 17,76 |
| 2-я щелочность А2:44,86+32,86………………………….. | 77,72 |
| Итого:……………………………………………………….. | 100,0% |
Вода, таким образом, должна быть отнесена к I классу.
Для графического изображения классификации вод по Пальмеру используется график (рис. 5.2), представляющий собой три равных горизонтальных столбика, каждый из которых разделен на 100 равных частей.
На верхнем столбике откладывают процент-эквиваленты катионов (K + + Na + , Mg 2+ + Са 2+ , Fe 2 +, Mn 3+ и других тяжелых металлов), на нижнем – процент-эквиваленты анионов (SO4 2- , Cl — , NO3 — , СО3 2- + HCO3 — ). На среднем столбике откладывают характерные свойства воды.
Задание 1. и По данным результатов анализа воды (прилож. 4) определить её класс (по Пальмеру) построить график состава.
Рис. 5.2. График пяти классов воды, по Пальмеру
Нумерация природных вод, по Н. И. Толстихину.
Классификация Н.И. Толстихина, известная под названием «Нумерация природных вод», не только выделяет некоторые группы, но и охватывает все разнообразие вод, встречающихся в природе. Сущность нумерации заключается в том, что вычисленные в процент-эквивалентах группы катионов и анионов наносят на диаграмму, изображенную на рис. 5.3.
Диаграмма представляет собой квадрат, который разделен на десять вертикальных и десять горизонтальных рядов, образующих сто малых квадратов. Каждый имеет свой номер. Для определения номера воды поступают следующим образом. На горизонтальной стороне квадрата слева направо откладывают сумму процент-эквивалентов Са 2+ + Mg 2+ + Fe 2+ или справа налево – сумму процент- эквивалентов Na + + К + . На вертикальной стороне снизу вверх откладывают сумму процент-эквивалентов СО3 2- + HCO3 — или сверху вниз — сумму процент- эквивалентов SO4 2- + Cl — . Точка пересечения ординаты и абсциссы указывает на состав данной воды. Вода получает номер того малого квадрата, в который попадает точка ее анализа.
Рис. 5.3. График-квадрат нумерации природных вод,
Определить номер воды можно и арифметическим путем. Для этого округляют единицы процент-эквивалентов группы Na + + К + до полного десятка и полученное число десятков складывают с процент-эквивалентами группы SO4 2- + Cl — . При этом, если последняя группа окажется однозначным числом, она в расчет не принимается.
Пример расчета. Группа Na + + К + равна 54, число принимается равным 6. Группа SO4 2- + Cl — равна 49, число принимается равным 5. В приводимом примере вода по графику (рис. 5.3)
будет иметь № 46. В нем группа Na + + К + равна 18,50+ 3,78= 22,28 и число десятков в этой группе принимается равным 3. Группа SO4 2- + Cl — представлена однозначным числом 4,52 и в расчет не принимается.
На основании номера воды можно судить о сумме процент-эквивалентов групп а, е, S, А по принадлежности воды к I, II, III и IV классам Пальмера.
Номер воды не характеризует количества SO4 2- и Cl — , а дает их сумму. Н. И. Толстихин рекомендует устранить этот недостаток путем написания за номером воды количества процент-эквивалентов SO4 2 . Как дополнение к нумерации вод представляет интерес составление графиков-треугольников отдельно для катионов и анионов (рис. 5.4).
Рис. 5.4. Графики-треугольники для катионов и анионов
Для газов Н. И. Толстихиным предложен график-треугольник, стороны которого разделены на 100 частей (рис. 5.5). Применение последнего сходно с применением графика-квадрата.
Большое сходство с квадратом Н. И. Толстихина, дополненным треугольниками анионного и катионного состава, имеет графическое изображение состава воды в виде ромба с треугольниками катионного и анионного состава, опубликованное С. Девисом, Р. де Уистом и показанное на рис. 3.16. Характерно, что химический состав воды на данном рисунке называется в последовательности: катион – анион, в российской литературе воду называют в обратном порядке.
Рис. 5.5. График-треугольник для газов
Задание 2. По данным результатов анализа воды (прилож. 4) определить её номер (по Н. И. Толстихину).
График-квадрат А. А. Бродского. На графике (рис. 5.6а) по оси абсцисс откладывают первые и вторые по преобладанию катионы. Результаты каждого анализа наносят в один из 36 квадратов графика. Таким образом, в каждом квадрате представлен определенный тип воды. Химический состав воды наносят на график не в виде точки, а в виде значка, отображающего ту или иную степень минерализации. Для обобщения различных вод большого региона вводят условные обозначения – значки и индексы в виде букв. При применении условных обозначений любая вода может быть охарактеризована не только посредством наглядного изображения на графике, но и при помощи полного индекса, указывающего ее местоположение в том или ином квадрате. В прилагаемой табл. 11 вода А имеет индекс II5А, вода Б – III2Б.
Рис. 5.6. Классификация воды по содержанию ионов (в %-экв),
по С. Денису и Р. де Уисту: А – кальцево-карбонатная; В – кальциево-натриево-хлоридная вода; С – натриево-кальциево-магниево-сульфатная вода
Гидрохимический профиль, по А. А. Бродскому. Гидрохимический профиль строят следующим образом. По оси абсцисс (рис. 5.7б) откладывают в определенном масштабе расстояния между точками взятия проб воды. Для изучения изменения состава воды во времени или с глубиной на этой же оси вместо расстояния можно откладывать время или глубину отбора проб. По оси ординат, откладывают содержание ионов в миллиграмм-эквивалентах. В начале наносят в определенном порядке анионы. Первые точки от нуля ставят для гидрокарбонат-иона и соединяют между собой кривой.
Площадь, образованную этой кривой и осью абсцисс, штрихуют согласно условным обозначениям. Затем откладывают точки дли сульфат-иона и в той же последовательности – для хлорид-иона. При наличии в воде нитрат-иона он также выделяется на профиле, но уже выше линии хлорид-иона.
Химический состав вод А и Б
| Ионы | Вода А | Вода Б | ||||
| Мг/л | Мг-экв/л | %-экв. | Мг/л | Мг-экв/л | %-экв. | |
| Na + | 4.51 | 3,34 | ||||
| K + | 0,41 | 0,37 | ||||
| Ca 2+ | 2.46 | 12,29 | ||||
| Mg 2+ | 0,82 | 32 . | 2,60 | |||
| Сумма катионов | 8,20 | 18,60 | ||||
| Cl — | 1.64 | 1.86 | ||||
| SO4 2- | 1.40 | 8.75 | ||||
| NO3 — | 0,16 | 1,67 | ||||
| HCO3 — | 5,00 | 6,32 | ||||
| CO3 2 — | Нет | – | – | Нет | – | – |
| Сумма анионов | 8,20 | 18.60 |
Примечание. Кроме того, вода Б содержит 1300 мг/л СО2, рН = 6,5 и имеет температуру 40 о С. Дебит данного водоисточника 1000 л/сутки.
Все эти точки также соединяют между собой кривыми, а площади между кривыми соответственно штрихуют. На профиль, образованный анионами, таким же образом наносят катионный состав в последовательности: Са 2 + –Mg 2 + –Na + –К + . При этом заштриховывают только площадь, соответствующую ионам магния. Так как суммы миллиграмм-эквивалентов анионов и катионов всегда равны, то в любом месте графика кривая нитрат-иона (или, при его отсутствии, кривая хлорид-иона) совпадает с кривой щелочных металлов.
На рис. 5.7б скв. II и III расположены от скв. I на расстоянии соответственно 4,5 и 11,3 км. Скв. I имеет воду с содержанием (мг-экв/л): HCO3 — – 2,0; SO4 2- – 8, Cl — – 1,0; NO3 3- – нет; Ca 2+ – 7,0; Mg 2+ – 2,6; Na + – 1,4. Скв. II содержит воду А, а скв. III — воду Б. На гидрохимическом профиле четко отображены не только соотношения между ионами в каждом отдельном водопункте, но и гипотетические соли, образующие эти ионы, и, самое главное, изменение ионного состава.
В тех случаях, когда гидрохимический профиль применяется для выяснения пространственных изменений, он обязательно совмещается с соответствующим гидрогеологическим профилем или разрезом.
Выражение химического состава воды в виде формул. Из формул наибольшей популярностью пользуются формула Курлова и формула солевого состава воды.
Рис. 5.7. График-квадрат (а) и гидрохимический профиль (б)
Формула Курлова представляет собой псевдодробь, в числителе которой находятся анионы (%-экв) в убывающем порядке их содержания, а в знаменателе – в таком же порядке катионы. Для вычисления процент-эквивалентов (% — экв) принимаем сумму мг — экв анионов (ХА), содержащихся в 1 л воды за 100 % и вычисляем процент содержания каждого аниона в мг — экв по отношению к этой сумме. Аналогично вычисляем %- экв катионов.
Ионы, присутствующие в количестве менее 10%-экв, в формуле не указывают. Формула сопровождается дополнительными данными. Слева от дроби проставляют величину рН, жесткость (ж)( в мг-экв/л), в граммах на литр количество газов и активных элементов при содержании их не менее нижних норм, отличающих обычные воды от минеральных, и минерализация воды М в граммах до первого десятичного знака. Справа от дроби проставляется температура воды Т и дебет Д в литрах в сутки. Так, вода Б будет обозначаться следующей формулой:

Формула солевого состава отличается от формулы Курлова тем, что в ней отображено только содержание основных ионов, без указания температуры, дебета, рН и жесткости. Она часто используется в случае большого количества анализов воды, для упрощения обработки результатов.
Задание 3. Составить формулы Курлова и солевого состава для трех проб воды. Варианты для выполнения задания представлены в прилож. 3. В каждом варианте принять шаг по дебету скважины 1,0 л/сут, исходное значение по дебету 2 л/сут. Температура для 1-й воды 30ºС; 2-й – 45ºС; 3-й 20ºС.
Практическая работа № 6
Последнее изменение этой страницы: 2017-01-25; Нарушение авторского права страницы
источник