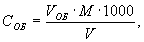Настоящий документ устанавливает методику выполнения измерений общей и свободной щелочности в пробах питьевой и природной воды титриметрическим методом в диапазоне измерений от 0,2 до 20 ммоль/дм 3 .
Методика выполнения измерений обеспечивает с вероятностью Р = 0,95 получение результатов анализа с погрешностью, не превышающей значения, приведенного в таблице 1.
Характеристика погрешности (границы интервала, в котором погрешность находится с доверительной вероятностью Р = 0,95), ± δ, %
Общая щелочность вод обусловлена присутствием в воде гидроксильных ионов и анионов слабых кислот (преимущественно гидрокарбонатов и карбонатов). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих ионов.
В обычных природных водах щелочность зависит в основном от присутствия гидрокарбонатов щелочноземельных металлов, в меньшей степени щелочных. В этом случае значение рН воды не превышает 8,3. Растворимые карбонаты и гидроксиды повышают значение рН (более 8,3). Та часть общей щелочности, которая соответствует количеству кислоты, требуемому для понижения рН до 8,3, называется свободной щелочностью (или щелочностью по фенолфталеину). Титрованием пробы воды до рН 4,5 определяют в пробе общую щелочность. При рН воды меньше 4,5 ее щелочность равна нулю.
Конечную точку при титровании определяют визуально с использованием индикаторов или электрометрически. Электрометрическое определение предпочтительно при анализе загрязненных или окрашенных вод, а также вод, содержащих свободный хлор, обесцвечивающий индикатор.
4.1 Весы лабораторные общего назначения по ГОСТ 24104-88, 2 класса точности с наибольшим пределом взвешивания 200 г.
4.2 рН-метр по ГОСТ 27987-88, с погрешностью измерения ± 0,1 рН.
4.3 Стандарт-титры (фиксаналы) для приготовления образцовых буферных растворов 2-ого разряда по ГОСТ 8.135-74 или ГСО рН водных сред.
4.4 Колбы мерные по ГОСТ 1770-74, номинальной вместимостью 200, 250, 1000 см 3 .
4.5 Цилиндр мерный по ГОСТ 1770-74, номинальной вместимостью 100 см 3 .
4.6 Пипетки мерные по ГОСТ 29227-91, номинальной вместимостью 25 см 3 .
4.7 Бюретка по ГОСТ 29251-91, номинальной вместимостью 5 см 3 .
4.8 Колбы конические по ГОСТ 25336-82, вместимостью 250 см 3 .
4.9 Стаканчики для взвешивания по ГОСТ 25336-82, вместимостью 50 см 3 .
4.12 Мембранные фильтры с диаметром пор 0,45 мкм, например, по ТУ 6-55-221-903-88.
4.13 Фильтры обеззоленные «белая лента», например, по МРТУ 6-09-2411-65.
4.14 Кислота соляная, фиксанал, например, по ТУ 6-09-2540-87.
4.15 Метиловый оранжевый (индикатор), например, по ТУ 6-09-5171-84.
4.16 Ализариновый красный (индикатор), например, по ТУ 6-09-2105-77.
4.17 Фенолфталеин (индикатор), ч.д.а.
4.18 Вода дистиллированная по ГОСТ 6709-72.
Допускается применение других средств измерений, вспомогательных устройств и реактивов, в т.ч. импортных, с метрологическими и техническими характеристиками не хуже указанных.
При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 и ГОСТ 12.4.021.
Требования по электробезопасности при работе с электроустановками должны соблюдаться по ГОСТ 12.1.019.
Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Исполнители должны быть проинструктированы о мерах безопасности при работе с нагревательными приборами.
Организация обучения работающих безопасности труда производится по ГОСТ 12.0.004.
Измерения по методике может выполнять специалист-химик, прошедший соответствующую подготовку и имеющий навыки работы в химической лаборатории.
При подготовке к выполнению измерений и при их проведении необходимо соблюдать следующие условия:
температура окружающего воздуха, °С 20 ± 5,
атмосферное давление, кПа 101 ± 4 (760 мм рт.ст. ± 30 мм рт.ст.),
относительная влажность воздуха, % 65 ± 15,
напряжение питания сети, В 220 ± 22,
частота питающей сети Гц 50 ± 1
Общие требования к отбору проб по ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», и ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб», или другой нормативной документации, утвержденной в установленном порядке.
Объем пробы воды должен быть не менее 200 см 3 . При отборе бутыль следует заполнить водой доверху. Для отбора и хранения используют стеклянную или полиэтиленовую посуду. Щелочность необходимо определять не позднее, чем через 24 часа после отбора пробы. Мутные воды предварительно фильтруют через мембранные фильтры 0,45 мкм.
8.2 Приготовление реактивов
8.2.1 Приготовление раствора соляной кислоты молярной концентрации 0,1 моль/дм 3 (0,1 н). Раствор готовят из фиксанала разбавлением дистиллированной водой до 1000 см 3 .
8.2.2 Раствор индикатора метилового оранжевого с массовой долей 0,05 %. Растворяют 0,1 г метилового оранжевого в 200 см 3 дистиллированной воды.
8.2.3 Раствор индикатора ализаринового красного с массовой долей 0,05 %. Растворяют 0,1 г ализаринового красного в 200 см 3 дистиллированной воды.
8.2.4 Раствор индикатора фенолфталеина с массовой долей 0,5 %. Растворяют 1,0 г фенолфталеина в 200 см 3 дистиллированной воды.
8.3 Подготовка рН-метра к работе
рН-метр подготавливают к работе в соответствии с инструкцией по эксплуатации. Перед проведением измерений рН-метр прогревают в течение 30 минут и производят настройку его по двум стандартным образцам рН или буферным растворам с рН = 4,01 и рН = 6,86. Буферные растворы готовят в соответствии с указаниями в приложении к стандарт-титрам. Стандартные образцы используют в соответствии с инструкцией по применению ГСО рН.
9.1 Определение свободной щелочности
В коническую колбу мерным цилиндром помещают 100 см 3 исследуемой воды, добавляют 2 капли фенолфталеина и титруют на белом фоне раствором соляной кислоты до обесцвечивания. Фиксируют объем израсходованной кислоты ( V СВ ). Если розового окрашивания раствора не происходит, то щелочность по фенолфталеину равна 0.
При электрометрическом определении конечной точки титрования сосуд для титрования помещают на магнитную мешалку и при перемешивании измеряют рН пробы. Если рН пробы равно 8,3 или меньше, то щелочность по фенолфталеину равна 0. Если рН пробы больше 8,3, то пробу титруют до рН 8,3 и фиксируют объем израсходованной кислоты ( V СВ ).
9.2 Определение общей щелочности
В коническую колбу мерным цилиндром помещают 100 см 3 исследуемой воды (или используют раствор после определения свободной щелочности), добавляют 2 — 3 капли индикатора метилового оранжевого или ализаринового красного и титруют на белом фоне раствором соляной кислоты до начала перехода окраски индикатора. Фиксируют объем израсходованной кислоты ( V об ).
При электрометрическом определении конечной точки титрования сосуд для титрования помещают на магнитную мешалку и при перемешивании измеряют рН пробы. Пробу титруют до рН 4,5. Фиксируют объем израсходованной кислоты ( V об ).
Если для определения общей щелочности использовали раствор после определения свободной щелочности, то V об = V cb + V Р , где V Р — объем кислоты, израсходованный на титрование раствора после определения свободной щелочности.
10.1 Свободную щелочность анализируемой пробы вычисляют по формуле:
где ССВ — значение свободной щелочности, моль/дм 3 ;
V СВ — объем раствора соляной кислоты, см 3 , пошедший на титрование пробы до рН 8,3;
М — молярность раствора соляной кислоты, моль/дм 3 ;
1000 — коэффициент пересчета;
V — объем исследуемой пробы, см 3 .
10.2 Общую щелочность анализируемой пробы вычисляют по формуле:
где СОБ — значение общей щелочности, ммоль/дм 3 ;
V ОБ — объем раствора соляной кислоты, пошедший на титрование пробы, см 3 ;
М — молярность раствора соляной кислоты, моль/дм 3 ;
1000 — коэффициент пересчета;
V — объем исследуемой пробы воды, см 3 .
10.3 Результаты измерений общей и свободной щелочности анализируемой пробы представляют в виде:
где С — значение щелочности пробы, ммоль/дм 3 ,
Δ — абсолютная погрешность измерения щелочности при доверительной вероятности Р = 0,95, моль/дм 3 .
Значение Δ рассчитывают по формуле:
где δ — относительная погрешность измерения щелочности при Р = 0,95, %, таблица 1.
10.4 Результаты определения общей и свободной щелочности используются для вычисления содержания ионных форм углекислоты. Расчет основан на предположении, что щелочность вызывается только ионными формами углекислоты и, в отдельных случаях, гидроксильными ионами. Вследствие того, что эта предпосылка редко соответствует действительности, расчет почти всегда дает лишь приближенные результаты. Расчетом нельзя пользоваться при исследовании сильно загрязненных вод.
В зависимости от соотношения между свободной и общей щелочностью возможны 5 случаев расчета:
Отношение между свободной (ССВ) и общей (СОБ) щелочностью
Умножая содержание гидрокарбонат- и карбонат-ионов в ммоль/дм 3 , на 61,02 и 30 соответственно, получаем содержание этих ионов в мг/дм 3 .
Контроль стабильности результатов измерений в лаборатории осуществляют по ГОСТ Р ИСО 5725-6, раздел 6, используя методы контроля стабильности стандартного отклонения повторяемости или стандартного отклонения промежуточной прецизионности рутинного анализа.
Средством контроля являются пробы питьевых и природных вод, анализируемых в лаборатории.
11.1 При построении контрольных карт для контроля стандартного отклонения повторяемости используют приведенные к среднему значению результатов анализа значения расхождений ( w’ ) полученных результатов единичных измерений с1и с2, которые сравнивают с рассчитанными при построении контрольных карт пределами предупреждения и действия
где σ r — стандартное отклонение повторяемости результатов для значения у численно равного 1. Значение стандартного отклонения повторяемости приведено в таблице 2.
Пример. За три дня получены результаты параллельных определений 0,36 и 0,33 ммоль/дм 3 , 4,7 и 4,9 ммоль/дм 3 ; 6,5 и 6,7 ммоль/дм 3 .
Рассчитывают расхождения w 1 ‘ = |0,36 — 0,33| / 0,5 · (0,36 + 0,33) = 0,09
w 2 ‘ = |4,7 — 4,9| / 0,5 · (4,7 + 4,9) = 0,04
w 3 ‘ = |6,5 — 6,7| / 0,5 · (6,5 + 6,7) = 0,02
Значения расхождений наносят на контрольную карту.
Для расчета UCLn и UCL Диз таблицы 2 берут σ r = 5 %. Расчет UCLn = 2,834 · 0,05 = 0,14, UCL Д= 3,686 · 0,05 = 0,18, где 0,05 — абсолютное значение σ r = 5% для у = 1.
11.2 При построении контрольных карт для контроля стандартного отклонения промежуточной прецизионности используют приведенные к среднему значению расхождения ( w’ ) результатов, полученных в условиях промежуточной прецизионности (при различиях по факторам «время», «оператор», «оборудование») y 1 и у2, которые сравнивают с рассчитанными при построении контрольных карт пределами предупреждения и действия
где σI(T,O,E) — стандартное отклонение промежуточной прецизионности результатов для значения у численно равного 1. Значение стандартного отклонения промежуточной прецизионности приведено в таблице 2.
Пример. За три дня двумя операторами получены результаты измерений 0,31 и 0,26 ммоль/дм 3 , 5,2 и 5,6 ммоль/дм 3 , 6,3 и 6,6 ммоль/дм 3 .
Рассчитывают расхождения w 1 ‘ = |0,31 — 0,26 | / 0,5 · (0,31 + 0,26) = 0,18
Значения расхождений наносят на контрольную карту.
Диапазон измерений щелочности, ммоль/дм 3
Стандартное отклонение повторяемости, σr,.%
Стандартное отклонение промежуточной прецизионности при различиях по факторам «время», «оператор», «оборудование», σI(T,O,E), %
При неудовлетворительных результатах контроля, например, превышение предела действия или регулярное превышение предела предупреждения, выясняют причины этих отклонений, в том числе проверяют работу оператора.
Периодичность проведения контроля стабильности результатов измерений устанавливают индивидуально для каждой лаборатории в соответствии с документами по внутрилабораторному контролю качества результатов анализа.
После внедрения МВИ в практику работы лаборатории при необходимости проверки приемлемости результатов измерений, полученных в условиях воспроизводимости, проводят межлабораторные сравнительные испытания с использованием данной методики для оценки стандартного отклонения воспроизводимости. В случае невозможности организации межлабораторных сравнительных испытаний допускается, согласно МИ 2336-2002, оценить значение стандартного отклонения воспроизводимости, σ R , по формуле: σ R = 1,2 · σI(T,O,E). Проверку приемлемости результатов измерений в условиях воспроизводимости осуществляют по ГОСТ Р ИСО 5725-6-2002, пункт 5.3.
Оценки стандартных отклонений повторяемости и воспроизводимости
В таблице А.1 представлены данные по результатам межлабораторных сравнительных испытаний (МСИ) по определению общей щелочности в пробах питьевой воды, проведенных Органом по аккредитации ЦИКВ среди аккредитованных лабораторий и обработанных в соответствии с п. 7.4 ГОСТ Р 5725-2-2002. Представленные данные не применимы для обобщений.
р — количество лабораторий;
п — количество измерений, полученных в каждой лаборатории;
у — общее среднее значение щелочности в образце;
Sr — оценка стандартного отклонения повторяемости результатов измерений;
SR — оценка стандартного отклонения воспроизводимости результатов измерений.
Ионы СО3 2- и НСО3 при совместном присутствии определяют обычно путем титрования воды соляной кислотой. Это определение основано на реакциях:
При прибавлении соляной кислоты будет увеличиваться концентрация ионов водорода в воде, это повлечет за собой нарушение указанных выше равновесий, обе реакции пойдут слева направо. На основании того, что константы углекислоты различаются на 4 порядка, можно утверждать, что пока в воде остается заметное количество карбонат-ионов, в ней практически будет отсутствовать свободная углекислота.
Таким образом, вначале протекать практически будет только первая из указанных реакций, так как карбонат-ионы будут связывать ионы водорода, превращаясь в ионы НСО3 — . Сдвиг равновесия вправо для второй реакции не будет иметь практического значения. После окончания первой реакции рН воды будет равен 8,3. В этот момент вода не будет содержать практически ни ионов СО3 2- , ни свободной углекислоты.
При дальнейшем прибавлении соляной кислоты будет протекать уже вторая реакция. При значении рН около 4,5 в воде будет только свободная углекислота, ионы НСО3 — будут отсутствовать. При этом как в эквивалентной точке, соответствующей концу первой реакции, так и в эквивалентной точке, отвечающей концу второй реакции, будут отмечаться скачки в титровании, хотя и не очень большие.
Указанные обстоятельства позволяют определить конец первой и конец второй реакции при помощи двух различных индикаторов. Конец первой реакции устанавливается по фенолфталеину, конец второй — по метиловому оранжевому. При анализе загрязненных и окрашенных вод рекомендуется электрометрическое титрование.
Силикат-, фосфат-, борат-, сульфид-ионы, ионы гуминовых и других слабых кислот титруются вместе с карбонат- и гидрокарбонат-ионами. Обычно эти ионы присутствуют в природных водах в очень малых концентрациях.
«Унифицированные методы анализа вод» под общей редакцией Лурье Ю.Ю., М., 1971, издательство «Химия», с. 65 — 68, 165
«Методы определения вредных веществ в воде водоемов» под редакцией Щипковой А.П., М., издательство «Химия», 1981, с. 37 — 40
«Контроль химической, бактериальной и радиационной безопасности по международным стандартам» под редакцией Фомина Г.С., М., 1995, с. 118 — 120
Центр Исследования и Контроля Воды
аккредитован в Системе аккредитации аналитических лабораторий (центров) Госстандарта России, № Госреестра РОСС RU .0001.510045
Метрологическая служба аккредитована на право аттестации методик выполнения измерений и проведения метрологической экспертизы документов, в том числе применяемых в сферах распространения государственного метрологического контроля и надзора, № Госреестра 01.00031-97
199034, Санкт-Петербург, Университетская наб., 7/9
о метрологической аттестации методики выполнения измерений щелочности в пробах питьевой и природной воды титриметрическим методом (ЦВ 1.01.11-98 «А »)
Методика выполнения измерений щелочности в пробах питьевой и природной воды титриметрическим методом,
разработанная Центром исследования и контроля воды.
регламентированная в документе: «Методика выполнения измерений щелочности в пробах питьевой и природной воды титриметрическим методом» ЦВ 1.01.11-98 «А»,
аттестована в соответствии с ГОСТ Р 8.563-96.
Аттестация осуществлена по данным внутрилабораторного контроля воспроизводимости результатов измерений, полученным в 1997 — 1998 годах.
В результате аттестации установлено, что МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Диапазон измерений щелочности, ммоль/дм 3
Характеристика погрешности (границы интервала, в котором погрешность находится с доверительной вероятностью Р = 0,95), ± σ, %
Свидетельство выдано 25 декабря 1998 г.
источник
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 17 ноя 2009 03:45 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 04 ноя 2009 21:05 | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 03 апр 2010 07:36 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 04 ноя 2009 21:05 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 04 ноя 2009 21:05 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 04 ноя 2009 21:05 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 27 май 2011 22:35 | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 04 ноя 2009 21:05 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 04 ноя 2009 21:05 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Зарегистрирован: 17 ноя 2009 03:45 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вернуться к началу |
| Модератор |
Зарегистрирован: 17 ноя 2009 03:45
Сообщения: 10858
Откуда: г. Волгоград
_________________ |
| Модератор |
Зарегистрирован: 17 ноя 2009 03:45
Сообщения: 10858
Откуда: г. Волгоград
_________________ |
| Модератор |
Зарегистрирован: 17 ноя 2009 03:45
Сообщения: 10858
Откуда: г. Волгоград
| _________________ |
| . |
Зарегистрирован: 04 ноя 2009 21:05
Сообщения: 46094
Откуда: Київ
| Publisher: C U P 1992 | 616 Pages | ISBN: 052138317X | DJVU | 4 MB The present book covers different aspects of proton conduction: the first part describes chemical and physical parameters necessary for fast proton conduction and proposes a classification of different kinds of proton conductors. Comparison is made with other hydrogen containing materials (metals, graphites). The importance of partial water pressure, the role of defects and surface phenomena are discussed. The second part treats the chemistry, structures and electrical properties of typical materials from hydrogen bronzes to polymers via ice, hydroxides, acid sulphates, layer hydrates, clays, gels and porous or fractal media. The third part discusses the methods concerning the proton dynamics from local to macroscopic scale. The fourth part deals with conductivity mechanisms and the last one presents typical applications: electrochemical systems for production or energy storage and microionic devices. Комментарий к файлу: Mickaël Lallart, «Ferroelectrics — Characterization and Modeling» Ferroelectrics_-_Characterizat_31.08.2011_19_23_45.jpeg [ 8.38 Кб | Просмотров: 20673 ] InTech | 2011 | ISBN: 9789533074559 | 586 pages | PDF | 28,8 MB Ferroelectric materials have been and still are widely used in many applications, that have moved from sonar towards breakthrough technologies such as memories or optical devices. This book is a part of a four volume collection (covering material aspects, physical effects, characterization and modeling, and applications) and focuses on the characterization of ferroelectric materials, including structural, electrical and multiphysic aspects, as well as innovative techniques for modeling and predicting the performance of these devices using phenomenological approaches and nonlinear methods. Hence, the aim of this book is to provide an up-to-date review of recent scientific findings and recent advances in the field of ferroelectric system characterization and modeling, allowing a deep understanding of ferroelectricity. |
| . |
Зарегистрирован: 04 ноя 2009 21:05
Сообщения: 46094
Откуда: Київ
| Обобщающий труд студентов Химического факультета МГУ 1957 г. В сжатой и обобщенной форме рассмотрены самые различные области химической науки: строение вещества, физическая, неорганическая, аналитическая, органическая, биоорганическая химия, энзимология, прикладные исследования. На высоком профессиональном уровне и вместе с тем доступно для химиков любого профиля описано современное состояние этих областей, достижения последних лет и перспективы развития. Подчеркнуты наиболее острые проблемы, стоящие перед соответствующими областями знаний. В книге отражены взгляды химиков одного поколения, активно развивающих общественную науку. Книга предназначена для широкого круга специалистов, интересующихся различными аспектами химической науки и промышленности, работников высшей школы, а также аспирантов и студентов. Содержание Засорин. Электронографическое определение структур молекул. Локшин. Спектроскопия комбинационного рассеяния в химии. Харитонов. Колебательные спектры в неорганической и координационной химии. Ходеев. Высокотемпературная масс-спектрометрия. Розынов. Масс-спектрометрия в изучении строения биополимеров. Багреев. Экстракционные методы в аналитической химии. Долманова. Кинетические методы в аналитической химии. Колесов. Нейтронно-активационный анализ внеземного вещества. Базилевский. Расчеты химических реакций. Калязин. Химия высоких энергий. Видавский, Богородский. Химические реакции под действием лазерного излучения. Серебрянков. Органическая фотохимия. Бочков. Синтетическая химия углеводов. Бубнов. Применение борорганических соединений в синтезе. Заиков. Кинетические аспекты деструкции и стабилизации полимеров. Агеев. Термодиффузия и перспективы ее применения. Зоркий. Современная кристаллохимия. Барсова. Радиационно-химические дефекты в ионных кристаллах. Кравченко. Химические проблемы твердотельной электроники. Шимулис. Строение поверхности раздела фаз. Перцов. Поверхностные явления и прочность твердых тел. Амелина. Контактные взаимодействия частиц в химических системах. Овчинников. Физико-химические основы ионного транспорта через биологические мембраны: ионофоры и ионные каналы. Северин. Проблемы регуляции активности ферментов. Баскова (Григорьева) Химические основы свертывания крови. Лазарев. Химические проблемы защиты атмосферы. Привалова, Заиков. Проблемы использования полимеров в хирургии. Яковлева. Химия и строительные материалы. Привалов. Химия и проблемы сохранности документов. Саморуков. Что дает анализ цитируемости научных работ. Изложено применение электролиза в органической химии. Приведены электрохимические реакции энзимов, карбонильных соединений, анодного окисления и прочие аспекты применения электролиза. A presentation of developments in the electrochemistry of C60 and related compounds, electroenzymatic synthesis, conducting polymers, and electrochemical partial fluorination. It contains accounts of carbonyl compounds, anodic oxidation of oxygen-containing compounds, electrosynthesis of bioactive materials, electrolyte reductive coupling, and more. |
| . |
Зарегистрирован: 04 ноя 2009 21:05
Сообщения: 46094
Откуда: Київ
| Publisher: Springer | ISBN: 3642228593 | November 28, 2011 | PDF | 191 pages | 12 MB Jason Woolford’s thesis describes for the first time, a double [3+2] photocycloaddition of alkenes onto aromatic rings. Modern synthetic chemistry relies on the ability of researchers to uncover new and more efficient ways of creating highly complex structures. This work describes a novel, environmentally friendly photochemical step that converts in one pot, trivial starting materials into otherwise difficult to construct fenstrane frameworks. The rigid cores of these frameworks have significant potential in drug design. Moreover, the novelty of this work overtakes many other methods for the creation of chiral centres. No less than seven chiral centres are created in the photochemical step together with the formation of four carbon-carbon bonds and multifused rings. Jason’s innovative work has been the subject of several publications in peer-reviewed journals. Introduction to Organic Photochemistry by J. D. Coyle Publisher: W iley (January 15, 1991) | ISBN: 0471909750 | Pages: 184 | PDF | 49.73 MB Introduction to Organic Photochemistry John D. Coyle, The Open University, Milton Keynes The purpose of this book is to provide an introductory account of the major types of organic photochemical reactions, to enable those with a prior knowledge of basic organic chemistry to appreciate the differences between processes which occur photochemically (through an electronically excited state) and those that occur thermally (directly from the electronic ground state). The material is organized according to organic functional groups, in parallel with the approach adopted in most general textbooks on organic chemistry. In this respect it differs from many of the existing, older organic photochemistry texts. The first chapter provides an account of the distinctive features of photochemical reactions, and a physical/mechanistic framework for the descriptions in the rest of the book. The overall emphasis is on organic photoreactions potentially useful in synthesis. The book thus integrates this branch of chemistry with broader aspects of the subject, and introduces the reader to important applications of organic photochemistry. Publisher: Wil..ey-Inters..cience 1980 | 526 Pages | ISBN: 0471043923 | PDF | 4 MB Updated every five years, the series represents the optimal compromise between currency and a sufficient body of material for cohesive and comprehensive treatment in a monograph. Provides a quick yet thorough overview of the synthetic routines that have been used to access specific classes of therapeutic agents. Materials are organized by chemical class, and syntheses are taken back to available starting materials. Discusses disease state, rational for method of drug therapy, biological activities of each compound and preparation. Coverage also includes those generic pharmaceutical compounds not accorded clinical status. A glossary defines biological terms. Publisher: Ro al S ociety of Chem istry; 1 edition (December 31, 1995) | ISBN: 0854042105 | Pages: 168 | PDF | 1.40 MB The protection of the environment is our responsibility, whether we are a member of the public as a citizen or consumer or as an industrialist producing consumer products, or as a part of Government, either in setting environmental policy or in regulating environmental pollution. Concern for the environment and both national and international regulations will continue to put pressure on industries to minimize their impact on the environment. There are great business opportunities for companies to supply and adopt cleaner technologies and more environmentally friendly techniques. There are challenges to be met in developing new products and processes that are more e¦cient and produce less waste. There are savings to be made in avoiding the increasing costs of environmentally acceptable waste disposal. There are further opportunities. New technologies can bring together the beneÞts of greater e¦ciency, less pollution, and a minimizing of impact on the environment as a whole. Maintaining the status quo is not acceptable. |
| . |
Зарегистрирован: 04 ноя 2009 21:05
Сообщения: 46094
Откуда: Київ
| Комментарий к файлу: Алекин О.А. Основы гидрохимии Основы гидрохимии.jpg [ 27.07 Кб | Просмотров: 20507 ] Ruthenium in Organic Synthesis by Shun-Ichi Murahashi |
| . |
Зарегистрирован: 04 ноя 2009 21:05
Сообщения: 46094
Откуда: Київ
| Publisher: Elsevier Science | 2000-10-30 | ISBN: 0444894306 | Pages: 676 | PDF | 15.75 MB This book is mainly concerned with building a narrow but secure ladder which polymer chemists or engineers can climb from the primary level to an advanced level without great difficulty (but by no means easily, either). Publisher: Wil..ey-Inters..cience 1980 | 526 Pages | ISBN: 0471043923 | PDF | 4 MB Updated every five years, the series represents the optimal compromise between currency and a sufficient body of material for cohesive and comprehensive treatment in a monograph. Provides a quick yet thorough overview of the synthetic routines that have been used to access specific classes of therapeutic agents. Materials are organized by chemical class, and syntheses are taken back to available starting materials. Discusses disease state, rational for method of drug therapy, biological activities of each compound and preparation. Coverage also includes those generic pharmaceutical compounds not accorded clinical status. A glossary defines biological terms. Publisher: Elsеvier Sciеnce | 1999-03-11 | ISBN: 0444824375 | PDF | 624 pages | 28.03 MB The principal objective of this book is to stimulate interest in research that will extend available theory towards a greater understanding of the steps involved in solid-state decompositions and the properties of solids that control reactivities. Much of the activity in this field has been directed towards increasing the range of reactants for which decomposition kinetic data is available, rather than extending insights into the fundamental chemistry of the reactions being studied. The first part of the book (Chapters 1-6) is concerned with theoretical aspects of the subject. The second part (Chapters 7-17) surveys groups of reactions classified by similarities of chemical composition. The final Chapter (18) reviews the subject by unifying features identified as significant and proposes possible directions for future progress. Проблема очистки воды, используемой для бытовых и промышленных целей, от различных загрязнений имеет огромное значение. С одной стороны, постоянно повышаются требования к качеству воды, особенно в промышленности и энергетике, а с другой — происходит прогрессирующее загрязнение водных источников, которое затрудняет работу существующих систем очистки. В данной работе обобщены основные направления развития и современное состояние систем водоподготовки с использованием новейших технологических и аппаратурных решений в области осветления, обезжелезивания, умягчения и обессоливания воды для использования в пищевой промышленности, энергетике и для бытового применения. Основное внимание уделено современным методам обезжелезивания, ионного обмена, мембранной фильтрации и аппаратурно-технологическим схемам на их основе. Для специалистов в области водоподготовки для пищевых производств, энергетики и бытового использования. |
| источник |