СПИСОК ЛИТЕРАТУРЫ ПО ОЧИСТКЕ ПРИРОДНЫХ ВОД
1. Рябчиков Б.Е. Современные методы подготовки воды для промышленного и бытового использования. – М.: ДеЛи принт, 2004. – 328 с.
2. Николадзе И.Г., Сомов М.А. Водоснабжение. – М.: Стройиздат, 1995. – 688 с.
3. Фрог Б.Н. Водоподготовка. – М.: МГУ, 2001. – 680 с.
4. СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. – М.: Федеральный центр Госсанэпиднадзора, 2002. – 103 с.
5. СНиП 2.04.02-84. Водоснабжение. Наружные сети и сооружения.
6. Мазаев В.Т., Королев А.А., Шлепнина Т.Г. Коммунальная гигиена/Под ред. В.Т. Мазаева. – «2-е изд., испр. и доп. – М.: ГЭОТАР-Медиа, 2005. – 304 с.
7. Мазаев В.Т., Ильницкий А.П., Шлепнина Т.Г. Руководство по гигиене питьевой воды и питьевого водоснабжения. – М.: ООО «Медицинское информационное агентство», 2008. – 320 с.
8. Журба М.Г., Соколов Л.И., Говорова Ж.М. Водоснабжение. Проектирование систем и сооружений: т.2., изд. 2-е, пер. и доп. Учеб. пособие. – М.: Издательство АСВ, 2004. – 496 с.
9. Губонина З.И. Промышленная экология. Проблемы питьевой воды: учеб. пособ./ Губонина З.И., Владимиров С.Н. – М.: Изд-во МГОУ, 2010. – 100 с.
10. Шевцов М.Н. Водоснабжение промышленных предприятий: учеб. пособ. для вузов. – Хабаровск: Изд-во ТОГУ, 2010. – 127 с.
МЕТОДЫ ИНЖЕНЕРНОЙ ЗАЩИТЫ ПОВЕРХНОСТНЫХ ВОД ОТ ПРОМЫШЛЕННЫХ СТОКОВ. СОВРЕМЕННЫЕ МЕТОДЫ ПОДГОТОВКИ ВОДЫ ДЛЯ ПРОМЫШЛЕННОГО И БЫТОВОГО ИСПОЛЬЗОВАНИЯ
Список литературы по очистке сточных вод
1. Инженерная защита поверхностных вод от промышленных стоков: Учеб. пособие/Д.А. Кривошеин, П.П. Кукин, В.Л. Лапин и др. – М.: Высшая школа, 2003. – 344 с.
2. Будыкина Т.А., Емельянов С.Г. Процессы и аппараты защиты гидросферы: учеб. пособие для студ. высш. проф. образования. – М.: Издательский центр «Академия», 2010. – 288 с.
3. Яковлев С.В., Воронов Ю.В. Водоотведение и очистка сточных вод/Учебник для вузов: — М.: АСВ, 2004. – 704 с.
4. Родионов А.И., Кузнецов Ю.П., Соловьев Г.С. Защита биосферы от промышленных выбросов. Основы проектирования технологических процессов. – М.: Химия, КолосС, 2005. – 392 с.
5. Очистка производственных сточных вод: Учеб. пособие для вузов/С.В. Яковлев, Я.А. Карелин, Ю.М. Ласков, Ю.В. Воронов; Под ред. С.В. Яковлева. – 2-е изд., перераб. и доп. – М.: Стройиздат, 1985. – 335 с.
6. Яковлев С.В., Волков Л.С., Воронов Ю.В., Волков В.Л. Обработка и утилизация осадков производственных сточных вод. – М.: Химия, 1999. – 448 с.
7. Евилевич А.М., Евилевич В.А. Утилизация осадков сточных вод. – Л.: Стройиздат, 1988. – 248 с.
8. Туровский И.С. Обработка осадков сточных вод. – М.: Стройиздат, 2009. – 256 с.
9. СанПиН 2.1.7.573-96 Гигиенические требования к использованию сточных вод для орошения и удобрения. – М.: Информационно-издательский центр Минздрава России, 1997. – 54 с.
10. СНиП 2.04.03-85 Канализация. Наружные сети и сооружения. – М.: ЦИТП, 1986. – 72 с.
11. Канализация населенных мест и промышленных предприятий. Справочник проектировщика/Н.И. Лихачев, И.И. Ларин, С.А. Хаскин и др..; Под общ. ред. В.Н. Самохина. – 2-е изд., перераб. и доп. – М.: Стройиздат, 1981. – 639 с.
12. Хенце М. Очистка сточных вод: Пер. с англ./ Хенце М., Армоэс П., Ля-Кур-Янсен Й., Арван Э.- М.: Мир,2006. – 480 с.
13. Кузнецов А.Е., Градова Н.Б. Научные основы экобиотехнологии (для данного курса представляют интерес разделы «Экосистемы природных сред и сооружений биологической очистки», «Антропогенные факторы загрязнения», «Биотрансформация соединений азота и серы»). Учеб пособ. – М.: Мир, 2006. – 504 с.
14. Гетманцев С.В., Нечаев И.А., Гандурина Л.В. Очистка производственных сточных вод коагулянтами и флокулянтами. Научное издание. Издательство АСВ. – М.: 2008. – 272 с.
15. Алексеев Е.В. Физико-химическая очистка сточных вод: Учебное пособие. – М. : Издательство Ассоциации строительных вузов, 2007. – 248 с.
16. Водоотводящие системы промышленных предприятий / С.В. Яковлев, Я.А. Карелин, Ю.М. Ласков, Ю.В. Воронов. – М.: Стройиздат, 1990. – 511 с.
17. Ресурсосберегающие технологии в системах водного хозяйства промышленных предприятий: Учеб. пособие. / Л.И. Соколов. – М.: Издательство АСВ, 1997. – 256 с.
18. Пахненко Е.П. Осадки сточных вод и другие нетрадиционные органические удобрения. – М.: БИНОМ. Лаборатория знаний, 2007. – 311 с.
19. Воронов Ю.В., Яковлев С.В. Водоотведение и очистка сточных вод: учеб. для вузов (направление «Строительство»). 4-е изд., доп. и перераб. М.: АСВ: Изд-во МГСУ, 2006. – 704 с.
20. Ласков Ю.М., Воронов Ю.В., Калицун В.И. Примеры расчетов канализационных сооружений. Учеб. пособ. для вузов. 3-е изд., перераб. и доп. – М.: Альянс, 2008. – 256 с.
21. Пугачев Е.А. Процессы и аппараты обработки осадков сточных вод. – 2010. – 208 с.
22. Самыгин В.Д., Игнаткина В.А. Процессы и аппараты очистки сточных вод. Учебное пособие. – 2009. – 223 с.
23. Типовой технический регламент использования осадков сточных вод в качестве органического удобрения от 19.06.2000 г.
24. Сельскохозяйственное использование сточных вод: Справочник/ Л.П. Овцов, В.В. Игнатова, Э.Е. Элик и др.; Сост. Э.Е. Элик. – М.: Росагропромиздат, 1989. – 223 с.
25. Серпокрылов Н.С. и др. Экология очистки сточных вод физико-химическими методами. – М.: АСВ, 2009. – 262 с.
26. Кичигин В.И. Водоотводящие системы промышленных предприятий: учеб. пособ. для вузов. – М.: АСВ, 2011. – 656 с.
27. Лапицкая М.П. Очистка сточных вод (примеры расчетов): учеб. для вузов и среднего спец. Образов. (спец. «Водоснабжение и канализация») / Лапицкая М.П., Зуева Л.И., Балаескул Н.М., Кулешова Л.В. – Минск, Высшая школа, 2007. – 256 с.
28. Ветошкин А.Г. Процессы и аппараты защиты гидросферы. Учеб. пособ. – Пенза: Изд-во Пенз. гос. ун-та, 2004. – 188 с.
источник
Исследовательская работа по проведению химического анализа проб воды. Методика простая и доступная, не требуются дефицитные реактивы.
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа № 108 »
Советского района г. Казани
Исследовательская работа по теме
«Химический анализ воды в речке Нокса»
Работу выполнил ученик 7 класса
Руководитель: учитель химии
Латфуллина Резеда Нурахметовна
Кузнецов Андрей 6 класс.doc
2.1. Пробоотбор и подготовка воды к анализу
2.5. определение присутствия масел и жиров
4. Список использованной литературы
Наша республика богата природными источниками и водными ресурсами. А мой родной город расположен на прекрасном и живописном берегу великой реки Волга, в которую впадает.
А в р. Казанку в свою очередь впадает речка Нокса, которая протекает совсем рядом с нашей школой.
Целью моей работы является изучение химического состава и свойств воды речки Нокса.
Исходя из этой цели я поставил перед собой следующие задачи :
1. На основании качественного и количественного анализа определить
физические показатели качества воды.
2. Расширить и углубить знания о качестве воды, оказывающей влияние на
Актуальность выбранной мною темы в том, что вода является источником всего живого на Земле. Этой исследовательской работой я хотел расширить свои знания о составе и свойствах воды, с которой мы имеем дело ежедневно.
— забор пробы из речки Нокса;
— практические и лабораторные работы по определению физических
показателей, качественных и количественных анализов воды.
· Прямые факторы, непосредственно воздействующие на воду (т. е. действие веществ, которые могут обогащать воду растворёнными соединениями или, наоборот, выделять их из воды); состав горных пород, живые организмы, хозяйственная деятельность человека;
· Косвенные факторы, определяющие условия, в которых протекает взаимодействие веществ с водой: климат, рельеф, гидрологический режим, растительность, гидрогеологические и гидродинамические условия.
Самой чистой природной водой считают дождевую, снеговую воду; но и она, падая на поверхность земли, увлекает с собой взвешенные в воздухе минеральные, органические и организованные примеси (микроорганизмы). Проходя через слои земли, загрязнённые различными отбросами, вода получает продукты распада этих органических веществ.
При отборе проб воды используют посуду из бесцветного стекла или полиэтилена марок, разрешенных для контакта с питьевой водой. Посуда должна быть тщательно вымыта моющими средствами, многократно ополоснута водопроводной и дистиллированной водой, а непосредственно перед забором воды посуду несколько раз ополаскивают исследуемой водой. Пробки желательно использовать стеклянные или полиэтиленовые; корковые или резиновые пробки обертывают полиэтиленовой пленкой.
На практике удобно пользоваться банкой или бутылью. В местах с затрудненным доступом к воде банку или бутыль можно прикрепить к шесту.
Отбор проб воды на проточных водоемах производится 1 км выше ближайшего по течению пункта водопользования (водозабор для питьевого водоснабжения, места купания, организованного отдыха, территория населенного пункта), а на непроточных водоемах и водохранилищах — в 1 км в обе стороны от пункта от пункта водопользования.
Обычно пробы в створе отбирают в трех точках (у обоих берегов и в фарватерах); при ограниченных же технических же возможностях или на небольших водоемах допускается отбор проб в одной — двух точках (в местах наиболее сильного течения). Чаще всего пробы отбирают в 5-10 м от берега га глубине 50 см. Объектом особого внимания должны стать загрязненные реки. Для получения достоверных результатов анализ следует проводить как можно быстрее. В воде происходят процессы окисления-восстановления, физико-химические, биохимические, вызванные деятельностью микроорганизмов, сорбции, десорбции, седиментации и т.д. Могут изменяться и органолептические свойства воды — запах, цвет и др. Некоторые вещества способны адсорбироваться на стенках сосудов (железо, алюминий, медь, кадмий, марганец и др.), а из стекла бутылей могут выщелачиваться микроэлементы
Запах воды обусловлен наличием в ней пахнущих веществ, которые попадают в нее естественным путем и со сточными водами. Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде или (для водоемов хозяйственно-питьевого назначения) после ее хлорирования. Определения основано на органолептическом исследовании характера и интенсивности запаха воды при 20 и 60 °С. По предлагаемой методике определяют характер и интенсивность запаха.
100 мл исследуемой воды при комнатной температуре наливают в колбу вместимостью 150-200 мл с широким горлом, накрывают часовым стеклом или притертой пробкой, встряхивают вращательным движением, открывают пробку или сдвигают часовое стекло и быстро определяют характер и интенсивность запаха. Затем колбу нагревают до 60 °С на водяной бане и также оценивают запах.
(от живущих в воде и отмерших организмов, от влияния почв и т.п.) находят по классификации, приведенной в таблице 2.
Характер и род запаха воды естественного происхождения
Мокрой щепы, древесной коры
Прелый, свежевспаханной земли, глинистый
Не подходящий под предыдущие определения
(от промышленных выбросов, для питьевой воды — от обработки воды реагентами на водопроводных сооружениях и т.п.) называются по соответствующим веществам: хлорфенольный, камфорный, бензиновый, хлорный и т.п. Интенсивность запаха также оценивается при 20 и 60 °С по 5-балльной системе согласно табл. 3.
Интенсивность запаха воды
Отсутствие ощутимого запаха
Запах, не поддающийся обнаружению потребителем, но обнаруживаемый в лаборатории опытным исследователем
Запах, не привлекающий внимания потребителя, но обнаруживаемый, если на него обратить внимание
Запах, легко обнаруживаемый и дающий повод относится к воде с неодобрением
Запах, обращающий на себя внимание и делающий воду непригодной для питья
Запах настолько сильный, что вода становится непригодной для питья
Запах воды следует определять в помещении, где воздух не имеет постороннего запаха. Желательно, чтобы характер и интенсивность запаха отмечали несколько исследователей .
Чистые природные воды почти бесцветны, наличие окраски поверхностных вод обычно связано с присутствием гуминовых веществ и соединений железа. При загрязнении сточными водами наблюдается окрашивание, не свойственное природным водам. Цвет вод, содержащих большое количество взвешенных веществ определяют после отстаивания или фильтрования.
1. Заполните пробирку водой до высоты 10-12 см.
2. Определите цветность воды, рассматривая пробирку на белом фоне при достаточном боковом освещении (дневном, искусственном).
Большинство известных элементов, входящих в состав вод в сравнительно больших количествах, существуют в виде ионов. Для доказательства наличия этих ионов в воде использовалась методика качественного химического полумикроанализа. Качественный анализ пробы воды проводился на наличие в воде: катионов магния, железа(II,III), кальция, свинца, меди; анионов брома, йода, хлора, сульфата.
Хлориды являются составной частью большинства природных вод. Обнаружение большого количества хлоридов является показателем загрязнения природных вод бытовыми и промышленными сточными водами.
Для определения хлоридов используется 10% раствор нитрата серебра. Необходимо взять 5 мл исследуемой воды и добавить 3 капли 10% раствора нитрата серебра. При наличии ионов хлора возникает опалесценция или выпадает белый осадок. Приближенную количественную оценку дают в соответствии с таблицей:
источник
муниципального общеобразовательного учреждения
«Никифоровская средняя общеобразовательная школа №1»
Вода – красота всей природы. Вода жива.
Она бежит или волнуется ветром,
она движется и даёт жизнь и движение всему живому.
С. А. Аксаков.
Актуальность проблемы_________________________________________ _ __3
Выбор и обоснование темы. _________________________________ _ __4
Объект исследования, предмет исследования.
Цель, задачи, гипотеза_____________________________________ _ ___4
Методы исследования, ход исследования____________ __ ___________4
Результаты исследования питьевых ресурсов с. Екатеринино________5
5.1. Определение содержания взвешенных частиц____________________5
5.2 Определение органолептических показателей воды_______________5
5.2.1 Определение запаха____________________________________5- 6
52.2 Определение цветности_____________________________________7
5.2.3.. Определение мутности____________________________________7
5.3. Обработка результатов исследования органолептических показателей воды и выводы___________________________________________________8
6. Определение качества воды методами химического анализа________8
6.1. Водородный показатель_____________________________________8
6 2. Определение нитратов и нитритов____________________________9
6. 3. Определение хлоридов_____________________________________9
6.4. Определение содержания соединений железа___________________10
6.5. Обработка результатов химического анализа воды и выводы_____10
8.Список используемой литературы_______________________________12
9. Приложение. _____________________________________________13-18
Актуальность темы обусловлена тем, что Вода – драгоценный дар природы. Вода это основа жизни , она входит в состав клеток любого животного и растения. Мы пьем ее, готовим пищу, принимаем душ, стираем в ней, плаваем и ловим рыбу, иногда ни замечая особой связи между ней и жизнью.
На сегодняшний день ситуация с питьевой водой может быть названа крайне тяжелой. Многие регионы планеты испытывают недостаток воды. Статистика показывает, из 10 жителей планеты 5 имеют доступ к водопроводу в своем доме; 4 не имеют приемлемого с санитарной точки зрения туалета; 3 получают воду из безопасных источников (регулярно инспектируемый колодец, артезианская скважина и пр.); 2 не имеют доступа к удобным и безопасным источникам.
Одной из основополагающих причин недостатка воды является ее повсеместный перерасход. Ежегодно человечество потребляет 3,5 тыс. куб. м. пресной воды. Без воды нельзя представить жизнь человека, ведь он ее употребляет для самых разных бытовых нужд. На две трети человек состоит из воды — до 80% в младенчестве и на 65% в старости, потому что процесс старение — это и есть потеря влаги нашими клетками. Недостаточное количество воды в организме человека приводит к нарушению вывода продуктов обмена пищеварения, кровь обедняется водой, человека лихорадит.
Наша страна обладает почти четвертью мировых запасов пресной воды. Их эффективное и бережное использование поможет обеспечить гарантированный доступ к качественной питьевой воде не только в России, но и за рубежом. Решение этой масштабной задачи прямо связано с повышением экологической безопасности производств, их модернизацией, совершенствованием природоохранного законодательства. Важнейшими приоритетами здесь должны стать защита воды от загрязнения, ее эффективное и экономичное использование в промышленности, сельском хозяйстве, в быту. От этого, без преувеличения, во многом зависит устойчивое развитие всех стран и континентов, и в целом, — будущее человечества.
Из всего выше сказанного можно сделать вывод, что запасы водных ресурсов наравне с качеством воды являются одними из наиболее важных проблем современности и от их решения зависит в конечном итоге будущее человечества.
И какая вода поступает в дома, волнует каждого жителя нашего села.
2. Выбор и обоснование темы.
Поэтому я выбрала эту тему т.к. вода самое удивительное, самое распространённое и самое важное вещество на планете Земля. Решила изучить состояние нашей воды в исследовательской работе «Питьевая вода села Екатеринино».
Работа состоит из теоретической и практической части. В теоретической я изучала, систематизировала и обобщала материал по интересующим меня вопросам, а в практической части проводила исследовательский эксперимент.
3. Объект исследования — служат питьевые воды находящийся на территории с. Екатеринино, Никифоровского района, Тамбовской области.
Предмет исследования – территория с.Екатеринино по ул. Зеленая и ул. Парковая
Цель: Дать оценку питьевой воде с. Екатеринино, а также показать большую значимость и важность воды в жизни человека
— Изучить литературу по теме исследования.
— Изучить физико — химические свойства воды.
— Определить наличие примесей составы воды.
— Изучить влияние загрязненной воды на организм человека
— Определить органолептические свойства воды.
Гипотеза: Питьевые воды села Екатеринино находятся в плачевном состоянии и представляют ли они опасность для человека.
Исследовательский, аналитический, органолептический, практический, экспериментальный
Изучить литературу о строении, химических и физических свойствах воды,.
Проанализировать причины уникальных свойств воды как растворителя.
Определить качество питьевой воды методами простейшего химического анализа.
Проанализировать результаты и сделать выводы.
Выявить органолептические свойства воды.
5. Результаты исследования питьевых ресурсов с. Екатеринино
Биоиндикация (биоиндикационный анализ качества вод)
5.1. Определение содержания взвешенных частиц
Этот показатель качества воды определяют фильтрованием определенного объема через бумажный фильтр и последующим высушиванием осадка на фильтре в сушильном шкафу до постоянной массы.
Для анализа берут 500-1000 мл воды. Фильтр перед работой взвешивают. После фильтрования осадок с фильтром высушивают до постоянной массы при 105˚С, охлаждают и взвешивают.
Содержание взвешенных веществ в в испытуемой воде ,где, m1— масса бумажного фильтра до опыта, г; m2 – масса бумажного фильтра с осадком взвешенных частиц, г;
масса бумажного фильтра до опыта
масса бумажного фильтра с осадком взвешенных частиц, наличие взвешенных частиц
0,501г, отсутствие взвешенных частиц
0,502г, присутствие взвешенных частиц
5.2 Определение органолептических показателей воды.
Запах воды обусловлен наличием в ней пахнущих веществ, которые попадают в неё естественным путем и со сточными водами. Запах воды, обнаруживаемый непосредственно в воде после её хлорирования , не должен превышать 2 баллов. Определение основано на органолептическом исследовании характера и интенсивности запахов воды при 20 и 60 0 С.
Определение характера и интенсивности запаха воды:
1. Заполните колбу водой на 1/3 объема и закройте пробкой.
2. Взболтайте содержимое колбы.
3. Откройте колбу и осторожно, неглубоко вдыхая воздух, сразу же определите характер и интенсивность запаха. Если запах сразу не ощущается или неотчетливый, испытание можно повторить, нагрев воду в колбе до температуры 60˚ С (подержав колбу в горячей воде).
Интенсивность запаха определятся по пятибалльной системе согласно таблице 1.
Определение интенсивности запаха. Таблица 1.
Характер проявления запаха
Оценка интенсивности запаха
Запах сразу не ощущается, но обнаруживается при тщательном исследовании (при нагревании воды)
Запах замечается, если обратить на это внимание
Запах легко замечается и вызывает, неодобрительны отзыв о воде
Запах обращает на себя внимание и заставляет воздержаться от питья
Запах на столько сильный, что делает воду непригодной для питья.
Определение характера запаха. Таблица 2.
неотчетливый (или отсутствует)
неотчетливый (или отсутствует)
Результаты исследования Таблица 3.
Результаты исследования образцов
Запах не ощущается, интенсивность- 0.
Запах легко замечается и вызывает неодобрительный отзыв о воде, запах искусственного происхождения, интенсивность–3.
5.2.2. Определение цветности
При загрязнении стоками промышленных предприятий вода может иметь окраску, не свойственную цветности природной воды. Для источников хозяйственно- питьевого водоснабжения окраска не должна обнаруживаться в столбике высотой 10-20 см.
Диагностика цвета – один из главных показателей воды. Для определения цветности необходимо выполнить следующее:
1. Заполните прибор водой до высоты 10-12 см.
2. Определите цветность воды, рассматривая пробирку сверху на белом фоне при достаточном боковом освещении.
3. Подчеркните наиболее подходящий оттенок из приведенных в табл.4.
Результаты исследования образцов
Прозрачный, без следов изменения цветности
Слабо — серый, с оттенками желтого
Прозрачность воды зависит от нескольких факторов: количества взвешенных частиц песка, микроорганизмов, содержания химических соединений.
Для определения прозрачности используют методику и оценивают уровень прозрачности образцов:
1. Заполните пробирку водой до высоты 10-12 см.
2.Определите мутность воды, рассматривая пробирку сверху на темном фоне при достаточном боковом освещении (дневном, искусственном).
источник
Исследовательская работа по проведению химического анализа проб воды. Методика простая и доступная, не требуются дефицитные реактивы.
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа № 108 »
Советского района г. Казани
Исследовательская работа по теме
«Химический анализ воды в речке Нокса»
Работу выполнил ученик 7 класса
Руководитель: учитель химии
Латфуллина Резеда Нурахметовна
Кузнецов Андрей 6 класс.doc
2.1. Пробоотбор и подготовка воды к анализу
2.5. определение присутствия масел и жиров
4. Список использованной литературы
Наша республика богата природными источниками и водными ресурсами. А мой родной город расположен на прекрасном и живописном берегу великой реки Волга, в которую впадает.
А в р. Казанку в свою очередь впадает речка Нокса, которая протекает совсем рядом с нашей школой.
Целью моей работы является изучение химического состава и свойств воды речки Нокса.
Исходя из этой цели я поставил перед собой следующие задачи :
1. На основании качественного и количественного анализа определить
физические показатели качества воды.
2. Расширить и углубить знания о качестве воды, оказывающей влияние на
Актуальность выбранной мною темы в том, что вода является источником всего живого на Земле. Этой исследовательской работой я хотел расширить свои знания о составе и свойствах воды, с которой мы имеем дело ежедневно.
— забор пробы из речки Нокса;
— практические и лабораторные работы по определению физических
показателей, качественных и количественных анализов воды.
· Прямые факторы, непосредственно воздействующие на воду (т. е. действие веществ, которые могут обогащать воду растворёнными соединениями или, наоборот, выделять их из воды); состав горных пород, живые организмы, хозяйственная деятельность человека;
· Косвенные факторы, определяющие условия, в которых протекает взаимодействие веществ с водой: климат, рельеф, гидрологический режим, растительность, гидрогеологические и гидродинамические условия.
Самой чистой природной водой считают дождевую, снеговую воду; но и она, падая на поверхность земли, увлекает с собой взвешенные в воздухе минеральные, органические и организованные примеси (микроорганизмы). Проходя через слои земли, загрязнённые различными отбросами, вода получает продукты распада этих органических веществ.
При отборе проб воды используют посуду из бесцветного стекла или полиэтилена марок, разрешенных для контакта с питьевой водой. Посуда должна быть тщательно вымыта моющими средствами, многократно ополоснута водопроводной и дистиллированной водой, а непосредственно перед забором воды посуду несколько раз ополаскивают исследуемой водой. Пробки желательно использовать стеклянные или полиэтиленовые; корковые или резиновые пробки обертывают полиэтиленовой пленкой.
На практике удобно пользоваться банкой или бутылью. В местах с затрудненным доступом к воде банку или бутыль можно прикрепить к шесту.
Отбор проб воды на проточных водоемах производится 1 км выше ближайшего по течению пункта водопользования (водозабор для питьевого водоснабжения, места купания, организованного отдыха, территория населенного пункта), а на непроточных водоемах и водохранилищах — в 1 км в обе стороны от пункта от пункта водопользования.
Обычно пробы в створе отбирают в трех точках (у обоих берегов и в фарватерах); при ограниченных же технических же возможностях или на небольших водоемах допускается отбор проб в одной — двух точках (в местах наиболее сильного течения). Чаще всего пробы отбирают в 5-10 м от берега га глубине 50 см. Объектом особого внимания должны стать загрязненные реки. Для получения достоверных результатов анализ следует проводить как можно быстрее. В воде происходят процессы окисления-восстановления, физико-химические, биохимические, вызванные деятельностью микроорганизмов, сорбции, десорбции, седиментации и т.д. Могут изменяться и органолептические свойства воды — запах, цвет и др. Некоторые вещества способны адсорбироваться на стенках сосудов (железо, алюминий, медь, кадмий, марганец и др.), а из стекла бутылей могут выщелачиваться микроэлементы
Запах воды обусловлен наличием в ней пахнущих веществ, которые попадают в нее естественным путем и со сточными водами. Запах воды водоемов не должен превышать 2 баллов, обнаруживаемых непосредственно в воде или (для водоемов хозяйственно-питьевого назначения) после ее хлорирования. Определения основано на органолептическом исследовании характера и интенсивности запаха воды при 20 и 60 °С. По предлагаемой методике определяют характер и интенсивность запаха.
100 мл исследуемой воды при комнатной температуре наливают в колбу вместимостью 150-200 мл с широким горлом, накрывают часовым стеклом или притертой пробкой, встряхивают вращательным движением, открывают пробку или сдвигают часовое стекло и быстро определяют характер и интенсивность запаха. Затем колбу нагревают до 60 °С на водяной бане и также оценивают запах.
(от живущих в воде и отмерших организмов, от влияния почв и т.п.) находят по классификации, приведенной в таблице 2.
Характер и род запаха воды естественного происхождения
Мокрой щепы, древесной коры
Прелый, свежевспаханной земли, глинистый
Не подходящий под предыдущие определения
(от промышленных выбросов, для питьевой воды — от обработки воды реагентами на водопроводных сооружениях и т.п.) называются по соответствующим веществам: хлорфенольный, камфорный, бензиновый, хлорный и т.п. Интенсивность запаха также оценивается при 20 и 60 °С по 5-балльной системе согласно табл. 3.
Интенсивность запаха воды
Отсутствие ощутимого запаха
Запах, не поддающийся обнаружению потребителем, но обнаруживаемый в лаборатории опытным исследователем
Запах, не привлекающий внимания потребителя, но обнаруживаемый, если на него обратить внимание
Запах, легко обнаруживаемый и дающий повод относится к воде с неодобрением
Запах, обращающий на себя внимание и делающий воду непригодной для питья
Запах настолько сильный, что вода становится непригодной для питья
Запах воды следует определять в помещении, где воздух не имеет постороннего запаха. Желательно, чтобы характер и интенсивность запаха отмечали несколько исследователей .
Чистые природные воды почти бесцветны, наличие окраски поверхностных вод обычно связано с присутствием гуминовых веществ и соединений железа. При загрязнении сточными водами наблюдается окрашивание, не свойственное природным водам. Цвет вод, содержащих большое количество взвешенных веществ определяют после отстаивания или фильтрования.
1. Заполните пробирку водой до высоты 10-12 см.
2. Определите цветность воды, рассматривая пробирку на белом фоне при достаточном боковом освещении (дневном, искусственном).
Большинство известных элементов, входящих в состав вод в сравнительно больших количествах, существуют в виде ионов. Для доказательства наличия этих ионов в воде использовалась методика качественного химического полумикроанализа. Качественный анализ пробы воды проводился на наличие в воде: катионов магния, железа(II,III), кальция, свинца, меди; анионов брома, йода, хлора, сульфата.
Хлориды являются составной частью большинства природных вод. Обнаружение большого количества хлоридов является показателем загрязнения природных вод бытовыми и промышленными сточными водами.
Для определения хлоридов используется 10% раствор нитрата серебра. Необходимо взять 5 мл исследуемой воды и добавить 3 капли 10% раствора нитрата серебра. При наличии ионов хлора возникает опалесценция или выпадает белый осадок. Приближенную количественную оценку дают в соответствии с таблицей:
источник
Согласовать время доставки оборудования на объект
ФИЛЬТРУЮЩИЕ СРЕДЫ И РЕАГЕНТЫ
ОБОРУДОВАНИЕ И РАСХОДНИКИ В ПРОДАЖЕ
Компрессор для систем напорной аэрации воды
КАРТА АНАЛИЗОВ ВОДЫ ПО ДМИТРОВСКОМУ РАЙОНУ
В книге описаны правила отбора и подготовки проб, процедуры выполнения анализов, приведена разнообразная полезная информация, даны библиографические ссылки на руководства и действующие нормативно-методические документы по анализу воды. Текст руководства содержит много иллюстраций, создающих наглядность и облегчающих выполнение анализа.Руководство рекомендуется специалистам-гидрохимикам, преподавателям, учителям школ, педагогам дополнительного образования, студентам вузов, учащимся профильных классов, а также всем интересующимся вопросами контроля качества воды
Общая характеристика и назначение.
Технические данные и методы анализа.
На что следует обратить внимание при работе с портативными комплектами (полезная информация) .
Общие сведения о применении портативных комплектов для химического анализа.
Рабочие условия при анализе.
О способах выражения концентраций веществ в растворах.
Особенности применяемых методов и выполняемых операций.
Органолептические методы.
Титриметрические методы.
Колориметрические методы.
О выполнении анализа с фотоколориметрированием проб.
Об анализе почвенных вытяжек.
Неопределенности и погрешности измерений.
Точность анализа и факторы, ее определяющие.
Система контроля и документирования результатов.
Меры безопасности при выполнении анализов .
Факторы опасности.
Общие правила безопасной работы.
Правила работы с едкими веществами и растворами.
Правила работы с растворителями.
Отбор проб и их консервация.
Общие правила отбора проб.
Отбор проб из водоисточников.
Консервация проб воды.
Отбор и подготовка проб почвы.
Общие правила отбора проб почвы.
Отбор объединенной пробы методом конверта.
Подготовка проб почвы к анализу.
Унифицированная методика приготовления почвенных вытяжек.
Показатели и процедуры анализа .
Алюминий.
Аммоний.
Биохимическое потребление кислорода (БПК).
Вкус и привкус.
Водородный показатель (рН).
Диоксид углерода.
Железо общее.
Жесткость общая, кальций и магний.
Запах.
Карбонаты, гидрокарбонаты, карбонатная жесткость и щелочность.
Кислород растворенный.
Кислотность.
Металлы, сумма.
Мутность и прозрачность.
Нефтепродукты.
Нитраты.
Нитриты.
Окисляемость перманганатная, метод Кубеля.
Пенистость.
Поверхностно-активные вещества, анионоактивные.
Свинец.
Сероводород и сульфиды.
Солесодержание общее, натрий и калий, сухой остаток (расчетные методы).
Сульфаты.
Фенолы.
Формальдегид.
Фосфаты и общий фосфор.
Фториды.
Хлор активный.
Хлориды.
Цветность.
Приложения.
Протокол исследования качества воды.
Набор-укладка для фотоколориметрирования «Экотест 2020-К».
Комплектные изделия, расходные материалы и принадлежности для химического анализа.
Список литературы.
Список нормативных документов .
Российские и международные стандарты.
Методики выполнения измерений на основе тест-комплектов
Методики количественного химического анализа ПНДФ, РД 52
источник
1. Аналитическая химия: Учебник / Под ред. Ищенко А.А.. — М.: Academia, 2017. — 512 c.
2. Аналитическая химия: Учебник / Под ред. Ищенко А.А.. — М.: Academia, 2017. — 512 c.
3. Аналитическая химия: Учебник / Под ред. Ищенко А.А.. — М.: Academia, 2015. — 192 c.
4. Аналитическая химия. Методы разделения веществ и гибридные методы анализа. Т.2 / Под ред. Москвина Л.. — М.: Academia, 2018. — 608 c.
5. Аналитическая химия и физико-химические методы анализа. Т.2: Учебник / Под ред. Ищенко А.А.. — М.: Academia, 2018. — 512 c.
6. Аналитическая химия и физико-химические методы анализа. Т.1: Учебник / Под ред. Ищенко А.А.. — М.: Academia, 2018. — 512 c.
7. Александрова, Э.А. Аналитическая химия в 2 кн. Кн. 2. Физико-химические методы анализа: Учебник и практикум / Э.А. Александрова, Н.Г. Гайдукова. — Люберцы: Юрайт, 2016. — 355 c.
8. Александрова, Э.А. Аналитическая химия. Теоретические основы и лабораторный практикум. В 2 кн. Кн. 2. Физико-химические методы анализа / Э.А. Александрова. — М.: КолосС, 2011. — 350 c.
9. Александрова, Э.А. Аналитическая химия в 2 кн. Кн. 1. Химические методы анализа: Учебник и практикум / Э.А. Александрова, Н.Г. Гайдукова. — Люберцы: Юрайт, 2016. — 551 c.
10. Александрова, Э.А. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа: Учебник и практикум / Э.А. Александрова, Н.Г. Гайдукова. — Люберцы: Юрайт, 2015. — 551 c.
11. Александрова, Э.А. Аналитическая химия в 2 книгах. Книга 2. Физико-химические методы анализа: Учебник и практикум / Э.А. Александрова, Н.Г. Гайдукова. — Люберцы: Юрайт, 2016. — 355 c.
12. Александрова, Э.А. Аналитическая химия. Теоретические основы и лабораторный практикум. В 2-х т. Т. 2. Физико-химические методы анализа / Э.А. Александрова. — М.: КолосС, 2011. — 352 c.
13. Александрова, Э.А. Аналитическая химия. Теоретические основы и лабораторный практикум. В 2-х кн. Кн. 1. Химические методы анализа / Э.А. Александрова. — М.: КолосС, 2011. — 549 c.
14. Алов, Н.В. Аналитическая химия и физико-химические методы анализа. В 2-х т.Аналитическая химия и физико-химические методы анализа: Учеб. для студ. учреждений высш. проф. образования / Н.В. Алов. — М.: ИЦ Академия, 2012. — 768 c.
15. Булатов, М.И. Аналитическая химия. Методы идентификации и определения веществ: Учебник / М.И. Булатов, А.А. Ганеев и др. — СПб.: Лань, 2019. — 584 c.
16. Валова, (Копылова) В.Д. Аналитическая химия и физико-химические методы анализа: Практикум / (Копылова) В.Д. Валова. — М.: Дашков и К, 2013. — 200 c.
17. Вершинин, В.И. Аналитическая химия: Учебник / В.И. Вершинин, И.В. Власова, И.А. Никифорова. — СПб.: Лань, 2017. — 428 c.
18. Вершинин, В.И. Аналитическая химия: Учебник / В.И. Вершинин, И.В. Власова, И.А. Никифорова. — СПб.: Лань, 2019. — 428 c.
19. Ганеев, А.А. Аналитическая химия. Методы разделения веществ и гибридные методы анализа: Учебник / А.А. Ганеев, И.Г. Зенкевич и др. — СПб.: Лань, 2019. — 336 c.
20. Глубоков, Ю.М. Аналитическая химия: Учебник для студентов учреждений среднего профессионального образования / Ю.М. Глубоков, В.А. Головачева, Ю.А. Ефимова; Под ред. А.А. Ищенко. — М.: ИЦ Академия, 2013. — 320 c.
21. Григорьянц, И.К. Аналитическая химия / И.К. Григорьянц, Л.А. Арбузова. — М.: МГИУ, 2007. — 68 c.
22. Егоров, В.В. Неорганическая и аналитическая химия. Аналитическая химия: Учебник / В.В. Егоров, Н.И. Воробьева. — СПб.: Лань, 2014. — 144 c.
23. Жебентяев, А.И. Аналитическая химия. Практикум: Учебное пособие / А.И. Жебентяев, А.К. Жерносек, И.Е. Талуть. — М.: Инфра-М, 2018. — 272 c.
24. Жебентяев, А.И. Аналитическая химия. Хроматографические методы анализа: Учебное пособие / А.И. Жебентяев.. — М.: НИЦ Инфра-М, Нов. знание, 2013. — 206 c.
25. Жебентяев, А.И. Аналитическая химия. Хроматографические методы анализа: Учебное пособие / А.И. Жебентяев. — М.: Инфра-М, 2013. — 206 c.
26. Жебентяев, А.И. Аналитическая химия. Химические методы анализа: Учебное пособие / А.И. Жебентяев, А.К. Жерносек, И.Е. Талуть. — М.: Инфра-М, 2011. — 542 c.
27. Жебентяев, А.И. Аналитическая химия. Хроматографические методы анализа: Учебное пособие / А.И. Жебентяев. — М.: Инфра-М, 2018. — 480 c.
28. Жебентяев, А.И. Аналитическая химия. Хим. методы.: Учебное пособие / А.И. Жебентяев, А.К. Жерносек, И.Е. Талуть. — М.: Инфра-М, 2018. — 272 c.
29. Зенкевич, И.Г. Аналитическая химия. В 3-х т. Т.3. Химический анализ: Учебник для студ. высших учебных заведений / И.Г. Зенкевич. — М.: ИЦ Академия, 2010. — 368 c.
30. Иванова, М.А. Аналитическая химия физико-химические методы анализа / М.А. Иванова. — М.: Риор, 2018. — 544 c.
31. Иванова, М.А. Аналитическая химия и физико-химические методы анализа: Учебное пособие / М.А. Иванова. — М.: ИЦ РИОР, 2013. — 289 c.
32. Ищенко, А.А. Аналитическая химия: Учебник / А.А. Ищенко. — М.: Academia, 2017. — 448 c.
33. Ищенко, А.А. Аналитическая химия и физико-химические методы анализа: В 2 т.Т. 1: Учебник / А.А. Ищенко. — М.: Академия, 2017. — 352 c.
34. Ищенко, А.А. Аналитическая химия и физико-химические методы анализа: В 2 т.Т. 2: Учебник / А.А. Ищенко. — М.: Академия, 2012. — 384 c.
35. Комиссарова, Л.Н. Неорганическая и аналитическая химия скандия / Л.Н. Комиссарова. — М.: УРСС, 2006. — 512 c.
36. Комиссарова, Л.Н. Неорганическая и аналитическая химия скандия, , стереотипное / Л.Н. Комиссарова. — М.: УРСС, 2006. — 512 c.
37. Кристиан, Г. Аналитическая химия. В 2-х т.Аналитическая химия / Г. Кристиан. — М.: Бином. ЛЗ, 2012. — 1128 c.
38. Кристиан, Г.Д. Аналитическая химия в 2-х томах т.1 и т.2 / Г.Д. Кристиан. — М.: Бином. Лаборатория знаний, 2011. — 1127 c.
39. Мовчан, Н.И. Аналитическая химия: Учебник / Н.И. Мовчан, Т.С. Горбунова, Р.Г. Романова. — М.: Инфра-М, 2016. — 112 c.
40. Москвин, Л.Н. Аналитическая химия: В 3 т.Т. 1: Учебник / Л.Н. Москвин. — М.: Академия, 2013. — 288 c.
41. Москвин, Л.Н. Аналитическая химия: В 3 т.Т. 2: Учебник / Л.Н. Москвин. — М.: Академия, 2017. — 336 c.
42. Петрухин, О.М. Аналитическая химия. Химические методы анализа: Учебное пособие / О.М. Петрухин. — М.: Альянс, 2016. — 400 c.
43. Саенко, О.Е. Аналитическая химия: учебник / О.Е. Саенко. — РнД: Феникс, 2018. — 284 c.
44. Саенко, О.Е. Аналитическая химия: Учебник / О.Е. Саенко. — Рн/Д: Феникс, 2015. — 96 c.
45. Саенко, О.Е. Аналитическая химия: Учебник для средних специальных учебных заведений / О.Е. Саенко. — Рн/Д: Феникс, 2013. — 287 c.
46. Харитонов, Ю.Я. Аналитическая химия (аналитика). Т.2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учебник для вузов / Ю.Я. Харитонов. — М.: Высшая школа, 2010. — 559 c.
47. Харитонов, Ю.Я. Аналитическая химия (аналитика). Т.1. Общие теоретические основы. Качественный анализ: Учебник для вузов / Ю.Я. Харитонов. — М.: Высшая школа, 2010. — 615 c.
48. Харитонов, Ю.Я. Аналитическая химия. Кн. 2. М.: Высшая школа, 2003. — 345 c.
49. Хаханина, Т.И. Аналитическая химия: Учебное пособие для бакалавров / Т.И. Хаханина, Н.Г. Никитина. — М.: Юрайт, ИД Юрайт, 2012. — 278 c.
источник
Учебно-исследовательский проект по теме «Исследование качества водопроводной воды в условиях школьной лаборатории»
Вода «из-под крана» используется нами повсеместно. По данным лаборатории питьевого водоснабжения НИИ экологии человека и окружающей среды РАМН, 90% водопроводных сетей подают в дома воду, не отвечающую санитарным нормам. Главная причина наличия в водопроводной воде вредных для здоровья нитратов, пестицидов, нефтепродуктов и солей тяжелых металлов — это катастрофическое состояние водопроводных и канализационных систем. Соединение канализационных вод с выбросами предприятий дает добавочный эффект: к перечисленным выше химическим составляющим питьевой воды добавляются и бактерии — кишечные палочки, патогенные микроорганизмы, холерный вибрион и т.д. Поэтому актуальность данной проблемы очень высока.
Объект исследования
Объектом исследования является обычная водопроводная вода, взятая из централизованного источника водоснабжения МОУ лицей №22, которая не подвергалась никакой предварительной обработке и фильтрации, чтобы была возможность составить объективную картину состояния воды, используемой в быту.
Если вода почти прозрачна, не имеет достаточно выраженных вкуса и запаха, а также если содержание хлора, водородный показатель и жесткость воды удовлетворяют ПДК, то вода централизованного источника водоснабжения пригодна к применению.
Цель исследования
В соответствие с гипотезой, целью исследования является проверить, удовлетворяет ли водопроводная вода некоторым требованиям ГОСТа.
Обзор литературы
Был проведен обзор литературы по изучению влияния качества питьевой воды на здоровье, нормативов качества питьевой воды и образования мутагенов в результате хлорирования воды.
Методика «СОСТАВ И КАЧЕСТВО ВОДЫ»
Суточный обмен воды в организме человека составляет 2,5 л, поэтому от её качества сильно зависит состояние человека, его здоровье и работоспособность. Различные вещества, присутствующие в воде, придают ей запах, делают её то сладковатой, то солёной, а то и горькой. Существует 5-балльная шкала оценки интенсивности запаха и привкуса питьевой воды. При сомнении в качестве питьевой воды для очистки её от примесей следует использовать специальные фильтры.
Метод физического изучения воды включает:
- Исследование прозрачности воды
- Определение в воде взвешенных частиц
- Запах
- Вкус.
Данные показатели определяются по специальным методикам, описанным в различных источниках литературы (например, С.В.Дружинин «Исследование воды и водоемов в условиях школы», 2008).
Метод химического анализа включает определение:
- Ионов в воде с помощью качественных реакций
- рН, водородного показателя
- Жесткости воды титриметрическим методом.
Определение ионов
Большинство известных элементов, входящих в состав вод в сравнительно больших количествах, существуют в виде ионов. Для доказательства наличия этих ионов в воде использовалась методика качественного химического полумикроанализа. Качественный анализ пробы воды проводился на наличие в воде: катионов магния, железа(II,III), кальция, свинца, меди; анионов брома, йода, хлора, сульфата.
Жесткость воды.
Жесткость воды обуславливается присутствием в ней солей кальция и магния. Это общая жесткость. Она складывается из карбонатной (временной, обусловленной присутствием гидрокарбонатов кальция и магния) и некарбонатной (постоянной, обусловленной присутствием хлоридов кальция, Mg 2+ и Fe 2+ ). Оставшиеся в растворе после кипячения соли обуславливают постоянную жесткость воды. Общая жесткость воды определяется следующим образом. В коническую колбу на 250 мл вносят 100 мл исследуемой воды, прибавляют 5 мл аммиачного буферного раствора(NH4OH+NH4Cl) для установления щелочной реакции, а затем 7-8 капель индикатора (эриохрома черного). Проба окрашивается в интенсивный вишнево-красный цвет. Раствор перемешивают и медленно титруют 0,05 нормальным раствором трилона «Б» до изменения окраски пробы от вишневой до синей. Это происходит из-за того, что трилон «Б» в щелочной среде взаимодействует с ионами кальция и магния, образуя комплексное неокрашенное соединение и вытесняя индикатор в свободном виде. Расчет общей жесткости производят по формуле:
где: V — объем раствора трилона «Б», израсходованного на титрование, мл.
N — нормальность раствора трилона «Б», мг экв/л (0.05)
V1— объем исследуемого раствора, взятого для титрования, мл.(100 мл)
Водородный показатель.
Вода тестируется различными индикаторами (лакмус, универсальная индикаторная бумага, метил оранжевый) и по изменению их окраски формулируются соответствующие выводы.
Результаты см. в таблице №1.
Сравнительный анализ данных, полученных в ходе исследования.
Он приведен в таблице «Соответствие физико-химических показателей пробы воды требованиям ГОСТ».
| Параметр | Единица измерения | Полученное значение | Предельно допустимая норма по ГОСТу 2874-82 |
| Прозрачность воды | 5-балльная шкала | 1 | 1.5 |
| Присутствие взвешенных частиц | 1 | 2 | |
| Вкус воды | 1 | 2 | |
| Запах воды при t=20 o C Запах воды при t=60 o C | 1 |
2
6.5
В ходе проведенного исследования было установлено:
- Показатель мутности оптимален
- Каких-либо взвешенных частиц в воде не обнаружено
- Проба воды не обладала привкусом и запахом
- Качественный анализ пробы воды дал отрицательный результат на наличие в воде: катионов магния, железа(II,III), свинца, меди; анионов, брома, йода; сульфатов
- Были обнаружены катионы кальция (незначительное выпадение гипсового осадка) и анионы хлора (незначительное выпадение белого творожистого осадка хлорида серебра)
- Причиной слабо кислой среды, вероятнее всего, является, установленное выше, наличие в воде ионов хлора
- Жесткость воды была получена в пределах 4-4.5 ммоль/литр.
Таким образом, можно сделать вывод о том, что проба воды, взятая из централизованного источника водоснабжения МОУ лицей №22, соответствует требованиям ГОСТ согласно тем критериям, по которым проводилось исследование, а, значит, наша гипотеза подтвердилась.
Рекомендации.
- продолжать мониторинговые исследования качества питьевой воды из разных источников;
- провести сравнительный анализ полученных результатов;
- исследовать пробы воды по методикам количественного анализа;
- продолжать исследование в условиях лабораторий, обеспеченных соответствующим оборудованием и реактивами.
источник
1. Значение химической промышленности
2. Роль аналитического контроля
3. Функции и задачи лаборатории
1. Характеристика анализируемой продукции
2. Требования, предъявляемые к природной воде
4. Устройство, универсальный иономер ЭВ-74
1. ТБ с кислотами и щелочами
2. ТБ при работе в лаборатории
3. Пожаро- и электробезопасность
IV. Охрана окружающей среды
1. Значение химической промышленности
Химическая промышленность – комплексная отрасль, определяющая, наряду с машиностроением, уровень НТП, обеспечивающая все отрасли народного хозяйства химическими технологиями и материалами, в том числе новыми, прогрессивными и производящая товары массового народного потребления.
Химическая промышленность представляет собой одну из ведущих отраслей тяжелой индустрии, является научно-технической и материальной базой химизации народного хозяйства и играет исключительно важную роль в развитии производительных сил, укреплению обороноспособности государства и в обеспечении жизненных потребностей общества. Она объединяет целый комплекс отраслей производства, в которых преобладают химические методы переработки предметов овеществленного труда (сырья, материалов), позволяет решить технические, технологические и экономические проблемы, создавать новые материалы с заранее заданными свойствами, заменять металл в строительстве, машиностроении, повышать производительность и экономить затраты общественного труда. Химическая промышленность включает производство нескольких тысяч различных видов продукции, по количеству которых уступает только машиностроению.
Значение химической промышленности выражается в прогрессивной химизации всего народнохозяйственного комплекса: расширяется производство ценных промышленных продуктов; происходит замена дорогого и дефицитного сырья более дешевым и распространенным; производится комплексное использование сырья; улавливаются и утилизируются многие производственные отходы, в том числе вредные в экологическом отношении. На базе комплексного использования разнообразного сырья и утилизации производственных отходов химическая индустрия образует сложную систему связей со многими отраслями промышленности и комбинируется с переработкой нефти, газа, угля, с черной и цветной металлургией, лесной промышленностью. Из таких сочетаний складываются целые промышленные комплексы.
В основе производственного процесса в химической промышленности чаще всего лежит преобразование молекулярной структуры вещества. Продукцию этой отрасли народного хозяйства можно подразделить на предметы производственного назначения и предметы длительного или кратковременного личного пользования.
Потребители продукции химической промышленности находятся во всех сферах народного хозяйства. Машиностроение нуждается в пластических массах, лаках, красках; сельское хозяйство – в минеральных удобрениях, препаратах для борьбы с вредителями растений, в кормовых добавках (животноводство); транспорт – в моторном топливе, смазочных материалах, синтетическом каучуке. Химическая и нефтехимическая промышленность становится источником сырья для производства товаров широкого потребления, особенно химических волокон и пластмасс.
2. Роль аналитического контроля
Аналитическая химия – наука о методах и средствах определения химического состава веществ и их смесей. Задачи аналитической химии: обнаружение, идентификация и определение составных частей (атомов, ионов, радикалов, молекул, функциональных групп) анализируемого объекта. Соответствующий раздел аналитической химии – качественный анализ;
Определение последовательности соединения и взаимного расположения составных частей в анализируемом объекте. Соответствующий раздел аналитической химии – структурный анализ;
Определение изменения природы и концентрации составных частей объекта во времени. Это важно для установления характера, механизма и скорости превращений, в частности, для контроля технологических процессов в производстве.
Во многих методах аналитической химии используются последние достижения естественных, технических наук. Поэтому вполне закономерно рассматривать аналитическую химию как междисциплинарную науку.
Методы аналитической химии широко реализуется в самых разнообразных производствах. Например, в нефтехимии, металлургии, при получении кислот, щелочей, соды, удобрений, органических продуктов и красителей, пластических масс, искусственных и синтетических волокон, строительных материалов, взрывчатых веществ, поверхностно-активных веществ, лекарственных препаратов, парфюмерии.
В нефтехимии и металлургии требуется аналитический контроль исходного сырья, промежуточных и конечных продуктов производства.
Получение особо чистых веществ, в частности полупроводниковых материалов, невозможно без определения примесей на уровне до 10-9 %.
Химический анализ необходим при поиске полезных ископаемых. Многие выводы геохимии базируется на результатах химического анализа.
Огромное значение имеет химический анализ для наук биологического цикла. Например, выяснение природы белка – задача, в сущности, аналитическая, поскольку требуется выяснить, какие аминокислоты входят в состав белка и в какой последовательности они связаны. В медицине методы аналитической химии широко применяют при проведении разнообразных биохимических анализов.
Даже гуманитарные науки используют методы аналитической химии. На первом месте среди них стоит археология. Результаты химического анализа предметов древности служат источником важной информации, позволяющим делать выводы о происхождении предметов и их возрасте. Развитие криминалистики также немыслимо без современных методов аналитической химии. Как и в археологии, в ней чрезвычайно важны методы, не разрушающие исследуемый образец: локальный анализ, идентификация веществ.
3. Функции и задачи лаборатории
Основными задачами лаборатории является выполнение опытно-исследовательских работ, обеспечивающих внедрение и освоение новой техники и технологии при использовании современных достижений, направленных на интенсификацию действующих цехов, улучшению их экономических показателей, повышения качества выпускаемой продукции, охраны окружающей среды.
Во исполнении указанных задач лаборатория проводит работы по:
— Осуществление с требуемой точностью и достоверностью количественного химического и микробиологического анализов проб питьевой воды, сточных вод и промышленных стоков с целью установления соответствия их качества требованиям нормативных документов;
— Выполнение в полном объёме «Рабочей программы производственного контроля качества питьевой воды», контроль эффективности очистки питьевой воды, а также «Графика производственного контроля качества сточных вод и промышленных стоков».
— Подготовка исходных данных для разработки нормативно-технической документации для предприятий и принятия решений по улучшению качества воды согласно санитарно-эпидемиологического надзора и сбросов.
— Подбор, освоение и внедрение новых методик для анализа состояния качества питьевой, сточной воды.
— Усовершенствованию технологических процессов и полному освоению производственных мощностей.
— Улучшению методов утилизации промышленных отходов.
1. Характеристика анализируемой продукции
Вода (Н2 О) – жидкость без запаха, вкуса, цвета; самое распространенное природное соединение.
По физико-химическим свойствам В. отличается аномальным характером констант, которые определяют многие физические и биологические процессы на Земле. Плотность воды возрастает в интервале 100–4°, при дальнейшем охлаждении уменьшается, а при замерзании скачкообразно падает. Поэтому в реках и озерах лед как более легкий располагается на поверхности, создавая необходимые условия для сохранения жизни в водных экологических системах. Морская вода превращается в лед, не достигая наибольшей плотности, поэтому в морях происходит более интенсивное вертикальное перемешивание воды.
В качестве первых санитарно – гигиенических характеристик пресной воды использовались органолептические показатели, которые были основаны на интенсивности восприятия органами чувств физических свойств воды. В настоящее время в эту группу в качестве нормативных характеристик входят:
· Запах при 20о С и подогреве до 60о С,
· балл Цветность по шкале, градус
· Мутность по стандартной шкале, мг/дм3
· Окраска окрашенного столбца (отсутствие водных организмов и пленки)
В артезианских водах содержатся взвешенные твердые примеси. Они состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Взвешенные частицы влияют на прозрачность воды. Содержание в воде взвешенных примесей, измеряемое в мг/л, дает представление о загрязненности воды частицами в основном условным диаметром более 1·10-4 мм. При содержании в воде взвешенных веществ менее 2–3 мг/л или
больше указанных значений, но условный диаметр частиц меньше 1 · 10-4 мм, определение загрязненности воды производят косвенно по мутности воды.
2. Требования предъявляемые к природной воде
Основными требованиями, предъявляемыми к питьевой воде, являются безопасность в эпидемическом отношении, безвредность по токсикологическим показателям, хорошие органолептические показатели и пригодность для хозяйственных нужд. Оптимальная температура воды для питьевых целей находится в пределах 7-11 °С. Наиболее близки к этим условиям воды подземных источников, которые отличаются постоянством температуры. Их в первую очередь рекомендуется использовать для хозяйственно-питьевого водоснабжения.
Органолептические показатели (мутность, прозрачность, цветность, запахи и привкусы) воды, потребляемой для хозяйственно-питьевых целей, определяются веществами, встречающимися в природных водах, добавляемыми в процессе обработки воды в виде реагентов и появляющимися в результате бытового, промышленного и сельскохозяйственного загрязнения водоисточников. К химическим веществам, влияющим на органолептические показатели воды, кроме нерастворимых примесей и гуминовых веществ относятся встречающиеся в природных водах или добавляемые в них при обработке хлориды, сульфаты, железо, марганец, медь, цинк, алюминий, гекса- мета- и триполифосфат, соли кальция и магния.
Водородный показатель рН большинства природных вод близок к 7. Постоянство рН воды имеет большое значение для нормального протекания в ней биологических и физико-химических процессов, приводящих к самоочищению. Для воды хозяйственно-питьевого назначения он должен находиться в пределах 6,5-8,5.
Количество сухого остатка характеризует степень минерализации природных вод; оно не должно превышать 1000 мг/л и лишь в отдельных случаях допускается 1500 мг/л.
Общая норма жесткости — 7 мг * экв/л.
В подземных водах, не подвергаемых обезжелезиванию, может быть допущено содержание железа 1 мг/л.
Азотсодержащие вещества (аммиак, нитриты и нитраты) образуются в воде в результате протекания химических процессов и гниения растительных остатков, а также за счет разложения белковых соединений, попадающих почти всегда со сточными бытовыми водами, конечным продуктом распада белковых веществ является аммиак. Присутствие в воде аммиака растительного или минерального происхождения не опасно в санитарном отношении. Воды, причиной образования аммиака в которых является разложение белковых веществ, непригодны для питья. Пригодной для питьевых целей считается вода, содержащая лишь следы аммиака и нитритов, а по стандарту допускается содержание не более 10 мг/л нитратов.
Сероводород может содержаться в природных водах в небольших количествах. Он придает воде неприятный запах, вызывает развитие серобактерий и интенсифицирует процесс коррозии металлов.
Токсические вещества (бериллий, молибден, мышьяк, селен, стронций и др.), а также радиоактивные вещества (уран, радий и стронцнй-90) попадают в воду с промышленными стоками и в результате длительного соприкосновения воды с пластами почвы, содержащими соответствующие минеральные соли. При наличии в воде нескольких токсических или радиоактивных веществ сумма концентраций или излучений, выраженная в долях концентраций, допустимых для каждого из них в отдельности, не должна превышать единицу.
Методика. Определение общей жесткости.
Метод основан на образовании прочного комплексного соединения трилона Б с ионами кальция и магния.
Определение проводят титрованием пробы трилоном Б при рН 10 в присутствии индикатора.
1.1. Пробы воды отбирают по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения общей жесткости должен быть не менее 250 см3.
1.3. Если определение жесткости не может быть проведено в день отбора пробы, то отмеренный объем воды, разбавленный дистиллированной водой 1:1, допускается оставлять для определения до следующего дня.
Пробы воды, предназначенные для определения общей жесткости, не консервируют.
2. АППАРАТУРА, МАТЕРИАЛЫ И РЕАКТИВЫ.
Посуда мерная лабораторная стеклянная по ГОСТ 1770 вместимостью: пипетки 10, 25, 50 и 100 см3 без делений; бюретка 25 см3.
Колбы конические по ГОСТ 25336 вместимостью 250-300 см3.
Трилон Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652.
Аммоний хлористый по ГОСТ 3773.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Гидроксиламин солянокислый по ГОСТ 5456.
Кислота лимонная по ГОСТ 3118.
Натрий сернистый (сульфид натрия) по ГОСТ 2053.
Натрий хлористый по ГОСТ 4233.
Спирт этиловый ректификованный по ГОСТ 5962.
Цинк металлический гранулированный.
Магний сернокислый — фиксанал.
Хромоген черный специальный ЕТ-00 (индикатор).
Хром темно-синий кислотный (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.)
3.1. Дистиллированная вода, перегнанная дважды в стеклянном приборе, используется для разбавления проб воды.
3.2. Приготовление 0,05 н. раствора трилона Б.
9,31 г трилона Б растворяют в дистиллированной и доводят до 1 дм3. Если раствор мутный, то его фильтруют. Раствор устойчив в течение нескольких месяцев.
3.3. Приготовление буферного раствора.
10 г хлористого аммония (NH4 Cl) растворяют в дистиллированной воде, добавляют 50 см3 25 %-ного раствора аммиака и доводят до 500 см3 дистиллированной водой. Во избежание потери аммиака раствор следует хранить в плотно закрытой склянке.
3.4. Приготовление индикаторов.
0,5 г индикатора растворяют в 20 см3 буферного раствора и доводят до 100 см3 этиловым спиртом. Раствор индикатора хрома темно-синего может сохраняться длительное время без изменения. Раствор индикатора хромогена черного устойчив в течение 10 сут. Допускается пользоваться сухим индикатором. Для этого 0,25 г индикатора смешивают с 50 г сухого хлористого натрия, предварительно тщательно растертого в ступке.
3.5. Приготовление раствора сернистого натрия.
5 г сернистого натрия Na2 S × 9H2 O или 3,7 г Na2 S × 5H2 O растворяют в 100 см3 дистиллированной воды. Раствор хранят в склянке с резиновой пробкой.
3.6. Приготовление раствора солянокислого гидроксиламина.
1 г солянокислого гидроксиламина NH2 OH × HCl растворяют в дистиллированной воде и доводят до 100 см3 .
3.7. Приготовление 0,1 н. раствора хлористого цинка.
Точную навеску гранулированного цинка 3,269 г растворяют в 30 см3 соляной кислоты, разбавленной 1:1. Затем доводят объем в мерной колбе дистиллированной водой до 1 дм3. Получают точный 0,1 н. раствор. Разведением этого раствора вдвое получают 0,05 н. раствор. Если навеска неточная (больше или меньше чем 3,269), то рассчитывают количество кубических сантиметров исходного раствора цинка для приготовления точного 0,05 н. раствора, который должен содержать 1,6345 г цинка в 1 дм3 .
3.8. Приготовление 0,05 н. раствора сернокислого магния.
Раствор готовят из фиксанала, прилагаемого к набору реактивов для определения жесткости воды и рассчитанного на приготовление 1 дм3 0,01 н раствора. Для получения 0,05 н. раствора содержимое ампулы растворяют в дистиллированной воде и доводят объем раствора в мерной колбе до 200 см3 .
3.9. Установка поправочного коэффициента к нормальности раствора трилона Б.
В коническую колбу вносят 10 см3 0,05 н. раствора хлористого цинка или 10 см3 0,05 н. раствора сернокислого магния и разбавляют дистиллированной водой до 100 см3. Прибавляют 5 см3 буферного раствора, 5-7 капель индикатора и титруют при сильном взбалтывании раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с фиолетовым оттенком при прибавлении индикатора хрома темно-синего и синей с зеленоватым оттенком при прибавлении индикатора хромогена черного.
Титрование следует проводить на фоне контрольной пробы, которой может быть слегка перетитрованная проба.
Поправочный коэффициент (К) к нормальности раствора трилона Б вычисляют по формуле:
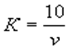
где v — количество раствора трилона Б, израсходованное на титрование, см3 .
4.1. Определению общей жесткости воды мешают: медь, цинк, марганец и высокое содержание углекислых и двууглекислых солей. Влияние мешающих веществ устраняется в ходе анализа.
Погрешность при титровании 100 см3 пробы составляет 0,05 моль/м3.
В коническую колбу вносят 100 см3 отфильтрованной испытуемой воды или меньший объем, разбавленный до 100 см3 дистиллированной водой. При этом суммарное количество вещества эквивалента ионов кальция и магния во взятом объеме не должно превышать 0,5 моль. Затем прибавляют 5 см3 буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромогена черного с сухим натрием и сразу же титруют при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленоватым оттенком).
Если на титрование было израсходовано больше 10 см3 0,05 н. раствора трилона Б, то это указывает что в отмеренном объеме воды суммарное количество вещества эквивалента ионов кальция и магния больше 0,5 моль. В таких случаях следует определение повторить, взяв меньший объем воды и разбавив его до 100 см3 дистиллированной водой.
Нечеткое изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения влияния мешающих веществ к отмеренной для титрования пробе воды прибавляют 1-2 см3 раствора сульфида натрия, после чего проводят испытание, как указано выше.
Если после прибавления к отмеренному объему воды буферного раствора и индикатора титруемый раствор постепенно обесцвечивается, приобретая серый цвет, что указывает на присутствие марганца, то в этом случае к пробе воды, отобранной для титрования, до внесения реактивов следует прибавить пять капель 1 %-ного раствора солянокислого гидроксиламина и далее определить жесткость, как указано выше.
Если титрование приобретает крайне затяжной характер с неустойчивой и нечеткой окраской в эквивалентной точке, что наблюдается при высокой щелочности воды, ее влияние устраняется прибавлением к пробе воды, отобранной для титрования, до внесения реактивов 0,1 н. раствора соляной кислоты в количестве, необходимом для нейтрализации щелочности воды, с последующим кипячением или продуванием раствора воздухом в течение 5 мин. После этого прибавляют буферный раствор, индикатор и далее определяют жесткость, как указано выше.
5.1. Общую жесткость воды (Х), моль/м3, вычисляют по формуле:
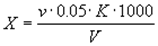
где v — количество раствора трилона Б, израсходованное на титрование, см3 ;
К — поправочный коэффициент к нормальности раствора трилона Б;
V — объем воды, взятый для определения, см3 .
Расхождение между повторными определениями не должно превышать 2 отн. %.
Методика. Определение содержания сухого остатка.
Величина сухого остатка характеризует общее содержание растворенных в воде нелетучих минеральных и частично органических соединений.
1.1. Пробы отбирают по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения сухого остатка должен быть не менее 300 см3.
2. АППАРАТУРА, РЕАКТИВЫ И РАСТВОРЫ.
Шкаф сушильный с терморегулятором.
Посуда мерная лабораторная стеклянная по ГОСТ 1770, вместимостью: колбы мерные 250 и 500 см2; пипетки без деления 25 см3, чашка фарфоровая выпарительная 500-100 см3.
Натрий углекислый безводный по ГОСТ 83.
Вода дистиллированная по ГОСТ 6709.
Натрий углекислый Na 2 CO 3, х.ч., точный раствор, готовят следующим образом: 10 г безводной соды (высушенной при 200 ° С и отвешенной на аналитических весах) растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3. 1 см3 раствора содержит 10 мг соды.
3.1 Определение сухого остатка без добавления соды (проводится в день отбора пробы).
250-500 см3 профильтрованной воды выпаривают в предварительно высушенной до постоянной массы фарфоровой чашке. Выпаривание ведут на водяной бане с дистиллированной водой. Затем чашку с сухим остатком помещают в термостат при 110 ° С и сушат до постоянной массы.
3.1.1. Обработка результатов.
Сухой остаток (Х), мг/дм3, вычисляют по формуле:
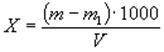
где m — масса чашки с сухим остатком, мг;
m 1 — масса пустой чашки, мг;
V — объем воды, взятый для определения, см3.
Данный метод определения сухого остатка дает несколько завышенные результаты вследствие гидролиза и гигроскопичности хлоридов магния и кальция и трудной отдачи кристаллизационной воды сульфатами кальция и магния. Эти недостатки устраняются прибавлением к выпариваемой воде химически чистого карбоната натрия. При этом хлориды, сульфаты кальция и магния переходят в безводные карбонаты, а из натриевых солей лишь сульфат натрия обладает кристаллизационной водой, но она полностью удаляется высушиванием сухого остатка при 150-180 ° С.
3.2. Определение сухого остатка с добавлением соды.
250-500 см3 профильтрованной воды выпаривают в фарфоровой чашке, высушенной до постоянной массы при 150 ° С. После того как в чашку прилита последняя порция воды, вносят пипеткой 25 см3 точного 1 %-ного раствора углекислого натрия с таким расчетом, чтобы масса прибавленной соды примерно в два раза превышала массу предполагаемого сухого остатка. Для обычных пресных вод достаточно добавить 250 мг безводной соли (25 см3 1 %-ного раствора Na 2 CO 3 ). Раствор хорошо перемешивают стеклянной палочкой. Палочку обмывают дистиллированной водой, собирая воду в чашку с осадком. Выпаренный с содой сухой остаток высушивают до постоянной массы при 150 ° С. Чашку с сухим остатком помещают в холодный термостат и затем поднимают температуру до 150 ° С. Разность в массе между чашкой с сухим остатком и первоначальной массой чашки и соды (1 см3 раствора соды содержит 10 мг Na 2 CO 3 ) дает значение сухого остатка во взятом объеме воды.
3.2.1. Обработка результатов.
Сухой остаток (Х), мг/дм3, вычисляют по формуле:
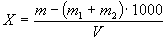
где m — масса чашки с сухим остатком, мг;
m 1 — масса пустой чашки, мг;
m 2 — масса добавленной соды, мг;
V — объем воды, взятый для определения, см3.
Расхождения между результатами повторных определений не должны превышать 10 мг/дм3, если сухой остаток не превышает 500 мг/дм3, при более высоких концентрациях расхождение не должно превышать 2 отн. оо/о.
Методика. Определение содержания хлоридов.
1.2. Объем пробы воды для определения содержания хлоридов должен быть не менее 250 см3.
1.3. Пробы воды, предназначенные для определения хлоридов, не консервируют.
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм3.
Посуда мерная стеклянная лабораторная по ГОСТ 1770, ГОСТ 29227, ГОСТ 29251, вместимостью: пипетки 100, 50 и 10 см3 без делений; пипетка 1 см3 с делением через 0,01 см3; цилиндр мерный 100 см3; бюретка 25 см3 со стеклянным краном.
Колбы конические по ГОСТ 25336, вместимостью 250 см3.
Пробирки колориметрические с отметкой на 5 см3.
Воронки стеклянные по ГОСТ 25336.
Фильтры без зольные «белая лента».
Серебро азотнокислое по ГОСТ 1277.
Натрий хлористый по ГОСТ 4233.
Квасцы алюмокалиевые (алюминий-калий сернокислый) по ГОСТ 4329.
Калий хромовокислый по ГОСТ 4459.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
2.3.1. Приготовление титрованного раствора азотнокислого серебра.
2,40 г химически чистого AgNO3 растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3.
1 см3 раствора эквивалентен 0,5 мг Сl-.
Раствор хранят в склянке из темного стекла.
2.3.2. Приготовление 10%-ного раствора (подкисленного азотной кислотой) азотнокислого серебра
10 г AgNO3 растворяют в 90 см3 дистиллированной воды и добавляют 1-2 капли HNO3.
2.3.3. Приготовление титрованного раствора хлористого натрия
0,8245 г химически чистого NaCl, высушенного при 105 °С, растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 дм3.
1 см3 раствора содержит 0,5 мг Сl-.
2.3.4. Приготовление гидроокиси алюминия
125 г алюмокалиевых квасцов [AlK(SO4)2×12H2O] растворяют в 1 дм3 дистиллированной воды, нагревают до 60 °С и постепенно прибавляют 55 см3 концентрированного раствора аммиака при постоянном перемешивании. После отстаивания в течение 1 ч осадок переносят в большой стакан и промывают декантацией дистиллированной водой до исчезновения реакции на хлориды.
2.3.5. Приготовление 5 %-ного раствора хромовокислого калия
50 г К2СrО4 растворяют в небольшом объеме дистиллированной воды и доводят объем раствора дистиллированной водой до 1 дм3.
2.3.6. Установка поправочного коэффициента к раствору азотнокислого серебра.
В коническую колбу вносят пипеткой 10 см3 раствора хлористого натрия и 90 см3 дистиллированной воды, добавляют 1 см3 раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода лимонно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15-20 с. Полученный результат считают ориентировочным. К оттитрованной пробе прибавляют 1-2 капли раствора хлористого натрия до получения желтой окраски. Эта проба является контрольной при повторном, более точном определении. Для этого отбирают новую порцию раствора хлористого натрия и титруют азотнокислым серебром до получения незначительной разницы оттенков слабо-оранжевого в титруемом растворе и желтого в контрольной пробе. Поправочный коэффициент (К) вычисляют по формуле

где v — количество азотнокислого серебра, израсходованное на титрование, см3 .
2.4.1. Качественное определение
В колориметрическую пробирку наливают 5 см3 воды и добавляют три капли 10 %-ного раствора азотнокислого серебра. Примерное содержание хлор-иона определяют по осадку или мути в соответствии с требованиями таблицы.
| Характеристика осадка или мути | Содержание Сl-, мг/дм2 |
| 1. Опалесценция или слабая муть | 1-10 |
| 2. Сильная муть | 10-50 |
| 3. Образуются хлопья, осаждаются не сразу | 50-100 |
| 4. Белый объемный осадок | Более 100 |
2.4.2. Количественное определение
В зависимости от результатов качественного определения отбирают 100 см3 испытуемой воды или меньший ее объем (10-50 см3 ) и доводят до 100 см3 дистиллированной водой. Без разбавления определяются хлориды в концентрации до 100 мг/дм3. pН титруемой пробы должен быть в пределах 6-10. Если вода мутная, ее фильтруют через без зольный фильтр, промытый горячей водой. Если вода имеет цветность выше 30°, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200 см3 пробы добавляют 6 см3 суспензии гидроокиси алюминия, а смесь встряхивают до обесцвечивания жидкости. Затем пробу фильтруют через без зольный фильтр. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносят в две конические колбы и прибавляют по 1 см3 раствора хромовокислого калия. Одну пробу титруют раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу используют в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок AgCl, мешающий определению. В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой.
Определению мешают: ортофосфаты в концентрации, превышающей 25 мг/дм3; железо в концентрации более 10 мг/дм3. Бромиды и йодиды определяются в концентрациях, эквивалентных Сl-. При обычном содержании в водопроводной воде они не мешают определению.
Содержание хлор-иона (X), мг/дм3, вычисляют по формуле
где v — количество азотнокислого серебра, израсходованное на титрование, см3 ;
К — поправочный коэффициент к титру раствора нитрата серебра;
g — количество хлор-иона, соответствующее 1 см3 раствора азотнокислого серебра, мг;
V — объем пробы, взятый для определения, см3 .
Расхождения между результатами повторных определений при содержании Сl- от 20 до 200 мг/дм3 — 2 мг/дм3; при более высоком содержании — 2 отн. %.
4. Устройство анализируемого прибора. Универсальный иономер ЭВ-74
Универсальный иономер ЭВ-74 предназначается для определения в комплекте с ионоселективными электродами активности одно- и двухвалентных анионов и катионов (величины pX) в водных растворах, а также для измерения окислительно-восстановительных потенциалов (величины Еh) в этих же растворах.
Иономер может использоваться также в качестве высокоомного милливольтметра.
При работе с блоком автоматического титрования прибор может быть использован для массового однотипного титрования.
Иономером ЭВ-74 можно производить измерения как методом отбора проб, так и непосредственно в лабораторных установках.
Иономер предназначен для применения в лабораториях научно-исследовательских учреждений и промышленных предприятий.
2. Устройство и принцип работы.
Для измерения активности одно- и двухвалентных ионов в растворах используется электродная система с ионоселективными измерительными электродами и преобразователь. Электродвижущая сила электродной системы зависит от активности соответствующих ионов в растворе и определяется уравнениями (1) или (2).
Значение рХ контролируемого раствора определяется измерением э.д.с. электродной системы с помощью преобразователя, шкала которого проградуирована в единицах рХ. Градировочные значения э.д.с, могут быть вычислены при помощи уравнений (1) и (2).
2.2. Принцип действия и схема преобразователя иономера
Работа иономера основана на преобразовании э.д.с. электродной системы в постоянный ток, пропорциональный измеряемой величине. Преобразование э.д.с. электродной системы в постоянный ток осуществляется высокоомным преобразователем авто компенсационного типа.
Электродвижущая сила Ех электродной системы (рис. 1) сравнивается с падением напряжения на сопротивлении R, через которое протекает ток Iвых. усилителя. Падение напряжения U вых. на сопротивлении R противоположно по знаку электродвижущей силе Ех на вход усилителя подается напряжение:
При достаточно большом коэффициенте усиления напряжение Uвых. мало отличается от э.д.с. электродной системы Sx благодаря этому ток, протекающий через электроды в процессе измерения, весьма мал, а ток Iвых. протекающий через сопротивление R, пропорционален э.д.с. электродной системы, т.е. рХ контролируемого раствора.
2.3. Конструкция иономера ЭВ-74
Иономер состоит из преобразователя и подставки, предназначенной для крепления электродов и установки сосудов с контролируемым раствором.
Общий вид преобразователя и элементы его конструкции показаны на рис. 5.
Для удобства монтажа и обслуживания при ремонте наклонная лицевая панель 9 (рис. 5) укреплена таким образом, что при снятии задней стенки и нижней планки она может быть откинута вперед после откручивания 2 винтов.
На лицевой панели располагаются органы оперативного управления и показывающий прибор 1. Органы заводской настройки и регулировки 7 расположены под лицевой панелью.
На шкале показывающего прибора имеются следующие оцифровки: «—1—19» для измерения на широком диапазоне и «0—5» для измерения на узких диапазонах (показания прибора суммируются со значением, соответствующим началу диапазона). Для удобства диапазон «—1—4» имеет дополнительную оцифровку.
Для установки температуры измеряемого раствора имеется оцифровка «0—100».
К органам оперативного управления относятся: тумблер «СЕТЬ», ручки переменных резисторов «КАЛИБРОВКА», «КРУТИЗНА», «рХи» и «ТЕМПЕРАТУРА РАСТВОРА»; 5 кнопок выбора рода работы: «АНИОНЫ/КАТИОНЫ (+/—)», «Х’/Х»», «mV», «рХ» и «t°»; 5 кнопок выбора диапазона измерения: «—1—19», «—1—4», «4—9», «9—14», «14—19»; корректор показывающего прибора. Кнопка «АНИОНЫ/КАТИОНЫ (+/—)» позволяет производить измерение активности анионов или положительных потенциалов в отжатом к катионов или отрицательных потенциалов в нажатом положениях, кнопка «Х’Х»» — измерение активности одновалентных или двухвалентных ионов соответственно в отжатом или нажатом положениях; кнопки с зависимой фиксацией «mV», «рХ» и «t°» позволяют включить прибор в режим милливольтметра («mV»), иономера («pX») или установки температуры раствора при ручной термокомпенсации («t°»).
При настройке ручками, выведенными на лицевую панель, следует учитывать, что в приборе применены потенциометры с высокой разрешающей способностью, которые имеют зоны плавной и грубой регулировки.
Резисторы «КАЛИБРОВКА», «КРУТИЗНА» и «pH» служат для оперативной настройки прибора на данную электродную систему.
Органы заводской настройки закрыты опломбированной планкой и предназначены: R52 — для дополнительной подстройки начала шкал при измерении катионов; R54 — то же при измерении анионов; R37 — для балансировки температурного моста; R11 — для основной настройки начала шкал при измерении рХ; R40 — для калибровки ручного термокомпенсатора при измерении двухвалентных ионов; R21 — для настройки начала шкал при измерении э.д.с. (мВ); R23 -— для регулировки размаха (крутизны) при измерении э.д.с. (мВ); R1 — для установки тока в цепи регулировки рХи.
Оси указанных потенциометров фиксируются цанговыми зажимами.
К органам заводской настройки относятся также резисторы, расположенные на плате измерительного блока: R48 — для подстройки показывающего прибора на диапазоне «—1—19»; R35 — для калибровки ручного термокомпенсатора при измерении одновалентных ионов.
Элементы внешних соединений расположены на задней планке.
Перемычка, замыкающая клеммы показывающего прибора в рабочем состоянии, должна быть снята.
питьевой вода хлорид жесткость
1. Техника безопасности при работе с кислотами и щелочами
Концентрированные кислоты вызывают обезвоживание кожи и других тканей.
По быстроте действия и по скорости разрушения тканей тела кислоты располагаются в следующем порядке, начиная с наиболее сильных: царская водка (смесь азотной и соляной кислот). Азотная кислота, уксусная кислота (90 – 100%), молочная кислота, щавелевая кислота и т.д. очень опасны ожоги хромой смесью. Сильное раздражающее действие на слизистые оболочки дыхательных путей и глаз оказывают дымящие кислоты (концентрированные соляная и азотная кислоты).
Концентрированные кислоты хранят под тягой. Переливают их также под тягой, пользуясь индивидуальными средствами защиты (очки или защитная маска, резиновые перчатки, халат, резиновый фартук).
При пользовании склянкой с кислотой необходимо следить, чтобы на каждой склянке было четкое название кислоты. Наливать кислоту надо так, чтобы при наклоне склянки этикетка, во избежание ее порчи оказывалась наверху.
При разбавлении или укреплении растворов кислот льют кислоту большей концентрации; при изготовлении смеси кислот необходимо вливать жидкость большей плотности в жидкость с меньшей плотностью.
При разбавлении кислот нужно помнить правило: кислоту следует приливать тонкой струей при перемешивании в холодную воду, а не наоборот, и только в жаростойких и фарфоровых стаканах, так как при этом происходит значительное выделение тепла.
Переливать крепкие HNO3, H2SO4 и HCl можно только при включенной тяге в вытяжном шкафу. Дверцы шкафа должны быть, по возможности, прикрыты.
Наливая раствор, следует снимать пробиркой со склянки последнюю каплю реактива во избежание попадания жидкости на халат (одежду) или обувь.
При работе с крепкими кислотами необходимо одевать защитные очки, а при работе с дымящими серной и соляной кислотой, кроме очков, надевать длинный резиновый фартук и противогаз (или по крайней мере марлевую повязку, респиратор).
Во время приготовления растворов щелочей твердые вещества из содержащих их емкостей берут только специальной ложечкой и ни в коем случае не насыпают, потому что пыль может попасть в глаза и на кожу. После использования ложечку тщательно моют, т. к. щелочь прочно пристает ко многим поверхностям.
При взятии навески используют тонкостенные фарфоровые чашечки. Бумагой, тем более фильтровальной, пользоваться нельзя, т к. щелочь ее разъедает.
Растворы приготавливают в толстостенных фарфоровых сосудах в два этапа. Сначала делают концентрированный раствор, охлаждают его до комнатной температуры, а потом разбавляют до нужной концентрации. Такая последовательность вызвана значительным экзотермическим эффектом растворения.
2. Общие требования безопасности работы в лаборатории
1. При выполнении химико-аналитических исследований необходимо соблюдать требования безопасности при работе с вредными веществами в соответствии с ГОСТ 12.1.007.
Во избежание возможного негативного воздействия на организм человека реактивы, применяемые при консервировании проб воды, подготовке и проведении анализов, должны храниться в минимально необходимом количестве.
2. Содержание вредных веществ в воздухе рабочей зоны не должно превышать значений, установленных в соответствии с ГОСТ 12.1.005.
3. Помещение, в котором проводятся химико-аналитические исследования, должно быть оборудовано общей приточно-вытяжной вентиляцией, соответствующей строительным нормам и правилам отопления, вентиляции и кондиционирования воздуха в соответствии с ГОСТ 12.4.021.
4. Необходимо организовать упорядоченное хранение отработанных реактивов и соответствующую их утилизацию. Определенные в установленном порядке отходы деятельности лаборатории следует направлять в специализированные организации по переработке отходов в соответствии с требованиями законодательства.
5. Приборы устанавливаются в сухом помещении, свободном от пыли, паров кислот и щелочей. Рядом с приборами не должны находиться электронагревательные приборы, а также источники электромагнитных колебаний и радиопомех.
Приборы, которые предусмотрены для работ с горючим газом, должны быть установлены на столах под вытяжными устройствами, обеспечивающими удаление продуктов сгорания.
6. Необходимо соблюдать правила ТБ по обращению и работе с газовыми баллонами, если таковые применяются. Баллоны с газом должны быть удалены от прибора и радиаторов отопления, а также защищены от прямого воздействия солнечных лучей. При работе с газом, находящимся под давлением, следует соблюдать установленные для этих работ «Правила устройства и безопасности эксплуатации сосудов, работающих под давлением». При подаче газа нужно следить за полной герметизацией всех систем подводных и отводных трубок системы.
3. Пожаро- и электробезопасность
1. Обесточить комнату, выключить электронагревательные приборы и тягу.
2. Немедленно сообщить по телефону 20-01 в пожарную часть о загорании (назвать место возникновения пожара и свою фамилию).
3. Доложить начальнику бюро, заведующей лабораторией, начальнику цеха.
4. Принять меры по ограничению распространения огня и ликвидации пожара всеми первичными средствами пожаротушения под руководством непосредственного руководителя, горящие хлорорганические продукты, перечисленные в данной инструкции можно тушить любыми средствами.
5. Организовать встречу пожарной части.
6. При загазованности одеть противогаз.
7. Для приведения огнетушителя ОУ-2 в действие необходимо вынуть его из гнезда, повернуть раструб в сторону очага загорания, левой рукой взяться за ручку, а правой — сорвать пломбу, повернуть до отказа маховичок вентиля. Направить струю на очаг загорания. Тушить следует с периферии, стремясь перекрыть струёй газа поверхность горения. Не следует направлять струю газа на поверхность горящей жидкости во избежание её разбрызгивания, что может привести к увеличению площади горения. После ликвидации очага загорания поворотом вентиля перекрыть клапан запорной головки.
8. При тушении песком следует засыпать им очаг загорания, двигаясь от периферии к центру.
9. При тушении асбестовым полотном необходимо накрыть им очаг загорания, прекратить доступ воздуха к продуктам загорания.
10. В случае, если при использовании средств пожаротушения, указанных выше, пожар ликвидировать не удалось, пользоваться пожарным краном, находящимся в коридоре.
11. Работа в лаборатории должна проводиться при наличии исправного электрооборудования. При обнаружении дефектов в изоляции проводов, неисправности пускателей рубильников, штепселей, розеток, вилок и другой арматуры, а также заземления и ограждений следует немедленно сообщить об этом непосредственным руководителям. Все обнаруженные неисправности должны устраняться только электромонтером.
12. При работе с электрооборудованием, находящимся под напряжением, необходимо применять неисправные индивидуальные средства защиты, диэлектрические перчатки, коврики.
13. Нельзя переносить включенные электронагревательные приборы.
14. В случае перерыва в подаче электрического тока все электронагревательные приборы и электрооборудования должны быть немедленно выключены.
15. В случае загорания электропроводов и электроустановок необходимо их немедленно обесточить и приступить к тушению огня углекислотным или порошковым огнетушителем, а также кошмой или песком.
IV . Охрана окружающей среды
Природоохранной является любая деятельность, направленная на сохранение качества окружающей среды на уровне, обеспечивающем устойчивость биосферы. К ней относится как крупномасштабная, осуществляемая на общегосударственном уровне деятельность по сохранению эталонных образцов нетронутой природы и сохранению разнообразия видов на Земле, организации научных исследований, подготовке специалистов-экологов и воспитанию населения, так и деятельность отдельных предприятий по очистке от вредных веществ сточных вод и отходящих газов, снижению норм использования природных ресурсов и т. д. Такая деятельность осуществляется в основном инженерными методами.
Существуют два основных направления природоохранной деятельности предприятий. Первое — очистка вредных выбросов. Этот путь «в чистом виде» малоэффективен, так как с его помощью далеко не всегда удается полностью прекратить поступление вредных веществ в биосферу. К тому же сокращение уровня загрязнения одного компонента окружающей среды ведет к усилению загрязнения другого.
И например, установка влажных фильтров при газоочистке позволяет сократить загрязнение воздуха, но ведет к еще большему загрязнению воды. Уловленные из отходящих газов и сливных вод вещества часто отравляют значительные земельные площади.
Использование очистных сооружений, даже самых эффективных, резко сокращает уровень загрязнения окружающей среды, однако не решает этой проблемы полностью, поскольку в процессе функционирования этих установок тоже вырабатываются отходы, хотя и в меньшем объеме, но, как правило, с повышенной концентрацией вредных веществ. Наконец, работа большей части очистных сооружений требует значительных энергетических затрат, что, в свою очередь, тоже небезопасно для окружающей среды.
Кроме того, загрязнители, на обезвреживание которых идут огромные средства, представляют собой вещества, на которые уже затрачен труд и которые за редким исключением можно было бы использовать в народном хозяйстве.
Для достижения высоких эколого-экономических результатов необходимо процесс очистки вредных выбросов совместить с процессом утилизации уловленных веществ, что сделает возможным объединение первого направления со вторым.
Второе направление — устранение самих причин загрязнения, что требует разработки малоотходных, а в перспективе и безотходных технологий производства, которые позволяли бы комплексно использовать исходное сырье и утилизировать максимум вредных для биосферы веществ.
Однако далеко не для всех производств найдены приемлемые технико-экономические решения по резкому сокращению количества образующихся отходов и их утилизации, поэтому в настоящее время приходится работать по обоим указанным направлениям.
Заботясь о совершенствовании инженерной охраны окружающей природной среды, надо помнить, что никакие очистные сооружения и безотходные технологии не смогут восстановить устойчивость биосферы, если будут превышены допустимые (пороговые) значения сокращения естественных, не преобразованных человеком природных систем, в чем проявляется действие закона незаменимости биосферы.
Таким порогом может оказаться использование более 1% энергетики биосферы и глубокое преобразование более 10% природных территорий (правила одного и десяти процентов). Поэтому технические достижения не снимают необходимости решения проблем изменения приоритетов общественного развития, стабилизации народонаселения, создания достаточного числа заповедных территорий и других, рассмотренных ранее.
Список используемой литературы
Аналитическая химия. Васильев В.П. Год издания: 1989
Герасимов И.П. Экологические проблемы в прошлой, настоящей и будущей географии мира. М.: Наука, 1985.
источник
