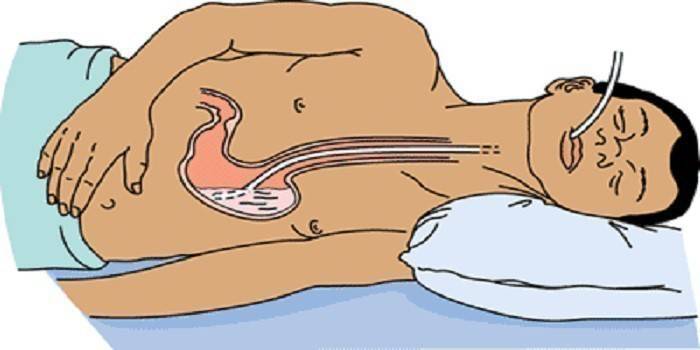
Особенности проведения промывания желудка у пациента в бессознательном состоянии.
1. Толстый стерильный желудочный зонд диаметром 10-15 мм, длиной – 100-120 см с метками на расстоянии 45, 55, 65 см от слепого конца – 1 шт.
2. Резиновая трубка длиной 70 см (для удлинения зонда) и стеклянная соединительная трубка диаметром не менее 8 мм – по 1 шт.
3. Воронка емкостью 1 л – 1 шт.
7. Антисептик – 1 разовая доза для обработки рук.
10. Фартук клеенчатый для пациента и медицинского работника – 2 шт.
11. Марлевая салфетка, смоченная дезсредством – 1 шт.
12. Перчатки нестерильные – 1 пара.
13. Емкость для промывных вод – 1 шт.
14. Емкость для отправки промывных вод в лабораторию – 2 шт.
15. Ведро с чистой водой комнатной температуры объёмом 10 л – 1 шт.
17. Жидкое мыло – при отсутствии антисептика для обработки рук.
18. Диспенсер с одноразовым полотенцем.
Алгоритм действий
Подготовка к процедуре:
1. Измерить артериальное давление, подсчитать пульс.
2. Снять зубные протезы у пациента (если они есть).
3. Медицинскому работнику надеть перчатки, фартук.
4. Поставить таз к головному концу кушетки.
5. Измерить шёлковой нитью расстояние от резцов до пупка плюс ширина ладони пациента.
6. Перенести метку на зонд, начиная от закруглённого конца.
7. Взять зонд в правую руку как «писчее перо» на расстоянии 10 см от закруглённого конца.
Выполнение процедуры:
7. Встать сбоку от пациента
8. Уложить пациента на левый бок, подстелив клеенку.
9. Раскрыть рот и зафиксировать его роторасширителем.
10. Захватить и зафиксировать язык языкодержателем.
11. Ввести пациенту зонд, проталкивая его по задней стенке глотки в пищевод и желудок.
12. Убедиться, что зонд не попал в дыхательные пути: к наружному концу зонда поднести несколько волокон ваты или тонкое перышко. Их колебание означает, что зонд находится в дыхательных путях.
13. Присоединить к зонду воронку, заполнить ее водой, держа на уровне кровати.
14. Поднять воронку выше головы пациента.
15. Как только вода достигнет устья воронки, быстро опустить воронку ниже уровня желудка, чтобы содержимое желудка наполнило воронку полностью.
16. Осторожно вылить содержимое воронки в таз для промывных вод.
17. Повторить промывание несколько раз до чистых промывных вод.
Окончание процедуры:
18. Воронку снять, конец зонда опустить в таз на 15-20 минут.
19. Зонд извлечь через салфетку, смоченную дезинфицирующим средством, предварительно пережав его непосредственно перед ртом пациента.
20. Поместить зонд, воронку в контейнер с дезинфицирующим средством, салфетку в контейнер с отходами класса Б.
21. Обработать полость рта пациента, обтереть полотенцем вокруг.
22. Пациента тепло укрыть, наблюдать за состоянием.
23. Снять перчатки, положить в ёмкость с дезинфицирующим раствором.
24. Вымыть руки, обработать антисептиком или мылом.
25. Написать направление и отправить емкости с промывными водами в лабораторию.
26. Сделать запись о проведении процедуры и реакции на нее пациента.
Техника получения промывных вод желудка.
1. При помощи шприца Жанэ ввести в желудок 0,5 л воды.
2. Потянуть поршень шприца на себя, аспирируя введенную воду.
3. Вновь ввести эту же порцию жидкости в желудок.
4. Вновь потянуть поршень шприца на себя, аспирируя введенную воду.
5. Вылить промывные воды в количестве 20 – 50 мл в стерильную емкость для промывных вод.
6. Повторить забор промывных вод в конце процедуры промывания желудка.
8. Обе стерильные ёмкости отправляют в лабораторию с соответствующим направлением.
Примечание.При подозрении на отравление прижигающими ядами сразу же берут первую порцию промывных вод (п.3 и п.4 не выполняются).
5. Помощь пациенту при рвоте.
1. Предотвратить развитие асфиксии от попадания рвотных масс в дыхательные пути.
2.Облегчить страдания пациента.
Показания: тошнота, начавшаяся рвота.
2. Клеенчатый фартук – 1 шт.
4. Марлевая салфетка – 4 — 6 шт.
5. Раствор для полоскания полости рта ( стакан кипячёной воды, или 2 раствор натрия гидрокарбоната, или 3 раствор перекиси водорода – 1 столовая ложка на стакан воды, иди слабо солёный раствор) ,
6. Электроотсос или грушевидный баллончик – 1 шт.
7. При необходимости – ёмкость для отправления рвотных масс в лабораторию – 1 шт.
9. Шпатель, обёрнутый бинтом – 1 шт.
Помощь пациенту при рвоте, находящемуся на полупостельном режиме:
Алгоритм действий
Подготовка к процедуре:
3. Если у пациента есть зубные протезы, их следует снять.
4. Усадить пациента на стул со спинкой, встать справа от него.
5. Быстро надеть на него клеенчатый фартук.
6. Слегка наклонить вперед туловище и голову пациента, развести его колени и поставить к ногам таз, в который опустить свободный конец фартука.
Выполнение процедуры:
7. Придерживать голову пациента во время акта рвоты, положив на лоб свою правую ладонь, а левой рукой держать левое плечо пациента.
8. Полоскать полость рта после каждого акта рвоты.
Окончание процедуры:
9. Вытереть лицо пациента салфеткой.
10. Уложить в постель и создать покой.
11. Необходимо установить наблюдение за пациентами: контроль артериального давления, пульса, частоты дыхательных движений, частоты сердечных сокращений, внешнего вида.
12. Оставить рвотные массы до прихода врача; собрав по его назначению в сухую стеклянную банку с плотно закрывающейся крышкой в количестве 50-60 мл, отправить в лабораторию.
13. К краю кровати поставить чистый таз, матрац прикрыть клеенкой на случай повторной рвоты.
Помощь при рвоте пациенту, находящемуся на постельном режиме в активном положении:
Алгоритм действий
Подготовка к процедуре:
3. Если у пациента есть зубные протезы, их следует снять.
4. Убрать подушки, прикрыть матрац клеенкой, а сверху пеленкой.
5. Поставить таз к краю кровати, повернуть пациента на бок, помочь наклониться над тазом.
Выполнение процедуры:
6. Поддерживать голову пациента при рвотных движениях.
Окончание процедуры:
7. После рвоты дать прополоскать рот, обтереть лицо пациента.
8. Уложить в постель и создать покой.
9. Необходимо установить наблюдение за пациентом: контроль артериального давления, пульса, частоты дыхательных движений, частоты сердечных сокращений, внешнего вида.
10. Оставить рвотные массы до прихода врача; собрав по его назначению в сухую стеклянную банку с плотно закрывающейся крышкой в количестве 50-60 мл, отправить в лабораторию.
11. К краю кровати поставить чистый таз, при необходимости сменить постельное и нательное бельё.
Помощь при рвоте пациенту, находящемуся на постельном режиме в пассивном положении или без сознания:
Алгоритм действий
Подготовка к процедуре:
3. Если у пациента есть зубные протезы, их следует снять.
4. Убрать подушки, повернуть голову пациента на бок.
5. Матрац прикрыть клеёнкой так, чтобы она подходила и под голову пациента
6. Прикрыть клеёнку пелёнкой так, чтобы она обязательно заходила под ухо пациента во избежание затекания рвотных масс в слуховой проход.
7. Поставить ко рту почкообразный лоток.
8. При необходимости разомкнуть челюсти пациента шпателем, обернутым бинтом, вводя его в горизонтальном положении между малыми коренными зубами.
9. С помощью роторасширителя зафиксировать челюсти в разведенном состоянии.
Выполнение процедуры:
10. Поддерживать голову пациента во время рвотных движений.
Окончание процедуры:
11.После рвоты освободить полость рта от остатков рвотных масс, подсасывая их баллончиком, или очищая рот пальцем, обёрнутым марлей, или шпателем, обёрнутым марлей.
11. Провести орошение полости рта одним из антисептиков из резинового баллончика.
12. Обтереть лицо пациента влажной салфеткой, при необходимости сменить бельё.
13. Уложить в постель и создать покой.
14. Необходимо установить наблюдение за пациентом: контроль артериального давления, пульса, частоты дыхательных движений, частоты сердечных сокращений, внешнего вида.
15. Оставить рвотные массы до прихода врача; собрав по его назначению в сухую стеклянную банку с плотно закрывающейся крышкой в количестве 50-60 мл, отправить в лабораторию.
Тема: 5.9. Медикаментозное лечение в сестринской практике.
Дата добавления: 2014-12-17 ; Просмотров: 8863 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Присутствие кислотоустойчивых бактерий в клиническом диагностическом материале может быть подтверждено или микроскопией, или культуральным исследованием. Поскольку микобактерии не могут быть точно идентифицированы при микроскопическом исследовании, и поскольку существует много видов микобактерий, окончательный диагноз туберкулез или микобактериоз (за исключением лепры) может быть установлен только при выделении Mycobacterium из клинического образца.
Кратность и сроки микробиологических исследований в ходе лечения и наблюдения различных групп пациентов определены в инструкциях по химиотерапии больных туберкулезом и организации диспансерного наблюдения и учета контингентов противотуберкулезных учреждений.
Преимущества аккуратной деконтаминации проб, применения высокочувствительных питательных сред и простых схем идентификации выделенных штаммов не будут реализованы до тех пор, пока не будет обеспечено правильное взятие проб и их быстрая и правильная транспортировка в лабораторию.
Для получения оптимальных результатов при исследовании диагностического материала необходимо соблюдать следующие условия:
– сбор материала необходимо производить до начала химиотерапии, так как даже несколько дней применения лекарственной терапии может быть достаточно для того, чтобы убить значительное количество кислотоустойчивых микобактерий или снизить их жизнеспособность и исказить результаты исследования;
– материал для исследования должен собираться рано утром;
– при исследовании мокроты желательно собрать не менее 3 проб утренней мокроты в течение 3 последовательных дней. Это существенно повышает результативность исследования;
– собранный материал необходимо как можно быстрее доставить в лабораторию; в случае невозможности немедленной доставки материал сохраняется в холодильнике при 4-10°С не более 48 часов;
– при перевозке материала необходимо особенно тщательно следить за сохранностью флаконов и правильностью их маркировки.
Флаконы для сбора материала.
Материал для исследования на кислотоустойчивые микобактерии собирают в стерильные флаконы (баночки). Эти флаконы должны быть достаточно прочными, чтобы предупредить возможность их повреждения при транспортировке, и иметь широкую герметично закрывающуюся крышку, чтобы избежать вытекания материала и его загрязнения. Чтобы облегчить выбор оптимальных флаконов, необходимо помнить о следующих основных требованиях к ним:
— широкое горлышко (диаметром не менее 35 мм), чтобы больному было удобно собирать мокроту, не загрязняя наружной поверхности флакона;
— емкость флакона — около 50 мл;
— флакон должен быть из прозрачного материала, чтобы было можно определить объем пробы и ее качество, не открывая крышку;
— крышка должна быть плотно завинчивающейся или герметично закрывающейся, чтобы предотвратить вытекание потенциально опасного материала в процессе транспортировки;
— наружная поверхность не должна быть чрезмерно гладкой и скользкой, чтобы можно было легко маркировать флаконы;
— желательно использовать одноразовые флаконы, изготовленные из легкосжигаемого материала;
— при отсутствии одноразовых контейнеров можно применять толстостенные флаконы из стекла.
Поскольку наиболее частой формой туберкулезного поражения является туберкулез органов дыхания, основной материал исследования составляют мокрота; отделяемое верхних дыхательных путей, полученное после аэрозольных ингаляций; промывные воды бронхов; бронхоальвеолярные смывы; материал, получаемый при бронхоскопии, транстрахеальной и внутрилегочной биопсии; аспират из бронхов; ларингеальные мазки; экссудаты; мазки из торакальных ран; промывные воды желудка (преимущественно у детей).
Хотя M.tuberculosis могут вызывать поражение практически любого органа и любой системы, более 85% больных в странах с высокой распространенностью туберкулеза страдают легочной формой заболевания. Поэтому при проведении исследований на туберкулез основным клиническим материалом является мокрота, которую следует собирать у всех больных с подозрением на это заболевание.
Хороший клинический образец – это недавно собранная мокрота из бронхиального дерева, с минимальными примесями слюны или слизи из носоглотки. Качественным материалом можно считать мокроту, имеющую слизистый или слизисто-гнойный характер, а также содержащую плотные белесоватые включения. Желтоватый, серый или бурый цвет мокроты позволяет предположить диагностическую ценность материала. Достаточный объем исследуемой порции мокроты составляет 3 — 5 мл, однако допустимо исследование и меньших по объему порций. Некоторые больные выделяют микобактерии нерегулярно, поэтому в целях повышения информативности практикуется повторное (до 3 раз) исследование мокроты. Такая тактика позволяет повысить число положительных находок.
Необходимо, чтобы лабораторный персонал знал, как следует правильно собирать мокроту. Эта методика описана в инструкции по бактериоскопическому методу диагностики туберкулеза. Лучше всего, если пациент собирает мокроту утром до завтрака и приема лекарств (частицы пищи и лекарства могут препятствовать росту микобактерий туберкулеза). Если предполагается брать пробы мокроты для культуральной диагностики, не следует до этого момента начинать химиотерапию.
Материал для исследования должен быть доставлен в лабораторию сразу же после его сбора. Если транспортировка откладывается, то собранный материал следует обязательно хранить в холодильнике, чтобы предупредить рост контаминирующей микрофлоры.
Образцы мокроты нельзя объединять из-за риска перекрестного загрязнения материала. Всегда проводят обработку (разжижение и деконтаминацию) всей пробы, т.е. не выбирают какие-то части образца, как это обычно делают при бактериоскопическом исследовании мокроты. Так как чаще всего для культурального исследования на туберкулез в лабораторию присылают именно пробы мокроты, разработанные способы разжижения и деконтаминации рассчитаны прежде всего именно на этот биологический материал. Другие биологические жидкости и ткани требуют более тщательной обработки, так как в них обычно содержится меньшее количество микобактерий туберкулеза, чем в мокроте.
Индуцированная мокрота
Если у больного продуктивный кашель, то необходимость сбора мокроты вполне очевидна. Однако, если больной не может собрать мокроту, для получения других биологических материалов из легких можно использовать несколько специальных приемов.
Для аэрозольных ингаляций пользуются портативными или стационарными аэрозольными ингаляторами. Для ингаляций рекомендуется раствор, в 1 л которого содержится 150 г хлорида натрия (NaCl) и 10 г двууглекислого натрия (Na2CO3). Для приготовления раствора используется стерильная дистиллированная вода. Для провокации мокроты необходимо вдохнуть на протяжении 10–15 минут от 30 до 60 мл подогретой до 42–45°С смеси. В связи с тем, что аэрозольная ингаляция вызывает выделение водянистого секрета, напоминающего по консистенции слюну, во избежание выбраковки материала в бланке направления и на флаконе с материалом должна быть обязательная маркировка, указывающая на то, что материал получен после аэрозольной ингаляции.
У большинства пациентов после аэрозольной ингаляции в течение нескольких часов наблюдается остаточная гиперсекреция бронхиального отделяемого, поэтому пациенту рекомендуется в течение суток после ингаляции собрать мокроту для второго исследования.
При отсутствии мокроты, невозможности проведения аэрозольной ингаляции или безуспешности этой процедуры для исследования на микобактерии берут промывные воды бронхов или желудка.
3.2.3. Промывные воды бронхов.
Сбор промывных вод бронхов производится врачом-отоларингологом. Пациенту во время вдоха вводят шприцем в трахею 5–7 мл стерильного изотонического раствора, который вызывает кашлевой рефлекс. Вместе с изотоническим раствором откашливается секрет из глубоких отделов бронхиального дерева. Промывные воды бронхов собирают в стерильный флакон и немедленно направляют в лабораторию.
Пациентам с выраженным глоточным рефлексом указанную процедуру производят после предварительной анестезии надгортанника, гортани и задней стенки глотки.
Промывные воды желудка.
Промывные воды желудка исследуют преимущественно у детей младшего возраста, которые плохо откашливают мокроту и часто проглатывают ее. Во избежание смешивания проглоченной мокроты с пищей промывные воды желудка следует брать натощак. Последний прием пищи должен быть не менее чем за 12 часов до взятия промывных вод желудка. Перед сбором материала для нейтрализации желудочного содержимого больному дают выпить 100–150 мл раствора питьевой соды (1 чайная ложка соды на 1 стакан воды), приготовленного на стерильной дистиллированной воде для исключения возможности попадания в желудок кислотоустойчивых сапрофитов, которые могут содержаться в водопроводной воде. После этого вводят желудочный зонд и собирают содержимое желудка в стерильный флакон. Материал немедленно доставляют в лабораторию и подвергают обработке, чтобы исключить повреждающее влияние на возбудителя содержащихся в материале желудочных ферментов.
Особенно результативен метод получения промывных вод желудка в сочетании с предварительной аэрозольной ингаляцией. Промывные воды желудка следует собирать через 30 мин после аэрозольной ингаляции. Такая комбинация двух указанных методов дает значительно больший процент положительных результатов, чем каждый из них в отдельности. Этот метод получения диагностического материала может оказаться полезным также у пациентов с подавленным кашлевым рефлексом, у которых не удается получить материал даже при провоцирующих ингаляциях.
3.2.5. Другие пробы.
При внелегочных формах заболевания микобактерии могут поражать практически любой орган, поэтому для исследования пригоден самый разнообразный материал: спинномозговая, плевральная, перикардиальная, синовиальная и асцитическая жидкости, кровь, гной, пунктаты костного мозга, резецированные ткани, гнойно-некротические массы, соскобы синовиальных оболочек, биопсийный материал лимфатических узлов и др.
Если у больного заподозрена внелегочная форма туберкулеза, помимо других видов диагностического материала, желательно также исследовать и мокроту, так как это существенно повышает частоту выявления сочетанных легочных и внелегочных форм туберкулеза.
При внелегочных формах процесса можно выделить 2 группы диагностических материалов: асептически полученный материал, обычно свободный от загрязняющей сопутствующей микрофлоры, и заведомо загрязненный материал из открытых очагов поражения, в отношении которого заранее известно, что он контаминирован сопутствующей микробной флорой или собран без соблюдения правил асептики.
3.2.5.1. Асептически собранный материалчаще всего представляет собой полученные при биопсиях или оперативных вмешательствах резецированной ткани того или иного органа, гнойно-некротические массы, грануляции, соскобы синовиальных оболочек, лимфатических узлов или пунктатов их содержимого, а также плевральную, спинномозговую, синовиальную или асцитическую жидкость. Материал помещают в стерильный флакон без консервантов и немедленно доставляют в лабораторию. Если материал не может быть немедленно доставлен в лабораторию, во избежание высыхания к нему добавляют небольшое количество стерильного изотонического раствора и помещают в холодильник при 4-10°С или во флакон с сухим льдом. Биологические жидкости, а также кровь, гной и костный мозг следует брать в стерильный контейнер с соблюдением правил асептики. Если в собранной жидкости могут образоваться сгустки, то предварительно в контейнер следует внести стерильный раствор щавелевокислого натрия (из расчета 0,01–0,02 мл 10% нейтрального раствора оксалата на 1 мл образца биологической жидкости) или раствор гепарина (0,2 мл на 1 мл образца), или равный объем стерильного 3% раствора лимоннокислого натрия.
3.2.5.2.Заведомо загрязненные материалы.К этой категории относится основной и наиболее доступный при мочеполовом туберкулезе материал – моча.
3.2.5.3.1. Моча (средняя часть утренней порции или вся утренняя порция) собирается в стерильную посуду после тщательного туалета наружных половых органов. Анализ мочи на микобактерии должен предусматривать обязательное трехкратное исследование.
Сбор суточной мочи для бактериологического исследования не практикуется. Это объясняется тем, что при накоплении мочи в течение суток невозможно сохранить ее стерильность. Хранение емкости с мочой в холодном месте может привести к выпадению солей, что неблагоприятно отражается на последующей обработке осадка. Кроме того, в моче содержатся бактерицидные продукты, которые могут не только угнетать жизнеспособность микобактерий, но в течение суток даже разрушать микробные клетки. В то же время при длительном хранении мочи невозможно избежать размножения в ней контаминирующей микрофлоры. Ферменты жизнедеятельности этой флоры могут угнетать способность микобактерий к росту. И, наконец, при сборе мочи в течение длительного времени следует иметь в виду возможность попадания в нее кислотоустойчивых сапрофитов, что может привести к диагностическим ошибкам. В этом отношении особенно осторожно должны оцениваться результаты исследования мочи, полученной от мужчин, так как в ней могут обнаруживаться M.smegmatis и другие нетуберкулезные микобактерии, которые ошибочно могут быть приняты за микобактерии туберкулеза.
3.2.5.3.2. Менструальная кровь.Исследование менструальной крови требует особого методического подхода. Наличие в этом материале большого количества протеолитических, фибринолитических и других ферментов обусловливает необходимость незамедлительной доставки материала в лабораторию и тщательной его обработки. Менструальная кровь, с одной стороны, является весьма подходящим материалом для развития контаминирующей флоры, а с другой, обилие ферментов неблагоприятно влияет на жизнеспособность микобактерий. Менструальную кровь следует собирать не тампоном, а вакуумным отсосом или колпачком Кафки. Исследуют ее так же, как кровь или другие материалы с примесью крови.
3.2.5.3.3. Каловые массы собирают в стерильную посуду. Для посева небольшое количество кала (1 г) гомогенизируют в ступке с 3–5 мл дистиллированной воды, фильтруют через ватно-марлевый фильтр, центрифугируют и исследуют полученный осадок. Бактериологическое исследование кала производят редко, так как обычно положительный результат получить не удается.
3.2.5.3.4. Смывы с поверхностей. Исследование различных поверхностей применяется для контроля качества дезинфекционных мероприятий, а также при обследовании очагов туберкулезной инфекции в эпидемиологических целях. Метод основан на определении загрязненности поверхностей различных предметов микобактериями путем взятия смывов стерильным тампоном из мелкопористой поролоновой губки размером 15 мм х 15 мм х 15 мм.
При заборе материала стерильный поролоновый тампон берут стерильным пинцетом, погружают в пробирку с 5 мл 5% раствора трехзамещенного фосфорнокислого натрия, слегка отжимают о внутреннюю стенку пробирки и производят смыв с поверхности предмета, после чего тампон снова погружают в смачивающий раствор. Пинцет перед очередным смывом стерилизуют обжиганием над пламенем спиртовки.
Дата добавления: 2016-11-18 ; просмотров: 1253 | Нарушение авторских прав
источник
Оснащение: стерильная сухая посуда (можно прокипятить 3-5 мин) с широким горлом, закрывающаяся резиновой пробкой, тазик для сбора рвотных масс, чашка Петри, ложка для сбора рвотных масс, шпатель, лоток, воронка и толстый зонд, кипяченая вода для сбора первой порции промывных вод, фартук 2 шт., пеленка, стакан кипяченой воды для полоскания рта пациента, бланки направления материала на бактериологическое исследование, перчатки, сухая хлорная известь, растворы антисептика для проведения дезобработки таза, фартука, перчаток, ветошь.
Медсестра проводит подготовительный этап сбора рвотных масс. Надевает фартук и чистые перчатки. Таз для сбора рвотных масс ополаскивает водой и обдает кипятком. Установить доверительные отношения с пациентом, объяснить ему цель и ход процедуры.
На дно таза устанавливает половинку чашки Петри. Пациента усаживают на стул, одевают фартук. Раздражают заднюю стенку глотки пациента. При возникновении рвоты медсестра оказывает помощь пациенту: придерживает голову, вытирает пеленкой рот, после выделения рвотных масс подает воду для полоскания рта. Воду при полоскании рта нельзя выплевывать в лоток.
Рвотные массы 50 – 150 мл собирают ложкой из чашки Петри и переносят в посуду с широким горлом, закрыть банку крышкой и обработать поверхность банки салфеткой смоченной в дезинфектанте, салфетку в лоток для отработанного материала. Собранный материал, до доставки в лабораторию, хранить в холодильнике.
СБОР ПРОМЫВНЫХ ВОД ЖЕЛУДКА:
Медсестра проводит подготовительный этап промывания желудка. Выполняет промывание желудка толстым зондом кипяченой водой. На исследование забирают всю первую порцию промывных вод в посуду с широким горлом. После сбора промывных вод закрыть банку крышкой и обработать поверхность банки салфеткой смоченной в дезинфектанте, салфетку в лоток для отработанного материала. Собранный материал, до доставки в лабораторию, хранить в холодильнике. Проводят обеззараживание оставшихся рвотных масс и промывных вод желудка: (200 гр. хлорной извести на 1 кг рвотных масс и промывных вод желудка экспозиция 90 мин). В заключительном этапе манипуляции обеззараживают фартуки, перчатки, таз и салфетки.
Заполняется направление в бактериологическую лабораторию.
Упаковать пробы в контейнер и доставить в лабораторию.
«БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ КАЛА»
Показания: острые кишечные инфекции или обследования на них; дети до 2-х лет поступающие на лечение в стационар; родители, находящиеся в стационаре для ухода за больным ребёнком; бактерионосители.
Оснащение:стерильный одноразовый контейнер для сбора кала, герметично закрытые стерильные пробирки с тампонами на металлических или деревянных стержнях; флакон с консервантом (30% раствор глицерина и 70% частей физиологического раствора); физиологический раствор; чашка Петри с питательной средой; стерильный флакон или пробирка с жидкой питательной средой закрытые герметично; контейнер для транспортировки; штатив, стеклограф; манипуляционный столик; судно, вощёная бумага; бланк направления ф. № 218-у. Ёмкости для растворов дезинфектанта (для обработки поверхностей, для замачивания использованной ветоши), ёмкость с чистой ветошью, продезинфицированный лоток для отработанного материала, флакон с дезинфектантом для обработки ампул и флаконов, продезинфицированные ножницы, чистые пеленки, емкость с перчатками, маска, продезинфицированный клеёнчатый фартук, халат, кушетка.
При применении химического метода дезинфекции– ёмкости для растворов дезинфектанта: для промывания перчаток, для замачивания перчаток, для замачивания масок; бак для грязного белья с полиэтиленовым мешком внутри.
При применении физического метода дезинфекции –промаркированную емкость с крышкой с полиэтиленовым мешком внутри. Если при проведении манипуляции применяются изделия одноразового использования, то после манипуляции весь использованный одноразовый материал сбрасывается в промаркированную емкость с полиэтиленовым мешком внутри.
Последовательность выполнения:
1. Перед началом работы снять с рук все предметы (кольца, часы и др.).
2. Вымыть руки дважды под проточной водой с мылом.
3. Просушить руки разовой салфеткой или электрополотенцем. Провести гигиеническую антисептику кожи рук согласно ЕN 1500.
4. Надеть соответствующую форму одежды (хирургический халат, фартук, маску).
5. Взять медицинские перчатки, проверить их на целостность и надеть.
6. Приготовить на вспомогательном столе емкость с чистой ветошью и емкости с растворами дезинфектантов:
для обработки поверхностей;
для замачивания использованной ветоши (раствор заливается в неё после обработки всех поверхностей);
при применении химического метода дезинфекции:
для промывания использованных перчаток;
для замачивания использованных перчаток;
для замачивания использованных масок;
(при применении физического метода дезинфекции:
промаркированную емкость с крышкой с полиэтиленовым мешком внутри.
7. Прикрепить бирки ко всем емкостям с дезинфицирующими растворами, на которых указать название дезинфицирующего раствора, концентрацию, дату, время замены дезинфицирующих растворов и подпись медсестры, которая меняла дезинфицирующие растворы в данных емкостях.
8. Взять дезинфектант для поверхностей и обработать полки рабочего манипуляционного стола путем орошения. Взять рукой чистую ветошь и протереть поверхность манипуляционного стола (вначале – верхнюю полку, затем другой стороной ветоши – нижнюю полку), ветошь сбросить в емкость для использованной ветоши. Второй ветошью протереть ножки столика, ветошь сбросить в емкость для использованной ветоши. Взять дезинфектант для поверхностей и обработать кушетку путем орошения. Взять рукой чистую ветошь и протереть поверхность кушетки, ветошь сбросить в емкость для использованной ветоши.
9. Взять чистую ветошь – рукой, смочить ее в растворе дезинфектанта и обработать ею фартук – движениями сверху вниз. Использованную ветошь сбросить в емкость для использованной ветоши. Залить дезинфицирующий раствор в емкость для использованной ветоши, прикрепить бирку, на которой указать название дезинфицирующего раствора, концентрацию, дату, время начала и завершения экспозиции, подпись медсестры, которая заливала дезинфицирующий раствор в данную емкость.
10. Взять пеленку и застелить на кушетку.
11. Поставить на нижнюю полку манипуляционного стола продезинфицированный лоток для отработанного материла.
12. Вымыть руки в перчатках дважды под проточной водой с мылом (для удаления дезинфектанта с поверхности перчаток) и просушить руки разовой салфеткой или электрополотенцем.
13. Поставить на верхнюю полку манипуляционного стола флакон с дезинфектантом для обработки ампул и флаконов, стерильный одноразовый контейнер для сбора кала, герметично закрытые стерильные пробирки с тампонами на металлических или деревянных стержнях. Выставить флакон с консервантом (30% раствор глицерина и 70% частей физиологического раствора); физиологический раствор; чашку Петри с питательной средой; стерильный флакон или пробирку с жидкой питательной средой закрытые герметично; контейнер для транспортировки; пелёнка, штатив, стеклограф; бланк направления ф. № 218-у.
14. Информировать пациента о цели и последовательности выполнения манипуляции. Получить его согласие на выполнение манипуляции.
15. Проверить целостность упаковок, время, дату стерилизации и состояние наружных индикаторов на упаковках со стерильным материалом, вскрыть (развернуть) упаковки и оценить состояние внутренних индикаторов.
16. Подготовить флакон с физиологическим раствором или консервантом: проверить срок годности, название, дозу на флаконе – сверить с листом назначения, проверить внешний вид лекарственного средства.
17. Взять стерильный шарик, смочить его раствором дезинфектанта для обработки флаконов и ампул. Обработать металлический колпачок и верхнюю треть флакона с физиологическим раствором или консервантом (сверху вниз, по спирали), шарик сбросить в лоток для отработанного материала. Вскрыть продезинфицированными ножницами металлический колпачок флакона. Взять второй стерильный шарик, смочить раствором дезинфектанта и обработать резиновую пробку, шарик сбросить в лоток для отработанного материала.
18. На флаконе поставить дату, время вскрытия флакона, подпись медсестры (вскрытый флакон годен в течение 24 часов с момента вскрытия).
19. Стеклографом на пробирке (стерильном флаконе) поставить номер, соответствующий номеру в направлении.
20. Установить пробирку в штатив.
21. Уложить пациента на левый бок с приведёнными к животу ногами (детей раннего возраста – на спину с приведёнными к животу ногами).
22. Извлечь из пробирки стерильный тампон и смочить его в физиологическом растворе или консерванте.
23. Левой рукой раздвинуть пациенту ягодицы. Правой рукой осторожно, без усилия, вращательным движением ввести в прямую кишку ватный тампон или металлическую петлю (детям раннего возраста на глубину 3 – 4 см, старшим детям и взрослым на 6 – 8 см).
25. Поместить петлю (тампон) в сухую стерильную пробирку, не касаясь краёв. До доставки в лабораторию эту пробирку поместить в холодильник, но не более чем на 2 часа.
26. При необходимости более длительного хранения необходимо налить в пробирку 3 – 5 мл консерванта и в него поместить петлю (тампон), до доставки в лабораторию пробирку хранить в холодильнике.
27. Использованную пеленку с кушетки сбросить в бак для грязного белья.
28. Взять дезинфектант для поверхностей и обработать кушетку путем орошения. Взять рукой чистую ветошь и протереть поверхность кушетки, ветошь сбросить в емкость для использованной ветоши.
29. Взять чистую ветошь – рукой, смочить ее в растворе дезинфектанта и обработать ею фартук – движениями сверху вниз. Использованную ветошь сбросить в емкость для использованной ветоши. Снять фартук.
30. Снять перчатки, маску и погрузить в соответствующие емкости с дезинфицирующим раствором.
Если для дезинфекции изделий одноразового использования применяют автоклав (физический метод дезинфекции), то после манипуляции весь использованный одноразовый материал сбрасывается в специально отведенную промаркированную емкость с полиэтиленовым мешком внутри.
Ёмкость закрыть крышкой и отнести в автоклав для дезинфекции. Мешки с отработанным материалом помещают в биксы, а биксы в автоклав, который предназначен для проведения физического метода дезинфекции. Режим дезинфекции:
Ёмкость внутри и снаружи обрабатывается раствором дезинфектанта. В отделении вложить новый полиэтиленовый мешок.
31. Вымыть руки дважды под проточной водой с мылом.
32. Просушить руки разовой салфеткой или электрополотенцем.
33. Оформить направление (ф. № 218-у).
34. Поместить пробы в контейнер для транспортировки, избегать возможного опрокидывания собранного материала. Направления поместить в пакет.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10436 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Производится при пищевых токсикоинфекциях и кишечных инфекциях. Рвотные массы собирают в стерильные банки в количестве 50-100мл и немедленно отправляют их в лабораторию. Целесообразно проводить исследование материала на обнаружение и патогенной и условно-патогенной флоры. Для этого полученный материал разводят в физ. растворе, затем титруют его и засевают на чашки со вредами для выделения энтеробактерий (Левина, Эндо, Плоскирева), для вибрионов – на щелочной агар, для бацилл – на МПА, для клостридий – на стреду Китта-Тароцци. После инкубации выделяют чистые культуры, проводят их идентификацию, определяют чувствительность к антибиотикам, определяют факторы патогенности. При выделении УПМ необходимо учитывать не только качественный состав микрофлоры, но и количественный, т.к. этиологически значимой для отсутствующих или присутствующих в небольшом количестве в кишечнике здоровых людей видом является 106 и больше
Посев промывных вод желудка производится при пищевых токсикоинфекциях и кишечных инфекциях. Собираются в количестве 20-25мл в стерильные банки или широкогорлые флаконы после промывания желудка кипяченой водой без добавления гидрокарбоната натрия или перманганата калия. Из промывных вод следует забирать первые порции, доставляется материал в лабораторию немедленно. Посев проводится так же как и рвотных масс, только без разведения в физ. растворе.
Правила забора гноя, экссудата и розеолокультуры
Посев производится из воспалительных очагов. Материал забирается стерильным шприцем, пинцетом или тампоном, по возможности из более глубоких отделов, т.к. верхние отделы могут содержать сапрофитную микрофлору. При снятии повязки рекомендуется очистить поверхность от мази, отмерших тканей и только после этого отбирать материал с соблюдением правил асептики. Взятый материал помещают в стерильную пробирку, флакон или чашку Петри и доставляют в лабораторию.
Забор отделяемого проводят двумя ватными тампонами – один для приготовления нативного мазка, второй для посева на питательные среды. Посев производят в пробирку с сахарным бульоном, неоднократно погружая ее в среду, после чего несколько капель сахарного бульона пипеткой засевают в среду Китта-Тароцци или тиогликолевую. Этим же тампоном материал засевают на плотные питательные среды (кровяной агар, ЖСА, Эндо, Сабуро). После инкубирования выделяют чистую культуру, идентифицируют микрофлору по рода и вида и определяют чувствительность к антибиотикам.
Посев из розеол производится для выделения микроорганизмов (при тифо-паратифозных заболеваниях). С целью получения содержимого розеолы кожу над ней обрабатывают спиртом и скарифицируют. На место скарификации наносят капли стерильного желчного или простого бульона, а затем с помощью пипетки переносят во флакон с 50мл желчного бульона. После инкубации 24 часа при 37 градусах материал из флакона пересевают на плотные питательные дифференциально-диагностические среды (Плоскирева, висмут-сульфит агар и т.д.). материал в количестве 0,5мл наносят на поверхность плотной среды и затем равномерно растирают шпателем.
Посев из розеол желается с 8-10 для болезни, когда появляются розеолы на коже. Метод не ранний, но важный в периоде реконвалесценции и при диагностике стертых форм тифо-паратифозных заболеваних, так как в крови возбудители бывают в небольшом количестве.
Правила забора и посева носоглоточной слизи
Производится при менингококковом назофарингите и для выявления носительства менингококка, реже – при других формах менингококковой инфекции. Слизь из носоглотки берется натощак или через 3-4 часа после еды. Стерильный тампон, укрепленный на изогнутой проволоке (угол 120-130 градусов), направляется концом вверх и подводится под мягкое небо в носоглотку. Материал берется при надавливании шпателем на корень языка. После взятия носоглоточной слизи необходимо сразу же сделать посев на теплые чашки с сывороточным агаром, можно с добавлением ристомицина, который ингибирует рост сопутствующей флоры. После посева необходимо незамедлительно поставить чашки в термостат и, не допуская охлаждения, доставить их в лабораторию, так как менингококк очень чувствителен к снижению температуры ниже 36 градусов. Окончательный ответ посева выдается на 4 день исследования. Необходимо помнить, что при менингитах другой этиологии в носоглоточной больного может быть обнаружен менингококк, а так же отрицательные результаты посева не исключают менингококковую этиологию заболевания.
Дата добавления: 2018-09-20 ; просмотров: 271 ; ЗАКАЗАТЬ РАБОТУ
источник
Забор мокроты проводится после провоцирующей отделение мокроты ингаляции. Для ингаляции рекомендуется использовать раствор, в 1 литре стерильной дистиллированной воды которого содержится 150 гр. NaCl и 10 гр Na2CO3 (двууглекислый натрий). Больной вдыхает за процедуру 30-60 мл данной смеси в течение 10-15 минут. После ингаляции усиливается отделение слюны еще до появления кашля, поэтому первую порцию слюны предлагается больному сплюнуть в специальный лоток с хлорамином, а затем собирать мокроту.
Забор промывных вод бронхов.
Промывные воды бронхов забираются у пациентов при отсутствии мокроты, невозможности проведения аэрозольной ингаляции или при безуспешности их.
Забор промывных вод бронхов осуществляет врач-отоларинголог или они забираются при проведении бронхоскопии. При этом во время вдоха вводят в трахею 5-7 мл стерильного изотонического раствора, в результате вызывается кашлевой рефлекс, и промывные воды бронхов собираются в стерильный флакон. У лиц с выраженным глоточным рефлексом при проведении процедуры рекомендуется предварительная анестезия надгортанника, гортани, задней стенки глотки.
Забор промывных вод желудка:
— промывные воды желудка забираются у детей младшего возраста, так как они плохо откашливают мокроту и проглатывают ее;
— мокрота забирается натощак, последний прием пищи должен быть не меньше, чем за 12 часов до взятия промывных вод желудка;
— больному дают выпить 100-150 мл раствора питьевой соды для нейтрализации желудочного содержимого. Для приготовления раствора питьевой соды берут 1 чайную ложку соды на 1 стакан стерильной дистиллированной, а не водопроводной воды, для исключения попадания в желудок кислотоустойчивых сапрофитов;
— больному вводят в желудок желудочный зонд и собирают содержимое желудка в специальный стерильный флакон, который быстро доставляют в лабораторию.
Имеются данные, что наиболее результативен в выявлении МБТ метод, включающий сочетание аэрозольных ингаляций с промывными водами желудка, которые должны забираться через 30 минут после ингаляции. В этом случае повышается процент положительных результатов выявления МБТ.
Забор операционного материала осуществляется в стерильные флаконы без консервантов с немедленной доставкой в лабораторию. Возможно хранение в холодильнике при температуре 4-10°С с небольшим количеством стерильного физиологического раствора или сухим льдом при невозможности быстрой доставки.
Забор анализа мочи на МБТ:
— забирается средняя утренняя порция мочи или вся утренняя порция с последующей доставкой в бактериологическую лабораторию;
— при невозможности быстрой доставки материал не должен храниться в холодильнике больше 48-72 часов, если больше, то добавляются консерванты: 2-3% раствор борной кислоты (срок хранения до 3 суток при комнатной температуре), 0,05-0,1% раствор хлоргексидина биглюконата (срок хранения 3-5 суток).
К микробиологическим методам диагностики туберкулеза относят:
4) молекулярно-биологический метод.
Из перечисленных выше, самым чувствительным методом выявления МБТ является биологический метод, его чувствительность составляет 1-5 микробных тел в 1мл исследуемого материала; на 2 месте — бактериологический метод (чувствительность — 20-100 микробных тел в 1 мл); на 3 месте – бактериоскопический метод (чувствительность более 100 тыс. и более микробных тел в 1 мл). Золотым стандартом выявления больных туберкулезом является сочетание бактериоскопического и бактериологического методов. Биологический метод более дорогой и используется в трудных диагностических случаях.
Разновидностями бактериоскопического метода являются:
— простая бактериоскопия с окраской по Цилю-Нильсену: вначале препарат обрабатывают карболовым раствором фуксина, затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта и докрашивают 0,25% раствором метиленового синего. МБТ выглядят под микроскопом в виде красных палочек на синем фоне (приложение 2, рис. 2);
— люминесцентная микроскопия с применением флюорохромов: аурамин 00, родамин С и другие. Под люминесцентным микроскопом МБТ выглядят в виде желто-зеленых светящихся палочек на черном фоне. При использовании люминесцентной микроскопии информативность метода повышается на 30% (приложение 2, рис.3).
— метод седиментации, метод флотации повышают информативность микроскопического метода на 10%.
Бактериологический (культуральный) метод заключается в посеве мокроты на питательные среды. Стандартной питательной средой для выращивания МБТ служит твердая яичная среда Левенштейна- Йенсена. Существуют так же жидкие питательные среды (система ВАСТЕТ 460 ТВ и др.). Посевы длительно выдерживают в термостате при температуре 37-38°С. Рост колоний на твердых питательных средах происходит за 14-90 дней, на жидких -3-14 дней. Для МБТ человеческого и бычьего видов характерно образование плотных морщинистых колоний кремового цвета (приложение 2, рис. 4).
Преимущества данного метода:
— данным методом можно определить жизнеспособность культуры (способность размножаться, способность к образованию и росту колоний). Если микобактерии туберкулеза выявляются при простой микроскопии, но при посеве роста колоний не наблюдается, то это нежизнеспособные МБТ (образно говоря «микобактерии туберкулеза-трупы»);
— можно определить степень вирулентности МБТ. Быстрорастущие колонии МБТ, это, как правило, более вирулентная культура;
— можно дать количественную характеристику бактериовыделения. Если у больного выявляется при посеве от 1-20 колоний, то это свидетельствует о скудном бактериовыделении; от 21 до 100 колоний — умеренное бактериовыделение; более 100 колоний – обильное бактериовыделение.
Пациенты с обильным бактериовыделением более опасны для окружающих в плане заражения;
— можно определить чувствительность МБТ к противотуберкулезным препаратам и выявить лекарственную устойчивость. Основными методами определения лекарственной чувствительности МБТ являются методы абсолютных концентраций (применяется в России) и пропорций (применяется за рубежом). По своей информативности они равноценны. У больных туберкулезом можно выявить следующие виды лекарственной устойчивости МБТ к применяемым противотуберкулезным препаратам:
1) первичная лекарственная устойчивость – если больной вообще не принимал противотуберкулезные препараты или принимал их менее 3 недель, то есть он заразился изначально лекарственно-устойчивыми штаммами МБТ. Первичная лекарственная устойчивость характеризует состояние микобактериальной популяции на данной территории и важна для эпидемической характеристики заболеваемости;
2) вторичная лекарственная устойчивость – если больной принимал противотуберкулезные препараты более 3 недель и лекарственная устойчивость у него сформировалась в результате неэффективной и неадекватной химиотерапии;
3) множественная лекарственная устойчивость – если выявляется устойчивость как минимум к сочетанию изониазида и рифампицина, независимо от наличия или отсутствия лекарственной устойчивости к другим препаратам;
4) поливалентная лекарственная устойчивость- выявление лекарственной устойчивости к препаратам основной группы и резервным;
5) монорезистентность — выявление устойчивости к одному препарату;
6) перекрестная лекарственная устойчивость – выявление лекарственной устойчивости к препаратам одной группы по происхождению (например, группа аминогликозиды: стрептомицин, канамицин).
Важно отметить, что в последние годы отмечается рост лекарственноустойчивых форм туберкулеза среди взрослого населения.
В настоящее время за рубежом и в последние годы в России для выявления живых МБТ применяется радиометрическая система ВАСТЕТ. МБТ культивируют в жидкой питательной среде, где в качестве источника углерода используется меченая 14С пальмитиновая кислота. Преимуществом новой микробиологической методики является возможность быстрого получения результата исследования – через 12-24 дня. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся:
— высокая себестоимость исследования;
— необходимость применения радиоактивных изотопов и специального радиометрического оборудования, сложность работы с изотопной технологией;
— необходимость дополнительного посева на плотную питательную среду при возникновении проблем с идентификацией возбудителя или интерпретации результатов. Данная методика не дает качественной характеристики возбудителя и не позволяет определить лекарственную чувствительность возбудителя.
Биологический метод заключается в заражении морских свинок мокротой или другим патологическим материалом, предварительно обработанным серной кислотой для уничтожения неспецифической микрофлоры. Исследуемый материал вводится подкожно в паховую область, яичко, внутрибрюшинно. Ежедневно животному вводится кортизон для снижения иммунитета. При положительном результате через 1 месяц у животного формируется генерализованный туберкулез, животное забивают и выделенные органы исследуют макроскопически, гистологически и бактериологически. Биологический метод применяется для выявления не только типичных, но и биологически измененных форм возбудителя, в частности L- трансформированных и фильтрующихся форм.
Иммуноферментный анализ. Впервые его применил для выявления противотуберкулезных антител Е. Nassau в 1976 году. Он использовал в качестве антигена фильтрат M. tuberculosis H37Rv. Преимуществами данного метода являются:
— высокая производительность метода;
— простота в проведении анализа и регистрации результатов;
-возможность использования микроколичества диагностического
— более безопасен и экономичен по сравнению с радиоиммунологическим
— специфичность метода (частота отсутствия реакции на препарат у здоро
вых лиц) колеблется от 86-97%, чувствительность метода (частота положи
тельных ответных реакций у лиц с активной туберкулезной инфекцией) —
Молекулярно-генетические методы обнаружения М. tuberculosis основаны на полимеразной цепной реакции (ПЦР). Метод известен с 1985 года и сущность его состоит в выявлении в составе биологического материала фрагментов цепи ДНК или РНК, специфических для данного возбудителя. Для поиска возбудителя используют различный патологический материал (мокроту, промывные воды трахеи, бронхов, плевральную, спинномозговую жидкость и другие объекты). Принцип метода состоит в циклическом повторении трех стадий реакции:
1) денатурации ДНК при нагревании;
2) гибридизации искусственно синтезированных олигонуклеотидов с фланговыми участками цепей амплифицируемого фрагмента ДНК (так называемых «праймеров» или «затравочных» фрагментов);
3) синтеза (достройки) цепи фрагмента ДНК с помощью термостабильной ДНК-полимеразы. Многократное удвоение цепей ДНК (30-40 циклов) позволяет в течение нескольких часов умножить (амплифицировать) специальный участок ДНК в геометрической прогрессии, а затем идентифицировать его (при электрофорезе в агарозном геле в присутствии красителя этидия бромида синтезированный фрагмент ДНК выявляется в виде светящейся под действием ультрафиолета полосы).
— метод обладает высокой чувствительностью (теоретически можно определять единичные М. tuberculosis в образце). По сравнению с культуральными методами, при обследовании больных туберкулезом методом ПЦР число положительных результатов увеличивается на 50-70%.
— быстрота проведения анализа (1-2 дня), что чрезвычайно ценно для клинической практики.
— данный метод позволяет значительно улучшить распознавание этиологии патологического процесса у пациентов без выделения микобактерий.
— информативен при дифференциальной диагностике туберкулезного плеврита, менингита, мочеполового туберкулеза.
— эффективен в отношении возбудителей с высокой антигенной изменчивостью (в том числе L-форм), определение которых требует длительного культивирования и сложных питательных сред.
— перспективен при дифференциации М. tuberculosis и нетуберкулезных микобактерий (в том числе и после культивирования микобактерий, особенно на жидких питательных средах с использованием систем типа BACTEC).
— перспективен для быстрого определения лекарственной устойчивости и, следовательно, необходим для своевременной коррекции лечения (Gene Xpert MTB/RIF (R ) – получение результата через 90 мин, ТБ –Биочип ( HR Fq) — 24 ч, ДНК – стриповый Hain Lifescience ( HRE Fq Am/Сm)- 5ч).
— имеется возможность штаммовой идентификации, что позволяет определять внутривидовые различия возбудителя туберкулеза и представляет интерес для эпидемиологических исследований и определения роли суперинфекции при рецидивах туберкулеза.
— проблема специфичности ПЦР в диагностике туберкулеза обусловлена высоким риском ложноположительных результатов, поскольку продукты амплификации (фрагменты ДНК) легко могут попасть в исследуемые образцы и служить матрицей для новых реакций. Это определяет очень жесткие требования к технологии проведения анализов, в том числе раздельные помещения для каждой из трех стадий анализа. Проблема может быть решена за счет инактивации загрязняющих молекул специальными реагентами и совершенствования технологии подготовки клинических образцов (выделение ДНК на микропористых частицах стекла, иммуномагнитная сепарация микобактериий и пр.
— метод не позволяет определять степень жизнеспособности выявляемых микобактерий.
В связи с этим, использование методов, основанных на амплификации фрагментов генома микобактерий (ПЦР), допускается в России как дополнительный метод ускоренной дифференциальной диагностики туберкулеза для получения ориентировочных результатов при обязательном параллельном применении классических микробиологических методов.
Молекулярно-биологические методы могут проводиться в лабораториях краевых, областных и крупных городских противотуберкулезных учреждений, использующих учрежденные Минздравом России наборы реагентов (тест-системы) и имеющих лицензию на работу с микроорганизмами III-IV групп патогенности. Технология проведения ПЦР приводится в описаниях и инструкциях соответствующих наборов (тест-систем).
источник
Промывание желудка – одна из самых распространенных методик лечения острых пищевых или химических отравлений, в домашних условиях можно воспользоваться способом без зонда, но если у человека тяжелое состояние может помочь только зондовый метод (лучше проводить в больнице, под присмотром медперсонала). Правильно поведенная процедура помогает вывести из организма токсические вещества (даже яды), улучшает состояние больного и способствует быстрому выздоровлению. В некоторых случаях своевременная помощь может спасти жизнь.
Суть процедуры промывания в откачивании токсичного содержимого из желудка пациента, но иногда она используется для диагностики заболеваний желудочно-кишечного тракта (ЖКТ). Способов как прочистить желудок всего два – упрощенный и с помощью зонда. Первый метод можно использовать в домашних условиях, а вот для проведения процедуры с помощью зонда необходимы условия медклиники. Выбор жидкости и расчет ее количества, измерение длины трубки (зонда) и аккуратное введение ее в тело – задача медперсонала.
В большинстве случаев промывка желудка проводится в случаях отравления алкоголем, медикаментами или едой (некачественные продукты питания, ядовитые грибы). Такая форма отравления считается легкой, но при определенном стечении обстоятельств может привести к летальному исходу. Если пациент находится в бессознательном состоянии, присутствуют судороги — самостоятельно делать промывание запрещено. Тактика лечения напрямую зависит от определения вида вещества, которым отравился пациент. Иногда промывку желудка рекомендуют проводить при переедании.
Кроме отравлений, показаниями к проведению очистки желудка могут быть разные острые и хронические проблемы с органами ЖКТ:
- сужение выходного отдела желудка;
- патологии ЖКТ, при которых активно вырабатывается слизь и мешает нормальному пищеварению;
- снижение тонуса мышц органов желудочно-кишечного тракта;
- непроходимость кишечника;
- попадание токсических веществ в ЖКТ (например, мочевина при почечной недостаточности).
Прежде чем приступить к процедуре, необходимо выяснить у пациента что было выпито или съедено перед появлением симптомов отравления. Если больной находится в сознании, эту информацию можно получить непосредственно от него. Но если человек не способен ответить на вопросы, тогда на помощь придет анализ состава рвотных масс. Очень важно, чтобы у человека, который будет проводить промывание был достаточный опыт, иначе есть риск осложнений (разрыв пищевода, аспирация дыхательных путей). На доврачебном этапе нужно внимательно изучить симптомы больного.
Как и для проведения другой процедуры, стоит знать противопоказания для промывания желудка, при обнаружении признаков – откладывают эту манипуляцию:
- сужение пищевода;
- кровотечение органов ЖКТ;
- ожог гортани, пищевода или слизистых желудка кислотами и щелочами (тяжелая степень выраженности);
- нарушение мозгового кровообращения;
- инфаркт миокарда, нарушения сердечного ритма, нестабильная стенокардия;
- бессознательное состояние при отсутствии предварительной интубации;
- отсутствие гортанного или кашлевого рефлекса;
- беременность (все периоды);
- судорожное состояние пациента.
При отравлении концентрированными кислотами, щелочными растворами, уксусом, бытовой химией или скипидаром вызывать рвоту категорически запрещено, ведь обратное прохождение этих веществ по пищеводу и гортани может вызвать сильный ожог. В таких случаях используют метод промывания с зондом, этой методикой владеют работники станций скорой помощи и медперсонал больниц. Сорбенты, как средство для связывания и выведения токсинов, ядов, бактерий или аллергенов можно использовать не во всех ситуациях, лучше посоветоваться с врачом.
Резиновая или пластиковая трубка для промывки желудка бывает двух видов – толстый зонд (диаметр 10-13 мм) или тонкий зонд (диаметр 5-9 мм). Эту трубку спокойными и аккуратными движениями проводят в желудок, потом на свободный край надевается воронка для вливания промывочного раствора. Чтобы научится использовать зонд для промывания желудка, медработники отрабатывают практические навыки на муляжах, но в реальной практике бывают ситуации, когда пациент (например, в алкогольном опьянении) слишком возбужден, тогда перед процедурой применяют седативные препараты.
При промывании с помощью зонда нужно следить за количеством введенной и выведенной жидкости, разница должна быть не больше 1% от массы тела пациента. В технике проведения процедуры есть несколько этапов:
- необходимо убедиться или пациент находится в сознании;
- выбрать правильную позу (положение сидя у спинки стула, или положение лежа на боку);
- грудную клетку больного накрыть фартуком либо пеленкой;
- измерить необходимую длину трубки зонда (от мочки уха, провести по передней стенке грудины до мечевидного отростка);
- закругленный конец обильно смазать вазелиновым маслом или глицерином;
- положить конец трубки на язык (корень) пациента, попросить делать глотательные движения (зонд должен медленно двигаться по пищеводу до отметки длины);
- убедиться, что зонд дошел до желудка;
- присоединить к трубке воронку, держа ее на уровне пупка налить до 1 литра воды;
- медленно поднять воронку до лица;
- когда вода достигнет устья воронки, опустить ее ниже уровня пупка;
- содержимое желудка начнет выходить, собрать его в специальную емкость, первую порцию отправляют на анализы;
- процедуру повторяют до того момента, пока воды не станут чистыми (от 5 до 10 литров воды);
- окончив манипуляцию, воронку отсоединяют и постепенно вынимают зонд, обернув в полотенце или салфетку.
Промывка желудка без применения зонда – это так называемый ресторанный метод. Его часто используют на догоспитальном этапе, чтобы быстро облегчить состояние пациента, но такая манипуляция неспособна полностью очистить желудок. Растворы для промывания можно приготовить в домашних условиях, приобрести в аптеке либо использовать обычную кипяченую воду. Необходимо выпить достаточное количество жидкости и вырвать ее вместе с содержимым желудка, если рвота не началась сама — ее стимулируют.
При правильном проведении процедуры можно избавиться от интоксикации в домашних условиях, при возможности стоит найти помощника. Необходимо точно знать алгоритм действий при проведении манипуляции и тщательно следовать ему:
- придать больному правильную позу (сидя на стуле или лежа на боку);
- поставить емкость для сбора промывных вод;
- дать больному выпить 500 мл воды за раз (общее количество жидкости – 5-10 литров);
- наклонить пациента над емкостью, фиксируя при этом голову;
- если рвота не возникла спонтанно – стимулировать ее надавливанием на корень языка либо использовать рвотное лекарственное средство;
- процедуру проводят до появления чистых, без остатков пищи промывочных вод.
Техника проведения процедуры промывки желудка у детей такая же, как у взрослых пациентов. Но есть несколько особенностей. Очень важно делать такую манипуляцию с помощником, который будет твердо фиксировать положение ребенка. Ребенку проще перенести «ресторанный» метод промывания, его оборачивают в простыню и аккуратно укладывают набок. Важно правильно рассчитать количество жидкости. Для новорожденных разовая доза жидкости 30-50 мл, от 1 до 6 месяцев – 100 мл, от полугода до года – 200 мл, для старших деток используют формулу – 200+100*возраст (лет).
Поскольку, алгоритм промывания желудка через зонд состоит из множества этапов, и такая процедура неприятна пациенту, если нет острой необходимости ее проводят упрощенным (без зонда) методом. Но есть случаи, в которых без применения прибора не обойтись. Например, если человек находится в бессознательном состоянии или у него неадекватное поведение. Кроме того, некоторые вещества способны обжечь слизистые оболочки при выходе обратно через пищевод.
Зонд всегда есть в аптечке у работников скорой помощи, но не всегда у больного дома. Но даже если удалось получить зонд, без опыта и знания дела проводить такую манипуляцию опасно для здоровья человека, поэтому нужно ограничиться «ресторанным» методом. После проведения процедуры необходимо дать организму время восстановиться, нужен покой и облегченное питание (переедание категорически запрещено). После очистки желудка рекомендуют принимать сорбенты (активированный уголь, «Сорбекс», «Энтеросгель») и пить воду, несладкие чаи.
Техника проведения процедуры проста, но стоит получить у врача консультацию, как промывают желудок. При отравлении важно начать быстро действовать, а это значит применять те средства, которые есть под рукой:
- раствор для промывания;
- чистая емкость для сбора промывных вод (ведро, таз), собранная жидкость может помочь врачам в диагностике болезни;
- средства для вызывания рвоты (ложка, палочка, лекарственные препараты);
- средства защиты для помощников (стерильные защитные перчатки, фартук), чтобы предотвратить попадание бактерий и других токсинов.
источник