К микробиологическим показателям безопасности питьевой воды относят общее микробное число, содержание бактерий группы кишечной палочки (общие колиформные бактерии и колифаги), споры сульфитредуцирующих клостридий и цисты лямблий.
В зависимости от характеристик водного источника с целью безопасности воды могут проверяться и такие показатели, как паразитологические и радиологические.
Санитарные нормы показателей качества питьевой воды
Нормативы основных показателей качества воды по требованиям санитарных норм РФ, ВОЗ, США, ЕС
| Наименование показателей | Ед. измерения | СанПиН 2.1.4.1074-01 | СанПиН 2.1.4.1175-02 | ВОЗ | USEPA (США) | Директива ЕС 98/83/ЕС |
| Органолептические показатели | ||||||
| Запах | баллы | не более 2..3 | отсутствие | — | приемлемый | |
| Привкус | баллы | не более 2..3 | отсутствие | — | приемлемый | |
| Цветность | градусы | 20 (35) 1 | не более 30 | — | ||
| Мутность | ЕМФ (единицы мутности по формазину) | 2,6 (3,5) 1 | 2,6..3,5 | — | — | 2,3 |
| или мг/л (по каолину) | 1,5 (2) 1 | 1,5..2,0 | 0,5 | — | — | |
| Химические показатели | ||||||
| Водородный показатель | ед. рН | в пределах 6..9 | в пределах 6..9 | — | 6,5..8,5 | 6,5..8,5 |
| Общая минерализация(сухой остаток) | мг/л | 1000 (1500) 1 | ||||
| Жесткость общая | мг-экв/л | 7,0 (10) 1 | — | — | 1,2 | |
| Окисляемость перманганатная | мг О2/л | — | — | |||
| Нефтепродукты, суммарно | мг/л | 0,1 | 0,1 | — | — | — |
| Поверхностно-активные вещества (ПАВ), анионоактивные | мг/л | 0,5 | 0,5 | |||
| Фенольный индекс | мг/л | 0,25 | 0,25 | — | — | — |
| Щелочность | мг НСО3 — /л | не нормируется | не нормируется | — | — | |
| Неорганические вещества | ||||||
| Алюминий (Al 3+ ) | мг/л | 0,5 | 0,5 | 0,2 | 0,2 | 0,2 |
| Азот аммонийный | мг/л | 1,5 | — | 0,5 | ||
| Железо (Fe,суммарно) | мг/л | 0,3 (1,0) 1 | 0,3 (1,0) 1 | 0,3 | 0,3 | 0,2 |
| Марганец (Mn,суммарно) | мг/л | 0,1 (0.5) 1 | 0,1 (0,5) 1 | 0.5(0.1) | 0.05 | 0.05 |
| Нитраты (по NO3 — ) | мг/л | |||||
| Нитриты (по NO2 — ) | мг/л | |||||
| Сульфаты (SO4 2- ) | мг/л | |||||
| Фториды (F) | мг/л | 1,5 | 1,5 | 1,5 | 2,0..4,0 | 1,5 |
| Хлориды (Cl-) | мг/л | |||||
| Цинк (Zn 2+ ) | мг/л | |||||
| Микробиологические показатели | ||||||
| Термотолерантные колиформные бактерии | Число бактерий в 100 мл | отсутствие | отсутствие | отсутствие | — | отсутствие |
| Общие колиформные бактерии | Число бактерий в 100 мл | отсутствие | отсутствие | отсутствие | — | отсутствие |
| Колифаги | Число бляшкообразующих единиц в 100 мл | отсутствие | отсутствие | — | — | — |
| Общее микробное число | Число образующих колонии микробов в 1 мл | — |
1. по указанию Главного государственного санитарного врача
Классификация основных методов обезвреживания сточных вод
Способы очистки и обезвреживания сточных вод подразделяются на механические, физико-химические, химические и биологические.
Механические способы очистки сточных вод от примесей заключаются в их отстаивании и фильтровании, в частности, через полупроницаемые мембраны под давлением.
Физико-химические методы основаны на применении флотации, экстракции и адсорбции вредных примесей, отгонки их с водяным паром. Разновидностью физико-химических методов являются термические, например, испарение воды при нагревании и сжигании органической части сухого остатка. Химические методы очистки сточных вод основаны на использовании окислительно-восстановительных, электрохимических процессов, реакций нейтрализации и перевода вредных веществ в неактивную безвредную форму.
Биологический метод заключается в разложении и окислении вредных примесей с помощью микроорганизмов. Среди встречающихся в почве микроорганизмов наиболее многочисленными являются грибы, водоросли и бактерии. Они «атакуют» содержащиеся в сточных водах органические вещества, которые представляют собой прекрасную питательную среду для микробов, и разлагают углеводы, жиры и другие соединения на двуокись углерода, воду и минеральные соли. Различают процессы биологической очистки, протекающие в естественных и искусственно созданных условиях, проводимых на специальных очистных станциях.
Схемы водообеспечения и водоотведения промышленных предприятий.
источник
Несоответствие воды микробиологическим нормам, так же как и химическим, делает ее непригодной для питья. Если Ваш источник водоснабжения не защищен от прямого воздействия окружающей среды или коммунальные системы устарели или давно не чистились, то сделать микробиологический анализ воды просто необходимо. От этого зависит Ваше здоровье и безопасность! Особенно это важно для тех, кто пользуется колодцем. Колодезная вода – грунтовая, она на прямую контактирует с почвами, а значит, грозит «напоить» Вас и нитратами, и тяжелыми металлами, и аммиаком, и, конечно, вредными органическими веществами, которые попадают в почву в результате деятельности сельскохозяйственных ферм или угодий.
В таблице 1 представлены микробиологические показатели действующего норматива СанПиН 2.1.4.1074-01 для питьевой воды:
Таблица 1. Микробиологические нормативы для питьевой воды
| Показатель | Норматив СанПиН 2.1.4.1074-01 |
|---|---|
| Общая микробная численность | Не более 50 КОЕ в 1 мл |
| Общие колиформные бактерии | Отсутствие в 100 мл |
| Термотолерантные колиформные бактерии | Отсутствие в 100 мл |
| Колифаги | Отсутствие в 100 мл |
| Споры сульфитредуцирующих бактерий | Отсутствие в 20 мл |
Стандартный микробиологический анализ питьевой воды в МГУ включает определение трех показателей: общего микробного числа, количества общих колиформных и термотолерантных колиформных бактерий.
Расширенный микробиологический анализ воды включает анализ пяти показателей: общего микробного числа, количества общих колиформных бактерий, количества термотолерантных колиформных бактерий, титр колифагов и содержание спор сульфитредуцирующих бактерий.
Часто на наших участках или поблизости имеются водоемы, где мы и наши дети с удовольствием любим провести время. Конечно, вода в данных водоемах не является питьевой, но ее безопасность для человека также, как и питьевая, регламентируется. В таблице 2 представлены микробиологические показатели действующего норматива по гигиеническим требованиям к охране поверхностных вод (СанПиН 2.1.5.980-00)
Таблица 2. Микробиологические нормативы для рекреационного водопользования, а также в черте населенных мест
| Показатель | Норматив СанПиН 2.1.5.980-00 |
|---|---|
| Общие колиформные бактерии | Не более 500 КОЕ в 100 мл |
| Термотолерантные колиформные бактерии | Не более 100 КОЕ в 100 мл |
| Колифаги | Не более 100 БОЕ в 100 мл |
| Возбудители кишечных инфекций (анализ бактерий из сем. Enterobacteriaceae рода Salmonella) | Вода не должна содержать возбудителей кишечных инфекций (полное отсутствие в 1000 мл) |
Микробиологический анализ воды, предназначенной не для питья, включает определение количества двух показателей: общих колиформных и колиформных термотолерантных бактерий.
Помимо двух основных показателей мы предлагаем провести дополнительный анализ на содержание: колифагов, условно-патогенных дрожжей и микромицетов (частых спутников опортунистических заболеваний) и индекса самоочищения водоёма.
При значительном превышении нормативов СанПиН 2.1.5.980-00, а также возможном фекальном загрязнении водоёма, мы предлагаем провести анализ на наличие возбудителей кишечных инфекций (род Salmonella и Enterococcus).
Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 часов, видимые с увеличением в 2 раза. Данный индикатор выявляет потенциальных бактерий, способных причинить вред здоровью человека.
Общие колиформные бактерии (ОКБ) – грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37+1) °С в течение (24-48) часов. Многие представители данной группы являются микроорганизмами нормальной микрофлоры желудка, поэтому превышение данной группы микроорганизмов может говорить о возможно антропогенном (в том числе и фекальном) загрязнении воды.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44±0,5) °С в течение 24 часов. Также, как и ОКБ являются индикаторной группой, однако более устойчивые в окружающей среде: вот почему обнаружение данной группы микроорганизмов в воде может говорить об однозначном загрязнении ее продуктами жизнедеятельности человека.
Колифаги, определяемые стандартным методом (МУК 4.2.1018-01), являются вирусами кишечной палочки (Escherichia coli) и рассматриваются эпидемиологами как дополнительный, а порой и более чувствительный, метод в определении загрязнения воды микроорганизмами группы кишечной палочки. Вирусные частицы, и в частности колифаги, более устойчивы к окружающей среде, чем их бактерии-хозяева. В связи с этим, наличие колифагов может служить достоверной меткой о более давнем фекальном загрязнении источника воды. Показана прямая корреляция между содержанием колифагов в воде и опасных для человека энтеровирусов, поэтому наличие колифагов в воде может говорить о вирусном заражении источника. Действующий нормативный документ (СанПиН 2.1.4.1074-01) подразумевает отсутствие колифагов в 100 мл воды.
Сульфитредуцирующие клостридии – спорообразующие анаэробные палочковидные микроорганизмы, являющиеся дополнительным микробиологическим показателем фекального загрязнения водоема. В отличие от относительно неустойчивых колиформных и термотолерантных колиформных бактерий, споры клостридий могут сохраняться в водоемах долгое время. Клостридии встречаются в кишечнике человека и домашних животных, однако, при попадании с водой в большом количестве могут вызвать пищевые отравления. К сульфитредуцирующим клостридиям относятся в том числе и опасные для человека клостридии (Clostridiumbotulinum, Clostridium perfringens, Clostridium tetani), вызывающие тяжелейшие заболевания. Согласно действующему нормативу (СанПиН 2.1.4.1074-01) споры клостридий должны отсутствовать в 20 мл воды.
К условно-патогенным дрожжам и микромицетам (плесени) относят большую неоднородную группу грибных организмов, способных сапротрофно расти при 37 °С. В нее входят такие представители, как Candida albicans и Cryptococcus neoformans, которые являются частым фактором оппортунистических заболеваний человека, вызывая кандидозы (грибковые заболевания кожи), молочницы и проч. Другие организмы микромицеты (Cladosporium cladosporioides, Aspergillusniger) могут являться активными сенсебилизаторами аллергических реакций, а иногда и самими аллергенами. В РФ не нормируется вода по плесеням и дрожжевым организмам в воде.
Общее число микроорганизмов не нормируется в воде водоемов в зонах рекреаций, поскольку уровень этой группы микроорганизмов в большей мере зависит от природных особенностей каждого объекта, времени года и т.п.
Однако при выборе нового источника водоснабжения или места рекреации в воде водоёмов дополнительно следует определять общую микробную численность, вырастающую:
- при температуре 37 °С в течение 24 часов;
- при температуре 22 °С в течение 72 часов.
- ОМЧ при 37 °С представлена большей частью алохтонной микрофлорой (внесенную в водоем в результате антропогенного загрязнения, в том числе фекального);
- ОМЧ при 20-22 °С представлена, помимо алохтонной, аборигенной микрофлорой (естественной, свойственной для данного водоёма).
Соотношение численности этих групп микроорганизмов позволяет судить об интенсивности процесса самоочищения. При завершении процесса самоочищения коэффициент ОМЧ 22 °С/ ОМЧ 37 °С. В местах загрязнения хозяйственно-бытовыми сточными водами численные значения обеих групп близки.
Показатель позволяет получить дополнительную информацию о санитарном состоянии водоемов, источниках загрязнения, процессах самоочищения.
источник
О безопасности воды в эпидемиологическом отношении судят по результатам ее санитарно-бактериологического исследования. Микробиологические показатели питьевой водопроводной воды нормированы ГОСТ 2874-82 «Вода питьевая. Гигиенические требования и контроль за качеством». Общая бактериальная обсемененность (микробное число) не более 100 клеток в 1 г, коли-титр – не менее 300 мл, коли-индекс – не более 3.
Коли-титр – наименьший объем воды, в котором содержится одна кишечная палочка.
Коли-индекс – количество кишечных палочек в 1 дм 3 воды.
В СанПиНе 2.1.4.1074-01»Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества», введенного в действие с 1 января 2002 г, предъявляются более жесткие требования к питьевой воде. Для оценки санитарного состояния воды в ней определяют общее микробное число – не более 50 КОЕ/см 3 ; термотолерантные колиформные бактерии – не допускаются в 100 см 3 ; общие колиформные бактерии также должны отсутствовать в 100 см 3 ; споры сульфитредуцирующих клостридий — не допускаются в 20 см 3 ; колифаги – в 100 см 3 . Исследование питьевой воды проводят один раз в квартал при пользовании городским водопроводом и один раз в месяц при наличии собственных источников водоснабжения.
Общее микробное число воды (ОМЧ) – количество мезофильных аэробных и факультативноанаэробных микроорганизмов, способных образовывать колонии на питательном агаре при 37 0 С в течение 24 часов.
К общим колиформным бактериям относятся грамотрицательные не образующие спор палочки, не обладающие оксидазной активностью, ферментирующие лактозу или маннит с образованием альдегида, кислоты и газа при температуре 37 0 С в течение 24 часов.
Термотолерантные колиформные бактерии обладают всеми признаками общих колиформных бактерий, которые, кроме этого способны ферментировать лактозу до кислоты и газа при температуре 44 0 С в течение 24 часов.
Сульфитредуцирующие клостридии (преимущественно Clostridium perfringens) – спорообразующие анаэробные палочковидные бактерии, редуцирующие сульфит натрия на железо-сульфитном агаре в течение 24 часов при температуре 44 0 С.
Колифаги – бактериальные вирусы, способные лизировать кишечную палочку и формировать зоны лизиса через 18±2 часа при температуре 37 0 С на ее газоне на питательном агаре. Колифаги – индикаторы очистки питьевой воды в отношении энтеровирусов.
В отдельных случаях при санитарной оценке воды в качестве санитарно – показательного микроорганизма наряду с БГКП используют энтерококки. Так, в Международном Европейском стандарте на питьевую воду наличие энтерококка определяют в качестве дополнительного показателя фекального загрязнения воды.
Очистка и дезинфекция питьевой воды состоит из нескольких этапов:
1. Отстаивание в специальных отстойниках. При этом удаляются взвеси, нежелательные привкусы и запахи, происходит обесцвечивание, обессоливание и опреснение воды. Для ускорения отстаивания применяют коагулянты.
2. Фильтрование через слой речного песка. В верхних слоях фильтра формируется биологическая пленка, состоящая из содержащихся в воде примесей и хлопьев коагулянтов, на которых оседает большое количество микроорганизмов.
3. Обеззараживание профильтрованной воды, т.е. удаление оставшихся в воде микроорганизмов, среди которых могут быть и патогенные, с помощью различных дезинфицирующих средств (с помощью окислителей, путем озонирования, облучения ультрафиолетом, обработки ультразвуком).
Очистка сточных вод. Биологические методы очистки делятся на аэробные и анаэробные.
В свою очередь,аэробная очистка может протекать в естественных и в искусственно создаваемых условиях.
Очистка в естественных условиях проводится путем фильтрования сточных вод через слой почвы на полях орошения или полях фильтрации (почвенные методы очистки), а также в очистных прудах.
При аэробной очистке в искусственных условиях процесс очищения ведут в специальных сооружениях: в биофильтрах и аэротенках. В аэротенках процесс очистки близок к естественным способам очистки, но интенсифицируется путем дополнительного насыщения кислородом. При этом активный ил (биоценоз микроорганизмов, с помощью которых осуществляется очистка) свободно плавает в воде в виде хлопьев. В биофильтрах биологическая очистка происходит при участии микроорганизмов, прикрепленных к биопленке. При аэробной очистке протекают интенсивные процессы по минерализации органических веществ различными гетеротрофными микроорганизмами, а также протекает активная нитрификация.
Анаэробная очистка проводится в искусственно создаваемых сооружениях – метантенках, септиктенках и двухъярусных отстойниках. В них осуществляется обработка твердой фазы сточных вод (осадков с решеток из первичных отстойников, а также активный ил и биопленка). При анаэробной очистке происходят различные микробиологические процессы (гниение, различные типы брожения). В результате, сложные органические соединения (белки, жиры, углеводы) сточных вод превращаются в жирные кислоты, спирты и газообразные вещества (диоксид углерода, аммиак, метан, водород). Остаток твердой фазы сточных вод, не разрушенный микроорганизмами обезвоживают, сушат и используют в виде удобрения, а спрессованный в виде брикетов – в качестве топлива.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Компания «Эко-Дефенс» более 10 лет производит профессиональную дезинсекцию, дезинфекцию, дератизацию. Также мы проводим экспертизу и анализы воды, почвы, воздуха, радиации и шума в Москве и Московской области. Мы используем проверенные и надежные гипоаллергенные препараты и гарантируем 100%-е качество выполненных услуг. Точную стоимость услуги, вы можете узнать позвонив по телефону 8 (495) 151-84-77. Менеджер уточнит площадь квартиры, дома или участка, удаленность от МКАД и еще ряд параметров и даст вам развернутый ответ по стоимости, методах работы и времени приезда специалиста.
При использовании воды для питья и бытовых нужд, применении на предприятиях сферы обслуживания крайне важное значение приобретает такой фактор, как ее микробиологические характеристики. При нарушении санитарных и эпидемиологических, а также гигиенических норм употребление жидкости не допускается, а также считается опасным для жизни и здоровья человека. Наша лаборатория в Москве проводит исследования на наличие факторов риска, выдает квалифицированные экспертные заключения. Подробный прайс позволяет оценить стоимость обычной и расширенной проверки заранее. Частным лицам рекомендуется регулярно делать исследование скважин и колодезной воды, используемой при питье. Станция принимает образцы от населения, а также сама предоставляет услуги лаборантов с выездом для забора проб.
Биологический анализ воды представляет собой исследование, нацеленное на определение чистоты и качества жидкости. Наличие в составе бактериальной флоры должно отслеживаться в природных источниках не реже двух раз в год. Для предприятий и организаций периодичность контроля зависит от вида деятельности. Преимущественно, используется ежемесячный режим проверки. Такие муки вполне оправданы. В результате контакта с окружающей средой или неудовлетворительного состояния коммуникаций, используемых для обеспечения водоснабжения, качество транспортируемой и используемой в питьевых целях среды может значительно ухудшиться. Исправить положение помогает тщательный контроль, а также своевременное принятие мер безопасности самими собственниками.
Микробиологические анализы сточной воды и жидкости, подаваемой через системы водоснабжения или получаемой из колодцев, скважин, необходимы для выявления целого комплекса потенциально опасных веществ. К числу наиболее часто встречающихся примесей можно отнести:
- колиформные бактерии (обычные и термотолерантные);
- споры сульфитредуцирующей бактериальной флоры;
- общую микробную массу.
Кроме того, в составе сточных и грунтовых вод, в виде примесей, попадающих в питьевые и хозяйственные источники, можно обнаружить такие компоненты, как нитраты, аммиак, тяжелые металлы. Определение безопасности предоставленных на экспертизу образцов проходит с использованием нормативов СанПиН 2.1.4.1074-01.
Все микробиологические исследования воды можно условно поделить на несколько категорий, исходя из их полноты и типов исследуемых объектов. Стандартный вариант подразумевает оценить пригодность использования источника и проистекающей из него среды в питьевых целях. Расширенное исследование изучает пять показателей, позволяет получить более подробные и точные сведения о содержании в жидкостях потенциальной опасной концентрации бактериальной флоры. Отдельно рассматривается проверка поверхностных водоемов. К ним относятся реки, пруды, бассейны. Для них действует другой норматив, но проведение исследований на пригодность для купания также обязательно. Кроме того, без проверки не стоит производить и забор воды для технических нужд.
Микробиологическая экспертиза и анализ воды из колодца, скважины, источника магистрального водоснабжения позволяет обеспечивать постоянный и полный контроль за качеством питьевого сырья. Подвергать проверке периодически рекомендуется и бутилированную продукцию, используемую в кулерах, особенно если интенсивность потребления невысока, и есть условия для размножения патогенных микроорганизмов. При расширенном формате исследований к проверке воды на общее микробное число и колиформные бактерии добавляется проверка на титры колифагов и наличие сульфитредуцирующих бактериальных спор (в объеме на 20 мл). В норме все показатели, кроме первого, должны быть нулевыми, в нем допускается концентрация до 50 КОЕ /мл.
Микробиологический анализ воды СЭС включает в себя и проверку так называемых поверхностных водоемов — источников стоячей или открытой среды, используемой для купания, технических нужд, содержания животных и рыб. В рамках рекреационного водопользования требуется контролировать преимущественно наличие возбудителей, способных вызывать кишечные инфекции — энтеробактерии, в том числе рода Salmonella. Кроме того, рекомендуется дополнительно контролировать наличие дрожжевых структур, относящихся к категории условно-патогенной флоры. Микромицеты, также довольно часто встречающиеся в открытых водоемах, требуют исследования наравне с прочими показателями, поскольку представляют значительную опасность для здоровья человека.
Установленные на микробиологический анализ воды цены во многом зависят от полноты и объемов исследований. Но одним из самых важных базовых параметров контроля всегда остается ОМЧ или общее микробное число. В него включаются все выявленные бактерии мезофильной группы, аэробные и анаэробные микроорганизмы. Проверка производится путем посева жидкого содержимого пробы в питательную среду — агар, с выдерживанием образца в течение суток при комфортной для протекания процессов размножения температуре (+37 градусов Цельсия). Разумеется, выполнять контроль должны исключительно эксперты, в условиях лаборатории. Проверка позволяет выявить потенциальную угрозу для человека и вовремя принять меры безопасности.
Выполняя отбор проб воды на микробиологический анализ, специалисты санэпидемстанции обязательно учитывают объемы заказываемых исследований. Так, при проверке на ОКБ — общие колиформные бактерии (один из базовых показателей), выявляется возможное загрязнение питьевых или поверхностных водных ресурсов фекальными стоками. Исследование проводится в лаборатории, с использованием современного и производительного оборудования, позволяющего с точностью установить концентрацию опасных веществ. Но этот индикатор нельзя считать достаточно надежным. Именно поэтому дополнительно проводится проверка на содержание ТКБ — термотолерантной формы этого типа бактериальной флоры, дающей более точные результаты.
Санитарно-микробиологический анализ питьевой воды позволяет эффективно и достоверно обнаруживать многие виды опасных патогенных микроорганизмов. В том числе, и колифаги. Они относятся к разряду вирусов, распространяющих кишечную палочку. Выполняется их обнаружение при помощи специализированного, расширенного исследования. Считается, что этот метод более достоверен в выявлении загрязненных источников по той причине, что позволяет производить оценку не по наличию самих бактерий, а по целому ряду продуктов их жизнедеятельности. Наличие колифагов в воде является достоверным подтверждением того, что источник был ранее заражен бактериальной флорой и остается опасным до сих пор. Пользоваться им для питья и купания нельзя.
По установленным требованиям МУК 4.2.1884-04 рекреационные водоемы не имеют точного действующего регламента по общему числу микроорганизмов, в связи с изменяющимися характеристиками подобного рода объектов. Сезонные факторы, разновидность самого источника, тип его снабжения — все это играет важную роль в достижении конечных результатов проверки. Определять способность водоема к самоочищению помогает специальный индекс, который получают при сравнении микробиологии пробы при температуре 20-22 градуса и нагреве до 37 градусов. Считается, что первый показатель дает естественный фон, характерный для источника, тогда как второй определяет характеристики и объемы антропогенного вмешательства в естественную среду.
Своевременное проведение лабораторных исследований жидкостей, используемых для питья, гигиенических или иных целей, позволяет вовремя выявить источники бактериологической опасности, а также дает возможность обеспечить оптимальную скорость устранения подобных нарушений. Достоверная информация помогает сделать жизнь человека безопаснее.
Чтобы сделать микробиологический анализ воды, вам нужно обратиться в нашу санэпидемстанцию. Служба работает ежедневно, по Москве и Московской области без выходных. С предприятиями и организациями заключаются договоры на постоянное обслуживание, исследование стоков, химические показатели, качество очистки. Проводить лабораторные исследования мы доверяем только квалифицированным экспертам. При выполнении испытаний соблюдаются все методические указания Роспотребнадзора, выдается соответствующее заключение. Для природных источников, применяемых для розлива бутилированной продукции, определение числа бактериальной флоры обязательно, как и получение гигиенического сертификата. Обращайтесь, чтобы законно оформить все документы уже сейчас.
источник
Задачи микробиологического контроля на предприятиях пищевой отрасли: быстрое обнаружение микробных контаминантов и выявление путей их проникновения в производство; определение очагов и степени размножения микроорганизмов на отдельных этапах технологического процесса; предотвращение развития посторонней микрофлоры путем использования различных профилактических мероприятий; активное уничтожение микроорганизмов путем дезинфекции с целью получения высококачественной готовой продукции.
Микробиологический контроль должен проводиться заводскими лабораториями систематически. Он осуществляется на всех этапах технологического процесса, начиная с сырья и заканчивая готовым продуктом на основании государственных стандартов (ГОСТ), технических условий (ТУ), инструкций (ТИ), правил, методических указаний и другой нормативной документации, разработанной для каждой отрасли пищевой промышленности. Для отдельных пищевых производств имеются свои схемы микробиологического контроля, в которых определены объекты контроля, точки отбора проб, периодичность контроля, указывается, какой микробиологический показатель необходимо определить, приводятся нормы допустимой общей бактериальной обсемененности.
Микробиологический мониторинг на предприятии обычно включает следующие шаги.
- Выделение микроорганизмов из производственной среды.
- Посев (если требуется).
- Учет результатов.
- Анализ совокупности полученных при мониторинге данных.
Микробиологический контроль включает оценку микробной контаминации воды, воздуха производственных помещений, пищевых продуктов, санитарного состояния технологического оборудования, инвентаря, тары, гигиенического состояния обслуживающего персонала (рук, одежды и т. п.). Он осуществляется как микробиологической лабораторией предприятия, так и санитарно-эпидемиологическими станциями.
Возможное загрязнение внешней среды патогенными микробами определяют на основании косвенного показателя – обнаружения так называемых санитарно-показательных микроорганизмов: кишечной палочки, гемолитических стрептококков и стафилококков. Присутствие этих микроорганизмов в объектах внешней среды указывает на загрязненность их выделениями человека, животных, сточными водами биотехнологических производств и т. п.
В тех пищевых производствах, где применяются ферментные препараты, также обязателен микробиологический контроль их активности и биологической чистоты.
Санитарно-показательные микроорганизмы
Сведения о возможности опасного в эпидемическом отношении загрязнения окружающей среды дает количественный учет санитарно-показательных микроорганизмов. Это связано с тем, что непосредственное обнаружение патогенных микроорганизмов в естественных субстратах (почве, воде, воздухе) наталкивается на следующие трудности:
- патогенные микроорганизмы встречаются в объектах окружающей среды не постоянно, а главным образом в период эпидемических вспышек;
- количество патогенных микроорганизмов во внешней среде значительно уступает количеству непатогенных;
- применение элективных сред и методов культивирования патогенных микроорганизмов не всегда гарантирует успех.
Поэтому возможное загрязнение внешней среды патогенными микроорганизмами определяют на основании косвенного показателя – обнаружения так называемых индикаторных микроорганизмов. Присутствие санитарно-показательных микроорганизмов в объектах внешней среды указывает на загрязненность их выделениями человеческого организма, а следовательно, и возможность наличия в них соответствующих патогенных микроорганизмов. Чем больше количество санитарно-показательных микроорганизмов в исследуемом объекте, тем больше он загрязнен выделениями человеческого организма и тем вероятнее, что в нем содержатся патогенные микроорганизмы – возбудители инфекционных заболеваний.
Индикаторная ценность микроорганизма определяется по ряду критериев:
- индикаторный микроорганизм должен иметь общее место естественного обитания с соответствующим патогенным микроорганизмом и аналогичный способ распространения в окружающей среде;
- санитарно-показателъные микроорганизмы должны несколько превосходить патогенные микроорганизмы по выживаемости в окружающей среде, по устойчивости к воздействию различных физических, химических и биологических факторов;
- одними из условий при выборе санитарно-показательного микроорганизма являются простота, доступность методов его определения, быстрота в получении ответа.
Многолетние исследования, подтвержденные практикой во многих странах мира, позволили отдать предпочтение бактериям группы кишечной палочки (БГКП) (рис. 16) как основному и наиболее надежному показателю фекального загрязнения воды, пищевых продуктов, смывов с оборудования и рук персонала.
Рис. 16. Кишечная палочка Escherichia coli (фото, х 1250)
Гемолитические стафилококки являются санитарно-показательными микроорганизмами загрязнения воздуха, т. к. они являются постоянными обитателями слизистых оболочек рта и верхних дыхательных путей человека. В группу санитарно-показательных спорообразующих анаэробов почвы входят грамположительные споровые палочки – Clostridium perfringens и Clostridium sporogenes.
Контроль пищевых продуктов
Для оценки качества сырья, полуфабрикатов, вспомогательных материалов, готовой продукции в нашей стране обязательно используются два показателя – общая микробная обсемененность (общее микробное число – ОМЧ) или количество мезофильных аэробных и факультативно анаэробных микроорганизмов (КМАФАнМ) и бактерии группы кишечной палочки (БГКП). На практике ОМЧ и КМАФАнМ оцениваются числом жизнеспособных клеток, способных образовывать колонии на поверхности питательной среды, и выражаются количеством колониеобразующих единиц (КОЕ).
Показатели общей бактериальной обсемененности, ОМЧ, КМАФАнМ выражают в КОЕ/г или КОЕ/см 3 и определяют в основном путем высева продукта или пробы на стандартную плотную питательную среду методом глубинного посева. После посева чашки инкубируют (78 ± 3) ч при температуре (30 ± 1) °С. По окончании срока производят подсчет выросших колоний. Число колоний, выросших на каждой чашке Петри, пересчитывают на 1 г или 1 см 3 продукта.
Необходимо заметить, что полученные результаты будут меньше истинной контаминации продукта, так как микроорганизмы обладают способностью адсорбироваться на взвешенных веществах с образованием трудноразделимых в процессе взбалтывания комплексов, которые при посевах могут регистрироваться как один микроорганизм. Чашечным методом учитываются только сапрофитные мезофильные бактерии (аэробы и факультативные анаэробы). Термофильные и психрофильные бактерии не растут из-за несоответствия температуры оптимальной; анаэробы не растут, поскольку выращивание проводится в аэробных условиях; другие бактерии (в частности, патогенные) не растут из-за несоответствия компонентного состава питательной среды и условий культивирования. Не образуют колоний мертвые клетки. Однако эти микроорганизмы можно не учитывать и ошибкой анализа пренебречь, поскольку сапрофиты являются основными возбудителями порчи пищевых продуктов. Для этого в микробиологических исследованиях введено понятие доверительного интервала.
В некоторых производствах используются дополнительные микробиологические показатели, например, количество анаэробных, термофильных, спорообразующих и других микроорганизмов, характерных для каждого вида исследуемого объекта. Для их учета имеются специальные методические приемы, описанные в соответствующей нормативной документации. Например, для определения процентного содержания спорообразующих бактерий посев производят из пробирок с разведениями проб, предварительно прогретых несколько минут на кипящей водяной бане. При высевах из прогретых проб вырастают только спорообразующие бактерии, а из непрогретых – все остальные. Затем рассчитывают процентное содержание спорообразующих форм микроорганизмов.
Чем выше показатель общей бактериальной обсемененности, тем больше вероятность попадания в исследуемый объект патогенных микроорганизмов – возбудителей инфекционных болезней и пищевых отравлений. Обычно в 1 г (или 1 см 3 ) продукта, не прошедшего термической обработки, содержится не более 100 тысяч сапрофитных мезофильных бактерий.
Определение БГКП (колиформных бактерий) основано на способности колиформных бактерий расти на дифференциально-диагностических средах, сбраживая лактозу с образованием кислоты и газа.
Санитарно-микробиологическое исследование воды
Вода является благоприятной средой для развития различных микроорганизмов, в том числе и возбудителей многих инфекционных заболеваний. В связи с этим санитарно-микробиологический анализ водоемов и питьевой воды является обязательным и важнейшим этапом системы контроля качества воды. Качество питьевой воды, подаваемой централизованными водопроводами для питьевых и хозяйственно-бытовых целей, должно соответствовать гигиеническим нормам (см. СанПиН 2.1.4.1074-01).
Сведения о возможности опасного загрязнения окружающей среды дает количественный учет санитарно-показательных микроорганизмов. Обнаружение данных микроорганизмов в воде следует рассматривать как показатель фекального загрязнения, а их количество позволяет судить о степени этого загрязнения, а значит, о возможности присутствия патогенной микрофлоры.
Преимущество БГКП как показателя фекального загрязнения состоит в полном соответствии основным требованиям, предъявляемым к санитарно-показательным микроорганизмам.
К БГКП относятся грамотрицательные, не образующие спор палочки, ферментирующие лактозу, глюкозу, маннит, мальтозу при 37 °С в течение 24 ч и не обладающие оксидазной активностью. Таким образом, кишечная палочка, представитель нормальной микрофлоры кишечника человека, является показателем фекального загрязнения объектов внешней среды.
Чаще всего при санитарно-микробиологическом исследовании воды на производствах проводят следующие определения:
- микробного числа – общее количество микроорганизмов в 1 см 3 воды;
- микробного числа – общее количество микроорганизмов в 100 см 3 воды при 37ºС;
- микробного числа – общее количество микроорганизмов в 100 см 3 воды при 22ºС;
- количества общих и термотолерантных колиформных бактерий в 100 см 3 ;
- спор сульфитредуцирующих клостридий.
Безопасность питьевой воды в эпидемическом отношении определяется ее соответствием нормативам по микробиологическим и паразитологическим показателям, представленным в табл. 4.
Микробиологические и паразитологические показатели безопасности питьевой воды
| Показатели | Единицы измерения | Нормативы |
| Термотолерантные колиформные бактерии | Число бактерий в 100 см 3 | Отсутствие |
| Общие колиформные бактерии | Число бактерий в 100 см 3 | Отсутствие |
| Общее микробное число | Число образующих колонии бактерий в 1 см 3 | Не более 50 |
| Колифаги | Число бляшкообразующих единиц (БОЕ) в 100 см 3 | Отсутствие |
| Споры сульфитредуцирующих клостридий | Число спор в 20 см 3 | Отсутствие |
| Цисты лямблий | Число цист в 50 дм 3 | Отсутствие |
Внутренний контроль качества санитарно-микробиологических исследований воды проводят в соответствии с МУ 2.1.4.1057-01.
Отбор проб производят в соответствии с МУК 4.2.1018-01. Воду для санитарно-микробиологического исследования отбирают в стерильные емкости.
Из кранов водопроводных сетей отбор проб воды производят после предварительного фламбирования кранов и спуска воды в течение 10 мин при полном открытии крана.
Определение общего микробного числа воды . Общее микробное загрязнение определяется количеством микроорганизмов, содержащихся в 1 см 3 воды, глубинным посевом на питательный агар. В водопроводной (или питьевой) воде в соответствии с СанПиН 2.1.4.1074-01 микробное число не должно превышать 50 КОЕ в 1 см 3 . В соответствии с требованиями ВОЗ (Всемирной организации здравоохранения) ОМЧ также определяют, инкубируя посевы при 37 и 22ºС.
Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод). Общие колиформные бактерии (ОКБ) – грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37 ± 1) °С в течение 24-48 ч.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44 ± 0,5) °С за 24 ч.
Определение ОКБ и ТКБ методом мембранной фильтрации предполагает фильтрацию установленного объема воды через мембранные фильтры, выращивание посевов на дифференциальной питательной среде с лактозой и последующей идентификацией колоний по культуральным и биохимическим свойствам.
При исследовании питьевой воды анализируют 3 объема по 100 см 3 . При получении стабильных отрицательных результатов допустима фильтрация 300 см 3 воды через один фильтр.
При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 см 3 воды).
Отмеренный объем воды фильтруют через мембранные фильтры. По окончании фильтрации фильтр аккуратно снимают стерильным пинцетом и помещают в центр чашки Петри на поверхность среды Эндо фильтрующей поверхностью вверх. При этом следует избегать образования пузырьков воздуха между средой и фильтром. Чашки с фильтрами ставят в термостат и инкубируют посевы при температуре (37 ± 1) °С в течение (24 ± 2) ч (рис. 17). Если на фильтрах нет роста или выросли колонии пленчатые, губчатые, плесневые, прозрачные, расплывчатые, выдают отрицательный ответ: отсутствие ОКБ и ТКБ в 100 см 3 исследуемой воды.
Рис. 17. Схема определения общих и термотолерантных колиформных бактерий методом мембранной фильтрации
Санитарно-микробиологическое исследование воздуха
Микробиота воздуха весьма немногочисленна и не отличается разнообразием. Ее количественный и качественный состав зависит от места, над которым исследуется воздух. Воздух является неблагоприятной средой для развития и жизнедеятельности микроорганизмов, т. к. в нем нет питательных веществ и пагубно влияет УФ-излучение.
Задачей микробиологического контроля является получение репрезентативной оценки микробной нагрузки производственной среды.
Текущий контроль бактериальной загрязненности воздуха в принципе не может и не должен выявить или подсчитать все микроорганизмы, присутствующие в контролируемой среде. Он может только показать, что все ключевые системы, контролирующие состояние производственной среды, работают в соответствии с установленными требованиями и лимиты бактериальной нагрузки не превышены. В пробе воздушных масс учитывают общее число микроорганизмов, содержащихся в определенном объеме воздуха, и качественный состав микрофлоры воздуха.
В воздухе закрытых помещений содержится большое количество различных форм микроорганизмов: пигментированные бактерии, микрококки, спорообразующие палочки, дрожжи, мицелиальные грибы. Санитарно-показательными микроорганизмами воздуха являются гемолитические стафилококки, т. к. эти микроорганизмы – постоянные обитатели слизистых оболочек полости рта, верхних дыхательных путей человека.
Для оценки санитарно-гигиенического состояния воздуха помещений определяют общее количество микробов, находящихся в 1 м 3 воздуха и количество санитарно-показательных микроорганизмов в том же объеме воздуха.
Санитарно-микробиологическое исследование воздуха проводится несколькими методами: седиментационным, аспирационным, барботированием стерильной воды или физиологического раствора с последующим высевом пробы на питательную среду методом мембранной фильтрации или пропусканием воздуха непосредственно через питательную среду.
Седиментационный метод (метод Коха) – оседание микроорганизмов под воздействием силы тяжести на поверхность питательной среды чашки Петри. Количество выросших колоний соответствует степени загрязненности воздуха: по приблизительным подсчетам на площадь 100 см 2 (площадь чашки Петри) в течение 5 мин попадает столько микробов, сколько их содержится в 10 дм 3 воздуха. Описанный метод относится к пассивным (качественным), он позволяет лишь определить спектр присутствующих микроорганизмов. Главным его недостатком является выявление только больших быстрооседающих частиц в объеме отобранной пробы.
Аспирационный метод связан с применением аппарата, который дает возможность исследовать определенный объем воздуха. Работа его основана на принципе ударного действия струи воздуха. Аппарат состоит из узла для отбора проб воздуха, микроманометра и электромотора. Засасываемый воздух распределяется по поверхности среды чашки Петри, помещенной во вращающемся устройстве. Скорость просасывания воздуха должна быть около 25 дм 3 /мин. Экспозиция в течение 4–5 мин (т. е. пропускание 100 дм 3 воздуха) позволяет выявить общее количество микроорганизмов. Затем чашки Петри закрывают, инкубируют в течение 24 ч в термостате при 37°С и 24 ч при комнатной температуре и подсчитывают число выросших колоний.
Бактериальную загрязненность воздуха оценивают по количеству микроорганизмов в 1 м 3 воздуха, используя готовые производственные таблицы, или рассчитывают по формуле Омелянского:
где X – количество микроорганизмов в 1 м 3 воздуха; А – количество колоний в чашке; В – площадь чашки, см 2 ; Т – время, в течение которого чашка была открыта, мин; 5 – время по расчету Омелянского, мин; 10 – объем воздуха, из которого происходит оседание микробов за 5 мин, дм 3 ; 100 – площадь, на которую происходит оседание, см 2 ; 1000 – искомый объем воздуха, дм 3 .
В. Л. Омелянский установил, что за 5 мин при спокойном состоянии воздуха на площадь 100 см 2 оседает столько микроорганизмов, сколько их содержится в 10 дм 3 (это описано выше как метод Коха).
Для выявления санитарно-показательной микрофлоры ранее использовали кровяной агар, на котором данные микроорганизмы растут желтыми с ровными краями колониями и вызывают гемолиз клеток крови, в результате чего среда вокруг колонии становится прозрачной, или проводили посев на чашки Петри с желточно-солевым агаром (элективность среды обусловливается содержанием высокой концентрации хлорида натрия). При этом большая часть патогенных стафилококков, образующих летициназу, дает реакцию, проявляющуюся в образовании вокруг колонии зоны просветления с радужным венчиком по периферии.
В настоящее время для определения количества Staphylococcus aureus применяют агар Байрд-Паркера, а образование термостабильной нуклеазы устанавливают при необходимости определения его потенциальной энтеротоксигенности.
Микробная обсемененность различных помещений неодинакова. Критерии чистоты воздуха жилых помещений приведены в табл. 5.
К воздуху производственных цехов пищевых производств предъявляются более строгие требования.
Критерий для оценки воздуха жилых помещений
(число микроорганизмов в 1 м 3 воздуха по А. И. Шарифу)
источник
Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-микробиологический анализ питьевой воды
Методические указания
МУК 4.2.1018-01
1. Разработаны НИИ экологии человека и гигиены окружающей среды им. А. Н. Сысина РАМН (Недачин А. Е., Доскина Т. В., Дмитриева Р. А., Тишкова Н. Ю., Сидоренко С. Г.), Федеральным научным центром гигиены им. Ф. Ф. Эрисмана Минздрава России (Трухина Г. М., Мойсеенко Н. Н., Сарафанюк Е. В.), Аналитическим центром контроля качества воды «Роса» (Кашкарова Г. П.), Федеральным центром госсанэпиднадзора Минздрава России (Кривопалова Н. С., Сорокина Р. С.), Центром госсанэпиднадзора в г. Москве (Салова Н. Я., Малышева З. Г., Кожевникова Н. А.), Центром госсанэпиднадзора в Московской области (Козлова А. Т.), Московским НИИ генетики (Бовыкина Н. М.), НИИ коммунального водоснабжения и очистки воды (Русанова Н. А.), Российской медицинской академией последипломного образования (Власова И. В.), Российским государственным медицинским университетом (Пивоваров Ю. П.).
2. Утверждены Главным государственным санитарным врачом Российской Федерации — Первым заместителем министра здравоохранения Российской Федерации 9 февраля 2001 г.
3. С момента ввода данных методических указаний считаются утратившими силу методические указания МУК 4.2.671-97 «Методы санитарно-микробиологического анализа питьевой воды» и Информационно-методическое письмо Департамента государственного санитарно-эпидемиологического надзора Министерства здравоохранения Российской Федерации № 1100/1670-98-111 «О дополнительных мерах по осуществлению контроля качества питьевой воды по микробиологическим и паразитологическим показателям».
3. Отбор, хранение и транспортирование проб . 2
3.1. Общие требования к отбору проб . 2
3.2. Хранение и транспортирование проб . 3
4. Оборудование, расходные материалы, реактивы, питательные среды .. 3
4.2. Расходные материалы .. 4
4.3. Химические реактивы .. 4
4.5. Тест-культуры микроорганизмов . 6
5. Приготовление питательных сред и реактивов . 6
5.4. Фуксин-сульфитная среда Эндо . 7
5.5. Лактозо-пептонная среда . 7
5.6. Питательные среды для подтверждения способности ферментировать лактозу до кислоты и газа . 7
5.7. Реактивы для оксидазного теста . 8
5.8. Железо-сульфитный агар . 8
5.9. Реактивы для окраски препаратов по Граму . 8
6. Подготовка к анализу . 9
6.1. Подготовка посуды и материалов . 9
6.2. Подготовка проб воды .. 9
7. Методика работы при использовании мембранных фильтров . 9
7.1. Подготовка мембранных фильтров . 9
7.2. Подготовка фильтровального аппарата . 9
8.1. Определение общего числа микроорганизмов, образующих колонии на питательном агаре . 10
8.2. Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод) 10
8.3. Определение общих и термотолерантных колиформных бактерий титрационным методом .. 13
8.4. Определение спор сульфитредуцирующих клостридий . 15
8.5. Определение колифагов . 16
Главный государственный санитарный врач
Российской Федерации — Первый заместитель
Министра здравоохранения Российской Федерации
Дата введения: 1 июля 2001 г.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-микробиологический анализ питьевой воды
Методические указания
МУК 4.2.1018-01
1.1. Настоящие методические указания устанавливают методы санитарно-микробиологического контроля качества питьевой воды в отношении ее эпидемической безопасности по показателям СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
1.2. Методические указания предназначены для лабораторий организаций, предприятий и иных хозяйственных субъектов, осуществляющих производственный контроль, а также органов санитарно-эпидемиологической службы, обеспечивающих государственный и ведомственный санитарно-эпидемиологический надзор за качеством питьевой воды централизованных систем питьевого водоснабжения.
2.1. Санитарные правила и нормы. «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». СанПиН 2.1.4.559-96.
2.2. Санитарные правила «Безопасность работы с микроорганизмами III — IV групп патогенности и гельминтами». СП 1.2.731-99.
2.3. ГОСТ 18963-73. Вода питьевая. Методы санитарно-бактериологического анализа.
3.1.1. Отбор проб производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа.
3.1.2. Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов.
3.1.3. Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги). Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием.
3.1.4. При отборе проб в одной и той же точке для различных целей первыми отбирают пробы для бактериологических исследований. Если отбирают воду после обеззараживания химическими реагентами, то для нейтрализации остаточного количества дезинфектанта в емкость, предназначенную для отбора проб, вносят до стерилизации натрий серноватисто-кислый в виде кристаллов из расчета 10 мг на 500 мл воды.
3.1.5. Пробу отбирают в стерильные емкости. Емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. Ополаскивать посуду запрещается.
3.1.6. При исследовании воды из распределительных сетей отбор проб из крана производят после предварительной его стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При отборе пробы напор воды может быть уменьшен. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок. Если через пробоотборный кран происходит постоянный излив воды, отбор проб производят без предварительного обжига, не изменяя напора воды и существующей конструкции (при наличии силиконовых или резиновых шлангов).
При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании.
После наполнения емкость закрывают стерильной пробкой и колпачком.
3.1.7. Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбиравшего пробу, и другой информации.
3.2.1. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре (4 — 10) °С. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При соблюдении указанных условий срок начала исследований от момента отбора проб не должен превышать 6 ч.
Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора.
Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы проводить не следует.
Пробы питьевой воды должны доставляться в отдельных продезинфицированных контейнерах.
Термостат для температурного режима (37 ± 1) °С
Термостат для температурного режима (44 ± 1) °С
Термостат или водяная баня для температурного режима (44 ± 0,5) °С
Водяная баня для температурного режима (75 ± 5) °С
Водяная баня или термостат для температурного режима (45 — 49) °С (для питательных сред)
Прибор для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм и устройство для создания разрежения (0,5 — 1,0) атм
Весы лабораторные общего назначения 4 кл. точности, с пределом взвешивания до 1000 г
Максимальный термометр ртутный с диапазоном измерения от 20 до 200 °С с ценой деления шкалы 1 °С
Термометр ртутный с диапазоном измерения от 0 до 100 °С с ценой деления шкалы 0,5 °С
рН-метр, обеспечивающий измерение с погрешностью до 0,01
Дистиллятор, обеспечивающий качество дистиллированной воды не ниже
Стерилизатор суховоздушный для температурного режима (180 ± 5) °С
Холодильник бытовой электрический
Вытяжной шкаф для работы с хлороформом при проведении анализа на колифаги
Нагревательный прибор для варки питательных сред либо магнитные мешалки с подогревом до 300 °С
Прибор для счета колоний бактерий
Лупа с двукратным увеличением
Дозаторы для разлива питательных сред
Оптический стандарт мутности на 10 ед.
Горелки газовые или спиртовки
Пинцеты для работы с мембранными фильтрами
Мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм и другие фильтрующие мембраны с аналогичной способностью фильтрации, имеющие сертификат качества
Индикаторы бумажные для определения рН в диапазоне 6 — 8 с интервалом определения 0,2 — 0,3
Фольга алюминиевая, колпачки силиконовые, металлические
Пипетки, вместимостью 1,5, 10 мл с ценой деления 0,1 мл многоразового или одноразового использования)
Пробирки (многоразового или одноразового использования)
Цилиндры, вместимостью 100, 250, 500 мл или мензурки, вместимостью 250, 500, 1000 мл
Чашки бактериологические (Петри)
Пробки (силиконовые, резиновые и другие, выдерживающие стерилизацию сухим жаром или автоклавированием)
Бумага фильтровальная лабораторная
Вата хлопковая медицинская гигроскопическая
Карандаши или фломастеры по стеклу
Все химические реактивы должны соответствовать квалификации не ниже ч. д. а.
Железо серно-кислое закисное (7-водное)
Натрий серноватисто-кислый (тиосульфат натрия) 5-водный
Спирт этиловый ректификованный медицинский
Спирт этиловый технический
Натрий сернисто-кислый (сульфит натрия)
Фенилендиаминовые соединения* (тетраметил-п-фенилендиамин гидрохлорид, диметил-п-фенилендиамин соляно-кислый)
Генциан фиолетовый кристаллический
* Вещества обладают канцерогенным и мутагенным действием, работа с ними требует соблюдения мер предосторожности.
Сухой препарат с индикатором ВР и лактозой или среда Гисса с лактозой
Пептон сухой ферментативный для бактериологических целей
Системы индикаторные бумажные (СИБ)
Допускаются к использованию коммерческие питательные среды, диагностические препараты и системы идентификации производства зарубежных фирм, предназначенные для целей описываемых методов. Питательные среды и биологические препараты зарубежного производства должны иметь международный сертификат качества ISO 9000 или EN 29 000.
При использовании следует руководствоваться рекомендациями фирмы-производителя.
Все обезвоженные коммерческие питательные среды и препараты отечественного производства должны иметь сертификат соответствия.
4.5.1. Контрольный колифаг М82, штамм ВКПМ-3254 Е. coli К12 F + Str r получают в ГНИИ Генетика — Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ — Россия, 113545, г. Москва, 1-ый Дорожный проезд, д. 1).
4.5.2. Штамм Е. coli М17-02 и один из штаммов: Pseudomonas aeruginosa или Pseudomonas fluorescens получают в Государственном Национальном Органе контроля медицинских и биологических препаратов им. Л. А. Тарасовича Минздрава России (Россия, 121002, г. Москва, ул. Сивцев-Вражек, д. 41).
В производственных лабораториях, расположенных на территории водопроводных станции, следует использовать штамм Pseudomonas fluorescens .
Предпочтительно использование стандартизованных сухих питательных сред промышленного производства.
При использовании промышленных сухих питательных сред их приготавливают в соответствии с указаниями изготовителя на этикетке.
В этом случае следует соблюдать способ применения и срок хранения питательных сред, указанные на упаковках.
Сухие питательные среды хранят в сухих помещениях, в темноте, при комнатной температуре. Открытые упаковки тщательно закупоривают. Среды с измененным внешним видом (уплотненные, с комками), а также с истекшим сроком годности не используют.
Для приготовления растворов, реактивов и питательных сред применяют воду дистиллированную по ГОСТу 6709-72.
Питательные среды готовят в посуде из инертного материала.
Учитывая возможное изменение рН питательных сред после кипячения и стерилизации, окончательный контроль рН проводят в готовой среде при температуре 25 °С с использованием индикаторной бумаги.
После стерилизации питательные среды оставляют для охлаждения при комнатной температуре. При необходимости розлива в чашки Петри среды охлаждают до температуры (50 — 60) °С.
Температура сред, хранящихся в холодильнике, перед посевом должна быть доведена до комнатной.
5.2.1. Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
5.2.2. Питательный бульон (десятикратный) для колифагов готовят путем увеличения в 10 раз навески сухого препарата, указанной на этикетке.
5.3.1. Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
5.3.2. Питательный агар для определения колифагов прямым методом готовят, увеличивая навеску сухого препарата в 2 раза от прописи.
5.3.3. Питательный агар запрещается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
5.3.4. Полужидкий питательный агар готовят следующим образом: сухой питательный бульон (15 г) и агар микробиологический (3 г) растворить при нагревании в 1000 мл дистиллированной воды. Довести рН до 7,0 — 7,2, разлить в пробирки и стерилизовать автоклавированием при 121 °С в течение 15 мин.
5.3.5. Питательный агар со стрептомицином готовят из расчета содержания 100 мкг стрептомицина на 1 мл питательного агара, приготовленного по стандартной прописи. Стерильно на стерильной дистиллированной воде готовят раствор стрептомицина в концентрации 10 мг на 1 мл. В готовый питательный агар, отмеренный по объему и остуженный до температуры (45 — 49) °С, вносят приготовленный стерильный раствор стрептомицина из расчета 0,1 мл на 10 мл питательного агара. Разливают в пробирки для приготовления скошенного агара. Повторное расплавление питательной среды со стрептомицином запрещается.
Готовят из сухого препарата по способу, указанному на этикетке. Если на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить. Срок хранения чашек со средой не более 2 — 3 суток в темноте, если производителем не оговорены другие сроки.
5.4.2. Повышение дифференцирующих свойств среды
Для повышения дифференцирующих свойств среды в готовую и охлажденную до (60 — 70) °С среду перед разливкой в чашки допускается прибавлять на 100 мл среды 0,2 мл 5 %-ного спиртового раствора основного фуксина. Срок хранения раствора фуксина — не более 1 мес.
5.4.3. Модификация среды с добавлением розоловой кислоты
В случаях, когда мембранные фильтры зарастают микрофлорой, не относящейся к бактериям кишечной группы, помимо фуксина, допускается добавление на 100 мл среды Эндо 0,2 мл 5 %-ного спиртового раствора розоловой кислоты. Срок хранения раствора розоловой кислоты — не более 1 мес.
Модификацию среды Эндо с добавлением розоловой кислоты используют только при работе методом мембранной фильтрации.
10 г пептона, 5 г натрия хлористого, 5 г лактозы растворяют при нагревании в 1 л дистиллированной воды. После растворения ингредиентов устанавливают рН 7,4 — 7,6, разливают по 10 мл в пробирки, стерилизуют при (112 ± 2) °С 12 мин.
Для приготовления концентрированной лактозо-пептонной среды все ингредиенты, кроме воды, увеличивают в 10 раз, разливают по 1 мл в пробирки и по 10 мл во флаконы.
5.6.1. Полужидкая среда с лактозой из сухого препарата
Готовят по способу, указанному на этикетке.
Срок хранения — не более 2 недель при комнатной температуре.
Посев производят уколом до дна пробирки. При образовании кислоты цвет питательной среды изменяется в соответствии с использованным индикатором. При газообразовании газ скапливается или по уколу, или на поверхности, или в толще среды появляются разрывы. При инкубации посевов более 5 ч газ может улетучиться. В таких случаях на присутствие газа указывают оставшиеся в толще среды «карманы» — потемнения среды на месте бывшего пузырька газа.
5.6.2. Полужидкая среда с лактозой
Готовят при отсутствии сухого препарата.
В 1 л дистиллированной воды растворяют 10 г пептона, 5 г натрия хлористого, (4 — 5) г агар-агара, доводят до кипения, устанавливают рН 7,2 — 7,4, добавляют 1 мл 1,6 %-ного спиртового раствора бромтимолового синего. Стерилизуют при (120 ± 2) °С 20 мин. В расплавленную среду вносят 5 г лактозы, нагревают до кипения, разливают в стерильные пробирки на высоту (3 — 5) см и стерилизуют при (112 ± 2) °С 12 мин. Срок хранения — не более 2 недель при комнатной температуре.
Правильно приготовленная среда зеленого цвета с синеватым оттенком (цвет бутылочного стекла). При Образовании кислоты цвет среды изменяется на желтый.
5.6.3. Лактозо-пептонная среда
Готовят по п. 5.5 с добавлением 1 мл 1,6 %-ного спиртового раствора бромтимолового синего на 1 л и разливают по (3 — 5) мл в пробирки с поплавком.
Готовят по прописи завода-изготовителя.
1 %-ный водный раствор тетраметил-п-фенилендиамина гидрохлорид. Готовят перед употреблением.
Реактив № 1. 1 %-ный спиртовой раствор α-нафтола.
Реактив № 2. 1 %-ный водный раствор фенкпендиаминового соединения.
Растворы сохраняют в темных флаконах с притертыми пробками:
1 — до одного месяца, 2 — до одной недели. Перед употреблением к трем частям первого раствора добавляют семь частей второго раствора.
Могут быть использованы коммерческие тест-системы для постановки оксидазного теста (СИБ-оксидаза или аналоги).
Перед работой с каждой серией проб реактивы или тест-системы на оксидазу следует испытывать с тест-культурами микроорганизмов, дающих положительную ( Ps . aeruginosa , Ps . fluorescens ) и отрицательную оксидазную реакцию (E. coli).
В 1000 мл стерильного расплавленного питательного агара (по п. 5.4) добавляют 10 г глюкозы, нагревают до растворения, разливают мерно во флаконы, автоклавируют при (112 ± 2) °С 12 мин (основная среда).
20 %-ный раствор сульфита натрия ( Na 2 SO 3 ) и 8 %-ный раствор железа серно-кислого закисного ( FeSO 4 ) или железа хлористого ( FeCl 2 ) готовят непосредственно перед употреблением в стерильной посуде на стерильной дистиллированной воде. Раствор сульфита натрия нагревают до полного растворения. Перед выполнением анализа в 100 мл расплавленной основной среды вносят 5 мл 20 %-ного раствора сульфита натрия, перемешивают, затем вносят 1 мл 8 %-ного раствора сернокислого железа, перемешивают и стерильно разливают в пробирки высоким столбиком (12 — 15) см для работы методом мембранной фильтрации или во флаконы для работы методом прямого посева.
5.9.1. Карболовый раствор генциана фиолетового готовят следующим образом: 1 г генциана фиолетового, 10 мл ректификованного этилового спирта, 5 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды.
5.9.2. Раствор Люголя готовят следующим образом: 1 г йода, 2 г йодистого калия растворяют в 300 мл дистиллированной воды. Хранить во флаконе из темного стекла.
5.9.3. Фуксин Циля готовят следующим образом: 1 г основного фуксина, 10 мл спирта этилового ректификованного, 54 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды.
Лабораторную посуду моют, ополаскивают сначала водопроводной, затем дистиллированной водой и высушивают.
Пробирки, колбы, бутылки, флаконы закрывают силиконовыми или ватно-марлевыми пробками и колпачками (силиконовые, металлические, из фольги или плотной бумаги).
Пипетки со вставленными тампонами из ваты укладывают в металлические пеналы или заворачивают в бумагу.
Чашки Петри укладывают в металлические пеналы или заворачивают в бумагу. Бумага, используемая для обертывания лабораторной посуды, не должна разрушаться при стерилизации.
Подготовленную посуду стерилизуют в сушильном шкафу при температуре 160 °С в течение 2 ч или 180 °С 1 ч, считая с момента достижения указанной температуры. Стерильную посуду вынимают из стерилизационного шкафа после его охлаждения ниже 60 °С. Срок хранения стерильной посуды — не более 10 дней.
Материалы и лабораторную посуду, разрушающиеся при температуре (160 — 180) °С (резина и т.п.), следует стерилизовать в паровом стерилизаторе при температуре (121 ± 2) °С 20 мин.
Новые резиновые пробки кипятят в 2 %-ном растворе натрия двууглекислого 30 мин и 5 раз промывают водопроводной водой (кипячение и промывание повторяют дважды). Затем пробки кипятят в дистиллированной воде 30 мин, высушивают, заворачивают в бумагу или фольгу и стерилизуют в паровом стерилизаторе. Резиновые пробки, использованные ранее, обеззараживают, кипятят 30 мин в водопроводной воде с нейтральным моющим средством, промывают в водопроводной воде, высушивают, монтируют и стерилизуют.
После выполнения анализа все использованные чашки, пробирки и пипетки обеззараживают в автоклаве при (126 ± 2) °С в течение 60 мин, в исключительных случаях допускается обеззараживание кипячением в 2 %-ном растворе пищевой соды или 0,5 %-ном моющего средства в течение 60 мин с момента закипания (в закрытой емкости с полным погружением в раствор).
Перед посевом пробу тщательно перемешивают и фламбируют горящим тампоном край емкости. Используемые пробирки и чашки маркируют.
Перед каждым отбором новой порции воды для анализа пробу перемешивают стерильной пипеткой.
Мембранные фильтры должны быть подготовлены к анализу в соответствии с указаниями изготовителя.
Воронку и столик фильтровального аппарата обтирают марлевым (ватным) тампоном, смоченным спиртом ректификованным, и фламбируют. После охлаждения на столик фильтровального аппарата кладут фламбированным пинцетом стерильный мембранный фильтр, прижимают его воронкой.
В воронку прибора для фильтрования наливают отмеренный объем воды, затем создают вакуум.
При посеве нескольких объемов одной пробы следует фильтровать через один фильтровальный аппарат без обеззараживания сначала меньшие, а затем большие объемы воды, меняя каждый раз фильтры. Перед фильтрованием каждой новой пробы прибор обеззараживают.
Следует начинать с фильтрования проб обеззараженной воды или тех проб, которые предположительно не загрязнены, а затем фильтровать загрязненные пробы.
При фильтровании 1 мл исследуемой воды следует в воронку налить предварительно не менее 10 мл стерильной воды, а затем внести анализируемую воду.
После окончания фильтрования и осушения фильтра отключают вакуум, воронку снимают, фильтр осторожно поднимают за край фламбированным пинцетом и переносят его, не переворачивая, на питательную среду, разлитую в чашки Петри, избегая пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
Под каждым фильтром на дне чашки делают надпись с указанием объема профильтрованной воды, номера пробы и даты посева. На одну чашку можно поместить 3 — 4 фильтра с условием, чтобы фильтры не соприкасались.
8.1.1. Определение понятия показателя
Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 ч, видимые с увеличением в 2 раза.
Из каждой пробы делают посев не менее двух объемов по 1 мл.
После тщательного перемешивания пробы воды вносят по 1 мл в стерильные чашки Петри, слегка приоткрывая крышки. После внесения воды в каждую чашку вливают (8 — 12) мл (на чашку диаметром 90 — 100 мм) расплавленного и остуженного до (45 — 49) °С питательного агара после фламбирования края посуды, в которой он содержится. Затем быстро смешивают содержимое чашек, равномерно распределяя по всему дну, избегая образования пузырьков воздуха, попадания агара на края и крышку чашки. Эту процедуру производят на горизонтальной поверхности, где чашки оставляют до застывания агара.
Расплавленный агар на период проведения анализа помещают в водяную баню или термостат, поддерживающие температуру (45 — 49) °С.
После застывания агара чашки с посевами помещают в термостат вверх дном и инкубируют при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Подсчитывают все выросшие на чашке колонии, наблюдаемые при увеличении в 2 раза. Учитывают только те чашки, на которых выросло не более 300 изолированных колоний.
Количество колоний на обеих чашках суммируют и делят на два. Результат выражают числом колониеобразующих единиц (КОЕ) в 1 мл исследуемой пробы воды.
Если на одной из 2 чашек подсчет невозможен, результат выдают на основании учета колоний на одной чашке. Если на двух чашках имеет место рост расплывчатых колоний, не распространяющийся на всю поверхность чашки, или выросло более 300 колоний и анализ нельзя повторить, подсчитывают сектор чашки с последующим пересчетом на всю поверхность. В этих случаях в протоколе отмечают «число КОЕ/мл — ориентировочно».
Если подсчет колоний на чашках невозможен, то в протоколе отмечают «сплошной рост».
8.2. Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод)
8.2.1. Определение понятия показателя
Общие колиформные бактерии (ОКБ) — грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37 + 1) °С в течение (24 — 48) ч.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44 ± 0,5) °С в течение 24 ч.
Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциальной питательной среде с лактозой и последующей идентификации колоний по культуральным и биохимическим свойствам.
8.2.3.1. Порядок исследования
При исследовании питьевой воды анализируют 3 объема по 100 мл.
При получении стабильных отрицательных результатов допустима фильтрация 300 мл воды через один фильтр.
При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 мл воды).
Отмеренный объем воды фильтруют через мембранные фильтры с соблюдением требований, изложенных в п. 7.
Фильтры помещают на среду Эндо, приготовленную по п. 5.4. Чашки с фильтрами ставят в термостат дном вверх и инкубируют посевы при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Если на фильтрах нет роста или выросли колонии пленчатые, губчатые, плесневые, прозрачные, расплывчатые, выдают отрицательный ответ: отсутствие ОКБ и ТКБ в 100 мл исследуемой воды. Анализ заканчивают через 24 ч.
Если на фильтрах обнаружен рост изолированных типичных лактозоположительных колоний: темно-красных, красных с металлическим блеском или без него или других подобного типа колоний с отпечатком на обратной стороне фильтра, подсчитывают число колоний каждого типа отдельно и приступают к подтверждению их принадлежности к ОКБ и ТКБ.
Для подтверждения наличия ОКБ исследуют:
· все колонии, если на фильтрах выросло менее 5 колоний;
· не менее 3 — 4 колоний каждого типа.
Для подтверждения наличия ТКБ исследуют все типичные колонии, но не более 10.
Каждую выбранную изолированную колонию исследуют на:
· наличие оксидазной активности;
· принадлежность к Граму (микроскопия окрашенного по Граму препарата или постановка теста Грегерсена);
· ферментацию лактозы до кислоты и газа.
8 2.3 2. Постановка оксидазного теста
Полоску фильтровальной бумаги помещают в чистую чашку Петри и смачивают 2 — 3 каплями реактива для оксидазного теста по п. 5.7. Готовые бумажные системы смачивают дистиллированной водой. Часть изолированной колонии стеклянной палочкой или платиновой петлей (металлическая петля из нихрома может дать ложноположительную реакцию) наносят штрихом на подготовленную фильтровальную бумагу. Реакция считается положительной, если в течение 1 мин появляется фиолетово-коричневое ( п. 5.7.1 вариант 1) или синее ( п. 5.7.2 вариант 2 и СИБ-оксидаза) окрашивание штриха. При отрицательной реакции цвет в месте нанесения культуры не меняется. При положительном результате эту колонию из дальнейшего исследования исключают.
Если при исследовании колоний, окрашенных в темно-красный цвет, получают недостаточно четкий результат, необходимо пересеять культуру со среды Эндо на питательный агар. После инкубации тест повторяют.
8.2.3.3. Определение принадлежности к Граму
Из оксидазоотрицательной колонии делается мазок, окрашивается по Граму и микроскопируется.
На обезжиренное спиртом предметное стекло наносят петлей 1 каплю дистиллированной воды, вносят небольшое количество культуры из анализируемой колонии и распределяют по поверхности стекла. Мазок высушивают при комнатной температуре и фиксируют трехкратным проведением через пламя горелки. На препарат накладывают полоску фильтровальной бумаги и на нее наливают карболовый раствор генциана фиолетового на (0,5 — 1) мин, снимают бумагу, наливают раствор Люголя на (0,5 — 1) мин, сливают раствор Люголя и стекло промывают в этиловом спирте в течение (0,5 — 1) мин, пока не перестанет отходить краситель. Затем стекло тщательно промывают водой и докрашивают в течение (1 — 2) мин фуксином Циля, разведенным 1:10 дистиллированной водой. После промывания и просушивания препарата мазок микроскопируют.
Приготовление реактивов для окраски по Граму изложено в п. 5.9.
Грамотрицательные микроорганизмы имеют розовую окраску, грамположительные окрашиваются в синий цвет. Колиформные бактерии являются грамотрицательными палочками.
Окраска по Граму может быть заменена тестом Грегерсена, не требующим использования оптики.
Тест Грегерсена: в капле 3 %-ного водного раствора КОН на предметном стекле эмульгируют бактерийную массу, взятую с плотной среды. После нескольких секунд перемешивания петлей взвесь ослизняется и за петлей тянутся слизистые нити, что указывает на принадлежность испытуемой культуры или колонии к грамотрицательному виду. У грамположительных бактерий слизистые нити не образуются — реакция отрицательная.
8.2.3.4. Определение ферментации лактозы
Оставшуюся часть оксидазоотрицательной грамотрицательной изолированной колонии засевают параллельно в две пробирки с лактозной средой ( п. 5.6):
· для подтверждения наличия ОКБ посев инкубируют при температуре (37 ± 1) °С в течение 48 ч;
· для подтверждения наличия ТКБ посев осуществляют в среду, предварительно прогретую до температуры (43 — 44) °С, и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч.
Первичный учет образования кислоты и газа на подтверждающих полужидких средах и СИБ ( п. 5.6) возможен через (4 — 6) ч. При обнаружении кислоты и газа дают положительный ответ. При отсутствии кислоты и газа или при наличии только кислоты пробирки с посевами для окончательного учета ТКБ оставляют до 24 ч. Пробирки с посевами для подтверждения наличия ОКБ после просмотра через 24 ч и получения отрицательного результата оставляют для окончательного учета до 48 ч.
Если колония, подлежащая исследованию, незначительных размеров, ее пересевают на скошенный питательный агар и после инкубации в течение (18 — 24) ч выполняют все необходимые подтверждающие тесты.
8.2.3.5. Постановка подтверждающих тестов при наложении колоний или сплошном росте
Если на части или на всей поверхности фильтра наблюдается наложение колоний или сплошной рост, выполняют оксидазный тест путем помещения мембранного фильтра на кружок фильтровальной бумаги большего диаметра, чем фильтр, обильно смоченный реактивом, или на диск СИБ-оксидаза, смоченный дистиллированной водой. При появлении первых признаков реакции, но не более чем через 5 мин, мембранный фильтр переносят обратно на среду Эндо. После четкого проявления реакции определяют результат. При появлении фиолетово-коричневого или синего окрашивания (в зависимости от примененного реактива) оксидазный тест считают положительным.
Если на фильтрах все колонии оксидазоположительные, они не учитываются и выдают ответ об отсутствии ОКБ и ТКБ и завершают анализ.
При отрицательной оксидазной реакции проводят рассев до получения изолированных колоний и подтверждают их принадлежность к ОКБ и ТКБ по п. п. 8.2.3.3 — 8.2.3.4 (анализ качественный).
8.2.4.1. Грамотрицательные колонии учитываются как ОКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 37 °С с образованием кислоты и газа.
Грамотрицательные колонии учитываются как ТКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 44 °С с образованием кислоты и газа.
8.2.4.2. При отсутствии общих и термотолерантных колиформных бактерий на всех фильтрах результат записывают «не обнаружено КОЕ ОКБ в 100 мл» и «не обнаружено КОЕ ТКБ в 100 мл».
8.2.4.3. В случае идентификации всех выросших подозрительных колоний число колониеобразующих единиц ОКБ и ТКБ подсчитывают на всех фильтрах и выражают результат анализа КОЕ в 100 мл воды.
Вычисление проводят по формуле:
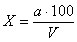
Х — число колоний в 100 мл;
V — профильтрованный объем воды через фильтры, на которых велся учет;
а — число подсчитанных на этих фильтрах колоний в сумме.
1. При посеве 3 фильтров по 100 мл выросло две колонии в 100 мл, на остальных двух фильтрах нет роста. Число общих или термотолерантных колиформных бактерий будет:
2. При посеве 10, 40, 100 и 150 мл на фильтрах с профильтрованным объемом 40 мл выросло 4 изолированные колонии, с профильтрованным объемом 100 — 3 ОКБ. Фильтры с объемами 10 мл и 150 мл заросли и учету не подлежат. Суммируют общее число колоний ОКБ (ТКБ) на тех фильтрах, где получены изолированные колонии, и пересчитывают на объем 100 мл.
8.2.4.4. Если при выборочной проверке колоний одного типа получены неодинаковые результаты, то вычисляют числа ОКБ или ТКБ среди колоний этого типа по формуле:
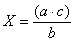
Х — число подтвержденных бактерий одного типа;
а — общее число колоний этого типа;
b — число проверенных из них;
с — число колоний с положительным результатом.
Полученные результаты учета по каждому типу колоний суммируют и далее подсчитывают по п. 8.2.4.3 — 8.2.4.4.
8.2.4.5. Окончательный результат выдают: количество КОЕ ОКБ в 100 мл, из них количество КОЕ ТКБ в 100 мл.
Ориентировочный результат может быть выдан при обнаружении типичных колиформных колоний на среде Эндо, образованных грамотрицательными оксидазоотрицательными бактериями. Окончательный ответ подтверждается по результатам ферментации лактозы.
8.2.4.6. При наложении колоний или сплошном росте на всех фильтрах ( п. 8.2.3.5) в случае подтверждения принадлежности к ОКБ и ТКБ выдается качественный результат «обнаружено ОКБ в 100 мл».
Если все колонии на фильтре оксидазоположительные или не подтвердилась их принадлежность к ОКБ и ТКБ, анализ завершается, в протоколе отмечают «зарост фильтров».
В обоих случаях анализ повторяют.
8.3.1. Определение понятия показателя
Определение понятия показателей ОКБ и ТКБ по п. 8.2.1.
Титрационный метод может быть использован:
· при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации;
· при анализе воды с большим содержанием взвешенных веществ;
· в случае преобладания в воде посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний общих колиформных бактерий.
Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциальную плотную питательную среду с лактозой и идентификации колоний по культуральным и биохимическим тестам.
При исследовании питьевой воды качественным методом (текущий санэпиднадзор, производственный контроль) засевают 3 объема по 100 мл.
При исследованиях воды с целью количественного определения ОКБ и ТКБ при повторном анализе производят посев: 3 объемов по 100 мл, 3 объемов по 10 мл, 3 объемов по 1 мл.
Каждый объем исследуемой воды засевают в лактозо-пептонную среду, приготовленную по п. 5.5. Посев 100 мл и 10 мл воды производят в 10 и 1 мл концентрированной лактозо-пептонной среды, посев 1 мл пробы проводят в 10 мл среды обычной концентрации.
Посевы инкубируют при (37 ± 1) °С в течение 48 ч. Не ранее 24 час инкубации проводят предварительную оценку посевов. Из емкостей, где отмечено наличие роста (помутнение) и образование газа, производят высев бактериологической петлей на сектора среды Эндо ( п. 5.4.1) для получения изолированных колоний.
Емкости без наличия роста и образования газа оставляют в термостате и окончательно просматривают через 48 ч. Посевы без признаков роста считают отрицательными и дальнейшему исследованию они не подлежат. Из емкостей, где отмечено помутнение и образование газа или только помутнение, делают высев на сектора среды Эндо.
Посевы на среде Эндо инкубируют при температуре (37 ± 1) °С в течение (18 — 20) ч.
При образовании помутнения и газа в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий: темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде, дают положительный ответ на присутствие общих колиформных бактерий в данном объеме пробы.
Наличие ОКБ требуется подтвердить:
· если в среде накопления отмечено только помутнение;
· если принадлежность к лактозоположительным колониям вызывает сомнение у исследователя.
· проверяют наличие отпечатка на среде Эндо после снятия петлей подозрительной колонии;
· выполняют оксидазный тест по п. 8.2.3.2;
· подтверждают принадлежность к Граму по п. 8.2.3.3;
· подтверждают способность к газообразованию при посеве изолированных 1 — 2 колоний каждого типа с каждого сектора на среду с лактозой по п. 5.6 с последующей инкубацией посевов при температуре (37 ± 1) °С в течение (24 — 48) ч.
При отсутствии изолированных колоний проводят рассев на среду Эндо общепринятыми бактериологическими методами.
Отрицательный ответ дают, если:
· в среде накопления нет признаков роста;
· на секторах среды Эндо нет роста;
· на секторах среды Эндо выросли не характерные для колиформных бактерий колонии (прозрачные с неровными краями, расплывчатые и т.п.);
· все колонии оказались оксидазоположительными;
· все колонии оказались грамположительными;
· если в подтверждающем тесте на среде с углеводом не отмечено газообразования.
Для определения термотолерантных колиформных бактерий работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии. Делают посев 2 — 3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред, приготовленных по п. 5.6.
Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч. Допускается просмотр посевов через (4 — 6) ч.
При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
Допустимо для ускорения выдачи ответа на присутствие ТКБ производить высев 1 мл из объемов среды накопления, где отмечено помутнение и газообразование в пробирке с лактозо-пептонной средой с поплавком по п. 5.6 и прогретой предварительно до температуры 44 °С. Посевы выдерживают в термостате при температуре (44 ± 0,5) °С в течение 24 ч. При обнаружении кислоты и газа дают положительный ответ.
При исследовании 3 объемов по 100 мл результаты оцениваются качественно и при обнаружении ОКБ и ТКБ хотя бы в одном из 3 объемов, делается запись в протоколе «обнаружены в 100 мл».
При исследовании количественным методом определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ по табл. 1.1 приложения 1.
Результат сообщают без доверительного интервала.
При отрицательном ответе на наличие ОКБ и ТКБ во всех исследованных объемах выдают заключение в протоколе «не обнаружены в 100 мл».
8.4.1. Определение понятия показателя
Сулъфитредуцирующие клостридии — спорообразующие анаэробные палочковидные микроорганизмы, редуцирующие сульфит натрия на железо-сульфитном агаре при температуре (44 ± 1) °С в течение (16 — 18) ч.
Метод основан на выращивании посевов в железо-сульфитном агаре в условиях, приближенных к анаэробным, и подсчете числа черных колоний.
8.4.3.1. Пробу воды 20 мл прогревают на водяной бане в пробирках при температуре (75 ± 5) °С в течение 15 мин для исключения вегетативных форм.
При исследовании хлорированной воды прогревание пробы можно не производить.
Из каждой пробы питьевой воды делают посев или фильтруют 20 мл. При необходимости подбирают объемы с таким расчетом, чтобы в посевах (на фильтрах) выросло не более 10 — 15 колоний. При этом ориентируются на результаты предыдущих исследований.
Фильтрование воды производят в соответствии с требованиями, изложенными в п. 7.
8.4.3.2. Определение методом фильтрования в пробирках
Перед посевом пробирки с железо-сульфитным агаром, приготовленным по п. 5.8, расплавляют на водяной бане (не кипятить!). В течение посева поддерживают среду нагретой до (70 — 80) °С в водяной бане.
После фильтрования установленного объема воды мембранный фильтр фламбированным пинцетом берут за два противоположных края и согнутый в виде трубочки помещают в пробирку с горячим агаром. Сторона фильтра с осевшими бактериями обращена внутрь. При этом фильтр распрямляется и располагается по стенке пробирки.
Сразу же после посева пробирку с агаром и фильтром для создания анаэробных условий быстро охлаждают, помещая в емкость с холодной водой. Культивируют посевы при (44 ± 1) °С в течение (16 — 18) ч.
8.4.3.3. Определение методом фильтрования в чашках Петри
Чашки Петри диаметром (55 — 60) мм заливают тонким слоем железо-сульфитного агара. После фильтрации фильтр поместить фильтрующей поверхностью вниз на застывшую питательную среду так, чтобы под фильтром не было пузырьков воздуха. Затем заливают расплавленным железо-сульфитным агаром до верхнего края чашки, чтобы крышка плотно прилегала к среде для создания анаэробных условий. Культивируют посевы при (44 ± 1) °С в течение (16 — 18) ч.
8.4.3.4. Определение прямым посевом
Железо-сульфитный агар во флаконах и пробу воды готовят, как это описано в п. 8.4.3.1.
В стерильные пробирки вносят:
· по 10 мл в 2 пробирки (объемом не менее 30 мл) или
· по 5 мл в 4 пробирки (объемом по 15 мл).
Посевы заливают горячим железо-сульфитным агаром в количестве, превышающем объем воды в 2 раза. Среду заливать по стенке пробирки, избегая образования пузырьков воздуха. После этого пробирку быстро охлаждают, помещая ее в емкость с холодной водой для создания анаэробных условий. Посевы инкубируют при (44 ± 1) °С в течение (16 — 18) ч.
Количественному учету подлежат только те посевы, где получены изолированные колонии. Подсчитывают черные колонии, выросшие как на фильтрах, так и в толще питательной среды.
Результат анализа выражают числом колониеобразующих единиц (КОЕ) спор сульфитредуцирующих клостридий в 20 мл воды.
При отсутствии роста черных колоний на всех фильтрах дают ответ «не обнаружено в 20 мл воды».
При невозможности учета колоний из-за сливного роста результат оценивается как качественный, в протоколе отмечают «обнаружено в 20 мл». При необходимости получения количественного результата анализ повторяют.
8.5.1. Определение понятия показателя
Колифаги — бактериальные вирусы, способные лизировать E. coli и формировать при температуре (37 ± 1) °С через (18 ± 2) ч зоны лизиса бактериального газона (бляшки) на питательном агаре.
8.5.2. Титрационный метод определения колифагов
Определение колифагов в питьевой воде заключается в предварительном накоплении колифагов в среде обогащения на культуре E. coli и последующем выявлении зон лизиса (просветления) газона E. coli на питательном агаре.
Метод предназначен для проведения текущего контроля качества питьевой воды.
8.5.2.3. Подготовка тест-культуры E. coli К12 Str R .
На всех этапах исследования используют бактериальную взвесь, приготовленную следующим образом: культуру E. coli засевают в пробирку со скошенным питательным агаром со стрептомицином ( п. 5.3.5). Через (18 ± 2) ч инкубации при температуре (37 ± 1) °С произвести смыв бактерий с косяка 5 мл стерильного физиологического раствора (0,85 %-ный раствор NaCl ) и по стандарту мутности готовят взвесь E. coli в концентрации 10 9 бактериальных клеток в 1 мл.
Допускается использование 4-часовой бульонной культуры E. coli, полученной путем подращивания в термостате при температуре 37 °С. Концентрация 10 9 бактериальных клеток E. coli содержится в 2 мл.
8.5.2.4. Проведение качественного анализа
В исследуемую пробу воды объемом 100 мл вносят 10 мл 10-кратного питательного бульона (приготовленного по п. 5.2.2) и 1 мл подготовленного смыва тест-культуры или 2 мл 4-часовой бульонной культуры ( п. 8.5.2.3).
Для контроля культуры 0,1 мл смыва бактерий Е. c oli (или 0,2 мл 4-часовой бульонной культуры) помещают в чашку Петри и заливают питательным агаром.
Исследуемую пробу воды (100 мл) и чашку Петри с контролем E. coli помещают в термостат и инкубируют при температуре (37 ± 1) °С в течение (18 ± 2) ч.
После инкубации из исследуемой пробы воды отливают в пробирку 10 мл и добавляют 1 мл хлороформа.
Пробирку закрывают стерильной резиновой или силиконовой пробкой, энергично встряхивают для равномерного распределения хлороформа по объему пробы и оставляют при комнатной температуре не менее 15 мин до полного осаждения хлороформа.
В предварительно расплавленный и остуженный до (45 — 49) °С питательный агар добавляют приготовленный смыв бактерий E. coli ( п. 8.5.2.3) из расчета 1,0 мл смыва (или 2 мл 4-часовой бульонной культуры) на 100 мл агара.
В стерильную чашку Петри пипеткой из пробирки переносят 1 мл обработанной хлороформом пробы (не касаясь хлороформа) и заливают смесью расплавленного и остуженного до (45 — 49) °С питательного агара объемом (12 — 15) мл, а также одну дополнительную чашку Петри для контроля культуры E. coli и осторожно покачивают для равномерного перемешивания пробы воды и агара. Для полного застывания чашки оставляют на столе при комнатной температуре на 10 мин. После застывания чашки переворачивают и помещают в термостат на (18 ± 2) ч при 37 °С.
При выполнении серии проб ставится общий контроль для всей серии.
Просмотр посевов осуществляют в проходящем свете.
Проба считается положительной при наличии полного лизиса, просветления нескольких бляшек, одной бляшки на чашке с пробой воды при отсутствии зон лизиса на контрольной чашке.
В протоколе анализа отмечается: колифаги обнаружены или не обнаружены в 100 мл воды (результат качественный).
При наличии зон лизиса в контроле культуры результат считается недействительным.
8.5.2.5. Проведение количественного анализа
Исследуемую пробу воды в количестве 100 мл разлить на 6 объемов: 1 флакон 50 мл и 5 пробирок по 10 мл. В 50 мл пробы добавить 5 мл десятикратного питательного бульона (по п. 5.2.2) и 0,5 мл смыва (или 1 мл 4-часовой бульонной культуры) бактерий E. coli ( п. 8.5.2.3). В каждые 10 мл пробы внести по 1 мл десятикратного питательного бульона и 0,1 мл смыва (или 0,2 мл 4-часовой бульонной культуры) бактерий E. coli.
Для контроля культуры 0,1 мл смыва бактерий (или 0,2 мл 4-часовой бульонной культуры) E. coli помещают в чашку Петри и заливают питательным агаром.
Посевы инкубируют при температуре (37 ± 1) °С в течение 18 ± 2 ч.
После инкубации из объема 50 мл отлить в пробирку 10 мл. Во все исследуемые 6 объемов добавить по 1 мл хлороформа. Пробирки закрыть стерильными резиновыми или силиконовыми пробками, энергично встряхнуть для равномерного распределения хлороформа по объему пробы и оставить при комнатной температуре не менее 15 мин для осаждения хлороформа.
В предварительно расплавленный и остуженный до (45 — 49) °С питательный агар добавить приготовленный смыв бактерий E. coli ( п. 8.5.2.3) из расчета 1,0 мл смыва (или 2 мл 4-часовой бульонной культуры) на 100 мл агара. Приготовленную смесь разлить в чашки Петри: 1 чашку для контроля культуры E. coli на лизогенность и по одной чашке на каждую исследуемую пробу воды. При одновременном анализе нескольких проб воды ставится один контроль культуры E. coli.
После застывания агара чашки, предназначенные для посева проб, разделить на 6 секторов, промаркировать их в соответствии с исследуемыми объемами. На каждый сектор из соответствующей пробирки нанести пастеровской пипеткой (микропипеткой или бактериологической петлей продольным штрихом) по 1 капле надосадочной жидкости (без хлороформа).
После подсыхания капель чашки с исследуемыми пробами и контрольную чашку поместить в термостат при (37 ± 1) °С на (18 ± 2) ч.
Просмотр результатов осуществляется в проходящем свете.
Учет проводится по наличию зон просветления (лизиса) на секторах газона E. coli.
При применении капельного способа посева пипеткой образуется зона лизиса в виде округлого пятна или отдельных бляшек. При посеве продольным штрихом бактериологической петлей отмечается лизис по ходу штриха.
Проба считается положительной при наличии зоны лизиса хотя бы на одном секторе при отсутствии зон лизиса на контрольной чашке.
Оценка проводится по таблице наиболее вероятного числа (НВЧ) бляшкообразующих единиц (БОЕ) (табл. 1.2). В протоколе анализа указывается наиболее вероятное количество колифагов в 100 мл воды и диапазон возможных колебаний: НВЧ БОЕ (нижний предел — верхний предел) колифагов в 100 мл. Результат полуколичественный.
При наличии зон лизиса в контрольной чашке результат считать недействительным.
8.5.3. Прямой метод определения колифагов
Определение колифагов в питьевой воде заключается в исследовании нормируемого объема воды (100 мл) путем его прямого посева и последующего учета зон лизиса (бляшек) на газоне E. coli в чашках Петри с питательным агаром.
Прямой метод выделения колифагов из воды проводят параллельно с титрационным при исследованиях по эпидемическим показаниям.
В питательный агар двойной концентрации ( п. 5.3.2), расплавленный и остуженный до (45 — 49) °С, добавить смыв E. coli ( п. 8.5.2.3) из расчета 2,0 мл смыва (или 4 мл 4-часовой бульонной культуры) на каждые 100 мл агара, перемешать. Исследуемые 100 мл воды разлить по 20 мл в большие пробирки, нагреть до (35 — 44) °С и немедленно (не более чем через 5 мин по достижении требуемой температуры) разлить в 5 чашек Петри и сразу же внести в каждую чашку по 20 мл смеси агара с культурой E. coli.
Для контроля культуры E. coli в одну чашку Петри внести 20 мл стерильной водопроводной воды, предварительно прогретой до (35 — 44) °С, залить 20 мл приготовленного агара с E. coli и осторожно перемешать.
Содержимое чашек осторожно перемешать и оставить при комнатной температуре до застывания. Чашки с застывшим агаром поместить дном вверх в термостат и инкубировать при температуре (37 ± 1) °С в течение (18 ± 2) ч.
Просмотр посевов осуществляется в проходящем свете.
Учет результатов проводят путем подсчета и суммирования бляшек, выросших на 5 чашках Петри. Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 мл пробы воды. В контрольной чашке бляшки должны отсутствовать.
Наиболее часто зоны лизиса выглядят прозрачными пятнами на фоне газона тест-культуры питательного агара в виде круглых изолированных бляшек (от 1 до 5 — 7) мм в диаметре с четко выраженными либо стертыми границами.
При высоких концентрациях фага наблюдается разная картина лизиса.
Слияние негативных колоний дает «ажурный» газон E. coli, рост единичных колоний E. coli на фоне сплошного лизиса, либо полное отсутствие роста на чашке.
При прямом посеве возможен лизис, маскируемый негомогенно застывшим агаром, а также закрытый сопутствующей микрофлорой. Капли конденсата и негомогенно застывший при прямом посеве агар могут приводить к образованию артефактов на газоне E. coli, визуально напоминающих лизис.
Предварительный учет результатов можно проводить через (5 — 6) ч инкубации. На этом этапе при наличии четких зон лизиса может быть выдан предварительный ответ о присутствии колифагов в воде.
Окончательный количественный учет прямого посева проводится через (18 ± 2) ч. Результаты выражают количеством бляшкообразующих единиц (БОЕ) на 100 мл пробы воды.
Если отмечен сливной рост бляшек и счет затруднителен, то по данным прямого посева может быть выдан качественный результат: «обнаружено в 100 мл воды».
При получении отрицательного результата при работе прямым методом окончательный ответ выдается по результатам титрационного метода.
При наличии зон лизиса в контрольной чашке результат исследования считается недействительным.
8.5.4.1. Отрицательный контроль
Отрицательный контроль подтверждает отсутствие контаминации фагом питательных сред, лабораторной посуды, оборудования на этапах подготовки и проведения анализа, а также позволяет оценить способность тест-культуры E. coli давать равномерный газон.
Отрицательным контролем служит исследование стерильной водопроводной воды, проводимое аналогично анализируемой пробе воды. Так, при анализе воды титрационным методом 10 мл стерильной водопроводной воды вносят в дополнительную пробирку. При анализе воды прямым посевом в дополнительную шестую чашку Петри вносят 20 мл стерильной водопроводной воды.
Дополнительные посевы исследуются на колифаги аналогично основным пробам.
При анализе серии проб отрицательный контроль может быть один на каждый вид анализа: титрационный и прямой. В этом случае постановка отрицательного контроля поэтапно осуществляется после обработки всех проб данной серии.
В случае обнаружения бляшек колифагов в чашках с отрицательным контролем результаты исследования всей серии проб воды недействительны.
Следует проверить стерильность лабораторного оборудования, посуды, питательных сред, а также повторить контрольный посев на чистоту тест-штамма E. coli К12 F + Str R .
Кратность проведения отрицательного контроля — 1 раз в день.
8.5.4.2. Методика подтверждения фаговой природы лизиса
В сомнительных случаях при работе как титрационным, так и прямым методами необходимо провести контрольный посев на подтверждение фаговой природы лизиса.
С этой целью бактериологической петлей извлекают участок агара, подозрительный на колифаги, помещают его в 5 мл питательного бульона, куда добавляют каплю тест-культуры E. coli и инкубируют при 37 °С в течение (16 — 18) ч. Полученную культуру обрабатывают хлороформом и исследуют на наличие фага. Высев осуществляют петлей или пипеткой на сектора питательного агара аналогично способу, описанному в п. 8.5.2.5. Лизис на любом из секторов расценивается как подтверждение наличия фага.
Таблицы расчета наиболее вероятного числа микроорганизмов
Расчет наиболее вероятного числа бактерий в 100 мл питьевой воды
источник


