ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы измерения массовой концентрации
Methods for determination
Настоящий стандарт распространяется на питьевую воду и устанавливает колориметрические методы измерения массовой концентрации общего железа.
1.1. Пробы воды отбирают по ГОСТ 2874 и ГОСТ 24481.
1.2. Объем пробы воды для измерения массовой концентрации железа должен быть не менее 200 см 3 .
1.3. Способы консервирования, сроки и условия хранения проб воды, предназначенных для измерения массовой концентрации общего железа, — по ГОСТ 24481.
(Измененная редакция, Изм. № 2).
Метод основан на взаимодействии ионов железа в щелочной среде с сульфосалициловой кислотой с образованием окрашенного в желтый цвет комплексного соединения. Интенсивность окраски, пропорциональную массовой концентрации железа, измеряют при длине волны 400-430 нм. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,10-2,00 мг/дм 3 . В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм 3 .
Фотоколориметр любого типа с фиолетовым светофильтром ( 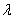
Кюветы с толщиной рабочего слоя 2-5 см.
Весы аналитические лабораторные, класс точности 1, 2 по ГОСТ 24104.
Колбы мерные 2-го класса, вместимостью 50, 100, 1000 см 3 по ГОСТ 1770.
Пипетки мерные без делений вместимостью 50 см 3 и пипетки мерные с ценой наименьшего деления 0,1-0,05 см 3 , вместимостью 1, 5 и 10 см 3 2-го класса по нормативно-техническому документу.
Колбы стеклянные лабораторные конические номинальной вместимостью 100 см 3 , типа Кн по ГОСТ 25336.
Аммоний хлористый по ГОСТ 3773.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота соляная по ГОСТ 3118.
Кислота сульфосалициловая по ГОСТ 4478.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч.д.а).
2.3.1. Приготовление основного стандартного раствора железо-аммонийных квасцов
0,8636 г железоаммонийных квасцов FeNH 4 ( SO 4 )2 × 12 H 2 O взвешивают с точностью, не превышающей 0,0002 г по шкале весов, растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды, добавляют 2,00 см 3 соляной кислоты плотностью 1,19 г/см 3 и доводят до метки дистиллированной водой. 1 см 3 раствора содержит 0.1 мг железа.
Срок и условия хранения раствора — по ГОСТ 4212.
2.3.2. Приготовление рабочего стандартного раствора железоаммонийных квасцов
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 20 раз. 1 см 3 раствора содержит 0,005 мг железа.
2.3.3. Приготовление раствора сульфосалициловой кислоты
20 г сульфосалициловой кислоты растворяют в мерной колбе вместимостью 100 см 3 в небольшом количестве дистиллированной воды и доводят этой водой до метки.
2.3.4. Приготовление раствора хлористого аммония молярной концентрации 2 моль/дм 3
107 г NH 4 Cl растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды и доводят этой водой до метки.
2.3.5. Приготовление раствора аммиака (1:1)
100 см 3 25 %-ного раствора аммиака приливают к 100 см 3 дистиллированной воды и перемешивают.
При массовой концентрации общего железа не более 2,00 мг/дм 3 отбирают 50 см 3 исследуемой воды (при большей массовой концентрации железа пробу разбавляют дистиллированной водой) и помещают в коническую колбу вместимостью 100 см 3 . Если проба при отборе не консервировалась кислотой, то к 50 см 3 добавляют 0,20 см 3 соляной кислоты плотностью 1,19 г/см 3 . Пробу воды нагревают до кипения и упаривают до объема 35-40 см 3 . Раствор охлаждают до комнатной температуры, переносят в мерную колбу вместимостью 50 см 3 , ополаскивают 2-3 раза по 1 см 3 дистиллированной водой, сливая эти порции в ту же мерную колбу. Затем к полученному раствору прибавляют 1,00 см 3 хлористого аммония, 1,00 см 3 сульфосалициловой кислоты, 1,00 см 3 раствора аммиака (1:1), тщательно перемешивая после добавления каждого реактива. По индикаторной бумаге определяют значение рН раствора, которое должно быть 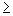
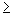
Объем раствора в мерной колбе доводят до метки дистиллированной водой, оставляют стоять 5 мин для развития окраски. Измеряют оптическую плотность окрашенных растворов, используя фиолетовый светофильтр ( 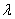
Для построения градуировочного графика в ряд мерных колб вместимостью 50 см 3 наливают 0,0; 1,0; 2,0; 5,0. 10,0; 15,0; 20,0 см 3 рабочего стандартного раствора, доводят до метки дистиллированной водой, перемешивают и анализируют, как исследуемую воду. Получают шкалу растворов, соответствующих массовым концентрациям железа 0,0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0 мг/дм 3 .
Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию железа, а по оси ординат — соответствующие значения оптической плотности. Построение градуировочного графика повторяют для каждой партии реактивов и не реже одного раза в квартал.
Массовую концентрацию железа (X) в анализируемой пробе, мг/дм 3 с учетом разбавления вычисляют по формуле
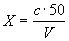
где с — концентрация железа, найденная по градуировочному графику, мг/дм 3 ;
V — объем воды, взятый для анализа, см 3 ;
50 — объем, до которого разбавлена проба, см 3 .
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных измерений, допустимое расхождение между которыми не должно превышать 25 % при массовой концентрации железа на уровне предельно допустимой. Результат округляют до двух значащих цифр.
Сходимость результатов анализа ( А) в процентах вычисляют по формуле
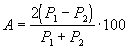
где Р1 — больший результат из двух параллельных измерений;
Р 2 — меньший результат из двух параллельных измерений.
Разд. 2. (Измененная редакция, Изм. № 2).
Метод основан на реакции ортофенантролина с ионами двухвалентного железа в области рН 3-9 с образованием комплексного соединения, окрашенного в оранжево-красный цвет. Интенсивность окраски пропорциональна концентрации железа. Восстановление железа до двухвалентного проводится в кислой среде гидроксиламином. Окраска развивается быстро при рН 3,0-3,5 в присутствии избытка фенантролина и устойчива в течение нескольких дней. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,05-2,0 мг/дм 3 . В этом интервале суммарная погрешность измерения с вероятностью Р = 0,95 находится в пределах 0,01-0,02 мг/дм 3 .
(Измененная редакция, Изм. № 2).
3.2. Аппаратура, материалы и реактивы
Фотоэлектроколориметр различных марок.
Кюветы с толщиной рабочего слоя 2-5 см.
Колбы мерные 2-го класса точности по ГОСТ 1770, вместимостью 50 и 1000 см 3 .
Пипетки мерные без делений, вместимостью 10, 25 и 50 см 3 и пипетки мерные с делениями 0,1-0,01 см 3 вместимостью 1, 2 и 5 см 3 2-го класса точности по нормативно-техническому документу.
Колбы плоскодонные по ГОСТ 25336, вместимостью 150-200 см 3 .
Аммоний уксуснокислый по ГОСТ 3117.
Гидроксиламин солянокислый по ГОСТ 5456.
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота соляная по ГОСТ 3118.
Кислота уксусная по ГОСТ 61.
Вода дистиллированная по ГОСТ 6709.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3.1. Приготовление раствора ортофенантролина
0,1 г моногидрата ортофенантролина ( C 12 Н8 N 2 × H 2 O ), взвешенного с погрешностью не более 0,01 г, растворяют в 100 см 3 дистиллированной воды, подкисленной 2-3 каплями концентрированной соляной кислоты. Реактив сохраняют на холоде в темной склянке с притертой пробкой. 1 см 3 этого реактива связывает в комплекс 0,1 мг железа.
3.3.2. Приготовление 10%-ного раствора солянокислого гидроксиламина
10 г солянокислого гидроксиламина ( NH 2 OH × HCl ), взвешенного с погрешностью не более 0,1 г, растворяют в дистиллированной воде и доводят объем до 100 см 3 .
3.3.3. Приготовление буферного раствора
250 г уксуснокислого аммония ( N Н4С2Н3 O 2 ), взвешенного с погрешностью не более 0,1 г, растворяют в 150 см 3 дистиллированной воды. Добавляют 70 см 3 уксусной кислоты и доводят объем до 1 дм 3 дистиллированной водой.
(Измененная редакция, Изм. № 2).
3.3.4. Приготовление основного стандартного раствора железоаммонийных квасцов — по п. 2.3.1.
3.3.5. Приготовление рабочего стандартного раствора железоаммонийных квасцов — по п. 2.3.2.
3.3.4; 3.3.5. (Измененная редакция, Изм. № 2).
Определению мешают цианиды, нитриты, полифосфаты; хром и цинк в концентрации, превышающей в 10 раз массовую концентрацию железа; кобальт и медь в концентрации более 5 мг/дм 3 и никель в концентрации 2 мг/дм 3 . Предварительное кипячение воды с кислотой превращает полифосфаты в ортофосфаты, добавлением гидроксиламина устраняется мешающее влияние окислителей. Мешающее влияние меди уменьшается при рН 2,5-4.
При отсутствии полифосфатов исследуемую воду тщательно перемешивают и отбирают 25 см 3 (или меньший объем, содержащий не более 0,1 мг железа, разбавленный, до 25 см 3 дистиллированной водой) в мерную колбу вместимостью 50 см 3 . Если при отборе пробы вода была подкислена, то ее нейтрализуют 25 %-ным раствором аммиака до рН 4-5, контролируя потенциометрически или по индикаторной бумаге. Затем добавляют 1 см 3 солянокислого раствора гидроксиламина, 2,00 см 3 ацетатного буферного раствора и 1 см 3 раствора ортофенантролина. После прибавления каждого реактива раствор перемешивают, затем доводят объем до 50 см 3 дистиллированной водой, тщательно перемешивают и оставляют на 15-20 мин для полного развития окраски.
Окрашенный раствор фотометрируют при сине-зеленом светофильтре ( 
Массовую концентрацию железа находят по градуировочному графику.
В присутствии полифосфатов 25 см 3 исследуемой пробы помещают в плоскодонную колбу вместимостью 100-150 см 3 , прибавляют 1 см 3 концентрированной соляной кислоты, нагревают до кипения и упаривают до объема 15-20 см 3 . После охлаждения раствора его переносят в мерную колбу вместимостью 50 см 3 , добавляют дистиллированную воду до объема примерно 25 см 3 и доводят 25 %-ным раствором аммиака до рН 4-5, контролируя потенциометрически или по индикаторной бумаге.
Далее прибавляют реактивы и проводят анализ, как указано выше (при отсутствии полифосфатов).
Для построения градуировочного графика в мерные колбы вместимостью 50 см 3 вносят 0,0; 0,5; 1,0; 2,0; 3.0; 4,0; 5,0; 10,0; 20,0 см 3 рабочего стандартного раствора, содержащего в 1 см 3 0,005 мг железа, доводят объем дистиллированной водой приблизительно до 25 см 3 и анализируют так же, как и исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 1,0 и 2,0 мг/дм 3 . Фотометрируют в тех же условиях, что и пробу. Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию общего железа в мг/дм 3 а на оси ординат — соответствующие значения оптической плотности.
(Измененная редакция, Изм. № 2).
3.5. Массовую концентрацию общего железа вычисляют по п. 2.5.
(Измененная редакция, Изм. № 2).
Метод основан на взаимодействии ионов двухвалентного железа с 2,2-дипиридилом в области рН 3,5-8,5 с образованием окрашенного в красный цвет комплексного соединения. Интенсивность окраски пропорциональна массовой концентрации железа. Восстановление трехвалентного железа до двухвалентного проводится гидроксиламином. Окраска развивается быстро и устойчива в течение нескольких дней. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,05-2,00 мг/дм 3 .
В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм 3 .
(Измененная редакция, Изм. № 2).
4.2. Аппаратура, материалы, реактивы
Фотоэлектроколориметр любой марки.
Кюветы с толщиной оптического слоя 2-5 см.
Колбы мерные 2-го класса точности по ГОСТ 1770, вместимостью 50, 100 и 1000 см 3 .
Пипетки мерные без делений, вместимостью 25 см 3 н пипетки мерные с делениями 0,1-0,01 см 3 , вместимостью 1, 5 и 10 см 3 2-го класса точности по нормативно-техническому документу.
Аммоний уксуснокислый по ГОСТ 3117.
Гидроксиламин солянокислый по ГОСТ 5456.
2,2-дипиридил ( 
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота уксусная по ГОСТ 61.
Спирт этиловый ректификованный по ГОСТ 18300, высшего сорта.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч. д. а.).
(Измененная редакция, Изм. № 2).
4.3.1. Приготовление основного стандартного раствора железоаммонийных квасцов — по п. 2.3.1.
4.3.2. Приготовление рабочего стандартного раствора железоаммонийных квасцов — по п. 2.3.2.
4.3.1; 4.3.2. (Измененная редакция, Изм. № 2).
4.3.3. Приготовление 10 %-ного раствора солянокислого гидроксиламина — по п. 3.3.2.
4.3.4. Приготовление ацетатного буферного раствора — по п. 3.3.3.
4.3.5. Приготовление 0,1 %-ного раствора 2,2-дипиридила.
0,1 г 2,2-дипиридила, взвешенного с погрешностью не более 0,01 г, растворяют в 5,00 см 3 этилового спирта и разбавляют в 100 см 3 дистиллированной воды.
Для определения массовой концентрации общего железа исследуемую воду тщательно перемешивают и отбирают 25 см 3 (или меньший объем, содержащий не более 0,1 мг железа) в мерную колбу вместимостью 50 см 3 . Прибавляют 1 см 3 раствора гидроксиламина солянокислого, 2,00 см 3 ацетатного буферного раствора, 1,00 см 3 раствора 2,2-дипириднла и доводят до метки дистиллированной водой. После добавления каждого реактива содержимое колбы перемешивают. Раствор оставляют на 15-20 мин для полного развития окраски. Окрашенный раствор фотометрируют, применяя зеленый светофильтр ( 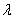
Массовую концентрацию железа находят по градуировочному графику.
Для построения градуировочного графика в мерные колбы вместимостью 50 см 3 вносят 0,0; 2,0; 5,0; 10,0; 15,0; 20,0 см 3 рабочего стандартного раствора железоаммонийных квасцов. Добавляют дистиллированной воды до объема примерно 25 см 3 . Далее растворы проводят через весь ход анализа так же, как исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,2; 0,5; 1,0; 1,5; 2,0 мг/дм 3 . Оптическую плотность измеряют в тех же условиях, что и пробы. Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию железа в мг/дм 3 , а по оси ординат — соответствующие значения оптической плотности.
Массовую концентрацию общего железа вычисляют по п. 2.5.
4.3.5; 4.4; 4.5. (Измененная редакция, Изм. № 2).
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 09.10.72 № 1855
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
источник
Содержание железа в воде – распространенное явление. В большинстве своем оно приносит пользу организму, но не стоит безоглядно пользоваться водой, содержащей данную примесь.
Поведение железа в воде зависит от валентности и взаимодействий с другими соединениями.
Железо в воде может быть в нескольких видах:
- Трехвалентное – не растворяется, придает воде желтый оттенок и оседает в виде бурого осадка;
- Соединенное с молекулами органики – придает воде желтый цвет и не выпадает в осадок;
- Двухвалентное – хорошо растворяется и не окрашивает воду;
- Бактериальное – образует радужную пленку и желеобразные отложение в водопроводе.
Возникновение железа в питьевой воде обусловлено коррозией водопроводных труб и очистных сооружений, которые фильтруют воду перед подачей в дома и квартиры.
Появление железа в воде из скважины связано с процессами растворения горных пород, а также с подземными стоками промышленных предприятий и сельскохозяйственных производств.
Для нормального функционирования организма человеку нужно употреблять в сутки 1-2 мг железа, но накопленный избыток негативно отражается на здоровье и угрожает жизни.
Чрезмерное содержание данной примеси в воде вызывает коррозию металлов и сокращает срок эксплуатации водопроводной системы.
ПДК железа в воде составляет 0,3 мг на литр. Данное значение установлено санитарными нормами. В связи тем, что влияние железа на организм не до конца изучено, а потребление элемента в сутки зависит от массы тела человека, ВОЗ не устанавливает определенных границ.
Самым надежным способом определения содержания железа в воде будет лабораторный анализ.
К первичным признакам избытка железа относятся:
- Ржавый налет на дне металлической посуды;
- «Металлический» привкус воды;
- Ржавые потеки на сантехнике;
- Обесцвечивание белья после стирки.
Чтобы анализ воды на железо показал точный результат, необходимо правильно собрать исследуемый материал. Для начала необходимо слить воду в течении 10 минут и хорошо промыть тару в исходной воде без моющих средств. Затем набрать воду тонкой струей под самую крышку, выдавить воздух, плотно закрыть емкость и доставить в пункт приема проб.
Что делать, если в воде много железа? Правильнее всего будет установить фильтр. Очистка в воде железа с помощью фильтра происходит двумя способами:
- Ионный обмен – гранулированные ионные смолы заменяют железо натрием, используется для технологических целей;
- Использование сильных окислителей – с помощью гипохлорида натрия или марганцовки; требует тщательной дозировки; дорогостоящий метод, больше подходит для технологических целей;
- Аэрация – создание интенсивного воздухообмена искусственным путем, в результате чего вода насыщается кислородом, который окисляет железо;
- Осмос – самая эффективная система очистки от двухвалентного железа.
В лаборатории «ИОН» вы сможете провести анализ вашей воды, узнать все о ее состоянии и получить рекомендации по улучшению качества. Мы работаем более 20-ти лет, используя современное оборудование и качественные материалы. Наши сотрудники – профессионалы своего дела. Лаборатория проводит исследование питьевой, талой, морской, технологической, водоемной и других видов вод. Мы сотрудничаем с крупнейшими разработчиками аналитического оборудования и постоянно ищем новые методы диагностики веществ и материалов. Мы осуществляем пробы с материалов Москвы и московской области.
Марганец в воде – довольно распространенное явление. Это вещество представляет из себя легкорастворимый минерал, занимающий 14 место среди общего количества. Содержание марганца в воде способно как принести организму пользу, так и причинить вред.
Сероводород — это газ, имеющий характерный неприятный запах (запах тухлых яиц). Содержание данной примеси практически не меняет цвет воды, но придает ей сладковатый привкус. Воду с повышенным содержанием сероводорода нельзя употреблять в пищу.
* Бесплатный выезд для физических лиц в пределах МКАД при заказе на сумму более 5 000 ₽. Подробнее в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора/оценки работы фильтров
- Не включает определение тяжелых металлов
- Не включает определение органических загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний, марганец, калий, магний, кальций;
- анионы: фториды, хлориды, нитраты, сульфаты, карбонаты, гидрокарбонаты.
Данный анализ рекомендуется для воды централизованных систем водоснабжения. По протоколу анализа «Начальный» также можно сделать вывод о корректности работы системы водоочистки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов.
- Точность определений
- Подходит для водопроводной воды
- Позволяет оценить эффективность работы системы водоочистки
- Позволяет корректно настроить водоочистное оборудование
- Срок выполнения — 5 рабочих дней
- Не включает определение тяжелых металлов
- Не включает определение органических загрязнителей
- Не подходит для полной проверки воды из колодца или скважины
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний, марганец, калий, магний, кальций, алюминий, натрий;
- анионы: фториды, хлориды, нитраты, сульфаты, карбонаты, гидрокарбонаты;
- тяжелые металлы и металлоиды: медь, мышьяк, свинец, кадмий, цинк, стронций.
Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Помимо катионов и анионов, органолептических и общих химических параметров содержит перечень основных тяжелых металлов и метталоидов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить. Если вода из Вашего источника имеет выраженный запах сероводорода (запах тухлых яиц), рекомендуем дополнительно проверить воду на содержание сероводорода.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Срок выполнения — 5-6 рабочих дней
Анализ «СанПиН» предназначен для исследования воды по максимальному перечню загрязнителей, вне зависимости от источника, и включает 61 параметр:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная, сероводород, хлор общий, хлор остаточный свободный, нефтепродукты;
- катионы: железо, аммоний, марганец, калий, магний, кальций, алюминий, натрий, литий;
- анионы: фториды, хлориды, нитраты, нитриты, фосфаты, сульфаты, сульфиды, гидросульфиды, карбонаты, гидрокарбонаты;
- тяжелые металлы и металлоиды: барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть;
- органические компаненты: АПАВ, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол.
Данное исследование рекомендуется тем, кто серьезно относится к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
- Срок выполнения — 5-6 рабочих дней
Помимо хичиеского анализа мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ включает определение общего микробного числа (ОМЧ), общих колиформных и колиформных термотолерантных бактерий.
Важен правильный отбор проб и оперативная доставка образцов в лабораторию или пункт приема проб. Подробная информация здесь
Если у Вас есть точный перечень параметров, Вы можете заказать анализ по Индивидуальному перечню показателей. Минимальный чек на индивидуальный анализ — 1 500 руб! Для расчета стоимости позвоните нам по номеру +7 (495) 149-23-57 или напишите на почту info@ion-lab.ru.
Анализ «Водоем / Аквариум» включает в себя перечень параметров, превышения по которым чаще всего встречаются в водоемах. Анализ включает определение основных химических параметров.
Химические параметры:
- общехимические : рН, нефтепродукты, аммоний, ХПК, БПК5, АПАВ, фенол;
- анионы : нитраты, сульфаты, хлориды, нитриты, фосфаты, фториды;
- тяжелые металлы и металлоиды : марганец, железо общее, ртуть, цинк, никель, кадмий, мышьяк, медь, свинец, хром.
Нормирование осуществляется по №552 Минсельхоза РФ от 13.12.2016 г «Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения.»
источник
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Лабораторная работа № 2.
ВОДОПОДГОТОВКА.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ РАСТВОРЕННОГО ЖЕЛЕЗА В ВОДЕ.
Цель работы: определить содержание железа в сточной или природной воде фотоколориметрическим методом.
Общие сведения.
Железо (Ferrum) – принадлежит к 8 группе химических элементов периодической системы Д.И. Менделеева, атомная масса 55,847, атомный номер 26, плотность 7,874 г/см 3 , серебристо – белый блестящий пластичный металл, температура плавления 1535 o С. Железо достаточно распространено в земле (4 место) находится на 2 месте после алюминия; процентное содержание 4,65 %.
Главными источниками попадания соединений железа в поверхностные воды являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. В питьевой воде железо может содержаться также из-за плохого состояния водопроводов и применения коагулянтов на основе солей железа.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот – единицы миллиграммов. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм 3 ) наблюдается в подземных водах с низкими значениями pH. Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Концентрация железа подвержена сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации ионов железа в придонных слоях воды. Предельно допустимая концентрация общего железа в воде водоемов 0.5 мг/л.
Содержание железа в воде выше 1-2 мг Fe 3+ в 1 дм 3 значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. По органолептическим показателям воды содержание железа в питьевой воде не должно превышать 0.3 мг/л (а по нормам ЕС даже 0.2 мг/л). Лишь в отдельных случаях при использовании подземных вод без установок по обезжелезиванию по согласованию с органами санитарно-эпидемиологической службы содержание железа в воде, поступающей в водопроводную сеть, допускается до 1 мг/л.
В поверхностных пресных водах железо содержится в очень не больших количествах, и, как правило, в трехвалентной форме. Повышенное содержание железа наблюдается в болотистых водах, до нескольких миллиграммов на литр, в таких водах повышенное содержание гумусовых веществ, которые соединены с трехвалентным железом. При высоких значениях pH железо в воде находится в коллоидной форме оксида железа Fe(OH)3. В подземных водах с низкими значениями pHи при минимальном содержании растворенного кислорода железо присутствует в растворенной двухвалентной форме. Трехвалентное железо при определенных условиях также может присутствовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
При содержании в воде железа в концентрациях выше 0.3 мг/л вода после непродолжительного контакта с воздухом окисляется кислородом и становится желтовато – бурого цвета. Такая вода вызывает появление ржавых подтеков на сантехнике, отложения в котельном и бойлерном оборудовании. При концентрациях выше 1 мг/л вода мутная окрашивается в желто-бурый цвет при не длительном контакте с воздухом. Такая вода не допустима для использования, как в питьевых, так и в технических целях.
Железо человек получает в основном с пищей, из воды – максимально 10%. Также возможно попадание железа из воздуха, при этом вероятно возникновение профессиональных заболеваний. ВОЗ не дает рекомендуемой величины потребления железа по показаниям здоровья. В больших количествах железо, как и любое другое химическое вещество, способно вызвать в организме человека нарушения и даже патологии.
Виды железа, содержащегося в воде.
Как правило, в воде встречается несколько видов железа (таблица 1).
Двухвалентное железо (Fe +2 ) –в этой форме железо находится в растворенном состоянии. Иногда при определенных значениях pH гидроксид железа Fe(OH)2, выпадает в осадок.
Трехвалентное железо (Fe +3 ) —Хлорид (FeCl3) и сульфат (Fe2(SO4)3) – в растворимой форме, гидроксид железа Fe(OH)3 – в нерастворимом виде (существуют исключения при низком уровне pH).
Органическое железо – существует в различных комплексах, растворимых или в коллоидной форме. Органическое железо трудно удалить из воды. Органическое железо бывает следующих видов:
· Растворимое органическое железо. Способно связывать и удерживать кальций и другие металлы. Некоторые органические молекулы связывают железо в сложные растворимые комплексы – хелаты. Пример, таких органических соединений: порфириновая группа гемоглобина крови (удерживает железо), хлорофилл (удерживает магний), гуминовая кислота.
· Бактериальное железо. Существуют бактерии, использующие растворенное железо для жизни, они получают энергию, преобразуя двухвалентное железо в трехвалентное.
· Коллоидное железо. Коллоиды –частицы размером менее 1 микрона, которые не растворяются в воде, но трудно фильтруются из-за малого размера. К коллоидным частицам также относятся крупные органические молекулы (танины, лигнины). Коллоидные частицы обладают высоким поверхностным зарядом, поэтому они отталкивают друг друга и не укрупняются, образуя в воде суспензии, находящиеся во взвешенном состоянии, вода становится мутной.
Таблица 1 – Виды железа, содержащиеся в воде.
| Тип железа | Вода из-под крана | Вода после отстаивания |
| Двухвалентное | Чистая | Красно-бурый осадок |
| Трехвалентное | Окрашена | Красно-бурый осадок |
| Коллоидное | Желто-бурая | Не образует осадка, Не фильтруется |
| Растворенное органическое | Желто-бурая | |
| Бактериальное | Радужная пленка, желеобразные образования в водопроводной системе. |
Процесс удаления из воды железа называется обезжелезиванием. Очистка воды от железа – одна из самых сложных задач в водоподготовке. Одного универсального экономически оправданного метода очистки, который можно было бы применить во всех случаях для любой воды, не существует. Основные методы обезжелезивания:
· Окисление (реагентное, каталитическое). В результате окисления загрязнения осаждаются (с помощью коагулянтов или без них), потом фильтруются с помощью специальных систем очистки воды.
· Мембранные методы (осмос, обратный осмос, нанофильтрация)
Поскольку железо образует устойчивые окрашенные соединения, для его определения можно использовать фотоколориметрические методы.
Фотоколориметрия. Теоретические основы метода.
Закон Бугера – Ламберта — Бера
В основе оптических методов анализа лежит эффект избирательного поглощения света определенной длины волны веществом. Если вещество облучается видимым светом, этот раздел оптических методов анализа называется фотоколориметрией.
При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока I согласно закону Бугера – Ламберта — Бера равна
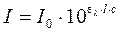
где I – интенсивность падающего потока;
ελ – молярный коэффициент поглощения при данной длине волны;
l – толщина поглощающего слоя (кюветы);
с – концентрация поглощающего вещества, моль/дм 3 .
Или в логарифмической форме:

Величину lg(I/I) в (2), характеризующую поглощающую способность вещества в растворе, называют оптической плотностью. В аналитической практике, стремясь подчеркнуть сущность процесса, лежащего в основе фотометрического определения, а именно поглощение квантов электромагнитного излучения оптического диапазона аналитической формой, эту величину называют поглощением, или светопоглощением и обозначают буквой А (absorption) либо D (density).
Закон Бугера – Ламберта — Бера: оптическая плотность раствора прямо пропорциональна концентрации вещества и толщине поглощающего слоя. Серию аналитических определений выполняют при постоянной толщине поглощающего слоя, тогда оптическая плотность линейно зависит от концентрации (рисунок 1).
Коэффициент линейной регрессии зависимости А = f(С) представляет собой молярный коэффициент поглощения ελ = tg a.
Рисунок 1. – зависимость оптической раствора плотности от концентрации.
Обратите внимание, что эта прямая линия проходит через начало координат. Для раствора поглощающего вещества при постоянных концентрациях и толщине поглощающего слоя оптическая плотность зависит от длины волны, поэтому измерения проводят при длине волны, соответствующей максимальному поглощению.
Приборами для фотоколориметрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Большинство фотометров имеет набор из 10-15 светофильтров и представляет собой прибор, в которых пучок света от источника излучения (лампа накаливания, редко ртутная лампа) проходит через светофильтр и проходит через кювету с исследуемым раствором или раствором сравнения (рисунок 2).
1 – источник света, 2 – щель, 3 – монохроматор (светофильтр),
4 – измерительная ячейка (анализируемый образец, образец сравнения),
5 – детектор, 6 – усилитель, 7 – регистрирующее устройство
(графическое, визуальное, цифровое)
Рисунок 2 – Блок-схема фотоэлектроколориметра (упрощенная)
Количественное определение вещества по светопоглощению основано на применении закона Бугера — Ламберта — Бера. Концентрацию можно определить, пользуясь методом градуировочного графика А = f(C), методом сравнения или методом добавок. Погрешности определения составляют около 5%.
Для перевода вещества в окрашенную форму используются химические реакции. Обязательное требование к реакциям, используемым в количественном анализе – они должны протекать избирательно, быстро и полностью воспроизводимо. Окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, несущее информацию о концентрации поглощающего вещества, должно подчиняться физическим законам, связывающим поглощение и концентрацию, конкретно – закону Бугера – Ламберта – Бера.
Практическая часть.
Ион Fe 3+ с роданид-ионом в зависимости концентрации ионов железа и роданид-ионов дает ряд окрашенных в кроваво-красный цвет комплексов:
Число роданид-анионов n в комплексе железа может изменяться от 1 до 6. В данной работе берется избыток роданид-ионов, при этом образуются комплекс FeSCN6 3- .
Для построения градуировочной кривой используются стандартные растворы, отличающиеся друг от друга по концентрации не менее чем на 10 %.
Растворы готовят непосредственно перед колориметрированием, так как окраска растворов неустойчива.
По серии стандартных растворов соли железа строят градуировочную кривую, выражающую зависимость оптической плотности от концентрации. На оси ординат наносят значения оптической плотности, на оси абсцисс – концентрации. Обычно график строят по 5 – 6 точкам.
Определив плотность исследуемого раствора соли железа, по оси ординат находят точку, которая соответствует данному значению оптической плотности, проводят линию, параллельную оси абсцисс до пересечения ее с градуировочной кривой. Из точки пересечения опускают перпендикуляр на ось абсцисс. Находят Cx.
Определению иона Fe 3+ данным методом мешают некоторые восстановители (S 2- , SO3 2- , Sr 2+ ) и окислители, разрушающие роданид-ион (MnO4 — , NO3 — , H2O2), а также ионы, образующие комплексные соединения с железом (F — , Cl — , PO4 3- ).
Оборудование.
Посуда и материалы
Мерные колбы вместимостью 50 см 3 и 1000 см 3
Пипетки вместимостью 1, 5, 10, 25 см 3 .
1. Основной стандартный раствор железоаммиачных квасцов NH4Fe(SO4)2×12 H2O (додекагидрата сульфата аммония железа III) концентрации 0.1 мг Fe 3+ в 1 см 3 раствора.
2. Рабочий стандартный растворжелезоаммиачных квасцов готовят в день анализа разбавлением основного стандартного раствора в 10 раз (5 см 3 основного раствора отмерить пипеткой, поместить в мерную колбу объемом 50 см 3 и довести до метки дистиллированной водой). В 1 см 3 рабочего стандартного раствора сожержится 0.01 мг железа Fe 3+ .
3. Роданид аммония NH4SCN либо роданид калия KSCN концентрации 50 %.
4. Соляная кислота, плотность 1.12 г/см 3 .
Вопросы для защиты
Информация для лаборантов.
1. железоаммиачные квасцы NH4Fe(SO4)2×12 H2O (додекагидрат сульфата аммония железа III), концентрация 0.1 г Fe 3+ в 1 см 3 .
Навеску свежеперекристаллизованных железоаммиачных квасцов массой 0.8836 г растворяют в мерной колбе объемом 1000 см 3 , добавляют 2 см 3 концентрированной соляной кислоты и доводят до метки дистиллированной водой.
2. Роданид аммония NH4SCN либо роданид калия KSCN концентрации 50 %. Навеску соли массой 50 г растворяют в 50 см 3 дистиллированой воды.
3. Соляная кислота, плотность 1.12 г/см 3 . К 65 см 3 дистиллированной воды приливают 100 см 3 концентрированной соляной кислоты.
4. Аммоний надсернокислый.
5. Вода дистиллированная
1. 7 мерных колб объемом 50 см 3
2. пипетки на 1 (2) и 5 см 3 со шкалой
Оборудование
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Лабораторная работа № 2.
ВОДОПОДГОТОВКА.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ РАСТВОРЕННОГО ЖЕЛЕЗА В ВОДЕ.
Цель работы: определить содержание железа в сточной или природной воде фотоколориметрическим методом.
Общие сведения.
Железо (Ferrum) – принадлежит к 8 группе химических элементов периодической системы Д.И. Менделеева, атомная масса 55,847, атомный номер 26, плотность 7,874 г/см 3 , серебристо – белый блестящий пластичный металл, температура плавления 1535 o С. Железо достаточно распространено в земле (4 место) находится на 2 месте после алюминия; процентное содержание 4,65 %.
Главными источниками попадания соединений железа в поверхностные воды являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. В питьевой воде железо может содержаться также из-за плохого состояния водопроводов и применения коагулянтов на основе солей железа.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот – единицы миллиграммов. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм 3 ) наблюдается в подземных водах с низкими значениями pH. Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Концентрация железа подвержена сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации ионов железа в придонных слоях воды. Предельно допустимая концентрация общего железа в воде водоемов 0.5 мг/л.
Содержание железа в воде выше 1-2 мг Fe 3+ в 1 дм 3 значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. По органолептическим показателям воды содержание железа в питьевой воде не должно превышать 0.3 мг/л (а по нормам ЕС даже 0.2 мг/л). Лишь в отдельных случаях при использовании подземных вод без установок по обезжелезиванию по согласованию с органами санитарно-эпидемиологической службы содержание железа в воде, поступающей в водопроводную сеть, допускается до 1 мг/л.
В поверхностных пресных водах железо содержится в очень не больших количествах, и, как правило, в трехвалентной форме. Повышенное содержание железа наблюдается в болотистых водах, до нескольких миллиграммов на литр, в таких водах повышенное содержание гумусовых веществ, которые соединены с трехвалентным железом. При высоких значениях pH железо в воде находится в коллоидной форме оксида железа Fe(OH)3. В подземных водах с низкими значениями pHи при минимальном содержании растворенного кислорода железо присутствует в растворенной двухвалентной форме. Трехвалентное железо при определенных условиях также может присутствовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
При содержании в воде железа в концентрациях выше 0.3 мг/л вода после непродолжительного контакта с воздухом окисляется кислородом и становится желтовато – бурого цвета. Такая вода вызывает появление ржавых подтеков на сантехнике, отложения в котельном и бойлерном оборудовании. При концентрациях выше 1 мг/л вода мутная окрашивается в желто-бурый цвет при не длительном контакте с воздухом. Такая вода не допустима для использования, как в питьевых, так и в технических целях.
Железо человек получает в основном с пищей, из воды – максимально 10%. Также возможно попадание железа из воздуха, при этом вероятно возникновение профессиональных заболеваний. ВОЗ не дает рекомендуемой величины потребления железа по показаниям здоровья. В больших количествах железо, как и любое другое химическое вещество, способно вызвать в организме человека нарушения и даже патологии.
Виды железа, содержащегося в воде.
Как правило, в воде встречается несколько видов железа (таблица 1).
Двухвалентное железо (Fe +2 ) –в этой форме железо находится в растворенном состоянии. Иногда при определенных значениях pH гидроксид железа Fe(OH)2, выпадает в осадок.
Трехвалентное железо (Fe +3 ) —Хлорид (FeCl3) и сульфат (Fe2(SO4)3) – в растворимой форме, гидроксид железа Fe(OH)3 – в нерастворимом виде (существуют исключения при низком уровне pH).
Органическое железо – существует в различных комплексах, растворимых или в коллоидной форме. Органическое железо трудно удалить из воды. Органическое железо бывает следующих видов:
· Растворимое органическое железо. Способно связывать и удерживать кальций и другие металлы. Некоторые органические молекулы связывают железо в сложные растворимые комплексы – хелаты. Пример, таких органических соединений: порфириновая группа гемоглобина крови (удерживает железо), хлорофилл (удерживает магний), гуминовая кислота.
· Бактериальное железо. Существуют бактерии, использующие растворенное железо для жизни, они получают энергию, преобразуя двухвалентное железо в трехвалентное.
· Коллоидное железо. Коллоиды –частицы размером менее 1 микрона, которые не растворяются в воде, но трудно фильтруются из-за малого размера. К коллоидным частицам также относятся крупные органические молекулы (танины, лигнины). Коллоидные частицы обладают высоким поверхностным зарядом, поэтому они отталкивают друг друга и не укрупняются, образуя в воде суспензии, находящиеся во взвешенном состоянии, вода становится мутной.
Таблица 1 – Виды железа, содержащиеся в воде.
| Тип железа | Вода из-под крана | Вода после отстаивания |
| Двухвалентное | Чистая | Красно-бурый осадок |
| Трехвалентное | Окрашена | Красно-бурый осадок |
| Коллоидное | Желто-бурая | Не образует осадка, Не фильтруется |
| Растворенное органическое | Желто-бурая | |
| Бактериальное | Радужная пленка, желеобразные образования в водопроводной системе. |
Процесс удаления из воды железа называется обезжелезиванием. Очистка воды от железа – одна из самых сложных задач в водоподготовке. Одного универсального экономически оправданного метода очистки, который можно было бы применить во всех случаях для любой воды, не существует. Основные методы обезжелезивания:
· Окисление (реагентное, каталитическое). В результате окисления загрязнения осаждаются (с помощью коагулянтов или без них), потом фильтруются с помощью специальных систем очистки воды.
· Мембранные методы (осмос, обратный осмос, нанофильтрация)
Поскольку железо образует устойчивые окрашенные соединения, для его определения можно использовать фотоколориметрические методы.
Фотоколориметрия. Теоретические основы метода.
Закон Бугера – Ламберта — Бера
В основе оптических методов анализа лежит эффект избирательного поглощения света определенной длины волны веществом. Если вещество облучается видимым светом, этот раздел оптических методов анализа называется фотоколориметрией.
При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока I согласно закону Бугера – Ламберта — Бера равна
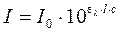
где I – интенсивность падающего потока;
ελ – молярный коэффициент поглощения при данной длине волны;
l – толщина поглощающего слоя (кюветы);
с – концентрация поглощающего вещества, моль/дм 3 .
Или в логарифмической форме:

Величину lg(I/I) в (2), характеризующую поглощающую способность вещества в растворе, называют оптической плотностью. В аналитической практике, стремясь подчеркнуть сущность процесса, лежащего в основе фотометрического определения, а именно поглощение квантов электромагнитного излучения оптического диапазона аналитической формой, эту величину называют поглощением, или светопоглощением и обозначают буквой А (absorption) либо D (density).
Закон Бугера – Ламберта — Бера: оптическая плотность раствора прямо пропорциональна концентрации вещества и толщине поглощающего слоя. Серию аналитических определений выполняют при постоянной толщине поглощающего слоя, тогда оптическая плотность линейно зависит от концентрации (рисунок 1).
Коэффициент линейной регрессии зависимости А = f(С) представляет собой молярный коэффициент поглощения ελ = tg a.
Рисунок 1. – зависимость оптической раствора плотности от концентрации.
Обратите внимание, что эта прямая линия проходит через начало координат. Для раствора поглощающего вещества при постоянных концентрациях и толщине поглощающего слоя оптическая плотность зависит от длины волны, поэтому измерения проводят при длине волны, соответствующей максимальному поглощению.
Приборами для фотоколориметрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Большинство фотометров имеет набор из 10-15 светофильтров и представляет собой прибор, в которых пучок света от источника излучения (лампа накаливания, редко ртутная лампа) проходит через светофильтр и проходит через кювету с исследуемым раствором или раствором сравнения (рисунок 2).
1 – источник света, 2 – щель, 3 – монохроматор (светофильтр),
4 – измерительная ячейка (анализируемый образец, образец сравнения),
5 – детектор, 6 – усилитель, 7 – регистрирующее устройство
(графическое, визуальное, цифровое)
Рисунок 2 – Блок-схема фотоэлектроколориметра (упрощенная)
Количественное определение вещества по светопоглощению основано на применении закона Бугера — Ламберта — Бера. Концентрацию можно определить, пользуясь методом градуировочного графика А = f(C), методом сравнения или методом добавок. Погрешности определения составляют около 5%.
Для перевода вещества в окрашенную форму используются химические реакции. Обязательное требование к реакциям, используемым в количественном анализе – они должны протекать избирательно, быстро и полностью воспроизводимо. Окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, несущее информацию о концентрации поглощающего вещества, должно подчиняться физическим законам, связывающим поглощение и концентрацию, конкретно – закону Бугера – Ламберта – Бера.
Практическая часть.
Ион Fe 3+ с роданид-ионом в зависимости концентрации ионов железа и роданид-ионов дает ряд окрашенных в кроваво-красный цвет комплексов:
Число роданид-анионов n в комплексе железа может изменяться от 1 до 6. В данной работе берется избыток роданид-ионов, при этом образуются комплекс FeSCN6 3- .
Для построения градуировочной кривой используются стандартные растворы, отличающиеся друг от друга по концентрации не менее чем на 10 %.
Растворы готовят непосредственно перед колориметрированием, так как окраска растворов неустойчива.
По серии стандартных растворов соли железа строят градуировочную кривую, выражающую зависимость оптической плотности от концентрации. На оси ординат наносят значения оптической плотности, на оси абсцисс – концентрации. Обычно график строят по 5 – 6 точкам.
Определив плотность исследуемого раствора соли железа, по оси ординат находят точку, которая соответствует данному значению оптической плотности, проводят линию, параллельную оси абсцисс до пересечения ее с градуировочной кривой. Из точки пересечения опускают перпендикуляр на ось абсцисс. Находят Cx.
Определению иона Fe 3+ данным методом мешают некоторые восстановители (S 2- , SO3 2- , Sr 2+ ) и окислители, разрушающие роданид-ион (MnO4 — , NO3 — , H2O2), а также ионы, образующие комплексные соединения с железом (F — , Cl — , PO4 3- ).
Оборудование.
Посуда и материалы
Мерные колбы вместимостью 50 см 3 и 1000 см 3
Пипетки вместимостью 1, 5, 10, 25 см 3 .
1. Основной стандартный раствор железоаммиачных квасцов NH4Fe(SO4)2×12 H2O (додекагидрата сульфата аммония железа III) концентрации 0.1 мг Fe 3+ в 1 см 3 раствора.
2. Рабочий стандартный растворжелезоаммиачных квасцов готовят в день анализа разбавлением основного стандартного раствора в 10 раз (5 см 3 основного раствора отмерить пипеткой, поместить в мерную колбу объемом 50 см 3 и довести до метки дистиллированной водой). В 1 см 3 рабочего стандартного раствора сожержится 0.01 мг железа Fe 3+ .
3. Роданид аммония NH4SCN либо роданид калия KSCN концентрации 50 %.
4. Соляная кислота, плотность 1.12 г/см 3 .
Последнее изменение этой страницы: 2016-09-20; Нарушение авторского права страницы
источник