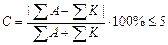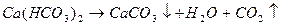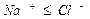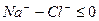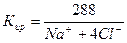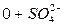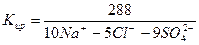Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм 3 , мг/дм 3 , а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
| Ионы | Содержание, мг/дм 3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na + Ca 2+ Mg 2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | — | 126,41 | |
| Cl — SO4 2 — HCO3 — | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | — | 119,34 | |
| М (сухой остаток) | — | — | |
| СО2(свободный) | — | — | |
| рН водородный показатель | 5,3 | — | — |
| Т воды, градус С | — | — |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na + Ca 2+ Mg 2+ | 0,0435 0,0499 0,08222 | Cl — SO4 2- HCO3 — | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм 3 и минерализация (М) в г/дм 3 , за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м 3 /сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
| Минерализация М, г/дм 3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм 3 . Вода солоноватая.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
| Водородный показатель рН при Т22 о С | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
| Температура, Т о С | Наименование |
| 0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100 о С называются термальными.
В нашем случае Т15 о С. Вода холодная.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм 3 ).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3 — в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl — и SO 2- 4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм 3 Общая жесткость ОЖ, ммоль 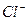 , мг/дм 3 , мг/дм 3 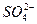 , мг/дм 3 рН , мг/дм 3 рН | 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
| Минерализация, г/дм 3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм 3 . Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.


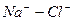
 |
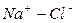

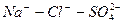
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
| Ирригационный коэффициент | Характеристика воды | ||||||||||||||||||||||||||||||||||||||||||||||||||
| >18 >6-18 ³1,2-6,0 + — , Кир= 0,58. Вода очень плохая и улучшению не подлежит. 10) Агрессивность подземных вод. Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП 2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП). Дата добавления: 2015-04-18 ; просмотров: 71 ; Нарушение авторских прав источник Данная работа рассчитана на 2 часа академических занятий и на 4 часа самостоятельной работы студентов с преподавателем. Целью данной работы является ознакомление студентов с данными сокращенного химического анализа подземных вод, методикой их обработки и пересчета путем использования нормативов ГОСТа, систематизация и оценка пригодности их для питьевого водоснабжения или технического использования. 2.2.1 Свойства и характеристика подземных вод. Вопросы практического использования подземных и рудничных вод могут быть решены только после полного изучения их физико-химических свойств, химического и бактериального состава. Химический состав и физические свойства подземных вод изучают для различных целей: питьевого и технически-хозяйственного водоснабжения (питания паровых котлов, охлаждения машин, тушения пожаров и т.п.), орошения полей, лечебных целей, как поисковый критерий на различные полезные ископаемые, для оценки агрессивности подземных вод по отношению к бетону, коррозирующих свойств по отношению к металлам, для установления связи водоносных горизонтов между собой и с поверхностными водами и т.п. Подземные воды представляют собой сложные естественные растворы, находящиеся в многообразных связях и взаимодействии с окружающей природной средой. Естественная физико-географическая и геологическая обстановка определяют особенности генезиса и дальнейшего преобразования подземных вод. К физическим свойствам подземных вод относятся температура, цвет, запах, прозрачность, вкус, привкус, электропроводность и радиоактивность. Определение этих свойств частично проводится непосредственно в полевых условиях при отборе проб воды, а в основном – в химических лабораториях по специальной методике. Химические свойства подземных вод определяются количеством и соотношением содержащихся в них в растворенном виде солей, присутствующих в воде в виде ионов – анионов и катионов, а также некоторых недиссоциированных соединений, газов и органических соединений. Среди ионов наибольшее практическое значение имеют следующие: катионы – водород – H + , натрий – Na + , калий – K + , магний – Mg 2+ , кальций – Ca 2+ , железо – Fe 2+ ; анионы – хлор – Cl — , сульфат – SO4 2- , гидрокарбонат – HCO3 — . Из недиссоциированных соединений наиболее часто встречаются окислы железа – Fe2O3, кремния – Si2O3, алюминия – Al2O3, а из газов – углекислый газ – CO2, кислород – O2, азот – N2, метан – CH4, сероводород – H2S. В результате выполнения данной работы студенты, изучив химический состав подземных вод, должны иметь определенные навыки по их обработке и систематизации, а также определить область практического использования. Перечень необходимых определений веществ, содержащихся в подземных водах, устанавливается в соответствии с целевым назначением анализа, что и указывается в программе работ гидрогеологических исследований. 2.2.2 Способы выражения химического состава подземных вод. В природной воде молекулы солей почти полностью диссоциированы на ионы, поэтому основной формой выражения результатов химического анализа воды является ионная форма. При этом содержание любого иона в процессе исследования выражается в граммах или миллиграммах на кубический дециметр (что равнозначно литру) воды (г/дм 3 (г/л), мг/дм 3 (мг/л)). Поэтому результаты анализов в химических лабораториях даются в ионной форме, т.е. в г/дм 3 (г/л), мг/дм 3 (мг/л). Но, делать некоторые выводы о составе и свойствах воды можно, лишь имея анализы в миллиграмм — эквивалентной и эквивалент — процентной формах. Поэтому данные химического анализа должны быть пересчитаны (табл. 3). Для этого вначале необходимо определить эквивалент каждого аниона и катиона. Дело в том, что ионы взаимодействуют между собой в строго определенных эквивалентных весовых соотношениях. Например, один эквивалент одного иона хлора Cl — может взаимодействовать только с одним эквивалентом иона натрия Na + или кальция Ca 2+ . Следовательно, эквивалент – это число, показывающее, в каком весовом соотношении данный ион вступает в соединение с другим ионом. Для пересчета анализа из ионной формы в миллиграмм – эквивалентную следует число миллиграммов каждого иона разделить на его эквивалентный вес, который представляет собой отношение атомного (или ионного) веса данного элемента к его валентности. Например, кальция Ca 2+ в воде содержится 420 мг/дм 3 . Эквивалентный вес одного иона кальция Ca 2+ равен: 40,08 : 2 = 20,04 мг/экв. Чтобы определить его миллиграмм – эквивалентное содержание надо 420 : 20,04 = 20,96 мг/экв. Также для пересчета анализов воды в миллиграмм-эквиваленты содержание ионов умножают на специальные пересчетные коэффициенты, которые представляют частное от деления единицы на эквивалентный вес. Для выше приведенного примера пересчетный коэффициент кальция Ca 2+ равен 1 : 20,04 = 0,0499. Если 420 • 0,0499 = 20,96 мг/экв – миллиграмм-эквивалентная форма. Ниже приведены пересчетные коэффициенты для некоторых ионов: гидрокарбонат HCO3 — – 0,0164 Если сумму всех катионов и анионов в миллиграмм-эквивалентной форме принять за 100%, можно получить соответствующие выражения для анионов и катионов в эквивалент-процентной форме. Количества катионов и анионов, выраженные в эквивалент-процентной форме, должны быть равны между собой, т.е. сумма всех катионов должна составлять 50% и сумма всех анионов тоже 50%, что является удобным контролем анализа. В последнее время очень часто принимают за 100% сумму миллиграмм-эквивалентов анионов и также за 100% — сумму миллиграмм-эквивалентов катионов. Расчет от этого не изменяется, но величины эквивалент-процентов становятся в два раза больше. Если результаты анализа воды выражены в миллиграмм-эквивалентной форме, то перед символом иона ставят букву r, например rCl — и т.д. При анализе могут быть неточности. Допустимая неточность анализа определяется из выражения: Таблица 3 — Исходные данные
В итоге пересчетов должна быть составлена таблица следующей формы (табл. 4): Таблица 4 — Порядок пересчета ионной формы в другие формы
При химическом анализе воды определяют величину сухого остатка после выпаривания и количества веществ, содержащихся в воде (минерализацию). Количества веществ показывают в ионной форме, при которой содержание отдельных ионов определяют в миллиграммах на 1 л воды. При выборе и оценке воды источника централизованного хозяйственно-питьевого водоснабжения пользуются государственными стандартами (ГОСТ – 2874 – 82 и др.). Сумма растворенных в воде веществ – сухой остаток – при t = 105 – 110 0 C не должна превышать 1000 мг/л. 2.2.3 Минерализация. Это экспериментально определенный сухой остаток или подсчитанная сумма минеральных веществ. Единой классификации по степени минерализации нет, их достаточно много применительно к требованиям отдельных ведомств. В таблице 5 приводится выражение общей минерализации подземных вод по В.М. Вернадскому, согласующееся с требованиями их практического использования. Таблица 5 — Классификация подземных вод по общей минерализации
2.2.4 Жесткость воды. Особое ее качество, обусловленное присутствием углекислых и сернокислых солей Ca 2+ и Mg 2+ . Жесткость поземных вод имеет большое значение при их оценке для практического использования. Жесткая вода плохо взмыливается, дает накипь в паровых котлах (что уменьшает их теплопроводность, приводит к перерасходу топлива и может вызвать аварию) и в посуде, вспенивается, в жесткой воде медленнее развариваются овощи, мясо, крупы и другие продукты. Различают общую, временную (карбонатную или устранимую) и постоянную жесткость воды. Общей называют жесткость, соответствующую пробе свежей воды. При кипячении воды растворенные в ней бикарбонаты (двууглекислые соли) переходят в углекислые и выпадают в виде осадка или накипи. Жесткость, соответствующая кипяченной воде, называется постоянной. Разность между общей и постоянной жесткостью воды называют временной жесткостью. Жесткость выражают в градусах жесткости. Существует три системы градусов жесткости: немецкая, французская, английская. За один немецкий градус жесткости принимается содержание в 1 л 10 мг CaO или 7,2 мг MgO. За один французский градус – содержание в 1 л воды 10 мг CaCO3 или 17,5 мг MgCO3. В английской системе одному градусу жесткости соответствует содержание в 1 л воды14 мг CaCO3 (точнее, в английских мерах, — 1 гран (64,79892 мг) CaCO3 на 1 галлон (4,546 л) воды). Для перевода из одной системы градусов в другую можно воспользоваться такими соотношениями: 1,0 0 жестк. нем. = 1,79 0 жестк. франц. = 1,25 0 жестк. англ. 0,56 0 жестк. нем. = 1,0 0 жестк. франц. = 0,7 0 жестк. англ. 0,8 0 жестк. нем. = 1,43 0 жестк. франц. = 1,0 0 жестк. англ. Количество солей, мг/л, из которых каждая в отдельности обусловливает 1 0 жесткости, представлены ниже: 1,0 0 жестк. нем. 10,0 7,2 17,9 8,0 19,7 17,0 25,0 21,5 1,0 0 жестк. франц. 5,6 4,0 10,0 4,4 11,0 9,5 14,0 12,0 1,0 0 жестк. англ. 8,0 5,8 14,0 6,4 15,8 13,6 20,1 17,2 В настоящее время в нашем государстве вместо жесткости в градусах введено понятие жесткости в миллиграмм-эквивалентах на литр. За единицу жесткости принимают 1 мг-экв Ca, т.е.20,04 мг Ca на 1 л воды. Вместо кальция может быть принят 1 мг-экв магния, т.е. 12,16 мг Mg на 1 л воды. Для перевода из системы градусов жесткости (немецких) в миллиграмм-эквиваленты и обратно можно воспользоваться такими соотношениями: 1 мг-экв/л соответствует 2,8 0 жест. (нем.); 0,357 мг-экв/л соответствует 1,0 0 жест. (нем.). Жесткость природных вод колеблется в пределах от нескольких до десятков и сотен мг-экв/л; в одном и том же водоисточнике жесткость неодинаковая в разные времена года. В случае необходимости использования жестких вод для тех или иных целей их приходится обрабатывать специальными способами для снижения жесткости до требуемых норм. Природные воды по общей жесткости О.А. Алекин подразделяет на пять групп (табл. 6): Таблица 6 — Классификация природных вод по общей жескости
2.2.5 Оценка воды по активной реакции. Как уже отмечалось, в воде часть молекул всегда находится в диссоциированном состоянии, в виде ионов H + и OH — . Концентрация недиссоциированной воды считается постоянной, поэтому произведение ионов водорода и ионов гидроксила при данной температуре тоже будет величиной постоянной. При температуре 22 0 C эта величина равна 10 -14 . Так как чистая вода имеет нейтральную реакцию, количества ионов водорода и ионов гидроксила должны быть равны. Следовательно, Это выражение означает, что в 1 л чистой воды при 22 0 C содержится 10 -7 грамм-молекул воды в ионизированном виде, т.е. 10 -7 грамм-ионов водорода и 10 -7 грамм-ионов гидроксила. Если [H + ] = 10 -7 , то lg[H + ] = -7 и — lg[H + ] = 7. Выражение — lg[H + ] означает pH. Следовательно, если pH 7 – щелочная. По величине активной реакции или водородного показателя pH природные воды классифицируются следующим образом (табл. 7): Таблица 7 — Классификация природных вод по активной реакции
Подземные воды в большинстве своем имеют слабощелочную реакцию. Воды сульфидных и особенно колчеданных и каменноугольных месторождений обычно кислые и часто весьма кислые. Определять концентрацию водородных ионов необходимо на месте взятия пробы; наиболее употребительный способ определения – колориметрический, основанный на свойстве индикаторов менять окраску в зависимости от концентрации водородных ионов. 2.2.6 Агрессивные свойства подземных вод. Отрицательное воздействие подземных вод на металл и бетон называется агрессивностью воды. Это свойство обусловлено присутствием в воде ионов бикарбоната, водорода, агрессивной углекислоты, сульфатов и магния. В связи с этим различают агрессивность выщелачивания, общекислотную, углекислую, сульфатную и магнезиальную. Оценку различных видов агрессивности проводят по справочнику «Нормы и технические условия. Бетон гидротехнический. Признаки и нормы агрессивности воды-среды». Наличие натриевых и калиевых солей вызывает образование накипи. Свободный ион H + вызывает разъедание стенок котлов и труб. Временная (устранимая) жесткость воды является с этой точки зрения положительным фактором, так как ионы HCO3 — связывают свободные ионы H + . Кроме ионов водорода разъедающее действие на металл оказывают ионы кислорода, углекислоты, сероводорода. Поэтому вода, применяемая для технических целей, нуждается в предварительной обработке. После обработки вода по большей части становится непригодной для питья. Агрессивность выщелачивания возникает при малом содержании в воде HCO3 — (менее 1,5 мг-экв/л). В этих условиях происходит растворение и вымывание из бетона содержащейся в нем извести. Общекислотная агрессивность обусловлена низким значением водородного показателя pH (менее 5), из-за чего усиливается растворение извести бетона. Углекислая агрессивность возникает в результате действия агрессивной углекислоты CO2. В процессе взаимодействия с водой из цемента выделяется свободная известь CaCO3, которая реагирует со свободной углекислотой CO2. Реакция идет по схеме CaCO3 + CO2 + H2O = Ca(HCO3)2. Образующийся при этом бигидрокарбонат кальция является растворимым и легко выносится из бетона. Вода для большинства марок цемента становится агрессивной, если содержание в ней свободной углекислоты больше величины, определяемой по формуле a∙Ca + b. Содержание Ca 2+ выражается в мг/л, а коэффициенты a и b определяются в зависимости от карбонатной жесткости HCO3 — (мг-экв/л) и суммарного содержания ионов Cl — + SO4 2- в мг/л по специальной таблице 14. Сульфатная агрессивность возникает при наличии в воде повышенного количества сульфата SO4 2- ; в бетоне происходит кристаллизация новых соединений, образование которых сопровождается увеличением объема, вследствие чего происходит разрушение бетона. Такими новыми соединениями являются гипс CaSO4 ∙ 2H2O и сульфоаллюминат кальция 3CaO ∙ Al2O3 ∙ 3CaSO4 ∙ 31H2O (цементная бацилла). При образовании гипса объем бетона увеличится в два раза, а при образовании цементной бациллы – в 2,5 раза. При содержании в воде SO4 2- менее 250 мг/л сульфатная агрессивность отсутствует независимо от содержания хлора Cl — . Вода становится агрессивной по отношению к обычным портландцементам, если содержание ионов SO4 2- будет больше приведенных ниже показателей с учетом содержания в воде ионов хлора Cl — (мг/л): Cl — — менее 1000 SO4 2- — 250 Магнезиальная агрессивность, подобно сульфатной, ведет к разрушению бетона при соприкосновении его с водой, содержащей повышенное количество Mg 2+ . При этом, если содержание ионов магния Mg 2+ будет меньше 1000 мг/л, вода считается магнезиально – неагрессивной независимо от содержания иона SO4 2- (мг/л). При содержании ионов магния Mg 2+ более 1000 мг/л и больше величины, определяемой по формуле К- SO4 2- , вода считается агрессивной. Величина К для обычного портланд — цемента равна 7000. 2.2.7 Классификация подземных вод по химическому составу. Единой общепринятой классификации подземных вод в зависимости от их химического состава нет, что объясняется чрезвычайно разнообразным качественным и количественным химическим составом природных вод. Наиболее удобны те классификации, которые построены на принципе деления вод по преобладающим ионам (катионам и анионам) и по соотношению между ними. Именно на этом принципе построена классификация О.А. Алекина, широко используемая в геолого–разведочной, горной промышленности, гидротехнике и коммунальном хозяйстве. В соответствии с этой классификацией все природные воды по преобладающему в них аниону делятся на три больших класса – гидрокарбонатные, хлоридные и сульфатные. Каждый класс, в свою очередь, по преобладающему катиону делится на три группы – натриевые, кальциевые и магниевые. Группы по соотношению между ионами подразделяются на четыре типа: I тип: HCO3 — > Ca 2+ + Mg 2+ — воды маломинерализованные; II тип: HCO3 — 2+ + Mg 2+ — + SO4 2- — воды умеренной минерализации; III тип: HCO3 — + SO4 2- 2+ + Mg 2+ или, что то же самое, Cl — > Na + — воды высокоминерализованные; IV тип — HCO3 — = 0 – воды кислые, имеются только в сульфатном и хлоридном классе. Для удобства сопоставления анализов воды используют различные способы сокращенного изображения состава. Наиболее часто применяются формула М.Г. Курлова, графические – прямоугольник солевого состава Н.И. Толстихина и треугольники Фере ионного состава. Формула М.Г. Курлова представляет собой псевдодробь, где в числителе располагаются по убывающей анионы с индексом, равным содержанию данного иона в экв/%, в знаменателе — в такой же последовательности катионы. Ионы, содержание которых не превышает 10 экв/%, в формулу не включаются. Количество анионов и катионов округляется до целого числа. Перед дробью даются значение минерализации (М) с индексом, равным количеству сухого остатка в г/л, а также содержание элементов и газов с индексами, равными их содержанию в мг/л. После дроби указываются температура воды в градусах (t 0 C) и активная реакция воды (pH). В наименовании состава воды рекомендуется называть первыми анионы, затем катионы, а также элементы и газы. Ионы, содержание которых в воде менее 25%, не называются. Прямоугольник солевого состава Н.И. Толстихина (рис. 13) состоит из трех вертикальных граф. Левая и правая графы делятся на 10 равных частей, каждая часть приравнивается 10%. Нумерация производится снизу вверх. В левой графе изображаются катионы, в правой – анионы в экв/%. В средней графе показывают состав и процентное содержание солей, которые образуются в результате реакции катионов и анионов. Катионы и анионы на графике располагаются снизу вверх в последовательности, определяемой относительной реактивной силой: K + , Na + , Mg 2+ , Ca 2+ , Fe 2+ , NO3 — , Cl — , Br — , I — , SO4 2- , HCO3 — , CO3 2- .
Рисунок 13 – Прямоугольник солевого состава Треугольники Фере ионного состава (рис. 14) составляются отдельно для катионов и анионов, содержание которых дается в экв/%. В произвольном масштабе вычерчиваются два равносторонних треугольника, в вершинах которых располагаются катионы и анионы. Считается, что в вершине количество каждого катиона и аниона равно 100%. Далее, каждая сторона треугольника делится на 10 равных отрезков, соответствующих 10-ти процентам. Содержание катиона или аниона откладывается в виде точек на двух прилежащих к этой вершине сторонах треугольника. Эти точки затем соединяются прямой линией, параллельной третьей стороне. В итоге в каждом треугольнике получится по три прямые линии, точка пересечения которых графически изображает химический состав воды. 2.2.8 Оценка воды для питьевого водоснабжения. Вода, используемаядля хозяйственно-питьевого водоснабжения, должна удовлетворять требованиям ГОСТ — 2874-82 «Вода питьевая, технические требования к качеству». Согласно этого стандарта ниже приведены предельно-допустимые концентрации (ПДК) для некоторых показателей (табл. 8): Таблица 8 — Нормативы ГОСТ 2874-82
При отсутствии источника с пресной водой разрешается использовать воду с сухим остатком до 1500 мг/л, при общей жесткости до 10 мг-экв/л. В каждом случае возможность использования таких вод должна быть согласована с органами санитарно-эпидемиологической службы. Питьевая вода должна быть прозрачна, бесцветна, не иметь запаха, быть приятной на вкус. Золотисто-желтая или бурая окраска воды свидетельствует о наличии в ней растворенных органических веществ. Соленый вкус обуславливается значительным количеством NaCl, а горький – присутствием MgSO4. Наличие в воде солей азотной и азотистой кислот, а также аммиака указывает на связь этой воды с участками, где происходит разложение органических веществ, следовательно, на возможность наличия болезнетворных бактерий. Кроме того, пригодность воды для питья определяется по наличию кишечной палочки Coli. Сама по себе кишечная палочка безвредна, но ее наличие также свидетельствует о возможном присутствии болезнетворных бактерий. Количественные показатели определяются коли-тиром, т,е. наименьшим количеством кубических сантиметров воды, содержащим одну кишечную палочку (300 см 3 ), или коли-тестом, т.е. наибольшим количеством кишечных палочек, содержащихся в 1 л воды ( 0 C | Второ-степен. компо-ненты, мг/л | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Na + + K + | Ca 2+ | Mg 2+ | HCO3 — | SO4 2- | Cl — | ||||||||||||||||||||||||||||||||||||||||||||||
| 25,0 | 6,5 | 33,0 | CO2=18 Br2=0,6 |
Выполнить следующие виды работ:
а) Пересчитать результаты анализа из ионной формы в миллиграмм-эквивалентную и эквивалент-процентную формы и составить таблицу.
б) Оценить воду по степени минерализации.
в) Определить и оценить воду по всем видам жесткости.
д) Определить и оценить воду по всем видам агрессивности.
е) Произвести классификацию подземных вод по химическому составу.
ж) Выразить химический состав подземных вод в виде:
2) прямоугольника солевого состава
з) Оценить пригодность воды для питьевого водоснабжения.
Порядок выполнения работы
а) Для перерасчета результатов анализа согласно заданию составляется таблица 10.
В природной воде содержание K + составляет всего 4 – 10% от содержания Na + , поэтому все расчеты производятся по Na + .
Таблица 10 — Порядок пересчета из ионной формы в другие
| Основные ионы | мг/л | мг∙экв/л | экв./проц. | пересчетные коэффициен-ты | прочие определения, мг/л |
| Катионы: Na + K + Ca 2+ Mg 2+ | 482,85 20,96 106,86 | 79,07 3,43 17,50 | 0,0435 0,0256 0,0499 0,0822 | CO2=18,0 Br2=0,6 | |
| ∑ ∑r + Анионы HCO3 — Cl — SO4 2- ∑ ∑r — Всего | 610,67 1,15 545,67 56,16 602,98 | 0,19 90,50 9,31 | 0,0164 0,0282 0,0208 |
б) Определяем степень минерализации
Таблица 11 — Классификация подземных вод по общей минерализации
| Оценка воды (раствора) | Минерализация г/л |
| Пресная Солоноватая Соленая Горько-соленая Слабые рассолы Крепкие рассолы | До 1 1 – 3 3 – 10 10 – 50 50 – 100 >100 |
Согласно классификации данная вода горько-соленая (М = 34,940 г/л).
в) Определяем все виды жесткости
Общая жесткость равна 20,96 + 106,86 = 127,82 мг-экв/л
Карбонатная жесткость равна 1,15 мг-экв/л
Постоянная жесткость равна 127,82 – 1.15 = 126,67 мг-экв/л
Таблица 12 — Классификация природных вод по общей жесткости
| Оценка воды | Жесткость, мг-экв/л |
| Очень мягкая Мягкая Умеренно-жесткая Жесткая Очень жесткая | До 1,5 1,5 – 3,0 3,0 – 6,0 6,0 – 9,0 >9,0 |
Согласно таблицы 12 данная вода относится к очень жестким.
г) По значению активной реакции определяем pH среду
Таблица 13 — Классификация природных вод по активной реакции
| Признак | Значение pH |
| Весьма кислые Кислые Нейтральные Слабощелочные Высокощелочные | 9 |
Так как в нашем анализе pH = 6,5, данная среда – кислая.
д) Определяем агрессивные свойства данной воды
— так как значение HCO3 — равно 1,15 мг-экв/л, т.е меньше 1,5 мг-экв/л, агрессивность выщелачивания присутствует;
— так как pH = 6,5, больше 5,0, общекислотная агрессивность отсутствует;
— в нашем анализе содержание свободной углекислоты составляет 18,0 мг/л. Из таблицы 14 берем значения коэффициентов a = 0,00 и b = 17. Вычисляем по формуле: a∙Ca + b = 17. Так как содержание свободной углекислоты составляет 18,0 мг/л, т.е. больше, чем определенное по формуле, углекислая агрессивность присутствует.
— Так как в данном анализе содержание SO4 2- составляет 2700 мг/л при содержании Cl — = 19350 мг/л, сульфатная агрессивность присутствует.
— Содержание Mg 2+ составляет 1300 мг/л (>1000), применяем формулу К — SO4 2- , т.е. 7000 – 2700 = 4300, 1300 0 C pH6,5 ( 5 )
По химическому составу вода хлоридно-натриевая, бромисто-углекислая.
Рисунок 15—Прямоугольник солевого состава.
з) Оценка воды для питьевого водоснабжения
Таблица 15 — Нормативы ГОСТ 2874-82
| № | Показатель | ПДК, не более | Данные анализа |
| Активная реакция, pH Сухой остаток, мг/л Общая жесткость, мг∙экв/л Хлориды Cl — , мг/л Сульфаты SO4 2 , мг/л | 6,0 – 9,0 | 6,5 127,82 |
Вывод: Данная вода по сухому остатку, общей жесткости, содержанию хлоридов и сульфатов не подходит для практического применения.
Таблица 14 — Значения коэффициентов «a» и «b» для определения углекислой агрессивности водной среды.
| Карбонат. жестк. мг-экв/л | Суммарное содержание Cl — + SO4 2- | ||||||||||
| 0 — 200 | 201 -400 | 401 — 600 | 601 — 800 | 801 — 1000 | >1000 | ||||||
| a | b | a | b | a | b | a | b | a | b | b | b |
| 1,4 1,8 2,1 2,5 2,9 3,2 3,6 4,0 4,3 4,7 5,0 5,4 5,7 6,1 6,4 6,8 7,1 7,5 7,8 8,2 8,6 9,0 | 0,01 0,04 0,07 0,10 0,13 0,16 0,20 0,24 0,28 0,32 0,36 0,40 0,44 0,48 0,54 0,61 0,67 0,74 0,81 0,88 0,96 1,04 | 0,01 0,04 0,06 0,08 0,11 0,14 0,17 0,20 0,24 0,28 0,32 0,36 0,40 0,44 0,47 0,51 0,55 0,60 0,65 0,70 0,76 0,81 | 0,01 0,03 0,05 0,07 0,09 0,11 0,14 0,16 0,19 0,22 0,25 0,29 0,32 0,36 0,40 0,44 0,48 0,53 0,58 0,63 0,68 0,73 | 0,00 0,02 0,04 0,06 0,08 0,10 0,12 0,15 0,17 0,20 0,23 0,26 0,29 0,33 0,36 0,40 0,44 0,48 0,53 0,58 0,63 0,67 | 0,00 0,02 0,04 0,06 0,07 0,09 0,11 0,13 0,16 0,19 0,22 0,24 0,27 0,30 0,33 0,37 0,41 0,45 0,49 0,53 0,57 0,61 | 0,00 0,02 0,04 0,05 0,07 0,08 0,10 0,12 0,14 0,17 0,19 0,22 0,25 0,28 0,31 0,34 0,38 0,41 0,44 0,48 0,52 0,56 |
Вопросы для контроля знаний студентов
1. Перечислите основные физические свойства подземных вод и показатели, которыми они характеризуются.
2. Что входит в понятие «состав подземных вод»?
3. Каковы источники минерализации подземных вод? Что входит в понятие общей минерализации воды?
4. Что называется агрессивной углекислотой? Перечислите все виды агрессивности воды по отношению к бетону.
5. Каковы свойства жесткой воды и в каких единицах выражается жесткость?
6. Почему при кипячении жесткость уменьшается?
7. Какой показатель pH должна иметь вода, чтобы ее можно было отнести к кислотной, активной по отношению к металлам?
8. Как оценивается пригодность воды для питьевых целей? При каком коли-титре вода считается допустимой к употреблению без кипячения?
9. Как проводится пересчет результатов анализа воды из весовой формы в эквивалент-процентную?
10. Чем отличаются минеральные воды от минерализованных?
Список использованных источников
1. Ларионов А.К. Занимательная гидрогеология. – М.: Недра, 1979. – 155 с.
2. Николадзе Г.И. Улучшение качества подземных вод. – М.: Стройиздат, 1988. – 366 с.
3. Пешковский Л.М., Перескокова Т.М. Инженерная геология. – М: Высшая школа, 1982. – 344 с.
4. Седенко М.В. Основы гидрогеологии и инженерной геологии. – М: Недра, 1979. – 216 с.
5. Ташенов К.М. Подготовка технической воды. – А: КазГАСА, 1977. – 173 с.
6. Толстой М.П., Малыгин В.А. Геология и гидрогеологи. – М: Недра, 1988. – 274 с.
источник
Анализ водопроводной, бутилированной воды, а также воды из скважин, колодцев и т.д.
Лабораторный анализ сточных и технических вод для организаций и частных лиц.
Комплексный анализ воды бассейнов для частных лиц и организаций.
Анализ воды представляет собой исследование свойств и веществ, входящих в состав. Возможна проверка питьевой воды в квартирах и на предприятиях, где она используется для регулярного употребления. Также проводится исследование воды в бассейнах и частных домах. Анализ выявляет содержание вредных микроорганизмов и веществ, превышение органических показателей и содержание основных составляющих. Как сделать анализ воды правильно, чтобы выявить все вредные факторы и определить химический состав?
Для анализа воды в Москве обратитесь в аккредитованную лабораторию, имеющую необходимое оборудование с высокой точностью измерений.. Исследование проводится при соблюдении установленным нормативов и требований, не допускаются погрешности. Только при обращении в подобную лабораторию можно быть уверенным в юридической силе и достоверности полученных протоколов. В компании «РосЭкология» доступны любые виды проверок. Вы можете провести исследование воды с учетом существующих методик и нормативов. Эксперт не упустит ни одной детали, а проверка выполняется в стерильных и нейтральных условиях.
Анализ качества проводится в различных ситуациях, часто входит в состав проектной документации. Поэтому важно серьезно подходить к выбору лаборатории. Проверка требуется в таких ситуациях:
- экспертиза, необходимая при устройстве скважины или колодца;
- оценка содержимого бассейна;
- определение качества питьевой воды, поступающей по городскому водопроводу;
- проверка качества бутилированной воды;
- состояние дистиллированной воды, используемой в технических и медицинских целях;
- определение эффективности очистки и контроля оставшегося ресурса сменного фильтра;
- проверка на предприятии, сбрасывающем стоки в канализацию или природный водоем.
Бывают ситуации, когда анализ воды в Москве не просто желателен, но и необходимо. Если вода внезапно изменила цвет, запах или вкус, пригласите экспертов для взятия образцов и проведения проверки. Исследование определит, что послужило причиной изменения. Проблема выявляется в источнике водоснабжения или трубах.
Если рядом со скважиной возводится промышленный объект, важно обезопасить ее. Желательно провести проверку на разных стадиях постройки сооружения, так как проблема может появиться не сразу. Анализ воды определяет мельчайшие изменения в составе. Даже если при бурении проводилась проверка, которая не выявила отрицательного воздействия, экологическая обстановка может испортиться со временем. На нее оказывает влияние оживленное шоссе, завод или хранилище удобрений. Проблема возникает, если рядом произошла техногенная авария.
Чтобы провести грамотный анализ, необходимо сотрудничать с аккредитованной лабораторией. Она проходит регулярные проверки на достоверность и надежность результатов. Учитывайте, что юридическую силу имеет заключение только такой лаборатории. Его можно использовать при различных ситуациях для подтверждения результата.
По желанию эксперт даст рекомендации по выбору оборудования, объяснит, как могут повлиять определенные показатели на здоровье. Особенно важно проводить исследование перед покупкой участка для личного пользования или предпринимательской деятельности. Это позволит избежать в дальнейшем серьезных проблем и расходов на очистительные мероприятия.
При выполнении тщательного анализа воды требуется полное исследование на различные параметры. Бактериологическая проверка необходима, чтобы подтвердить отсутствие в составе вредных бактерий и микроорганизмов, которые могут привести к серьезным заболеваниям. Особенно это опасно для детей и при установке колодца на собственном участке. В этом случае многие считают воду безопасной, но на нее могут воздействовать внешние факторы. Может произойти настоящая эпидемия, поэтому специалисты проверяют воду на конкретные виды инфекций.
- 12 параметров. Подходит для проверки правильности функционирования фильтров.
- 24 параметра. Используется для оценки уровня загрязнения.
- 31 параметр. Используется для Мосводоканала, чтобы предотвратить любые виды загрязнений и инфицирования.
| Показатели | |||
| Органолептические показатели (запах, привкус) | Цветность | Мутность | Водородный показатель, ед. рН |
| Сульфаты | Фосфаты | Хлориды | Нитраты |
| Цианиды | Сероводород | Алюминий | Барий |
| Бериллий | Железо | Кадмий | Кобальт |
| Литий | Марганец | Медь | Молибден |
| Натрий | Никель | Ртуть | Селен |
| Серебро | Свинец | Стронций | Хром |
| Цинк | Бор | Мышьяк | Бромид-ион |
| Хлор остаточный связанный | Хлор остаточный свободный | Аммиак и аммонийные соли | Нитриты по нитрит-иону |
| Перманганатная окисляемость | Хлороформ | Бромоформ | Дибромхлорметан |
| Общая минерализация (сухой остаток) | Жесткость | Фторид-ион (F) | Взвешенные вещества |
| Силикаты | Сурьма | Озон | Анионоактивные ПАВ |
| Неионогенные СПАВ | Нефтепродукты | Летучие фенолы (суммарно) | Четыреххлористый углерод |
| Формальдегид | Бенз(а)пирен | Ди(2-этилгексил)фталат | Гексахлорбензол |
| Линдан (гамма-изомер ГХЦГ) | 2,4-Д | Гептахлор | ДДТ (сумма изомеров) |
| Атразин | Симазин | Удельная суммарная α-активность | Удельная суммарная β-активность |
| Щелочность | Кальций (Са) | Магний (Мg) | Калий (К) |
| Бикарбонаты (НСО) | Йодид-ион (I–) | БПК | ХПК |
| Жиры | Летучие органические соединения (ЛОС) | Сульфиды | Хлор и хлорамины |
| Полихлорированные бифенилы | |||
Обычно анализ проводят по 10-20 параметрам, которые составляют представление о качестве воды. Оцениваются органические и неорганические показатели. Учитываются внешние характеристики, такие как запах, привкус, цвет и прозрачность. Также учитываются обобщенные (интегральные показатели) – плотность, жесткость, PH. Только при проведении полноценного использования можно говорить о высоком качестве или каких-то проблемах. Незначительное превышение нормативов говорит о начавшейся недавно проблеме.
Даже если вода добывается из артезианского источника, она может быть заражена. Это связано с плохим качеством трубы обсадки, плохой сваркой труб, попаданием поверхностных вод в процессе бурения. Микробиологический анализ включает следующие проверки:
- на радиацию – альфа и бета активность, радон;
- санитарно-микробиологическая проверка.
Проверку следует проводить как минимум раз в год, чтобы определить сохранение основных параметров на допустимом уровне. Это позволяет подобрать подходящие фильтры, провести очищение и обеззараживание источника. Чтобы не затрачивать лишние средства на ненужные процедуры сначала важно определить, какое состояние воды и что послужило ее изменению. В противном случае оборудование может быть неэффективным.
После проведения анализа качества воды предоставляются соответствующие протоколы со штампом организации, подписанные руководителем. Они содержат данные лаборатории, результаты исследований, подробные сведения об испытуемом объекте и ссылки на основные нормативные требования. В таком виде документ используется в государственных инстанциях и при судебных спорах.
| № | Показатель |
| 1. | Общее микробное число, КОЕ/мл |
| 2. | Общие колиформные бактерии (ОКБ) КОЕ/100 мл |
| 3. | Глюкозоположительные колиформные бактерии, КОЕ/100 мл (ГКБ) |
| 4. | Термотолерантные колиформные бактерии, КОЕ/100 мл (ТКБ) |
| 5. | Споры сульфитредуцирующих клостридий, КОЕ/100 мл |
| 6. | Pseudomonas аeruginosa |
| 7. | Колифаги, БОЕ/100 мл |
| и другие. |
Среди наших клиентов отечественные и зарубежные организации различного профиля. Мы гарантируем надежный результат и предоставляем комплекс услуг. К нам можно привести пробу, взятую самостоятельно. Но большей эффективности и точности можно добиться, если доверить все этапы экспертам высокого уровня. Правильный забор пробы и стерильная емкость – залог достоверности результата.
Мы обеспечиваем завершение проверки в кратчайшие сроки, а результаты могут использоваться в различных целях, так как протоколы имеют юридическую силу. Мы проводим лабораторные анализы на следующих условиях:
- длительный опыт успешных проверок;
- в штате квалифицированные эксперты с профильным образованием и практикой;
- современное оборудование, методы подготовки проб и референтные образцы, позволяющее получать точные данные;
- наличие действующей аккредитации, дающей дополнительную гарантию безопасности;
- регулярные проверки со стороны контролирующих органов.
| № | Наименование компонента | Нормативы СанПиН 2.1.4.1074-01, не более |
| 1 | Реакция среды, рН | 6,0-9,0 |
| 2 | Цветность, град | 20 |
| 3 | Мутность, ЕМФ | 2,6 |
| 4 | Жёсткость | 7,0 (10,0) мг-экв/л |
| 5 | Железо общее | 0,3 мг/л |
| 6 | Щелочность | Не нормируется |
| 7 | Перманганатная окисляемость | 5 мг/л |
| 8 | Аммоний, ионы по азоту | 2 (N) |
| 9 | Сульфаты, ионы | 500,0 мг/л |
| 10 | Сульфиды | 0,003 мг/л |
| 11 | Марганец | 0,1 мг/л |
| 12 | Сероводород | 0,003 мг/л |
| 13 | Нитриты | 3 мг/л |
| 14 | Нитраты | 45 мг/л |
| 15 | Электропроводность среды | Не нормируется |
Обратившись в компанию «РосЭкология», вы получаете высокое качество работы и минимальные сроки проверки в Москве. Наши сотрудники возьмут образцы, проведут тщательное исследование на современном оборудовании. Результаты предоставляются в виде протоколов с точными данными. При необходимости обеспечивается максимальная оперативность забора образцов и проведения проверки. Заказав проверку у нас, вы получите анализ качества воды в соответствии с действующими правилами и законодательством.
источник
Проведение лабораторных исследований воды уже стало хорошим тоном для собственников частных домов. Наличие собственного источника водоснабжения на участке требует регулярного изучения физических параметров, а также выполнения химанализа — для получения точной информации о составе и качестве жидкости. Кроме колодезного и скважинного водоснабжения, получать точные данные о составе текущей в трубах среды нужно представителям промышленного сектора. Но где сделать химический анализ воды можно быстро, эффективно и качественно? Лаборатория нашей санэпидемслужбы предлагает четкий прайс и широкий перечень параметров для проверки. Получать результаты мы предлагаем в строго установленные сроки и на официальных бланках, соответствующих требованиям Роспотребнадзора.
Куда обращаться, если у вас возникли сомнения в качестве и чистоте жидкости, используемой в питьевых целях? Наша СЭС проведет все исследования с учетом особенностей проблемы. В первую очередь, нужно учесть, что водопроводные среды проверяются на уровень качества по стандартам СанПиН еще на стадии прохождения через станцию, централизованно. В них должны отсутствовать фекальные примеси, тяжелые металлы. Бактериологические показатели также должны соответствовать норме. Особенно важно качество питьевого сырья. Его показатели зависят от способов используемой очистки. Микробиологические пробы обычно проводятся в природных водоемах. Санобработка для водопровода подавляет развитие патогенной флоры в трубах и водных массивах.
В Москве и Московской области, несмотря на все прилагаемые усилия, сохраняется недостаточно благоприятная санитарная обстановка. Компании, предприятия, организации используют жидкости в промышленных целях и часто экономят на их очистке, выбирая самые дешевые системы. Кроме того, на состав воды сильно влияет уровень грунтовых вод, сезонные факторы. Испытательная лаборатория отмечает, что любые изменения физических характеристик должны подвергаться проверке. Если источник загрязнен, сдавать пробы в центр для исследования нужно немедленно. Но даже когда визуальных изменений нет, физико-химическая экспертиза и анализ воды, проведенный специалистами, может показать негативные изменения, связанные с содержанием примесей органического и неорганического типа.
Содержание микроэлементов минерального и металлического происхождения в каждом источнике водоснабжения абсолютно уникально. Однако существуют определенные нормативы, устанавливающие уровень их безопасного потребления организмом человека. Если он превышен, то последствия могут быть самыми негативными. При проверке хим. состава жидкостей исследуются как содержащиеся внутри них компоненты, так и органолептические показатели, способные стать достаточно информативным дополнением ко всему, что касается составления полного отчета о проведенной проверке. Изменения запаха, цвета, уровня прозрачности, вкуса — все эти факторы являются следствием наличия посторонних примесей. И если они выявляются при детальной или экспресс-проверке, следует проявить бдительность.
При изучении представленных образцов и проб специалисты лаборатории в первую очередь обращают внимание на следующие показатели:
- содержание органических примесей — окисляемых и выявляемых при помощи кислородного воздействия, кроме простого наличия, можно выявить точные наименования веществ;
- органолептические характеристики — они определяют основные показатели, влияющие на потребительские свойства жидкости;
- обобщенные или физические — плотность, жесткость, кислотность среды;
- наличие неорганических примесей — металлы, черные, цветные, тяжелые.
Современные технические средства и химические реагенты позволяют специалистам нашей лаборатории получать максимально точные и достоверные результаты исследований в короткие сроки.
Установленная на хим анализ воды из скважины стоимость для населения в нашей лаборатории всегда остается максимально доступной. Законодательно обязанность по проверке качества текущей из крана, скважины, колодца жидкости на частных собственников не возлагается. Но многие владельцы домов и квартир предпочитают контролировать эти параметры в соответствии с рекомендациями Роспотребнадзора не реже 1 раз в полугодие. Причинами для выполнения проверки могут быть следующие факторы:
- контроль за качеством применяемого для приготовления пищи и питья сырья;
- подбор системы водоподготовки с учетом состава жидкости;
- определение возможностей для целевого назначения жидкости (для аквариумистики, полива комнатных растений).
Выполнять химический анализ водопроводной воды в Москве должны представители ресурсоснабжающих организаций. В частности, на Водоканале исследование после очистки проводится сразу по 130 параметрам. Но если на выходе со станции жидкость является безопасной, нет гарантии, что она останется таковой до момента попадания в кран. Некачественное обслуживание труб приводит к развитию внутри них патогенной микрофлоры, попаданию органических или неорганических примесей. При их поступлении в организм человека — во время купания, при чистке зубов или при употреблении жидкости без кипячения, может происходить бактериальное заражение, поражение органов и тканей тяжелыми металлами. Анализ в этом случае поможет уточнить опасные компоненты.
Химический анализ воды из колодца, родника не является обязательным. Но собственники таких источников водоснабжения, как правило, предпочитают следить за тем, что они пьют. Тем более, что именно здесь чаще всего наблюдаются случаи употребления жидкостей в некипяченом виде. Распознать наличие опасных примесей по неприятному привкусу, запаху, изменению цвета можно только в 3% всех случаев загрязнения. Помимо распространенных бактерий, вроде кишечной палочки, в составе могут находиться такие компоненты, как яйца глистов, а также возбудители и споры гораздо более опасных инфекций. Так, при отсутствии данных о предыдущем использовании участка, вырытый на его территории колодец может оказаться вблизи от скотомогильника.
Химический анализ воды из скважины и стоимость его проведения — важный вопрос для обладателей собственных, автономных источников водоснабжения глубокого залегания. Если на участке присутствует подобное дополнение уже при покупке, анализ стоит сделать обязательно. Кроме того, рекомендуется выполнять проверку недавно выкопанного источника спустя 3-4 месяца, после естественного осаживания поднятых взвесей. При использовании скважины для розлива бутилированной продукции, промышленном или лечебном применении сырья, поступающего из нее, обязательно оформление установленного требованиями органов по сертификации подтверждающего документа. Именно он подтверждает соответствие уровня санитарии нормативным требованиям.
Химический анализ воды в Москве, цена которого зависит от перечня исследуемых характеристик, для бутилированной продукции обязателен. Но и здесь есть свои тонкости. К примеру, многие поставщики бутылей для кулеров заправляют их чуть ли не из водопроводной сети, без дополнительной фильтрации и обработки. Обращение в лабораторию позволяет исследовать уровень качества и безопасности жидкости. Кроме того, можно проверить микробиологические характеристики — в самой бутыли и после выхода воды из крана. Они покажут, насколько чистым и безопасным с санитарно-гигиенической точки зрения является источник питьевого сырья. Для минеральной и артезианской продукции существуют отдельные стандарты и нормативы.
В рамках применения исследований химсостава продукции может применяться целый комплекс различных методов контроля. Среди наиболее часто используемых вариантов можно отметить:
- спектрофотометрический — исследует наличие посторонних включений органического и неорганического характера в составе;
- потенциометрический — обеспечивает контроль за содержанием фторидов, водорода;
- хроматографический — обеспечивает выявление органики в составе образцов;
- гравиметрический — обеспечивает оценку сульфатных характеристик, минерализации воды;
- органолептический — основан на объективной оценке вкуса, цвета, запаха, визуальных характеристик жидкости;
- капиллярный электрофорез — позволяет выявлять экзотоксические вещества, катионы и анионы.
Аналитическая проверка воды подразумевает использование современных и эффективных средств, методов и технологий для выполнения исследований. Порядок действий зависит от того, выполняется забор проб лаборантами или самим заказчиком. Как только образцы оказываются доставлены к месту назначения, их тщательно проверяют на все заданные параметры (15 базовых, 22 или 33 вида показателей). По результатам выполненных испытаний производится составление отчетной документации.
Проводящие химический анализ воды независимые лаборатории сегодня являются одним из базовых инструментов, при помощи которых Роспотребнадзор контролирует качество питьевого сырья в регионе. Профессиональный подход в этом случае обеспечивает возможности для оптимального достижения заявленных результатов. Наша санэпидемстанция располагает собственным сертифицированным исследовательским центром, на базе которого обеспечивается выполнение контрольных мероприятий по изучению уровня безопасности предоставляемых образцов. Все работы проводятся экспертами высокого класса, способными с высокой точностью проконтролировать все значимые характеристики.
источник