Вы сделали скважину у себя на участке, но не знаете какого качества вода из неё?
Судить о качестве воды и ее соответствии или несоответствии установленным нормам можно только на основании максимально полного химического и бактериологического анализа.
Почему вода имеет неприятные запах и привкус? Почему вода мутная и желтого цвета? Почему водонагревательные приборы покрыты густым желтым (белым) налетом? Почему при использовании воды (водопроводной, скважинной, колодезной) возникает зуд на кожных покровах?
Анализ проб воды по ряду химических и микробиологических показателей дает ответы на эти и другие вопросы, а так же определяет необходимый именно для Вас комплект оборудования системы водоочистки и выявляет:
- Наличие в воде нерастворимых примесей, песка, взвесей, ржавчины.
- Присутствие в воде растворимого железа и марганца.
- Жесткость воды.
- Наличие неприятного привкуса, запаха и цветности.
- Бактериологическая загрязненность.
Проведенный в лаборатории химический анализ воды гарантирует правильный выбор системы очистки, что в свою очередь является гарантией здоровья вашей семьи.
Анализ воды с источника для питьевых или хозяйственно-бытовых целей производится независимой аккредитованной испытательной лабораторией в городе Киеве. Лаборатория оборудована современным оборудованием для проведения анализа воды с применением современных препаратов, реактивов. Это обеспечивает высокую оперативность, высокую достоверность и точность анализа воды. Все методики измерений аттестованы Госстандартом Украины.
Высококвалифицированные специалисты изготавливаю, анализируют и выдают для Вас анализ воды. При оценке качества воды производят химический анализ состава воды по большой номенклатуре показателей. Среди показателей наиболее востребованные мутность, содержание железа, сероводород, цветность, жесткость воды, тяжелые металлы, перманганатная окисляемость, РН, содержание органических веществ и, конечно, запахи. Среди других показателей микробиологической безопасности: общее микробное число и термотолерантные колиформные бактерии (срок исполнения такого анализа более трех дней).
После того, как анализ воды будет готов, лаборатория составляет протокол о пригодности воды для нужд потребителя, выдается заключение и назначение по корректировке состава воды с учетом концентрации всех химических веществ и рекомендации по технологии очистки воды.
Для химического анализа (по 24 параметрам) необходимо не менее 1,5 литров воды. Воду нужно набрать в стеклянную тару
или пластиковую из под минеральной воды, которая более удобна. Посуда обязана быть чистой и без посторонних запахов.
Последовательность действий при наборе воды на анализ:
1. Из проверяемого источника необходимо дать воде стечь в течение 10-15 минут. Это необходимо, чтобы на анализ попала вода непосредственно из скважины (или водопровода), а не из труб и накопителей в доме. Спускать воду нужно обязательно, иначе анализ будет не достоверный.
2. Сполоснуть изнутри емкости той водой, которая будет сдаваться на анализ.
3. Набирать воду небольшой медленной струей, можно по стенке бутылки. Это нужно делать затем, чтобы обеспечить минимальное «бурление» воды при ее наборе, т.к. в противном случае она насыщается кислородом и в ней возможны химические реакции, влияющие на первоначальный химический состав воды.
4. Воду в тару набирать под самое горлышко или крышку «с переливом», чтобы не допустить образования воздушной пробки. Меньше воздуха в воде — более точный анализ..
5. Далее необходимо поместить набранные емкости с водой в непрозрачный пакет или сумку, и чем скорее вода попадет в лабораторию, тем лучше.
Химический анализ воды по расширенному перечню проводится в несколько этапов, при этом он учитывает всевозможные типы критериев: основные характеристики воды – цвет и запах, осадок и мутность, PH и т.д.; и специальные — на выявление химических элементов, соединений и др.
Стоимость такого анализа 450 грн . при доставке воды самостоятельно и 550 грн . при выезде для забора воды к клиенту.
Сокращенный анализ годится для оценки совокупной загрязненности воды в сопоставлении с требованиями СанПиН. Такой комплекс анализа воды нужен при ежегоднем профилактическом контроле качества воды, получаемой из артезианских скважин и колодцев, а также для проверки качества работы фильтров очистки.
Санитарно-бактериологический анализ (3 показателя) – это оценка степени и характера бактериального загрязнения объектов внешней среды.
Основные выявляемые бактериальные загрязнения:
При стандартном санитарно-бактериологическом анализе воды санитарное состояние характеризуют двумя основными показателями: общим количеством бактерий в воде; количеством бактерий группы кишечной палочки(бактерий Coli). При бактериологическом исследовании воды прежде всего ставится цель установить, заражена ли вода болезнетворными бактериями, возбудителями тифа, холеры, дизентерии. Поскольку определить наличие этих бактерий очень трудно, то обычно бактериологический анализ воды сводится к выявлению бактерий группы кишечной палочки, которые для человека не опасны, но присутствие их свидетельствует о загрязнении воды фекалиями и вызывает подозрение о наличии в воде патогенных (болезнетворных) бактерий.
источник
Некоторые из нас лечат простуду самостоятельно, назначают, покупают и принимают таблетки. Это обусловлено тем, что к врачу идти долго и нет уверенности в целесообразности визита. Но что, если речь идет о более серьезных заболеваниях? Вероятно, что в таком случае принимать лекарства без предварительной диагностики — дорогая и опасная затея. Аналогичная ситуация наблюдается для воды. Использование фильтра против свободного хлора для водопровода — безобидно и правильно. Но установка в загородном доме фильтрационной системы, стоимостью более 100 000 рублей без предварительного исследования может стать убыточным проектом. Поэтому действиям по изменению состава предшествует анализ, расчет и консультация — это верный путь к улучшению качества.
Этот блок исследования состоит из показателей, имеющих химическую природу. Их разделяют на обобщенные, металлы или элементы, органические показатели, анионы и другие. В первую очередь контролируют вещества и элементы, оказывающие токсическое действие на организм. При анализе воды из скважины обращают внимание на тяжелые металлы, радиологию. В случае колодца — на перманганатную окисляемость, нитраты, нитриты, ПАВ. В анализ водопровода входят алюминий, окисляемость, pH. Химические анализы разделяются по подробности. Минимальный анализ содержит базовый набор показателей, расширенный набор — полный перечень тяжелых металлов и нефтепродукты, максимальный — в дополнение к расширенному, набор органических веществ, в том числе канцерогенных (способных вызывать рак).
Включает в себя определение базовых обобщенных групп микроорганизмов, таких как ОМЧ — общее микробное число, ОКБ — общие колиформные бактерии, ТКБ — термотолерантные колиформные бактерии по МУК 4.2.1018-01. Общее микробное число выявляет количество микроорганизмов способных образовывать колонии на питательной среде. Эта группа включает как патогенные (опасные для организма), так и условно патогенные микроорганизмы. В ОКБ и ТКБ входят колиформные бактерии, это группа кишечной палочки, которая вызывает расстройства желудочно-кишечного тракта. Эти организмы опасны для пожилых людей и детей, а также для людей с ослабленным иммунитетом.
Если результаты исследований показывают, что присутствуют указанные выше группы — проводят дополнительные исследования или предпринимают меры по очистке воды от микроорганизмов. Подробную статью о методах очистки читайте здесь. Развернутый материал о микрофлоре питьевой воды поможет разобраться в особенностях классификации микроорганизмов и узнать их типичные места обитания.
Требования к качеству питьевой воды зависят от её класса. Источники питьевого водоснабжения делят следующим образом:
- Источники централизованного водоснабжения
К этой группе относятся водопроводы городов, поселков городского типа, крупных поселений. К ним предъявляются жесткие требования, которые контролируются водоканалом, поставляющим воду в сеть и управляющей компанией, которая обслуживает распределительную сеть жилого строения. Документ, регламентирующий качество в этом случае — СанПиН 2.1.4.1074-01. В отличие от состава бутилированной, в водопроводе содержание показателей регламентируется только сверху, т.е. показатель должен быть не больше определенного числа. - Бутилированная вода
Сюда попадает питьевая, расфасованная в ёмкости и не попадает минеральная вода (с минерализацией более одного грамма на литр) и напитки, включая сладкие газированные. Эта группа подразделяется на две части: высшую категорию и первую категорию. Требования к ним различаются в том числе тем, что содержание веществ и элементов в воде высшей категории ограничено как сверху, так и снизу. Т.е. вещества должны находиться в отведенном диапазоне. Это сделано для того, чтобы жидкость в бутылке была физиологически полноценной.
Вода после обратного осмоса не считается физиологически полноценной. Требования к воде, расфасованной в емкости, предъявляются в СанПиН 2.1.4.1116-02.
Микробиологические требования к качеству подробно описаны здесь.
Анализ необходим если вы хотите узнать состояние своего источника водоснабжения и скорректировать его, если что-то не так. Вот несколько примеров:
Вырыли новый колодец или переехали в место, где колодец уже есть. Колодец — один из самых не защищенных от воздействия окружающей среды источников водоснабжения. На состав в нем влияют грунтовая влага, осадки, почвы. В колодезной воде рекомендовано проводить бактериальный анализ в дополнение к химическому.
Пробурили скважину. Состав воды из скважины разнится в зависимости от глубины, местоположения, геологии. Для безопасного употребления в пищу воду стоит проанализировать, убедиться в отсутствии загрязнителей, в случае необходимости, подобрать и установить фильтр, подходящий составу Вашей скважины.
Пользуетесь кулером или накопительными баками. В 83 % случаев образцы бутилированной воды, отобранные из распределительной системы кулера, не проходят проверку по микробиологии. Это связано с нарушением частоты и технологии санобработки. Не моете накопительный бак после обратного осмоса — со временем там образуются биопленки.
Бактериологический анализ воды в офисах Москвы рекомендовано проводить регулярно, поскольку систематические заболевания сотрудников приводят к убыткам.
Чтобы правильно отобрать образец, воспользуйтесь инструкцией. Обратите внимание, что образец для микробиологического анализа отбирают в стерильную тару. Это требование связано с недопустимостью попадания в образец микроорганизмов извне, поскольку это искажает результаты исследования. Для отбора подходит контейнер для биоматериала из аптеки или другая одноразовая стерильная тара вместимостью не менее 100 мл.
Отбор проб питьевой воды для химического анализа регламентирован ГОСТ 31861-2012. Допускается и упрощенный отбор, описание и объем тары смотрите в инструкции. Если Вам требуется расчет тары по ГОСТ — обратитесь к нам, мы предоставим перечень и, если потребуется, саму тару с консервантами. Обратите внимание на условия хранения, большинство показателей требует хранения проб при температуре 3-5 градусов. Так что, после отбора, положите пробу в холодильник.
источник
Свидетельство об аккредитации № РОСС RU.0001.511201
Вопрос качества питьевой воды — один из острых вопросов современной жизни человека, когда ответственность за качество своей жизни и здоровье свое и близких каждый несет сам.
Состав воды из родников, колодцев, индивидуальных скважин и скважин поселковых водопроводов не находится под постоянным санитарным контролем. Как показывает практика анализа воды наших Заказчиков, в более чем половине случаев состав воды подземных источников не удовлетворяет нормативу СанПиН 2.1.2.1188-03. Какая система очистки требуется в Вашем случае и насколько она эффективно работает – подскажет анализ в независимой от производителей фильтров лаборатории.
В городских условиях, как правило, вода, отпускаемая со станций водоподготовки, проходит тщательную очистку и удовлетворяет всем нормативам. Однако Вы можете все-таки получить воду, неотвечающую требованиям безопасности, из-за изношенности коммунальных сетей.
В наше время покупка бутилированной воды с полки магазина — не гарантия ее безопасности, а уж тем более полезности. Если Вы перешли в своем рационе питания на бутилированную воду, мы настоятельно рекомендуем Вам ее проверить.
Анализ качества исходной воды при стороительстве частного бассейна позволит осуществить правильный выбор системы очистки и подготовки воды. Мы проводим также анализ воды бассейнов на соответствие требованиям ГОСТ Р 53491.1-2009 «Бассейны. Подготовка воды» и СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества»
Качество поверхностных вод напрямую влияет на безопасность жизни людей. Загрязнение водоемов сточными водами и размещение отходов на берегах могут приводить к негативному воздействию на здоровье. Загрязненную воду нельзя использовать для питья, полива и водопоя скота. Высокое содержание химических вредных веществ в воде при купании могут вызывать заболевания внутренних органов, ослабления иммунитета, различного вида кишечных расстройств. Анализ воды из водоемов может наглядно показать области загрязнения и привлечь внимание компетентных органов для разработки мероприятий по очистке воды.
Мы предлагаем провести анализ сточных вод для заинтересованных юридических лиц.
Выбирайте какой вам больше нравится по соотношению максимум информации/цена, если сомневаетесь то позвоните
Включает самый необходимый минимум показателей для оценки качества воды из любого источника водоснабжения: Запах, Привкус (для бутилированной воды), Цветность, Мутность, Водородный показатель (рН), Общая жесткость, Перманганатная окисляемость, Минерализация, Железо общее, анионы (F-, Cl-, NO3-, SO42-).
К этому списку Вы можете самостоятельно можете добавить интересующие показатели и сформировать свой профиль анализа воды.
Физико-химический анализ воды по 22 показателям, включающим органолептические (Мутность, Цветность, Запах) и химические (Водородный показатель (рН), Общая жесткость, Перманганатная окисляемость, Щелочность общая, Щелочность свободная, Кальций, Магний, Натрий, Калий, Фторид-, Хлорид-, Нитрат-, Сульфат-, Карбонат- и Гидрокарбонат- ионы, Минерализация, Электропроводность, Железо общее, Марганец,) показатели состава воды. Профиль «Минимальный» ориентирован на выявление макрокомпонентного состава воды и включает также определение наиболее часто обнаруживаемых загрязнителей в питьевых водах регионов России – железа и марганца, подходит для источников нецентрализованного водоснабжения (колодцев, скважин, родников). Ограничения: не учитывает возможность загрязнения воды микроколичествами токсичных металлов и органических экотоксикантов.
«Минимальный» (22 компонента)
Физико-химический анализ воды по 30 показателям, включающим органолептические (Мутность, Цветность, Запах) и химические (Водородный показатель (рН), Общая жесткость, Перманганатная окисляемость, Щелочность общая, Щелочность свободная, Кальций, Магний, Натрий, Калий, Фторид-, Хлорид-, Нитрат-, Сульфат-, Карбонат- и Гидрокарбонат- ионы, Минерализация, Электропроводность, Аммоний-, Алюминий, Железо общее, Марганец, Медь, Цинк, Кадмий, Свинец, Мышьяк, Стронций). По сравнению с профилем «Минимальный» включены некоторые, часто встречающиеся в воде или наиболее опасные, токсичные ионы металлов, а также аммоний – показатель микробиологического загрязнения и продукт деструкции азотистых органических соединений в воде и почве в результате разложения биологических объектов.
«Оптимальный» (30 компонентов)
Физико-химический анализ воды по 50 показателям, включающим органолептические (Запах, Привкус (для бутилированной воды), Цветность, Мутность) и химические (Водородный показатель (рН), Общая жесткость, Перманганатная окисляемость, Щелочность общая и свободная, Катионы и Анионы макрокомпонентного состава вод, Тяжелые металлы и микроэлементы, Сероводород и его формы, Формы минерального азота (Аммоний, Нитрат- и Нитрит – ионы), Нефтепродукты, Электропроводность, Минерализация (сухой остаток). Охватывает большинство приоритетных загрязнителей питьевой воды неорганической природы. Наилучшим образом подходит для первичной оценки качества воды из индивидуальной скважины, колодца, родника, водопровода небольших поселений, а также бутилированных питьевых вод, безопасности их употребления. Позволяет подобрать наилучшим образом систему очистки воды и оценить эффективность работы.
Профиль разработан для наиболее трепетно относящихся к своему здоровью заказчиков. По сравнению с профилем «Подробный» расширен перечень определяемых компонентов за счет ряда характерных загрязнителей — органических веществ, аллергенов и канцерогенов, включенных в перечень нормируемых в СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения»:
анионные поверхностно-активные вещества (ПАВ), хлороформ, формальдегид, бенз(а)пирен, фенол, бензол, толуол, стирол, орто-, мета- и пара- ксилолы, а также хлор остаточный свободный, хлор общий (применяется для воды централизованного водоснабжения и при очистке воды хлорированием).
Данный анализ позволяет получить наиболее полную картину о чистоте и безопасности воды.
Анализ предназначен для определения химического загрязнения в открытых водоемах. По оценкам Всемирной организации здравоохранения (ВОЗ) 80 % заболеваний в мире вызваны неподобающим качеством и антисанитарным состоянием воды. В сельской местности проблема качества воды стоит особенно остро — около 90 % всех сельских жителей в мире постоянно пользуются для питья и купания загрязненной водой.
Исследуемые показатели:
Водородный показатель (рН), ХПК (окисляемость бихроматная), БПК5, АПАВ, Нефтепродукты, Аммоний, Фенол, Токсичные ионы металлов (Железо общее, Марганец, Медь, Кадмий, Ртуть, Мышьяк, Никель, Свинец, Хром, Цинк), Анионы (Фториды, Хлориды, Нитраты, Нитриты, Сульфаты, Фосфаты) Заказав исследование «Пруд» Вы сможете убедиться, что вода в Вашем водоеме не наносит вреда организму или, получив тревожные результаты, взяться за решение выявленных проблем «с открытыми глазами».
Анализ воды призван оценить состояние воды в частном или общественном бассейне по 17 показателям:
Запах, Цветность, Мутность, Водородный показатель (рН), Общая жесткость, Перманганатная окисляемость, Аммоний, Железо, Марганец, Хлор общий, Хлор свободный, Формальдегид, Хлороформ, Фторид-, Хлорид-, Сульфат- и Нитрат- ионы.
Перечень показателей учитывает все требования СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества» и ГОСТ Р 53491.1-2009 «Бассейны. Подготовка воды» и позволяет оценить безопасность плавания в бассейне. Учитывая, что во время купания люди могут случайно проглотить её, что особенно часто происходит у детей, рекомендуем проверять пригодна ли вода бассейна для питья.
«Вода бассейнов» (17 компонентов)
Помимо химического анализа воды мы рекомендуем сделать микробиологическое исследование воды в партнерской лаборатории биологического факультета МГУ (без аккредитации).
Понятно, что несоответствие воды микробиологическим нормам, так же, как и химическим, делает ее непригодной для питья. Своевременный микробиологический анализ позволит предотвратить заражение кишечными инфекциями, передающимися водным путем, и в случае индивидуальных скважин разработать меры по очистке воды.
Микробиологический анализ воды в МГУ включает определение общего микробного числа (ОМЧ), количества общих колиформных и колиформных термотолерантных бактерий.
Общее микробное число — количество микроорганизмов в единице объема исследуемого объекта. ОМЧ позволяет получить представление о массивности бактериального загрязнения воды. Чем выше ОМЧ, тем больше вероятность попадания в объект патогенных микроорганизмов.
Колиформные организмы (общие колиформы) являются удобными микробными индикаторами качества питьевой воды. Согласно рекомендациям СанПиН, колиформные бактерии не должны обнаруживаться в системах водоснабжения с подготовленной водой. Допускается случайное попадание колиформных организмов в распределительной системе, но не более чем в 5% проб, отобранных в течение любого 12 — месячного периода. Присутствие же колиформных организмов в воде свидетельствует о ее недостаточной очистке, вторичном загрязнении или о наличии в воде избыточного количества питательных веществ.
Среди колиформных микроорганизмов выделяют группу термотолерантных бактерий, которые ферментируют лактозу при 44°С в течение 24 ч. Эти бактерии являются показателями свежего фекального загрязнения.
Микробиологическое исследование выполняется только в дополнение к химическому анализу воды.
источник
Компания «Эко-Дефенс» более 10 лет производит профессиональную дезинсекцию, дезинфекцию, дератизацию. Также мы проводим экспертизу и анализы воды, почвы, воздуха, радиации и шума в Москве и Московской области. Мы используем проверенные и надежные гипоаллергенные препараты и гарантируем 100%-е качество выполненных услуг. Точную стоимость услуги, вы можете узнать позвонив по телефону 8 (495) 151-84-77. Менеджер уточнит площадь квартиры, дома или участка, удаленность от МКАД и еще ряд параметров и даст вам развернутый ответ по стоимости, методах работы и времени приезда специалиста.
Современный мир полон опасностей, и купить противоядие от каждой из них вряд ли получится. Даже привычные элементы комфорта могут нести серьезную угрозу. К примеру, забираемая из колодца, родника, скважины жидкость для питья может быть заражена опасными патогенными микроорганизмами. В этом случае любое употребление некипяченой воды, в том числе при купании, умывании, других манипуляциях, может приводить к весьма тяжелым последствиям. Но с проблемой можно справиться и даже ее предупредить, если использовать для этого специализированные исследования в лаборатории. Анализ воды — химический и бактериологический, подразумевает наличие возможностей для своевременного выявления угрозы, а также ее классификации с учетом требований Роспотребнадзора и СанПиН.
Прайс на услуги нашей санэпидемстанции в Москве и Московской области предусматривает и предоставления полного комплекса лабораторных услуг. Специалисты выполняют необходимые исследования на бактериальные показатели, наличие опасных химикатов и составляют квалифицированные экспертные заключения. Долго употреблять зараженную воду просто опасно. Если ее качество не соответствует санитарным нормам, считать жидкость питьевой нельзя. Она должна подвергаться кипячению и другим видам очистки. Органические примеси в источниках должны присутствовать в строго ограниченном количестве. Для проверки содержимого природных источников водоснабжения достаточно сделать проверку микробиологических характеристик и качества по заданным параметрам.
Поскольку водопроводные системы регулярно подвергаются достаточно интенсивной санитарной обработке, проводить в них контрольные исследования приходится нечасто. А вот владельцы колодцев и скважин — частные лица и компании, должны сдавать пробы в СЭС не реже раза в полугодие, чтобы позаботиться о регулярном проведении лабораторных исследований для оценки состава воды. Однако бывают и исключения из правил. В старых водопроводных трубах магистрали также может наблюдаться существенное ухудшение санитарных показателей транспортируемой среды. Если вода явно имеет следы загрязнений, мутная, имеет осадок, посторонние запахи, не стоит полагаться на добросовестность коммунальных служб — лучше сразу обратиться за помощью в СЭС.
Выполненный на высоком профессиональном уровне, бак анализ воды из скважины позволяет успешно выявить и уточнить все необходимые показатели, способные представлять опасность для здоровья человека. Потенциальные источники угрозы могут быть выявлены при присутствии фекальных примесей. Они проявляются в воде в виде колиформных бактерий — чаще всего Escherichia coli, имеющих спорообразующуюся структуру. При возникновении эпидемиологической угрозы такая вода становится основным источником распространения опасных кишечных инфекций. Если примеси попадают в скважину с завидной регулярностью, может встать вопрос о целесообразности ее применения в хозяйственно-бытовых целях. Принять решение собственник сможет лично.
Установленная на бак анализ воды цена невысока, но позволяет получить важнейшие данные о санитарной безопасности источника. Для колодцев это особенно важно, ведь для них характерны следующие особенности:
- Близкое расположение водоносного слоя. Жидкость подвержена заражению через наружные слои почвы, при наличии контакта с фекальными массами может включать в себя широкий спектр бактериальной флоры.
- Высокий подъем грунтовых вод. Разливаясь, они могут приносить с собой дополнительные примеси, способные представлять существенную санитарную опасность.
- Нарушение санитарных норм в строительстве. Копка колодца поблизости от дачного туалета, выгребной или компостной ямы может привести к просачиванию загрязнений в чистую воду.
Уточняя, сколько стоит бак анализ на воду, нужно обязательно учитывать, что все ее показатели достоверно и точно сможет установить только квалифицированная экспертиза. Выполнять исследования имеют право только аккредитованные лаборатории. Именно на них Роспотребнадзором возлагается проведение всех необходимых контрольно-ревизионных действий для проверки безопасности жидкости в природных источниках водоснабжения. В нашей санэпидемстанции уже оборудовано все необходимое для решения самых сложных задач в этой области. Сотрудники лаборатории имеют опыт обслуживания колодцев и скважин общественного и индивидуального назначения и всегда готовы отправиться на выезд для забора образцов, а также их последующего изучения.
Сколько стоит химический и бактериологический анализ воды, и когда он должен проводиться обязательно? Важно понимать, что любые источники водоснабжения, искусственные водоемы и бассейны периодически должны проходить контроль на предмет обнаружения в составе потенциально опасных веществ в высокой концентрации. Среди важных показателей можно отметить:
- колиформная бактериальная флора — ее содержание в питьевой воде недопустимо (проверяется на каждые 100 мл);
- микробное число — допустимая концентрация составляет 50 КОЕ/мл;
- термотолерантная колиформная микрофлора — не должна присутствовать в любом объеме;
- эндотоксические бактериальные показатели — здесь норма не должна превышать 0,125 ЭЕ/мл.
Химико-бактериологическая экспертиза и анализ воды проводится с исследованием характерных для ее состава показателей, а также их проверкой на соответствие нормам и требованиям. Все актуальные параметры регламентированы требованиями СанПиН. Микробиологические аналитические исследования выполняются для определения соответствия воды нормам питьевого или технического стандарта. Проверка проб выполняется с использованием современных и актуальных методов, позволяет обеспечивать оптимальное соотношение скорости и качества выполняемых исследовательских мероприятий. Современное техническое оснащение делает такой лабораторный контроль по-настоящему эффективным, обеспечивает возможности для точного выявления всех фактов нарушения санитарии.
Применение данного способа проверки микробиологических параметров воды подразумевает использования индикаторов, которые при контакте со средой позволяют выявлять колибактерии при помощи изменения окраски жидкости. Проявление происходит в случае, если в жидкости есть определенные группы кислот и выделяемые патогенными бактериями продукты жизнедеятельности. Такой способ рекомендован Роспотребнадзором для контроля за качеством воды в бассейнах, природных водоемах: реках, озерах, а также при проверке колодцев и скважин различного назначения. Вода при этом берется в довольно значительных объемах, поскольку в экспериментах оказывается задействовано несколько пробирок с контрольными образцами, предназначенными для проверки.
На регулярной основе химический и бактериологический анализ воды в Москве в комплексе проводится на промышленных, социальных, культурных объектах, в образовательных и лечебных учреждениях. Здесь исследованию подвергаются также стоки и воды технического назначения. Оценить достоверно содержание в них патогенных микроорганизмов бывает достаточно сложно. На помощь приходит использование метода АТФ, в котором своеобразным индикатором выступает аденозинтрифорсфорная кислота. С ее помощью удается определить уровень концентрации живых микроорганизмов в составе пробы. При добавлении химического компонента в пробирку происходит реакция, проверить результаты которой можно при помощи люминометра. Интенсивность свечения покажет масштаб заражения.
Классическая методика, применяемая на протяжении долгих лет. В чашках Петри с питательной средой (агаром)высаживаются бактериальные колонии из полученных проб. При отсутствии микрофлоры, спустя сутки микробиологический фон не изменится. Но, если для опасных вредителей найдется питательная среда, за 24 часа их колония сумеет разрастись до значительных размеров. Для получения пригодной к высеванию бак посева среды воду разбавляют до определенной концентрации. Кроме того, при выращивании бактериальной колонии поддерживается определенный температурный режим. Применение данной методики актуально для контрольных исследований бактериальных показателей любых типов питьевой воды: от природной до бутилированной.
Если обычно колонизация бактерий в рамках аналитических исследований выполняется при помощи гелеобразного агара, имеющего довольно высокую плотность, то в этом случае бак посев делается исключительно в жидкость. Правда, состоящую из слабой концентрации все того же питательного «бульона» из коллагена, содержащегося в водорослях. Сильно разбавленный агар обеспечивает возможности для максимально быстрого роста колонии, гарантирует точность получаемых результатов. Размножение микроорганизмов в этом случае оказывается гораздо более быстрым и активным — при их отсутствии, питательная среда так и останется лишенной новых обитателей. Метод используется при исследовании воды питьевого назначения.
В рамках этого метода применяется дополнительная вакуумная фильтрация исследуемых образцов. Это целесообразно, если речь идет о точном установлении видовой и классовой принадлежности выявленных микроорганизмов. Стоит обратить внимание, что такой подход оказывается актуален для контроля качества питьевых вод всех типов.
Чтобы установленная на химический и бактериологический анализ воды цена оставалась выгодной, стоит с самого начала найти лабораторию, которой вы сможете доверять. Наша санэпидемстанция предлагает возможности для быстрого и эффективного решения этой проблемы. В аккредитованной лаборатории созданы все условия для успешного исследования всех представленных образцов и собранных проб. Вы можете обратиться к специалистам для проверки на наличие колиформных бактерий открытых водоемов и природных источников водоснабжения, а также сред, используемых для подачи по магистральным коммуникационным линиям. Обращаясь к специалистам, вы исключаете возможность ошибок и можете быть уверены в санитарной безопасности водоема.
источник
Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-микробиологический анализ питьевой воды
Методические указания
МУК 4.2.1018-01
1. Разработаны НИИ экологии человека и гигиены окружающей среды им. А. Н. Сысина РАМН (Недачин А. Е., Доскина Т. В., Дмитриева Р. А., Тишкова Н. Ю., Сидоренко С. Г.), Федеральным научным центром гигиены им. Ф. Ф. Эрисмана Минздрава России (Трухина Г. М., Мойсеенко Н. Н., Сарафанюк Е. В.), Аналитическим центром контроля качества воды «Роса» (Кашкарова Г. П.), Федеральным центром госсанэпиднадзора Минздрава России (Кривопалова Н. С., Сорокина Р. С.), Центром госсанэпиднадзора в г. Москве (Салова Н. Я., Малышева З. Г., Кожевникова Н. А.), Центром госсанэпиднадзора в Московской области (Козлова А. Т.), Московским НИИ генетики (Бовыкина Н. М.), НИИ коммунального водоснабжения и очистки воды (Русанова Н. А.), Российской медицинской академией последипломного образования (Власова И. В.), Российским государственным медицинским университетом (Пивоваров Ю. П.).
2. Утверждены Главным государственным санитарным врачом Российской Федерации — Первым заместителем министра здравоохранения Российской Федерации 9 февраля 2001 г.
3. С момента ввода данных методических указаний считаются утратившими силу методические указания МУК 4.2.671-97 «Методы санитарно-микробиологического анализа питьевой воды» и Информационно-методическое письмо Департамента государственного санитарно-эпидемиологического надзора Министерства здравоохранения Российской Федерации № 1100/1670-98-111 «О дополнительных мерах по осуществлению контроля качества питьевой воды по микробиологическим и паразитологическим показателям».
3. Отбор, хранение и транспортирование проб . 2
3.1. Общие требования к отбору проб . 2
3.2. Хранение и транспортирование проб . 3
4. Оборудование, расходные материалы, реактивы, питательные среды .. 3
4.2. Расходные материалы .. 4
4.3. Химические реактивы .. 4
4.5. Тест-культуры микроорганизмов . 6
5. Приготовление питательных сред и реактивов . 6
5.4. Фуксин-сульфитная среда Эндо . 7
5.5. Лактозо-пептонная среда . 7
5.6. Питательные среды для подтверждения способности ферментировать лактозу до кислоты и газа . 7
5.7. Реактивы для оксидазного теста . 8
5.8. Железо-сульфитный агар . 8
5.9. Реактивы для окраски препаратов по Граму . 8
6. Подготовка к анализу . 9
6.1. Подготовка посуды и материалов . 9
6.2. Подготовка проб воды .. 9
7. Методика работы при использовании мембранных фильтров . 9
7.1. Подготовка мембранных фильтров . 9
7.2. Подготовка фильтровального аппарата . 9
8.1. Определение общего числа микроорганизмов, образующих колонии на питательном агаре . 10
8.2. Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод) 10
8.3. Определение общих и термотолерантных колиформных бактерий титрационным методом .. 13
8.4. Определение спор сульфитредуцирующих клостридий . 15
8.5. Определение колифагов . 16
Главный государственный санитарный врач
Российской Федерации — Первый заместитель
Министра здравоохранения Российской Федерации
Дата введения: 1 июля 2001 г.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Санитарно-микробиологический анализ питьевой воды
Методические указания
МУК 4.2.1018-01
1.1. Настоящие методические указания устанавливают методы санитарно-микробиологического контроля качества питьевой воды в отношении ее эпидемической безопасности по показателям СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
1.2. Методические указания предназначены для лабораторий организаций, предприятий и иных хозяйственных субъектов, осуществляющих производственный контроль, а также органов санитарно-эпидемиологической службы, обеспечивающих государственный и ведомственный санитарно-эпидемиологический надзор за качеством питьевой воды централизованных систем питьевого водоснабжения.
2.1. Санитарные правила и нормы. «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». СанПиН 2.1.4.559-96.
2.2. Санитарные правила «Безопасность работы с микроорганизмами III — IV групп патогенности и гельминтами». СП 1.2.731-99.
2.3. ГОСТ 18963-73. Вода питьевая. Методы санитарно-бактериологического анализа.
3.1.1. Отбор проб производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа.
3.1.2. Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов.
3.1.3. Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги). Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием.
3.1.4. При отборе проб в одной и той же точке для различных целей первыми отбирают пробы для бактериологических исследований. Если отбирают воду после обеззараживания химическими реагентами, то для нейтрализации остаточного количества дезинфектанта в емкость, предназначенную для отбора проб, вносят до стерилизации натрий серноватисто-кислый в виде кристаллов из расчета 10 мг на 500 мл воды.
3.1.5. Пробу отбирают в стерильные емкости. Емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. Ополаскивать посуду запрещается.
3.1.6. При исследовании воды из распределительных сетей отбор проб из крана производят после предварительной его стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При отборе пробы напор воды может быть уменьшен. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок. Если через пробоотборный кран происходит постоянный излив воды, отбор проб производят без предварительного обжига, не изменяя напора воды и существующей конструкции (при наличии силиконовых или резиновых шлангов).
При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании.
После наполнения емкость закрывают стерильной пробкой и колпачком.
3.1.7. Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбиравшего пробу, и другой информации.
3.2.1. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре (4 — 10) °С. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При соблюдении указанных условий срок начала исследований от момента отбора проб не должен превышать 6 ч.
Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора.
Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы проводить не следует.
Пробы питьевой воды должны доставляться в отдельных продезинфицированных контейнерах.
Термостат для температурного режима (37 ± 1) °С
Термостат для температурного режима (44 ± 1) °С
Термостат или водяная баня для температурного режима (44 ± 0,5) °С
Водяная баня для температурного режима (75 ± 5) °С
Водяная баня или термостат для температурного режима (45 — 49) °С (для питательных сред)
Прибор для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм и устройство для создания разрежения (0,5 — 1,0) атм
Весы лабораторные общего назначения 4 кл. точности, с пределом взвешивания до 1000 г
Максимальный термометр ртутный с диапазоном измерения от 20 до 200 °С с ценой деления шкалы 1 °С
Термометр ртутный с диапазоном измерения от 0 до 100 °С с ценой деления шкалы 0,5 °С
рН-метр, обеспечивающий измерение с погрешностью до 0,01
Дистиллятор, обеспечивающий качество дистиллированной воды не ниже
Стерилизатор суховоздушный для температурного режима (180 ± 5) °С
Холодильник бытовой электрический
Вытяжной шкаф для работы с хлороформом при проведении анализа на колифаги
Нагревательный прибор для варки питательных сред либо магнитные мешалки с подогревом до 300 °С
Прибор для счета колоний бактерий
Лупа с двукратным увеличением
Дозаторы для разлива питательных сред
Оптический стандарт мутности на 10 ед.
Горелки газовые или спиртовки
Пинцеты для работы с мембранными фильтрами
Мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм и другие фильтрующие мембраны с аналогичной способностью фильтрации, имеющие сертификат качества
Индикаторы бумажные для определения рН в диапазоне 6 — 8 с интервалом определения 0,2 — 0,3
Фольга алюминиевая, колпачки силиконовые, металлические
Пипетки, вместимостью 1,5, 10 мл с ценой деления 0,1 мл многоразового или одноразового использования)
Пробирки (многоразового или одноразового использования)
Цилиндры, вместимостью 100, 250, 500 мл или мензурки, вместимостью 250, 500, 1000 мл
Чашки бактериологические (Петри)
Пробки (силиконовые, резиновые и другие, выдерживающие стерилизацию сухим жаром или автоклавированием)
Бумага фильтровальная лабораторная
Вата хлопковая медицинская гигроскопическая
Карандаши или фломастеры по стеклу
Все химические реактивы должны соответствовать квалификации не ниже ч. д. а.
Железо серно-кислое закисное (7-водное)
Натрий серноватисто-кислый (тиосульфат натрия) 5-водный
Спирт этиловый ректификованный медицинский
Спирт этиловый технический
Натрий сернисто-кислый (сульфит натрия)
Фенилендиаминовые соединения* (тетраметил-п-фенилендиамин гидрохлорид, диметил-п-фенилендиамин соляно-кислый)
Генциан фиолетовый кристаллический
* Вещества обладают канцерогенным и мутагенным действием, работа с ними требует соблюдения мер предосторожности.
Сухой препарат с индикатором ВР и лактозой или среда Гисса с лактозой
Пептон сухой ферментативный для бактериологических целей
Системы индикаторные бумажные (СИБ)
Допускаются к использованию коммерческие питательные среды, диагностические препараты и системы идентификации производства зарубежных фирм, предназначенные для целей описываемых методов. Питательные среды и биологические препараты зарубежного производства должны иметь международный сертификат качества ISO 9000 или EN 29 000.
При использовании следует руководствоваться рекомендациями фирмы-производителя.
Все обезвоженные коммерческие питательные среды и препараты отечественного производства должны иметь сертификат соответствия.
4.5.1. Контрольный колифаг М82, штамм ВКПМ-3254 Е. coli К12 F + Str r получают в ГНИИ Генетика — Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ — Россия, 113545, г. Москва, 1-ый Дорожный проезд, д. 1).
4.5.2. Штамм Е. coli М17-02 и один из штаммов: Pseudomonas aeruginosa или Pseudomonas fluorescens получают в Государственном Национальном Органе контроля медицинских и биологических препаратов им. Л. А. Тарасовича Минздрава России (Россия, 121002, г. Москва, ул. Сивцев-Вражек, д. 41).
В производственных лабораториях, расположенных на территории водопроводных станции, следует использовать штамм Pseudomonas fluorescens .
Предпочтительно использование стандартизованных сухих питательных сред промышленного производства.
При использовании промышленных сухих питательных сред их приготавливают в соответствии с указаниями изготовителя на этикетке.
В этом случае следует соблюдать способ применения и срок хранения питательных сред, указанные на упаковках.
Сухие питательные среды хранят в сухих помещениях, в темноте, при комнатной температуре. Открытые упаковки тщательно закупоривают. Среды с измененным внешним видом (уплотненные, с комками), а также с истекшим сроком годности не используют.
Для приготовления растворов, реактивов и питательных сред применяют воду дистиллированную по ГОСТу 6709-72.
Питательные среды готовят в посуде из инертного материала.
Учитывая возможное изменение рН питательных сред после кипячения и стерилизации, окончательный контроль рН проводят в готовой среде при температуре 25 °С с использованием индикаторной бумаги.
После стерилизации питательные среды оставляют для охлаждения при комнатной температуре. При необходимости розлива в чашки Петри среды охлаждают до температуры (50 — 60) °С.
Температура сред, хранящихся в холодильнике, перед посевом должна быть доведена до комнатной.
5.2.1. Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
5.2.2. Питательный бульон (десятикратный) для колифагов готовят путем увеличения в 10 раз навески сухого препарата, указанной на этикетке.
5.3.1. Готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
5.3.2. Питательный агар для определения колифагов прямым методом готовят, увеличивая навеску сухого препарата в 2 раза от прописи.
5.3.3. Питательный агар запрещается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
5.3.4. Полужидкий питательный агар готовят следующим образом: сухой питательный бульон (15 г) и агар микробиологический (3 г) растворить при нагревании в 1000 мл дистиллированной воды. Довести рН до 7,0 — 7,2, разлить в пробирки и стерилизовать автоклавированием при 121 °С в течение 15 мин.
5.3.5. Питательный агар со стрептомицином готовят из расчета содержания 100 мкг стрептомицина на 1 мл питательного агара, приготовленного по стандартной прописи. Стерильно на стерильной дистиллированной воде готовят раствор стрептомицина в концентрации 10 мг на 1 мл. В готовый питательный агар, отмеренный по объему и остуженный до температуры (45 — 49) °С, вносят приготовленный стерильный раствор стрептомицина из расчета 0,1 мл на 10 мл питательного агара. Разливают в пробирки для приготовления скошенного агара. Повторное расплавление питательной среды со стрептомицином запрещается.
Готовят из сухого препарата по способу, указанному на этикетке. Если на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить. Срок хранения чашек со средой не более 2 — 3 суток в темноте, если производителем не оговорены другие сроки.
5.4.2. Повышение дифференцирующих свойств среды
Для повышения дифференцирующих свойств среды в готовую и охлажденную до (60 — 70) °С среду перед разливкой в чашки допускается прибавлять на 100 мл среды 0,2 мл 5 %-ного спиртового раствора основного фуксина. Срок хранения раствора фуксина — не более 1 мес.
5.4.3. Модификация среды с добавлением розоловой кислоты
В случаях, когда мембранные фильтры зарастают микрофлорой, не относящейся к бактериям кишечной группы, помимо фуксина, допускается добавление на 100 мл среды Эндо 0,2 мл 5 %-ного спиртового раствора розоловой кислоты. Срок хранения раствора розоловой кислоты — не более 1 мес.
Модификацию среды Эндо с добавлением розоловой кислоты используют только при работе методом мембранной фильтрации.
10 г пептона, 5 г натрия хлористого, 5 г лактозы растворяют при нагревании в 1 л дистиллированной воды. После растворения ингредиентов устанавливают рН 7,4 — 7,6, разливают по 10 мл в пробирки, стерилизуют при (112 ± 2) °С 12 мин.
Для приготовления концентрированной лактозо-пептонной среды все ингредиенты, кроме воды, увеличивают в 10 раз, разливают по 1 мл в пробирки и по 10 мл во флаконы.
5.6.1. Полужидкая среда с лактозой из сухого препарата
Готовят по способу, указанному на этикетке.
Срок хранения — не более 2 недель при комнатной температуре.
Посев производят уколом до дна пробирки. При образовании кислоты цвет питательной среды изменяется в соответствии с использованным индикатором. При газообразовании газ скапливается или по уколу, или на поверхности, или в толще среды появляются разрывы. При инкубации посевов более 5 ч газ может улетучиться. В таких случаях на присутствие газа указывают оставшиеся в толще среды «карманы» — потемнения среды на месте бывшего пузырька газа.
5.6.2. Полужидкая среда с лактозой
Готовят при отсутствии сухого препарата.
В 1 л дистиллированной воды растворяют 10 г пептона, 5 г натрия хлористого, (4 — 5) г агар-агара, доводят до кипения, устанавливают рН 7,2 — 7,4, добавляют 1 мл 1,6 %-ного спиртового раствора бромтимолового синего. Стерилизуют при (120 ± 2) °С 20 мин. В расплавленную среду вносят 5 г лактозы, нагревают до кипения, разливают в стерильные пробирки на высоту (3 — 5) см и стерилизуют при (112 ± 2) °С 12 мин. Срок хранения — не более 2 недель при комнатной температуре.
Правильно приготовленная среда зеленого цвета с синеватым оттенком (цвет бутылочного стекла). При Образовании кислоты цвет среды изменяется на желтый.
5.6.3. Лактозо-пептонная среда
Готовят по п. 5.5 с добавлением 1 мл 1,6 %-ного спиртового раствора бромтимолового синего на 1 л и разливают по (3 — 5) мл в пробирки с поплавком.
Готовят по прописи завода-изготовителя.
1 %-ный водный раствор тетраметил-п-фенилендиамина гидрохлорид. Готовят перед употреблением.
Реактив № 1. 1 %-ный спиртовой раствор α-нафтола.
Реактив № 2. 1 %-ный водный раствор фенкпендиаминового соединения.
Растворы сохраняют в темных флаконах с притертыми пробками:
1 — до одного месяца, 2 — до одной недели. Перед употреблением к трем частям первого раствора добавляют семь частей второго раствора.
Могут быть использованы коммерческие тест-системы для постановки оксидазного теста (СИБ-оксидаза или аналоги).
Перед работой с каждой серией проб реактивы или тест-системы на оксидазу следует испытывать с тест-культурами микроорганизмов, дающих положительную ( Ps . aeruginosa , Ps . fluorescens ) и отрицательную оксидазную реакцию (E. coli).
В 1000 мл стерильного расплавленного питательного агара (по п. 5.4) добавляют 10 г глюкозы, нагревают до растворения, разливают мерно во флаконы, автоклавируют при (112 ± 2) °С 12 мин (основная среда).
20 %-ный раствор сульфита натрия ( Na 2 SO 3 ) и 8 %-ный раствор железа серно-кислого закисного ( FeSO 4 ) или железа хлористого ( FeCl 2 ) готовят непосредственно перед употреблением в стерильной посуде на стерильной дистиллированной воде. Раствор сульфита натрия нагревают до полного растворения. Перед выполнением анализа в 100 мл расплавленной основной среды вносят 5 мл 20 %-ного раствора сульфита натрия, перемешивают, затем вносят 1 мл 8 %-ного раствора сернокислого железа, перемешивают и стерильно разливают в пробирки высоким столбиком (12 — 15) см для работы методом мембранной фильтрации или во флаконы для работы методом прямого посева.
5.9.1. Карболовый раствор генциана фиолетового готовят следующим образом: 1 г генциана фиолетового, 10 мл ректификованного этилового спирта, 5 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды.
5.9.2. Раствор Люголя готовят следующим образом: 1 г йода, 2 г йодистого калия растворяют в 300 мл дистиллированной воды. Хранить во флаконе из темного стекла.
5.9.3. Фуксин Циля готовят следующим образом: 1 г основного фуксина, 10 мл спирта этилового ректификованного, 54 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды.
Лабораторную посуду моют, ополаскивают сначала водопроводной, затем дистиллированной водой и высушивают.
Пробирки, колбы, бутылки, флаконы закрывают силиконовыми или ватно-марлевыми пробками и колпачками (силиконовые, металлические, из фольги или плотной бумаги).
Пипетки со вставленными тампонами из ваты укладывают в металлические пеналы или заворачивают в бумагу.
Чашки Петри укладывают в металлические пеналы или заворачивают в бумагу. Бумага, используемая для обертывания лабораторной посуды, не должна разрушаться при стерилизации.
Подготовленную посуду стерилизуют в сушильном шкафу при температуре 160 °С в течение 2 ч или 180 °С 1 ч, считая с момента достижения указанной температуры. Стерильную посуду вынимают из стерилизационного шкафа после его охлаждения ниже 60 °С. Срок хранения стерильной посуды — не более 10 дней.
Материалы и лабораторную посуду, разрушающиеся при температуре (160 — 180) °С (резина и т.п.), следует стерилизовать в паровом стерилизаторе при температуре (121 ± 2) °С 20 мин.
Новые резиновые пробки кипятят в 2 %-ном растворе натрия двууглекислого 30 мин и 5 раз промывают водопроводной водой (кипячение и промывание повторяют дважды). Затем пробки кипятят в дистиллированной воде 30 мин, высушивают, заворачивают в бумагу или фольгу и стерилизуют в паровом стерилизаторе. Резиновые пробки, использованные ранее, обеззараживают, кипятят 30 мин в водопроводной воде с нейтральным моющим средством, промывают в водопроводной воде, высушивают, монтируют и стерилизуют.
После выполнения анализа все использованные чашки, пробирки и пипетки обеззараживают в автоклаве при (126 ± 2) °С в течение 60 мин, в исключительных случаях допускается обеззараживание кипячением в 2 %-ном растворе пищевой соды или 0,5 %-ном моющего средства в течение 60 мин с момента закипания (в закрытой емкости с полным погружением в раствор).
Перед посевом пробу тщательно перемешивают и фламбируют горящим тампоном край емкости. Используемые пробирки и чашки маркируют.
Перед каждым отбором новой порции воды для анализа пробу перемешивают стерильной пипеткой.
Мембранные фильтры должны быть подготовлены к анализу в соответствии с указаниями изготовителя.
Воронку и столик фильтровального аппарата обтирают марлевым (ватным) тампоном, смоченным спиртом ректификованным, и фламбируют. После охлаждения на столик фильтровального аппарата кладут фламбированным пинцетом стерильный мембранный фильтр, прижимают его воронкой.
В воронку прибора для фильтрования наливают отмеренный объем воды, затем создают вакуум.
При посеве нескольких объемов одной пробы следует фильтровать через один фильтровальный аппарат без обеззараживания сначала меньшие, а затем большие объемы воды, меняя каждый раз фильтры. Перед фильтрованием каждой новой пробы прибор обеззараживают.
Следует начинать с фильтрования проб обеззараженной воды или тех проб, которые предположительно не загрязнены, а затем фильтровать загрязненные пробы.
При фильтровании 1 мл исследуемой воды следует в воронку налить предварительно не менее 10 мл стерильной воды, а затем внести анализируемую воду.
После окончания фильтрования и осушения фильтра отключают вакуум, воронку снимают, фильтр осторожно поднимают за край фламбированным пинцетом и переносят его, не переворачивая, на питательную среду, разлитую в чашки Петри, избегая пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
Под каждым фильтром на дне чашки делают надпись с указанием объема профильтрованной воды, номера пробы и даты посева. На одну чашку можно поместить 3 — 4 фильтра с условием, чтобы фильтры не соприкасались.
8.1.1. Определение понятия показателя
Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 ч, видимые с увеличением в 2 раза.
Из каждой пробы делают посев не менее двух объемов по 1 мл.
После тщательного перемешивания пробы воды вносят по 1 мл в стерильные чашки Петри, слегка приоткрывая крышки. После внесения воды в каждую чашку вливают (8 — 12) мл (на чашку диаметром 90 — 100 мм) расплавленного и остуженного до (45 — 49) °С питательного агара после фламбирования края посуды, в которой он содержится. Затем быстро смешивают содержимое чашек, равномерно распределяя по всему дну, избегая образования пузырьков воздуха, попадания агара на края и крышку чашки. Эту процедуру производят на горизонтальной поверхности, где чашки оставляют до застывания агара.
Расплавленный агар на период проведения анализа помещают в водяную баню или термостат, поддерживающие температуру (45 — 49) °С.
После застывания агара чашки с посевами помещают в термостат вверх дном и инкубируют при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Подсчитывают все выросшие на чашке колонии, наблюдаемые при увеличении в 2 раза. Учитывают только те чашки, на которых выросло не более 300 изолированных колоний.
Количество колоний на обеих чашках суммируют и делят на два. Результат выражают числом колониеобразующих единиц (КОЕ) в 1 мл исследуемой пробы воды.
Если на одной из 2 чашек подсчет невозможен, результат выдают на основании учета колоний на одной чашке. Если на двух чашках имеет место рост расплывчатых колоний, не распространяющийся на всю поверхность чашки, или выросло более 300 колоний и анализ нельзя повторить, подсчитывают сектор чашки с последующим пересчетом на всю поверхность. В этих случаях в протоколе отмечают «число КОЕ/мл — ориентировочно».
Если подсчет колоний на чашках невозможен, то в протоколе отмечают «сплошной рост».
8.2. Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод)
8.2.1. Определение понятия показателя
Общие колиформные бактерии (ОКБ) — грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37 + 1) °С в течение (24 — 48) ч.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44 ± 0,5) °С в течение 24 ч.
Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциальной питательной среде с лактозой и последующей идентификации колоний по культуральным и биохимическим свойствам.
8.2.3.1. Порядок исследования
При исследовании питьевой воды анализируют 3 объема по 100 мл.
При получении стабильных отрицательных результатов допустима фильтрация 300 мл воды через один фильтр.
При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 мл воды).
Отмеренный объем воды фильтруют через мембранные фильтры с соблюдением требований, изложенных в п. 7.
Фильтры помещают на среду Эндо, приготовленную по п. 5.4. Чашки с фильтрами ставят в термостат дном вверх и инкубируют посевы при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Если на фильтрах нет роста или выросли колонии пленчатые, губчатые, плесневые, прозрачные, расплывчатые, выдают отрицательный ответ: отсутствие ОКБ и ТКБ в 100 мл исследуемой воды. Анализ заканчивают через 24 ч.
Если на фильтрах обнаружен рост изолированных типичных лактозоположительных колоний: темно-красных, красных с металлическим блеском или без него или других подобного типа колоний с отпечатком на обратной стороне фильтра, подсчитывают число колоний каждого типа отдельно и приступают к подтверждению их принадлежности к ОКБ и ТКБ.
Для подтверждения наличия ОКБ исследуют:
· все колонии, если на фильтрах выросло менее 5 колоний;
· не менее 3 — 4 колоний каждого типа.
Для подтверждения наличия ТКБ исследуют все типичные колонии, но не более 10.
Каждую выбранную изолированную колонию исследуют на:
· наличие оксидазной активности;
· принадлежность к Граму (микроскопия окрашенного по Граму препарата или постановка теста Грегерсена);
· ферментацию лактозы до кислоты и газа.
8 2.3 2. Постановка оксидазного теста
Полоску фильтровальной бумаги помещают в чистую чашку Петри и смачивают 2 — 3 каплями реактива для оксидазного теста по п. 5.7. Готовые бумажные системы смачивают дистиллированной водой. Часть изолированной колонии стеклянной палочкой или платиновой петлей (металлическая петля из нихрома может дать ложноположительную реакцию) наносят штрихом на подготовленную фильтровальную бумагу. Реакция считается положительной, если в течение 1 мин появляется фиолетово-коричневое ( п. 5.7.1 вариант 1) или синее ( п. 5.7.2 вариант 2 и СИБ-оксидаза) окрашивание штриха. При отрицательной реакции цвет в месте нанесения культуры не меняется. При положительном результате эту колонию из дальнейшего исследования исключают.
Если при исследовании колоний, окрашенных в темно-красный цвет, получают недостаточно четкий результат, необходимо пересеять культуру со среды Эндо на питательный агар. После инкубации тест повторяют.
8.2.3.3. Определение принадлежности к Граму
Из оксидазоотрицательной колонии делается мазок, окрашивается по Граму и микроскопируется.
На обезжиренное спиртом предметное стекло наносят петлей 1 каплю дистиллированной воды, вносят небольшое количество культуры из анализируемой колонии и распределяют по поверхности стекла. Мазок высушивают при комнатной температуре и фиксируют трехкратным проведением через пламя горелки. На препарат накладывают полоску фильтровальной бумаги и на нее наливают карболовый раствор генциана фиолетового на (0,5 — 1) мин, снимают бумагу, наливают раствор Люголя на (0,5 — 1) мин, сливают раствор Люголя и стекло промывают в этиловом спирте в течение (0,5 — 1) мин, пока не перестанет отходить краситель. Затем стекло тщательно промывают водой и докрашивают в течение (1 — 2) мин фуксином Циля, разведенным 1:10 дистиллированной водой. После промывания и просушивания препарата мазок микроскопируют.
Приготовление реактивов для окраски по Граму изложено в п. 5.9.
Грамотрицательные микроорганизмы имеют розовую окраску, грамположительные окрашиваются в синий цвет. Колиформные бактерии являются грамотрицательными палочками.
Окраска по Граму может быть заменена тестом Грегерсена, не требующим использования оптики.
Тест Грегерсена: в капле 3 %-ного водного раствора КОН на предметном стекле эмульгируют бактерийную массу, взятую с плотной среды. После нескольких секунд перемешивания петлей взвесь ослизняется и за петлей тянутся слизистые нити, что указывает на принадлежность испытуемой культуры или колонии к грамотрицательному виду. У грамположительных бактерий слизистые нити не образуются — реакция отрицательная.
8.2.3.4. Определение ферментации лактозы
Оставшуюся часть оксидазоотрицательной грамотрицательной изолированной колонии засевают параллельно в две пробирки с лактозной средой ( п. 5.6):
· для подтверждения наличия ОКБ посев инкубируют при температуре (37 ± 1) °С в течение 48 ч;
· для подтверждения наличия ТКБ посев осуществляют в среду, предварительно прогретую до температуры (43 — 44) °С, и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч.
Первичный учет образования кислоты и газа на подтверждающих полужидких средах и СИБ ( п. 5.6) возможен через (4 — 6) ч. При обнаружении кислоты и газа дают положительный ответ. При отсутствии кислоты и газа или при наличии только кислоты пробирки с посевами для окончательного учета ТКБ оставляют до 24 ч. Пробирки с посевами для подтверждения наличия ОКБ после просмотра через 24 ч и получения отрицательного результата оставляют для окончательного учета до 48 ч.
Если колония, подлежащая исследованию, незначительных размеров, ее пересевают на скошенный питательный агар и после инкубации в течение (18 — 24) ч выполняют все необходимые подтверждающие тесты.
8.2.3.5. Постановка подтверждающих тестов при наложении колоний или сплошном росте
Если на части или на всей поверхности фильтра наблюдается наложение колоний или сплошной рост, выполняют оксидазный тест путем помещения мембранного фильтра на кружок фильтровальной бумаги большего диаметра, чем фильтр, обильно смоченный реактивом, или на диск СИБ-оксидаза, смоченный дистиллированной водой. При появлении первых признаков реакции, но не более чем через 5 мин, мембранный фильтр переносят обратно на среду Эндо. После четкого проявления реакции определяют результат. При появлении фиолетово-коричневого или синего окрашивания (в зависимости от примененного реактива) оксидазный тест считают положительным.
Если на фильтрах все колонии оксидазоположительные, они не учитываются и выдают ответ об отсутствии ОКБ и ТКБ и завершают анализ.
При отрицательной оксидазной реакции проводят рассев до получения изолированных колоний и подтверждают их принадлежность к ОКБ и ТКБ по п. п. 8.2.3.3 — 8.2.3.4 (анализ качественный).
8.2.4.1. Грамотрицательные колонии учитываются как ОКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 37 °С с образованием кислоты и газа.
Грамотрицательные колонии учитываются как ТКБ при отрицательном оксидазном тесте и ферментации лактозы при температуре 44 °С с образованием кислоты и газа.
8.2.4.2. При отсутствии общих и термотолерантных колиформных бактерий на всех фильтрах результат записывают «не обнаружено КОЕ ОКБ в 100 мл» и «не обнаружено КОЕ ТКБ в 100 мл».
8.2.4.3. В случае идентификации всех выросших подозрительных колоний число колониеобразующих единиц ОКБ и ТКБ подсчитывают на всех фильтрах и выражают результат анализа КОЕ в 100 мл воды.
Вычисление проводят по формуле:
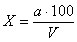
Х — число колоний в 100 мл;
V — профильтрованный объем воды через фильтры, на которых велся учет;
а — число подсчитанных на этих фильтрах колоний в сумме.
1. При посеве 3 фильтров по 100 мл выросло две колонии в 100 мл, на остальных двух фильтрах нет роста. Число общих или термотолерантных колиформных бактерий будет:
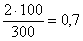
2. При посеве 10, 40, 100 и 150 мл на фильтрах с профильтрованным объемом 40 мл выросло 4 изолированные колонии, с профильтрованным объемом 100 — 3 ОКБ. Фильтры с объемами 10 мл и 150 мл заросли и учету не подлежат. Суммируют общее число колоний ОКБ (ТКБ) на тех фильтрах, где получены изолированные колонии, и пересчитывают на объем 100 мл.
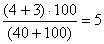
8.2.4.4. Если при выборочной проверке колоний одного типа получены неодинаковые результаты, то вычисляют числа ОКБ или ТКБ среди колоний этого типа по формуле:
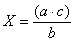
Х — число подтвержденных бактерий одного типа;
а — общее число колоний этого типа;
b — число проверенных из них;
с — число колоний с положительным результатом.
Полученные результаты учета по каждому типу колоний суммируют и далее подсчитывают по п. 8.2.4.3 — 8.2.4.4.
8.2.4.5. Окончательный результат выдают: количество КОЕ ОКБ в 100 мл, из них количество КОЕ ТКБ в 100 мл.
Ориентировочный результат может быть выдан при обнаружении типичных колиформных колоний на среде Эндо, образованных грамотрицательными оксидазоотрицательными бактериями. Окончательный ответ подтверждается по результатам ферментации лактозы.
8.2.4.6. При наложении колоний или сплошном росте на всех фильтрах ( п. 8.2.3.5) в случае подтверждения принадлежности к ОКБ и ТКБ выдается качественный результат «обнаружено ОКБ в 100 мл».
Если все колонии на фильтре оксидазоположительные или не подтвердилась их принадлежность к ОКБ и ТКБ, анализ завершается, в протоколе отмечают «зарост фильтров».
В обоих случаях анализ повторяют.
8.3.1. Определение понятия показателя
Определение понятия показателей ОКБ и ТКБ по п. 8.2.1.
Титрационный метод может быть использован:
· при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации;
· при анализе воды с большим содержанием взвешенных веществ;
· в случае преобладания в воде посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний общих колиформных бактерий.
Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциальную плотную питательную среду с лактозой и идентификации колоний по культуральным и биохимическим тестам.
При исследовании питьевой воды качественным методом (текущий санэпиднадзор, производственный контроль) засевают 3 объема по 100 мл.
При исследованиях воды с целью количественного определения ОКБ и ТКБ при повторном анализе производят посев: 3 объемов по 100 мл, 3 объемов по 10 мл, 3 объемов по 1 мл.
Каждый объем исследуемой воды засевают в лактозо-пептонную среду, приготовленную по п. 5.5. Посев 100 мл и 10 мл воды производят в 10 и 1 мл концентрированной лактозо-пептонной среды, посев 1 мл пробы проводят в 10 мл среды обычной концентрации.
Посевы инкубируют при (37 ± 1) °С в течение 48 ч. Не ранее 24 час инкубации проводят предварительную оценку посевов. Из емкостей, где отмечено наличие роста (помутнение) и образование газа, производят высев бактериологической петлей на сектора среды Эндо ( п. 5.4.1) для получения изолированных колоний.
Емкости без наличия роста и образования газа оставляют в термостате и окончательно просматривают через 48 ч. Посевы без признаков роста считают отрицательными и дальнейшему исследованию они не подлежат. Из емкостей, где отмечено помутнение и образование газа или только помутнение, делают высев на сектора среды Эндо.
Посевы на среде Эндо инкубируют при температуре (37 ± 1) °С в течение (18 — 20) ч.
При образовании помутнения и газа в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий: темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде, дают положительный ответ на присутствие общих колиформных бактерий в данном объеме пробы.
Наличие ОКБ требуется подтвердить:
· если в среде накопления отмечено только помутнение;
· если принадлежность к лактозоположительным колониям вызывает сомнение у исследователя.
· проверяют наличие отпечатка на среде Эндо после снятия петлей подозрительной колонии;
· выполняют оксидазный тест по п. 8.2.3.2;
· подтверждают принадлежность к Граму по п. 8.2.3.3;
· подтверждают способность к газообразованию при посеве изолированных 1 — 2 колоний каждого типа с каждого сектора на среду с лактозой по п. 5.6 с последующей инкубацией посевов при температуре (37 ± 1) °С в течение (24 — 48) ч.
При отсутствии изолированных колоний проводят рассев на среду Эндо общепринятыми бактериологическими методами.
Отрицательный ответ дают, если:
· в среде накопления нет признаков роста;
· на секторах среды Эндо нет роста;
· на секторах среды Эндо выросли не характерные для колиформных бактерий колонии (прозрачные с неровными краями, расплывчатые и т.п.);
· все колонии оказались оксидазоположительными;
· все колонии оказались грамположительными;
· если в подтверждающем тесте на среде с углеводом не отмечено газообразования.
Для определения термотолерантных колиформных бактерий работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии. Делают посев 2 — 3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред, приготовленных по п. 5.6.
Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре (44 ± 0,5) °С в течение 24 ч. Допускается просмотр посевов через (4 — 6) ч.
При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
Допустимо для ускорения выдачи ответа на присутствие ТКБ производить высев 1 мл из объемов среды накопления, где отмечено помутнение и газообразование в пробирке с лактозо-пептонной средой с поплавком по п. 5.6 и прогретой предварительно до температуры 44 °С. Посевы выдерживают в термостате при температуре (44 ± 0,5) °С в течение 24 ч. При обнаружении кислоты и газа дают положительный ответ.
При исследовании 3 объемов по 100 мл результаты оцениваются качественно и при обнаружении ОКБ и ТКБ хотя бы в одном из 3 объемов, делается запись в протоколе «обнаружены в 100 мл».
При исследовании количественным методом определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ по табл. 1.1 приложения 1.
Результат сообщают без доверительного интервала.
При отрицательном ответе на наличие ОКБ и ТКБ во всех исследованных объемах выдают заключение в протоколе «не обнаружены в 100 мл».
8.4.1. Определение понятия показателя
Сулъфитредуцирующие клостридии — спорообразующие анаэробные палочковидные микроорганизмы, редуцирующие сульфит натрия на железо-сульфитном агаре при температуре (44 ± 1) °С в течение (16 — 18) ч.
Метод основан на выращивании посевов в железо-сульфитном агаре в условиях, приближенных к анаэробным, и подсчете числа черных колоний.
8.4.3.1. Пробу воды 20 мл прогревают на водяной бане в пробирках при температуре (75 ± 5) °С в течение 15 мин для исключения вегетативных форм.
При исследовании хлорированной воды прогревание пробы можно не производить.
Из каждой пробы питьевой воды делают посев или фильтруют 20 мл. При необходимости подбирают объемы с таким расчетом, чтобы в посевах (на фильтрах) выросло не более 10 — 15 колоний. При этом ориентируются на результаты предыдущих исследований.
Фильтрование воды производят в соответствии с требованиями, изложенными в п. 7.
8.4.3.2. Определение методом фильтрования в пробирках
Перед посевом пробирки с железо-сульфитным агаром, приготовленным по п. 5.8, расплавляют на водяной бане (не кипятить!). В течение посева поддерживают среду нагретой до (70 — 80) °С в водяной бане.
После фильтрования установленного объема воды мембранный фильтр фламбированным пинцетом берут за два противоположных края и согнутый в виде трубочки помещают в пробирку с горячим агаром. Сторона фильтра с осевшими бактериями обращена внутрь. При этом фильтр распрямляется и располагается по стенке пробирки.
Сразу же после посева пробирку с агаром и фильтром для создания анаэробных условий быстро охлаждают, помещая в емкость с холодной водой. Культивируют посевы при (44 ± 1) °С в течение (16 — 18) ч.
8.4.3.3. Определение методом фильтрования в чашках Петри
Чашки Петри диаметром (55 — 60) мм заливают тонким слоем железо-сульфитного агара. После фильтрации фильтр поместить фильтрующей поверхностью вниз на застывшую питательную среду так, чтобы под фильтром не было пузырьков воздуха. Затем заливают расплавленным железо-сульфитным агаром до верхнего края чашки, чтобы крышка плотно прилегала к среде для создания анаэробных условий. Культивируют посевы при (44 ± 1) °С в течение (16 — 18) ч.
8.4.3.4. Определение прямым посевом
Железо-сульфитный агар во флаконах и пробу воды готовят, как это описано в п. 8.4.3.1.
В стерильные пробирки вносят:
· по 10 мл в 2 пробирки (объемом не менее 30 мл) или
· по 5 мл в 4 пробирки (объемом по 15 мл).
Посевы заливают горячим железо-сульфитным агаром в количестве, превышающем объем воды в 2 раза. Среду заливать по стенке пробирки, избегая образования пузырьков воздуха. После этого пробирку быстро охлаждают, помещая ее в емкость с холодной водой для создания анаэробных условий. Посевы инкубируют при (44 ± 1) °С в течение (16 — 18) ч.
Количественному учету подлежат только те посевы, где получены изолированные колонии. Подсчитывают черные колонии, выросшие как на фильтрах, так и в толще питательной среды.
Результат анализа выражают числом колониеобразующих единиц (КОЕ) спор сульфитредуцирующих клостридий в 20 мл воды.
При отсутствии роста черных колоний на всех фильтрах дают ответ «не обнаружено в 20 мл воды».
При невозможности учета колоний из-за сливного роста результат оценивается как качественный, в протоколе отмечают «обнаружено в 20 мл». При необходимости получения количественного результата анализ повторяют.
8.5.1. Определение понятия показателя
Колифаги — бактериальные вирусы, способные лизировать E. coli и формировать при температуре (37 ± 1) °С через (18 ± 2) ч зоны лизиса бактериального газона (бляшки) на питательном агаре.
8.5.2. Титрационный метод определения колифагов
Определение колифагов в питьевой воде заключается в предварительном накоплении колифагов в среде обогащения на культуре E. coli и последующем выявлении зон лизиса (просветления) газона E. coli на питательном агаре.
Метод предназначен для проведения текущего контроля качества питьевой воды.
8.5.2.3. Подготовка тест-культуры E. coli К12 Str R .
На всех этапах исследования используют бактериальную взвесь, приготовленную следующим образом: культуру E. coli засевают в пробирку со скошенным питательным агаром со стрептомицином ( п. 5.3.5). Через (18 ± 2) ч инкубации при температуре (37 ± 1) °С произвести смыв бактерий с косяка 5 мл стерильного физиологического раствора (0,85 %-ный раствор NaCl ) и по стандарту мутности готовят взвесь E. coli в концентрации 10 9 бактериальных клеток в 1 мл.
Допускается использование 4-часовой бульонной культуры E. coli, полученной путем подращивания в термостате при температуре 37 °С. Концентрация 10 9 бактериальных клеток E. coli содержится в 2 мл.
8.5.2.4. Проведение качественного анализа
В исследуемую пробу воды объемом 100 мл вносят 10 мл 10-кратного питательного бульона (приготовленного по п. 5.2.2) и 1 мл подготовленного смыва тест-культуры или 2 мл 4-часовой бульонной культуры ( п. 8.5.2.3).
Для контроля культуры 0,1 мл смыва бактерий Е. c oli (или 0,2 мл 4-часовой бульонной культуры) помещают в чашку Петри и заливают питательным агаром.
Исследуемую пробу воды (100 мл) и чашку Петри с контролем E. coli помещают в термостат и инкубируют при температуре (37 ± 1) °С в течение (18 ± 2) ч.
После инкубации из исследуемой пробы воды отливают в пробирку 10 мл и добавляют 1 мл хлороформа.
Пробирку закрывают стерильной резиновой или силиконовой пробкой, энергично встряхивают для равномерного распределения хлороформа по объему пробы и оставляют при комнатной температуре не менее 15 мин до полного осаждения хлороформа.
В предварительно расплавленный и остуженный до (45 — 49) °С питательный агар добавляют приготовленный смыв бактерий E. coli ( п. 8.5.2.3) из расчета 1,0 мл смыва (или 2 мл 4-часовой бульонной культуры) на 100 мл агара.
В стерильную чашку Петри пипеткой из пробирки переносят 1 мл обработанной хлороформом пробы (не касаясь хлороформа) и заливают смесью расплавленного и остуженного до (45 — 49) °С питательного агара объемом (12 — 15) мл, а также одну дополнительную чашку Петри для контроля культуры E. coli и осторожно покачивают для равномерного перемешивания пробы воды и агара. Для полного застывания чашки оставляют на столе при комнатной температуре на 10 мин. После застывания чашки переворачивают и помещают в термостат на (18 ± 2) ч при 37 °С.
При выполнении серии проб ставится общий контроль для всей серии.
Просмотр посевов осуществляют в проходящем свете.
Проба считается положительной при наличии полного лизиса, просветления нескольких бляшек, одной бляшки на чашке с пробой воды при отсутствии зон лизиса на контрольной чашке.
В протоколе анализа отмечается: колифаги обнаружены или не обнаружены в 100 мл воды (результат качественный).
При наличии зон лизиса в контроле культуры результат считается недействительным.
8.5.2.5. Проведение количественного анализа
Исследуемую пробу воды в количестве 100 мл разлить на 6 объемов: 1 флакон 50 мл и 5 пробирок по 10 мл. В 50 мл пробы добавить 5 мл десятикратного питательного бульона (по п. 5.2.2) и 0,5 мл смыва (или 1 мл 4-часовой бульонной культуры) бактерий E. coli ( п. 8.5.2.3). В каждые 10 мл пробы внести по 1 мл десятикратного питательного бульона и 0,1 мл смыва (или 0,2 мл 4-часовой бульонной культуры) бактерий E. coli.
Для контроля культуры 0,1 мл смыва бактерий (или 0,2 мл 4-часовой бульонной культуры) E. coli помещают в чашку Петри и заливают питательным агаром.
Посевы инкубируют при температуре (37 ± 1) °С в течение 18 ± 2 ч.
После инкубации из объема 50 мл отлить в пробирку 10 мл. Во все исследуемые 6 объемов добавить по 1 мл хлороформа. Пробирки закрыть стерильными резиновыми или силиконовыми пробками, энергично встряхнуть для равномерного распределения хлороформа по объему пробы и оставить при комнатной температуре не менее 15 мин для осаждения хлороформа.
В предварительно расплавленный и остуженный до (45 — 49) °С питательный агар добавить приготовленный смыв бактерий E. coli ( п. 8.5.2.3) из расчета 1,0 мл смыва (или 2 мл 4-часовой бульонной культуры) на 100 мл агара. Приготовленную смесь разлить в чашки Петри: 1 чашку для контроля культуры E. coli на лизогенность и по одной чашке на каждую исследуемую пробу воды. При одновременном анализе нескольких проб воды ставится один контроль культуры E. coli.
После застывания агара чашки, предназначенные для посева проб, разделить на 6 секторов, промаркировать их в соответствии с исследуемыми объемами. На каждый сектор из соответствующей пробирки нанести пастеровской пипеткой (микропипеткой или бактериологической петлей продольным штрихом) по 1 капле надосадочной жидкости (без хлороформа).
После подсыхания капель чашки с исследуемыми пробами и контрольную чашку поместить в термостат при (37 ± 1) °С на (18 ± 2) ч.
Просмотр результатов осуществляется в проходящем свете.
Учет проводится по наличию зон просветления (лизиса) на секторах газона E. coli.
При применении капельного способа посева пипеткой образуется зона лизиса в виде округлого пятна или отдельных бляшек. При посеве продольным штрихом бактериологической петлей отмечается лизис по ходу штриха.
Проба считается положительной при наличии зоны лизиса хотя бы на одном секторе при отсутствии зон лизиса на контрольной чашке.
Оценка проводится по таблице наиболее вероятного числа (НВЧ) бляшкообразующих единиц (БОЕ) (табл. 1.2). В протоколе анализа указывается наиболее вероятное количество колифагов в 100 мл воды и диапазон возможных колебаний: НВЧ БОЕ (нижний предел — верхний предел) колифагов в 100 мл. Результат полуколичественный.
При наличии зон лизиса в контрольной чашке результат считать недействительным.
8.5.3. Прямой метод определения колифагов
Определение колифагов в питьевой воде заключается в исследовании нормируемого объема воды (100 мл) путем его прямого посева и последующего учета зон лизиса (бляшек) на газоне E. coli в чашках Петри с питательным агаром.
Прямой метод выделения колифагов из воды проводят параллельно с титрационным при исследованиях по эпидемическим показаниям.
В питательный агар двойной концентрации ( п. 5.3.2), расплавленный и остуженный до (45 — 49) °С, добавить смыв E. coli ( п. 8.5.2.3) из расчета 2,0 мл смыва (или 4 мл 4-часовой бульонной культуры) на каждые 100 мл агара, перемешать. Исследуемые 100 мл воды разлить по 20 мл в большие пробирки, нагреть до (35 — 44) °С и немедленно (не более чем через 5 мин по достижении требуемой температуры) разлить в 5 чашек Петри и сразу же внести в каждую чашку по 20 мл смеси агара с культурой E. coli.
Для контроля культуры E. coli в одну чашку Петри внести 20 мл стерильной водопроводной воды, предварительно прогретой до (35 — 44) °С, залить 20 мл приготовленного агара с E. coli и осторожно перемешать.
Содержимое чашек осторожно перемешать и оставить при комнатной температуре до застывания. Чашки с застывшим агаром поместить дном вверх в термостат и инкубировать при температуре (37 ± 1) °С в течение (18 ± 2) ч.
Просмотр посевов осуществляется в проходящем свете.
Учет результатов проводят путем подсчета и суммирования бляшек, выросших на 5 чашках Петри. Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 мл пробы воды. В контрольной чашке бляшки должны отсутствовать.
Наиболее часто зоны лизиса выглядят прозрачными пятнами на фоне газона тест-культуры питательного агара в виде круглых изолированных бляшек (от 1 до 5 — 7) мм в диаметре с четко выраженными либо стертыми границами.
При высоких концентрациях фага наблюдается разная картина лизиса.
Слияние негативных колоний дает «ажурный» газон E. coli, рост единичных колоний E. coli на фоне сплошного лизиса, либо полное отсутствие роста на чашке.
При прямом посеве возможен лизис, маскируемый негомогенно застывшим агаром, а также закрытый сопутствующей микрофлорой. Капли конденсата и негомогенно застывший при прямом посеве агар могут приводить к образованию артефактов на газоне E. coli, визуально напоминающих лизис.
Предварительный учет результатов можно проводить через (5 — 6) ч инкубации. На этом этапе при наличии четких зон лизиса может быть выдан предварительный ответ о присутствии колифагов в воде.
Окончательный количественный учет прямого посева проводится через (18 ± 2) ч. Результаты выражают количеством бляшкообразующих единиц (БОЕ) на 100 мл пробы воды.
Если отмечен сливной рост бляшек и счет затруднителен, то по данным прямого посева может быть выдан качественный результат: «обнаружено в 100 мл воды».
При получении отрицательного результата при работе прямым методом окончательный ответ выдается по результатам титрационного метода.
При наличии зон лизиса в контрольной чашке результат исследования считается недействительным.
8.5.4.1. Отрицательный контроль
Отрицательный контроль подтверждает отсутствие контаминации фагом питательных сред, лабораторной посуды, оборудования на этапах подготовки и проведения анализа, а также позволяет оценить способность тест-культуры E. coli давать равномерный газон.
Отрицательным контролем служит исследование стерильной водопроводной воды, проводимое аналогично анализируемой пробе воды. Так, при анализе воды титрационным методом 10 мл стерильной водопроводной воды вносят в дополнительную пробирку. При анализе воды прямым посевом в дополнительную шестую чашку Петри вносят 20 мл стерильной водопроводной воды.
Дополнительные посевы исследуются на колифаги аналогично основным пробам.
При анализе серии проб отрицательный контроль может быть один на каждый вид анализа: титрационный и прямой. В этом случае постановка отрицательного контроля поэтапно осуществляется после обработки всех проб данной серии.
В случае обнаружения бляшек колифагов в чашках с отрицательным контролем результаты исследования всей серии проб воды недействительны.
Следует проверить стерильность лабораторного оборудования, посуды, питательных сред, а также повторить контрольный посев на чистоту тест-штамма E. coli К12 F + Str R .
Кратность проведения отрицательного контроля — 1 раз в день.
8.5.4.2. Методика подтверждения фаговой природы лизиса
В сомнительных случаях при работе как титрационным, так и прямым методами необходимо провести контрольный посев на подтверждение фаговой природы лизиса.
С этой целью бактериологической петлей извлекают участок агара, подозрительный на колифаги, помещают его в 5 мл питательного бульона, куда добавляют каплю тест-культуры E. coli и инкубируют при 37 °С в течение (16 — 18) ч. Полученную культуру обрабатывают хлороформом и исследуют на наличие фага. Высев осуществляют петлей или пипеткой на сектора питательного агара аналогично способу, описанному в п. 8.5.2.5. Лизис на любом из секторов расценивается как подтверждение наличия фага.
Таблицы расчета наиболее вероятного числа микроорганизмов
Расчет наиболее вероятного числа бактерий в 100 мл питьевой воды
источник


