Если больше знать об основных и дополнительных параметрах вредных загрязнений, то будет проще принимать правильные решения при формировании очистных установок бытового и промышленного назначения. Оставим вопросы конструирования коммерческих систем специалистам. Изучим подробнее, какую опасность представляют нитриты и нитраты в воде, предназначенной для домашнего использования.
Нитраты – это ионы с одним зарядом (NO3), соли азотной кислоты. Ранее было распространено известное многим специалистам и работникам сельского хозяйства название «селитра». Это вещество является эффективным и сравнительно недорогим удобрением, поэтому широко используется и в наши дни, несмотря на потенциальную опасность для здоровья человека.
Если применять его в строго ограниченных нормативами дозах, то вреда не будет. Приведем несколько современных характеристик:
- интенсификация производственных процессов в соответствующей отрасли;
- снижение общего уровня контроля;
- экономические факторы, оказывающие влияние на снижение расходов.
Все перечисленное способствует повышению концентрации данных веществ в некоторых случаях намного выше предельно допустимого уровня.
Непосредственную угрозу для жизни человека и животных представляют собой нитриты. Они образуются естественным путем в желудочно-кишечном тракте, либо поступают в организм вместе с пищей. Там они вступают в реакцию с гемоглобином, переносящим кислород ко всем тканям. Он преобразуется в метгемоглобин и утрачивает данное полезное свойство.
Особенно опасны подобные процессы для детей. Только у взрослых людей эритроциты обретают способность (в ограниченных объемах) производить обратную операцию. У ребенка, не имеющего подобных механизмов защиты, поступление необходимого органам кислорода будет блокировано, что способно привести к возникновению различных заболеваний и даже к летальному исходу.
Перечислим иные вредные факторы и особенности, которые следует учитывать при создании системы очистки:
- Нитриты и нитраты в питьевой воде способны вызывать различные раздражения, неприятные и опасные аллергические реакции;
- Эти примеси оказывают угнетающее влияние на работу щитовидной железы;
- Они нарушают нормальное функционирование нервной системы;
- Нитраты создают благотворную среду в желудке для жизнедеятельности вредных микроорганизмов. Эта патогенная микрофлора при развитии продуцирует яды, отравляющие организм;
- Нитриты препятствуют нормальному обмену веществ!
Особенно опасной является способность этих вредных соединений накапливаться в организме. Губительные изменения способны происходить незаметно. Если не принять соответствующих профилактических мер, то последующее лечение будет сопряжено с повышенными проблемами и крупными затратами.
Прежде чем ответить на основной вопрос данного раздела приведем действующие нормы:
- Нитраты (класс опасности – 3). Их содержание в миллиграммах на один дм. куб. воды не должно превышать более 45 единиц (СанПин), или 50 ед. по правилам Евросоюза;
- Нитриты регламентируются строже, так как класс опасности (2) в данном случае выше. По аналогу с предыдущим пунктом, содержание таких примесей недолжно превышать следующие значения:
- СанПин – 3,0 мг. на дм. куб.;
- Директивы Евросоюза – 0,5 мг. на дм. куб.
Каждый человек вправе самостоятельно выбрать устраивающие его нормативы, но, с учетом вредной способности нитратов к постепенному накоплению, лучше использовать минимально возможные значения.
Данные химические соединения используются в питьевой воде не только в качестве удобрений, которые поступают вместе с овощами и фруктами в организм. Эти же загрязнения хорошо растворяются, не задерживаются полноценно песочными и другими природными системами очистки питьевой воды, поэтому в больших концентрациях могут содержаться в колодцах.
Нитраты в питьевой воде способны подавлять жизнедеятельность некоторых видов болезнетворных микроорганизмов. Также они могут улучшить внешний вид колбас, сосисок, иных изделий, изготовленных из мяса. Таким образом, можно констатировать, что нитраты используются часто при изготовлении пищевой продукции.
Чтобы предотвратить употребление пищи с повышенным содержанием вредных примесей, можно использовать соответствующие специализированные одноразовые химические тестеры, либо особые приборы, нитратомеры.
Электронные аппараты удобнее. Современные модели обладают небольшим собственным весом и малыми размерами. Их можно носить с собой в дамской сумочке, нагрудном кармане рубашки. Элементы управления и отображения информации приспособлены под потребности рядового пользователя. Они просты, исключают произведение неправильных действий. Общее время теста составляет несколько секунд, а погрешность измерений невелика.
К сожалению, приходится утверждать, что большое количество вредных веществ поступают в воду из скважины и влияют на человека иным путем. Нитриты и нитраты в воде из скважины, особенно за городом, где нет коммунальных очистных сооружений, присутствуют в повышенных концентрациях. Их содержание велико не только в колодцах, но даже в глубоких скважинах. При паводках, сильных ливнях, в иных подобных случаях опасные соединения из удобрений проникают в грунтовые воды особо интенсивно. Чтобы исключить риски следует подбирать оборудование для очистки воды от нитратов и нитритов с учетом данных факторов.
Так как нитраты в воде из скважины присутствуют в виде ионов, то их задержание можно произвести с использованием следующего оборудования. В его составе есть особая гранулированная засыпка. Она подбирается в соответствии с наличием определенного вида загрязнений. Такая смола способна впитать в себя вредные анионы с одновременным насыщением проходящей через нее жидкости соединениями натрия.
Как только уровень насыщенности засыпки достигнет предельного значения, надо будет произвести промывку гранул, а также обратное действие – заполнение их безвредными ионами. Если этого не сделать вовремя, то в воду может произойти неконтролируемый выброс опасных загрязнений.
Подобные ошибки надо исключить точно, поэтому добротное оборудование данного класса комплектуется специальным блоком. Электроника и программное обеспечение настраиваются нужным образом. Допустимо установить необходимый интервал времени, либо использовать для регенерации наполнителя и его промывки определенный объем обработанной жидкости.
Чтобы такие рабочие процессы происходили без прерывания работы водопровода, рекомендуется устанавливать два бака с ионообменными смолами. Их поочередное включение повысит уровень комфорта и снизит нагрузку на систему очистки.
Приведенный пример содержит много сложностей и ограничений. Такой набор оборудования для очистки воды из артезианской скважины с высокой производительностью будет стоить дорого, но в действительности чаще всего надо очищать только воду для питья и ту, которая предназначена для приготовления пищи.
Данная задача решается с помощью установок обратного осмоса. В них основную функцию выполняет полунепроницаемая мембрана. Она пропускает только небольшие по размерам молекулы воды. Нитраты и нитриты задерживаются в объеме перед этой преградой и смываются в дренаж автоматически. Подобные установки очистки воды от нитратов и нитритов не надо настраивать и регулировать. Но чтобы они работали полноценно, следует вовремя, 1-2 раза в год , менять картриджи. Современные мембраны рассчитаны на долгосрочную эксплуатацию. Если они используются по назначению, не в экстремальных условиях, то новое аналогичное изделие для удаления нитратов и нитритов из воды скважины придется приобрести только через несколько лет.
источник
Нитриты — промежуточная ступень в цепи бактериальных процессов окисления аммония до нитратов или, напротив, восстановления нитратов до азота и аммиака. Подобные окислительно-восстановительные реакции характерны для станций аэрации, систем водоснабжения и природных вод. Наибольшие концентрации нитритов в воде наблюдается летом, что связано с деятельностью некоторых микроорганизмов и водорослей.
Анализ воды на нитриты делается для вод поверхностных и приповерхностных водотоков. Проверять содержание нитритов в воде особенно важно при анализе воды из колодцев и родников.
Нитриты могут применяться в промышленности как консерванты и ингибиторы коррозии. Из сточных вод они могут попадать в открытые водотоки.
Повышенное содержание нитритов указывает на усиление процессов разложения органических веществ в условиях медленного окисления NO2- в NO3-, это указывает на загрязнение водоема. Содержание нитритов является важным санитарным показателем.
ПДК нитритов в воде согласно СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 3 мг/дм 3 . Нитриты значительно опаснее нитратов, поэтому их содержание в воде контролируется более строго (ПДК нитратов 45 мг/дм 3 )
Кислородсодержащие неорганические соединения азота в настоящее время привлекают к себе особое внимание. Это связано с тем, что увеличение применения азотистых веществ в промышленности и сельском хозяйстве привело к возрастанию уровня кислородсодержащих соединений азота в почве в виде нитратов, нитритов и солей аммония, что стало причиной ряда заболеваний среди людей и животных.
В воде подземных источников встречаются нитриты и нитраты почвенного происхождения. Особенно это касается источников нецентрализованного водоснабжения, например шахтных колодцев. Нитриты более токсичны, чем нитраты, но в обычных условиях нитриты очень нестойкие вещества: окисляясь, они быстро переходят в нитраты. В хлорированной питьевой воде содержание нитритов часто ниже пределов обнаружения. Нитраты, как более устойчивые соединения имеют гигиенический норматив в питьевой воде на уровне 45 мг/л.
Нитриты и нитраты могут поступать в организм, как с водой, так и с продуктами питания, в основном растительного происхождения, в которых они депонируются. Воздействие данных соединений на организм проявляется в изменении работы сердечно-сосудистой и выделительной систем, а также органов желудочно-кишечного тракта.
В организме нитраты под воздействием кишечной микрофлоры восстанавливаются до нитритов. Нитриты в свою очередь, соединяясь с гемоглобином, образуют стойкое соединение метгемоглобин, в результате резко снижается его способность к транспорту кислорода и наступает гипоксия тканей. Развивается заболевание, именуемое нитратной метгемоглобинемией. У заболевших нитратной метгемоглобинемией наблюдается предшествующие этому состоянию снижение кислотности желудочного сока и развитие диспепсических явлений.
Нитраты могут поступать в водоисточники со сточными водами городов и при смыве азотных удобрений с сельскохозяйственных полей. Нитраты практически не удаляются из воды во время обработки её на водопроводных станциях.
Есть еще одна сторона поведения нитросоединений в организме. Нитраты, как отмечалось выше довольно легко превращаются в нитриты, те в свою очередь, соединяются с поступающими вместе с пищей аминами и амидами. В результате образуются нитрозамины с выраженными канцерогенными свойствами. Этот процесс активно протекает при нормальной кислотности в желудке. Нитразамины оказывают также токсическое действие на печень, а некоторые из них обладают мутагенными и тератогенными свойствами.
Одним из наиболее эффективных способов профилактики неблагоприятного действия нитратов на человека является их гигиеническое регламентирование в воде.
В разводящей сети г. Нижнего Тагила нитраты и нитриты содержатся в минимальных количествах. Однако, выявляется довольно большое количество проб, несоответствующих требованиям санитарных правил по содержанию нитратов6
— из источников нецентрализованного водоснабжения — в первую очередь родники и колодцы,
источник
Окисляемость показывает количество кислорода в миллиграммах, необходимого для окисления органических веществ, содержащихся в 1 дм³ воды.
Воды поверхностных и подземных источников имеют разную окисляемость — у подземных вод величина окисляемости незначительна, за исключением болотных вод и вод нефтяных месторождений. Окисляемость горных рек ниже, чем равнинных. Наибольшая величина окисляемости (до десятков мг/дм³) — у рек с питанием болотными водами.
Величина окисляемости закономерно изменяется в течение года. Окисляемость характеризуется несколькими величинами — перманганатной, бихроматной, йодатной окисляемостью (в зависимости от того, какой окислитель используется).
ПДК окисляемости воды имеют следующие значения: химическое потребление кислорода или бихроматная окисляемость (ХПК) водоемов питьевого назначения не должна превышать 15 мг О₂ /дм³. Для водоемов в зонах рекреации величина ХПК не должна превышать 30 мг О₂ /дм³.
Водородный показатель (pH) природной воды показывает количественное содержание в ней угольной кислоты и ее ионов.
Санитарно-гигиенические нормативы для водоемов разного типа водопользования (питьевого, рыбохозяйственного, рекреационных зон) устанавливают ПДК pH в интервале 6,5-8,5.
Концентрация ионов водорода, выраженная величиной pH — один из важнейших показателей качества воды. Величина pH имеет решающее значение при протекании многочисленных химических и биологических процессов в природной воде. Именно от величины pH зависит, какие растения и организмы будут развиваться в данной воде, каким образом будет происходить миграция элементов, от этой величины также зависит степень коррозионной активности воды на металлические и бетонные конструкции.
От величины pH зависят пути превращения биогенных элементов и степени токсичности загрязняющих веществ.
Жесткость природной воды проявляется вследствие содержания в ней растворенных солей кальция и магния. Суммарное содержание ионов кальция и магния является общей жесткостью. Жесткость можно выражать несколькими единицами измерения, на практике чаще используют величину мг-экв/дм³.
Высокая жесткость ухудшает бытовые характеристики и вкусовые свойства воды, оказывает неблагоприятное воздействие на здоровье человека.
ПДК по жесткости питьевой воды нормируется величиной 10,0 мг-экв/дм³.
К технической воде отопительных систем предъявляют более строгие требования по жесткости их-за вероятности образования накипи в трубопроводах.
Присутствие аммиака в природной воде обусловлено разложением азотсодержащих органических веществ. Если аммиак в воде образуется при разложении органических остатков (фекальное загрязнение), то такая вода непригодна для питьевых нужд. Аммиак определяется в воде по содержанию ионов аммония NH₄⁺.
ПДК аммиака в воде составляет 2,0 мг/дм³.
Нитриты NO₂⁻ являются промежуточным продуктом биологического окисления аммиака до нитратов. Процессы нитрификации возможны только в аэробных условиях, в противном случае природные процессы идут по пути денитрификации — восстановления нитратов до азота и аммиака.
Нитриты в поверхностных водах находятся в виде нитрит-ионов, в кислых водах частично могут быть в форме недиссоциированной азотистой кислоты (HN0₂).
Содержание нитритов в поверхностных водах существенно ниже, чем в водах подземного происхождения. Подземные воды верхних водоносных горизонтов могут содержать нитритов до десятых долей миллиграмма на литр.
ПДК нитритов в воде составляет 3,3 мг/дм³ (по нитрит-иону), или 1 мг/дм³ в пересчете на азот аммонийный. Для водоемов рыбохозяйственного назначения нормы составляют 0,08 мг/дм³ по нитрит-иону или 0,02 мг/дм³ в пересчете на азот.
Нитраты по сравнению с другими азотными соединениями наименее токсичны, однако в значительных концентрациях вызывают вредные последствия для организмов. Основная опасность нитратов — в их способности накапливаться в организме и окисляться там до нитритов и нитрозаминов, которые значительно более токсичны и способны вызывать так называемое вторичное и третичное нитратное отравление.
Накопление больших количеств нитратов в организме способствует развитию метгемоглобинемии. Нитраты вступают в реакцию с гемоглобином крови и образуют метгемоглобин, которые не переносит кислород и, таким образом, вызывает кислородное голодание тканей и органов.
Подпороговая концентрация нитрата аммония, не оказывающая вредных последствий на санитарный режим водоема составляет 10мг/дм³.
Для водоемов рыбохозяйственного назначения повреждающие концентрации нитратов аммония для различных видов рыб начинаются с величин порядка сотен миллиграммов на литр.
ПДК нитратов для питьевой воды составляет 45 мг/дм³ , для рыбохозяйственных водоемов —40 мг/дм³ по нитратам или 9,1 мг/дм³ по азоту.
Хлориды в повышенной концентрации ухудшают вкусовые качества воды, а при высокой концентрации делают воду непригодной для питьевых целей. Для технических и хозяйственных целей содержание хлоридов также строго нормируется. Вода, в которой много хлоридов непригодна для орошения сельскохозяйственных насаждений.
ПДК хлоридов в питьевой воде не должно превышать 350 мг/дм³, в воде рыбохозяйственных водоемов — 300мг/дм³.
Сульфаты в питьевой воде ухудшают ее органолептические показатели, при высоких концентрациях оказывают физиологическое воздействие на организм человека. Сульфаты в медицине используются как слабительное средство, поэтому их содержание в питьевой воде строго нормируется.
Содержание сульфатов в технической воде также подлежит контролю. В присутствии кальция сульфаты образуют накипь, что важно учитывать при подготовке вод, питающих паросиловые установки.
Содержание сульфатов в промышленной и питьевой воде может быть благоприятным или нежелательным фактором.
Сульфат магния определяется в воде на вкус при содержании от 400 до 600 мг/дм³, сульфат кальция — от 250 до 800 мг/дм³.
ПДК сульфатов для питьевой воды — 500 мг/дм³, для вод рыбохозяйственных водоемов —100 мг/дм³.
О влиянии сульфатов на процессы коррозии нет достоверных данных, но отмечается, что при содержании сульфатов в воде свыше 200 мг/дм³ из свинцовых труб вымывается свинец.
Соединения железа поступают в природную воду из природных и антропогенных источников. Значительные количества железа поступают в водоемы вместе со сточными водами металлургических, химических, текстильных и сельскохозяйственных предприятий.
При концентрации железа свыше 2 мг/дм³ ухудшаются органолептические показатели воды— в частности, появляется вяжущий привкус.
Высокое содержание железа делает воду непригодной для питьевых и технических целей.
ПДК железа в питьевой воде 0,3 мг/дм³,при лимитирующем показатели вредности – органолептическом. Для вод рыбохозяйственных водоемов — 0,1 мг/дм³, лимитирующий показатель вредности — токсикологический.
Высокие концентрации фтора наблюдаются в сточных водах стекольных, металлургических и химических производств (при производстве удобрений, стали, алюминия и др.), а также на горнорудных предприятиях.
Содержание фтора в питьевой воде нормируется. Повышенное содержание фтора в питьевой воде вызывает заболевание костной ткани — флюороз. Недостаток фтора тоже опасен. В местностях, где в питьевой воде содержание фторидов понижено – менее 0,01 мг/дм³, у людей чаще развивается кариес зубов.
ПДК по фтору в питьевой воде составляет 1,5 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
Щелочность — показатель, логически противоположный кислотности. Щелочность природных и технических вод – способность содержащихся в них ионов нейтрализовать эквивалентное количество сильных кислот.
Показатели щелочности воды необходимо учитывать при реагентной подготовке воды, в процессах водоснабжения, при дозировании химических реагентов.
Если концентрация щелочноземельных металлов повышена, знание щелочности воды необходимо при определении пригодности воды для систем орошения.
Щелочность воды и показатель pH используются в расчете баланса угольной кислоты и определении концентрации карбонат-ионов.
Поступление кальция в природные воды идет из естественных и антропогенных источников. Большое количество кальция поступает в природные водоемы со стоками металлургических, химических, стекольных и силикатных производств, а также при стоке с поверхности сельхозугодий, где применялись минеральные удобрения.
ПДК кальция в воде рыбохозяйственных водоемов составляет 180 мг/дм³.
Ионы кальция относятся к ионам жесткости, которые образуют прочную накипь в присутствии сульфатов, карбонатов и некоторых других ионов. Поэтому содержание кальция в технических водах, питающих паросиловые установки, строго контролируется.
Количественное содержание в воде ионов кальция необходимо учитывать при исследовании карбонатно-кальциевого равновесия, а также при анализе происхождения и химсостава природных вод.
Алюминий известен как легкий серебристый металл. В природных водах он присутствует в остаточных количествах в виде ионов или нерастворимых солей. Источники попадания алюминия в природные воды — сточные воды металлургических производств, переработки бокситов. В процессах водоподготовки соединения алюминия применяют в качестве коагулянтов.
Растворенные соединения алюминия отличаются высокой токсичностью, способны накапливаться в организме и приводить к тяжелым поражениям нервной системы.
ПДК алюминия в питьевой воде не должна превышать 0,5 мг/дм³.
Магний — один из важнейших биогенных элементов, играющий большую роль в жизнедеятельности живых организмов.
Антропогенные источники поступления магния в природные воды— сточные воды металлургии, текстильной, силикатной промышленности.
ПДК магния в питьевой воде — 40 мг/дм³.
Натрий — щелочной металл и биогенный элемент. В небольших количествах ионы натрия выполняют важные физиологические функции в живом организме, в высоких концентрациях натрий вызывает нарушение работы почек.
В сточных водах натрий поступает в природные воды преимущественно с орошаемых сельхозугодий.
ПДК натрия в питьевой воде составляет 200 мг/дм³.
Элемент марганец содержится в природе в виде минеральных соединений, а для живых организмов является микроэлементом, то есть в малых количествах необходим для их жизнедеятельности.
Значительное поступление марганца в природные водоемы происходит со стоками металлургических и химических предприятий, горно-обогатительных фабрик и шахтных производств.
ПДК ионов марганца в питьевой воде —0,1 мг/дм³, при лимитирующем показателе вредности органолептическом.
Избыточное поступление марганца в организм человека нарушает метаболизм железа, при тяжелых отравлениях возможны серьезные психические расстройства. Марганец способен постепенно накапливаться в тканях организма, вызывая специфические заболевания.
Используемый для обеззараживания воды гипохлорит натрия присутствует в воде в виде хлорноватистой кислоты или иона гипохлорита. Использование хлора для дезинфекции питьевых и сточных вод, несмотря на критику метода, до сих пор широко используется.
Хлорирование также применяется в процессах изготовления бумаги, ваты, для дезинсекции холодильных установок.
В природных водоемах активный хлор присутствовать не должен.
ПДК свободного хлора в питьевой воде 0.3 — 0.5 мг/дм³.
Нефтепродукты — одни из наиболее опасных загрязнителей природных водоемов. Нефтепродукты попадают в природные воды несколькими путями: в результате разливов нефти при авариях нефтеналивных судов; со сточными водами нефтегазовой промышленности; со сточными водами химических, металлургических и других тяжелых производств; с хозяйственно-бытовыми стоками.
Небольшие количества углеводородов образуются в результате биологического разложения живых организмов.
Для санитарно-гигиенического контроля определяются показатели содержания растворенной, эмульгированной и сорбированной нефти, поскольку каждый перечисленный вид по-разному влияет на живые организмы.
Растворенные и эмульгированные нефтепродукты оказывают многообразное неблагоприятное воздействие на растительный и животный мир водоемов, на здоровье человека, на общее физико-химическое состояние биогеоценоза.
ПДК нефтепродуктов для питьевой воды —0,3 мг/дм³, при лимитирующем показатели вредности органолептическом. Для водоемов рыбохозяйственного назначения ПДК нефтепродуктов 0,05 мг/дм³.
Полифосфатные соли используются в процессах водоподготовки для умягчения технической воды, в качестве компонента средств бытовой химии, как катализатор или ингибитор химических реакций, как пищевая добавка.
ПДК полифосфатов для воды хозяйственно-питьевого назначения — 3,5 мг/дм³, при лимитирующем показатели вредности органолептическом.
Кремний – распространенный в земной коре элемент, входит в состав многих минералов. Для организма человека является микроэлементом.
Значительное содержание кремния наблюдается в сточных водах керамических, цементных, стекольных и силикатных производств, при производстве вяжущих материалов.
ПДК кремния в питьевой воде — 10 мг/дм³.
Сульфиды — серосодержащие соединения, соли сероводородной кислоты H₂S. В природных водах содержание сероводорода позволяет судить об органическом загрязнении, поскольку сероводород образуется при гниении белка.
Антропогенные источники сероводорода и сульфидов — хозяйственно-бытовые сточные воды, стоки металлургических, химических и целлюлозных производств.
Высокая концентрация сероводорода придает воде характерный неприятный запах (тухлых яиц) и токсичные свойства, вода становится непригодной для технических и хозяйственно-питьевых целей.
ПДК по сульфидам — в водоемах рыбохозяйственного назначения содержание сероводорода и сульфидов недопустимо.
Химически активный металл, в естественной форме является микроэлементом растительных и животных организмов.
Повышенные поступления стронция в организм изменяют метаболизм кальция в организме. Возможно развитие стронциевого рахита или «уровской болезни», при которой наблюдается задержка роста и искривление суставов.
Радиоактивные изотопы стронция вызывают у человека канцерогенный эффект или лучевую болезнь.
ПДК природного стронция в питьевой воде составляет 7 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
источник
Очистка воды от нитритов может осуществляться несколькими способами, которые отличаются степенью очистки, стоимостью, принципом работы и техническими средствами, используемыми при этом. Нитриты — это соли азотистой кислоты. Они считаются очень вредными элементами, воздействующими на гемоглобин человека и попадают в организм двумя путями — посредством употребления продуктов, в которых они содержатся или же нитратами, которые впоследствии превращаются в организме в нитриты.
Осуществлять водоподготовку и водоочистку от этих вредных элементов желательно после проведения лабораторного анализа исходной воды и в полном соответствии с индивидуальными потребностями и техническими особенностями объекта. Монтаж систем очистки в этих случаях следует доверять специалистам, они определят какое именно оборудование требуется в каждом конкретном случае.
На сегодня самым популярным и распространенным способом очистки воды от нитритов является использование установок, принцип работы которых основывается на ионном обмене. При их работе происходит последовательное фильтрование жидкости, проходящей через водород-катионитный, а затем анионитный фильтры.
Стоит отметить, что при этом осуществляется дополнительная очистка воды от сульфатов. Данный метод очистки очень востребован в энергетической и промышленной отраслях, поскольку показывает высокую степень водоочистки. В зависимости от задач, которые ставятся при выполнении очистки, и требований к полученной воде, процессы очистки выполняются с разными уровнями сложности.
На первом этапе очистка воды от нитритов осуществляется следующим образом. Проходя сквозь водород-катионитный фильтр, катионы, находящиеся в исходной жидкости, заменяются на водород-катионы. После этого в профильтрованной жидкости остается такое же количество анионной кислоты, с которыми ранее были связаны катионы. При такой очистке, в процессе разложения гидрокарбонатов, в воде образуется углекислый газ, который впоследствии удаляется в устройствах — декарбонизаторах.
Второй этап очистки методом ионного обмена осуществляется с применением анионитных фильтров. Стоит отметить, что данные фильтры применяются также в том случае, когда требуется удалить из воды тяжелые металлы. Проходя сквозь анионитные фильтры, образовавшиеся анионы кислоты заменяются ионами ОН, то есть остаются в фильтре. После второго этапа процесс очистки можно считать законченным.
В зависимости от требуемой степени очистки и от количества содержащихся нитритов в воде, возможно применение установок, которые осуществляют одну, две или три ступени очистки. Но в любом случае обязательным является использование водород-катионитов с большим содержанием кислоты. Таким образом, очистка воды от нитритов в промышленных масштабах осуществляется по одноступенчатой, двухступенчатой и трехступенчатой схемах.
Также существует еще один очень эффективный и продуктивный способ очистки от вредных веществ с использованием установок обратного осмоса воды. Очистка воды от нитритов с помощью данных установок имеет много преимуществ перед другими методами. Прежде всего, это простота конструкции самих установок и удобство выполнения очистки, небольшие энергозатраты, легкость эксплуатации системы и небольшие габаритные размеры устройств. Причем такой метод очистки очень удобно применять для обезжелезивания воды.
Установки обратного осмоса используются тогда, когда уровень нитритов в воде находится в пределах 40 г/литр. Сущность данного метода заключается в применении полупроницаемых мембранных перегородок. Во время процесса очистки раствор и растворитель разделяются, поскольку растворитель проходит сквозь мембрану, а раствор нет. Растворитель просачивается сквозь перегородку до тех пор, покуда степень концентрации растворов не уравняется по обе стороны.
Очистка от нитритов посредством применения установок обратного осмоса — это такой процесс, при выполнении которого вещества самопроизвольно перетекают сквозь полупроницаемую мембранную перегородку. В итоге получаем два водных раствора, в которых различная степень концентрации.
источник
Вряд ли найдётся человек, который бы не слышал о вреде нитратов. Мы привыкли думать, что основную опасность в плане содержания нитратов представляют ранние и несезонные овощи и фрукты. Но нитраты в питьевой воде – довольно распространённое явление. Откуда они там берутся, существует ли допустимая норма нитратов в воде и как обезопасить себя – узнаете из нашей статьи.
Для начала давайте выясним – что же такое нитраты и как они могут попасть в воду. Это соли азотной кислоты, которые могут оказывать токсичное воздействие на организм. Нитраты в воде, как правило, являются результатом попадания в источники водоснабжения стоков промышленных предприятий или азотосодержащих удобрений с полей.
Многие люди думают, что вода из скважины или колодца априори чище и здоровее той, что течёт из крана. Это далеко не так. Специалисты отмечают, что при анализе воды на нитраты, довольно часто бракуют как раз пробы воды из колодцев и скважин небольшой глубины. Также в зоне риска и поверхностные источники (реки, озёра). Причина этого заключается, в первую очередь, в использовании большого количества азотосодержащих удобрений и неразумной хозяйственной деятельности (например, когда колодец находится недалеко от места стоков с полей). Нитраты попадают в почву, а оттуда в грунтовые воды, а из них – в скважины и колодцы.
Если содержание нитратов в питьевой воде превышено, то её употребление может иметь довольно серьёзные последствия для здоровья. По статистике ВОЗ, во всём мире в результате отравления нитратами в воде умирает 3, 5 млн. человек. Подавляющее большинство из них (около 90%) –это дети до пяти лет. Именно поэтому нужно уделять внимание качеству питьевой воды, особенно, если в семье есть маленькие дети.
Чем же опасны нитраты в питьевой воде? При единоразовом попадании в организм большой дозы нитратов, они могут вызвать серьёзное отравление, вплоть до летального исхода (особенно у детей раннего возраста). Но даже если последствия отравления нитратами в воде вы заметили не сразу, накапливаясь в организме, они могут привести к развитию серьёзных заболеваний.
- Онкологические заболевания (в частности, желудочно-кишечного тракта).
- Нарушение работы поджелудочной и щитовидной железы
- Сердечная недостаточность
- Заболевания почек
- Заболевания сердечно-сосудистой системы
Накапливаясь в организме, нитраты провоцируют так называемую метгемоглобинемию. При этом заболевании гемоглобин в крови замещается метгемоглобином, который не выполняет функцию переноса кислорода. Это ведёт к таким серьёзным последствиям как кислородное голодание, резко ухудшается состояние здоровья.
Учитывая опасность попадания нитратов в организм, актуальным становится вопрос, сколько нитратов может содержаться в воде, чтобы она не представляла опасности для здоровья. Этот параметр регулируется Государственными санитарными нормами. Согласно гигиеническим требованиям к качеству питьевой воды, содержание в ней нитратов не должно превышать 50 мг/л.
Определение нитратов в воде лучше провести, отдав её на анализ в лабораторию. Конечно, существуют и специальные тест-полоски, которые можно использовать в домашних условиях. Но если вы хотите получить точную исчерпывающую информацию, то лучше обратится к специалистам. Кроме того, у вас будет возможность провести сравнительный анализ воды сразу из нескольких источников.
После того, как проведено определение нитратов в воде, и результаты показали превышение нормы, необходимо решать проблему как можно скорее. Очистку воды от нитратов можно эффективно провести при помощи фильтра обратного осмоса. Но проблема в том, что зачастую нитраты в воде обнаруживаются именно в колодцах и скважинах. Тут наладить систему фильтрации сложнее, но всё же возможно. Для этого можно использовать насос и фильтровать уже ту воду, которую он качает. Если же возможности наладить очистку нет, то безопаснее перестать пользоваться водой из данного источника.
Если в качестве источника водоснабжения вы используете скважину и колодец важно не забывать о простых правилах профилактики, которые помогут минимизировать или исключить содержание нитратов в питьевой воде.
- Размещайте колодец как можно дальше от уборной и хозяйственных построек.
- Не разбивайте грядки вблизи источника водоснабжения
- Правильно используйте удобрения на участке, не допускайте их «передозировки».
- Организуйте над колодцем крышку или навес – это поможет избежать механических загрязнений.
Соблюдая эти простые правила, вы защитите воду от загрязнения и сохраните своё здоровье.
источник
Предельно допустимая концентрация (ПДК) нитритов (NO2 – ) в питьевой воде водоемов 3,3 мг/л, нитратов (NO3 – ) — 45 мг/л.
Качественное определение нитратов и нитритов. На часовое или предметное стекло поместите 3 капли раствора дифениламина, приготовленного на концентрированной серной кислоте (Осторожно!),и 1-2 капли исследуемой воды. В присутствии нитрат- и нитрит-ионов появляется синее окрашивание, интенсивность которого зависит от их концентрации.
Раздельное определение нитратов и нитритов следует начинать с обнаружения нитритов, которые мешают определению нитратов.
Определение нитритов. К 5 мл исследуемой воды прибавить 0,5 мл реактива Грисса (Осторожно! Реактив содержит вредные вещества. Работать в вытяжном шкафу, используя пипетку с грушей) и нагреть до 70-80° С на водяной бане (в качестве бани можно использовать химический стакан на электроплитке). Появление розового окрашивания той или иной интенсивности свидетельствует о наличии нитрит-ионов в пробе.

После этого присутствие нитратов можно определить раствором дифениламина, как описано выше, либо следующим способом.
К 3 мл исследуемого раствора прилить 2 мл 20%-ного раствора щелочи, добавить 10-15 мг цинковой пыли, смесь осторожно нагреть (можно на водяной бане). Нитраты восстанавливаются до аммиака, который обнаруживается по покраснению фенолфталеиновой бумаги или по посинению красной лакмусовой, смоченной дистиллированной водой и внесенной в пары исследуемого раствора.
Качественное определение нитрит-ионов с приближенной количественной оценкой. В пробирку диаметром 13-14 мм наливают 10 мл исследуемой воды, прибавляют 1 мл реактива Грисса (ТБ!) и нагревают до 70-80° С на водяной бане. Через 10 мин. появившуюся окраску сравнивают со шкалой (табл. 8.10).
Количественное определение нитритов. Для приготовления шкалы готовят основной стандартный раствор (0,15 г нитрита натрия растворяют в 100 мл дистиллированной воды), содержащий 1 мг нитрит-ионов в мл раствора; рабочий раствор готовят разбавлением основного раствора в 1000 раз. С целью повышения точности эту операцию целесообразно выполнить в два приема — сначала разбавить раствор в 50 раз, а затем еще в 20 раз. Для этого 2 мл основного стандартного раствора переносят пипеткой в мерную колбу на 100 мл, доводят объем до метки дистиллированной водой, перемешивают. Затем из полученного раствора берут 5 мл в другую мерную колбу на 100 мл, так же доводят объем до метки и перемешивают. 1 мл полученного раствора содержит 1 мкг нитрит-ионов. В 10 мерных колб на 50 мл вносят рабочий раствор в соответствии с табл. 8.11 и доводят объем до метки дистиллированной водой.
Из каждой колбы взять по 5 мл раствора в 10 пронумерованных пробирок, в 11-ю — 5 мл исследуемой воды, добавить в каждую по 0,5 мл реактива Грисса (ТБ!), перемешать и нагреть на водяной бане при 50-60°С. Через 10-15 минут интенсивность появившейся розовой окраски пробы сравнить со шкалой стандартных растворов.
Количественное определение суммарного содержания нитратов и нитритов. Определение проводят с реактивом Грисса (ТБ!) по вышеописанной методике, предварительно переведя нитраты в нитриты цинковой пылью в кислой среде при рН=3. Для перевода нитратов в нитриты к 10 мл исследуемой воды прибавляют 10-15 мг цинковой пыли и добавляют по каплям 0,1 н. раствор серной кислоты, доводя рН до 3, контролируя его значение по универсальной индикаторной бумаге. Через 10-15 минут отобрать пипеткой 5 мл прозрачного раствора в пробирку и провести анализ.
Количественное определение нитратов. В фарфоровую чашку помещают 10 мл исследуемой воды, прибавляют 1 мл 0,5% раствора салицилата натрия или салициловой кислоты и выпаривают досуха на водяной бане. После охлаждения сухой остаток увлажняют 1 мл концентрированной серной кислоты, тщательно растирают стеклянной палочкой и оставляют на 10 мин. Затем добавляют 5-10 мл дистиллированной воды и количественно переносят в мерную колбу на 50 мл, прибавляют 7 мл 10М гидроксида натрия (Осторожно!), доводят объем дистиллированной водой до метки и перемешивают.
5 мл раствора наливают в пробирку и сравнивают его окраску с контрольной шкалой. За результат анализа следует принимать значение концентрации нитрат-анионов (в мг/л) того образца шкалы, который более всего соответствует окраске полученного раствора.
Если в лаборатории имеется фотоколориметр, раствор помещают в кювету, измеряют его оптическую плотность, значение концентрации нитрат-анионов определяют по предварительно построенному градуировочному графику.
Если окраска содержимого пробирки окажется интенсивнее крайнего образца шкалы (5 мг/л) или значение оптической плотности выходит за пределы градуировочного графика, анализируемую воду разбавляют в 5 раз дистиллированной водой и определение повторяют. При вычислении результатов учитывают степень разбавления пробы.
Для приготовления шкалы готовят основной стандартный раствор, растворяя дистиллированной водой 0,032 г нитрата калия в мерной колбе на 200 мл (0,1 мг нитратов/мл), и рабочий раствор разведением основного в 10 раз (0,01 мг/мл). Затем в фарфоровые чашки вносят 0,1, 2, 5, 10, 15,20 и 25 мл рабочего раствора (что соответствует содержанию нитратов 0; 0,2; 0,4; 1,0; 2,0; 3,0; 4,0 и 5,0 мг/л), добавляют по 1 мл раствора салицилата натрия, выпаривают досуха. Далее проводят те же операции, что и с исследуемой пробой.
Определение нитратов и нитритов в воде по методу АЛ.Рычкова.
Для определения нитратов и нитритов по этому методу необходимы следующие медицинские препараты (их можно приобрести в аптеке): риванол (этакридина лактат), антипирин, оксафенамид, стрептоцид, гидрокарбонат натрия (питьевая сода), физиологический раствор (0,9% раствор хлорида натрия в дистиллированной воде), а также соляная кислота и дихромат калия.
В питьевой воде должно содержаться не более 3,3 мг/л нитрит- и 45 мг/л нитрат-ионов.
Определение нитритов. Для контроля нитритов можно воспользоваться одним из трех методов, пределы обнаружения у которых составляют 1,3; 1,6 и 2 мг/л нитрит-ионов.
Риванольная реакция. К 1 мл исследуемой воды прибавляют 1 мл физиологического раствора и смешивают с 1 мл риванольного раствора (таблетку растворяют при нагревании в 200 мл 8%-ной соляной кислоты). Если появится бледная розовая окраска, значит, уровень нитритов в питьевой воде недопустим.
Антипириновая реакция. 1 мл питьевой воды смешивают с 1 мл физиологического раствора (концентрация нитритов при таком разведении падает вдвое), 1 мл раствора антипирина (одна таблетка в 50 мл 8%-ной соляной кислоты) и быстро прибавляют две капли 1%-ного раствора дихромата калия. Смесь нагревают до появления признаков кипения. Если в течение 5 мин. раствор становится бледно-розовым, то значит, что в нем содержится более 1,6 мг/л нитрит-ионов, а в пробе питьевой воды соответственно вдвое больше (выше 3,2 мг/л). В этом случае содержание нитрит-ионов превышает предельно допустимую концентрацию.
Домашняя модификация метода Грисса. Метод Грисса довольно трудоемок, но этот метод санитарно-гигиенического контроля можно вполне повторить на кухне, не используя быстроокисляющиеся реактивы и специальную аппаратуру
К 1 мл солянокислого раствора стрептоцида (таблетка 0,5 г в 50 мл 8%-ной соляной кислоты) прибавляют 1 мл анализируемой воды, предварительно разбавленной вдвое дистиллированной водой или физраствором, и ставят на 2 мин. в холодильник. Затем в смесь понемногу присыпают гидрокарбонат натрия, пока не перестанут выделяться пузырьки газа. Здесь главное не переборщить с содой, так как ее избыток мешает цветной реакции. Поэтому следует добавлять ее по крупинкам. После того, как кислота нейтрализована, остается прибавить 1 мл холодного раствора оксафенамида в 10%-ный раствор гидрокарбоната натрия (в 100 мл физраствора растворяют 20 таблеток по 0,5 г гидрокарбоната натрия и 1 таблетку оксафенамида). Если в течение 5 мин. смесь приобретает бледно-желтую окраску, вода не пригодна к употреблению.
Определение нитратов (риванольная реакция). К 1 мл исследуемой воды прибавляют 2,2 мл физиологического раствора. Затем отбирают 2 мл приготовленного раствора, добавляют 1 мл солянокислого раствора риванола и немного порошка цинка (на кончике ножа). Если в течение 3-5 мин. желтая окраска риванола исчезнет и раствор окрасится в бледно-розовый цвет, то содержание нитратов в питьевой воде превышает ПДК.
8.2.3.7. Хлориды [37, 38]
Концентрация хлоридов в водоемах-источниках водоснабжения допускается до 350 мг/л.
В поверхностных водах количество хлоридов зависит от характера пород, слагающих бассейны, и варьирует в значительных пределах — от десятых долей до тысячи миллиграммов на литр. В реках северной части России хлоридов обычно немного, не более 10 мг/л, в южных районах эта величина повышается до десятков и сотен мг/л. Много хлоридов попадает в водоемы со сбросами хозяйственно-бытовых и промышленных сточных вод. Этот показатель весьма важен при оценке санитарного состояния водоема.
Качественное определение с приближенной количественной оценкой. В пробирку отбирают 5 мл исследуемой воды и добавляют 3 капли 10%-ного раствора нитрата серебра. Приблизительное содержание хлоридов определяют по осадку или помутнению (табл. 8.12).
Количественное определение хлоридов. Хлориды определяют титрованием пробы анализируемой воды нитратом серебра в присутствии хромата калия как индикатора. Нитрат серебра дает с хлорид-ионами белый осадок, а с хроматом калия — кирпично-красный осадок хромата серебра. Из образовавшихся осадков меньшей растворимостью обладает хлорид серебра. Поэтому лишь после того, как хлорид-ионы будут связаны, начинается образование красного хромата серебра. Появление слабо-оранжевой окраски свидетельствует о конце реакции. Титрование можно проводить в нейтральной или слабощелочной среде. Кислую анализируемую воду нейтрализуют гидрокарбонатом натрия.
В коническую колбу помещают 100 мл исследуемой воды, прибавляют 1 мл 5%-ного раствора хромата калия и титруют 0,05 н. раствором нитрата серебра при постоянном взбалтывании до появления слабо-красного окрашивания.
Содержание хлоридов (X) в мг/л вычисляют по формуле:
где 1,773 — масса хлорид-ионов (мг), эквивалентная 1 мл точно 0,05 н. раствора нитрата серебра;
V — объем раствора нитрата серебра, затраченного на титрование, мл. Техника безопасности! После работы обязательно вымыть руки.
8.2.3.8. Сульфаты [37, 38]

Содержание сульфатов в природных, поверхностных и подземных водах обусловлено выщелачиванием горных пород, биохимическими процессами и др. В северных водоемах сульфатов обычно не много; в южных районах, где воды более минерализованы, содержание содержание сульфатов увеличивается. Сульфаты попадают в водоемы также со сбросами сточных вод.
Качественное определение с приближенной количественной оценкой. В пробирку вносят 10 мл исследуемой воды, 0,5 мл раствора соляной кислоты (1:5) и 2 мл 5%-ного раствора хлорида бария, перемешивают. По характеру выпавшего осадка определяют ориентировочное содержание сульфатов: при отсутствии мути — концентрация сульфат-ионов менее 5 мг/л; при слабой мути, появляющейся не сразу, а через несколько мин.. -5-10 мг/л; при слабой мути, появляющейся сразу после добавления хлорида бария, — 10-100 мг/л; сильная, быстро оседающая муть свидетельствует о достаточно высоком содержании сульфат-ионов (более 100 мг/л).
Дата добавления: 2015-04-11 ; просмотров: 572 ; Нарушение авторских прав
источник
НИТРАТЫ НИТРИТЫ В ВОДЕ.
(Нитриты и нитраты, угроза и способы очистки.)
В местах отсутствия централизованной системы подачи воды, мы вынуждены искать альтернативные способы её получения. Один из них, это рытье колодца. Как нам кажется, вполне безопасный. А по мнению большинства из нас, полезный для здоровья. Это одно из самых распространенных и трагических заблуждений нашего времени. Попробуем разобраться в этом.
Почти наверняка в вашем колодце завышена норма нитратов и нитритов. А возможно она превышает норму п.д.к. (предельно допустимая концентрация ). Даже если ваш колодец, является источником воды в вашем доме уже много лет и до этого дня вы не знали о случаях отравления из него, вы подвергаете риску себя и свою семью. Ещё одно широко распространённое заблуждение, это то, что в вода из централизованной водопроводной системы не содержит нитратов или нитритов.
Случаи отравления нитратами и нитритами, очень распространены.
Избыточное содержание нитратов и нитритов в воде, является причиной 70-80 процентов всех заболеваний, сокращающих нашу жизнь на 30%.
Ежегодно, в мире от отравлений нитрато нитритной водой, заболевает 2 млрд. человек, из них 3,5 млн.умирает, 90% это дети до 5 лет.
Эта страшная статистика, болезней и смертей, вызвана нитратами и нитритами которые содержаться в воде.
Что же это такое? И чего в них больше, вреда или пользы. Про это я и предлагаю поговорить
| фильтры от нитратов с механическим клапаном | фильтры от нитратов с автоматическим клапаном | Обратный осмос от нитратов нитритов, для питьевой воды. |
| Норма нитратов и нитритов в питьевой воде | |||||
| Наименование | Ед-изм | В водопроводной воде | В колодцах, родниках и каптажных источниках | фасуемая вода в пунктах разлива и бюветах | Методики опреде-ления согласно дополн. 5 |
| Нитраты | мг/дм3 | Ј 50,0 | Ј 50,0 | Ј 10 (50)4 | пп. 6, 20 |
| Нитриты | мг/дм3 | Ј 0,5 (0,1)3 | Ј 3,3 | Ј 0,5 (0,1)7 | пп. 6, 36 |
ЧТО ТАКОЕ НИТРАТЫ и НИТРИТЫ.
Азото-кислые соли, нитраты и нитриты по сути два типа одного соединения. Возьмем один атом азота (N) присоединим к нему два атома кислорода (O) получим нитрит (NO2), добавим ещё один атом кислорода получаем нитрат (NO3).
В природе эти элементы присутствуют повсюду, являясь основой клеток у растений. Даже наш организм выделяет определенное количество нитратов.
Дело в том, что азот необходим растениям. С его помощью растения создают аминокислоты, из которых составляют белок.
Получая из почвы минеральные соли азота, растения подвергают их сложной трансформации.
Нитраты восстанавливаются до нитритов. Накапливаясь в растениях и улучшая рост вегетативной части растения, (крона, ствол, корневая система).
Часть нитритов, трансформируется в аммиак. Наличие этих компонентов неизбежно.
Аммиак, продукт, который стоит первым в цепи разложения органики, содержащей азот. Наличие аммиака в воде, это своеобразный показатель того что, существует свежее эпидемиологическое загрязнение воды органикой. Хотя и не всегда. Глубоко, в подземных водах, в местах где отсутствует кислород, нитраты восстанавливаются до аммиака. Присутствие в воде нитритов признак того, что скорее всего, загрязнения воды имеет определенную давность. Конечный продукт разложения (минерализации органики) это нитраты.
Преимущественное наличие в воде одного из трёх компонентов говорит о определенном временном отрезке, прошедшем с момента попадания органики в воду.
Наличие в равной доле всех трёх компонентов, говорит о не завершенности процессов разложения и продолжающемся поступлении загрязнений в воду.
Если-же мы имеем дело с повышенной дозой нитратов, то скорее всего мы столкнулись с человеческим фактором.
Это могут быть отходы промышленности, минеральные (калийно азотные) удобрения. Так выглядит круговорот азота в природе.
В природных условиях, в источниках, нитритов и нитратов обычно содержится мало. В грунтовых водах содержание азото кислых солей возрастает. В пределах населенных пунктов содержание нитратов выше нормы, дело обычное.
Как влияют, казалось бы естественные для природы минеральные соли азота, на человеческое здоровье?
По этому поводу существует много версий. Одни считают, что нитраты нейтральны и безвредны. Для большинства людей нитраты, это яд. Давайте разберёмся в этом вопросе более подробно.
Присутствие нитратов и нитритов в большинстве водных источников, продуктах питания, атмосфере и почве безусловно и неизбежно. Гниение растительного и животного материала, удобрения и сточные воды, вымывание из мест захоронения отходов и из атмосферы, промышленные отходы, это источник поступления нитратов в воду.
Ни один из существующих методов обработки воды (обеззараживание, очистка) для подачи в городскую систему не даёт какого либо существенного результата приводящего к значительному снижению нитратов в воде. Уровень нитратов в водопроводной системе, обычно полностью идентичен уровню содержания таковых в окружающих водоемах.
Широкое применение нитратов и нитритов в пищевой промышленности, они сохраняют цвет мяса, добавляют в бекон, ветчину и сосиски, сыры. Но это лишь малый процент нитратов, которые мы получаем. На самом деле львиная доля нитратов и нитритов, которые мы получаем, растительного происхождения.
Как было сказано выше ,азотные соединения, это основа клеточного строительства у растений. В пищу мы употребляем достаточное количество нитратов, которое необходимо для нашего организма.
Здесь хочу отметить, что сами по себе нитраты, вопреки бытующему мнению, не представляют особой опасности для человека. Но попадая в организм, нитраты под воздействием микроорганизмов переходят в нитриты. А вот нитриты представляют собой определенную угрозу.
В нашем организме, основная функция нитритов, расслабление кровеносных сосудов. Теряя атом кислорода, нитриты трансформируются в оксид азота, нестабильный газ. Передавая сигнал в мышечные клетки кровеносных сосудов, расслабляя и расширяя их, снижают давление.
Проблема возникает, когда излишние нитриты вступают в реакции с аминокислотами, при этом образовываются нитроз амины. Более ста соединений нитроз аминов являются канцерогенами, вызывая раковые заболевания. Но основная проблема и угроза состоит в том, что нитроз амины, окисляя железо, из которого состоит гемоглобин, образовывают метгемоглобин.
Назначение гемоглобина, переносить кислород из легких в мышечные ткани. Метгемоглобин, по строению схожий с гемоглобином, заменяет и угнетает его, но не выполняет его функции. Он попросту не способен переносить кислород. Накопление метгемоглобина, вызывает водную метгемоглобинию. Этому заболеванию очень подвержены дети.
Попросту говоря, организму для полноценного функционирования не хватает кислорода. Появляется отдышка. Образовывается холестерин, накапливается молочная кислота, падает содержание белка. Нарушается работа щитовидной железы, обмена веществ. Метгемоглобиния особо опасна беременным от 30 недель, а также детям до года, ввиду того что гемоглобин у плода и у детей раннего возраста находится в фетальной форме, который легче генерирует в метгемоглобин. Любое молоко содержит микроорганизмы, которые перерабатывают нитраты в нитриты. Во время кипячения, с испарением увеличивается содержание нитритов. Из-за отсутствия, в колодцах водорослей, активно потребляющих нитраты, количество нитратов в воде превышает все допустимые нормы.
Учитывая то что токсичность водных нитратов в 1,25 раза выше нитратов пищевых, приготовление пищи на колодезной воде, особенно на молоке, для маленьких детей, без предварительной очистки воды от нитратов чревато негативными последствиями. Из всех известных способов очистки воды, лишь один способен качественно очистить воду от нитратов.
Хорошая растворимость азото кислых солей делает проблематичным удаление нитратов из питьевой воды.
Учитывая тот факт что в колодцах содержится помимо нитратов, нитритов, возможно повышение содержание таких вредоносных веществ как сероводород, железо и прочие минеральные микроэлементы и микроорганизмы, решение очистки этой воды требует серьёзного подхода и комплексного решения. Которое может дать обратно осмотический способ очистки воды.
Его преимущество над другими способами состоит в том ,что он дает почти сто процентный результат. Весь секрет успеха лежит в принципе по которому осуществляется очистка воды.
Вода проходит под давлением через специальную мембрану. Отверстия в которой соответствуют размеру молекул воды. Как известно, молекулы воды одни из самых маленьких. Таким образом мы получаем фактически стерильную воду.
Такая вода идеально подходит для приготовления пищи, не содержит посторонних запахов и вкусовых примесей. Пища, приготовленная на такой воде вкуснее, а чай-кофе ароматней.
Но для прямого употребления, воду нужно наполнить необходимыми для жизнедеятельности организма минералами. Для этого, вода пропускается через специальный фильтр “минерализатор”, насыщается всеми полезными минералами и микроорганизмами. Такая вода имеет приятный, мягкий вкус и абсолютно безопасна для здоровья взрослых и малышей.
источник
Настоящий документ устанавливает методику измерений массовой концентрации нитрит-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с реактивом Грисса.
Диапазон измерений от 0,02 до 3 мг/дм 3 .
Если массовая концентрация нитрит-ионов в анализируемой пробе превышает 0,6 мг/дм 3 , то пробу необходимо разбавлять.
Определению мешают мутность и взвешенные вещества. Трехвалентное железо, двухвалентная ртуть, серебро, висмут, трехвалентная сурьма, свинец, трехвалентное золото, хлорплатинаты и метаванадаты мешают определению, так как выпадают в осадок. В анализируемой пробе не должны присутствовать сильные окислители или восстановители. Определению мешает также окраска воды и трихлорамин, двухвалентная медь занижает результаты вследствие вызываемого ею каталитического распада диазотированной сульфаниловой кислоты. Мешающие влияния устраняются в соответствии с п. 9.1.
Значения показателя точности измерений 1 — расширенной относительной неопределенности измерений при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
Таблица 1 — Диапазон измерений, показатели неопределенности измерений
Диапазоны определяемых концентраций, мг/дм 3
Суммарная стандартная относительная неопределенность, u , %
Расширенная относительная неопределенность 2 , U при коэффициенте охвата k = 2, %
Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
2 Соответствует характеристике погрешности при доверительной вероятности Р = 0,95.
При выполнении измерений применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы.
Фотоэлектро колориметр или спектрофотометр любого типа, позволяющий измерять оптическую плотность при λ = 520 нм.
Кюветы с длиной поглощающего слоя 10 или 20 мм.
Весы лабораторные специального класса точности с ценой деления не более 0,1 мг, наибольшим пределом взвешивания не более 210 г по ГОСТ Р 53228-2008.
Колбы мерные, наливные 2-50-2, 2-100-2, 2-1000-2 по ГОСТ 1770-74.
Пипетки 4(5)-2-1, 4(5)-2-2, 6(7)-2-5, 6(7)-2-10, 3-2-1, 3-2-5, 3-2-10 по ГОСТ 29227-91.
Государственные стандартные образцы (ГСО) состава водного раствора нитрит-ионов с массовой концентрацией 1 мг/см 3 и относительной погрешностью аттестованных значений массовых концентраций не более 1 % при Р = 0,95.
Шкаф сушильный лабораторный с температурой нагрева до 130 °С.
1 Допускается использование других средств измерений утвержденных типов, обеспечивающих измерения с установленной точностью.
2 Допускается использование другого оборудования с метрологическими и техническими характеристиками, аналогичными указанным.
3 Средства измерений должны быть поверены в установленные сроки.
Квасцы алюмокалиевые (алюминий калий сернокислый) по ГОСТ 4329-77.
Кислота уксусная ледяная по ГОСТ 61-75.
Реактив Грисса по ТУ 6-09-3569-86.
Калия гидрокись (едкое кали) по ГОСТ 24363-80
или натрия гидрокись (едкий натр) по ГОСТ 4328-77.
Марганец сернокислый, 5-ти водный по ТУ 6-09-4007-82.
Калий марганцевокислый по ГОСТ 20490-75.
Аммоний щавелевокислый 1-водный по ГОСТ 5712-78.
Вода бидистиллированная по ТУ 6-09-2502-77.
1 Все реактивы, используемые для измерений, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Определение основано на способности нитритов диазотировать сульфаниловую кислоту с образованием красно-фиолетового диазосоединения с α-нафтиламином. Интенсивность окраски пропорциональна массовой концентрации нитритов. Протекание реакции в значительной степени зависит от pH среды. Оптическую плотность раствора измеряют при λ = 520 нм.
При выполнении измерений необходимо соблюдать следующие требования техники безопасности.
5.1 При выполнении измерений необходимо соблюдать требования техники безопасности при работе о химическими реактивами по ГОСТ 12.1.007-76.
5.2 Электробезопасность при работе с электроустановками по ГОСТ Р 12.1.019-2009.
5.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
5.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического анализа, изучивший инструкцию по эксплуатации спектрофотометра или фотоколориметра и получивший удовлетворительные результаты при выполнении контроля процедуры измерений.
Измерения проводятся в следующих условиях:
— температура окружающего воздуха (20 ± 5) °С;
— относительная влажность не более 80 % при t = 25 °C;
— атмосферное давление (84 — 106) кПа (630 — 800 мм рт.ст);
— частота переменного тока (50 ± 1) Гц;
— напряжение в сети (220 ± 22) В.
При подготовке к выполнению измерений должны быть проведены следующие работы: подготовка посуды для отбора проб, отбор и хранение проб, подготовка прибора к работе, приготовление вспомогательных и градуировочных растворов, установление и контроль стабильности градуировочной характеристики.
Бутыли для отбора и хранения проб воды обезжиривают раствором СМС, промывают водой, обрабатывают хромовой смесью, промывают водопроводной водой, затем 3 — 4 раза дистиллированной водой.
Отбор проб питьевых вод производится в соответствии с требованиями ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб».
Отбор проб поверхностных и сточных вод производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
Пробы воды (объем не менее 500 см 3 ) отбирают в емкости из полимерного материала или стекла, предварительно ополоснутые отбираемой водой.
Если анализ производят в день отбора пробы, то консервирование не производится.
В том случае, если пробы не могут быть проанализированы сразу, их хранят при температуре 3 — 4 °С не более 24 часов или консервируют добавлением 2 — 4 см 3 хлороформа на 1 дм 3 воды. Законсервированные пробы хранят не более двух суток.
Для доставки в лабораторию сосуды с пробками упаковываются в тару, обеспечивающую сохранение и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по форме, в котором указывают:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
Подготовку прибора к работе и оптимизацию условий измерения проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
8.4.1 Вода дистиллированная, не содержащая нитритов
Воду готовят одним из следующих способов:
а) 1 дм 3 дистиллированной воды подкисляют 5 см 3 раствора серной кислоты (1:3), добавляют 50 см 3 бромной воды и кипятят (желательно с обратным холодильником) в течение 1 часа до полного удаления брома.
б) К 1 дм 3 дистиллированной воды добавляют 1 см 3 концентрированной серной кислоты и 0,2 см 3 48 %-ного раствора тетрагидрата сульфата марганца. Добавляют 1 — 3 см 3 0,04 %-ного раствора перманганата калия до появления постоянной розовой окраски. Через 15 минут раствор обесцвечивают, прибавляя по каплям 0,09 %-ный раствор моногидрата оксалата аммония.
в) К 1 дм 3 дистиллированной воды добавляют один кристалл перманганата калия и один кристалл едкой щелочи (КОН или NaOH) и производят повторную дистилляцию.
8.4.2 Бром, насыщенный водный раствор (бромная вода)
Бром по каплям при непрерывном перемешивании прибавляют к воде до появления нерастворяющейся капли на дне склянки. (Работу проводят в вытяжном шкафу). Реактив хранят в склянке из темного стекла в вытяжном шкафу.
8.4.3 Серная кислота, водный раствор (1:3)
Смешивают один объем серной кислоты, ρ = 1,84 г/см 3 с тремя объемами воды, осторожно приливая кислоту к воде.
8.4.4 Тетрагидрат сульфата марганца, 48 %-ный раствор
48 г соли тетрагидрата сульфата марганца растворяют в 52 см 3 дистиллированной воды.
8.4.5 Калий марганцевокислый, 0,04 %-ный раствор
0,4 г калия марганцевокислого растворяют в 1 дм 3 дистиллированной воды.
8.4.6 Аммоний щавелевокислый, 0,09 %-ный раствор
0,9 г моногидрата оксалата аммония растворяют в 1 дм 3 дистиллированной воды.
8.4.7 Сульфат алюминия-калия, 12,5 %-ный раствор
12,5 г алюмокалиевых квасцов растворяют в 87,5 см 3 воды при температуре 60 °С.
8.4.8 Алюминий гидроксид, суспензия для коагуляции
125 г сульфата алюминия-калия AlK(SO4)2∙12Н2O растворяют в 1 дм 3 воды, нагревают до 60 °С и постепенно прибавляют 55 см 3 25 %-ного раствора аммиака при постоянном перемешивании. После отстаивания в течение 1 ч осадок переносят в большой стакан и промывают декантацией бидистиллированной водой до исчезновения в промывной воде реакции на хлориды, аммиак, нитриты, нитраты.
27,2 г уксуснокислого натрия растворяют в 100 см 3 дистиллированной воды.
Растворяют 6,0 г сульфаниловой кислоты в 750 см 3 горячей дистиллированной воды. К полученному раствору прибавляют 250 см 3 ледяной уксусной кислоты.
Смешивают 0,600 г гидрохлорида α-нафтиламина с 1 см 3 концентрированной соляной кислоты (или 0,480 г основания α-нафтиламина смешивают с 1,4 см 3 концентрированной соляной кислоты) и разбавляют дистиллированной водой до 100 см 3 .
Растворяют 1,2 г α-нафтиламина в дистиллированной воде, прибавляют 50 см 3 ледяной уксусной кислоты и доводят объем дистиллированной водой до 200 см 3 . При образовании мути раствор фильтруют через хлопчатобумажную ткань, промытую дистиллированной водой. Раствор сохраняется 2 — 3 месяца.
8.4.12 Реактив Грисса, 10 %-ный раствор
10 г реактива Грисса, взвешенного с погрешностью не более 0,1 г, растворяют в 100 см 3 12 %-ного раствора уксусной кислоты.
8.4.13 Уксусная кислота, 12 %-ный раствор
25 см 3 ледяной уксусной кислоты разбавляют дистиллированной водой до 200 см 3 .
8.4.14 Приготовление из ГСО 3 основного градуировочного
раствора нитрит-иона с массовой концентрацией 0,1 мг/см 3 .
Раствор готовят в соответствии с прилагаемой к ГСО инструкцией. 1 см 3 раствора должен содержать 0,1 мг нитрит-иона.
Раствор устойчив в течение месяца.
3 Приготовление градуировочных растворов из натрия азотистокислого приведено в Приложении Б.
8.4.15 Приготовление рабочего градуировочного раствора нитрит-иона с массовой концентрацией 0,001 мг/см 3 .
Раствор готовят из основного градуировочного раствора соответствующим разбавлением. 1 см 3 раствора должен содержать 0,001 мг нитрит-иона.
Раствор готовят вдень проведения измерений.
Для построения градуировочного графика необходимо приготовить образцы для градуировки определяемого компонента с массовой концентрацией от 0,002 до 0,06 мг/дм 3 . Условия измерений, процедура выполнения измерений должны соответствовать п.п. 7, 9.
Состав и количество образцов для градуировки для построения градуировочного графика приведены в таблице 2.
Неопределенность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,5 %.
Таблица 2 — Состав и количество образцов для градуировки
Массовая концентрация нитрит-ионов в градуировочных растворах, мг/дм 3
Аликвотная часть рабочего градуировочного раствора, с массовой концентрацией 0,001 мг/см 3 , помещаемого в мерную колбу вместимостью 50 см 3 , см 3
Разбавляют каждый раствор до метки дистиллированной водой и перемешивают. Далее раствор проводят через весь ход анализа по п. 9.2.
Анализ образцов для градуировки проводят в порядке возрастания их массовой концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных.
При построении градуировочного графика по оси ординат откладывают значения оптической плотности, а по оси абсцисс — величину массовой концентрации вещества в мг/дм 3 .
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал, а также при смене партий реактивов, после поверки или ремонта прибора. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в табл. 2).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где X — результат контрольного измерения массовой концентрации нитрит-ионов в образце для градуировки;
С — аттестованное значение массовой концентрации нитрит-ионов;
u1(ТОЕ) — стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности, %.
Значения u1(ТОЕ) приведены в Приложении А.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
9.1.1 Мешающее влияние взвешенных веществ, мутности и окраски воды частично устраняется фильтрованием пробы через бумажный фильтр «синяя лента».
Если мутность фильтрованием не устраняется и поверхностные или сточные воды содержат коллоидные вещества, пробу необходимо осветлить путем коагулирования с гидрооксидом алюминия. Для этого к 100 см 3 пробы прибавляют около 0,5 г активированного угля, 1,0 см 3 12,5 % раствора сульфата алюминия и калия (KAI(SО4)∙12H2О) и раствор аммиака до получения pH — 5,8. После взбалтывания дают осадку осесть до полного осветления пробы. Фильтруют через сухой плотный фильтр («синяя лента»).
Осветление можно также проводить, взбалтывая 100 см 3 пробы с 2 см 3 суспензии гидроокида алюминия.
9.1.2 Влияние ионов металлов устраняется в ходе измерений (см. п. 9.2).
9.1.3 Окраску воды устраняют способом, описанным в п. 9.1.1.
Анализируемую воду нейтрализуют до pH = 7, и, если появится осадок или муть, фильтруют через мембранный фильтр № 1 (разбавление учитывают при расчете результата определения).
В коническую колбу вместимостью 100 см 3 помещают 50 см 3 анализируемой воды (или фильтрата после отделения осадка, или меньший объем, но разбавленный до 50 см 3 дистиллированной водой). В отобранном объеме должно содержаться не более 60 мкг NО2. Прибавляют 1,0 см 3 раствора сульфаниловой кислоты (п. 8.4.10) и тщательно перемешивают. Дают постоять 5 мин, затем приливают 1,0 см 3 раствора α-нафтиламина (п. 8.4.11) и 1,0 см 3 ацетата натрия (п. 8.4.9) (раствор ацетата натрия добавляется лишь в том случае, если раствор α-нафтиламина готовят с добавлением соляной кислоты) или добавляют 2,0 см 3 готового реактива Грисса, смесь перемешивают. Через 40 минут определяют оптическую плотность при λ = 520 нм.
Одновременно проводят холостой опыт с 50 см 3 дистиллированной воды и полученный в холостом опыте раствор используют в качестве сравнительного раствора при измерении оптической плотности. Результат определения находят по градуировочному графику.
Массовую концентрацию нитрит-ионов, X (мг/дм 3 ) рассчитывают по формуле:
где: С — массовая концентрация нитрит-ионов, найденная по графику, мг/дм 3 ;
50 — объем, до которого разбавлена проба, см 3 ;
V — объем пробы, взятой для определения, см 3 .
При необходимости за результат измерений Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в Таблице 3.
Таблица 3 — Значения предела повторяемости при вероятности Р = 0,95
Диапазон измерений, мг/дм 3
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r , %
При невыполнении условия (4) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Результат измерений в документах, предусматривающих его использование, может быть представлен в виде: X ± = 0,01∙U∙X, мг/дм 3 , где X — результат измерений массовой концентрации, установленный по п. 10, мг/дм 3 ;
U — значение показателя точности измерений (расширенная неопределенность измерений с коэффициентом охвата 2).
Значение U приведено в таблице 1.
Допускается результат измерений в документах, выдаваемых лабораторией, представлять в виде: X ± = 0,01Uл∙X, мг/дм 3 , Р = 0,95, при условии Uл Примечание.
При представлении результата измерений в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерений;
— способ определения результата измерений (среднее арифметическое значение или медиана результатов параллельных определений).
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры измерений;
— контроль стабильности результатов измерений на основе контроля стабильности среднего квадратического отклонения (СКО) повторяемости, СКО промежуточной (внутрилабораторной) прецизионности и правильности.
Периодичность контроля исполнителем процедуры выполнения измерений и алгоритмы контрольных процедур, а также реализуемые процедуры контроля стабильности результатов измерений регламентируют во внутренних документах лаборатории.
Ответственность за организацию проведения контроля стабильности результатов измерений возлагают на лицо, ответственное за систему менеджмента качества в лаборатории.
Разрешение противоречий между результатами двух лабораторий проводят в соответствии с 5.3.3 ГОСТ Р ИСО 5725-6-2002.
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Kк с нормативом
Результат контрольной процедуры Kк рассчитывают по формуле:
где Х′ср — результат измерений массовой концентрации нитрит-ионов в пробе с известной добавкой — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4).
Хср — результат измерений массовой концентрации нитрит-ионов в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4).
Норматив контроля K рассчитывают по формуле
где 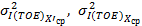
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (7) контрольную процедуру повторяют. При повторном невыполнении условия (7) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Kк с нормативом контроля K.
Результат контрольной процедуры Kк рассчитывают по формуле:
где Сср — результат измерений массовой концентрации нитрит-ионов в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4);
С — аттестованное значение массовой концентрации нитрит-ионов в образце для контроля.
Норматив контроля K рассчитывают по формуле
где σI(TOE) — стандартное отклонение промежуточной прецизионности, соответствующие массовой концентрации нитрит-ионов в образце для контроля, мг/дм 3 .
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (10) контрольную процедуру повторяют. При повторном невыполнении условия (10) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Таблица 4 — Диапазон измерений, значения пределов воспроизводимости при вероятности Р = 0,95
Диапазон измерений, мг/дм 3
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R , %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно разделу 5 ГОСТ Р ИСО 5725-6-2002.
Таблица А.1 — Бюджет неопределенности измерений
Стандартная относительная неопределенность 4 , %
Приготовление градуировочных растворов, u 1 , %
Степень чистоты реактивов и дистиллированной воды, u 2 , %
Подготовка проб к анализу, u 3 , %
Стандартное отклонение результатов измерений, полученных в условиях повторяемости 5 , ur (σ r ), %
Стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности 5 , uI(TOE) ( σI(TOE) ), %
Стандартное отклонение измерений полученных в условиях воспроизводимости, uR (σ R ), %
Суммарная стандартная относительная неопределенность, u с , %
Расширенная относительная неопределенность, ( U отн ) при k = 2, %
1 Оценка (неопределенности) типа А получена путем статистического анализа ряда наблюдений.
2 Оценка (неопределенности) типа В получена способами, отличными от статистического анализа ряда наблюдений.
4 Соответствует характеристике относительной погрешности при доверительной вероятности Р = 0,95.
5 Согласно ГОСТ Р ИСО 5725-3-2002 учтено при расчете стандартного отклонения результатов измерений, получаемых в условиях воспроизводимости.
Б.1 Натрий азотистокислый, основной градуировочный раствор
0,150 г азотистокислого натрия, высушенного при 105 °С, растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды и доводят раствор до метки.
1 см 3 раствора содержит 0,1 мг нитрит-ионов. Раствор консервируют 1 см 3 хлороформа, хранят в склянке темного стекла в холодном месте.
Б.2 Натрий азотистокислый, рабочий градуировочный раствор (I)
100 см 3 основного стандартного раствора помещают в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой.
1 см 3 раствора содержит 0,01 мг нитрит-ионов. Раствор готовят в день проведения измерений.
Б.3 Натрий азотистокислый, рабочий градуировочный раствор (II)
100 см 3 рабочего раствора (1) помещают в мерную колбу вместимостью 1 дм 3 и доводят до метки дистиллированной водой.
1 см 3 раствора содержит 0,001 мг нитрит-ионов. Раствор готовят в день проведения измерений.
источник
