Фотометрический метод определения массовой концентрации нитрат-иона основан на взаимодействии нитрат-ионов с салициловой кислотой с образованием желтого комплексного соединения.
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведенных в таблице 1.
Диапазон измерений, значения показателей точности, повторяемости и воспроизводимости
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ± d , %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) s r, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), s R, %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоэлектроколориметр, позволяющие измерять светопоглощение при значениях l = 410 нм.
ГСО c аттестованным содержанием нитрат-ионов.
Кюветы кварцевые с толщиной поглощающего слоя 20 мм.
Весы лабораторные, 2 кл. точности ГОСТ 24104.
Колбы мерные наливные 2-50-2
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Стаканчики для взвешивания СВ ГОСТ 25336.
Стаканы термостойкие В-1-1000
Пробирки колориметрические П-2-10-0,1 ХС ГОСТ 1770.
3.2 . Вспомогательное оборудование, материалы
Сушильный шкаф электрический ОСТ 16.0.801.397.
Чашки выпарительные фарфоровые ГОСТ 9147.
Фильтры обеззоленные ТУ 6-09-1678.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 см 3 для отбора и хранения проб.
Активированный уголь БАУ-Э, ТУ 6-16-3075.
Натрий салициловокислый ГОСТ 17628 G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Калий-натрий виннокислый 4-водный (Сегнетова соль) ГОСТ 5845.
Серебро сернокислое ТУ 6-09-3703.
Все реактивы должны быть квалификации х.ч. или ч.д.а. и не содержать примесей нитрат-ионов.
4.1 . При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 .
4.2 . Электробезопасность при работе с электроустановками по ГОСТ 12.1.019 .
4.3 . Организация обучения работающих безопасности труда по ГОСТ 12.0.004 .
4.4 . Помещение лаборатории должно соответствовать пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009 .
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического и спектрофотометрического анализов, изучивший инструкцию по работе с соответствующими приборами.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 ± 5) °С;
относительная влажность (80 ± 5) %;
атмосферное давление (84 — 106) кПа (630 — 800 мм рт.ст.);
частота переменного тока (50 ± 1) Гц;
напряжение в сети (220 ± 10) В.
7.1 . Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб». G )
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Пробы воды (объем не менее 200 см 3 ) отбирают в стеклянные или полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
Если определение нитратов производят в день отбора пробы, то консервирование не требуется.
Если проба не будет проанализирована в день отбора, то ее консервируют добавлением концентрированной серной кислоты (на 1 дм 3 воды — 1 см 3 H 2 SO 4 конц.). Консервированная проба может храниться не более 2 суток при температуре (3 — 4) °С.
Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
7.3 . Подготовка прибора к работе
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
7.4 . Освобождение от мешающих влияний
1. Взвешенные, окрашен. органические вещества. Железо(> 5 мг/дм 3 )
К 150 см 3 пробы добавить 3 см 3 гидроксида алюминия, пробу перемешивают, дают отстояться и фильтруют через фильтр «белая лента», отбрасывая первую порцию фильтрата.
В ходе анализа добавляют сернокислое серебро в количестве, эквивалентном содержанию хлорид-иона. Осадок хлорида серебра отфильтровывают через фильтр «белая лента».
К 20 см 3 пробы добавляют 0,05 г сернокислого аммония и упаривают досуха на водяной бане, доводят до первоначального объема дистиллированной водой.
Основной раствор нитрат-ионов.
Навеску (0,1631 г) калия азотнокислого, предварительно высушенного при 105 °С, помещают в стакан вместимостью 100 см 3 , растворяют в 50 см 3 дистиллированной воды, переносят в мерную колбу вместимостью 1000 см 3 и доводят до метки дистиллированной водой.
1 см 3 содержит 0,1 мг нитрат-ионов. Раствор устойчив в течение 3 мес.
При наличии ГСО: раствор готовят в соответствии с прилагаемой к образцу инструкцией.
1 см 3 раствора должен содержать 0,1 мг нитрат-ионов.
Рабочий раствор нитрат-ионов.
10 ,0 см 3 основного раствора нитрат-ионов переносят в мерную колбу на 100 см 3 и доводят до метки дистиллированной водой.
1 см 3 раствора содержит 0,01 мг нитрат-ионов. Раствор готовят в день проведения анализа.
Раствор гидроксида натрия и сегнетовой соли.
400 г гидроксида натрия и 60 г сегнетовой соли помещают в стакан вместимостью 1000 см 3 , растворяют в 500 см 3 дистиллированной воды, охлаждают, переносят в мерную колбу вместимостью 1000 см 3 G ) и доводят до метки дистиллированной водой G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Раствор салициловой кислоты (о-гидроксибензойной).
Навеску (1,0 г) салициловой кислоты помещают в стакан вместимостью 100 см 3 , растворяют в 50 см 3 этилового спирта, переносят в мерную колбу вместимостью 100 см 3 , доводят до метки этиловым спиртом. Раствор готовят в день использования.
Навеску (0,5 г) натрия салициловокислого растворяют в 100 см 3 дистиллированной воды. Раствор готовят в день использования G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Суспензия гидроксида алюминия.
125 г алюмоаммонийных или алюмокалиевых квасцов растворяют в 1 дм 3 дистиллированной воды, раствор нагревают до 60 °С и медленно при непрерывном перемешивании прибавляют 55 см 3 концентрированного раствора аммиака. Дают смеси отстояться около 1 часа, фильтруют и промывают осадок гидроксида алюминия многократной декантацией дистиллированной водой до полного удаления свободного аммиака.
7.6 . Приготовление градуировочных растворов
В ряд колориметрических пробирок на 10 см 3 отбирают последовательно пипеткой 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 см 3 рабочего раствора нитрат-иона (0,01 мг/см 3 ) и доводят дистиллированной водой до метки. G ) Содержание нитрат-ионов в растворах соответственно равно 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 мг/дм 3 G ) .
ПНД Ф 14.1:2.4-95 G ) Внесены дополнения и изменения согласно протоколу № 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Растворы переносят в фарфоровые чашки, добавляют 2 см 3 раствора салициловой кислоты (или 2 см 3 раствора натрия салициловокислого) и выпаривают в фарфоровой чашке на водяной бане досуха. После охлаждения сухой остаток смешивают с 2 см 3 серной кислоты и оставляют на 10 мин. Затем содержимое чашки разбавляют 10 — 15 см 3 дистиллированной воды, приливают приблизительно 15 см 3 раствора гидроксида натрия и сегнетовой соли, переносят в мерную колбу вместимостью 50 см 3 , смывая стенки чашки дистиллированной водой, охлаждают колбу в холодной воде до комнатной температуры, доводят дистиллированной водой до метки и полученный окрашенный раствор сразу фотометрируют при l = 410 нм в кюветах с толщиной поглощающего слоя 20 мм. Одновременно с обработкой градуировочных растворов проводят «холостой опыт» с дистиллированной водой, который используют в качестве раствора сравнения.
Градуировочный график строят методом наименьших квадратов в координатах: А — оптическая плотность; С — концентрация нитрат-ионов в градуировочном растворе (мг/дм 3 ).
7.7 . Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал или при смене партий реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 7.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
где Х — результат контрольного измерения массовой концентрации нитрат-ионов в образце для градуировки;
С — аттестованное значение массовой концентрации нитрат-ионов;
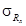
Примечание . Допустимо среднеквадратическое отклонение внутрилабораторной прецизионности при внедрении методики в лаборатории устанавливать на основе выражения: 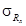
Значения s R приведены в таблице 1.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Пробу объемом 150 см 3 обрабатывают как указано в п. 7.4. Для анализа используют фильтрат. Его объем может составлять 5,0 — 10 см 3 в зависимости от концентрации нитрат-ионов в воде. Далее поступают, как описано в пункте 7.6. При анализе пробы воды выполняют не менее двух параллельных определений.
Содержание нитрат-ионов, X , мг/дм 3 вычисляют по формуле:
где С — содержание нитрат-ионов, найденное по графику, мг/дм 3 ;
V — объем исследуемой пробы, взятой на анализ, дм 3 .
За результат анализа Хср принимают среднее арифметическое значение двух параллельных определений Х1 и X 2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
источник
Цель работы: ознакомление с фотометрическим методом определения нитратов в питьевой, сточной и других видах вод.
1.1. Общие сведения и характеристика метода определения нитратов
Нитраты – соли азотной кислоты, например NaNO3,KNO3, NH4NO3, Mg(NO3)2. Они являются нормальными продуктами обмена азотистых веществ любого живого организма – растительного и животного, поэтому «безнитратных» продуктов в природе не бывает.
Нитраты встречаются почти во всех видах вод. Большое количество нитратов в поверхностных и подземных водах указывает иногда на загрязнение в прошлом фекальными водами. Значительные количества нитратов содержат некоторые промышленные сточные воды. При современной технологии внесения удобрений в почву растения усваивают только 50 % их, остальные уходят со стоком. Азот поступает в почву в нескольких формах. Нитратная форма вследствие подвижности легко вымывается из почвы. Вода с повышенным содержанием нитратов — потенциальная опасность для здоровья животных и человека. Для воды питьевой (ГОСТ 2874-82) содержание нитратов (NO3) должно составлять не более 45 мг/л. Предельно допустимая концентрация (ПДК) нитратов (по азоту) в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования составляет (по ЛПВ)
В производственных сточных водах, а также сельскохозяйственных водах (стоки от животноводческих ферм) содержание нитратов может достигать до 1000 мг/л. Такая сточная вода должна подвергаться очистке на сооружениях перед ее сбросом в поверхностный водоем или повторном использовании в производстве. Внесение больших доз нитратов при несбалансированности по фосфору, калию, молибдену и др. приводит к накоплению нитратов в растениях.
Определение нитратов в грунтовых водах может служить оценкой характера процессов минерализации при фильтровании воды через почвенные соли. При исследовании поверхностных вод по содержанию нитратов можно судить о протекающих процессах самоочищения, а при биологической очистке сточных вод – о процессе нитрификации.
Содержание нитратов в растениях выше 0,5 % представляет потенциальную опасность отравления животных. В кишечнике нитраты способны под действием бактерий переходить в нитриты, которые характеризуются значительной токсичностью. Они способны соединяться с гемоглобином крови вместо кислорода, переводя его в метгемоглобин, препятствующего переносу кислорода кровеносной системой. Это заболевание называется метгемоглобинемией. Поэтому для профилактики загрязнения окружающей среды, особенно в районах высоких норм применения азотных удобрений, необходимо наблюдение за составом грунтовых и поверхностных вод и содержанием в них нитратов.
Вода, забираемая в водопроводную сеть в качестве питьевой, а также для нужд производства, контролируется на содержание нитратов.
В производстве вода, используемая в водооборотных системах, также должна контролироваться на содержание нитратов. Их высокая концентрация может спровоцировать рост водорослей и микроорганизмов в трубопроводах (застойные зоны) и вторичное загрязнение циркулируемой воды в системе продуктами их жизнедеятельности и, соответственно, инициировать процессы биохимической коррозии. Кроме того, биообрастание внутри систем теплообмена снижает теплопередачу и эффективность их работы.
Разработано и применяется несколько способов определения нитратов в воде. Выбор метода зависит от концентрации нитратов и цели исследования.
Хорошие результаты даёт фотометрический метод с применением химического реагента — салицилата натрия. Интервал определяемых концентраций нитратов — 0,1-20 мг/л. Это определение основано на реакции взаимодействия нитратов с салицилатом натрия в среде концентрированной серной кислоты. При этом образуется смесь 3-нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют жёлтую окраску. Фотометрирование желтоокрашенных растворов проводят при длине волны = 410 нм.При необходимости мешающее влияние окрашенных органических веществ устраняют предварительной обработкой пробы суспензией гидроксида алюминия и ее последующего осветления (фильтрования).
1.2. Фотометрический метод анализа
Фотоколориметрический метод анализа основан на измерении интенсивности светового потока, прошедшего через окрашенный раствор (предложен русским ученым В.М. Севергиным, 1795 г.).
Сущность анализа заключается в переводе различных исследуемых соединений (в составе газов, воды и почвы) в раствор с последующим их окрашиванием. Через окрашенный раствор пропускают световой поток и по светопоглощению такого окрашенного раствора определяют содержание окрашенного исследуемого соединения в анализируемом растворе.
Зависимость между интенсивностью окрашивания раствора и содержанием в нем окрашенного соединения может быть выражена зависимостью
| (закон Бугера-Ламберта-Бера), где, | (1) |
— интенсивность света, прошедшего через окрашенный раствор;
— интенсивность падающего света;
— коэффициент поглощения света (зависит от природы окрашенного вещества);
— концентрация окрашенного вещества в растворе;
— толщина слоя светопоглощающего раствора, см.
Если прологарифмировать уравнение (1) и изменить знаки на обратные, то уравнение примет вид:
— называют оптической плотностью (Д) раствора, которая прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Прибор для фотоколориметрии – ФЭК (фотоэлектроколориметр).
В состав прибора КФК-2 входятLоптическая система) — источник света, светофильтры, линзы, фотоэлемент, преобразователь светового потока в электросигнал на гальванометре, гальванометр, кюветодержатель, ручки (чувствительность и длина волны), набор кювет для растворов.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Устройство и принцип работы фотоэлектроколориметра (КФК-2)
КФК-2 является однолучевым прибором и предназначен для измерения коэффициентов пропускания (в диапазоне длин волн 315-980 нм) и абсорбционности растворов. Пределы измерения коэффициентов пропускания от 100 до 5 % .
На рис. 1 приведена оптическая схема КФК-2.
Рис. 1 Оптическая схема КФК-2
1 — лампа накаливания ; 2 — конденсоры; 3 — диафрагма; 4,5 — объективы; 6,7,8 – светофильтры; 9,11 – защитные стекла ; 10 – кювета с раствором; 12 – фотодиод ; 13 – светофильтр ; 14 – делительная пластина ;15 – фотоэлемент.
Колориметр включают в сеть за 15 минут до начала измерений (кюветное отделение открыто).
Кюветы установленного размера подготавливают к работе следующим образом: рабочие поверхности кювет протирают обезжиривающей смесью. После каждого определения на приборе, кюветы промывают от рабочей смеси дистиллированной водой не менее трех раз и тщательно протирают фильтровальной бумагой.
В приборе КФК используют для измерения две кюветы. Одна – с «холостой» пробой и вторая – для анализа исследуемой пробы. Измерение оптической плотности начинают с «холостой» пробы (Д1), после нее измеряют оптическую плотность окрашенного исследуемого раствора (Д2). Разница между показаниями фиксируется в виде показателя Д – светопропускания. Данная величина будет расти по мере увеличения разницы концентраций «холостой» и контрольной пробами. Графическая зависимость оптической плотности (светопропускания) Д от концентрации анализируемого соединения называется калибровочным графиком. На нем принято указывать дату калибрования на приборе, чувствительность, светофильтр, размер кюветы для раствора.
На приборе левой ручкой устанавливают заданную измерением длину волны (светофильтр), а верхней правой — минимальную чувствительность прибора. В кюветодержатель прибора вставляют кювету с «холостой» пробой (дистиллированная вода + реактивы для определения анализируемого вещества), закрывают крышку кюветного отделения и ручками «чувствительность», «установка 100», «грубо» и «точно» устанавливают ноль по шкале абсорбционности (Д – оптическая плотность). Поворотом ручки кюветодержателя (снизу) кювету с «холостой» пробой заменяют на кювету с рабочим окрашенным раствором. Снимают отсчет по шкале микроамперметра. Измерения одной пробы проводят не менее 3-х раз и окончательное значение измеренной абсорбционности определяют как среднее арифметическое из полученных значений.
2.2. Методика проведения работы
2.2.1. Построение калибровочного графика.
Используя рабочий раствор нитрата калия, согласно таблице 1 готовят серию стандартных растворов, содержащих NO3. Рабочий раствор KNO3 содержит 10 мг/л . Для этого в мерные колбы на 50 мл вносят определенное количество рабочего раствора и доводят дистиллированной водой до метки.
Растворы для приготовления шкалы стандартов при определении
| № колбы | Количество рабочего раствора, мл | Содержание , мг/л |
| 1. | ||
| 2. | 0,2 | |
| 3. | 0,4 | |
| 4. | 0,6 | |
| 5. | 1,0 | |
| 6. | 2,0 | |
| 7. | 3,0 | |
| 8. | 4,0 | |
| 9. | 5,0 | |
| 10. | 6,0 | |
| 11. | 7,0 | |
| 12. | 8,0 | |
| 13. |
В фарфоровые чашки отбирают пробы по 20 мл с различным содержанием NO3, добавляют по 2 мл салицилата натрия и выпаривают на песчаной бане досуха. Затем охлаждают чашки с осадком, добавляют в них по 2 мл концентрированной серной кислоты и оставляют на 10 минут. По истечении этого времени в чашки приливают 15 мл дистиллированной воды, 15 мл раствора едкого натра и сегнетовой соли. Внимание. Реагенты приливать в указанном порядке! Далее полученную смесь количественно переносят в мерные колбы ёмкостью 50 мл, обмывая стенки чашек дистиллированной водой, колбы охлаждают до комнатной температуры.
После охлаждения доводят объём дистиллированной водой до метки и измеряют оптическую плотность растворов при длине 410 нм (фиолетовый фильтр) в кюветах толщиной слоя 5 см. Измерение нужно проводить не позднее, чем через 10 мин. после приливания гидрооксида натрия, в противном случае окраска раствора изменяется.
Для построения калибровочного графика можно сократить количество замеров (колб с пробами) до 4-5 штук.
Калибровочный график строят в координатах: оптическая плотность Д – концентрация нитрат-ионов ( )
2.2.2. Определение нитратов в пробах воды
Проводят анализ проб воды различных источников (по заданию преподавателя).
Перед началом работы необходимо внимательно осмотреть пробу. Если очевидно, что в ней присутствуют окрашенные органические соединения, необходимо отобрать 150 мл пробы, прибавить к ней 3 мл суспензии гидроксида алюминия. После тщательного перемешивания пробу воды отстаивают, затем фильтруют, отбрасывая первые порции фильтрата.
Затем отбирают 20 мл фильтрата и анализируют пробу как указано выше (см. п. 2.2.1.).
Параллельно проводят холостую пробу с 20 мл дистиллированной воды. Результаты анализов заносят в таблицу 2.
2.3. Обработка результатов эксперимента
Обработка результатов измерений ведется МНК с использованием ПЭВМ и представляется в графическом виде (см. рисунок 1) с указанием ошибки в определении ( ).
По полученным данным строится график зависимости оптической плотности Д от концентрации нитратов в пробах (шкала стандартов). На графике приводят данные по условиям анализа (номер светофильтра, толщина кюветы, чувствительность и дату выполнения калибровочного графика).
Рис.2. Калибровочный график
По оптической плотности анализируемых проб воды на калибровочном графике находят содержание нитратов в растворе. По найденным значениям рассчитывают содержание нитрат-ионов в исследуемых пробах (мг/л):
,
где С – концентрация нитрат-ионов, найденная по калибровочной кривой, мг/л;
V – объём пробы, взятой для анализа, мл.
Результаты анализа и расчета концентрации нитратов в пробах воды приводят в таблицу 2.
Результаты анализа воды различного происхождения
| № п/п | Образец пробы воды | Оптическая плотность, Д | Концентрация нитратов, , мг/л |
| Вода водопроводная сырая | |||
| Вода водопроводная кипяченая | |||
| Сточная вода НПЗ | |||
| Сточная вода химкомбината |
1. Построить калибровочный график.
2. Провести анализ проб воды различных источников (по заданию преподавателя).
3. На основании результатов анализа сделать вывод о качестве воды и ее пригодности для целевого использования (питьевое снабжение, водооборотная система производства, сброс в поверхностный водоем).
1. Опасно ли использовать воду как питьевую, если в ней содержание нитратов 35 мг/л?
2. Устройство и принцип работы фотоэлектроколориметра.
3. Теоретические основы колориметрии.
4. Принцип построения калибровочного графика. Точность определения анализируемого компонента.
5. С каким содержанием нитратов (после сооружений очистки сточных вод) можно сбрасывать очищенную сточную воду в поверхностный водоем?
6. Почему вводят ограничения на содержание в воде нитратов?
1. Перед работой ознакомиться с устройством и принципом работы фотоэлектроколориметра (КФК).
2. Всю работу с фарфоровыми чашками проводить только в вытяжном шкафу при включенной тяге.
3. С реактивами работать в резиновых перчатках.
4. Отбор серной кислоты проводить под тягой с помощью пипетки.
5. Реагенты приливать в строго указанном порядке.
6. По окончании работы вымыть руки с мылом.
ОПРЕДЕЛЕНИЕ ФОСФАТОВ В ПРИРОДНОЙ И СТОЧНОЙ ВОДЕ
В сточных водах, как и в природных водах, фосфор может присутствовать в различных видах. В жидкой фазе анализируемой воды он может быть в виде ортофосфорной кислоты и её ионов ( ), в виде мета-, пиро- и полифосфатов органических соединений (нуклеиновых кислот, нуклеопротеиды, фосфоролипиды и др.)
При взаимодействии ортофосфат-ионов с молибдатом в кислой среде образуется жёлтая гетерополикислота, которая под действием восстановителей превращается в интенсивно окрашенное синее соединение. Восстановление можно проводить оловом или аскорбиновой кислотой.
Восстановление аскорбиновой кислотой, сравнительно слабым восстановителем, происходит только при повышенной температуре, т.е. в условиях, когда полифосфат и органические эфиры фосфорной кислоты гидролизуются с образованием ортофосфорной кислоты. Для ускорения реакции при комнатной температуре и интенсификации окраски вводят соль сурьмы (антимонилтартрат калия – КSbH4O6·0,5H2O).
Мешающие вещества. Сильнокислые и сильнощелочные пробы предварительно нейтрализуют. Определению мешают сульфиды и Н2S, в концентрации, превышающих 3 мг/л. Мешающие влиянию можно устранить, прибавляя несколько мг КMnО4 на 100 мл пробы и встряхивая 1-2 мин; раствор должен быть розовым. Затем прибавляют требуемые для определения реактивы, но в обратном порядке: сначала раствор аскорбиновой кислоты, перемешивают и вливают раствор молибтана.
Для устранения влияния нитритов вводят сульфаминовой кислоты, которую вводят в состав применяемого реактива. При большом содержании железа следует ввести эквивалентное количество ЭДТА.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию фосфатов определяем в питьевой и сточной воде.
К 50 мл пробы, профильтрованной в день отбора через мембранный фильтр № 1 или через плотный бумажный фильтр (синяя лента), приливают 2 мл смешанного раствора через короткое время – 0,5 мл раствора аскорбиновой кислоты (в присутствии мешающих веществ, реактивы приливают в обратном порядке). Смесь перемешивают. Одновременно проводят холостое определение с 50 мл дистиллированной воды. Через 15 мин (20 мин.) определяют оптическую плотность. Измерение проводят при = 800 нм или при максимально возможном для данного прибора значении.
Содержание растворённых неорганических фосфатов (мг/л) ( ) определяют по формуле:
где С – концентрация фосфатов, определённая по калибровочной кривой, мг/л;
V – объём пробы, взятой для анализа, мл.
В диапазоне концентраций до 1 мг/л результаты округляют до сотых долей мг/л, свыше 1 мг/л – до десятых долей мг/л.
Построение калибровочного графика
Берут 0; 1,0; 2,5; 5,0…..50,0 мл рабочего стандартного раствора 2 фосфата калия, разбавляют каждый раствор до 50 мл дистиллированной Н2О и далее продолжают, как в ходе определения (общее содержание растворённых ортофосфатов, найденных экспериментально, выражают в мг/л ).
Измеряют оптическую плотность и строят график зависимости оптической плотности от концентрации ионов фосфорной кислоты.
Построение калибровочной кривой.
| Реактивы | Номер мерной колбы | |||||
| Количество ст. раствора 2, мл | 1,0 | 2,5 | 5,0 | 10,0 | ||
| Количество дист. Н2О, мл | 49,0 | 47,5 | 45,0 | 40,0 | 25,0 | |
| Содержание , мг/л | 0,02 | 0,05 | 0,1 | 0,2 | 0,5 | 1,0 |
1. Построить калибровочную кривую в диапазоне 0-1 мг/л (табл.1).
2. Провести определение фосфата в водопроводной воде (сравнить данные с ГОСТ на воду питьевую).
3. Рассчитать и построить калибровочную кривую на содержание фосфатов до 50 мг/л.
4. Провести определение содержание в пробе сточной воды (с учётом мешающего влияния отдельных компонентов сточной воды).
Давление насыщенного водяного пара
при температурах от 10 до 39 °С
| , °C | , мм.рт.ст. | , °C | , мм.рт.ст. | , °C | , мм.рт.ст. |
| 9.2 9.8 10.5 11.2 12.0 12.8 13.6 14.5 15.5 16.5 | 17.5 18.7 19.8 21.1 22.4 23.8 25.2 26.7 28.3 30.0 | 31.8 33.7 35.7 37.7 39.9 42.2 44.6 47.1 49.7 52.4 |
| Формула | Плотность, г/см 3 | Формула | Плотность, г/см 3 | Формула | Плотность, г/см 3 |
| Al Be Cd Co Cr Cu Fe | 2.70 1.85 8.64 8.80 7.16 8.93 7.86 | Mg Mn Mo Nb Ni Pb Si | 1.74 7.30 10.23 8.56 8.90 11.34 2.00 | Sn Ta Ti V W Zn Zr | 7.30 16.60 4.54 6.11 19.3 7.14 6.50 |
Десятибалльная шкала коррозионной стойкости металлов
| Группа стойкости | Скорость коррозии металла, мм/год | Балл |
| Совершенно стойкие Весьма стойкие Стойкие Пониженно-стойкие Малостойкие Нестойкие | Менее 0,001 Свыше 0,001 до 0,005 Свыше 0,005 до 0,01 Свыше 0,01 до 0,05 Свыше 0,05 до 0,1 Свыше 0,1 до 0,5 Свыше 0,5 до 1,0 Свыше 1,0 до 5,0 Свыше 5,0 до 10,0 Свыше 10,0 |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8396 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
«Количественный химический анализ вод. Методика выполнения измерений массовой концентрации нитрат-ионов в природных и сточных водах фотометрическим методом с салициловой кислотой. ПНД Ф 14.1:2.4-95»
Документ по состоянию на август 2014 г.
Утверждаю
Заместитель Министра
охраны окружающей среды
и природных ресурсов
Российской Федерации
В.Ф.КОСТИН
20 марта 1995 года
Методика допущена для целей государственного экологического контроля.
Методика рассмотрена и одобрена Главным управлением аналитического контроля и метрологического обеспечения природоохранной деятельности (ГУАК) и Главным метрологом Минприроды РФ.
В соответствии с требованиями ГОСТ Р ИСО 5725-1-2002 — ГОСТ Р ИСО 5725-6-2002 и на основании свидетельства о метрологической аттестации N 224.01.03.012/2004 в МВИ внесены изменения. (Протокол N 1 заседания НТС ФГУ «ФЦАМ» МПР России от 03.03.2004).
Методика предназначена для выполнения измерений массовой концентрации нитрат-ионов в диапазоне 0,1 — 10,0 мг/куб. дм в природных и сточных водах фотометрическим методом.
Если массовая концентрация нитрат-иона в анализируемой пробе превышает верхнюю границу, то допускается разбавление пробы таким образом, чтобы концентрация нитрат-иона соответствовала регламентированному в таблице 1 диапазону.
Мешающие влияния, обусловленные присутствием взвешенных, окрашенных органических веществ, хлоридов в количествах, превышающих 200 мг/куб. дм, нитритов при содержании свыше 2,0 мг/куб. дм, железа в концентрациях более 5,0 мг/куб. дм, устраняются специальной подготовкой пробы (см. п. 7.4).
Фотометрический метод определения массовой концентрации нитрат-иона основан на взаимодействии нитрат-ионов с салициловой кислотой с образованием желтого комплексного соединения.
Настоящая Методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведенных в таблице 1.
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Спектрофотометр или фотоэлектроколориметр, позволяющие измерять светопоглощение при значениях лямбда = 410 нм.
ГСО с аттестованным содержанием нитрат-ионов.
Кюветы кварцевые с толщиной поглощающего слоя 20 мм.
Весы лабораторные, 2 кл. точности ГОСТ 24104.
Внесены дополнения и изменения согласно протоколу N 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Стаканчики для взвешивания СВ ГОСТ 25336.
Пробирки колориметрические П-2-10-0,1 ХС ГОСТ 1770.
Сушильный шкаф электрический ОСТ 16.0.801.397.
Чашки выпарительные фарфоровые ГОСТ 9147.
Фильтры обеззоленные ТУ 6-09-1678.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 500 — 1000 куб. см для отбора и хранения проб.
Калий азотнокислый ГОСТ 4217.
Калий двухромовокислый ГОСТ 4220.
Квасцы алюмоаммонийные ГОСТ 4238.
Квасцы алюмокалиевые ГОСТ 4329.
Активированный уголь БАУ-Э, ТУ 6-16-3075.
Аммоний сернокислый ГОСТ 3769.
Спирт этиловый ГОСТ 18300.
Салициловая кислота ГОСТ 624.
Натрий салициловокислый ГОСТ 17628 .
Внесены дополнения и изменения согласно протоколу N 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Натрия гидроокись ГОСТ 4328.
Калий-натрий виннокислый 4-водный (Сегнетова соль) ГОСТ 5845.
Серебро сернокислое ТУ 6-09-3703.
Вода дистиллированная ГОСТ 6709.
Все реактивы должны быть квалификации х.ч. или ч.д.а. и не содержать примесей нитрат-ионов.
4.1. При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007.
4.2. Электробезопасность при работе с электроустановками по ГОСТ 12.1.019.
4.3. Организация обучения работающих безопасности труда по ГОСТ 12.0.004.
4.4. Помещение лаборатории должно соответствовать пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического и спектрофотометрического анализов, изучивший инструкцию по работе с соответствующими приборами.
Измерения проводятся в следующих условиях:
температура окружающего воздуха (20 +/- 5) °С;
относительная влажность (80 +/- 5)%;
атмосферное давление (84 — 106) кПа (630 — 800 мм рт. ст.);
частота переменного тока (50 +/- 1) Гц;
напряжение в сети (220 +/- 10) В.
Бутыли для отбора и хранения проб воды обезжиривают раствором СМС, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб» .
Внесены дополнения и изменения согласно протоколу N 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Пробы воды (объем не менее 200 куб. см) отбирают в стеклянные или полиэтиленовые бутыли, предварительно ополоснутые отбираемой водой.
Если определение нитратов производят в день отбора пробы, то консервирование не требуется.
Проба воды не должна подвергаться воздействию прямого солнечного света. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую сохранность и предохраняющую от резких перепадов температуры. При отборе проб составляют сопроводительный документ по утвержденной форме, в котором указывают:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
Основной раствор нитрат-ионов.
Навеску (0,1631 г) калия азотнокислого, предварительно высушенного при 105 °С, помещают в стакан вместимостью 100 куб. см, растворяют в 50 куб. см дистиллированной воды, переносят в мерную колбу вместимостью 1000 куб. см и доводят до метки дистиллированной водой.
1 куб. см содержит 0,1 мг нитрат-ионов. Раствор устойчив в течение 3 мес.
При наличии ГСО: раствор готовят в соответствии с прилагаемой к образцу инструкцией.
1 куб. см раствора должен содержать 0,1 мг нитрат-ионов.
Рабочий раствор нитрат-ионов.
10,0 куб. см основного раствора нитрат-ионов переносят в мерную колбу на 100 куб. см и доводят до метки дистиллированной водой.
1 куб. см раствора содержит 0,01 мг нитрат-ионов. Раствор готовят в день проведения анализа.
Раствор гидроксида натрия и сегнетовой соли.
400 г гидроксида натрия и 60 г сегнетовой соли помещают в стакан вместимостью 1000 куб. см, растворяют в 500 куб. см дистиллированной воды, охлаждают, переносят в мерную колбу вместимостью 1000 куб. см и доводят до метки дистиллированной водой .
Внесены дополнения и изменения согласно протоколу N 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Раствор салициловой кислоты (о-гидроксибензойной).
Навеску (1,0 г) салициловой кислоты помещают в стакан вместимостью 100 куб. см, растворяют в 50 куб. см этилового спирта, переносят в мерную колбу вместимостью 100 куб. см, доводят до метки этиловым спиртом. Раствор готовят в день использования.
Натрий салициловокислый, 0,5%-ный раствор .
Навеску (0,5 г) натрия салициловокислого растворяют в 100 куб. см дистиллированной воды. Раствор готовят в день использования .
Внесены дополнения и изменения согласно протоколу N 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Суспензия гидроксида алюминия.
125 г алюмоаммонийных или алюмокалиевых квасцов растворяют в 1 куб. дм дистиллированной воды, раствор нагревают до 60 °С и медленно при непрерывном перемешивании прибавляют 55 куб. см концентрированного раствора аммиака. Дают смеси отстояться около 1 часа, фильтруют и промывают осадок гидроксида алюминия многократной декантацией дистиллированной водой до полного удаления свободного аммиака.
В ряд колориметрических пробирок на 10 куб. см отбирают последовательно пипеткой 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 куб. см рабочего раствора нитрат-иона (0,01 мг/куб. см) и доводят дистиллированной водой до метки. Содержание нитрат-ионов в растворах соответственно равно 0,1; 0,5; 1,0; 2,0; 4,0; 6,0; 10,0 мг/куб. дм .
Внесены дополнения и изменения согласно протоколу N 23 заседания НТК ФГУ «ЦЭКА» МПР России от 30 мая 2001 г.
Растворы переносят в фарфоровые чашки, добавляют 2 куб. см раствора салициловой кислоты (или 2 куб. см раствора натрия салициловокислого) и выпаривают в фарфоровой чашке на водяной бане досуха. После охлаждения сухой остаток смешивают с 2 куб. см серной кислоты и оставляют на 10 мин. Затем содержимое чашки разбавляют 10 — 15 куб. см дистиллированной воды, приливают приблизительно 15 куб. см раствора гидроксида натрия и сегнетовой соли, переносят в мерную колбу вместимостью 50 куб. см, смывая стенки чашки дистиллированной водой, охлаждают колбу в холодной воде до комнатной температуры, доводят дистиллированной водой до метки и полученный окрашенный раствор сразу фотометрируют при лямбда = 410 нм в кюветах с толщиной поглощающего слоя 20 мм. Одновременно с обработкой градуировочных растворов проводят «холостой опыт» с дистиллированной водой, который используют в качестве раствора сравнения.
Градуировочный график строят методом наименьших квадратов в координатах: А — оптическая плотность; С — концентрация нитрат-ионов в градуировочном растворе (мг/куб. дм).
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал или при смене партий реактивов. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 7.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
Пробу объемом 150 куб. см обрабатывают как указано в п. 7.4. Для анализа используют фильтрат. Его объем может составлять 5,0 — 10 куб. см в зависимости от концентрации нитрат-ионов в воде. Далее поступают, как описано в пункте 7.6. При анализе пробы воды выполняют не менее двух параллельных определений.
Содержание нитрат-ионов, Х, мг/куб. дм, вычисляют по формуле:
При невыполнении условия (1) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно разделу 5 ГОСТ Р ИСО 5725-6.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 3.
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно разделу 5 ГОСТ Р ИСО 5725-6.
Примечание. При представлении результата анализа в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата анализа;
— способ определения результата анализа (среднее арифметическое значение или медиана результатов параллельных определений).
10.2. В том случае, если массовая концентрация нитрат-ионов в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление пробы таким образом, чтобы массовая концентрация нитрат-ионов соответствовала регламентированному диапазону.
Контроль качества результатов анализа при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры анализа (на основе оценки погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов анализа (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности, погрешности).
При невыполнении условия (2) контрольную процедуру повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
При невыполнении условия (3) контрольную процедуру повторяют. При повторном невыполнении условия (3) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Периодичность оперативного контроля процедуры анализа, а также реализуемые процедуры контроля стабильности результатов анализа регламентируют в Руководстве по качеству лаборатории.
источник
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Нитриты являются промежуточным продуктом биологического окисления аммиака или восстановления нитратов. В поверхностных водах нитриты окисляются до нитратов. Нитриты в больших количествах находятся в некоторых промышленных и биологически очищенных сточных водах.
Для определения нитритов в сточных и поверхностных водах применяется фотометрический метод, основанный на реакции образования азокрасителя с реактивом Грисса. Реактив Грисса состоит из растворов сульфаниловой кислоты и 1-нафтиламина в 30% уксусной кислоте. Нитриты с сульфаниловой кислотой дают соль диазония, которая с 1-нафтиламином в кислой среде образует азокраситель красного цвета (λ max 520 нм):
Вследствие нестойкости нитритов (так как превращение нитритов в нитраты или аммиак под действием микроорганизмов происходит непрерывно) их следует определять, не консервируя не позже чем через 4 ч после отбора пробы. Если это невозможно, то пробу хранят при 4oС в холодильнике (анализ проводят в течение суток) или консервируют 2-3 мл хлороформа, и в этом случае анализ проводят в течение 1- 2 сут после отбора пробы. Без разбавления пробы можно определять от 0,001 до 0,6 мг/л нитрит-ионов.
Определению мешают взвешенные вещества и мутность воды, поэтому пробу перед анализом необходимо профильтровать. Если сточная вода содержит коллоидные вещества, пробу осветляют коагулированием гидроксидом алюминия. В анализируемой пробе не должны присутствовать сильные окислители и восстановители, которые мешают определению. Мешающее влияние железа (III), ртути (II), висмута, сурьмы (III), свинца устраняют соответствующим разбавлением. Медь (II) снижает результаты определения вследствие вызываемого ею каталитического распада диазотированной сульфаниловой кислоты. В присутствии меди пробу также разбавляют. В анализируемой пробе также не должны присутствовать алифатические и ароматические амины, которые реагируют с нитритами.
Для построения калибровочного графика используют стандартный раствор нитрита натрия.
Нитраты встречаются почти во всех видах вод. Значительное количество нитратов содержат некоторые промышленные сточные воды. Для определения нитратов в сточных водах чаще всего применяют фотометрические методы, основанные на нитровании салициловой кислоты или 2,4-фенолдисульфокислоты. Определение с салициловой кислотой основано на реакции нитратов с салицилатом натрия в концентрированной трихлоруксусной кислоте с последующим добавлением раствора гидроксида натрия и образованием натриевой соли нитросалициловой кислоты, окрашенной в желтый цвет (λmax 410 нм). В среде трихлоруксусной кислоты устраняется мешающее влияние некоторых неустойчивых органических веществ, которое наблюдается при применении концентрированной серной кислоты:
 |
Метод позволяет определять нитраты при концентрациях от 0,1 до 20 мг/л. Большие концентрации можно определять указанным методом при соответствующем разбавлении пробы. Пробу не консервируют, анализ проводят не позже чем через 4 ч после отбора пробы. В противном случае пробу консервируют 1 мл концентрированной серной кислоты или 2- 4 мл хлороформа на 1 л пробы воды, анализ проводят не позже 1-2 сут после отбора пробы.
Мешающее влияние нитритов, ионов железа и других катионов устраняют пропусканием пробы через колонку с катионитом. Расчет проводят по калибровочному графику, для построения которого используют стандартный раствор нитрата калия.
Определение с 2,4-фенолдисульфокислотой основано на взаимодействии нитратов с указанным реактивом с образованием нитропроизводного 2,4-фенолдисульфокислоты желтого цвета. Окраска интенсивнее в щелочной среде при добавлении раствора аммиака (λ max 410 нм):
Аммонийная соль нитропроизводного фенолдисульфокислоты
Способы консервации и сроки анализа пробы такие же, как в определении с салициловой кислотой. Если исследуемая вода мутная или окрашенная, ее предварительно обесцвечивают и осветляют гидроксидом алюминия. Определению мешают хлориды, влияние которых устраняют добавлением сульфата серебра. Выпавший осадок хлорида серебра отфильтровывают лишь в том случае, если в пробе содержится много хлоридов. При небольшом количестве хлоридов осадок AgCl растворяется в растворе аммиака при его добавлении к полученному нитропроизводному 2,4-фенолдисульфокислоты. Для построения калибровочного графика используют стандартный раствор нитрата калия.
В некоторых промышленных сточных водах содержится значительное количество аммиака и солей аммония, являющихся отходами производства, в том числе и химико-фармацевтических предприятий. Для определения аммиака используются:
-метод непосредственного фотоэлектроколориметрического определения с реактивом Несслера;
-метод отгонки с фотоэлектроколориметрическим или объемным окончанием;
-метод фотометрического определения с гипохлоритом и фенолом.
Если пробы анализируют не сразу после отбора, то их консервируют прибавлением 1 мл концентрированной серной кислоты или 2-4 мл хлороформа и анализируют не позже чем через 1-2 сут после отбора.
Фотоэлектроколориметрическое определение аммиака с реактивом Несслера. Метод основан на взаимодействии аммиака или ионов аммония с реактивом Несслера (K2HgI4 + КОН) с образованием йодида меркураммония желтого цвета (λ max 400-425 нм, фиолетовый светофильтр):
Нижний предел определения равен 0,05 мг ионов аммония в 1 л. Без разбавления можно определять не более 4 мг ионов аммония в 1 л воды. Расчет проводят по калибровочному графику, который строят по стандартному раствору хлорида аммония. Определение с отгонкой и фотометрическим или объемным окончанием. Аммиак перегоняют из щелочной среды и определяют в дистилляте фотоэлектроколориметрическим методом с реактивом Несслера (см. выше) или объемным методом. При определении объемным методом пробу подщелачивают либо фосфатным буферным раствором до рН 7,4 (биологически очищенные сточные воды), либо раствором гидроксида натрия (фенольные сточные воды). Подщелачивание гидроксидом натрия неприменимо для вод, содержащих белковые или другие вещества, выделяющие аммиак.
В зависимости от содержания в пробе аммиака для его поглощения в приемнике применяют серную кислоту различной нормальности или борную кислоту. Количество серной кислоты, израсходованной на нейтрализацию перегнанного аммиака, определяют обратным титрованием раствором гидроксида натрия (а); при использовании борной кислоты перегнанный аммиак определяют прямым титрованием тетрагидроксибората аммония серной кислотой. Титруют по метиловому красному или со смешанным индикатором, состоящим из метилового красного и метиленового синего:

H2S04 + 2NaOH Na2S04 + 2H20


Фотометрическое определение с гипохлоритом и фенолом.
Метод основан на образовании индофенолового красителя интенсивно-синего цвета (λ max 630 нм) при взаимодействии аммиака с фенолом в присутствии окислителя гипохлорита натрия. Фенол окисляется гипохлоритом натрия в щелочной среде до п-хинона, который с аммиаком образует хинонимин. Последний при взаимодействии с неокисленным фенолом образует индофенол:
 |
Метод пригоден для определения аммиака и ионов аммония в поверхностных и сточных водах, а также для определения азота после сжигания по Кьельдалю. Без разбавления в пробе можно определить до 5 мг ионов аммония на 1 л. Определение следует проводить в среде, не содержащей аммиака. Мешающее влияние сульфидов, цианидов и роданидов устраняют пропусканием пробы через ионит (анионит).
Расчет проводят по калибровочному графику, который строят по стандартному раствору хлорида аммония.
Общее содержание азота (общий азот)
Содержание общего азота можно определить расчетом или же непосредственно после перевода всех соединений азота в аммиак. Если общий азот не может быть определен в день отбора, то пробу консервируют прибавлением 1 мл концентрированной серной кислоты или 2-4 мл хлороформа на 1 л пробы.
Определение содержания общего азота (х) расчетом проводят по формуле:
где а — концентрация нитратов в мг N/л;
b — концентрация нитритов в мг N/л;
с — концентрация аммиака в мг N/л;
d — концентрация органического азота в мг N/л.
Определение после перевода в аммиак.
Нитраты и нитриты, находящиеся в пробе, восстанавливают водородом в момент выделения до аммиака (аммония):



После восстановления смесь минерализуют концентрированной серной кислотой с сульфатом калия в присутствии катализатора сульфата меди. Этим способом все азотсодержащие соединения переводят в гидросульфат аммония.
К минерализованной пробе, которая находится в колбе Кьельдаля, соединенной с приемником и парообразователем, добавляют гидроксид натрия; выделившийся аммиак отгоняют с водяным паром в приемник с избытком стандартного раствора серной кислоты. Избыток серной кислоты титруют раствором гидроксида натрия:
источник
Количественный химический анализ вод. Методика измерений массовой концентрации нитрат-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с салициловой кислотой
Количественный химический анализ вод. Методика измерений массовой концентрации нитрат-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с салициловой кислотой
- Методика допущена для целей государственного экологического контроля.
- Методика рассмотрена и одобрена федеральным бюджетным учреждением «Федеральный центр анализа и оценки техногенного воздействия (ФБУ «ФЦАО»).
- Разработчик: «Федеральный центр анализа и оценки техногенного воздействия» (ФБУ «ФЦАО»).
- 1. ВВЕДЕНИЕ
- Настоящий документ устанавливает методику измерений массовой концентрации нитрат-ионов в питьевых, поверхностных и сточных водах фотометрическим методом.
- Диапазон измерений от 0,1 до 100 мг/куб. дм.
- Если массовая концентрация нитрат-ионов в анализируемой пробе превышает 10 мг/куб. дм, то пробу необходимо разбавлять.
- Мешающие влияния, обусловленные присутствием взвешенных, окрашенных органических веществ, хлоридов в количествах, превышающих 200 мг/куб. дм, нитритов при содержании свыше 2,0 мг/куб. дм, железа при массовых концентрациях более 5,0 мг/куб. дм, устраняются специальной подготовкой пробы (п. 9.1).
- 2. ПРИПИСАННЫЕ ХАРАКТЕРИСТИКИ ПОКАЗАТЕЛЕЙ ТОЧНОСТИ ИЗМЕРЕНИЙ
- Значения показателя точности измерений — расширенной относительной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
———————————
В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений.
| Диапазон измерений, мг/куб. дм | Суммарная стандартная относительная неопределенность, u, % | Расширенная относительная неопределенность , U при коэффициенте охвата k = 2, % | |
| Питьевые, поверхностные природные воды | |||
| От 0,1 до 3 включ. | 9 | 18 | |
| Св. 3 до 100 включ. | 6 | 12 | |
| Сточные воды | |||
| От 0,1 до 1 включ. | 17 | 34 | |
| Св. 1 до 3 включ. | 15 | 30 | |
| Св. 3 до 100 включ. | 11 | 22 | |
———————————
Соответствует характеристике погрешности при доверительной вероятности P = 0,95.
Примечания.
1. Допускается использование других средств измерений утвержденных типов, обеспечивающих измерения с установленной точностью.
2. Допускается использование другого оборудования с метрологическими и техническими характеристиками, аналогичными указанным.
3. Средства измерений должны быть поверены в установленные сроки.
Примечания.
1. Все реактивы, используемые для измерений, должны быть квалификации ч.д.а. или х.ч.
2. Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
| Факторы пробы | Устранение |
| 1. Взвешенные, окрашен. орган. в-ва. Железо (> 5 мг/куб. дм) | К 150 куб. см пробы добавляют 3 куб. см гидроксида алюминия, пробу перемешивают, дают отстояться и фильтруют через фильтр «белая лента», отбрасывая первую порцию фильтрата |
| 2. Хлориды (> 200 мг/куб. дм) | В ходе измерений добавляют сернокислое серебро в количестве, эквивалентном содержанию хлорид-ионов. Осадок хлорида серебра отфильтровывают через фильтр «белая лента» |
| 3. Нитриты (> 2 мг/куб. дм) | К 20 куб. см пробы добавляют 0,05 г сернокислого аммония и упаривают досуха на водяной бане, доводят до первоначального объема дистиллированной водой |
| Диапазон измерений, мг/куб. дм | Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, % | |
| Питьевые, поверхностные природные воды | ||
| От 0,1 до 3 включ. | 14 | |
| Св. 3 до 100 включ. | 8 | |
| Сточные воды | ||
| От 0,1 до 1 включ. | 25 | |
| Св. 1 до 3 включ. | 22 | |
| Св. 3 до 100 включ. | 20 | |
Примечание.
При представлении результата измерений в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерений;
— способ определения результата измерений (среднее арифметическое значение или медиана результатов параллельных определений).
источник