Сущность метода заключается в титровании пробы стандартным раствором кислоты в присутствии индикаторов фенолфталеина или метилового оранжевого.
Чувствительность метода 50 мкг-экв./дм 3 .
Диапазон определяемых значений — от 0,5 до 20 мг-экв./л.
Комплектация рассчитана на проведение 1000 определений.
Необходимые для проведения анализа приборы и материалы:
Колбы мерные 2-1000-2 по ГОСТ 1770.
Колбы Кн-250 ТХС по ГОСТ 25336Е.
Цилиндры мерные вместимостью 100 см 3 по ГОСТ 1770
Воронка коническая стеклянная по ГОСТ 23932.
Бюретка 1-2-25-0,1 по ГОСТ 29251.
Вода дистиллированная по ГОСТ 6709 (вода обессоленная, конденсат).
Состав набора:
Кислота соляная, стандарт-титр для приготовления раствора с концентрацией 0,1 г-экв./дм 3 .
Метиловый оранжевый, индикатор, 0,1% водный раствор по ГОСТ 4919.1.
Фенолфталеин, индикатор, сухая смесь, по ГОСТ 4919.1.
Реактивы, входящие в состав набора, проверяются на соответствие требованиям действующих стандартов и технических условий.
Поправочные коэффициенты на нормальность стандартных растворов находятся в пределах 1±0,003.
Приготовление рабочих растворов.
Перед проведением анализа необходимо приготовить раствор соляной кислоты.
Для приготовления раствора соляной кислоты необходимо количественно перенести содержимое ампулы в мерную колбу, растворить примерно в 800-900 мл дистиллированной воды, хорошо перемешать и довести объем раствора до метки дистиллированной водой.
Время, затрачиваемое на проведение операции — около 20 минут.
Поправочный коэффициент для растворов, приготовленных из стандарт-титров, равен единице.
Готовый раствор перелить в емкости для хранения.
Проведение анализа.
1. В чистую коническую колбу Кн 2-250 мерным цилиндром отмеряют 100 см 3 анализируемой воды и прибавляют индикатор фенолфталеин.
Если проба имеет розовую окраску, ее титруют стандартным раствором соляной кислоты до обесцвечивания раствора. Результат титрования заносят в журнал. После чего к пробе прибавляют 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
Если после прибавления к пробе фенолфталеина окрашивание не проявляется. К пробе следует сразу прибавить 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
2. Окрашенную в желтый цвет пробу титруют стандартным раствором соляной кислоты до перехода окраски в апельсиновую.
3. Величина щелочности определяется по формулам:
Щфф — щелочность пробы по фенолфталеину, мг-экв./дм 3 ;
афф — расход кислоты на титрование с индикатором фенолфталеином, см 3
С — концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V — объем взятой на титрование пробы, см 3 .
Щмо — щелочность пробы по метиловому оранжевому (общая щелочность), мг-экв./дм 3 ;
амо — расход кислоты на титрование с индикатором метиловым оранжевым (в случае последовательного титрования за объем кислоты, пошедший на титрования с метиловым оранжевым берется суммарный расход кислоты с начала титрования), см 3 ;
С — концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V — объем взятой на титрование пробы, см 3 .
источник
Сущность метода. В основе метода определения общей щелочности воды лежит принцип образования нейтральных солей при взаимодействии кислоты с гидратами, гидрокарбонатами и карбонатами щелочных и щелочнозечельных металлов, а также свойство различных индикаторов изменять свой цвет в зависимости от величины рН.
Учитывая эти свойства, исследуемую пробу воды подвергают титрованию раствором соляной или серной кислоты требуемой концентрации в присутствии индикаторов фенолфталеина и метилоранжа.
Применяемые реактивы:
децинормальный (0,1 н.) раствор соляной или серной кислоты;
1%-ный спиртовый раствор фенолфталеина для определения гидратной и карбонатной щелочности;
0,1%-ный раствор метилоранжа, служащий индикатором при определении карбонатной и гидрокарбонатной щелочности.
Подготовка_пробы воды. При титровании воды кислота вступает во взаимодействие как со щелочами, так и с веществами, которые могут находиться в воде во взвешенном состоянии и которые не обусловливают щелочность воды. Чтобы уменьшить расход кислоты на ненужные реакции и обеспечить правильность определения щелочности, анализируемую пробу охлаждают до 20°С, если она была горячей, и пропускают через бумажный фильтр.
Порядок анализа. К 100 мл соответственно подготовленной для титрования пробы воды добавляют 2-3 капли фенолфталеина.
При окрашивании пробу титруют раствором соляной или серной кислоты соответствующей нормальности (0,1 н. или 0,01 н.) до исчезновения окраски. Титрование проводят медленно, тщательно перемешивая пробу воды.
Количество 0,1 н. или 0,01 н. раствора соляной или серной кислоты, пошедшее на титрование с фенолфталеином, записывают с пометкой «фф». Если в процессе прибавления фенолфталеина окрашивания не наступает, значит, в воде отсутствуют гидратная и карбонатная щелочности. В этом случае титровать пробы воды раствором кислоты не нужно, так как щелочность по фенолфталеину отсутствует.
После этого в эту же пробу добавляют 2-3 капли метилоранжа и титруют 0,1 н. или 0,01 н. раствором кислоты до перехода окраски пробы из желтой в оранжевую. Количество раствора кислоты, пошедшее на титрование с метилоранжем, записывают с пометкой «МО».
Для расчета общей щелочности воды берут суммарный расход кислоты, пошедшей на титрование с фенолфталеином и метилоранжем.
Расчет результатов анализа. Расчет результатов анализа основан на том, что каждый 1 мл нормального раствора соляной или серной кислоты оттитровывают 1 мг×экв щелочности. Соответственно этому 1 мл децинорнального (0,1 н.) раствора соляной кислоты оттитровывает 0,1 мг×экв. щелочности, а 1 мл сантинормального (0,01 н.) раствора оттитровывает 0,01 мг×экв щелочности.
Следовательно, общая щелочность воды
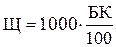
где Щ — общая щелочность воды, мг×экв/кг;
1000 — перерасчет результатов анализа на 1 л воды;
К — коэффициент нормальности раствора кислоты;
Б — суммарный расход кислоты на титрование, мл;
100 -объем пробы воды, взятой для анализа, мл.
При титровании 100 мл пробы воды децинормальным раствором кислоты (0,1 н.) формула упрощается:
При использовании саитинормального раствора кислоты (0,01 н.):
Для воды типа конденсата щелочность принято выражать в микро-грамм эквивалентах на литр (мкг×экв/кг). В этом случае
Щ =Б 0.01 × 1000 × 1000/100
СОСТАВЛЕНИЕ ОТЧЕТА
Для оформления отчета необходимо заполнить табл. 3.
Результаты расчетов
| № | Наименование параметра | По какой формуле определяется | Значение | Размерность |
| Карбонатная жесткость Некарбонатная жесткость Общая жесткость метод титрования метод комплексометрический Окисляемость Общая щелочность Сухой остаток Класс жесткости | табл.2 |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем обусловлена и в каких единицах измеряется карбонатная жесткость?
2. Чем обусловлена и в каких единицах измеряется некарбонатная жесткость?
3. Что такое общая жесткость?
4. Как определить класс жесткости воды?
5. Почему карбонатная жесткость устраняется при кипячении? Напишите, какие при этом протекают реакции.
6. Как устраняют жесткость воды в промышленных условиях?
7. Как определяют карбонатную жесткость?
8. Как определяют некарбонатную жесткость?
9. Как определяют общую жесткость?
10. Что такое окисляемоеть воды и чем она обусловлена, в каких единицах измеряется?
11. Как определяют окисляемоеть воды?
12. Что такое общая щелочность воды, в каких единицах измеряется?
13. Как определяют щелочность воды?
14. Что такое сухой остаток, в каких единицах измеряется и как определяется?
источник
Лабораторная работа №3
Взятие пробы воды для анализа
Для правильного суждения о качестве воды необходимо соблюдать следующие требования:
1. Брать пробы воды для анализа нужно из точно установленных мест, указанных в водном режиме котельной установи.
2. Если воду берут из трубопровода, то перед взятием пробы следует застоявшуюся воду слить в течение 2-3 минут.
3. Посуда, в которую берут пробу воды, должна быть чистой, ее следует 1-2 раза ополоснуть водой из-под крана, откуда берется проба.
4. Анализы качества котловой воды и теплого ящика проводятся ежесуточно, котельного танка (общая жесткость и содержание хлоридов) 1 раз в 5-7 суток. Полученные результаты фиксируются в журнале.
Проведение испытания
Водородный показатель (pH)
1.1 Метод определения и характеристики
Недородный показатель воды (pH, отрицательный десятичный логарифм концентрации водородных ионов) определяется двумя методами визуально-колориметрическим и потенциометрическим.
При визуально-колориметрическом определении, основанном на реакции ионов водорода с универсальным индикатором (ГД 24.031.120-91, РД 24.032.01-91), pH анализируемой воды определяют визуально сравнением окраски пробы с окраской образцов на контрольной шкале. Диапазон определяемых значений pH составляет 4,5-11,0 при точности анализа ±0,5 ед. pH.
Объём пробы для определения составляет 5 мл, продолжительность выполнения определения — не более 1 мин.
Принадлежности, реактивы и материалы
Определение выполняется с использованием оборудования из состава навесного ящика №1 СЛКВ, секция №2 «pH» или pH-метра типа pH-410 .
Реактивы:раствор индикатора универсального.
Принадлежности, материалы:контрольная шкала образцов окраски растворов для определения pH (pH 4,5; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0; 10,0; 11,0); полимерная пипетка; пробирка колориметрическая с меткой «5 мл».
Отбор и хранение проб
Отбор проб воды и пара должен проводиться в соответствии с п. 9 настоящего руководства.
Для отбора проб используются бутыли из полимерного материала или стекла. Выполнение определений следует проводить как можно скорее и предпочтительнее на месте отбора пробы. Максимальный рекомендуемый срок хранение проб — не более 6 часов.
1.3 Выполнение определения
1) Ополосните колориметрическую пробирку несколько раз анализируемой водой. Налейте в пробирку анализируемую воду до метки «5 мл».
2) Добавьте полимерной пипеткой 3-4 капли раствора индикатора универсального и встряхните пробирку.
3) Проведите визуальное колориметрирование пробы. Для этого пробирку с пробой поместите на белое поле контрольной шкалы и, освещая пробирку рассеянным белым светом достаточной интенсивности, наблюдайте окраску пробы сверху вниз.
4)Определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение pH. При необходимости повторите определение.
2.1 Метод определения и характеристики
Щелочность воды — показатель, характеризующий содержание в воде соединений, способных реагировать с водородными ионами. К таким соединениям относятся гидроокиси щелочных металлов, карбонаты, гидрокарбонаты и фосфаты щелочных и щелочноземельных металлов, а также соли других слабых кислот.
Метод определения щёлочности является титриметрическим (РД 24.031.120-91, РД 24.032.01-91, РД 34.37.523.7-88). Определение щёлочности воды основано на титровании растворённых в воде щелочных соединений кислотой в присутствии индикаторов, меняющих свою окраску в зависимости от реакции среды. Метод определения щёлочности зависит от вида анализируемой воды и предполагаемого значения щёлочности.
Методом А определяется щёлочность исходной, известкованной, катионированной и питательной вод. Титрование проводят с индикаторами метиловым оранжевым и фенолфталеином при использовании в качестве титранта раствора соляной кислоты 0,1 моль/л. При этом, при титровании с фенолфталеином, определяется свободная щёлочность по фенолфталеину (ЩСВОБ), а при титровании с метиловым оранжевым — общая щелочность (ЩОБЩ). Величина ЩОБЩ условно характеризует суммарное содержание в воде бикарбонатов, карбонатов, гидратов, 2/3 ортофосфатов и гуматов, в то время как ЩСВОБ — гидратов, 1/2 карбонатов, 1/3 ортофосфатов и гуматов.
Методом Вопределяется общая щелочность котловой воды. Титрование проводят со смешанным индикатором для вод, имеющих значительную цветность, а также при титровании при электрическом освещении, при использовании в качестве титранта также раствора соляной кислоты 0,1 моль/л.
Методом С определяется щёлочность воды типа конденсата, т.е. при значении щёлочности менее 0,2 ммоль/кг экв. Титрование проводят со смешанным индикатором или с индикатором метиловым оранжевым, при использовании в качестве титранта раствора соляной кислоты 0,01 моль/л.
Данные по изменению окраски индикаторов в зависимости от pH среды приведены в табл. 3.2.
Отбор и хранение проб
Отбор проб воды и пара проводится в соответствии с требованиями.
Для отбора проб используются бутыли из полимерного материалаили стекла. Выполнение определений рекомендуется пропилить сразу после отбора проб.
Максимальный рекомендуемый срок хранение проб при охлаждении до 2-5°С — не более 24 ч.
Подготовка к определению
Подготовка к определению общей щелочности состоит в приготовлении израсходованного раствора соляной кислоты (0,01 моль/л). Потребитель готовит его самостоятельно, используя раствор соляной кислоты (0,1 моль/л) из состава лаборатории.
Жёсткость общая
3.1 Методы определения и характеристики
Метод определения общей жёсткости как суммарной массовой концентрации эквивалентов катионов кальция и магния — комплексонометрической, основан на реакции образования в щелочной среде (pH = 9) в присутствии индикаторов окрашенных внутрикомплексонных соединений катионов кальция и магния с трилоном Б (двунатриевой солью этилендиаминтетрауксусной кислоты). (РД 24.031.120-91, РД 24.032.01-91, РД 34.37.523.8-88).
В зависимости от предполагаемого значения жёсткости, опредение выполняется тремя методами.
Метод А— титриметрический.Определяется жёсткость природной, известковой и коагулированной воды при величине более 0,1 °Ж. При титровании используется раствор индикатора хром темно-синего и в качестве титранта — раствор трилона Б 0,05 моль/л экв.
Метод Б— титриметрический.Определяется жёсткость любых вод при величине в диапазоне 0,02-0,1 °Ж. При титровании используется раствор индикатора хром тёмно-синего и в качества титранта раствор трилона Б 0,005 моль/л экв.
МетодС — визуально-колориметрический.Определяется жёсткость вод при величине менее 0,02 °Ж. Особенностью данного метода, на первом этапе, является необходимость выбора пары индикатор — буферный раствор, которая для данной исходной (катионированной) воды обеспечивает оптимальный переход окраски от розового к синему, что является индивидуальной особенностью данной исходной воды.
Сравнение окраски анализируемой воды с окраской эталонных растворов позволяет определить фактическое значение жёсткости с чувствительностью 0,001-0,002 °Ж.
Индикаторы кислотный хром тёмно-синий и эриохром чёрный Т образуют с катионами солей жёсткости непрочные окрашенные соединения красного цвета. При добавлении в воду с подобными окрашенными соединениями раствора трилона Б в точке эквивалентности происходит их полное разрушение, при этом раствор становится синим.
В присутствии ионов цинка или меди (неотчётливый переход окраски) определение жёсткости проводят с добавлением раствора сульфида натрия, связывающего эти катионы в нерастворимые сульфидные соединения.
Влияние ионов марганца, приводящее к быстрому обесцвечиванию окраски, устраняют добавлением к пробе раствора солянокислого гидроксиламина.
Объём пробы для анализа составляет, в зависимости от метода, от 10 до 100 мл, продолжительность выполнения анализа — не более 15 мин.
Подготовка к определению
Подготовка к проведению анализа заключается в приготовлении расходных растворов из реактивов, входящих в состав лаборатории.
Буферные растворы следует приготавливать с использованием очищенной катионированной воды либо воды, применение которой не приводит к холостому окрашиванию пробы.
Очищенную воду, необходимую для проведения анализа, приготавливают по ОСТ 34.70.953.2-88, либо используют набор для приготовления очищенной воды.
Отбор и хранение проб
Отбор проб воды и пара должен проводиться в соответствии требованиями.
Пробы анализируемой воды следует отбирать в стеклянные бутыли или полимерные бутыли с пробками. Допускается хранение пробы до 24 ч без консервации.
3.4 Выполнение определения
Метод А. Определение общей жёсткости воды более 0,1 °Ж
1. Налейте анализируемую воду в коническую колбу вместимостью 250 мл до метки «100 мл».
2. Добавьте полимерными пипетками 1 мл аммиачного буферного раствора, 7 капель раствора индикатора кислотного хрома тёмно-синего.
3.Медленно титруйте пробу раствором трилона Б (0,05 моль/л экв.), используя бюретку или стойку-штатив с мерной пипеткой вместимостью 10 мл со шприцем-дозатором, до отчётливого изменения цвета с розового на синий.
Примечание.При нечётком переходе окраски или обесцвечивании пробы определение повторите с добавлением к пробе 0,5 мл раствора сернистого натрия для устранения мешающего действия ионов меди и цинка либо трёх капель раствора солянокислого гидроксиламина для устранения мешающего действия соединений марганца.
4Рассчитайте общую жёсткость (Жобщ) в °Ж по формуле:
ЖОБЩ =V × 0,5
На титрование 100 мл пробы воды израсходовано 3,5 мл раствора трилона Б (0,05 моль/л экв.). Общая жёсткость будет составлять:
ЖОБЩ = V × 0,5 = 3,5× 0,5 = 1,75°Ж
4.1 Метод определения и характеристики
Содержание хлоридов (массовая концентрация хлорид- иона) определяется методом аргентометрического титрования (РД 24.031.120-91, РД 24.032.01-91). Определение основано на титровании хлорид-ионов раствором нитрата серебра при pH 5,0- 8,0, в результате чего образуется суспензия практически нерастворимого хлорида серебра. В качестве индикатора используется хромат калия, который реагирует с избытком нитрата серебра с образованием хорошо заметного оранжево-бурого осадка хромата серебра.
Объём пробы для анализа — см. табл. 12, продолжительность выполнения анализа — не более 5 мин.
Отбор и хранение проб
Отбор проб воды и проводится в соответствии с требованиями.
Для отбора проб используются бутыли из полимерного материала или из стекла. Допускается хранение пробы I мес. без консервации.
В зависимости от предполагаемого содержания хлоридов отбираются пробы для анализа в количествах согласно табл. 12.
На титрование 10 мл пробы котловой воды израсходовано 1,1 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов составит:
мг/л.
На титрование 10 мл пробы воды израсходовано 0,02 мл раствора нитрата серебра (0,05 моль/л экв.). Величина израсходованного на титрование объёма раствора нитрата серебра свидетельствует о том, что концентрация хлорид-ионов меньше предполагаемой.
мг/л.
Так как предполагаемая концентрация хлорид-иона оказалась меньше 4,0 мг/л (см. табл. 3.3), на анализ повторно отбирается проба объёмом 6000 мл, которая упаривается до 150 мл (в 40 раз). На титрование упаренной пробы объёмом 150 мл израсходовано 9,5 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов в этом случае составляет:
мг/л.
На титрование 10 мл пробы воды израсходовано 4,82 мл раствора нитрата серебра (0,05 моль/л экв.). Величина израсходованного на титрование объёма раствора нитрата серебра свидетельствует о том, что концентрация хлорид-ионов больше предполагаемой.
мг/л.
Так как предполагаемая концентрация хлорид-иона оказалась Тоньше 700 мг/л (см. табл. 3.3), отобранная проба разбавляется дистиллятом в 10 раз, на анализ берётся объем 10 мл разбавленной пробы. На титрование отобранной пробы израсходовано 0,48 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов в этом случае составляет:
мг/л.
Вопросы для самоконтроля:
1. Дать определения понятиям: главный конденсат, вспомогательный конденсат, дистиллят испарительной установки, дренажи, добавочная вода, питательная вода, котельная вода, котловая вода, продувочная вода, охлаждающая вода.
2. Охарактеризовать основные показатели: Общее содержание примесей, Растворённые вещества, Взвешенные вещества, Остаток после прокаливания, Потеря при прокаливании, Концентрация водородных ионов, Кислотность, Щёлочность, Щелочное число, Общая жёсткость воды, Карбонатная жёсткость, Некарбонатная жёсткость, Cодержание хлоридов, Фосфатное число, Нитратное число, Содержание окислов меди и железа, Содержание кислорода, Содержание нефтепродуктов.
Лабораторная работа №3
Тема: ОПРЕДЕЛЕНИЕ КАЧЕСТВА КОТЛОВОЙ ВОДЫ
Цель:Определение качества котловой воды, изучение норм качества котловой воды, рекомендации по водному режиму.
В пароконденсатном цикле СЭУ с паротурбинной установкой (ПТУ) вода и пар циркулируют по замкнутому контуру, в котором могут быть различные утечки воды или пара, вызывающие периодическое или непрерывное восполнение контура циркуляции технической водой. Поэтому в СЭУ с ПТУ существуют специальные определения воды в различных точках циркуляционного контура:
• главный конденсат – вода после конденсации отработавшего пара на выходе из главного конденсатора;
• вспомогательный конденсат – вода после конденсации отработавшего пара из вспомогательных конденсаторов (после вспомогательных механизмов и теплообменных аппаратов);
• дистиллят испарительной установки – вода, полученная из морской путем её термической дистилляции;
• дренажи – конденсаты после паровых подогревателей топлива и общесудовых потребителей пара;
• добавочная вода – вода, подаваемая в циркуляционный контур для восполнения его в результате утечек (воды и пара);
• питательная вода – вода, подаваемая в паровой котёл для поддержания его паропроизводительности (так же, как и забортная вода, поступающая в камеру испарения водоопреснительной установки);
• котельная вода – питательная вода определённого химического состава, предназначенная исключительно для парового котла, находящаяся в танке котельной воды;
• котловая вода – вода, находящаяся в циркуляционном контуре котла;
• продувочная вода – котловая вода, удаляемая периодически или непрерывно из котла для уменьшения солесодержания в ней взвешенных частиц шлама;
• охлаждающая вода – вода, с помощью которой отводят теплоту через поверхность теплообмена системы охлаждения теплотехнического объекта.
Питательная вода судовых паровых котлов обычно состоит из конденсата отработавшего пара и добавочной воды. Добавочная вода может быть природной, полученной с берега и прошедшей соответствующую водообработку, или дистиллятом от испарительной установки забортной воды. В целом, добавочная вода составляет 2–5 % от общего количества питательной воды.
Вода является одним из лучших природных растворителей органических и минеральных веществ, а также газов. Поэтому она в результате круговорота в природе приобретает множество примесей в виде газов, взвешенных мелкодисперсных частиц и растворенных минералов различного происхождения. Конденсат отработавшего пара на морских судах чаще всего содержит примеси в виде продуктов коррозии трубопроводов или забортной воды при подсосах в трубных решётках конденсаторов, а также – нефтеостатков СЭУ (частицы жидкого топлива и смазочного масла). Поэтому питательной водой, например, для судовых вспомогательных паровых котлов может быть конденсат отработавшего пара или природная вода, содержащая в себе частицы песка и глины, а также растворенные накипеобразователи щелочно-земельных металлов (Ca2+ и Mg2+), такие как бикарбонаты, сульфаты, хлориды и силикаты, а также коррозионно-активные газы – кислород, хлор и углекислый газ.
Поступление в котловую воду любых вышеперечисленных примесей является нежелательным, т. к. это приводит к появлению накипных отложений и коррозии на поверхности нагрева, что увеличивает расход топлива и снижает надежность котельных установок и эффективность их эксплуатации.
В СДВС с высокотемпературной системой охлаждения вышеуказанное также имеет место. Поэтому на морских транспортных судах системы охлаждения ДВС обычно низкотемпературные и двухконтурные. В первом контуре циркуляции для охлаждения СДВС обычно применяют водные растворы ингибиторов коррозии, а во втором – проточную морскую забортную воду.
Техническая эксплуатация СЭУ невозможна без проведения соответствующего водного режима, предусматривающего контроль основных показателей качества воды (водоконтроля) и определенной технологии водообработки. Качество используемой в СЭУ воды в значительной мере определяет надёжность элементов СЭУ и объём трудозатрат на восстановление работоспособности оборудования. Выбор технологии водоподготовки определяется её эффективностью и экономической целесообразностью.
Основными задачами водоподготовки в СЭУ являются: создание условий для предотвращения процессов накипеобразования и коррозии на поверхности нагрева, а также исключение уноса солей с влажным паром из зоны кипения воды. Поэтому каждый инженер-судомеханик должен уметь определять основные показатели качества питьевой и технической воды, а также корректировать водные режимы и технологии водообработки в соответствии с инструкциями по технической эксплуатации судового оборудования.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник
Объемный (количественный) анализ.Объемный метод количественного анализа основан на точном измерении реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называются титрованными, т.к. они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными. Процесс прибавления стандартного титрованного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности, т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества согласно уравнению реакции. Необходимое условие объемного анализа – точная фиксация точки эквивалентности, поэтому используют реакции, конец которых характеризуется определенным внешним признаком (изменение окраски, выпадение осадка). Часто для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет или другие свойства с изменением концентрации исследуемого иона. Такие вещества называются индикаторами.
Требования к реакциям, применяемым в объемном анализе:
— возможность тем или иным способом фиксировать точку эквивалентности;
— количественное течение реакции до равновесия, характеризующегося соответствующей величиной константы равновесия реакции;
— можно применять только те реакции, которые протекают с достаточной скоростью;
— при титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным.
В зависимости от типа реакции, которая протекает при титровании, выделяют методы объемного анализа:
1 Нейтрализация. В основе метода лежит реакция нейтрализации:
Этим методом определяют кислотность, щелочность, карбонатную жесткость воды.
2 Окислительно-восстановительные методы, в основе которых применяют окислительно-восстановительные реакции, в ходе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму.
3 Осаждение. Объемные определения метода основаны на осаждении определенного иона в виде труднорастворимого соединения.
4 Комплексометрия. В методе исследуемый ион связывается водным реактивом в малодиссоциированный комплекс. Метод применяется при определении жесткости воды Mg 2+ , Ca 2+ , иона Fe 3+ .
Измерение объемов. Для точного измерения в объемном анализе используют бюретки, пипетки, мерные колбы.
1 Бюретки служат для титрования и представляют собой цилиндрические трубки с суженным концом, отсчет ведется сверху вниз.
2 Пипетки служат для точного отмеривания каких-либо определенных объемов исследуемого раствора.
3 Мерные колбы служат для разбавления исследуемого раствора до определенного объема.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксоанион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
1 сильные щелочи (KOH, NaOH) и летучие основания (например, NH3×H2O), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО3 2– , S 2– , PO4 3– , SiO3 2– и др.);
2 слабые основания и анионы летучих и нелетучих слабых кислот (HCO3 – , H2PO4 – , HPO4 2– , CH3COO – , HS – , анионы гуминовых кислот и др.).
Щелочность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН = 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений
рН = 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая данным образом величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Экспериментальная часть
Определение свободной щелочности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором HCl до обесцвечивания раствора. Расчет производят по формуле:
где х – свободная щелочность воды, мг-экв/л;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
Определение общей щелочности. В ту же колбу, где проводили титрование, добавляют 2 – 3 капли индикатора метилового оранжевого и продолжают титрование до тех пор, пока окраска индикатора из желтой не перейдет в оранжевую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 1. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 1 – Результаты титрования
| № | V (H2О), мл | V (HСl), мл | V (HCl) средн., мл |
| 100,0 |
Перед каждым титрованием заполняют бюретку раствором до нулевого деления шкалы.
Расчет производят по формуле:
где х – общая щелочность воды, мг-экв/л;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
V (H2О) – взятый объем воды, мл.
Аналогично щелочности при анализе сточных и технологических вод определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксоанионами. К таким соединениям относятся:
1) сильные кислоты: соляная HCl, азотная HNO3, серная H2SO4;
2) слабые кислоты: уксусная CH3COOH; сернистая H2SO3; угольная H2CO3; сероводородная H2S и т.п.;
3) катионы слабых оснований: аммоний NH4 + ; катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора.
Различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН = 4,3 – 4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO3, H2SO4, H3PO4.
Общая кислотность определяется при титровании до значений рН = 8,2 – 8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др.
Экспериментальная часть
Определение свободной кислотности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора метилового оранжевого и титруют раствором щелочи до перехода оранжевой окраски раствора в желтую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 2. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 2 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствра щелочи, мл;
СH(NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л;
Определение общей кислотности. В коническую колбу наливают 100мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором щелочи появления малиновой окраски индикатора.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 3. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 3 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствора щелочи, мл;
СH(NaOHl) – молярная концентрация эквивалента раствора щелочи, моль/л;
Вопросы для самоконтроля
1 На титрование 100 мл исследуемой воды пошло 20 мл 0,1 н раствора соляной кислоты по метиловому оранжевому. Определите щелочность воды.
2 Вода содержит (мг/л): CaSO4 – 50, Ca(HCO3)2 – 100, Mg(HCO3)2 – 25. Какова величина щелочности.
3 Какова общая щелочность воды, содержащей СО3 2- – 50 мг/л, НСО3 — – 122 мг/л.
4 При определении щелочности воды было израсходовано 0,1 н кислоты на титрование 100 мл пробы с индикатором фенолфталеином 3 мл и дополнительно с индикатором метиловым оранжевым 5 мл. Рассчитайте общую и отдельные виды щелочности воды.
5 Вода имеет жесткость равную 9 мг-экв/л. Постоянная жесткость составляет 60 % от общей жесткости (соли натрия отсутствуют). Какова величина щелочности воды.
6 В 1 л воды содержится 210 мг NaHCO3 и 5,3 мг Na2CO3. Определите общую щелочность воды.
ЛАБОРАТОРНАЯ РАБОТА
Дата добавления: 2016-11-20 ; просмотров: 6906 | Нарушение авторских прав
источник
Когда заходит речь о качестве питьевой воды, мы, прежде всего, обращаем внимание на отсутствие вредных примесей, цвет, запах и т.п. А вот о важности такого показателя как щёлочность воды знают далеко не все. В этой статье мы попробуем разобраться, почему норма щёлочности воды так важна для нашего с вами здоровья, как она определяется и как достичь оптимальных показателей щёлочности воды.
Для начала попробуем разобраться, что же собственно такое «щёлочность воды». Справочная литература предлагает такое определение щёлочности: это общее число содержащихся в воде гидроксильных ионов, а также анионов слабых кислот. Щёлочность воды может быть гидратная, карбонатная, бикарбонатная, в зависимости от наличия в ней определённых веществ. Также следует разграничить понятие «щёлочность воды» и её водородный показатель (pH). Он показывает концентрацию в воде свободных ионов водорода. Если pH низкий ( 7) – о щелочной. Взаимосвязь pH и щёлочности прямопропорциональна: чем больше щёлочность воды, тем выше показатель pH. Щёлочность измеряется в ммоль/дм3, а рН – просто число единиц.
Согласно Государственным санитарным нормам, оптимальный показатель pH для питьевой воды от 6,5 до 8,5 единиц. Это совпадает с требованиями, применяющимися для контроля качества питьевой воды в США. Нормативы ЕС в этом вопросе отличаются несущественно (от 6,5 до 9,5). Показатель дистиллированной воды – 7 единиц. Это условно нейтральная вода. Показатели pH питьевой воды строго контролируются во всех странах.
А вот нормы щёлочности воды украинскими Государственными санитарными нормами не регулируются. Хотя и учитываются на предприятиях водоснабжения для правильного расчета реагентов, которые используют для обработки воды.
Относительно расчёта щёлочности воды стоит отметить, что оптимальные нормы немного отличаются в зависимости от того, для каких нужд используется вода.
Давайте попробуем разобраться, почему такое большое значение придаётся нормам щёлочности воды? Оказывается, от щёлочности воды напрямую зависит состояние нашего организма. Оптимальная норма щёлочности воды поможет наладить такие функции организма:
- обменные процессы
- восстановление микрофлоры кишечника
- активизация мозговой деятельности за счёт обогащения мозга кислородом
- укрепление иммунитета
Это неудивительно, поскольку в самом организме человека преобладают нейтральные или слабощелочные жидкости. Интересно, что pH человеческой крови составляет 7,43 (т.е. практически нейтрален).
Поэтому очень важным является определение щёлочности питьевой воды и контроль этих показателей.
Японские учёные установили, что если человек постоянно употребляет воду щёлочностью 6,5 – 7, то продолжительность жизни увеличивается на 20 – 30%. Дело в том, что кислая среда (низкая щёлочность воды) создаёт идеальные условия для развития различных болезней.
Для поддержания нормального кислотно-щелочного баланса и хорошего самочувствия важно «не закислять» организм. Но проблема в том, что большинство продуктов имеют кислую среду. А значит, для поддержания баланса важно пить воду, именно она способствует тому, что кровь может переносить больше кислорода. Но полезна не всякая вода. В первую очередь нужно обращать внимание на её щёлочность. Лучше, если она близка к нейтральной. Государственные санитарные нормы регламентируют щёлочность питьевой бутилированной воды и воды из бюветов на уровне 6,5 ммоль/дм3. Норма щёлочности воды, поступающей в централизованные водопроводные системы, регулируется ещё на этапе водоподготовки. Повышенная кислотность может наблюдаться в сильно загрязнённых природных водах (например, после сброса отходов промышленных предприятий, когда в воду попадает большое количество сильных кислот и их солей).
Кстати, вода повышенной щёлочности также не слишком полезна. Так, после водных процедур в такой воде может появляться:
- зуд на коже
- высыпания
- раздражения на слизистых
В разных регионах уровень pH водопроводной воды колеблется от 5,5 до 10 единиц. При необходимости этот показатель можно и нужно регулировать. Для измерения рН в домашних условиях можно использовать специальные тестеры. А вот для определения щёлочности воды понадобиться сдать образцы на анализ в специализированную лабораторию. После того, как вы получите результаты исследования, специалисты «УкрХимАнализ» дадут необходимые рекомендации. Если вода имеет повышенную щёлочность, то эффективным способом её снижения может стать фильтр. Хорошо справляются с данной проблемой, в частности, системы обратного осмоса. Они помогают не только снизить щёлочность воды, но и нормализовать её состав в целом, уменьшить минерализацию и жёсткость.
источник
Описание: многоуровневый интегральный параметр, отражающий концентрацию анионов слабых органических и неорганических кислот в воде, в основном — угольной. Характеризует направленность гидро- и геохимических процессов, коррозионной агрессивности воды по отношению к бетону, стали, отопительным котлам, парогенераторам.
Методы определения: титриметрия с использованием индикаторов, потенциометрическое определение.
Типы щёлочности
| Тип | Обусловленность |
|---|---|
| Свободная щелочность | Наличие в воде карбонат-ионов CO 2− 3 и гидроксильных ионов OH − в водах с pH > 8,3 |
| Карбонатная щелочность | Наличие в воде продуктов диссоциации угольной кислоты — карбонатов CO 2− 3 и гидрокарбонатов HCO − 3, находящихся в равновесии |
| Общая щелочность | Наличие в воде анионов слабых неорганических и органических кислот, титруемых сильной кислотой |
Методики, используемые в Испытательном центре МГУ определения концентрации гидрокарбонатов в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ГОСТ 31957-2012 | титриметрия | вспомогательное оборудование |
| РД 52.24.493-2006 | титриметрия | вспомогательное оборудование |
| Почва | ||
| ГОСТ 26424-85 | титриметрия | весы |
Распространённость: гидрокарбонаты HCO − 3, карбонаты CO 2− 3, гидроксид-ион OH − и ионы слабых органических и неорганических кислот появляются в природной воде естественным образом в процессе растворения в воде углекислого газа, минералов и вмещающих пород при контакте воды с почвой. Поэтому практически все типы вод характеризуются щёлочностью отличной от нуля. Щёлочность тесно связана с показателем pH, поэтому разные щёлочности могут не присутствовать в воде одновременно.
С нормированием щёлочностей дела обстоят сложно. Сама по себе эта группа параметров в воде не нормируется. Однако нормируются гидрокарбонаты (только в бутилированной воде), частично обуславливающие значение щёлочностей. Содержание карбонатов напрямую не нормируются, но, если учесть, что в питьевой воде строго нормируется pH, свободная щёлочность в питьевой воде должна быть равна нулю.
Предельно допустимая концентрация (ПДК) гидрокарбонатов в различных типах вод
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–400 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 30–400 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | — |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | — |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Сточные воды в бытовых системах водоотведения Постановление Правительства РФ № 644 | — |
| Сточные воды в ливневых системах водоотведения Постановление Правительства РФ № 644 | — |
Несмотря на то, что щёлочность не нормируется в большей части типов вод (кроме бутилированной), у щёлочности есть физиологическое воздействие: при употреблении воды с повышенной щёлочностью неизбежны негативные последствия для организма. Наиболее опасна свободная щёлочность. Общую и карбонатную щёлочности (при отсутствии свободной) лучше контролировать по содержанию гидрокарбонатов. Их содержание не должно превышать 400 мг/л.
При повышенной щёлочности наблюдается:
- нарушение кислотно-щелочного равновесия;
- снижение щелочного резерва крови;
- снижение кислотности желудочных соков;
- ускорение фильтрации мочевины;
- увеличение риска развития гипоацидного гастрита.
Появление в питьевой воде свободной щёлочности говорит о наличии загрязнения источника.
- моющие средства (ПАВ);
- щёлочи;
- мелкодисперсные (гидро)карбонаты щелочных и щёлочноземельных металлов (кальция, магния, натрия, калия) в форме порошка.
При загрязнении источника такими загрязнителями очистка воды, как правило, не целесообразна — необходимо проводить очистку самого источника. В случае, если без очистки воды не обойтись, предпочтительнее использовать обратный осмос.
Щёлочность — важный интегральный параметр состояния воды. Повышенное содержание свободной щёлочности говорит о загрязнении источника. Общая и карбонатная щёлочности позволяют судить о происходящих в воде процессах и о балансе карбонатов и гидрокарбонатов, а также о связи этого баланса с показателем pH. Также параметры используются для оценки пригодности воды для использования в технологических процесса и устройства, например парогенераторах, отопительных котлах, бойлерах и т.д.
источник
Мутность – показатель качества воды, обусловленный присутствием в воде нерастворенных и коллоидных веществ неорганического и органического происхождения. Причиной мутности поверхностных вод являются илы, кремниевая кислота, гидроокиси железа и алюминия, органические коллоиды, микроорганизмы и планктон. В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turb >
ВОЗ по показаниям влияния на здоровье мутность не нормирует, однако с точки зрения внешнего вида рекомендует, чтобы мутность была не выше 5 NTU (нефелометрическая единица мутности), а для целей обеззараживания – не более 1 NTU.
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах.
Цветность – показатель качества воды, обусловленный главным образом присутствием в воде гуминовых и фульфовых кислот, а также соединений железа (Fe3+). Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей – цветения воды — оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. Таким образом, высокая цветность является тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень важно выяснить причину цветности, так как методы удаления, например, железа и органических соединений отличаются. Наличие же органики не только ухудшает органолептические свойства воды, приводит к возникновению посторонних запахов, но и вызывает резкое снижение концентрации растворенного в воде кислорода, что может быть критично для ряда процессов водоочистки. Некоторые в принципе безвредные органические соединения, вступая в химические реакции (например, с хлором), способны образовывать очень вредные и опасные для здоровья человека соединения.
Цветность измеряется в градусах платино-кобальтовой шкалы и колеблется от единиц до тысяч градусов – Таблица 2.
Вкус воды определяется растворенными в ней веществами органического и неорганического происхождения и различается по характеру и интенсивности. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.
Качественную характеристику оттенков вкусовых ощущений – привкуса – выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький – сульфатом магния, кислый – избытком свободного диоксида углерода и т.д. Порог вкусового восприятия соленых растворов характеризуется такими концентрациями (в дистиллированной воде), мг/л: NaCl – 165; CaCl2 – 470; MgCl2 – 135; MnCl2 – 1,8; FeCl2 – 0,35; MgSO4 – 250; CaSO4 – 70; MnSO4 – 15,7; FeSO4 – 1,6; NaHCO3 – 450.
По силе воздействия на органы вкуса ионы некоторых металлов выстраиваются в следующие ряды:
O катионы: NH4+ > Na+ > K+; Fe2+ > Mn2+ > Mg2+ > Ca2+;
O анионы: ОН- > NO3- > Cl- > HCO3- > SO42- .
Запах – показатель качества воды, определяемый органолептическим методом с помощью обоняния на основании шкалы силы запаха. На запах воды оказывают влияние состав растворенных веществ, температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды определяют экспертным путем при 20 °С и 60 °С и измеряют в баллах, согласно требованиям.
Следует также указывать группу запаха по следующей классификации:
По характеру запахи делят на две группы:
- естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.)
- искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Интенсивность запаха по ГОСТ 3351-74* оценивают в шестибальной шкале – см. следующую страницу.
Водородный показатель (рН) — характеризует концентрацию свободных ионов водорода в воде и выражает степень кислотности или щелочности воды (соотношение в воде ионов Н+ и ОН- образующихся при диссоциации воды) и количественно определяется концентрацией ионов водорода pH = — Ig [H+]
Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН 9,5
Контроль над уровнем рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.
Обычно уровень рН находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. Так, в речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3. Поэтому ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Вместе с тем известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Кислотностью называют содержание в воде веществ, способных вступать в реакцию с гидроксид-ионами (ОН-). Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.
В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия, органических оснований). В этих случаях pH воды не бывает ниже 4.5.
В загрязненных водоемах может содержаться большое количество сильных кислот или их солей за счет сброса промышленных сточных вод. В этих случаях pH может быть ниже 4.5. Часть общей кислотности, снижающей pH до величин 7 выступает в виде иона HS-;
O при pH = 5 : 7 может быть в виде, как H2S, так и HS-.
воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:
Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
- при pH 7 выступает в виде иона HS-;
- при pH = 5 : 7 может быть в виде, как H2S, так и HS-.
Сульфаты (SO42-) – наряду с хлоридами являются наиболее распространенными видами загрязнения в воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:
- pH 10,5 – в основном в виде иона карбоната CO32-.
Агрессивная двуокись углерода – это часть свободной двуокиси углерода (CO2), которая необходима для удержания растворенных в воде углеводородов от разложения. Она очень активна и вызывает коррозию металлов. Кроме того, приводит к растворению карбоната кальция СаСО3 в строительных растворах или бетоне и поэтому ее необходимо удалять из воды, предназначенной для строительных целей. При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями. Содержание растворенного кислорода зависит от температуры, атмосферного давления, степени турбулизации воды, минерализации воды и др. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л. В артезианской воде кислород практически отсутствует.
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания и называется степенью насыщения кислородом. Этот параметр зависит от температуры воды, атмосферного давления и уровня минерализации. Вычисляется по формуле: M = (ax0,1308×100)/NxP, где
М – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, МПа.
N – нормальная концентрация кислорода при данной температуре и общем давлении 0,101308 МПа, приведенная в следующей таблице:
Окисляемость – это показатель, характеризующий содержание в воде органических и минеральных веществ, окисляемых сильным окислителем. Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.
Различают несколько видов окисляемости воды: перманганатную (1 мг KMnO4 соответствует 0,25 мг O2), бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – химическое потребление кислорода). Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами. Органические вещества, находящиеся в воде весьма разнообразны по своей природе и химическим свойствам. Их состав формируется как под влиянием биохимических процессов протекающих в водоеме, так и за счет поступления поверхностных и подземных вод, атмосферных осадков, промышленных и хозяйственно-бытовых сточных вод. Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды.
Поверхностные воды имеют более высокую окисляемость, а значит в них содержится высокие концентрации органических веществ по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2-3 мг О2/дм3, реки равнинные – 5-12 мг О2/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3.
Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2/дм3 (исключения составляют воды в районах нефтегазовых месторождений, торфяников, в сильно заболоченных местностях, подземных вод северной части РФ).
Электропроводность – это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации (концентрации растворенных минеральных солей) и температуры. Благодаря этой зависимости, по величине электропроводности можно с определенной степенью погрешности судить о минерализации воды. Такой принцип измерения используется, в частности, в довольно распространенных приборах оперативного измерения общего солесодержания (так называемых TDS-метрах).
Дело в том, что природные воды представляют собой растворы смесей сильных и слабых электролитов. Минеральную часть воды составляют преимущественно ионы натрия (Na+), калия (K+), кальция (Ca2+), хлора (Cl–), сульфата (SO42–), гидрокарбоната (HCO3–).
Этими ионами и обуславливается в основном электропроводность природных вод. Присутствие же других ионов, например трехвалентного и двухвалентного железа (Fe3+ и Fe2+), марганца (Mn2+), алюминия (Al3+), нитрата (NO3–), HPO4–, H2PO4– и т.п. не столь сильно влияет на электропроводность (конечно при условии, что эти ионы не содержатся в воде в значительных количествах, как например, это может быть в производственных или хозяйственно-бытовых сточных водах). Погрешности же измерения возникают из-за неодинаковой удельной электропроводимости растворов различных солей, а также из-за повышения электропроводимости с увеличением температуры. Однако, современный уровень техники позволяет минимизировать эти погрешности, благодаря заранее рассчитанным и занесенным в память зависимостям.
Электропроводность не нормируется, но величина 2000 мкС/см примерно соответствует общей минерализации в 1000 мг/л.
Окислительно-восстановительный потенциал (мера химической активности) Eh вместе с рН, температурой и содержанием солей в воде характеризует состояние стабильности воды. В частности этот потенциал необходимо учитывать при определении стабильности железа в воде. Eh в природных водах колеблется в основном от -0,5 до +0,7 В, но в некоторых глубоких зонах Земной коры может достигать значений минус 0,6 В (сероводородные горячие воды) и +1,2 В (перегретые воды современного вулканизма).
Подземные воды классифицируются:
- Eh > +(0,1–1,15) В – окислительная среда; в воде присутствует растворенный кислород, Fe3+, Cu2+, Pb2+, Mo2+ и др.
- Eh – 0,0 до +0,1 В – переходная окислительно-восстановительная среда, характеризуется неустойчивым геохимическим режимом и переменным содержанием кислорода и cероводорода, а также слабым окислением и слабым восстановлением разных металлов;
- Eh
источник

