В настоящее время вопрос об очистке воды и качестве бытовых фильтров волнует многих людей.
Для исследования были взяты образцы воды водопроводной и прошедшей очистку с помощью бытовых фильтров Аквафор (кувшин), Аквафор (кран), Барьер (кувшин). Изучались показатели: водородный показатель рН, содержание ионов цинка (II), меди (II), железа (III), жёсткость воды.
В пробирку наливается 5 мл исследуемой воды, рН определяется с помощью универсального индикатора, по шкале оценивается величина рН:
- Розово-оранжевая — рН=5;
- Светло-желтая — pH=6;
- Светло-зелёная — рН=7;
- Зеленовато-голубая — рН=8.
Отфильтрованная вода имеет слабокислую реакцию среды, а среда воды нефильтрованной близка к нейтральной.
К 10 мл исследуемой воды прибавляли 1-2 капли HCl (1:2) и 0,2 мл (4 капли) 50%-го раствора роданида калия KNCS. Перемешивается и проводятся наблюдения за развитием окраски. Этот метод чувствителен, можно определить до 0,02 мг/л ионов железа.
Примерное содержание железа (мг/л):
- Отсутствие окраски — менее 0,05;
- Едва заметное желтовато-розовое — от 0,05 до 0,1;
- Слабое желтовато-розовое — от 0,1 до 0,5;
- Желтовато-розовое — от 0,5 до 1,0;
- Желтовато-красное — от 1,0 до 2,5;
- Ярко-красное более 2,5.
Наибольшая концентрация ионов железа (III) – в нефильтрованной воде.
Иодид калия дает в растворе с ионами свинца характерный осадок PbI2. К испытуемому раствору прибавляется немного KI, после чего, добавив CH3COOH, нагревается содержимое пробирки до полного растворения первоначально выпавшего мало характерного желтого осадка PbI2. Охлаждается полученный раствор под краном, при этом PbI2 выпадает снова, но уже в виде красивых золотистых кристаллов Pb2+ +2I- = PbI2. Вода, прошедшая очистку и нефильтрованная, не содержат ионы свинца (II).
В фарфоровую чашку помещается 5 мл исследуемой воды, выпаривается досуха, затем прибавляется 1 капля концентрированного (25%) раствора аммиака. Появление интенсивного синего цвета свидетельствует о наличии ионов меди. 2Сu2+ +4NH4ОН = 2[Cu(NH3)4]2+ +4H2O
В коническую колбу на 250 мл вносится 100 мл исследуемой воды, прибавляется 5 мл аммиачного буферного раствора и на кончике шпателя вносится индикатор (эриохром черный). Затем следует раствор перемешать и медленно титровать 0,05 н раствором трилона Б до изменения окраски индикатора от вишневой до синей.
Приготовление индикатора эриохрома черного (сухого): для этого 0, 25 г индикатора смешивают с 50 г сухого хлорида натрия, предварительно тщательно растертого в ступке.
Приготовление буферного раствора: 10 г хлористого аммония (NH4Cl) растворяют в дистиллированной воде, добавляют 50см3 25 %-ного раствора аммиака и доводят до 500 см3 дистиллированной водой.
Приготовление 0,05 н раствора трилона Б: 9, 31 г трилона Б растворяют в дистиллированной воде и доводят до 1 дм3. Раствор устойчив в течение нескольких месяцев.
Расчет общей жесткость производят по формуле:
Ж мг-экв/л = (Vмл*N г-экв/л*1000мг-экв/г экв) / V1мл,
где: V — объем раствора трилона «Б», пошедшего на титрование, мл.
N — нормальность раствора трилона «Б» г-экв/л.
V1- объем исследуемого раствора, взятого для титрования, мл.
При оценке жёсткости воды её характеризуют следующим образом:
- очень мягкая – до 1,5 мг-экв/л;
- мягкая – от 1,5 до 4 мг-экв/л;
- средней жёсткости – от 4 до 8 мг-экв/л;
- жесткая – от 8 до 12 мг-экв/л;
- очень жесткая – более 12 мг-экв/л.
Водопроводная вода является жёсткой, вода, прошедшая очистку на фильтре Барьер, обладает средней жёсткостью, вода прошедшая очистку на фильтре Аквафор (кувшин и кран), мягкая и средней жёсткости.
Может ли вода приносить вред здоровью? В водопроводной воде могут содержаться очень опасные и даже ядовитые вещества, что водоочистные станции изношены, что вода, перед тем, как попасть в дом, должна проделать большой путь по старым водопроводным трубам, где она загрязняется солями тяжёлых металлов и неорганическим железом (ржавчиной). Потребность в чистой воде постоянно увеличивается, а исходная вода, попадающая на очистные станции, год от года становится все грязнее. После очистки вода становится пригодной для питья, но пахнет хлоркой. Концентрация хлора не являются опасными для здорового человека, но для некоторых категорий больных людей присутствие хлора даже в небольших концентрациях очень ухудшает самочувствие. Всё это неблагоприятно сказывается на здоровье человека. Фильтры для очистки воды в домашних условиях применять необходимо. Качество очищенной в домашних условиях воды лучше, чем качество воды из-под крана. С помощью бытовых фильтров можно очистить воду, которая содержит не только механические частицы (песок, ржавчина и т.п.), но и различные органические и неорганические соединения, опасные для здоровья. Вода, прошедшая очистку через фильтр становится менее жёсткой.
Фильтры полностью удаляют из воды хлор, который убивает бактерии и играет роль «консерванта». Но употреблять очищенную воду надо как можно быстрее после фильтрации, ведь в воде, лишенной «консерванта», бактерии начинают размножаться в приятной для них чистой и теплой среде (воде) особенно быстро.
Итак, что такое вода? Вопрос далеко не простой… Однозначно можно сказать лишь то, что вода – самое уникальное вещество на земле, от которого зависит состояние здоровья.
Определения рН исследуемой воды:
- Барьер – розово-оранжевая (рН=5);
- Аквафор (кувшин) – розово-оранжевая (рН=5);
- Аквафор (кран) – розово-оранжевая (рН=5);
- Нефильтрованная вода – светло-желтая (рН=6).
Результаты определения ионов железа (III):
- Барьер – Едва заметное желтовато-розовое от 0,05 до 0,1;
- Аквафор (кувшин) – отсутствие менее 0,05;
- Аквафор (кран) – отсутствие менее 0,05;
- Нефильтрованная вода – желтовато-розовое от 0,5 до 1,0.
Результаты определения ионов свинца (II):
- Барьер – осадка нет. За 3 капли вода обесцветилась;
- Аквафор (кувшин) – осадка нет. За 2 капли вода обесцветилась;
- Аквафор (кран) – осадка нет. За 2 капли вода обесцветилась;
- Нефильтрованная вода – осадка нет. За 10 капли вода обесцветилась.
Жёсткость исследуемой воды:
- Барьер – 7 мг-экв/л;
- Аквафор (кувшин) – 5 мг-экв/л;
- Аквафор (кран) – 4 мг-экв/л;
- Нефильтрованная вода – 9 мг-экв/л.
источник
Региональной особенностью состава вод Тюменской области является повышенное содержание железа. Ограничение на содержание железа в питьевой воде введено в СанПиН и по органолептическим признакам имеет ПДК равным 0,3 мг/л. На большинстве территории региона зарегистрированы высокие концентрации железа в питьевой воде (от 0,32 до 2,38 мг/л), в наиболее неблагоприятном положении находится северо-восточный район области. Повышенное содержание железа в водах Тюменской области отмечается на протяжении всего года, максимальная концентрация регистрировалась в зимний период и составляла 3,0 мг/л, что превышало ПДК в 10 раз, а в осенний период обнаруживалось до 5ПДК, что соответствовало годовому минимуму [1].
Вода, в которой железо содержится в концентрациях 1,0–1,5 мг/л и более, имеет желтовато-бурую окраску, повышенную мутность, выраженный привкус железа, поэтому является непригодной для питья. Но даже в менее низких концентрациях железо может причинить значительный вред бытовой и промышленной технике. Так уже при содержании общего железа 0,5 мг/л начинается интенсивное образование рыхлого шлама из хлопьевидных осадков в системах водоснабжения. Употребление воды с избыточным содержанием железа приводит к неблагоприятному воздействию на кожу, влияет на морфологический состав крови и может являться причиной возникновения аллергических реакций. При длительной перегрузке организма железом происходит его отложение в тканях, которое носит очаговый или генерализованный характер (гемосидероз). Если общее содержание железа в организме превышает 15 г, то поражаются внутренние органы. Такое состояние называется гемохроматозом [2]. Именно поэтому проблема загрязнения источников централизованного водоснабжения и обеспечение населения качественной питьевой водой на данный момент является одной из наиболее сложных современных проблем.
Главным источником железа в поверхностных водах являются процессы выветривания горных пород. К числу пород, подверженных процессам выветривания, относятся песчано-гравийные и глинистые материалы, содержащие большое количество железистых соединений. Для определения наиболее рационального метода удаления железа, необходимо выявить формы его существования в природных водах [3].
Железо в природных водах может находиться в виде двух- и трехвалентных ионов, коллоидов органического и неорганического происхождения, таких как ?Fe(OH)?_3, FeS, ?Fe(OH)?_2, комплексных соединений с гуматами и фульвокислотами, а также в виде тонкодисперсной взвеси.
Итак, в природных водах встречается несколько форм железа, к каждой из которых необходимо применять свою специфику очистки:
Элементарное железо (Fe0). Нерастворимо в воде, в присутствии кислорода воздуха или влаги окисляется до Fe2O3, образуя ржавчину.
Железо двухвалентное (Fe2+). Преимущественно встечается там, где нет кислорода воздуха и довольно высокое содержание углекислоты, т.е. главным образом в подземных водах. Его соединения хорошо растворимы. При окислении выпадает в красно-бурый осадок.
Гидроксид железа (III). При нейтральном pH и выше не растворяется в воде, может находиться как в коллоидном состоянии, так и выпадать в осадок красно-бурого цвета.
Хлорид железа (FeCl3), сульфат железа (Fe2(SO4)3) – соли железа III, хорошо растворимы в воде [4].
Органическое железо. Наибольшую роль в образовании органического железа играют гумусовые вещества, образуя с ним сложные комплексы и коллоидные структуры. Очистка от коллоидного железа является наиболее трудной задачей из всех прочих.
Определение ионов железа (III) методом титрования основано на взаимодействии их с SCN–, сопровождающимся образованием железороданидных комплексов, окрашивающих раствор в кроваво-красный цвет, тем более интенсивный, чем больше содержалось в растворе. К недостаткам этого метода относится то, что в зависимости от содержания в растворе состав комплексов может быть различным.
Эта реакция весьма чувствительна и позволяет определить железо при содержании его в растворе 10–7 г/мл.
Нами в лабораторных условиях был проведен количественный анализ пробы питьевой воды на содержание ионов железа. Проба была взята по адресу: г. Тобольск мкр. Левобережье.
В коническую колбу поместили 100 мл исследуемой пробы воды, прибавили 2мл концентрированной соляной кислоты, 2 мл роданида калия, 1 г персульфата аммония и тщательно взболтали. В ходе реакции наблюдалось изменение цвета раствора на красный.
В другой такой же колбе был приготовлен контрольный раствор. Для этого в колбу налили 100 мл дистиллированной воды, прибавили 2 мл концентрированной соляной кислоты, 2 мл роданида калия, 1 г персульфата аммония и также тщательно взболтали. Изменение окраски раствора не наблюдалось, вследствие отсутствия в нем ионов железа.
К контрольному раствору, содержащему все употребляемые реактивы, но не содержащему железа, добавили из микробюретки по каплям, при энергичном помешивании, стандартный раствор ионов железа. Титрование вели до тех пор, пока окраска контрольного раствора не сравнялась с окраской анализируемого раствора. Количество добавленного из микробюретки стандартного раствора ионов железа составило 21 мл [5].
Зная количество добавленного из микробюретки стандартного раствора ионов железа, вычислили содержание ионов железа в анализируемом растворе. Расчет проводили по формуле:
,
где VT – объем стандартного железа; V1 – объем исследуемой воды.
мг/л.
Таким образом, по результатам анализа можно сделать вывод, что концентрация железа в исследуемой пробе превышает ПДК в 70 раз. Полученные в результате анализа данные свидетельствуют о том, что проблема загрязнения источников централизованного водоснабжения и обеспечение населения качественной питьевой водой является актуальной в г. Тобольске и Тюменской области в целом. Население вынуждено употреблять питьевую воду, несоответствующую нормативным требованиям, что может негативно сказаться на состоянии здоровья.
источник
Настоящий документ устанавливает методику измерений общего железа в питьевых, поверхностных и сточных водах фотометрическим методом с сульфосалициловой кислотой.
Диапазон измерений от 0,05 до 10 мг/дм 3 без разбавления и концентрирования пробы.
Если массовая концентрация железа общего в анализируемой пробе превышает 10,0 мг/дм 3 , необходимо разбавлять пробу таким образом, чтобы массовая концентрация железа общего соответствовала регламентированному диапазону.
Если массовая концентрация железа общего в анализируемой пробе ниже 0,1 мг/дм 3 , пробу необходимо концентрировать путем упаривания.
Мешающие влияния, обусловленные присутствием в пробе органических веществ, нитритов, полифосфатов и др. устраняется специальной подготовкой пробы (см. п. 9.1).
При наличии в анализируемой пробе ионов хрома и цинка в количествах, превышающих в 10 раз концентрацию железа общего; меди и кобальта при массовых концентрациях, превышающих 2,0 мг/дм 3 , следует использовать другую методику.
Значения показателя точности измерений 1 — расширенной относительной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
Таблица 1 — Диапазон измерений, показатели неопределенности измерений
Суммарная стандартная относительная неопределенность, и, %
Расширенная относительная неопределенность 2 , U при коэффициенте охвата k = 2, %
2 Соответствует характеристике погрешности при доверительной вероятности Р = 0,95.
При выполнении измерений должны быть применены следующие средства измерений, оборудование и материалы:
3.1 Средства измерений, вспомогательное оборудование
Спектрофотометр или фотоэлектроколориметр, позволяющий измерять оптическую плотность при длине волны l = 425 и l = 500 нм.
Кюветы с толщиной поглощающего слоя 10 и 50 мм.
Весы лабораторные специального класса точности с ценой деления не более 0,1 мг, наибольшим пределом взвешивания не более 210 г по ГОСТ Р 53228-2008.
Плитка электрическая лабораторная с регулятором температуры и закрытой спиралью по ГОСТ 14919-83.
Сушильный шкаф электрический.
Государственные стандартные образцы (ГСО) состава раствора ионов железа с массовой концентрацией 1 мг/дм 3 . Относительная погрешность аттестованных значений массовой концентрации не более 1 % при Р = 0,95.
1 Допускается использование других средств измерений утвержденных типов, обеспечивающих измерения с установленной точностью.
2 Допускается использование другого оборудования с метрологическими и техническими характеристиками, аналогичными указанным.
3 Средства измерений должны быть поверены в установленные сроки.
Колбы мерные 2-(2)-25 (50, 100, 1000)-2, ГОСТ 1770-74.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 250 — 500 см 3 для отбора и хранения проб.
1 Допускается использование других средств измерений, вспомогательного оборудования, посуды и материалов с метрологическими и техническими характеристиками не хуже указанных.
2 Средства измерений должны быть поверены в установленные сроки.
Бумага индикаторная универсальная, ТУ 6-09-1181-89.
1 Все реактивы, используемые для измерений, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Фотометрический метод определения массовой концентрации общего железа основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа ( III ) (красное окрашивание), а в слабощелочной среде — с солями железа (II) и железа (III) (желтое окрашивание).
Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны l = 425 нм, для железа (III) — при длине волны l = 500 нм.
При выполнении измерений необходимо соблюдать следующие требования техники безопасности.
5.1 При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76.
5.2 Электробезопасность при работе с электроустановками по ГОСТ Р 12.1.019-2009.
5.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
5.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического анализа, изучивший инструкцию по эксплуатации спектрофотометра или фотоэлектроколориметра и получивший удовлетворительные результаты при выполнении контроля процедуры измерений.
Измерения проводятся в следующих условиях: температура окружающего воздуха (20 ± 5) ° С; атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм рт.ст); относительная влажность не более 80 % при t = 25 °C; напряжение сети (220 ± 22) В; частота переменного тока (50 ± 1) Гц.
При подготовке к выполнению измерений должны быть проведены следующие работы: подготовка посуды для отбора проб, отбор проб, подготовка прибора к работе, приготовление вспомогательных и градуировочных растворов, установление и контроль стабильности градуировочной характеристики.
8.1 Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
8 .2.1 Отбор проб питьевых вод производится в соответствии с требованиями ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб».
Отбор проб поверхностных и сточных вод производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
8 .2.2 Пробы воды отбирают в бутыли из полимерного материала или стекла, предварительно ополоснутые отбираемой водой. Объем отбираемой пробы должен быть не менее 250 см 3 .
8 .2.3 Если анализ выполняется в течение суток, пробу отбирают не консервируя. При невозможности выполнения измерений в указанные сроки пробу консервируют одним из следующих способов:
— если необходимо определять сумму растворенной и нерастворенной форм железа, к пробе добавляют 2 см 3 концентрированной соляной кислоты или 2,5 см 3 концентрированной азотной кислоты на каждые 100 см 3 пробы;
— если необходимо определять железо растворенное, то отобранную пробу сразу фильтруют через мембранный фильтр (0,35 — 0,45 мкм), поместив в приемную колбу 1 см 3 концентрированной соляной кислоты на каждые 100 см 3 пробы.
8 .2.4 При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указываются:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
8.4 Приготовление растворов
20,0 г сульфосалициловой кислоты помещают в колбу и растворяют в 80 см 3 дистиллированной воды.
Смешивают равные части концентрированного аммиака и дистиллированной воды.
Навеску хлорида аммония (107 г) помещают в мерную колбу вместимостью 1000 см 3 , растворяют в дистиллированной воде и доводят до метки дистиллированной водой.
3 Приготовление градуировочных растворов из соли железа приведено в Приложении Б.
Раствор готовят в соответствии с прилагаемой к образцу инструкцией. 1 дм 3 раствора должен содержать 100 мг железа.
Срок хранения — один месяц.
Рабочий раствор готовят в день проведения измерений путем разбавлением основного раствора в 10 раз дистиллированной водой в мерной колбе. Раствор готовят в день проведения измерений.
8.5 Построение градуировочных графиков
Для построения градуировочных графиков необходимо приготовить образцы для градуировки с массовой концентрацией железа общего от 0,1 до 10,0 мг/дм 3 . Условия измерений и ход проведения анализа должны соответствовать п.п. 7 и 9.
Состав и количество образцов для построения градуировочных графиков приведены в таблице 2. Неопределенность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,5 %.
Таблица 2 — Состав и количество образцов для градуировки
Массовая концентрация ионов железа в градуировочных растворах в мг/дм 3
Аликвотная часть раствора (см 3 ), помещаемая в мерную колбу вместимостью 100 см 3
Рабочий градуировочный раствор с концентрацией 10 мг/дм 3 (градуировочный график 1, кювета 50 мм)
Основной градуировочный раствор с концентрацией 100 мг/дм 3 (градуировочный график 2, кювета 10 мм)
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных.
При построении градуировочного графика по оси ординат откладывают значения оптической плотности, а по оси абсцисс — величину концентрации вещества в мг/дм 3 .
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал, а также при смене партий реактивов, после поверки или ремонта прибора. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 8.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
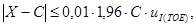
где X — результат контрольного измерения массовой концентрации железа в образце для градуировки;
С — аттестованное значение массовой концентрации железа;
u I(TOE) — стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности, %.
Значения u I(TOE) приведены в Приложении А.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
9.1.1 Измерению массовой концентрации железа с применением раствора сульфосалициловой кислоты мешает собственная окраска пробы. Если окраска пробы сохраняется после проведения пробоподготовки (п. 9.1.2), то окрашенную пробу обрабатывают по п. 9.2, но без добавления сульфосалициловой кислоты. Измеряют оптическую плотность и найденную величину вычитают из полученного результата.
9 .1.2 Для устранения мешающего влияния органических веществ пробу озоляют. При озолении пробы, в стакан из термостойкого стекла вместимостью 100 см 3 помещают аликвоту пробы в зависимости от содержания в ней железа (0,1 — 10,0 мг/дм 3 ). Последовательно прибавляют 2,0 и 5,0 см 3 концентрированной серной и азотной кислоты соответственно, накрывают часовым стеклом и кипятят смесь в вытяжном шкафу до появления густого белого дыма, после чего нагревание прекращают. Раствор охлаждают до комнатной температуры, разбавляют дистиллированной водой и нагревают до кипения для растворения труднорастворимых солей, фильтруют (в случае необходимости), переносят в мерную колбу вместимостью 100 см 3 и проводят измерения по п.п. 9.2 , 9.1 .
Если в обработке пробы по п. 9.1.2 нет необходимости, то к отобранному объему (100 см 3 и менее) добавляют 0,5 см 3 концентрированной азотной кислоты и упаривают раствор до 1 /3 объема.
Полученный раствор с концентрацией железа от 0,1 до 10,0 мг/дм 3 фильтруют через фильтр «белая лента» в мерную колбу вместимостью 100 см 3 , приливают 2,0 см 3 аммония хлористого (п. 8.4.3), 2,0 см 3 сульфосалициловой кислоты (п. 8.4.1), 2,0 см 3 аммиака (п. 8.4.2), рН раствора должен составлять 7 — 8 (по индикаторной бумаге). Доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 минут до развития окраски. Оптическую плотность полученного раствора измеряют при длине волны l = 425 нм в кювете с длиной поглощающего слоя 50 или 10 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход анализа. По градуировочному графику находят содержание железа общего.
9.3 Определение железа (III)
Определение можно проводить только в тех случаях, когда пробу не обрабатывали с целью разрушения органических компонентов, не кипятили и не консервировали, т.к. при этом железо (II) окисляется до железа (III).
Пробу объемом 80,0 см 3 и менее, в зависимости от концентрации, помещают в мерную колбу вместимостью 100 см 3 , нейтрализуют раствором аммиака или соляной кислоты до рН 3 — 5 по индикаторной бумаге, прибавляют 2 см 3 сульфосалициловой кислоты (п. 8.4.1), доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 мин до полного развития окраски.
Оптическую плотность полученного раствора измеряют при длине волны l = 500 нм в кювете с длиной поглощающего слоя 10 или 50 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход измерений. По градуировочному графику находят массовую концентрацию железа общего.
Массовую концентрацию железа рассчитывают по формуле:
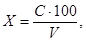
где X — массовая концентрация железа в анализируемой пробе, мг/дм 3 ;
С — массовая концентрация железа, найденная по градуировочному графику, мг/дм 3 ;
100 — объем, до которого была разбавлена проба, см 3 ;
V — объем, взятый для измерений, см 3 .
При необходимости за результат измерений Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
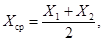
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
Таблица 3 — Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (4) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Результат измерений в документах, предусматривающих его использование, может быть представлен в виде: X ± = 0,01 × U × X, мг/дм 3 ,
где X — результат измерений массовой концентрации, установленный по п. 10, мг/дм 3 ;
U — значение показателя точности измерений (расширенная неопределенность измерений с коэффициентом охвата 2).
Значение U приведено в таблице 1.
Допускается результат измерений в документах, выдаваемых лабораторией, представлять в виде: Х ± 0,01 × U л × X , мг/дм 3 , Р = 0,95, при условии U л U , где U л — значение показателя точности измерений (расширенной неопределенности с коэффициентом охвата 2), установленное при реализации методики в лаборатории и обеспечиваемое контролем стабильности результатов измерений.
При представлении результата измерений в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерений;
— способ определения результата измерений (среднее арифметическое значение или медиана результатов параллельных определений).
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры измерений;
— контроль стабильности результатов измерений на основе контроля стабильности среднего квадратического отклонения (СКО) повторяемости, СКО промежуточной (внутрилабораторной) прецизионности и правильности.
Периодичность контроля исполнителем процедуры выполнения измерений и алгоритмы контрольных процедур, а также реализуемые процедуры контроля стабильности результатов измерений регламентируют во внутренних документах лаборатории.
Ответственность за организацию проведения контроля стабильности результатов измерений возлагают на лицо, ответственное за систему качества в лаборатории.
Разрешение противоречий между результатами двух лабораторий проводят в соответствии с 5.3.3 ГОСТ Р ИСО 5725-6-2002.
12.2 Оперативный контроль процедуры измерений с использованием метода добавок
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры K к с нормативом.
Результат контрольной процедуры Кк рассчитывают по формуле:
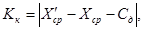
где 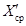
X ср — результат измерений массовой концентрации железа в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4).
Норматив контроля К рассчитывают по формуле
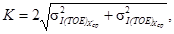
где 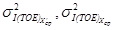
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (7) контрольную процедуру повторяют. При повторном невыполнении условия (7) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
12.3 Оперативный контроль процедуры измерений с использованием образцов для контроля
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Кк с нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
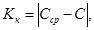
где Сср — результат измерений массовой концентрации железа в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4);
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле
где s I(TOE) — стандартное отклонение промежуточной прецизионности, соответствующие массовой концентрации железа в образце для контроля, мг/дм 3 .
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (10) контрольную процедуру повторяют. При повторном невыполнении условия (10) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Таблица 4 — Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Таблица А.1 — Бюджет неопределенности измерений
Стандартная относительная неопределенность 4 , %
Приготовление градуировочных растворов, u1, %
Степень чистоты реактивов и дистиллированной воды, и2, %
Подготовка проб к анализу, и3, %
Стандартное отклонение результатов измерений, полученных в условиях повторяемости 5 , иr ( s r), %
Стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности 5 , uI(TOE) ( s I(TOE)), %
Стандартное отклонение измерений полученных в условиях воспроизводимости, uR( s R), %
Суммарная стандартная относительная неопределенность, ис, %
Расширенная относительная неопределенность, (Uomн.) при k = 2, %
1 Оценка (неопределенности) типа А получена путем статистического анализа ряда наблюдений.
2 Оценка (неопределенности) типа В получена способами, отличными от статистического анализа ряда наблюдений.
4 Соответствует характеристике относительной погрешности при доверительной вероятности Р = 0,95.
5 Согласно ГОСТ Р ИСО 5725-3-2002 учтено при расчете стандартного отклонения результатов измерений, получаемых в условиях воспроизводимости.
Б.1 Приготовление основного градуировочного раствора из соли железа с концентрацией 100 мг/дм 3
Навеску железоаммонийных квасцов 0,8634 г помещают в мерную колбу вместимостью 1 дм 3 , растворяют в дистиллированной воде, прибавляют 2 см 3 концентрированной соляной кислоты и доводят дистиллированной водой до метки.
Срок хранения — один месяц.
Б.2 Приготовление рабочего стандартного раствора с концентрацией 10 мг/дм 3 из основного градуировочного раствора
Рабочий градуировочный раствор готовят в день проведения измерений разбавлением основного стандартного раствора в 10 раз дистиллированной водой.
источник
Содержание железа в воде – распространенное явление. В большинстве своем оно приносит пользу организму, но не стоит безоглядно пользоваться водой, содержащей данную примесь.
Поведение железа в воде зависит от валентности и взаимодействий с другими соединениями.
Железо в воде может быть в нескольких видах:
- Трехвалентное – не растворяется, придает воде желтый оттенок и оседает в виде бурого осадка;
- Соединенное с молекулами органики – придает воде желтый цвет и не выпадает в осадок;
- Двухвалентное – хорошо растворяется и не окрашивает воду;
- Бактериальное – образует радужную пленку и желеобразные отложение в водопроводе.
Возникновение железа в питьевой воде обусловлено коррозией водопроводных труб и очистных сооружений, которые фильтруют воду перед подачей в дома и квартиры.
Появление железа в воде из скважины связано с процессами растворения горных пород, а также с подземными стоками промышленных предприятий и сельскохозяйственных производств.
Для нормального функционирования организма человеку нужно употреблять в сутки 1-2 мг железа, но накопленный избыток негативно отражается на здоровье и угрожает жизни.
Чрезмерное содержание данной примеси в воде вызывает коррозию металлов и сокращает срок эксплуатации водопроводной системы.
ПДК железа в воде составляет 0,3 мг на литр. Данное значение установлено санитарными нормами. В связи тем, что влияние железа на организм не до конца изучено, а потребление элемента в сутки зависит от массы тела человека, ВОЗ не устанавливает определенных границ.
Самым надежным способом определения содержания железа в воде будет лабораторный анализ.
К первичным признакам избытка железа относятся:
- Ржавый налет на дне металлической посуды;
- «Металлический» привкус воды;
- Ржавые потеки на сантехнике;
- Обесцвечивание белья после стирки.
Чтобы анализ воды на железо показал точный результат, необходимо правильно собрать исследуемый материал. Для начала необходимо слить воду в течении 10 минут и хорошо промыть тару в исходной воде без моющих средств. Затем набрать воду тонкой струей под самую крышку, выдавить воздух, плотно закрыть емкость и доставить в пункт приема проб.
Что делать, если в воде много железа? Правильнее всего будет установить фильтр. Очистка в воде железа с помощью фильтра происходит двумя способами:
- Ионный обмен – гранулированные ионные смолы заменяют железо натрием, используется для технологических целей;
- Использование сильных окислителей – с помощью гипохлорида натрия или марганцовки; требует тщательной дозировки; дорогостоящий метод, больше подходит для технологических целей;
- Аэрация – создание интенсивного воздухообмена искусственным путем, в результате чего вода насыщается кислородом, который окисляет железо;
- Осмос – самая эффективная система очистки от двухвалентного железа.
В лаборатории «ИОН» вы сможете провести анализ вашей воды, узнать все о ее состоянии и получить рекомендации по улучшению качества. Мы работаем более 20-ти лет, используя современное оборудование и качественные материалы. Наши сотрудники – профессионалы своего дела. Лаборатория проводит исследование питьевой, талой, морской, технологической, водоемной и других видов вод. Мы сотрудничаем с крупнейшими разработчиками аналитического оборудования и постоянно ищем новые методы диагностики веществ и материалов. Мы осуществляем пробы с материалов Москвы и московской области.
Марганец в воде – довольно распространенное явление. Это вещество представляет из себя легкорастворимый минерал, занимающий 14 место среди общего количества. Содержание марганца в воде способно как принести организму пользу, так и причинить вред.
Сероводород — это газ, имеющий характерный неприятный запах (запах тухлых яиц). Содержание данной примеси практически не меняет цвет воды, но придает ей сладковатый привкус. Воду с повышенным содержанием сероводорода нельзя употреблять в пищу.
* Бесплатный выезд для физических лиц в пределах МКАД при заказе на сумму более 5 000 ₽. Подробнее в разделе Доставка и оплата
© 1997-2019 — Лаборатория ИОН. Все права защищены.
Для химического анализа необходимо заполнить водой чистую пластиковую тару (оптимально 1,5 л). Использовать бутылки из-под сладких, газированных или ароматизированных напитков, а также солёной или минеральной воды недопустимо.
Если выбранный Вами анализ включает определение содержания нефтепродуктов, необходимо заполнить дополнительную стеклянную тару объемом 0,2 л.
Если выбранный Вами анализ включает определение содержания сероводорода, необходимо заполнить дополнительную стеклянную тару объемом 0,5 л (необходимо использовать консервант).
При отборе воды из проточного источника, непосредственно перед отбором необходимо пролить воду сильной струёй в течение 3-5 минут. Перед отбором проб ёмкости и крышки необходимо 3 раза промыть изнутри водой, подлежащей анализу. Использование моющих средств недопустимо. Наполнять тару необходимо тонкой струёй по стенке сосуда «под горлышко». Это снижает насыщение воды кислородом и предотвращает протекание реакций.
Для микробиологического анализа необходимо использовать стерильный контейнер для биоматериалов объемом 150-200 мл.
Перед взятием пробы необходимо протереть водопроводный кран спиртовой салфеткой, уделив особое внимание месту выхода воды.
При отборе воды из водопровода, скважины или колонки необходимо пролить воду сильной струёй в течение 3–5 минут.
При отборе воды из колодца с помощью ведра необходимо обдать ведро кипятком для дезинфекции. Отбор пробы через поливочные шланги и предметы, контактирующие с почвой, не допускается.
Для отбора пробы необходимо надеть перчатки и вскрыть упаковку стерильного контейнера. Не касаясь внутренней поверхности ёмкости, отобрать образец воды (2/3 объема контейнера) и закрыть крышкой.
Рекомендуем доставлять пробу сразу после отбора.
Если сразу после отбора нет возможности доставить пробу в лабораторию, допускается хранение образцов при температуре 2–10 °C в течение 1 суток.
Съезд на ул. Руставели, на первом светофоре поворот налево на ул. Яблочкова.
Через 300 м поворот направо на ул. Гончарова, через 500 м поворот налево (напротив дома №6), через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Поворот на ул. Руставели, на светофоре поворот направо на ул. Добролюбова, через 300м на светофоре поворот налево на ул. Гончарова, напротив дома №6 поворот направо, через 200 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Двигаясь по ул. Милошенкова, поворачиваем на ул. Добролюбова
Через 150 метров поворот направо, за домом 21АкБ поворот налево, через 100-120 метров вы на месте — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Ближайшее станция метро – Фонвизинская (600 м)
Последний вагон из центра. Выход в сторону улицы Фонвизина. Из стеклянный дверей направо. Перейти через пешеходный переход и идти через дворы в соответствии со схемой. Пункт назначения — ул. Добролюбова, 21А, корпус А, 3-й подъезд (серая дверь, белый козырек из поликарбоната), помещение 14.
Анализ «Минимальный» содержит минимальный и обязательный перечень загрязнителей, часто встречающихся в питьевой воде, и включает 16 показателей:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний;
- анионы: нитраты, карбонат, гидрокарбонат.
Данный набор рекомендуется для исследования воды хозяйственно-бытового назначения. Анализ «Минимальный» не обладает достаточной информативностью для подбора системы водоочистки, так как не позволяет получить полную картину о безопасности воды. Если Вы планируете использовать воду в питьевых целях, рекомендуем обратить внимание на наборы, содержащие большее число параметров.
- Точность определения
- Подходит для воды, применяемой в хоз-бытовом назначении
- Срок выполнения — 3-4 рабочих дня
- Не подходит для воды, применяемой в питьевых целях
- Не подходит для корректного подбора/оценки работы фильтров
- Не включает определение тяжелых металлов
- Не включает определение органических загрязнителей
Анализ «Начальный» предназначен для выявления наиболее часто встречающихся вредных веществ в питьевой воде и включает 23 параметра:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний, марганец, калий, магний, кальций;
- анионы: фториды, хлориды, нитраты, сульфаты, карбонаты, гидрокарбонаты.
Данный анализ рекомендуется для воды централизованных систем водоснабжения. По протоколу анализа «Начальный» также можно сделать вывод о корректности работы системы водоочистки. В перечень определяемых параметров входят органолептические показатели, общие химические показатели, а также содержание катионов и анионов.
- Точность определений
- Подходит для водопроводной воды
- Позволяет оценить эффективность работы системы водоочистки
- Позволяет корректно настроить водоочистное оборудование
- Срок выполнения — 5 рабочих дней
- Не включает определение тяжелых металлов
- Не включает определение органических загрязнителей
- Не подходит для полной проверки воды из колодца или скважины
Анализ «Расширенный» содержит перечень наиболее часто встречающихся загрязнителей воды, вне зависимости от источника, и включает 31 показатель:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная;
- катионы: железо, аммоний, марганец, калий, магний, кальций, алюминий, натрий;
- анионы: фториды, хлориды, нитраты, сульфаты, карбонаты, гидрокарбонаты;
- тяжелые металлы и металлоиды: медь, мышьяк, свинец, кадмий, цинк, стронций.
Данный набор рекомендуется, в первую очередь, владельцам колодцев и скважин. Помимо катионов и анионов, органолептических и общих химических параметров содержит перечень основных тяжелых металлов и метталоидов. Перед покупкой системы водоподготовки рекомендуем провести исследование воды с данным перечнем загрязнителей. Ориентируясь на полученную информацию, Вы сможете подобрать оборудование водоочистки с эффективностью до 98%, а так же корректно его настроить. Если вода из Вашего источника имеет выраженный запах сероводорода (запах тухлых яиц), рекомендуем дополнительно проверить воду на содержание сероводорода.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для колодцев и скважин
- Содержит перечень тяжелых металлов
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Позволяет корректно и экономично настроить водоочистное оборудование
- Срок выполнения — 5-6 рабочих дней
Анализ «СанПиН» предназначен для исследования воды по максимальному перечню загрязнителей, вне зависимости от источника, и включает 61 параметр:
- органолептические: мутность, цветность, запах, привкус;
- общехимические: рН, жесткость, окисляемость перманганатная, минерализация, электропроводность, щелочность общая, щелочность свободная, сероводород, хлор общий, хлор остаточный свободный, нефтепродукты;
- катионы: железо, аммоний, марганец, калий, магний, кальций, алюминий, натрий, литий;
- анионы: фториды, хлориды, нитраты, нитриты, фосфаты, сульфаты, сульфиды, гидросульфиды, карбонаты, гидрокарбонаты;
- тяжелые металлы и металлоиды: барий, бериллий, бор, ванадий, молибден, кобальт, цинк, никель, хром, стронций, кадмий, мышьяк, медь, свинец, кремний, серебро, титан, ртуть;
- органические компаненты: АПАВ, фенол, формальдегид, бензол, толуол, о-ксилол, п-ксилол, м-ксилол, стирол.
Данное исследование рекомендуется тем, кто серьезно относится к выбору питьевой воды. Протокол анализа «Максимальный» позволяет со 100% уверенностью сделать вывод о пригодности воды для питья и приготовления пищи. Результаты исследования позволяют выбрать схему водоочиски, а также оценить эффективность уже установленного оборудования.
- Точность определений
- Подходит для подбора водоочистного оборудования
- Подходит для любых источников воды
- Позволяет оценить эффективность фильтрующей загрузки в фильтре и всей системы в целом
- Включает полный перечень тяжелых металлов
- Позволяет корректно и экономично настроить водоочистное оборудование
- Содержит полный перечень опасных органических веществ
- Срок выполнения — 5-6 рабочих дней
Помимо хичиеского анализа мы настоятельно рекомендуем провести микробиологическое исследование Вашей воды. Микробиологический анализ включает определение общего микробного числа (ОМЧ), общих колиформных и колиформных термотолерантных бактерий.
Важен правильный отбор проб и оперативная доставка образцов в лабораторию или пункт приема проб. Подробная информация здесь
Если у Вас есть точный перечень параметров, Вы можете заказать анализ по Индивидуальному перечню показателей. Минимальный чек на индивидуальный анализ — 1 500 руб! Для расчета стоимости позвоните нам по номеру +7 (495) 149-23-57 или напишите на почту info@ion-lab.ru.
Анализ «Водоем / Аквариум» включает в себя перечень параметров, превышения по которым чаще всего встречаются в водоемах. Анализ включает определение основных химических параметров.
Химические параметры:
- общехимические : рН, нефтепродукты, аммоний, ХПК, БПК5, АПАВ, фенол;
- анионы : нитраты, сульфаты, хлориды, нитриты, фосфаты, фториды;
- тяжелые металлы и металлоиды : марганец, железо общее, ртуть, цинк, никель, кадмий, мышьяк, медь, свинец, хром.
Нормирование осуществляется по №552 Минсельхоза РФ от 13.12.2016 г «Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения.»
источник
Разработка урока химии по теме: «Определение содержания ионов трехвалентного железа, ионов хлора и сульфат-ионов в водопроводной и речной воде».
Разработка урока химии по теме: «Определение содержания ионов трехвалентного железа, ионов хлора и сульфат-ионов в водопроводной и речной воде».
Цель: Познакомиться с методиками:
«Определения концентрации ионов трехвалентного железа
«Определения концентрации ионов хлора
«Определения концентрации сульфат-ионов.
«Самостоятельно и мотивированно организовать свою познавательную деятельность (от постановки цели до получения оценки и результата)
«Оценить и корректировать свое поведение в окружающей среде.
«Выполнять в практической деятельности и в повседневной жизни экологические требования.
I. Вступительное слово учителя.
«Вода, как и воздух, неразделимо связана с существованием жизни на Земле.
«Большинство процессов в природе протекают с участием воды или в водной среде.
«Вода необходима для жизни и деятельности человека.
«Существуют особые требования, предъявляемые к воде.
«Она должная быть бесцветной, чистой, она должна иметь хороший вкус и не иметь запаха. В ней также не должны содержаться биологические примеси.
II. Повторение методики определения концентрации ионов Fe 2+ ,NO 3- .
Определение концентрации ионов двухвалентного железа.
К 5 мл воды добавить на кончике ножа (0,1 г) гидросульфата калия, 0,1 г смеси (красная кровяная соль и сахарная пудра 1:9) и хорошо взболтать. В присутствии ионов двухвалентного железа появляется сине-зеленое окрашивание.
Светло-сине-зеленый 1 — 6 мг/л
К 5 мл воды осторожно, по стенке пробирки, прибавить 1 мл реактива, полученного растворением 1 г дифениламина в 100 мл концентрированной серной кислоты. Если есть нитрат-ионы, то появляется синее окрашивание. Но этой реакции мешают нитрит-ионы, которые предварительно надо разрушить. К исследуемой воде добавляют несколько кристаллов хлорида аммония и кипятят 2-3 минуты. Образовавшийся нитрит аммония разрушается до азота и воды. После этого проводят реакцию с дифениламином.
III. Объяснение нового материала (демонстрация опытов).
Определение концентрации ионов трёхвалентного железа.
К 5 мл природной воды прибавить 1-2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданида аммония. В присутствии ионов трехвалентного железа появляется красный цвет.
Слабо-красновато-желтоватый 0,95 — 0,4 мг/л
желтовато-красный 0,4 — 1,0 мг/л
Определение концентрации ионов хлора
К 5 мл природной воды прибавить 1-2 капли 10%-ного раствора нитрата серебра, подкисленного азотной кислотой. Образуется осадок или муть.
хлопья, осаждаются сразу 50 — 100 мг/л
белый объемистый осадок более 100 мг/л
Определение концентрации сульфат-ионов
К 5 мл воды прибавить 4 капли 10%-ного раствора соляной кислоты и 4 капли 5%-ного раствора хлорида бария. Нагреть. Образуется муть или осадок.
слабая муть через несколько минут 1 — 10 мг/л
слабая муть сразу 10 — 100 мг/л
сильная муть 100 — 500 мг/л
большой осадок, быстро оседающий более 500 мг/л
Во время экспериментальной работы учащиеся самостоятельно заполняют таблицу, с помощью учителя делают выводы.
Вода, подаваемая в водопроводную сеть города, соответствует санитарным правилам и нормам. Данные анализа качества воды свидетельствуют о загрязнении Дона:
«летучими фенолами, нитратами, превышающими ПДК;
«микробиологическими и вирусологическими показателями.
«Питьевая вода должна быть бесцветной, чистой, не иметь запаха и иметь хороший вкус.
«Она также не должна содержать химических или биологических примесей.
«Воду надо использовать экономно.
«Вода — необходимое условие для жизни.
«Для сохранения водных богатств создавать замкнутые циклы производства, когда вода используется многократно.
«Использовать новые биологические методы для очистки воды.
«Осуществлять постоянный контроль за качеством воды.
Взять пробу природной воды, определить интенсивность запаха, цветность и мутность.
Определение интенсивности запаха воды.
Определения цветности воды:
1.Заполнить пробирку водой до высоты 10-12см.
2.Определите цветность воды, рассматривая пробирку сверху на белом фоне при достаточном боковом освещении (дневном, искусственном.).
Подчеркните (или отметить галочкой) наиболее подходящий оттенок из приведенных в таблице либо заполните свободную линию в таблице.
Определение концентрации ионов двухвалентного железа.
К 5 мл воды добавить на кончике ножа (0,1 г) гидросульфата калия, 0,1 г смеси (красная кровяная соль и сахарная пудра 1:9) и хорошо взболтать. В присутствии ионов двухвалентного железа появляется сине-зеленое окрашивание.
Светло-сине-зеленый ? 1 — 6 мг/л
К 5 мл воды осторожно, по стенке пробирки, прибавить 1 мл реактива, полученного растворением 1 г дифениламина в 100 мл концентрированной серной кислоты. Если есть нитрат-ионы, то появляется синее окрашивание. Но этой реакции мешают нитрит-ионы, которые предварительно надо разрушить. К исследуемой воде добавляют несколько кристаллов хлорида аммония и кипятят 2-3 минуты. Образовавшийся нитрит аммония разрушается до азота и воды. После этого проводят реакцию с дифениламином.
Определение концентрации ионов трёхвалентного железа.
К 5 мл природной воды прибавить 1-2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданида аммония. В присутствии ионов трехвалентного железа появляется красный цвет.
Слабо-красновато-желтоватый ? 0,95 — 0,4 мг/л
желтовато-красный ? 0,4 — 1,0 мг/л
Определение концентрации ионов хлора
К 5 мл природной воды прибавить 1-2 капли 10%-ного раствора нитрата серебра, подкисленного азотной кислотой. Образуется осадок или муть.
хлопья, осаждаются сразу ? 50 — 100 мг/л
белый объемистый осадок ? более 100 мг/л
Определение концентрации сульфат-ионов
К 5 мл воды прибавить 4 капли 10%-ного раствора соляной кислоты и 4 капли 5%-ного раствора хлорида бария. Нагреть. Образуется муть или осадок.
— слабая муть через несколько минут ? 1 — 10 мг/л
— слабая муть сразу ? 10 — 100 мг/л
— сильная муть ? 100 — 500 мг/л
— большой осадок, быстро оседающий ? более 500 мг/л
источник
Ржавые потеки на раковине, унитазе или пластиковом трубопроводе свидетельствуют о том, что в воде присутствует железо, которое, окисляясь на воздухе, оставляет после себя следы соответствующего цвета.
Железо присутствует в природной воде изначально и человек употребляет его с водой. Плохо это или хорошо, когда «хорошо» переходит в «плохо», как определить этот предел количественно – ответы на эти и другие вопросы вы узнаете из этой статьи.
Врачи давно обратили внимание на то обстоятельство, что причиной усталости и плохого настроения, как правило, является дефицит железа в организме.
Дефицит этого важного для здоровья микроэлемента наблюдается у людей обоих полов в разные периоды жизни. Поэтому если вы замечаете, что у вас часто меняется настроение, и для этого нет видимых причин, то необходимо начать прием железосодержащих продуктов или препаратов.
Помимо того, что железо влияет на трудоспособность и настроение человека, оно имеет ряд других преимуществ:
- Железо является наиважнейшим элементом, участвующим в процессе формирования гемоглобина. Учитывая, что ежедневно происходит потеря большого количества железа в виде пота, мочи и кровотечений (например, менструальные выделения или порезы во время бритья), становится понятным, что это сказывается на качестве и количестве крови. Кроме того, железо участвует в транспортировки кислорода в клетки организма, что важно для правильного функционирования органов.
- Если в организме чувствуется недостаток железа, то мышцы становятся слабыми и дряблыми. Для спортсменов железо является важной составляющей эффективной тренировки. Железо помогает мышцам восстановиться в кратчайшие сроки.
- Мозг, так же как и мышцы, зависит от количества получаемого организмом железа. Если его недостаточно, то кровь не получает необходимого количества кислорода, от чего в первую очередь страдают мозговые клетки. Если же кислорода достаточно, то улучшается память, появляется стремление к новым знаниям. Врачи убеждены, что дефицит железа может повлиять на психическое здоровье человека.
- Крепкий иммунитет напрямую зависит от железа. Частые заболевания простудой и гриппом, сопровождающиеся упадком сил и вялостью, свидетельствуют о том, что организму не хватает этого микроэлемента. Чем ниже уровень железа, тем чаще приходится бороться за свое здоровье.
- Модницы давно поняли, что невозможно считаться красивой без ухоженных волос, чистой кожи и крепких ногтей. И если кератин временно делает волосы блестящими, то кожа и ногти будут выглядеть тусклыми и безжизненными без необходимого для их красоты железа.
- Железо помогает тем, кто хочет избавиться от лишнего веса либо желает держать его под контролем. Если его недостаточно, то организм не будет тратить энергию на сжигание жира, и ни диеты, ни тренировки не приведут к нужному результату.
Поэтому важно вовремя выявить этот избыток и устранить его. Как это сделать самостоятельно — читайте далее.
При высоком содержании в воде серной и соляной кислоты на вымытой посуде остаются зеленые или бурые пятна. Также о неудовлетворительном качестве воды говорит ее запах: рыбный, землистый или древесный. Это значит, что в своем составе она содержит органические соединения.
Если на серебряной посуде и на раковине остаются темноватые пятна, то вода из вашего крана содержит сероводород.
Возникновение пены при наливании воды в алюминиевую посуду говорит об избыточной концентрации щелочных соединений в ней.
Довольно часто встречающийся признак загрязненной воды – ее металлический привкус, показывающий высокое содержание в ней железа. А вода с красноватым и бурым оттенком свидетельствует о том, что ваш водопровод ржавый и старый, поэтому в трубах происходит окисление воды железом.
Мутная и грязная вода означает, что в ней содержится большое количество воздуха или метана.
Во многих городах существуют СЭС или мобильные лаборатории, изучающие качество воды, имеющие возможность проводить экспресс анализ воды на железо. Вы можете связаться с такой лабораторией и заказать анализ воды в вашем доме. Вам будет дан полный и точный ответ по этому вопросу.
В аккредитованных лабораториях проводится анализ воды на железо по ГОСТ 4011, который регламентирует порядок определения в воде двухвалентного железа (которое окисляется до ржавчины F2O3) и на общее железо.
Анализ воды на железо из скважины лучше всего производить непосредственно на месте, так как хранение и транспортировка образцов для анализа может привести к окислению железа при доступе воздуха и к выпадению окисла в осадок.
Если необходимо выполнить анализ воды на железо в лаборатории, отбираются пробы. Для проведения анализа потребуется не менее полутора литров воды, которые должны быть отобраны в чистую стеклянную или пластиковую тару. Очень важно, чтобы тара была чистой и не содержала остатков (даже запаха) жидкостей, которые в ней хранились. Хорошей посудой для отбора проб для анализа будет пластиковая бутылка от негазированной минеральной воды. Образец доставляется в лабораторию в течении двух часов.
Наиболее существенным в практическом значении является анализ воды на железо-ионы, потому что именно они влияют на образование накипи на посуде и нагревательных ТЭНах. И потеки ржавчины на сантехнике, в большей степени, зависят от активного железа, которое окисляется в воздушной среде.
Польза железа в воде для организма неоспорима, поэтому полностью избавляться от него с помощью фильтрации так же не стоит. Идеально очищенную с помощью обратного осмоса воду для этого специально минерализуют. Остаток железа в воде определяет анализ воды на общее железо.
Смягчать воду для бытовых нужд, безусловно, нужно (борьба с накипью, солями тяжелых металлов и азотными соединениями), но к содержанию в воде железа следует относиться бережно. Выдержать паритет в этом вопросе поможет своевременный и качественный анализ воды на железо, произведенный аккредитованной лабораторией.
источник



