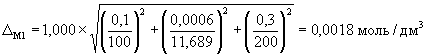Окисляемость показывает количество кислорода в миллиграммах, необходимого для окисления органических веществ, содержащихся в 1 дм³ воды.
Воды поверхностных и подземных источников имеют разную окисляемость — у подземных вод величина окисляемости незначительна, за исключением болотных вод и вод нефтяных месторождений. Окисляемость горных рек ниже, чем равнинных. Наибольшая величина окисляемости (до десятков мг/дм³) — у рек с питанием болотными водами.
Величина окисляемости закономерно изменяется в течение года. Окисляемость характеризуется несколькими величинами — перманганатной, бихроматной, йодатной окисляемостью (в зависимости от того, какой окислитель используется).
ПДК окисляемости воды имеют следующие значения: химическое потребление кислорода или бихроматная окисляемость (ХПК) водоемов питьевого назначения не должна превышать 15 мг О₂ /дм³. Для водоемов в зонах рекреации величина ХПК не должна превышать 30 мг О₂ /дм³.
Водородный показатель (pH) природной воды показывает количественное содержание в ней угольной кислоты и ее ионов.
Санитарно-гигиенические нормативы для водоемов разного типа водопользования (питьевого, рыбохозяйственного, рекреационных зон) устанавливают ПДК pH в интервале 6,5-8,5.
Концентрация ионов водорода, выраженная величиной pH — один из важнейших показателей качества воды. Величина pH имеет решающее значение при протекании многочисленных химических и биологических процессов в природной воде. Именно от величины pH зависит, какие растения и организмы будут развиваться в данной воде, каким образом будет происходить миграция элементов, от этой величины также зависит степень коррозионной активности воды на металлические и бетонные конструкции.
От величины pH зависят пути превращения биогенных элементов и степени токсичности загрязняющих веществ.
Жесткость природной воды проявляется вследствие содержания в ней растворенных солей кальция и магния. Суммарное содержание ионов кальция и магния является общей жесткостью. Жесткость можно выражать несколькими единицами измерения, на практике чаще используют величину мг-экв/дм³.
Высокая жесткость ухудшает бытовые характеристики и вкусовые свойства воды, оказывает неблагоприятное воздействие на здоровье человека.
ПДК по жесткости питьевой воды нормируется величиной 10,0 мг-экв/дм³.
К технической воде отопительных систем предъявляют более строгие требования по жесткости их-за вероятности образования накипи в трубопроводах.
Присутствие аммиака в природной воде обусловлено разложением азотсодержащих органических веществ. Если аммиак в воде образуется при разложении органических остатков (фекальное загрязнение), то такая вода непригодна для питьевых нужд. Аммиак определяется в воде по содержанию ионов аммония NH₄⁺.
ПДК аммиака в воде составляет 2,0 мг/дм³.
Нитриты NO₂⁻ являются промежуточным продуктом биологического окисления аммиака до нитратов. Процессы нитрификации возможны только в аэробных условиях, в противном случае природные процессы идут по пути денитрификации — восстановления нитратов до азота и аммиака.
Нитриты в поверхностных водах находятся в виде нитрит-ионов, в кислых водах частично могут быть в форме недиссоциированной азотистой кислоты (HN0₂).
Содержание нитритов в поверхностных водах существенно ниже, чем в водах подземного происхождения. Подземные воды верхних водоносных горизонтов могут содержать нитритов до десятых долей миллиграмма на литр.
ПДК нитритов в воде составляет 3,3 мг/дм³ (по нитрит-иону), или 1 мг/дм³ в пересчете на азот аммонийный. Для водоемов рыбохозяйственного назначения нормы составляют 0,08 мг/дм³ по нитрит-иону или 0,02 мг/дм³ в пересчете на азот.
Нитраты по сравнению с другими азотными соединениями наименее токсичны, однако в значительных концентрациях вызывают вредные последствия для организмов. Основная опасность нитратов — в их способности накапливаться в организме и окисляться там до нитритов и нитрозаминов, которые значительно более токсичны и способны вызывать так называемое вторичное и третичное нитратное отравление.
Накопление больших количеств нитратов в организме способствует развитию метгемоглобинемии. Нитраты вступают в реакцию с гемоглобином крови и образуют метгемоглобин, которые не переносит кислород и, таким образом, вызывает кислородное голодание тканей и органов.
Подпороговая концентрация нитрата аммония, не оказывающая вредных последствий на санитарный режим водоема составляет 10мг/дм³.
Для водоемов рыбохозяйственного назначения повреждающие концентрации нитратов аммония для различных видов рыб начинаются с величин порядка сотен миллиграммов на литр.
ПДК нитратов для питьевой воды составляет 45 мг/дм³ , для рыбохозяйственных водоемов —40 мг/дм³ по нитратам или 9,1 мг/дм³ по азоту.
Хлориды в повышенной концентрации ухудшают вкусовые качества воды, а при высокой концентрации делают воду непригодной для питьевых целей. Для технических и хозяйственных целей содержание хлоридов также строго нормируется. Вода, в которой много хлоридов непригодна для орошения сельскохозяйственных насаждений.
ПДК хлоридов в питьевой воде не должно превышать 350 мг/дм³, в воде рыбохозяйственных водоемов — 300мг/дм³.
Сульфаты в питьевой воде ухудшают ее органолептические показатели, при высоких концентрациях оказывают физиологическое воздействие на организм человека. Сульфаты в медицине используются как слабительное средство, поэтому их содержание в питьевой воде строго нормируется.
Содержание сульфатов в технической воде также подлежит контролю. В присутствии кальция сульфаты образуют накипь, что важно учитывать при подготовке вод, питающих паросиловые установки.
Содержание сульфатов в промышленной и питьевой воде может быть благоприятным или нежелательным фактором.
Сульфат магния определяется в воде на вкус при содержании от 400 до 600 мг/дм³, сульфат кальция — от 250 до 800 мг/дм³.
ПДК сульфатов для питьевой воды — 500 мг/дм³, для вод рыбохозяйственных водоемов —100 мг/дм³.
О влиянии сульфатов на процессы коррозии нет достоверных данных, но отмечается, что при содержании сульфатов в воде свыше 200 мг/дм³ из свинцовых труб вымывается свинец.
Соединения железа поступают в природную воду из природных и антропогенных источников. Значительные количества железа поступают в водоемы вместе со сточными водами металлургических, химических, текстильных и сельскохозяйственных предприятий.
При концентрации железа свыше 2 мг/дм³ ухудшаются органолептические показатели воды— в частности, появляется вяжущий привкус.
Высокое содержание железа делает воду непригодной для питьевых и технических целей.
ПДК железа в питьевой воде 0,3 мг/дм³,при лимитирующем показатели вредности – органолептическом. Для вод рыбохозяйственных водоемов — 0,1 мг/дм³, лимитирующий показатель вредности — токсикологический.
Высокие концентрации фтора наблюдаются в сточных водах стекольных, металлургических и химических производств (при производстве удобрений, стали, алюминия и др.), а также на горнорудных предприятиях.
Содержание фтора в питьевой воде нормируется. Повышенное содержание фтора в питьевой воде вызывает заболевание костной ткани — флюороз. Недостаток фтора тоже опасен. В местностях, где в питьевой воде содержание фторидов понижено – менее 0,01 мг/дм³, у людей чаще развивается кариес зубов.
ПДК по фтору в питьевой воде составляет 1,5 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
Щелочность — показатель, логически противоположный кислотности. Щелочность природных и технических вод – способность содержащихся в них ионов нейтрализовать эквивалентное количество сильных кислот.
Показатели щелочности воды необходимо учитывать при реагентной подготовке воды, в процессах водоснабжения, при дозировании химических реагентов.
Если концентрация щелочноземельных металлов повышена, знание щелочности воды необходимо при определении пригодности воды для систем орошения.
Щелочность воды и показатель pH используются в расчете баланса угольной кислоты и определении концентрации карбонат-ионов.
Поступление кальция в природные воды идет из естественных и антропогенных источников. Большое количество кальция поступает в природные водоемы со стоками металлургических, химических, стекольных и силикатных производств, а также при стоке с поверхности сельхозугодий, где применялись минеральные удобрения.
ПДК кальция в воде рыбохозяйственных водоемов составляет 180 мг/дм³.
Ионы кальция относятся к ионам жесткости, которые образуют прочную накипь в присутствии сульфатов, карбонатов и некоторых других ионов. Поэтому содержание кальция в технических водах, питающих паросиловые установки, строго контролируется.
Количественное содержание в воде ионов кальция необходимо учитывать при исследовании карбонатно-кальциевого равновесия, а также при анализе происхождения и химсостава природных вод.
Алюминий известен как легкий серебристый металл. В природных водах он присутствует в остаточных количествах в виде ионов или нерастворимых солей. Источники попадания алюминия в природные воды — сточные воды металлургических производств, переработки бокситов. В процессах водоподготовки соединения алюминия применяют в качестве коагулянтов.
Растворенные соединения алюминия отличаются высокой токсичностью, способны накапливаться в организме и приводить к тяжелым поражениям нервной системы.
ПДК алюминия в питьевой воде не должна превышать 0,5 мг/дм³.
Магний — один из важнейших биогенных элементов, играющий большую роль в жизнедеятельности живых организмов.
Антропогенные источники поступления магния в природные воды— сточные воды металлургии, текстильной, силикатной промышленности.
ПДК магния в питьевой воде — 40 мг/дм³.
Натрий — щелочной металл и биогенный элемент. В небольших количествах ионы натрия выполняют важные физиологические функции в живом организме, в высоких концентрациях натрий вызывает нарушение работы почек.
В сточных водах натрий поступает в природные воды преимущественно с орошаемых сельхозугодий.
ПДК натрия в питьевой воде составляет 200 мг/дм³.
Элемент марганец содержится в природе в виде минеральных соединений, а для живых организмов является микроэлементом, то есть в малых количествах необходим для их жизнедеятельности.
Значительное поступление марганца в природные водоемы происходит со стоками металлургических и химических предприятий, горно-обогатительных фабрик и шахтных производств.
ПДК ионов марганца в питьевой воде —0,1 мг/дм³, при лимитирующем показателе вредности органолептическом.
Избыточное поступление марганца в организм человека нарушает метаболизм железа, при тяжелых отравлениях возможны серьезные психические расстройства. Марганец способен постепенно накапливаться в тканях организма, вызывая специфические заболевания.
Используемый для обеззараживания воды гипохлорит натрия присутствует в воде в виде хлорноватистой кислоты или иона гипохлорита. Использование хлора для дезинфекции питьевых и сточных вод, несмотря на критику метода, до сих пор широко используется.
Хлорирование также применяется в процессах изготовления бумаги, ваты, для дезинсекции холодильных установок.
В природных водоемах активный хлор присутствовать не должен.
ПДК свободного хлора в питьевой воде 0.3 — 0.5 мг/дм³.
Нефтепродукты — одни из наиболее опасных загрязнителей природных водоемов. Нефтепродукты попадают в природные воды несколькими путями: в результате разливов нефти при авариях нефтеналивных судов; со сточными водами нефтегазовой промышленности; со сточными водами химических, металлургических и других тяжелых производств; с хозяйственно-бытовыми стоками.
Небольшие количества углеводородов образуются в результате биологического разложения живых организмов.
Для санитарно-гигиенического контроля определяются показатели содержания растворенной, эмульгированной и сорбированной нефти, поскольку каждый перечисленный вид по-разному влияет на живые организмы.
Растворенные и эмульгированные нефтепродукты оказывают многообразное неблагоприятное воздействие на растительный и животный мир водоемов, на здоровье человека, на общее физико-химическое состояние биогеоценоза.
ПДК нефтепродуктов для питьевой воды —0,3 мг/дм³, при лимитирующем показатели вредности органолептическом. Для водоемов рыбохозяйственного назначения ПДК нефтепродуктов 0,05 мг/дм³.
Полифосфатные соли используются в процессах водоподготовки для умягчения технической воды, в качестве компонента средств бытовой химии, как катализатор или ингибитор химических реакций, как пищевая добавка.
ПДК полифосфатов для воды хозяйственно-питьевого назначения — 3,5 мг/дм³, при лимитирующем показатели вредности органолептическом.
Кремний – распространенный в земной коре элемент, входит в состав многих минералов. Для организма человека является микроэлементом.
Значительное содержание кремния наблюдается в сточных водах керамических, цементных, стекольных и силикатных производств, при производстве вяжущих материалов.
ПДК кремния в питьевой воде — 10 мг/дм³.
Сульфиды — серосодержащие соединения, соли сероводородной кислоты H₂S. В природных водах содержание сероводорода позволяет судить об органическом загрязнении, поскольку сероводород образуется при гниении белка.
Антропогенные источники сероводорода и сульфидов — хозяйственно-бытовые сточные воды, стоки металлургических, химических и целлюлозных производств.
Высокая концентрация сероводорода придает воде характерный неприятный запах (тухлых яиц) и токсичные свойства, вода становится непригодной для технических и хозяйственно-питьевых целей.
ПДК по сульфидам — в водоемах рыбохозяйственного назначения содержание сероводорода и сульфидов недопустимо.
Химически активный металл, в естественной форме является микроэлементом растительных и животных организмов.
Повышенные поступления стронция в организм изменяют метаболизм кальция в организме. Возможно развитие стронциевого рахита или «уровской болезни», при которой наблюдается задержка роста и искривление суставов.
Радиоактивные изотопы стронция вызывают у человека канцерогенный эффект или лучевую болезнь.
ПДК природного стронция в питьевой воде составляет 7 мг/дм³, при лимитирующем показателе вредности санитарно-токсикологическом.
источник
Соль и перец – две основные специи современной русской кухни. С первой отношение у людей складываются довольно противоречиво. В семнадцатом веке люди в Москве устроили бунт, названный впоследствии Соляным. Его причиной стало повышение цен на продукт, без которого невозможно представить себе консервацию, закваску и хранение мясо в то время. А вот в наши дни люди отказываются от его использования. Потому что врачи и диетологи нам твердят о вредности поваренной соли. Но так ли это?
Прежде чем бездумно следовать моде и отказываться от поваренной соли нужно разобраться, что это такое и почему она веками была так нужна человечеству. Этот пищевой продукт химики называют хлорид натрия (NaCl). И он действительно жизненно необходим человеческому организму. Хлор участвует в образование желудочного сока. А вот многофункциональный натрий:
- поддерживает водно-солевой баланс и осмотическое давление в кровеносных и лимфатических сосудах;
- участвует в передаче нервных импульсов, транспортировке аминокислот и глюкозы через клеточные мембраны;
- помогает снабжать ткани кислородом и способствует усвоению питательных веществ;
- отвечает за сокращение мышечных волокон.
Естественно, во всем нужна мера. Суточная норма потребления этого макроэлемента составляет 1300 мг для взрослого человека и уменьшается вместе с возрастом. Но вот откуда нам ждать опасности: от соленых продуктов или от солей натрия в питьевой воде.
В природе любой водный источник в своем составе может похвастаться многими элементами периодической системы. В то числе, натрием. Этот мягкий металл попадает в грунтовые и артезианские воды в результате размывания магматических пород. В реках и озерах этот загрязнитель оказывается вместе со стоками промышленных предприятий, канализационными отходами, удобрениями с орошаемых сельскохозяйственных полей и ферм. В результате круговорота веществ в Мировом океане и отсутствия или неисправности водоочистных сооружений, он оказывается в водопроводе или скважине. Предельно допустимая концентрация (ПДК) натрия в воде составляет 200 мг/дм³. Превышение этого уровня негативно сказывается на здоровье. Первыми сигналами большого количества Na будут:
- отечность;
- тошнота;
- потеря аппетита;
- тяжелая отдышка;
- сильная жажда;
- высокое давление;
- гиперактивность;
- судороги в мышцах.
В дальнейшем избыток натрия в воде может привести к серьезным нарушениям в работе почек и сердечно-сосудистой системы.
Мы не будем разбираться в том, кто в этом виноват. Мы поделимся решением проблемы с вечным лозунгом: «Что делать?». Солоноватый (а иногда даже с привкусом горечи) вкус воды говорит о содержании большого количества натрия в воде. Чтобы узнать точное значение, закажите химический анализ в лаборатории «ИОН». Наши сотрудники работают оперативно и качественно: консультанты помогут подобрать нужный анализ, курьеры в кратчайшие сроки отберут пробу, соблюдая все тонкости и правила забора (если вы решите отвезти ее самостоятельно, ознакомьтесь с инструкцией). Лаборанты определяют количество металла методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и разрабатывают рекомендации для дальнейшей работы – установки очистных сооружений.
Большинство регионов России отличаются повышенным содержанием кальция в скважинах и водопроводах. Это объясняется природными процессами. К ним можно отнести выветривание, размывание грунтовыми источниками горных и осадочных пород.
источник
Работаем на рынке
с 2010 года
Предельно понятное
ценообразование
Свыше 5 000 довольных
клиентов по всей России
Нас рекомендуют! каждый третий клиент приходит по рекомендации
Индивидуальная ценовая политика при больших объемах
В состоянии найти комплексное решение даже для сложных задач
- атмосферные (снег, дождь);
- подземные (грунтовые, артезианские, родниковые, колодезные);
- поверхностные (океаны, моря, озера и т.п.).
Как известно, состав природных вод, распределенных по поверхности, имеет некоторые отличия в зависимости от территории на которой они находятся и от источника питания воды. На самом деле, природная вода — это раствор, который имеет в своем составе растворенные газы, и разнообразные химические соединения.
Выделяют четыре вида (или источника) водного питания природных вод: дождевое, снеговое, ледниковое и подземное. При этом источники питания могут быть антропогено-загрязненными.
Опасными загрязнителями являются соли тяжелых металлов(ртути, свинца, железа, меди), а так же нефть и нефтепродукты. Нефтью поражена пятая часть мирового океана. Если размер нефтяного пятна превышает 10 кв.м, то он приводит к смерти живых организмов, птиц и млекопитающих, мешает фотосинтезу и газообмену между атмосферой и гидросферой. Еще одним видом химического загрязнения является высокое содержание в них фосфатов и нитратов. Это приводит к перенасыщению водоемов удобрениями и возникновению в них интенсивного роста микроорганизмов-водорослей. Размножающиеся водоросли поглощают из воды большие объемы кислорода, растения и животные не могут существовать в такой среде и погибают, образовывая микроорганизмы которые способны разлагать растительные и животные ткани, в результатом происходит загнивание водоема — превращение его в болото. Органическое загрязнение — наличие в сточных водах веществ органического происхождения, губительно влияют на водоемы. Оседая на дно, они могут задерживать или прекращать жизнедеятельность микроорганизмов очищающих воду. При гниении остатков образуются отравляющие вещества, которые загрязняют всю воду в водоеме. Также наличие органических остатков мешает проникновению света в глубь воды, замедляя процесс фотосинтеза.
Под загрязненностью понимают такое состояние водного объекта в официально установленном месте его использования, при котором наблюдается отклонение от нормы в сторону увеличения тех или иных нормируемых компонентов. Санитарное состояние водных объектов и качество их воды у мест водопользования должны соответствовать нормативным показателям, т.е. ПДК.
Санитарные правила устанавливают нормируемые параметры воды водоемов: содержание плавающих примесей и взвешенных веществ, запах, привкус, окраска и температура воды, значение pH, состав и концентрация минеральных примесей и растворенного в воде кислорода, биологическая потребность воды в кислороде, состав и ПДК ядовитых и вредных веществ и болезнетворных бактерий.
Анализ природных вод необходим:
- изыскательским, проектно-изыскательскими организациям, предприятиям, объединениям, а также иными юридическим и физическим лицами, осуществляющими деятельность в области инженерных изысканий для строительства на территории Российской Федерации.
- органам государственной власти Российской Федерации, органам государственной власти субъектов Российской Федерации, органам местного самоуправления, юридическим и физическим лицам, хозяйственная и иная деятельность которых оказывает воздействие на окружающую среду.
- субъектам Российской Федерации, муниципальным образованиям, физическим лицам, юридическим лицам у которых в границах земельного участка, принадлежащего им на праве собственности, имеется водный объект.
Основанием для проведения анализа природных вод является требования таких нормативов как:
- СП 11-102-97 Инженерно-экологические изыскания для строительства;
- Федеральный закон «Об охране окружающей среды» от 10.01.2002 г. №7-ФЗ;
- Положение об оценке воздействия намечаемой хозяйственной деятельности на окружающую среду в РФ, утвержденное Приказом Госкомэкологии России от 16.05.2000 г. №372;
- Водный кодекс РФ от 16.10.1995 г. №167-ФЗ, статья 78.
ИЛ «АЛЬФАЛАБ» проводит испытания всех типов вод, включая природные воды. ИЛ «АЛЬФАЛАБ» аккредитованная лаборатория, которая работает на рынке услуг по анализу воды с 2015 года. Область аккредитации ИЛ имеет обширный перечень показателей, определяемых в природных водах.
Для расчета стоимости услуги по анализу природной воды нам необходима следующая информация:
- объемы работ (количество проб);
- перечень показателей;
- требуется ли выезд специалиста для отбора проб;
- территориальное расположение водного объекта;
- периодичность отбора проб, если это требуется.
После получения всей необходимой информации лаборатория обрабатывает запрос и формирует коммерческое предложение. При возникновении, каких либо вопросов заказчик всегда вправе задать их лаборатории и проконсультироваться по вопросу анализа природных вод. После уточнения всех нюансов лаборатория приступает к работам по анализу проб. В течении трех календарных дней лаборатория готова выехать на объект для отбора проб, любого территориального расположения. Лаборатория работает строго согласно методикам испытаний и имеет полное техническое оснащение для проведения анализа «первого дня» на содержание показателей, концентрация которых имеет свойство меняться во времени.
После доставки проб в лабораторию, их регистрируют и передают в аналитические залы для дальнейшего анализа.
Испытание природных вод на содержание различных веществ проводят различными химическими и физико-химическими методами: титриметрический, фотометрический, гравиметрический, спектрометрический, хроматографический и др. методы
В анализе воды титриметриметрия используется для определения следующих показателей: ион хлорида, гидрокарбонаты, сульфаты, определение жесткости и перманганатной окисляемости.
При выполнении весовых определений определяемый компонент смеси, или составную часть (элемент, ион) вещества количественно связывают в такое химическое соединение, в виде которого она может быть выделена и взвешена (так называемая гравиметрическая форма, ранее она именовалась «весовая форма»). Состав этого соединения должен быть строго определённым, то есть точно выражаться химической формулой, и оно не должно содержать каких-либо посторонних примесей.
В анализе различных типов вод гравиметрия используется для определения сухого остатка и взвешенных веществ.
- Атомно-эмиссионный спектральный анализ, который проводится по спектрам излучения атомов, возбужденных различными способами (нагреванием, бомбардировкой ускоренными частицами, электромагнитным излучением и т.д.);
- Атомно-абсорбционной спектральный анализ, осуществляемый по спектрам поглощения при прохождении света сквозь атомные газы или пары;
В анализе вод спектрометрия в первую очередь используется в определение тяжелых металлов: медь, свинец, мышьяк, никель кадмий и тд.
В зависимости от агрегатного состояния подвижной фазы системы, в которой проводят разделение смеси веществ на отдельные компоненты, различают газовую, газожидкостную хроматографию и жидкостную хроматографию. В отличие от газовой и газожидкостной хроматографии, пригодных для разделения только смесей газов и веществ, которые можно перевести в парообразное состояние без разложения, жидкостная хроматография позволяет разделять многочисленные органические и неорганические соединения.
В водной лаборатории хроматография используется для определения различных органических загрязнителей: различных производных бензола и толуола, различных полихлорированных бифенилов, пестицидов и очень опасного соединения обладающего канцерогенными свойствами-бенз(а)пирена.
Результатом работ по анализу природных вод является протоколом испытаний установленной формы, в котором отражена вся необходимая и доступная информация для правильной обработки результатов.
источник
Натрий является одним из главных компонентов химического состава природных вод и по распространённости среди катионов стоит на первом месте, составляя больше половины их общего содержания.
Основными источниками поступления натрия в поверхностные воды суши являются изверженные, осадочные породы и самородные растворимые хлористые (галит, сильвинит) и сернокислые (мирабилит) соли натрия. Кроме того, натрий поступает в природные воды с хозяйственно-бытовыми и промышленными сточными водами и с водами, сбрасываемыми с орошаемых полей. Источником его также могут быть засоленные почвы, из которых он вымывается атмосферными осадками. Большое значение имеют и биологические процессы, протекающие на водосборе, в результате которых образуются растворимые соединения натрия.
Натрий обладает высокой миграционной способностью, что обусловлено хорошей растворимостью его соединений в воде, слабо выраженной способностью к сорбции взвесями и донными отложениями. В поверхностных водах натрий мигрирует преимущественно в растворённом состоянии в виде иона. Концентрация его в речных водах колеблется от первых единиц до сотен миллиграммов в кубическом дециметре в зависимости от физико-географических условий и геологических особенностей бассейнов водных объектов. Обычно в поверхностных водах суши концентрация натрия не превышает 300 мг/дм 3 , но в некоторых случаях может достигать граммов в кубическом дециметре (например, в солёных озерах, небольших реках засушливых регионов с преимущественно подземным питанием).
В подземных водах концентрация натрия колеблется в более широких пределах — от миллиграммов до граммов и десятков граммов в кубическом дециметре. Это определяется составом водовмещающих пород, глубиной залегания подземных вод и другими условиями.
Внутригодовые изменения концентрации хлоридов в поверхностных водах суши связаны, в основном, с гидрологическим режимом водных объектов.
Для водных объектов рыбохозяйственного назначения предельно-допустимая концентрация (ПДК) натрия составляет 120 мг/дм 3 ; для объектов хозяйственно-питьевого и культурно-бытового назначения ПДК равна 200 мг/дм 3 .
МАССОВАЯ КОНЦЕНТРАЦИЯ НАТРИЯ В ВОДАХ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ С
ИОНСЕЛЕКТИВНЫМ ЭЛЕКТРОДОМ
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) массовой концентрации натрия в природных и очищенных сточных водах в диапазоне от 0,23 до 2300 мг/дм 3 потенциометрическим методом с ионселективным электродом.
При анализе проб воды с массовой концентрацией натрия, превышающей 2300 мг/дм 3 , допускается выполнение измерений после разбавления пробы дистиллированной водой таким образом, чтобы массовая концентрация натрия в разбавленной пробе находилась в пределах указанного выше диапазона измеряемых концентраций.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы
ГОСТ 12.1.005-88 ССБТ Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ Вредные вещества Классификация и общие требования безопасности
ГОСТ 17.15.04-81 Охрана природы Гидросфера Приборы и устройства для отбора, первичной обработки и хранения проб природных вод Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа.
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, А.3, А.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих при принятой вероятности Р = 0,95
Показатель повторяемости (среднеквадратическое отклонение повторяемости)
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости)
Показатель правильности (границы систематической погрешности)
Показатель точности (границы погрешности)
При выполнении измерений в пробах с массовой концентрацией натрия свыше 2300 мг/дм 3 после соответствующего разбавления погрешность измерений массовой концентрации натрия в исходной пробе ± D находят по формуле
где ± D 1 — показатель точности измерения массовой концентрации натрия в разбавленной пробе, рассчитанный по уравнению таблицы 1;
Предел обнаружения натрия потенциометрическим методом равен 0,2 мг/дм 3 .
3.2 Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения измерений;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
4.1.1 Мономер любого типа или рН-метр, работающий в режиме милливольтметра, снабжённый магнитной мешалкой (например, И-500, ТУ 4215-002-18294344-02; «Экотест-2000», ТУ 4215-005-41541647-99 и др.).
4.1.2 Электрод измерительный ЭСЛ-51-07, ТУ 25-05.1744-77, ЭС-10-07, ТУ 25-0519.072-86, или другого типа с аналогичными характеристиками.
4.1.3 Электрод вспомогательный хлорсеребрянный ЭВЛ-1МЗ, ТУ 25.05.2181-77 с минимальной скоростью истечения раствора хлорида калия через ключ (не более 1,0 см 3 в сутки) или другого типа с аналогичными характеристиками.
4.1.4 Весы лабораторные высокого (II) класса точности по ГОСТ 24104-2001.
4.1.5 Весы лабораторные среднего (III) класса точности по ГОСТ 24104-2001 с наибольшим пределом взвешивания 500 г.
4.1.6 Термометр с диапазоном измерения температур от 0 °С до 50 °С и ценой деления не более 0,5 °С, по ГОСТ 29224-91.
4.1.7 Колбы мерные 2 класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью 100 см 3 — 9 шт., 200 см 3 — 4 шт., 500 см 3 — 1 шт.
4.1.8 Пипетки градуированные 2 класса точности исполнения 1, 2 по ГОСТ 29227-91 вместимостью 1 см 3 — 1 шт., 2 см 3 — 2 шт., 5 см 3 — 3 шт.
4.1.9 Пипетки с одной отметкой 2 класса точности исполнения 2, по ГОСТ 29169-91 вместимостью 5 см 3 — 3 шт., 10 см 3 — 1 шт., 20 см — 3 шт., 25 см — 1 шт.
4.1.10 Цилиндры мерные исполнения 1, 2 по ГОСТ 1770-74 вместимостью 50 см 3 — 2 шт., 100 см 3 — 1 шт., 500 см 3 — 1 шт.
4.1.11 Стаканы В-1, ТХС по ГОСТ 25336-82 вместимостью 50 см 3 — 30 шт., 250 см 3 — 2 шт., 600 см 3 — 1 шт., 1000 см 3 — 1 шт.
4.1.12 Стаканчик для взвешивания (бюкс) СВ-24/10 по ГОСТ 25336-82 — 1 шт.
4.1.13 Воронки лабораторные, тип В по ГОСТ 25336-82 диаметром 56 мм — 2 шт.
4.1.14 Чашка выпарительная № 2 по ГОСТ 9147-80.
4.1.15 Эксикатор исполнения 2 с диаметром корпуса 140 мм или 190 мм по ГОСТ 25336-82.
4.1.16 Посуда полиэтиленовая (полипропиленовая) для хранения проб и растворов вместимостью 0,1; 0,25; 1 дм 3 .
4.1.17 Электроплитка с закрытой спиралью по ГОСТ 14919-83.
4.1.18 Шкаф сушильный общелабораторного назначения с диапазоном температур до 300 °С.
Примечание — Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2.1 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, х.ч.
4.2.2 Калий хлористый (хлорид калия) по ГОСТ 4234-77, х.ч.
4.2.4 Кислота соляная по ГОСТ 3118-77, х.ч.
4.2.5 Кальций углекислый (кальция карбонат) по ГОСТ 4530-76, х.ч. или кальция хлорид импортный с содержанием натрия не более 0,01 %.
4.2.6 Хлорид кальция обезвоженный, ТУ 6-09-4711-81, ч. (для эксикатора).
4.2.6 Вода дистиллированная по ГОСТ 6709-72.
4.2.7 Фильтры мембранные «Владипор МФАС-ОС-2», 0,45 мкм, ТУ 6-55-221-1-29-89 или другого типа, равноценные по характеристикам или фильтры бумажные обеззоленные «синяя лента», ТУ 6-09-1678-86.
4.2.8 Фильтровальная бумага по ГОСТ 12026-76.
Примечание — Допускается использование реактивов, изготовленных по другой нормативно- технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
Выполнение измерений основано на изменении потенциала ионселективного электрода в зависимости от активности ионов натрия в растворе. Измерения проводят в присутствии аммиака и индифферентного электролита (хлорида кальция), поддерживающих в анализируемом растворе определенное значение рН и ионной силы, что позволяет градуировать прибор в единицах концентрации, а не активности ионов натрия. Концентрацию натрия в пробе находят, исходя из градуировочной зависимости величины электродного потенциала от значения обратного логарифма активности (концентрации) ионов натрия ( pNa ).
6.1 При выполнении измерений массовой концентрации натрия в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в национальных стандартах и соответствующих нормативных документах.
6.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся к 3, 4 классам опасности по ГОСТ 12.1.007.
6.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
6.4 Особых требований по экологической безопасности не предъявляется.
К выполнению измерений допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы в лаборатории не менее года и освоившие методику анализа.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— температура окружающего воздуха (22 ± 5) °С;
— атмосферное давление от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
— влажность воздуха не более 80 % при 25 °С;
— напряжение в сети (220 ± 10) В;
— частота переменного тока в сети питания (50 ± 1) Гц.
Отбор проб для выполнения измерений массовой концентрации натрия производится в соответствии с ГОСТ 17.1.5.05 и ГОСТ Р 51592. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ Р 51592. Пробы помещают в плотно закрывающуюся полиэтиленовую или полипропиленовую посуду. Мутные пробы фильтруют через мембранный фильтр 0,45 мкм, очищенный кипячением в дистиллированной воде, или бумажный фильтр «синяя лента». Первые порции фильтрата отбрасывают. Объем отбираемой пробы не менее 100 см 3 .
10.1.1 Раствор хлорида кальция, 1 моль/дм 3
10.1.1.1 При наличии в лаборатории хлорида кальция необходимой степени чистоты, взвешивают в химическом стакане вместимостью 250 см 3 110 г хлорида кальция 6-водного или 56 г безводного и растворяют в дистиллированной воде. Раствор количественно переносят в мерную колбу вместимостью 500 см 3 . Объем раствора доводят дистиллированной водой до метки на колбе и перемешивают.
10.1.1.2 Для приготовления раствора из карбоната кальция взвешивают в химическом стакане вместимостью 600 см 3 50 г карбоната кальция, смачивают его 60 — 80 см 3 дистиллированной воды и медленно (вначале — по каплям) приливают при перемешивании 90 см 3 соляной кислоты. Выдерживают до растворения карбоната и проверяют рН универсальной индикаторной бумагой. Значение рН должно быть в пределах от 5 до 7. Если в полученном растворе рН оказался ниже 5, следует добавить несколько капель аммиака до получения требуемого значения рН. Раствор количественно переносят в мерную колбу вместимостью 500 см 3 . Объем раствора доводят дистиллированной водой до метки на колбе и перемешивают.
10.1.1.3 Хранят раствор хлорида кальция в плотно закрытой полиэтиленовой или полипропиленовой посуде.
10.1.2 Раствора аммиака 0,1 моль/дм 3
В стакан вместимостью 1000 см 3 помещают 500 см 3 дистиллированной воды, приливают пипеткой 3,8 см аммиака водного и перемешивают. Хранят раствор в плотно закрытой полиэтиленовой или полипропиленовой посуде.
10.1.3 Насыщенный раствор хлорида калия
В 140 см 3 дистиллированной воды при температуре 50 — 60 °С растворяют 60 г хлорида калия. После охлаждения используют раствор над осадком для заполнения вспомогательного электрода.
10.2.1 Градуировочные растворы готовят из аттестованного раствора с массовой концентрацией натрия 22,99 г/дм 3 (молярной концентрацией 1,000 моль/дм 3 ). Методика приготовления аттестованного раствора приведена в приложении А.
10.2.2 Для приготовления градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 аттестованного раствора с молярной концентрацией 1,000 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 1,00.
10.2.3 Для приготовления градуировочного раствора № 2 с молярной концентрацией натрия 2,50 · 10 -2 моль/дм 3 отбирают пипеткой с одной отметкой 25,0 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 1,60.
10.2.4 Для приготовления градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,00.
10.2.5 Для приготовления градуировочного раствора № 4 с молярной концентрацией натрия 5,00 · 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,30.
10.2.6 Для приготовления градуировочного раствора № 5 с молярной концентрацией натрия 2,00 × 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 градуировочного раствора № 3 с молярной концентрацией натрия 1,00 × 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,70.
10.2.7 Для приготовления градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,00.
10.2.8 Для приготовления градуировочного раствора № 7 с молярной концентрацией натрия 5,00 · 10 -4 моль/дм 3 отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,30.
10.2.9 Для приготовления градуировочного раствора № 8 с молярной концентрацией натрия 2,00 · 10 -44 моль/дм 3 отбирают пипеткой с одной отметкой 20,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,70.
10.2.10 Для приготовления градуировочного раствора № 9 с молярной концентрацией натрия 1,00 · 10 -4 моль/дм отбирают пипеткой с одной отметкой 10,00 см градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,00.
10.2.11 Для приготовления градуировочного раствора № 10 с молярной концентрацией натрия 5,00 · 10 -5 моль/дм отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,30.
10.2.12 Для приготовления градуировочного раствора № 11 с молярной концентрацией натрия 2,00 · 10 -5 моль/дм 3 отбирают градуированной пипеткой 2,00 см градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,70.
10.2.13 Для приготовления градуировочного раствора № 12 с молярной концентрацией натрия 1,00 · 10 -5 моль/дм 3 отбирают градуированной пипеткой 1,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 5,00.
10.2.14 Градуировочные растворы натрия хранят в полиэтиленовой или полипропиленовой посуде с плотно закрывающейся пробкой. Градуировочные растворы № 1 — 3 хранят не более 3 мес, растворы № 4 — 6 — не более мес, № 7 — 12 не более недели.
Подготовку иономера, измерительного и вспомогательного электродов к работе осуществляют в соответствии с руководством по эксплуатации или паспортом.
Вспомогательный электрод хранят в насыщенном растворе хлорида калия.
Измерительный электрод между измерениями следует хранить в растворе с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , не допуская высыхания мембраны электрода. Перед выполнением измерений электрод выдерживают в дистиллированной воде в течение часа.
10.4.1 Для установления градуировочных зависимостей в диапазоне pNa от 2,70 до 5,00 в три стакана вместимостью 50 см 3 мерным цилиндром вместимостью 50 см 3 вносят по 30 см 3 каждого из градуировочных растворов № 5 — 12, добавляют в каждый стакан по 2,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см раствора аммиака, 0,1 моль/дм 3 .
10.4.2 Для установления градуировочных зависимостей в диапазоне pNa от 1,00 до 2,70 в три стакана вместимостью 50 см 3 мерным цилиндром вместимостью 50 см 3 вносят по 30 см 3 каждого из градуировочных растворов № 1 — 5, добавляют в каждый стакан по 4,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
10.4.3 Один из трех стаканов устанавливают на магнитную мешалку, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и перемешивают раствор в течение 3 мин. Затем этот стакан убирают (не регистрируя значение потенциала), помещают на мешалку стакан со второй аликвотой этого же градуировочного раствора, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и после установления постоянного значения потенциала записывают показания иономера. Повторяют измерение с третьей аликвотой этого градуировочного раствора.
10.4.4 Измерения проводят, начиная от меньшей концентрации натрия ( pNa = 5,00) к большей (pNa = 1,00). За результат принимают среднее арифметическое двух измерений. Градуировочные зависимости для диапазонов pNa от 5,00 до 4,00 включительно, от 4,00 до 2,70 включительно и от 2, 70 до 1,00 включительно рассчитывают методом наименьших квадратов в координатах: значения pNa градуировочных растворов (отрицательный логарифм молярной концентрации натрия — lg [Na + ]) — соответствующие им значения потенциала в милливольтах. Одновременно измеряют и записывают температуру градуировочных растворов. Разница в температуре для разных градуировочных растворов не должна составлять более 1 °С.
10.4.5 Градуировочные зависимости устанавливают перед каждой серией измерений массовой концентрации натрия в пробах воды, а также при замене измерительного и (или) вспомогательного электродов.
Допускается устанавливать градуировочные зависимости для одного или двух диапазонов pNa, если в анализируемых пробах воды концентрация натрия не выходит за их пределы.
10.4.6 Если руководством по эксплуатации прибора предусмотрен иной способ установления градуировочной зависимости (градуировки), то допускается устанавливать её в соответствии с руководством по эксплуатации данного прибора для каждого из диапазонов, указанных в 10.4.4. Установление одной градуировочной зависимости для всего диапазона измеряемых концентраций не допускается.
В том случае, когда градуировочные зависимости для конкретного прибора устанавливают по меньшему числу градуировочных растворов, чем предусмотрено в 10.4.1 и 10.4.2, после их установления следует выполнить контроль стабильности градуировочных характеристик в соответствии с 10.5.
10.5.1 Средствами контроля являются градуировочные растворы № 1 — 12 по 10.2 (не менее 2-х растворов для каждого диапазона). Градуировочная характеристика считается стабильной при выполнении условия
где X — результат контрольного измерения массовой концентрации натрия в градуировочном растворе, мг/дм 3 ;
С m — приписанное значение массовой концентрации натрия в градуировочном растворе, мг/дм 3 ;
s R — показатель воспроизводимости для концентрации С, мг/дм 3 (таблица 1).
10.5.2 Если условие стабильности не выполняется для одного градуировочного раствора, необходимо выполнить повторное измерение этого раствора для исключения результата, содержащего грубую погрешность. При повторном невыполнении условия, выясняют причины нестабильности, устраняют их и повторяют измерения. Если градуировочная характеристика вновь не будет удовлетворять условию (1), устанавливают новую градировочную зависимость, либо проводят измерения в режиме милливольтметра и устанавливают градуировочные зависимости согласно 10.4.1 — 10.4.4.
11.1 В три стакана вместимостью 50 см 3 вносят мерным цилиндром вместимостью 50 см 3 по 30 см 3 анализируемой пробы, добавляют в каждый стакан по 2,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
Один из трех стаканов устанавливают на магнитную мешалку, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и перемешивают пробу в течение 3 мин. Затем этот стакан убирают (не регистрируя значение потенциала), помещают на мешалку стакан со второй аликвотой пробы, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и после установления постоянного значения потенциала записывают показания иономера. Повторяют измерение с третьей аликвотой пробы. По окончании измерения электроды отмывают дистиллированной водой. Отмывание электродов происходит достаточно быстро при её трехкратной замене. Остатки воды с поверхности электрода удаляют фильтровальной бумагой.
Температура анализируемых проб не должна отличаться от температуры градуировочных растворов более, чем на ± 1 °С.
11.2 Если величина измеренного потенциала ниже, чем потенциал соответствующий значению pNa 2,70 градуировочной зависимости, повторяют измерения, добавляя в пробу 4,0 см 3 раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
11.3 Выполнению измерений натрия с ионселективным электродом могут мешать высокие концентрации калия (30-кратный избыток по отношению к натрию), магния (10-кратный избыток), лития (концентрации, превышающие концентрацию натрия), однако для природных и очищенных сточных вод такие мешающие влияния маловероятны.
Наиболее существенное влияние на результаты измерения натрия оказывает концентрация ионов водорода (рН среды). Для получения правильных результатов разность (рН — pNa) должна быть более 3, что достигается подщелачиванием анализируемых проб раствором аммиака.
12.1 Значения pNa в анализируемых пробах воды находят по соответствующей градуировочной зависимости. Массовую концентрацию натрия X, мг/дм 3 , рассчитывают по следующим соотношениям:
pNa = — lg[ Na + ]; [ Na + ] = 10 — pNa , моль/дм 3 ;
X = 10 — pNa · 22,99 · 10 3 мг/дм 3
или находят по таблице Б.1 (см. приложение Б) для значений pNa в диапазоне от 3,00 до 4,00 включ. Массовую концентрацию натрия в мг/дм 3 для значений pNa от 2,00 до 3,00 включ. и от 1,00 до 2,00 включ. получают, увеличивая табличные значения в диапазоне от 3,00 до 4,00 включ., имеющие одинаковые значения дробной части, в 10 и в 100 раз, соответственно, а для значений pNa от 4,00 до 5,00 — уменьшая в 10 раз.
Например, pNa 3,10 соответствует 18,2 мг/дм 3 ионов натрия, pNa 2,10 — 182 мг/дм 3 , pNa 4,10 — 1,82 мг/дм 3 .
При использовании для выполнения измерений иономера, имеющего программу обработки данных, значение массовой концентрации натрия считывают непосредственно с дисплея.
12.2 Результат измерений в документах, предусматривающих его использование, представляют в виде
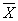
где 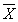
± D — границы характеристики погрешности результатов измерений для данной массовой концентрации натрия (таблица 1).
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности, которые не должны содержать более двух значащих цифр.
12.3 Допустимо представлять результат в виде:
X ± D л Р = 0,95, при условии D л D , (5)
где ± D л — границы характеристики погрешности результатов измерений, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
12.4 Результаты измерений оформляют протоколом или записью в журнале, по формам, приведенным в Руководстве по качеству лаборатории.
13.1.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости, погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, внутрилабораторной прецизионности, погрешности).
13.1.2 Периодичность контроля исполнителем процедуры выполнения измерений, а также реализуемые процедуры контроля стабильности результатов выполняемых измерений регламентируются в Руководстве по качеству лаборатории.
13.2.1 Контроль повторяемости осуществляют для каждого из результатов измерений, полученных в соответствии с методикой. Для этого отобранную пробу воды делят на три части, и выполняют измерения в соответствии с разделом 11.
13.2.2 Результат контрольной процедуры r к , мг/дм 3 , рассчитывают по формуле
где X 1 , Х2 — результаты единичных измерений массовой концентрации натрия в пробе, мг/дм 3 .
13.2.3 Предел повторяемости rn, мг/дм 3 , рассчитывают по формуле
где s r — показатель повторяемости, мг/дм 3 (таблица 1).
13.2.4 Результат контрольной процедуры должен удовлетворять условию
13.2.5 При несоблюдении условия (8) выполняют еще два измерения и сравнивают разницу между максимальным и минимальным результатами с нормативом контроля равным 3,6 s r . В случае повторного превышения предела повторяемости, поступают в соответствии с разделом 5 ГОСТ Р ИСО 5725-6.
13.3 Алгоритм оперативного контроля процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления проб
13.3.1 Оперативный контроль процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления пробы проводят, если массовая концентрация натрия в рабочей пробе составляет 1,0 мг/дм 3 и более. В противном случае оперативный контроль проводят с использованием метода добавок согласно 13.4. Для введения добавок используют аттестованный раствор натрия (см. приложение А).
13.3.2 Оперативный контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.3.3 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
Кк = 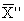
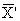
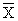
где 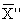

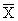
С — концентрация добавки, мг/дм 3 .
13.3.4 Норматив контроля К1, мг/дм 3 , рассчитывают по формуле
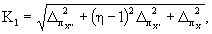
где 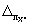
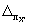
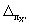
Примечание. Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения: 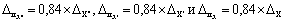
13.3.5 Если результат контрольной процедуры удовлетворяет условию:
процедуру анализа признают удовлетворительной.
При невыполнении условия (11) контрольную процедуру повторяют. При повторном невыполнении условия (11), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
13.4.1 Контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.4.2 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
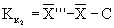
где 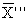
13.4.3 Норматив контроля погрешности К, мг/дм 3 , рассчитывают по формуле
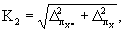
где 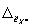
Примечание — Допустимо для расчета норматива контроля использовать значения характеристик погрешности, полученные расчетным путем по формулам 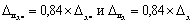
13.4.4 Если результат контрольной процедуры удовлетворяет условию
процедуру признают удовлетворительной.
При невыполнении условия (14) контрольную процедуру повторяют. При повторном невыполнении условия (14), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
14.1 Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости R . При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение. Значение предела воспроизводимости рассчитывают по формуле
14.2 При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно разделу 5 ГОСТ Р ИСО 5725-6 или МИ 2881.
14.3 Проверку приемлемости проводят при необходимости сравнения результатов измерений, полученных двумя лабораториями.
А.1 Назначение и область применения
Настоящая методика регламентирует процедуру приготовления аттестованного раствора натрия, предназначенного для установления градуировочных характеристик иономера и контроля точности результатов измерений массовой концентрации натрия в природных и очищенных сточных водах потенциометрическим методом.
А.2 Метрологические характеристики
Метрологические характеристики аттестованного раствора приведены в таблице А.1.
Таблица А.1 — Метрологические характеристики аттестованного раствора AP1-Na
Значение характеристики для аттестованного раствора AP1-Na
Аттестованное значение концентрации натрия
Границы погрешности аттестованного значения концентрации натрия (Р = 0,95)
А.3.1 Весы лабораторные высокого (II) класса точности по ГОСТ 24104-2001.
А.3.2 Колбы мерные 2 класса точности исполнения 2 по ГОСТ 1770-74 вместимостью 200 см 3 — 1 шт.
А.3.3 Стаканчик для взвешивания (бюкс) по ГОСТ 25336-82 СВ-24/10 .
А.3.4 Воронка лабораторная по ГОСТ 25336-82 диаметром 56 мм.
А.3.5 Чашка выпарительная № 2 по ГОСТ 9147-80.
А.3.6 Эксикатор исполнения 2, диаметром корпуса 190 мм по ГОСТ 25336-82, заполненный обезвоженным хлоридом кальция.
А.3.7 Шкаф сушильный общелабораторного назначения с диапазоном температур до 300 °С.
А.4.1 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, х.ч., с содержанием основного вещества не менее 99,9 %.
А.4.2 Вода дистиллированная по ГОСТ 6709-72.
А.5 Процедура приготовления аттестованного раствора натрия AP1-Na
Для приготовления аттестованного раствора AP1- Na взвешивают в бюксе с точностью до четвертого знака после запятой 11,6880 г хлорида натрия, предварительно высушенного в сушильном шкафу при температуре от 250 °С до 270 °С в течение 2 ч. Количественно переносят навеску в мерную колбу вместимостью 200 см 3 , растворяют в дистиллированной воде, доводят объём раствора до метки и перемешивают.
Полученному раствору приписывают молярную концентрацию натрия 1,000 моль/дм 3 и массовую концентрацию 22,99 мг/см 3 (г/дм 3 ).
А.6 Расчет метрологических характеристик аттестованного раствора AP 1-Na
А.6.1 Аттестованное значение молярной концентрации натрия M 1 , моль/дм 3 , и массовой концентрации С1, мг/см 3 (г/дм 3 ), рассчитывают по формулам
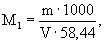
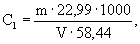
где m — масса навески хлорида натрия, г;
V — вместимость мерной колбы, см 3 .
22,99 и 58,44 — молярная масса иона натрия и хлорида натрия, соответственно, г/моль.
А.6.2 Расчет значений границ погрешности приготовления аттестованного раствора D C1 , г/дм 3 , или D М1 , моль/дм 3 , выполняют по формулам
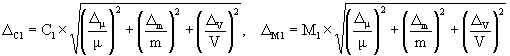
где D m — предельное значение возможного отклонения массовой доли основного вещества ( NaCl ) в реактиве от приписанного значения m , %;
m — массовая доля основного вещества (NaCl) в реактиве, приписанная реактиву квалификации «х.ч.», %;
D m — погрешность взвешивания, г;
D V — предельное значение возможного отклонения вместимости мерной колбы от номинального значения, см 3 .
А.6.3 Погрешности приготовления аттестованного раствора AP 1-Na равны
и
А.7 Требования безопасности
Необходимо соблюдать общие требования техники безопасности при работе в химических лабораториях.
А.8 Требования к квалификации операторов
Аттестованный раствор может готовить инженер или лаборант со средним профессиональным образованием, прошедший специальную подготовку и имеющий стаж работы в химической лаборатории не менее 6 мес.
А.9 Требования к маркировке
На склянку с аттестованным раствором должна быть наклеена этикетка с указанием условного обозначения раствора, величины массовой и молярной концентрации натрия, погрешности ее установления и даты приготовления раствора.
Аттестованный раствор следует хранить в герметично закрытой полиэтиленовой или полипропиленовой посуде при комнатной температуре не более 6 мес.
источник