1. Определение свободного активного хлора (иодометрический метод)
При введении в воду хлор гидролизуется, образуя хлорноватистую и соляную кислоты.
Cl2 + H2O HOCl + HCl
Образовавшаяся хлорноватистая кислота диссоциирует на ион гипохлорита OCl — и ион водорода Н + .
Хлор широко используется для обеззараживания сточных вод в оборотных системах водопотребления, а также перед сбросом их после очистки в канализацию или водоем. При сбросе СВ в водоем после полной биологической очистки содержание остаточного свободного активного хлора не должно превышать 2,5 мг/дм 3 .
Сущность метода. При подкислении анализируемой воды и прибавлении к ней иодида калия все перечисленные вещества выделяют йод:
НClО + 2J — + H + = J2 + Cl — + H2O
ClO — + 2H + + 2J — = J2 + Cl — + H2O
Выделившийся йод оттитровывают тиосульфатом натрия в присутствии крахмала. Содержание активного хлора выражают в мг/дм 3 в пересчете на хлор. В отношении хлорноватистой кислоты, гипохлорит-ионов, монохлорамина такое выражение результатов анализа условно, т.к. один моль этих веществ выделяет два атома йода и, следовательно, соответствует 2 молям, активного хлора, т.е. результаты оказывается завышенными.
Тиосульфат натрия, 0,01 н. раствор;
Йодид калия, уксусная кислота, 30%-ный раствор;
Ход определения. В коническую колбу, снабженную притертой стеклянной пробкой, наливают 50 . 100 мл анализируемой воды, вносят 0,5 г йодида калия и добавляют 10 мл уксусной кислоты. Через 5 мин оттитровывают выделившийся йод 0,01 н. раствором тиосульфата натрия (при содержании активного хлора выше 1 мг/дм 3 ) или 0,005 н. раствором тиосульфата натрия (при содержании активного хлора от 0,1 до 1 мг/дм 3 ). В конце титрования прибавляют 1-2 мл раствора крахмала.
Содержание активного хлора (X) в мг/дм 3 рассчитывают по формуле 1:
где а — объем раствора тиосульфата натрия, израсходованного на титрование, см 3 ;
К — поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точно 0,01 н.;
V — объем анализируемой воды, см 3 ;
0,355 — количество хлора, эквивалентное 1 мл 0,01 н. раствора тиосульфата натрия, мг.
«Свободный активный хлор» и «связанный активный хлор»
Вещества, объединенные понятия «активный хлор» — это сильные окислители Cl2; HClO и ClO — , а «связанный хлор» это относительно слабые окислители NH2Cl; NHCl2 и NCl3, образующихся при хлорировании сточных вод, имеющих в своем составе аммонийные ионы, аммиак. Последующее поведение каждого из этих веществ при смешивании хлорированной сточной воды с другими сточными водами, при прохождении ее по трубам, значительно различается, поэтому иногда возникает необходимость дальнейших разделений.
В отношении «свободного активного хлора» обычно удовлетворяются определением суммарного содержания: Cl2 + HClO + ClO — , а для нахождения содержания каждого из хлораминов, надо провести определения следующим образом.
Сущность метода. В нейтральной среде (рН=6,9) свободный активный хлор (Cl2; HClO и ClO — ) мгновенно реагируют с индикатором N, N / — диэтил-n-фенилендиамином, образуя соединения красного цвета.
Монохлорамин и дихлорамин в этих условиях в реакцию с индикатором не вступают. Свободный активный хлор оттитровывают раствором соли Мора. Затем в раствор вносят очень малое количество иодида калия, каталитическое действие которого приводит к быстрому взаимодействию монохлорамина и индикатора с образованием того же красного цвета, которое оттитровывают раствором соли Мора. Затем вводят иодид калия в избытке, при этом в реакцию вступает дихлорамин, который определяют тем же титрованием. Если в сточной воде содержится трихлорид азота NCl3, то он будет частично определен как дихлорамин NHCl2.
Первое определение надо проводить очень быстро при рН 6,9 (или чуть выше), чтобы в реакцию не вступил монохлорамин NH2Cl. Для того, чтобы он прореагировал полностью требуется 2 мин; если раствор имеет повышенную температуру – 1 мин.
N,N-диэтил-n-фенилендиамин, сернокислая соль. Растворяют 0,15 г сернокислой соли диэтил-n-фенилендиамина в дистиллированной воде, не содержащей хлора, в которую предварительно вносят 2 см 3 10% (по объему) раствора серной кислоты и 2,5 см 3 0,8%-ного раствора ЭДТА. Раствор разбавляют до 100 см 3 и хранят в склянке из железного стекла;
Фосфатный буферный раствор, рН=6,9. В дистиллированной воде растворяют 48,4 г Na2HPO4 . 2H2O и 30 г KH2PO4, прибавляют 100 см 3 0,8% раствора ЭДТА и разбавляют до 1 дм 3 ;
Стандартный раствор соли Мора Fe(NH4)2(SO4)2 . 6H2O, 1 см 3 которого соответствует 0,1 мг хлора. В дистиллированную воду предварительно вводят 1 см 3 25%-ного (по объему) серной кислоты, затем в ней растворяют 1,106 г соли Мора и разбавляют до 1 дм 3 ;
Иодид калия. Для приготовления 0,5% раствора растворяют 0,5 г KI в 100 см 3 дистиллированной воды. Для приготовления 10%-ного раствора растворяют 10 г KI в 100 см 3 дистиллированной воды.
1. Определение свободного активного хлора. В колбу для титрования, снабженную притертой пробкой, наливают сначала 5 см 3 фосфатного буферного раствора (рН=6,9) и 5 см 3 раствора сернокислой соли диэтил-n-фенилендиамина, перемешивают, вводят 100 см 3 анализируемой пробы и сразу же титруют раствором соли Мора до полного обесцвечивания.
2. Определение монохлорамина. К раствору после определения свободного активного хлора приливают 1 см 3 0,5%-ного раствора иодида калия, перемешивают и титруют раствором соли Мора до полного обесцвечивания.
3. Определение дихлорамина. После определения монохлорамина прибавляют 10 см 3 10%-ного раствора иодида калия, перемешивают, дают постоять 2 мин и титруют раствором соли Мора до обесцвечивания.
Предполагается, что общая концентрация активного хлора не превышает 4 мг/дм 3 . В противном случае берут меньший объем пробы, а дистиллированную воду для разбавления вводят до введения в подготовительную смесь анализируемой пробы.
Содержание каждого вида активного хлора (Cl2; NH2Cl; NHCl2) (Х) в мг/дм 3 вычисляют по формуле 2:
, (2)
где V1 – объем раствора соли Мора, израсходованного в первом, втором или третьем титровании, см 3 ;
V – объем пробы, взятой для анализа, см 3 ;
0,1 – количество активного хлора, отвечающие 1 см 3 раствора соли Мора, мг.
2. Определение хлороемкости
Обработка сточных вод хлором или раствором хлорной извести – один из самых распространенных в относительно дешевых способов обеззараживания и очистки сточных вод от загрязнения органическими веществами. Но так как обычно СВ содержат реагирующие с хлором вещества и вещества, взаимодействующие с ним очень медленно или неполно, и органические вещества, совсем не окисляющиеся хлором, определение окисляемости сточной воды не дает достаточных данных для выводов о том, как вода будет хлорироваться. Поэтому, прежде чем решать вопрос об очистке СВ хлорированием, ее специально исследуют. При этом необходимо определить, с какой скоростью проходят реакции между содержащимися в воде веществами и хлором (реакции окисления и замещения хлором), доходят ли они до конца, какой требуется избыток добавляемого хлора для того, чтобы реакция пошла в желаемой степени в заданный промежуток времени. На эти вопросы можно получить ответы, определив хлороемкость сточной воды так называемым диаграммным методом.
Хлором обрабатывают как фильтрованную или отстоянную воду, так и вместе с содержащимися в ней взвесями.
Ход определения. Отбирают ряд одинаковых по объему порций анализируемой сточной воды и помещают их в сосуды с притертыми пробками, в которых их обрабатывают различными количествами хлорной воды (или раствора хлорной извести), первую порцию – наименьшим количеством, вторую – в 2 — 3 раза большим и т.д. Рекомендуется проводить две серии таких опытов, изменяя продолжительность обработки. Первую серию проб СВ обрабатывают различными количествами хлора очень непродолжительное время, например, 5 мин. Результаты этих опытов показывают присутствие в СВ веществ, быстро реагирующих с хлором. Вторую серию проб обрабатывают столько времени, сколько будет проводиться процесс хлорирования, в предполагаемых очистных сооружениях (обычно 1-2 ч). По истечении намеченного времени определяют в каждом растворе количество непрореагировавшего хлора (йодометрическим методом) и строят диаграмму, нанося на оси абсцисс количество введенного в каждый раствор хлора по порядку, начиная с самого малого, а на оси ординат – соответствующее количество оставшегося хлора, и соединяют полученные точки кривой (рис.1).
Рис. 1. Кривая определения хлороемкости
|
Рис. 2. Кривая йодометрического титрования активного хлора
Начальный участок ОА кривой совпадает с осью абсцисс: количество остаточного хлора равно 0. Длина этого участка показывает содержание в воде веществ, быстроокисляющихся хлором (особенно при построении кривой для первой серии опытов). В тех случаях, когда исследуемая вода содержит аммиак, аммонийные соли или некоторые органические амины, начальный отрезок кривой может получиться другой формы (рис. 2). Хлор образует с этими соединениями различные хлорамины, которые так же выделяют йод из йодида калия, как и прибавленный хлор. Дальнейшее прибавление хлора приводит к разрушению хлораминов, поэтому кривая, достигнув некоторого максимума, снова снижается, подходя к нижней точке перегиба.
Таким образом, создается неправильное представление, что первые порции прибавляемого хлора вообще не поглощаются сточной водой, а последующие — вызывают поглощение как вновь прибавленного хлора, так и ранее бывшего в СВ. Получение кривых, аналогично рис.1 возможно только при определении свободного хлора без хлораминов.
Сточные воды хлорируют сильнее, чем питьевую воду, при этом продолжают хлорирование и после перехода за точку полного разрушения хлораминов, поэтому рассматривается только нормальная форма кривой хлороемкости, которая должна получиться при определении только свободного остаточного хлора. Отрезок АК кривой (рис.1) характеризует процесс окисления и хлорирования веществ, медленно реагирующих с хлором, которые за время опыта не успевают прореагировать и остаются в растворе вместе с остаточным хлором. Отрезок KB (прямолинейный) показывает отсутствие в растворе к концу опыта веществ, реагирующих с хлором. Характеристику исследуемой воды можно получить следующим образом:
1. Измеряют отрезок ОА, длина его (а) характеризует содержание быстрореагирующих с хлором веществ.
2. Прямолинейный отрезок KB кривой продолжают до пересечения с осью абсцисс в точке С и определяют угол наклона прямой СВ к оси абсцисс (угол α). Если бы образовавшаяся в СВ хлорноватистая кислота не разлагалась,
2 Cl2 + H2O 2HClO + 2 НCl
то количество хлора, прибавляемого после достижения точка К, была бы равна количеству остаточного хлора и прямая СВ была бы наклонена к. оси абсцесс под углом 45°. В действительности угол α- всегда меньше 45 0 и степень отклонения его от этого значения характеризует каталитическое разложение хлорноватистой кислоты.
3. Из точки К перехода кривой в прямую линию опускают на ось абсцисс перпендикуляр KR и проводят прямую KS , наклоненную к оси абсцисс под углом 45°. Длина отрезка OR=d показывает, сколько надо прибавить хлора, чтобы добиться полноты реакции его с присутствующими в воде окисляющими и хлорируемыми веществами за время проведения опыта.
4. Добавление хлора в количестве, соответствующем отрезку.OR, после опыта в растворе остается хлор в количестве, выражаемом отрезком KR. Так как KR = SR , то длина отрезка OS = ОR – SR = c показывает, сколько хлора расходуется на окисление, замещение хлором и на каталитическое разложение согласно приведенным выше уравнениям.
5. Отрезок ОС = В выражает количество хлора, израсходованного на окисление органических веществ и на хлорирование, т.е. действительную хлороемкостъ воды и поэтому с — h = CS = f показывает количество хлора, прореагировавшего с водой с образованием кислорода за время проведения опыта.
6. Если бы реакции между органическими веществами, содержащимися в сточной воде, и хлором проходили быстро и полностью, то после завершения этих реакций в растворе не содержалось бы свободного хлора и на диаграмме хлороемкости вместо кривой получилась бы ломаная линия ОСВ. Чем медленнее или менее полно проходят реакции в растворе, тем сильнее кривая ОАКВ. отклоняется от ломанной ОСВ и тем больше площадь АКС = Р. Последняя характеризует (условно) замедленность и не полноту происходящих реакции.
Реактивы: Хлорная вода (или насыщенный раствор хлорной извести). Насыщают дистиллированную воду хлором. Титр хлорной воды определяют каждый раз непосредственно перед определением хлороемкости, для этого к 10 мл хлорной воды добавляют 1 г сухого йодида калия и после подкисления титруют выделившийся йод 0,05 н раствором тиосульфата натрия, прибавляя 1 — 2 мл раствора крахмала в конце титрования. Раствор хлорной извести фильтруют и устанавливают его титр таким же способом.
Ход определения. В 10 конических колб вместимостью по 250 см 3 , снабженных притертыми пробками, наливают одинаковые объемы исследуемой воды. К взятым пробам прибавляют хлорную воду: в первый сосуд — 1 см 3 , во второй – 3 см 3 , дальше — 5, 8, 12, 15, 25, 40, 70 и 100 см 3 . Колбы закрывают притертыми пробками, ставят в темное место и выдерживают 5 мин при 16 – 20 0 С (первая серия). Параллельно этим пробам ставят также другие пробы с теми же добавками хлорной воды, но дают постоять 1 или 2 часа (вторая серия).
По истечении намеченного времени в каждую колбу добавляют от 0,2 до 2 г (в зависимости от количества прибавляемой хлорной воды) сухого йодида калия, перемешивают до растворения, подкисляют 10 см 3 уксусной кислоты и выделившийся йод оттитровывают 0,01 н раствором тиосульфата натрия. В конце титрования прибавляют 1 — 2 см 3 раствора крахмала.
Содержание активного хлора (X ) в мг/дм 3 вычисляют по формуле 1:
Затем вычерчивают диаграмму (подобно показанной на рис.1), откладывая на оси абсцисс количество прибавленного хлора, а на оси ординат в том же масштабе — соответствующее им количество остаточного хлора. Полученные точки соединяют кривой. Для каждой серии опытов (с различными промежутками времени) строят отдельную диаграмму. Если перехода кривой линии в прямую на первой не получилось, то это указывает на недостаточное количества прибавленного хлора. Тогда опыты дополняют новыми с большими дозами хлорной воды.
Если, на первой диаграмме отсутствует участок ОА, это указывает на слишком большое количество хлора, введенного в первую порцию СВ. Тогда проводят еще несколько опытов с меньшими дозами хлора. Построив кривые, определяют по ним а, в, с, f , р и угол α .
1. С какой целью хлорируют сточную воду?
2. В каких случаях в сточной воде при хлорировании образуется хлорамины?
3. Как идет реакция гидролиза хлора в воде?
4. В чем сущность метода определения остаточного свободного хлора в сточной воде?
5. Как определяют свободный хлор в воде при наличии в ней хлораминов?
6. На какие ионы диссоциирует хлорноватистая кислота?
7. Для чего исследуют сточную воду на хлорируемость?
8. Зачем для определения хлорируемости сточных вод проводят две серии опытов?
9. В каких случаях кривая хлорируемости имеет вид как на рис.2?
10. Какой отрезок прямой на оси абсцисс указывает на расход хлора на окисление органических веществ и на хлорирование?
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 8718 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Дезинфекция сточных вод жидким хлором
Основным источником микробного загрязнения объектов водопользовании, поверхностных вод, подземных водоносных горизонтов являются хозяйственно-бытовые сточные воды. Для них характерен высокий уровень микробного загрязнения на фоне значительных концентраций взвешенных и органических веществ. В сточных водах населенных пунктов обнаруживаются многие виды патогенных бактерий, вирусов и паразитов. Болезни, вызываемые микроорганизмами, различны и представляют серьезную опасность для человека. Средством предотвращения распространения инфекционных болезней и защиты поверхностных и подземных вод от заражения является обеззараживание (дезинфекция) сточных вод.
Обеззараживание воды – это процесс обработки воды, осуществляемый для полного удаления патогенных микроорганизмов, а также снижения общего числа микроорганизмов.
Обеззараживание воды может осуществляться:
· Химическими методами с использованием хлора и его соединений (гипохлорита натрия), озона, солей тяжелых металлов (серебра или меди);
· Физическими методами путем обработки воды УФ-лучами или ультразвуком.
Обеззараживание бытовых сточных вод и их смеси с производственными следует производить после их очистки. При совместной биологической очистке бытовых и производственных сточных вод, но раздельной их механической очистке допускается при обосновании предусматривать обеззараживание только бытовых вод после их механической очистки с дехлорированием их перед подачей на сооружения биологической очистки.
Обеззараживание сточных вод хлором и его соединениями
При насыщении воды хлором образуется хлорная вода, которая обладает сильными окислительными свойствами. Взаимодействие хлора с водой протекает по реакции:
При этом образуется небольшое количество соляной и хлорноватистой кислот, т. к. равновесие реакции сильно сдвинуто влево. Равновесие реакции можно сдвинуть вправо (в сторону образования продуктов) при проведении процесса в щелочной среде и повышением температуры раствора.
Хлорноватистая кислота – сильный окислитель. В щелочной среде или на свету она легко отдает кислород.
Количество активного хлора, вводимого на единицу объема сточной воды, называют дозой хлора и выражают в г/м 3 . В зависимости от условий (категории водоема, степени очистки сточных вод и т. п.) для дезинфекции сточных вод необходимы разные дозы хлора. Согласно СНиП 2.04.03-85 «Канализация. Наружные сети и сооружения» дозу хлора для дезинфекции сточных вод принимают:
· после механической очистки – 10 г/м 3 ;
· после механический и химической очистки при эффективности отстаивания свыше 70% и неполной биологической очисти – 5 г/м 3 ;
· после полной биологической, физико-химической и глубокой очистки – 3 . г/м 3 .
Фактически для полной очистки сточных вод обычно достаточно дозы хлора 2-5 г/м 3 .
Для обеспечения бактерицидного эффекта хлора необходимо обеспечить хорошее смешение хлора с водой. Контакт хлора с водой должен составлять не менее 30 минут. Жидкий хлор на станции очистки воды поставляют в баллонах емкостью 20-50 л, на крупные очистные сооружения – в бочках или цистернах. Давление хлора в баллоне при 18 0 С составляет 500 кПа.
Количество остаточного хлора в обработанной воде должно составлять 0,5-1 г/м 3 .
Установки для хлорирования
Сооружения для хлорирования состоят из хлораторной, смесителя и контактного резервуара.
Хлораторные установки размещают в отдельно стоящих зданиях. В хлораторной размещаются: расходный склад хлора, помещение для приготовления и дозирования хлора для приготовления хлорной воды. Хлораторы бывают напорными и вакуумными. Наиболее широкое распространение получили вакуумные хлораторы. Хлораторы имеют запорный вентиль, фильтр, редукционный клапан, снижающий давление до 20 кПа, манометры до и после редуктора, регулирующий вентиль.
В дозаторной размещают рабочий и резервный хлораторы. Жидкий хлор из баллона испаряют в специальной емкости. Хлор-газ проходит через фильтр и поступает в хлоратор, где смешивается с водой. Полученная хлорная вода направляется в контактный резервуар для смешения со сточными водами.
Для получения необходимого бактерицидного эффект смесь хлорной воды со сточной выдерживают в течение 20-30 минут в специальных контактных резервуарах (по конструкции схожи с вертикальными и горизонтальными отстойниками). При дезинфекции сточных вод хлором происходит коагуляция взвеси и ее осаждение в контактных резервуарах. Поэтому для предотвращения выноса из контактных резервуаров взвешенных веществ скорость движения воды в них принимается такой же, как и во вторичных отстойниках.
В схемах с биофильтрами контактные резервуары устанавливают после вторичных отстойников из-за большого выноса взвешенных примесей. При дезинфекции жидким хлором объем осадка после механической очистки составляет 0,08 л на человека в сутки, после аэротенков – 0,03 л, после биофильтров – 0,05 л. Влажность осадка в среднем составляет 96%. Удаление осадка из контактных резервуаров осуществляют под гидростатическим давлением.
Условия оптимальной работы резервуара достигаются при соотношении длины резервуара к ширине не менее 40:1. Это соотношение выдерживается в прямоугольных коридорных и кольцевых резервуарах.
Дезинфекция хлорной известью и гипохлоритом натрия
Для приготовления и дозирования раствора хлорной извести используют установку, состоящую из баков для растворения хлорной извести и приготовления концентрированного раствора, содержащего 10-15% активного хлора. Этот раствор пропускают через растворные баки, в которых его разбавляют до 2-3%. Этот раствор дозируют в смеситель для смешения со сточной водой. Оттуда сточная вода подается в контактный резервуар.
Гипохлорит натрия получают электролизом раствора поваренной соли. В России серийно выпускаются непроточные электролизные установки ЭН с графитовыми электродами пропускной способностью до 100 кг/сут по активному хлору.
Достаточная эффективность обеззараживания очищенной сточной воды гипохлоритом натрия наступает при его концентрации 1,5-3 3,5 мг/л (в зависимости от хлоропоглощаемости). Содержание остаточного хлора при этом составляет 0,3-0,5 мг/л. Эффективность обеззараживания зависит от температуры только при малых дозах гипохлорита. Продукты электролиза в некоторой степени способствуют ускорению процессов коагулирования и осаждения взвешенных веществ.
Недостатки обеззараживания сточных вод хлорированием
Хлорирование недостаточно эффективно в отношении уничтожения в воде вирусов. По имеющимся данным, после хлорирования при дозах остаточного хлора 1,5 мг/л в пробах воды обнаруживается достаточно высокое содержание вирусных частиц.
Другим серьезным недостатком данного метода является также образование в воде под действием хлора токсичных хлорорганических продуктов:
— четыреххлористого углерода (ПДК = 0,006 мг/л)
— бромдихлорметана (ПДК = 0,03 мг/л)
А также хлорфенолов, хлорбензолов, хлорированных пиридинов, хлораминов и т. п. Большинство из этих соединений высоко токсичны, канцерогенны и мутагенны.
Хлорирование сточных вод приводит к тому, что хлорпроизводные и остаточный хлор попадают в водоемы и вызывают гибель водных организмов, отрицательно влияют на процессы самоочищения водоемов.
источник
Свободный хлор и некоторые соединения хлора применяют для дезинфекции питьевой и сточной воды. В промышленности хлор используют при отбеливании в бумажном производстве и производстве ваты, для уничтожения паразитов в холодильных установках и т.д.
При растворении хлора в воде образуются соляная и хлорноватистая кислоты:
Активным называют хлор, который выделяется в свободном виде при взаимодействии вещества с соляной кислотой. Массовая доля активного хлора в веществе (в процентах) равна массе молекулярного хлора, который выделяется из 100 г вещества при взаимодействии с избытком HCI. Понятие «активный хлор» включает, кроме растворенного молекулярного хлора, и другие соединения хлора, как, например, хлорамины (монохлорамин — NH2Cl и дихлорамин – NHCl2, а также в виде треххлористого азота NCl3), органические хлорамины, гипохлориты (гипохлорит-анион ClO — ) и хлориты, т.е. вещества, определяемые иодометрическим методом.
ClO — + 2H + + 2I — = I2 + 2Cl — + H2O
HClO + H + + 2I — = I2 + Cl — + H2O
Активный хлор содержат многие вещества. Самое старое известно под названием жавелевая вода (Жавель — пригород Парижа), которую приготовил еще в 1785 г. К. Бертолле из хлора и калиевого щелока и предложил заменить ею хлорную воду для отбеливания тканей. С 1820 г. начали пользоваться натриевым аналогом жавелевой воды — «лабараковой жидкостью». Эти растворы обычно содержат от 8 до 15 % активного хлора. Широкое применение нашла хлорная известь — дешевый технический продукт, имеющий переменный состав, который зависит от условий получения. Ею отбеливают ткани и целлюлозу, обеззараживают сточные воды, обезвреживают отравляющие вещества. Растворы гипохлоритов применяют для смыва полимерных покрытий с металлических сеток при производстве конденсаторов или для обработки полимерных подошв, чтобы они лучше приклеивались к верху обуви.
Иодометрический метод определения основан на том, что хлорсодержащие сильные окислители выделяют иод из раствора иодида. Выделившийся иод титруют раствором тиосульфата натрия, используя в качестве индикатора крахмал. Результаты определения выражают в мг Cl на 1 л воды. Чувствительность метода – 0,3 мгCl/л при объеме пробы 250 мл, однако, при использовании растворов тиосульфата с различной концентрацией объем пробы может составлять, в зависимости от требуемой чувствительности определения, от 500 до 50 мл воды и менее.
Содержание активного хлора определяют в дезинфицированной им питьевой воде, в сточных водах, загрязненных хлором или соединениями, выделяющими хлор. В природной воде содержание активного хлора не допускается; в питьевой воде его содержание установлено в пересчете на хлор на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды. При определении активного хлора пробы нельзя консервировать, определение следует проводить немедленно после отбора пробы. Лимитирующий показатель вредности для активного хлора – общесанитарный.
Цель работы:измерение содержания активного хлора в воде и в образцах дезинфицирующих средств.
Объекты исследования:пробы водопроводной воды и образцы дезинфицирующих средств, в состав которых входят хлорсодержащие вещества.
- буферный ацетатный раствор (рН = 4,5),
- йодид калия,
- универсальная индикаторная бумага,
- 0,5%-ный раствор крахмала,
- 0,005 н раствор тиосульфата натрия,
- бюретки, конические колбы объемом 250 мл, мерный цилиндр на 100 мл, стеклянные палочки, пипетки на 5 мл,
- весы.
1) Проведите предварительное исследование образцов на содержание активного хлора, например, с помощью тест-системы. При необходимости проведите разбавление образцов.
Объем пробы, необходимый для анализа при концентрации активного хлора от 0,5 до 5,0 мг/л составляет 50 мл, при концентрации 0,3 до 0,5 мг/л – 250 мл.
2) В коническую колбу насыпьте 0,5 г КI и растворите в 1-2 мл дистиллированной воды.
3) Добавьте 1 мл буферного раствора и затем 50-250 мл анализируемой воды (в зависимости от предварительных результатов анализа).
3) Колбу закройте пробкой и поместите в темное место. Через 10 мин выделившийся йод титруйте 0,005 н раствором тиосульфата натрия до появления светло-желтой окраски, после чего добавьте 1 мл 0,5%-ного раствора крахмала и продолжите титровать до исчезновения синей окраски.
4) Проведите расчеты и сделайте выводы.
где: X – суммарный остаточный хлор, мг/л;
а – объем 0,005 н раствора тиосульфата натрия, израсходованного на титрование, мл;
К – поправочный коэффициент;
V – объем анализируемой пробы;
0,177 – содержание активного хлора, соответствующее 1 мл 0,005 н р-ра тиосульфата натрия, мг.
Дополнительная информация. Хлоремкость. Прежде чем решить вопрос об очистке сточной воды хлорированием, ее специально исследуют. При этом необходимо определить, с какой скоростью проходят реакции между содержащимися в воде веществами и хлором, доходят ли они до конца, какой требуется избыток добавляемого хлора для того, чтобы реакция прошла в желаемой степени в заданный промежуток времени t.
ОА – показывает содержание веществ, быстро окисляющихся хлором.
АК – процесс окисления и хлорирования веществ, медленно реагирующих с хлором, которые за время опыта не успевают прореагировать и остаются в растворе вместе с остаточным хлором.
КВ – отсутствие веществ, реагирующих с хлором.
Вопросы и задания для самостоятельной работы:
1. Зачем хлорируют воду? В чем преимущества и недостатки использования хлорированной питьевой воды?
2. Можете ли Вы предложить другие подходы к решению этой проблемы? Укажите преимущества и недостатки каждого из предложенных методов.
3. Сколько активного хлора содержит одна тонна вещества с массовой долей его 52%?
4. Почему хлороформ хранят в темных и заполненных доверху склянках?
5. Формально активный хлор могут содержать соединения, в которых вообще нет хлора — ведь это понятие определяет не истинное содержание хлора в соединении, а его окислительную способность по отношению к KI в кислой среде. Предложите несколько соединений, в растворах которых можно определить «активный хлор».
Приготовление растворов
1. Для приготовления 0.01 н раствора тиосульфата натрия 2,5 г его растворяют в свежепрокипяченной и охлаждённой дистиллированной воде, добавляют 0,2 г Na2СО3 и доводят объем до 1 л.
2. Для приготовления 0,005 н раствора тиосульфата натрия в мерную колбу объемом 1 л прибавляют 500 мл 0,01 н раствора тиосульфата натрия, 0,2 г Nа2СО3 и доводят объём до метки. Раствор используют при содержании активного хлора менее 1 мг/л.
3. Для приготовления 0,5%-ного раствора крахмала смешивают 0,5 г растворимого крахмала с небольшим количеством дистиллированной воды, а затем приливают к 100 мл кипящей дистиллированной воды и кипятят несколько минут. После охлаждения раствор консервируют, добавляя хлороформ или 0,1 г салициловой кислоты.
4. Для приготовления ацетатного буфера (рН = 4,5) в мерную колбу объемом 1 л приливают 102 мл 1 М уксусной кислоты (60г ледяной уксусной кислоты в 1 л дистиллированной воды), 98 мл 1 М раствора ацетата натрия (136,1 г СН3СООNа . 3Н2О в 1 л дистиллированной воды) и доводят объём раствора дистиллированной водой до метки.
источник
В водопроводной воде
Цель работы:научиться определять концентрацию остаточного активного хлора в водопроводной воде.
Основные теоретические положения
Хлор может существовать в воде в составе хлоридов и таких соединений как: свободный хлор (Cl2), гипохлорит-анион (ClO — ), хлорноватистая кислота (HСlO), хлорамины (монохлорамин NH2Cl, дихлорамин NHCl2, трихлорид азота NCl3).
Суммарное содержание этих соединений называют термином «активный хлор». Активный хлор существует в двух формах: свободный хлор и связанный хлор. Свободный хлор – хлор, присутствующий в воде в виде хлорноватистой кислоты, иона гипохлорита или растворенного элементарного хлора. Связанный хлор – хлор, присутствующий в воде в виде хлораминов. Общий хлор – сумма свободного и связанного хлора. Хлорамины – производные аммиака, образованные замещением одного, двух или трех атомов водорода атомами хлора.
Соединения, содержащие активный хлор используют для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, химической очистки некоторых сточных вод, ликвидации очагов распространения инфекционных загрязнений (например, хлорная известь).
Наиболее широко для дезинфекции питьевой воды используют свободный хлор, который при растворении в воде диспропорционирует по реакции
Эффект действия хлора на микроорганизмы зависит от начальной дозы хлора, продолжительности сохранения его воде и pH воды. Хлор расходуется на окисление примесей органического и неорганического происхождения.
При выборе дезинфицирующего вещества следует учитывать содержание в нем «активного хлора». «Активным» называют количество молекулярного хлора, отвечающее окислительной способности данного соединения относительно йодистого калия в кислой среде. Понятие «активный хлор» определяет не истинное содержание хлора в соединении, а окислительную способность соединения в кислой среде по йодистому калию.
В природной воде содержание «активного хлора» не допускается; в питьевой воде его предельно-допустимая концентрация (ПДК) установлена в пересчете на хлор, на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде.
«Активный хлор» присутствует в питьевой воде не более нескольких десятков минут и нацело удаляется даже при кратковременном кипячении воды. По этой причине анализ отобранной пробы на содержание активного хлора следует производить немедленно.
Активный хлор определяется йодометрическим методом (методом йодометрического титрования). Метод основан, на свойстве всех содержащих активный хлор соединений в кислой среде, выделять из йодида калия свободный йод
ClO — + 2H + + 2I — = I2 + Cl — + H2O
HClO + H + + 2I — = I2 + Cl — + H2O
Свободный йод оттитровывают раствором тиосульфата натрия в присутствии крахмала, который добавляют для более точного определения точки эквивалентности. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с pH 4,5.
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/л. Метод может использоваться для анализа мутных и окрашенных вод.
Колба коническая с пробкой на 250 мл, мерный цилиндр на 100 мл, бюретка на 25 мл, микробюретка на 5 мл, пипетки на 1мл, воронка
Раствор буферный ацетатный (pH 4,5), калий йодистый в кристаллах, раствор тиосульфата натрия (натрий серноватистокислый) (0,01 н. и 0,005 н.), раствор калия двухромовокислого (0,01 н.), кислота серная (25 %), раствор крахмала (0,5 %), дистиллированная вода
Порядок выполнения работы
1. Определение поправочного коэффициента
В коническую колбу помещают 0,5 г йодистого калия, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (25 %), затем 10 мл 0,01 н. раствора двухромовокислого калия, добавляют 80 мл дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 мл крахмала, прибавленного в конце титрования.
2. Определение остаточного активного хлора
В коническую колбу насыпают 0,5 г йодистого калия, растворяют его в 1-2 мл дистиллированной воды, затем добавляют 1 мл буферного раствора, после чего добавляют 250 мл анализируемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 мл 0,5 %-ного раствора крахмала и раствор титруют до исчезновения синей окраски. По делениям микробюретки определяют общий объем тиосульфата, израсходованный на титрование (как до, так и после добавления крахмала).
1. Поправочный коэффициент (0,01; 0,005 н. растворов серноватистокислого натрия) вычисляют по формуле
где 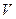
2. Концентрацию остаточного активного хлора (мг/л) вычисляют по формуле
где VT – количество 0,005 н. раствора тиосульфата натрия, израсходованное на титрование, мл; K – поправочный коэффициент нормальности раствора тиосульфата натрия; 0,177 – содержание активного хлора в мг, соответствующее 1 мл 0,005 н. раствора тиосульфата; 1000 – коэффициент пересчета единиц измерения из миллилитров в литры; VA – объем пробы воды, взятый для анализа, мл.
Полученные результаты заносят в таблицу 1.1.
1. Для чего необходимо хлорировать воду?
2. В составе каких соединений может присутствовать хлор в воде?
3. Что такое «активный» хлор, «свободный» и «связанный» хлор?
4. Сущность метода йодометрического титрования при определении «активного» хлора?
5. Предельно-допустимая концентрация «активного» хлора в питьевой воде?
6. Допускается ли содержание «активного» хлора в природной воде?
7. Почему анализ отобранной пробы на содержание «активного» хлора следует проводить немедленно?
Лабораторная работа № 2.
Последнее изменение этой страницы: 2016-12-12; Нарушение авторского права страницы
источник
ПНД Ф 14.1:2:4.113-97
Количественный химический анализ вод. Методика измерений массовой концентрации «активного хлора» в питьевых, поверхностных и сточных водах титриметрическим методом
Купить ПНД Ф 14.1:2:4.113-97 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО «ЦНТИ Нормоконтроль»
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Документ устанавливает методику измерений массовой концентрации «активного хлора» («остаточного хлора») в питьевых, поверхностных и сточных водах титриметрическим методом. Диапазон измерений от 0,05 до 5 мг/дм3.
Действует редакция 2018 года
2 Приписанные характеристики показателей точности измерений
3 Средства измерений, вспомогательные устройства, реактивы и материалы
3.1 Средства измерений, вспомогательное оборудование
5 Требования безопасности, охраны окружающей среды
6 Требования к квалификации операторов
7 Требования к условиям измерений
8 Подготовка к выполнению измерений
8.1 Подготовка посуды для отбора проб
8.2 Отбор проб, их консервирование и хранение
8.3 Приготовление вспомогательных растворов
10 Обработка результатов измерений
11 Оформление результатов измерений
12 Контроль точности результатов измерений
12.2 Оперативный контроль процедуры измерений с использованием образцов для контроля
13 Проверка приемлемости результатов, полученных в двух лабораториях
Приложение А (информационное). Бюджет неопределенности измерений (Таблица А.1)
Приложение Б. Установление поправочного коэффициента к титру раствора тиосульфата натрия
| Дата введения | 01.01.2019 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 01.05.2018 |
| Актуализация | 01.01.2019 |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ
В СФЕРЕ ПРИРОДОПОЛЬЗОВАНИЯ
И.о. директора ФБУ «Федеральный
центр анализа и оценки техногенного
воздействия»
_________________ С.А. Хахалин
КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ ВОД
МЕТОДИКА ИЗМЕРЕНИЙ МАССОВОЙ
КОНЦЕНТРАЦИИ «АКТИВНОГО ХЛОРА» В ПИТЬЕВЫХ,
ПОВЕРХНОСТНЫХ И СТОЧНЫХ ВОДАХ
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
Методика допущена для целей государственного
экологического контроля
МОСКВА 1997 г.
(издание 2011 г.)
Методика рассмотрена и одобрена федеральным бюджетным учреждением «Федеральный центр анализа и оценки техногенного воздействия (ФБУ «ФЦАО»).
Главный инженер ФБУ «ФЦАО», к.х.н.
«Федеральный центр анализа и оценки техногенного воздействия» (ФБУ «ФЦАО»)
Настоящий документ устанавливает методику измерений массовой концентрации «активного хлора» («остаточного хлора») в питьевых, поверхностных и сточных водах титриметрическим методом.
Диапазон измерений от 0,05 до 5 мг/дм 3 .
Под термином «активный хлор» понимают суммарное содержание в воде: свободного хлора, двуокиси хлора, хлорноватистой кислоты, хлораминов, гипохлоритов.
Определению мешают нитрит-ионы, нитрат-ионы, соли железа, марганца и другие окислители, вступающие в реакцию с йодидом калия в кислой среде. Для устранения мешающего влияния вышеперечисленных компонентов реакцию проводят с ацетатным буферным раствором, имеющим рН = 4,5.
Значения показателя точности измерений 1 — расширенной относительной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
8.2.3 Пробу предохраняют от прямого солнечного света, нагревания и сотрясений. Для доставки в лабораторию сосуды с пробами упаковывают в тару, обеспечивающую все вышеперечисленные условия.
8.2.4 Пробу воды анализируют в день отбора, не консервируют.
8.2.5 При отборе проб составляют сопроводительный документ, в котором указывают:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
8.3 Приготовление вспомогательных растворов
60 см 3 концентрированной уксусной кислоты, помещают в мерную колбу вместимостью 1000 см примерно наполовину заполненную дистиллированной водой, объем доводят до метки дистиллированной водой, перемешивают.
Навеску (136,1 г) трехводного уксуснокислого натрия помещают в мерную колбу вместимостью 1000 см 3 , растворяют в небольшом количестве дистиллированной воды, перемешивают, доводят до метки дистиллированной водой.
В мерной колбе вместимостью 1000 см 3 смешивают 102 см 3 раствора уксусной кислоты (п. 8.3.1) и 98 см 3 раствора уксуснокислого натрия (п. 8.3.2), объем доводят до метки дистиллированной водой, перемешивают.
Навеску (5,00 г) крахмала помещают в стакан, приливают 50 см 3 воды, перемешивают. Полученную кашицу вливают тонкой струйкой при перемешивании в 950 см 3 кипящей воды, кипятят 3 — 5 минут.
Раствор устойчив в течение 4 — 5 дней.
8.3.5 Раствор тиосульфата натрия (I) нормальной концентрации 0,1 н.
Содержимое ампулы стандарт-титра тиосульфата натрия количественно переносят в мерную колбу вместимостью 1000 см 3 , доводят до метки дистиллированной водой, перемешивают.
8.3.6 Раствор тиосульфата натрия (II) нормальной концентрации 0,01 н.
100 см 3 раствора тиосульфата натрия (I) переносят в мерную колбу вместимостью 1000 см 3 , доводят до метки дистиллированной водой, перемешивают.
8.3.7 Раствор тиосульфата натрия (III) нормальной концентрации 0,005 н.
50 см 3 раствора тиосульфата натрия (II) переносят в мерную колбу вместимостью 100 см 3 , доводят до метки дистиллированной водой, перемешивают.
8.3.8 Растворы дихромата калия (I) нормальной концентрации 0,1 н.
Содержимое ампулы стандарт-титра бихромата калия количественно переносят в мерную колбу вместимостью 1000 см 3 , доводят до метки дистиллированной водой, перемешивают.
8.3.9 Растворы бихромата калия (I) нормальной концентрации 0,01 н.
100 см 3 раствора бихромата калия (I) переносят в мерную колбу вместимостью 1000 см 3 , доводят до метки дистиллированной водой, перемешивают.
8.3.10 Растворы бихромата калия (III) нормальной концентрации 0,005 н.
50 см 3 раствора бихромата калия (II) переносят в мерную колбу вместимостью 100 см 3 , доводят до метки дистиллированной водой, перемешивают.
8.3.11 Раствор серной кислоты (1:4).
Смешивают 4 части дистиллированной воды и 1 часть концентрированной серной кислоты, осторожно приливая кислоту к воде.
При выполнении измерений массовой концентрации «активного хлора» в пробах питьевых, поверхностных и сточных вод выполняют следующие операции.
В коническую колбу вместимостью 500 см 3 , снабженную притертой стеклянной пробкой, помещают шпателем 0,5 — 0,7 г йодистого калия, растворяют в 2 — 3 см 3 дистиллированной воды, приливают 12 см 3 уксусно-ацетатного буферного раствора (п. 8.3.3) и 200 см 3 анализируемой воды, перемешивают, помещают на 5 минут в темное место.
Выделившийся йод титруют раствором тиосульфата натрия (III) при содержании «активного хлора» от 0,05 до 1 мг/дм 3 или раствором тиосульфата натрия (II) при содержании «активного хлора» свыше 1 мг/дм 3 до появления светло-желтой окраски. Добавляют 1 — 2 см 3 раствора крахмала (п. 8.3.4) и продолжают титровать до исчезновения синей окраски раствора.
Массовую концентрацию «активного хлора», X (мг/дм 3 ) вычисляют по формуле:
где а — объем раствора тиосульфата натрия, израсходованного на титрование анализируемой пробы, см 3 ;
V — аликвотная часть пробы, см 3 ;
М — молярная концентрация эквивалента тиосульфата натрия, моль/дм 3 ;
K — поправочный коэффициент к титру раствора тиосульфата натрия 3 ;
3 Установление поправочного коэффициента к титру раствора тиосульфата натрия приведено в приложении Б.
35,5 — эквивалентная молярная масса хлора, г/моль.
При необходимости за результат измерений Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
Таблица 2 — Значения предела повторяемости при вероятности Р = 0,95
Диапазон измерений, мг/дм 3
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (3) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
U — значение показателя точности измерений (расширенная неопределенность измерений с коэффициентом охвата 2).
Значение U приведено в таблице 1.
Допускается результат измерений в документах, выдаваемых лабораторией, представлять в виде: Х ± ,01 ∙ Uл ∙ X, мг/дм 3 , Р = 0,95, при условии Uл 3 .
Процедуру измерений признают удовлетворительной при выполнении условия:
При невыполнении условия (7) контрольную процедуру повторяют. При повторном невыполнении условия (7) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 3.
Таблица 3 — Значения предела воспроизводимости при вероятности Р = 0,95
Диапазон измерений, мг/дм 3
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
источник
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Метод определения содержания остаточного активного (общего) хлора на месте отбора проб
Drinking water. Method for the determination of total chlorine in situ
1 РАЗРАБОТАН Обществом с ограниченной ответственностью «Протектор» и Закрытым акционерным обществом «Центр исследования и контроля воды»
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 343 «Качество воды»
4 Настоящий стандарт разработан с учетом основных нормативных положений международного стандарта ИСО 7393-3:1990* «Качество воды. Определение содержания свободного и общего хлора. Часть 3. Метод йодометрического титрования для определения содержания общего хлора» (ISO 7393-3:1990 «Water quality — Determination of free chlorine and total chlorine — Part 3: Iodometric titration method for the determination of total chlorine», NEQ)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. — Примечание изготовителя базы данных.
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Июнь 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации» . Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 61 Реактивы. Кислота уксусная. Технические условия
ГОСТ 83 Реактивы. Натрий углекислый. Технические условия
ГОСТ 199 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 4204 Реактивы. Кислота серная. Технические условия
ГОСТ 4220 Реактивы. Калий двухромовокислый. Технические условия
ГОСТ 4232 Реактивы. Калий йодистый. Технические условия
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 10163 Реактивы. Крахмал растворимый. Технические условия
ГОСТ 14919 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ ИСО/МЭК 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27068 Реактивы. Натрий серноватистокислый 5-водный. Технические условия
ГОСТ 28311 Дозаторы медицинские лабораторные. Общие технические требования и методы испытаний
ГОСТ 29227 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251 (ИСО 835-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 31861 Вода. Общие требования к отбору проб
ГОСТ 31862 Вода питьевая. Отбор проб
________________
Действует ГОСТ Р 56237-2014 (ИСО 5667-5:2006) «Вода питьевая. Отбор проб на станциях водоподготовки и в трубопроводных распределительных системах».
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р ИСО 21748 Статистические методы. Руководство по использованию оценок повторимости, воспроизводимости и правильности при оценке неопределенности измерений
ГОСТ Р 53228 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 остаточный свободный хлор (free chlorine): Хлор, представленный в форме хлорноватистой кислоты, гипохлорит-ионов или элементарного растворенного хлора.
3.2 остаточный связанный хлор (combined chlorine): Хлор, представленный в форме хлораминов (монохлорамина, дихлорамина и трихлорида азота) и хлорированных органических азотсодержащих производных.
3.3 остаточный активный (общий) хлор (total chlorine, synonym — total residual chlorine): Суммарное содержание остаточного свободного и остаточного связанного хлора.
Отбор проб воды проводят по ГОСТ 31861 и ГОСТ 31862. Объем отобранной пробы должен быть не менее 500 см воды.
Пробы воды для определения массовой концентрации остаточного активного хлора не консервируют, определение следует проводить как можно скорее.
Метод основан на количественном окислении иодида калия активным хлором до иода, который титруют раствором тиосульфата натрия в присутствии крахмала в кислой среде (рН 4,5-6,2).
Мешающее влияние окислителей, в частности озона, перекиси водорода, диоксида хлора, устраняют соблюдением указанного диапазона рН среды.
Весы, обеспечивающие точность взвешивания со значением среднего квадратического отклонения (СКО), не превышающим 0,3 мг, и с пределом допускаемой абсолютной погрешности не более ±0,6 мг и весы с пределом допускаемой абсолютной погрешности не более ±10,0 мг по ГОСТ Р 53228.
рН-метр любого типа, обеспечивающий измерение рН с погрешностью не более ±0,1 рН
Колбы мерные 2-1000-2 по ГОСТ 1770.
Цилиндры мерные 1-10-2, 1-100-2, 1-500-2, 1-1000-2 или любого другого исполнения по ГОСТ 1770.
Пипетки градуированные 1-1-2-5, 1-1-2-10 или других типов и исполнений по ГОСТ 29227.
Дозаторы пипеточные переменного объема от 1 до 5 см и от 2 до 10 см с погрешностью дозирования не более ±1% по ГОСТ 28311.
Секундомер механический 2-го класса точности.
Пипетка из полиэтилена высокого давления с замкнутым резервуаром (встроенной грушей) и со стандартным размером капли, длиной 150-200 мм, вместимостью до 3-5 см , например пипетка Пастера или Liquipette, калиброванная по 7.3.
Бюретка 1-1-2-10-0,02 или 1-1-2-10-0,05 по ГОСТ 29251 номинальной вместимостью 10 см 2-го класса точности.
Стандартный образец (далее — СО) массовой концентрации активного хлора или имитирующий его стандартный образец состава водного раствора иодата калия, например ГСО 7105-94, с относительной погрешностью аттестованного значения не более ±3%.
Мензурки вместимостью 500 см по ГОСТ 1770 или стаканы (кружки) мерные вместимостью 100 и 500 см из полипропилена.
Стаканы химические вместимостью 500 см по ГОСТ 25336.
Колбы конические вместимостью 250 см и 750 см по ГОСТ 25336.
Колбы плоскодонные вместимостью 1000 см по ГОСТ 25336.
Электроплитки одноконфорочные по ГОСТ 14919.
Вода дистиллированная по ГОСТ 6709.
Калий йодистый (далее — иодид калия) по ГОСТ 4232, х.ч.
Калий двухромовокислый (далее — бихромат калия) по ГОСТ 4220, ч.д.а. или стандарт-титр (фиксанал) калия двухромовокислого.
Кислота серная по ГОСТ 4204, ос.ч.
Кислота уксусная ледяная по ГОСТ 61, х.ч.
Крахмал растворимый по ГОСТ 10163, ч.д.а.
Натрий серноватистокислый 5-водный (далее — тиосульфат натрия) по ГОСТ 27068, х.ч. или стандарт-титр (фиксанал) тиосульфата натрия.
Натрий уксуснокислый 3-водный (далее — тригидрат ацетат натрия) по ГОСТ 199, ч.д.а.
Кислота салициловая, со значением массовой доли (содержания) основного вещества не менее 98%.
Натрий углекислый (далее — карбонат натрия) по ГОСТ 83, х.ч.
Примечание — Допускается применять другие средства измерений, вспомогательные устройства, реактивы и материалы, в том числе импортные, с метрологическими характеристиками не хуже указанных.
При подготовке к выполнению измерений и при их проведении необходимо соблюдать условия, установленные в руководствах по эксплуатации или в паспортах средств измерений и вспомогательного оборудования.
7.1 Приготовление растворов
7.1.1 Приготовление основного раствора тиосульфата натрия молярной концентрации c ( ) 0,1 моль/дм
В мерной колбе вместимостью 1000 см растворяют 25,0 г тиосульфата натрия в 200 см дистиллированной воды, добавляют 0,2 г карбоната натрия и доводят до метки дистиллированной водой. В случае применения стандарт-титра (фиксанала) раствор готовят в соответствии с инструкцией по приготовлению.
Срок хранения раствора в емкости из темного стекла в защищенном от прямых солнечных лучей месте — не более 3 мес.
7.1.2 Приготовление рабочего раствора тиосульфата натрия молярной концентрации c ( ) 0 ,01 моль/дм
Раствор готовят разраблением* раствора по 7.1.1. В мерную колбу вместимостью 1000 см вносят 100 см раствора тиосульфата натрия молярной концентрации 0,1 моль/дм (см. 7.1.1), добавляют 0,2 г карбоната натрия и доводят до метки дистиллированной водой.
_______________
* Текст документа соответствует оригиналу. — Примечание изготовителя базы данных.
Срок хранения раствора в емкости из темного стекла — не более 3 мес.
7.1.3 Приготовление раствора бихромата калия молярной концентрации c (1/6 ) 0,1 моль/дм
Раствор готовят из стандарт-титра (фиксанала) бихромата калия в соответствии с инструкцией по применению, разбавляя его до требуемой концентрации дистиллированной водой.
При отсутствии стандарт-титра (фиксанала) бихромата калия раствор готовят следующим способом: в мерной колбе вместимостью 1000 см растворяют 4,90 г бихромата калия в 200 см дистиллированной воды и доводят до метки дистиллированной водой.
Срок хранения раствора в емкости из темного стекла — не более 6 мес.
7.1.4 Приготовление раствора бихромата калия молярной концентрации c (1/6 ) 0,01 моль/дм
Раствор готовят разбавлением в десять раз раствора, приготовленного по 7.1.3, дистиллированной водой. Например, в мерную колбу вместимостью 1000 см вносят 100 см раствора бихромата калия (см. 7.1.3) и доводят объем раствора в колбе до метки дистиллированной водой.
Срок хранения раствора в емкости из темного стекла — не более 3 мес.
7.1.5 Приготовление раствора иодида калия с массовой долей 25%
250 г иодида калия, проверенного по 7.4, растворяют в 750 см дистиллированной воды.
Срок хранения раствора в емкости из темного стекла — не более 3 мес.
7.1.6 Приготовление раствора иодида калия с массовой долей 10%
Раствор готовят путем растворения 10,00 г иодида калия, проверенного по 7.4, в 90 см дистиллированной воды или разбавлением в 2,5 раза раствора по 7.1.5. Например, в мерную колбу вместимостью 1000 см вносят 400 см раствора иодида калия по 7.1.5 и доводят объем раствора в колбе до метки дистиллированной водой.
Срок хранения раствора в емкости из темного стекла — не более 3 мес.
7.1.7 Приготовление раствора крахмала
В стакане смешивают 5,0 г растворимого крахмала и 100 см холодной дистиллированной воды.
В плоскодонную колбу вместимостью 1000 см вносят 900 см дистиллированной воды и доводят ее до кипения, затем вливают подготовленный растворимый крахмал и кипятят 2-3 мин. Затем содержимое колбы охлаждают до комнатной температуры и консервируют добавлением 1,0 г салициловой кислоты.
Срок хранения раствора в полиэтиленовой или стеклянной емкости при комнатной температуре — не более 5 сут, при температуре от 0°С до 5°С — не более 14 сут.
7.1.8 Приготовление раствора уксусной кислоты молярной концентрации c ( ) 1 моль/дм
В мерной колбе вместимостью 1000 см растворяют 57 см ледяной уксусной кислоты в 600-700 см дистиллированной воды и доводят до метки дистиллированной водой.
Срок хранения раствора в стеклянной емкости — не более 6 мес.
7.1.9 Приготовление ацетатного буферного раствора рН (4,5±0,1)
В мерную колбу вместимостью 1000 см вносят 102 см раствора уксусной кислоты, приготовленного по 7.1.8, добавляют 13,35 г тригидрата ацетата натрия и доводят до метки дистиллированной водой.
Срок хранения раствора в стеклянной емкости — не более 3 мес. Рекомендуется периодически в период хранения и перед применением раствора проверять рН с использованием рН-метра. Если значение рН изменилось более чем на 0,2 единицы рН, то готовят новый буферный раствор.
7.2.1 В коническую колбу вместимостью 250 см , снабженную пришлифованной пробкой, градуированной пипеткой вносят 5 см раствора иодида калия с массовой долей 10% (см. 7.1.6) (или 0,5 г иодида калия и 2 см дистиллированной воды), 5 см раствора серной кислоты (см. 7.1.10), прибавляют градуированной пипеткой 9 см раствора бихромата калия (см. 7.1.4), затем добавляют 80 см дистиллированной воды. Колбу закрывают крышкой, перемешивают и ставят в темное место на 5 мин, после чего выделившийся иод титруют с использованием бюретки раствором тиосульфата натрия молярной концентрации 0,01 моль/дм (см. 7.1.2) до появления бледно-соломенного окрашивания, затем прибавляют 1 см раствора крахмала, приготовленного по 7.1.7, и продолжают титрование до обесцвечивания раствора. Контроль исчезновения синей окраски проводят на фоне листа белой бумаги.
где — объем раствора бихромата калия (в данном случае равен 9 см , см. 7.2.1), см ;
— объем раствора тиосульфата натрия, пошедшего на титрование бихромата калия, см .
7.2.3 Титрование по процедуре 7.2.1 повторяют не менее трех раз и рассчитывают среднее арифметическое значение. При этом должно выполняться следующее условие
где , — наибольшее и наименьшее значения коэффициента поправки;
— значение предела повторяемости, равное 7%;
— среднее арифметическое значение коэффициента поправки.
Значение коэффициента поправки должно быть в пределах 0,97-1,03. Если значение коэффициента поправки выходит из указанных пределов, то раствор соответственно укрепляют (добавлением основного раствора тиосульфата натрия по 7.1.1) или разбавляют (добавлением дистиллированной воды). Коэффициент поправки определяют при приготовлении свежего раствора тиосульфата натрия, а также периодически в процессе его хранения — но не реже одного раза в месяц.
Примечание — После добавления в рабочий раствор тиосульфата натрия (см. 7.1.2) основного раствора (см. 7.1.1) или дистиллированной воды перед повторным определением коэффициента поправки рабочий раствор необходимо выдержать не менее суток.
где — суммарный объем капель, см ;
— количество капель.
По полученному значению среднего объема капли рассчитывают коэффициент пипетки *, мг, значение которого численно равно содержанию остаточного активного (общего) хлора, соответствующему одной капле раствора тиосульфата натрия (см. 7.1.2), по формуле
где — средний объем капли, рассчитанный по формуле (3), см ;
— содержание остаточного активного (общего) хлора, соответствующее 1 см раствора тиосульфата натрия (см. 7.1.2), мг/см ;
К — коэффициент поправки раствора тиосульфата натрия (см. 7.1.2), установленный по 7.2.
________________
* Формула и экспликация к ней соответствуют оригиналу. — Примечание изготовителя базы данных.
7.4 Контроль качества иодида калия
Иодид калия проверяют по ГОСТ 4232 (подраздел 3.5) на соответствие требованиям и нормам, предъявляемым к данному реактиву.
7.5 Установление объема буферного раствора, достаточного для достижения требуемого значения рН в анализируемой пробе
Объем буферного раствора, необходимый для достижения требуемого интервала рН, устанавливают экспериментально для каждого типа источника водоснабжения. Для этого в стакан помещают 500 см пробы анализируемой воды, электроды рН-метра и включают перемешивание, затем прибавляют 10 см раствора иодида калия (см. 7.1.5) и градуированной пипеткой постепенно вводят буферный раствор (см. 7.1.9) до достижения значения рН от 4,5 до 6,2. Фиксируют добавленный объем буферного раствора. При последующем определении остаточного активного (общего) хлора в пробе буферный раствор добавляют в объеме не меньше установленного значения.
В коническую колбу вместимостью не менее 750 см вносят мензуркой или мерной кружкой 500 см пробы анализируемой воды, пипеточным дозатором добавляют 10 см раствора иодида калия (см. 7.1.5), буферный раствор (см. 7.1.9), в количестве, установленном ранее по 7.5, и перемешивают, затем вносят 1 см раствора крахмала (см. 7.1.7) и титруют выделившийся иод раствором тиосульфата натрия (см. 7.1.2) с использованием откалиброванной по 7.3 пипетки до исчезновения синей окраски. Контроль исчезновения синей окраски проводят на фоне чистого листа белой бумаги. Фиксируют общее количество капель раствора тиосульфата натрия, израсходованных на титрование.
Примечание — При определении остаточного активного хлора в пробе неизвестного состава допускается контролировать соответствие рН требуемому интервалу значений (см. 7.5) с помощью индикаторной бумаги.
где — коэффициент пипетки, рассчитанный по 7.3, мг;
— количество капель раствора тиосульфата натрия, израсходованных на титрование (см. раздел 8);
— коэффициент объемного пересчета;
— объем пробы анализируемой воды, взятый для анализа, см .
________________
* Формула и экспликация к ней соответствуют оригиналу. — Примечание изготовителя базы данных.
За окончательный результат определения массовой концентрации остаточного активного (общего) хлора в пробе воды принимают значение, вычисленное по формуле (5).
Численное значение результата измерений должно оканчиваться цифрой того же разряда, что и абсолютное значение характеристики погрешности, вычисленное в мг/дм и округленное до двух значащих цифр.
источник