Данный урок — лабораторная работа разработан по предмету «Аналитическая химия» для обучающихся по профессии «Технология продукции общественного питания». В ходе лабораторной работы в основе определения общей жесткости воды используется один из методов титриметрического анализа — комплексонометрический.
Вода является универсальным растворителем на планете Земля. Как в загородных домах, так и в городе в квартирах с централизованным водопроводом существует проблема жесткой воды. Жесткость воды зависит от наличия в ней солей кальция и магния. Жесткость воды является характеристикой конкретного источника водоснабжения и не изменяется в процессе подготовки питьевой воды к централизованному водоснабжению. Как определить степень жесткости воды?
Цель: повторить основные понятия, используемые в титриметрическом анализе; научить определять общую жесткость воды комплексонометрическим методом; закрепить навыки работы с лабораторным оборудованием; развивать вычислительные навыки; воспитывать чувство ответственности и дисциплинированности при выполнении практической работы.
Оборудование: конические колбы, мерные круглодонные колбы, бюретки для титрования, реактивы: трилон Б, индикатор эриохром черный Т, водопроводная вода, аммиачно-буферная смесь; таблицы, инструкционные карты.
II. Актуализация знаний учащихся
Сегодня на уроке мы с Вами будем говорить о самом замечательном веществе на планете Земля — воде.
Вы, как будущие технологи общественного питания, будете использовать питьевую воду не только в быту, но и в своей профессиональной деятельности.
В Старом Осколе питьевая вода поступает в город из 14 водозаборов, расположенных в разных частях города и района.
1. Одинакова ли питьевая вода по своим свойствам? (нет)
2.Чем она отличается? (содержанием различных веществ — жесткостью)
Абсолютно чистой воды в природе не существует. Она всегда содержит различные примеси как в растворенном, так и во взвешенном состоянии. От концентрации и природы этих примесей зависит пригодность воды для бытовых и промышленных нужд.
3.Что такое жесткость воды?
Жесткость воды определяется содержанием в ней растворимых солей магния, кальция, гидрокарбонатов, сульфатов, хлоридов.
4. Какие виды жесткости воды Вы знаете?
Жесткость временная (карбонатная) обусловлена содержанием гидрокарбонатов кальция и магния.
Жесткость постоянной (некарбонатной) обусловленна присутствием в воде хлоридов, сульфатов и других солей магния и кальция.
Общая жесткость воды представляет сумму жесткости карбонатной и некарбонатной.
5. Почему нежелательно использовать жесткую воду в быту?
Жесткая вода образует плотные слои накипи на внутренних стенках паровых котлов и кипятильников, в ней плохо развариваются пищевые продукты, при стирке белья в жесткой воде расходуется больше мыла.
III. Изучение нового материала
Тема нашего урока «Определение общей жесткости воды комплексонометрическим методом». Запишем ее в тетради.
В ходе урока мы должны научиться практическим путем определять общую жесткость воды, используя титриметрический анализ, в частности комплексонометрический метод.
Вспомним основы комплексонометрического метода анализа.
1. В чем состоит сущность комплексонометрического метода?
Сущность комплексонометрического метода состоит в образовании комплексных соединений анализируемых катионов с органическими реагентами — комплексонами.
Титрование — постепенное добавление раствора известной концентрации до достижения точки эквивалентности.
3. Что такое точка эквивалентности?
Точка эквивалентности — момент окончания реакции, т.к. вещества реагируют между собой в эквивалентных количествах.
4. С помощью чего устанавливают точку эквивалентности? (индикатора)
Индикаторы — вещества, при помощи которых устанавливают момент эквивалентности между взаимодействующими растворами.
6. Что такое стандартный (рабочий) раствор?
Стандартный раствор — раствор с точно установленной концентрацией, используемый для титриметрических измерений.
7. Какие правила техники безопасности необходимо соблюдать при выполнении практической работы?
Правила техники безопасности при работе со стеклянной посудой; жидкостями и сыпучими, а также ядовитыми веществами.
Работу выполняем по парам. На столах имеются инструкционные карты.
IV. Выполнение практической работы
Работу выполняем по парам. На столах имеются инструкционные карты.
Цель работы: определить общую жесткость воды методом комплексонометрии.
Оборудование: бюретки, мерный цилиндр, мерные круглодонные колбы, конические колбы, цилиндры, воронки, шпатель; реактивы: раствор Трилона Б, эриохром черный Т (сухой), аммиачно-буферная смесь, водопроводная вода.
1. Мерной колбой отмерить 100 мл исследуемой Н2О и перелить ее в коническую колбу.
2. Добавить к воде 5 мл аммиачно-буферной смеси, затем 7-8 капель спиртового раствора индикатора эриохром черного Т или щепотку его смеси с NaCl или KCl (сухую).
3. Тщательно перемешать, раствор окрасится в винно-красный цвет.
4. Смесь оттитровать 0,05 Н раствором Трилона Б. К концу титрования раствор Трилона Б добавлять по каплям, встряхивая смесь в колбе после добавления каждой капли.
5.Титрование можно считать законченным если после добавления очередной капли окраска раствора приобретает синий цвет с зеленоватым оттенком и с добавлением лишней капли раствора комплексона не изменяется.
6. Определить объем трилона Б, израсходованного на титрование.
7.Титрование повторить 2-3 раза и для расчета взять среднее значение.
8. Произвести расчет общей жесткости воды.
Величину общей жесткости воды (Ж) в мг*экв/л вычисляют по формуле:
где N — нормальность раствора трилона Б, г-экв/л;
V — объем раствора трилона Б, мл;
9. Сделайте вывод о типе воды, пользуясь данными значениями жесткости воды.
Типы воды (по жесткости):
- Очень мягкие — 0-1,5 мг-экв/л;
- Мягкие — 1,5- 3,0 мг-экв/л;
- Среднежесткие — 3,0- 4,5 мг-экв/л;
- Довольно жесткие — 4,5 — 6,5 мг-экв/л;
- Жесткие — 6,5 — 11,0 мг-экв/л;
- Очень жесткие — свыше 11,0 мг-экв/л.
V. Подведение итогов работы
Сегодня на уроке мы практическим путем определили общую жесткость воды. Водопроводная вода, которую мы используем, является среднежесткой.
Какие способы устранения жесткости Вы знаете?
Способы устранения жесткости воды:
- Карбонатная (временная) жесткость — кипячение; добавление известкового молока или соды.
- Некарбонатная (постоянная) жесткость — добавление соды.
источник
Определение жесткости воды в современном мире – это обязательное условие для обеспечения работоспособности всей техники, работающей с ней. Тем не менее нельзя сказать, что такая жидкость действительно вредна для человека. Всего должно быть в меру, ведь излишне мягкая вода наносит не меньше ущерба здоровью, чем жесткая.
Начинать всегда следует с самых азов, чтобы было полное понимание проблемы. В нашем случае, прежде чем приступать к определению жесткости воды, сначала нужно понять, что она собой представляет. По результатам экспертизы, проведенной в 2011 на кафедре химии и экологии Новгородского университета им. Ярослава Мудрого, для природной натуральной воды жесткость является абсолютно нормальным явлением. Вплоть до момента появления современной техники этот вопрос вообще мало кого интересовал, тысячелетиями люди спокойно употребляли ее в том виде, в котором она есть. Придают воде жесткость растворенные в ней соли магния и кальция. Само понятие жесткости возникло по результатам ощущения людей, так как когда насыщенная этими солями и другими элементами вода вступает во взаимодействие с мылом, пена практически не образуется, затрудняя стирку или мытье.
Прежде чем понять, какую воду пить, следует учитывать тот факт, что жесткость не является однородной величиной. Есть как минимум две основные разновидности:
Зависят эти виды от типа растворенных солей, которые в любой жесткой воде присутствуют всегда вместе, составляя общую жесткость. Тем не менее разделять их можно и нужно. Временная жесткость напрямую зависит от наличия бикарбонатных и гидрокарбонатных анионов. Главная их особенность – разложение во время кипячения. В результате распада получается непосредственно сама вода, углекислый газ и карбонат кальция, который уже практически не растворяется. Получается, что от временной жесткости можно без особых проблем избавиться при помощи простого поднятия температуры воды до +100 градусов. В качестве примера можно привести любой чайник. После продолжительного использования можно обнаружить внутри осадок, который и является результатом описанного выше процесса распада. Все же, что не разлагается подобным образом, относится к постоянной жесткости, избавиться от которой без специальной обработки практически невозможно.
Это необходимо для того, чтобы понимать, какую воду пить можно без опаски, а также для того, чтобы любая техника, взаимодействующая с водой, не вышла из строя. Для человека излишне жесткая вода вредна. Но даже если этот параметр будет находиться на приемлемом для нашего организма уровне, все равно оборудование это не устроит. Аквариумы, кофейные, стиральные и посудомоечные машины, чайники, мультиварки и множество других вариантов техники требует воду строго определенной жесткости. Обычно справиться с этим помогают фильтры типа «Гейзер-3», однако зачастую такая мера может даже считаться излишней. Прежде чем тратить на них деньги, рекомендуется сначала провести тест на жесткость воды, ведь вполне возможно, что этот показатель и так на нормальном уровне.
Как уже было сказано выше, в первую очередь ущерб человеку наносит не какой-то определенный тип воды, а полное отсутствие баланса в организме.
- Плохое растворение пищевых продуктов (связано с катионами Ca 2 + и Mg 2 +).
- Кофе, чай и любые другие подобные напитки завариваются очень плохо.
- При длительном употреблении возможно расслабление желудка.
- Жесткая вода может стать причиной образования камней в почках.
- Насыщает организм требуемыми ему элементами.
- Улучшает состояние зубов, уменьшает вероятность возникновения кариеса.
- Жесткая вода является причиной поломки большинства видов техники.
- Выводит шлаки, но попутно вымывает полезные элементы (калий, магний и кальций). В результате кости становятся более хрупкими. Также не лучшим образом воздействует на сердечно-сосудистую систему.
- Негативно воздействует на гипофиз-адреналиновую систему.
- Оказывает плохое влияние на водно-солевой баланс организма.
Таким образом, определение жесткости воды должно производится не с целью избавиться от нее, а для того, чтобы свести негативное воздействие к минимуму и привести употребление такой жидкости к требуемому организмом балансу.
Согласно ГОСТу, питьевая вода должна проверяться на жесткость строго в лаборатории, посредством титриметрического анализа. Для этого сначала необходимо взять пробы, объем которых должен быть не менее 400 кубических сантиметров (0,4 литра). В качестве емкости, в которой будет производиться хранение, может использоваться любая тара, если она изготовлена из стекла или полимерного материала. Очень важно провести анализ не позднее чем через 24 часа после отбора пробы. В особых случаях, когда необходимо увеличить этот срок, производится подкисление жидкости посредством добавления соляной кислоты. В таком состоянии она может храниться уже около 1 месяца.
Среди всех методов определения жесткости воды данный вариант заслуженно считается самым достоверным и комплексным. В его основе лежит процесс образования соединений трилона вместе со щелочноземельными элементами ионов. Минимальный показатель жесткости, который поддается определению при помощи этого способа, – 0,1 о Ж (нормой считается 7-10 о Ж). В качестве пробы может быть использована обычная вода из-под крана. Лучшим выходом в ситуации с подозрением на повышенную жесткость является сразу же посетить соответствующую лабораторию, так как никакие домашние методы не смогут выдать точные данные. Но о них — ниже.
Полностью описывать весь процесс нет никакого смысла, так как воспроизвести его самостоятельно, без нужных навыков и химических элементов и оборудования невозможно. Тем не менее можно выделить несколько основных принципов реакции, которые сохраняются в любой ситуации и присущи абсолютно всем вариантам:
- Всегда должен быть способ, позволяющий зафиксировать эквивалентность реакции, которая и является основой для определения жесткости.
- Анализ проводится очень быстро.
- Должно выполняться требование стехиометричности процесса. Проще говоря, это значит, что в процессе проведения реакции не должны образовываться никакие побочные продукты.
- С момента начала реакции ее невозможно повернуть вспять или остановить.
Для определения жесткости воды в домашних условиях можно использовать специальные приспособления, купить которые не составит особого труда (они не запрещены и общедоступны). Выглядят они как стандартные тестовые полоски. Для использования достаточно погрузить одну из них в воду, требующую проверки, на указанный в инструкции период времени. В результате изделие изменит свой цвет. При использовании таких полосок для определения жесткости воды главной проблемой является определить, каков именно показатель жесткости. Чтобы это сделать, нужно сравнивать цвет на полосе и примеры с описанием на упаковке. К сожалению, далеко не всегда можно сразу же понять, что именно показывает приспособление, и даже в более четкой ситуации точность данных оставляет желать лучшего. В целом такие тест-полоски подходят только для общего понимания того, насколько жесткая или мягкая вода.
Проверить воду из-под крана на жесткость также можно при помощи подручных средств. Правда, это скорее занимательный опыт для детей, чем действительно вариант тестирования показаний жидкости.
- Банку емкостью 1 литр (или любую другую подобную емкость).
- Стакан в форме цилиндра.
- Любые весы (удобнее всего использовать электронные).
- Линейку.
- Мыло хозяйственное (72% или 60%).
- Дистиллированную воду.
Для проверки необходимо взять 1 грамм мыла, измельчить его и поместить в стакан. После этого следует подогреть дистиллированную воду, но не доводить до кипения. Ее следует налить в тот стакан, в котором уже лежит мыло. В итоге оно обязано растворится в воде. Следующий шаг – налить еще больше воды. После этого следует налить в банку обычной воды из-под крана и медленно вылить мыльную жидкость из стакана и перемешать (медленно). Если образуется пена, то это — показатель жесткости. К сожалению, более или менее четко сказать, каков именно ее уровень, при помощи такого метода практически невозможно.
Еще один вариант определения жесткости питьевой воды – воспользоваться специальным прибором – TDS-метром. В принципе, он предназначен для определения электропроводимости воды, на что влияют как непосредственно соли (создающие жесткость), так и множество других элементов, что не дает нужного уровня точности. Более того, показания прибора обычный человек, не умеющий их считывать, не поймет и скорее всего запутается. Попробуем упростить задачу. Подавляющее большинство таких устройств в качестве единиц измерения используется некие ppm. У нас же применяются другие варианты, основанные на эквиваленте миллиграмма на литр жидкости. В среднем, 1 наша единица (мг-экв/л) равняется 50,05 зарубежным ppm. По правилам, концентрация солей (т.е. жесткости) должна быть не более 350 ppm или же 7 мг-экв/л. На эти цифры и стоит ориентироваться. Если же прибор будет отечественным, все значительно облегчается. Хуже всего, когда подобное приспособление произведено где-то в Китае или другой подобной стране, где используются собственные единицы измерения. Тогда придется самостоятельно искать их эквивалент и переводить в привычные нам показания.
Из других приборов, способных определять жесткость воды, отдельно следует отметить уникальное устройство АКМС-1. Это достаточно большой стационарный агрегат, сходный по размерам с фильтрами «Гейзер-3». Просто так в домашних условиях с его помощью проверять жидкость не представляется возможным. Именно поэтому такие приспособления используются в первую очередь на производстве, где жесткость воды может повлиять на работу дорогостоящей техники или нанести другой подобный вред. В отличие от всех остальных аналогов, АКМС-1 действительно быстро и точно показывает текущий уровень жесткости, позволяя оператору своевременно реагировать. При помощи этого приспособления можно как пускать воду к рабочим агрегатам напрямую, если она не представляет для них угрозы, так и предварительно ее фильтровать. Это, конечно же, выльется в дополнительные затраты, но зато поможет сэкономить на ремонте техники, который обойдется значительно дороже.
Учитывая все указанное выше и требования ГОСТ, вода питьевая должна регулярно проверяться на уровень жесткости. Тем не менее принимать радикальные меры по ее умягчению не стоит, так как вредны оба состояния – слишком жесткая и слишком мягкая. Только в той ситуации, когда показатели действительно выше или ниже, стоит предпринимать какие-то действия. К слову, если с жесткостью регулярно борются, то про слишком мягкую воду практически не слышно, а ведь на это также нужно обращать не меньше внимания.
источник
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Метод определения общей жесткости
of total hardness content
Настоящий стандарт распространяется на питьевую воду и устанавливает комплексонометрический метод определения общей жесткости.
Метод основан на образовании прочного комплексного соединения трилона Б с ионами кальция и магния.
Определение проводят титрованием пробы трилоном Б при рН 10 в присутствии индикатора.
1.1. Пробы воды отбирают по ГОСТ 2874 и ГОСТ 4979.
1.2. Объем пробы воды для определения общей жесткости должен быть не менее 250 см 3 .
1.3. Если определение жесткости не может быть проведено в день отбора пробы, то отмеренный объем воды, разбавленный дистиллированной водой 1:1, допускается оставлять для определения до следующего дня.
Пробы воды, предназначенные для определения общей жесткости, не консервируют.
Посуда мерная лабораторная стеклянная по ГОСТ 1770 вместимостью: пипетки 10, 25, 50 и 100 см 3 без делений; бюретка 25 см 3 .
Колбы конические по ГОСТ 25336 вместимостью 250-300 см 3 .
Трилон Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652.
Аммоний хлористый по ГОСТ 3773.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Гидроксиламин солянокислый по ГОСТ 5456.
Кислота лимонная по ГОСТ 3118.
Натрий сернистый (сульфид натрия) по ГОСТ 2053.
Натрий хлористый по ГОСТ 4233.
Спирт этиловый ректификованный по ГОСТ 5962.
Цинк металлический гранулированный.
Магний сернокислый — фиксанал.
Хромоген черный специальный ЕТ-00 (индикатор).
Хром темно-синий кислотный (индикатор).
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.)
3.1. Дистиллированная вода, перегнанная дважды в стеклянном приборе, используется для разбавления проб воды.
3.2. Приготовление 0,05 н. раствора трилона Б
9,31 г трилона Б растворяют в дистиллированной и доводят до 1 дм3. Если раствор мутный, то его фильтруют. Раствор устойчив в течение нескольких месяцев.
3.3. Приготовление буферного раствора
10 г хлористого аммония (NH4Cl) растворяют в дистиллированной воде, добавляют 50 см 3 25 %-ного раствора аммиака и доводят до 500 см 3 дистиллированной водой. Во избежание потери аммиака раствор следует хранить в плотно закрытой склянке.
3.4. Приготовление индикаторов
0,5 г индикатора растворяют в 20 см 3 буферного раствора и доводят до 100 см3 этиловым спиртом. Раствор индикатора хрома темно-синего может сохраняться длительное время без изменения. Раствор индикатора хромогена черного устойчив в течение 10 сут. Допускается пользоваться сухим индикатором. Для этого 0,25 г индикатора смешивают с 50 г сухого хлористого натрия, предварительно тщательно растертого в ступке.
3.5. Приготовление раствора сернистого натрия
5 г сернистого натрия Na2S × 9H2O или 3,7 г Na2S × 5H2O растворяют в 100 см 3 дистиллированной воды. Раствор хранят в склянке с резиновой пробкой.
3.6. Приготовление раствора солянокислого гидроксиламина
1 г солянокислого гидроксиламина NH2OH × HCl растворяют в дистиллированной воде и доводят до 100 см 3 .
3.7. Приготовление 0,1 н. раствора хлористого цинка
Точную навеску гранулированного цинка 3,269 г растворяют в 30 см 3 соляной кислоты, разбавленной 1:1. Затем доводят объем в мерной колбе дистиллированной водой до 1 дм 3 . Получают точный 0,1 н. раствор. Разведением этого раствора вдвое получают 0,05 н. раствор. Если навеска неточная (больше или меньше чем 3,269), то рассчитывают количество кубических сантиметров исходного раствора цинка для приготовления точного 0,05 н. раствора, который должен содержать 1,6345 г цинка в 1 дм 3 .
3.8. Приготовление 0,05 н. раствора сернокислого магния
Раствор готовят из фиксанала, прилагаемого к набору реактивов для определения жесткости воды и рассчитанного на приготовление 1 дм3 0,01 н раствора. Для получения 0,05 н. раствора содержимое ампулы растворяют в дистиллированной воде и доводят объем раствора в мерной колбе до 200 см 3 .
3.9. Установка поправочного коэффициента к нормальности раствора трилона Б
В коническую колбу вносят 10 см 3 0,05 н. раствора хлористого цинка или 10 см3 0,05 н. раствора сернокислого магния и разбавляют дистиллированной водой до 100 см 3 . Прибавляют 5 см 3 буферного раствора, 5-7 капель индикатора и титруют при сильном взбалтывании раствором трилона Б до изменения окраски в эквивалентной точке. Окраска должна быть синей с фиолетовым оттенком при прибавлении индикатора хрома темно-синего и синей с зеленоватым оттенком при прибавлении индикатора хромогена черного.
Титрование следует проводить на фоне контрольной пробы, которой может быть слегка перетитрованная проба.
Поправочный коэффициент (К) к нормальности раствора трилона Б вычисляют по формуле
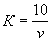
где v — количество раствора трилона Б, израсходованное на титрование, см 3 .
4.1. Определению общей жесткости воды мешают: медь, цинк, марганец и высокое содержание углекислых и двууглекислых солей. Влияние мешающих веществ устраняется в ходе анализа.
Погрешность при титровании 100 см 3 пробы составляет 0,05 моль/м 3 .
В коническую колбу вносят 100 см 3 отфильтрованной испытуемой воды или меньший объем, разбавленный до 100 см3 дистиллированной водой. При этом суммарное количество вещества эквивалента ионов кальция и магния во взятом объеме не должно превышать 0,5 моль. Затем прибавляют 5 см 3 буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромогена черного с сухим натрием и сразу же титруют при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленоватым оттенком).
Если на титрование было израсходовано больше 10 см3 0,05 н. раствора трилона Б, то это указывает что в отмеренном объеме воды суммарное количество вещества эквивалента ионов кальция и магния больше 0,5 моль. В таких случаях следует определение повторить, взяв меньший объем воды и разбавив его до 100 см3 дистиллированной водой.
Нечеткое изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения влияния мешающих веществ к отмеренной для титрования пробе воды прибавляют 1-2 см 3 раствора сульфида натрия, после чего проводят испытание, как указано выше.
Если после прибавления к отмеренному объему воды буферного раствора и индикатора титруемый раствор постепенно обесцвечивается, приобретая серый цвет, что указывает на присутствие марганца, то в этом случае к пробе воды, отобранной для титрования, до внесения реактивов следует прибавить пять капель 1 %-ного раствора солянокислого гидроксиламина и далее определить жесткость, как указано выше.
Если титрование приобретает крайне затяжной характер с неустойчивой и нечеткой окраской в эквивалентной точке, что наблюдается при высокой щелочности воды, ее влияние устраняется прибавлением к пробе воды, отобранной для титрования, до внесения реактивов 0,1 н. раствора соляной кислоты в количестве, необходимом для нейтрализации щелочности воды, с последующим кипячением или продуванием раствора воздухом в течение 5 мин. После этого прибавляют буферный раствор, индикатор и далее определяют жесткость, как указано выше.
(Измененная редакция, Изм. № 1).
5.1. Общую жесткость воды (Х), моль/м 3 , вычисляют по формуле
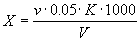
где v — количество раствора трилона Б, израсходованное на титрование, см 3 ;
К — поправочный коэффициент к нормальности раствора трилона Б;
V — объем воды, взятый для определения, см 3 .
Расхождение между повторными определениями не должно превышать 2 отн. %.
(Измененная редакция, Изм. № 1).
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 09.10.72 № 1855
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
источник
Чтобы выразить жесткость воды в цифрах, указывают концентрацию в ней ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы жесткости и миллиграмм-эквиваленты на литр (мг-экв/л).
Чтобы выразить жесткость воды в цифрах, указывают концентрацию в ней ионов кальция и магния. Международная система единиц рекомендует измерять жесткость в молях на кубический метр, но на практике применяют более удобные единицы.
В России для измерения жесткости используются градусы жесткости и миллиграмм-эквиваленты на литр (мг-экв/л).
По действующему ГОСТу 31865-2012 единицей измерения жесткости воды является градус — °Ж. 1°Ж = 1 мг-экв/л. Для сравнения 1°Ж (Россия) = 2,8 dH (Германия).
По величине данного показателя вода делится на 3 категории:
По действующему ГОСТу 31865-2012 единицей измерения жесткости воды является градус — °Ж. 1°Ж = 1 мг-экв/л. Для сравнения 1°Ж (Россия) = 2,8 dH (Германия).
По величине данного показателя вода делится на 3 категории:
По санитарным правилам и нормам ( СанПиН 2.1.4.1074–01 ) жесткость питьевой воды из централизованного источника водоснабжения не должна превышать 7 мг-экв/л (в отдельных случаях 10 мг-экв/л).
На практике даже «средняя» жесткость вызывает заметный дискомфорт. Уже 4–5 °Ж дадут о себе знать: оставят накипь в чайнике и плёнку на самом чае, известковый налет на мойке и белые разводы на посуде, «забьют» аэратор водопроводного крана и лейку душа.
По санитарным правилам и нормам ( СанПиН 2.1.4.1074–01 ) жесткость питьевой воды из централизованного источника водоснабжения не должна превышать 7 мг-экв/л (в отдельных случаях 10 мг-экв/л).
На практике даже «средняя» жесткость вызывает заметный дискомфорт. Уже 4–5 °Ж дадут о себе знать: оставят накипь в чайнике и плёнку на самом чае, известковый налет на мойке и белые разводы на посуде, «забьют» аэратор водопроводного крана и лейку душа.
Вариант «Точно»:
Самый точный метод определить жесткость воды — сдать ее на анализ в лабораторию. Например, в Санэпидемстанцию. СЭС проверит не только концентрацию солей жесткости, но и зафиксирует нитраты, пестициды, уровень содержания железа, сероводород, органические примеси и другие вещества, которые часто встречаются в грунтовых водах. Если вы подбираете систему водоочистки для коттеджа, вам обязательно нужно сделать анализ воды.
Вариант «Точно»:
Самый точный метод определить жесткость воды — сдать ее на анализ в лабораторию. Например, в Санэпидемстанцию. СЭС проверит не только концентрацию солей жесткости, но и зафиксирует нитраты, пестициды, уровень содержания железа, сероводород, органические примеси и другие вещества, которые часто встречаются в грунтовых водах. Если вы подбираете систему водоочистки для коттеджа, вам обязательно нужно сделать анализ воды.
Вариант «Быстро»:
Использовать тест-полоски для определения жесткости воды. Они продаются в зоомагазине или в магазине с кофе-машинами, иногда — в фирменных магазинах бытовой техники. Такой тест покажет примерную жесткость. На бумагу нанесен реагент, который при контакте с водой меняет окрас. Полоска опускается на время в воду, и интенсивность ее окраса будет меняться в зависимости от концентрации вещества в воде.
Основные недостатки такого метода: низкая точность и то, что интерпретировать результат теста бывает сложно. Придется сначала на глаз определить интенсивность окраса, сравнив с «палитрой» возможных результатов. А затем указанные на палитре численные значения жесткости переводить из европейских градусов в российские. Качественные тест-полоски обычно зарубежного производства.
источник
Как выполняется контроль жёсткости воды. Понятие жёсткости, от чего она зависит. Анализ воды на жёсткость дома. Лабораторные методы контроля общей и временной жёсткости жидкости. Приборы для выполнения анализа. Методы борьбы с повышенной жёсткостью в быту. Контроль жёсткость воды или анализ воды на жёсткость нужен для определения концентрации солей в жидкости. Этот анализ можно проводить в лабораторных условиях и дома.
Жёсткость воды – термин, говорящий о процентном соотношении солевых частиц магния и калия в жидкости. Она подразделяется на две разновидности:
- Временная (такая жидкость называется карбонатная);
- Общая жёсткость (данная вода относится к некарбонатной).
Первый тип жёсткости характеризуется присутствием гидрокарбонатных солевых частиц магния и калия. Если такую воду закипятить, то элементы распадутся на карбонаты и гидроксиды и выпадут в осадок. Именно этот белый налёт часто покрывает наши чайники изнутри и собирается на других нагревательных элементах.
Для жидкости с общей жёсткостью характерно наличие других химических элементов (различных нитратов, хлоридов и тп.п). Обычно жёсткость питьевой воды связана с особенностями вашего региона, составом грунтов. Чем больше известковых пород находится в почве, тем выше жёсткость воды. Но важно не только понимать суть понятия, но и знать, как проверить жёсткость воды. Выполнить это легко как в быту, так и на заводе.
Для проверки жёсткости водопроводной воды дома можно использовать следующие способы:
- Постарайтесь обильно вспенить мыльный брусок или порошок для стирки. Если у вас образуется мало пены, то ваша вода имеет повышенную жёсткость. Это возникает по той причине, что солевые частицы калия и магния не позволяют мылу пениться. При обильной пышной пене от любого моющего средства можно утверждать, что вода нежёсткая. Но этот метод не позволят точно определить степень жёсткости.
- На вкус также можно отличить жёсткую воду от мягкой. Она более горькая. Но не все могут точно уловить горьковатый привкус солей магния и калия.
- Белый осадок в чайниках, накипь на нагревательных элементах других бытовых приборов – признак жёсткой воды. Осадок возникает из-за распада солей и выпадения их на дно. Данная особенность жёсткой воды очень вредит бытовым приборам и отопительному трубопроводу.
- От жёсткости воды зависит скорость заваривания чайного напитка. При мягкой воде на эту процедуру уйдёт от 3 до 6 мин., в жёсткой воде чай будет завариваться от 8 до 12 мин. Кстати, на вкус оба напитка будут существенно отличаться.
- Благодаря нехитрому компактному измерительному прибору можно очень легко определить жёсткость любой жидкости. Он называется TDS-метр. Агрегат измерят электропроводность жидкости. Чем выше показатель, тем больше уровень солесодержания жидкости. Обычно его ещё называют солемер. Чаще такой анализ воды на жёсткость делают владельцы аквариумов и цветоводы.
- Проверить жёсткость воды в быту можно, используя тест-полоски, продающейся в аптеках медтехники.
Для этого анализа можно использовать колориметрическую методику и принцип титрования. Процедура анализа выполняется так: порция воды смешивается с метилоранжем (индикатором), ёмкость устанавливается на светлом фоне. Во вторую тару с водой добавляют соляную кислоту, пока не получится красно-оранжевый цвет воды.
Временную жёсткость жидкости находят в процессе расчёта требуемого количества соляной кислоты по формуле: Нвр = NHCl * VHCL* 1000/ V1, где N-насыщенность раствора, V-его количество, V1-количество пробы.
Этот анализ проводят в лаборатории. Для него используют комплексонометрическую методику. Она базируется на принципе возникновения соединений ионов, подвергающихся анализу, с природными реагентами. Сначала воду в пробирке разводят раствором индикатора на спирту (чёрного этиохрома «Т»). Также для этих целей может использоваться сухая смесь кальциевых и натриевых хлоридов. В итоге полученная смесь окрашивается в насыщенный рубиновый цвет. Затем в пробирку капается вещество, называемое Трилон.
Расчёт общей жёсткости производится по уравнению: Жо=Nx*Vx*1000/V1, где N-насыщенность вещества Трилон, V-его количество, V1-количество пробы.
Как мы уже говорили выше, прибор контроля жёсткости воды называется солемер или TDS-метр. Точность проверки составляет 2%. Основной принцип работы данного агрегата построен на зависимости электропроводности жидкости от общего числа примесей солей магния и калия. То есть чем больше данных солей в воде, тем больше будут показания прибора, а следовательно, тем выше жёсткость воды.
На некоторых предприятиях и заводах наблюдается прямая зависимость между жёсткостью используемой воды и исправностью работы оборудования. Поэтому для обеспечения бесперебойной работы технологического оборудования требуется осуществлять постоянный автоматический контроль жёсткости воды.
Для этих целей используется специальное оборудование, например, анализатор «АКМС-1». Этот прибор непрерывно контролирует содержание солевых частиц кальция и магния в жидкости, поступающей в технологическое оборудование. То есть он подсчитывает общую жёсткость в пределах 0,005-25,0 мг-экв/л.
Как понять, что ваша водопроводная вода жёсткая, мы писали выше. Теперь перечислим ряд мер, позволяющих снизить жёсткость воды в домашних условиях:
- Самый простой способ – кипячение воды.
- Фильтрация воды через системы обратного осмоса (специальные мембраны).
- Использование смягчающих солей.
- Применение фильтрующих картриджей.
- Магнитное фильтрующее устройство.
- Использование ионообменной смолы в комплексе с солевым раствором.
Хотите провести контроль жёсткости воды? Заказать такую услугу вы можете у наших специалистов, для этого вам достаточно связаться с нами по указанным телефонам.
источник
Жесткость — свойство воды, обусловленное присутствием в ней растворенных солей щелочно-земельных металлов (преимущественно кальция и магния). Различают жесткость кальциевую и магниевую, связанную с присутствием в воде соответственно ионов кальция и магния. Суммарное содержание ионов этих металлов в воде называется общей жесткостью.
Общая жёсткость подразделяется на карбонатную, обусловленную присутствием в воде гидрокарбонатов и карбонатов кальция и магния, и некарбонатную, обусловленную наличием кальциевых и магниевых солей сильных кислот.
Карбонатную жёсткость также называют временной (устранимой), а некарбонатную — постоянной. Гидрокарбонаты кальция и магния при длительном кипячении воды разлагаются с выделением диоксида углерода и выпадающих в осадок карбонатов кальция и магния (при дальнейшем кипячении карбонат магния гидролизуется с образованием гидроксида); жесткость воды при этом уменьшается:
Жесткость, оставшаяся после кипячения воды в течение определенного времени, достаточного для полного разложения гидрокарбонатов и удаления диоксида углерода (обычно 1 — 1,5 ч), называется постоянной жесткостью. Постоянная жесткость является важной характеристикой качества воды, используемой для технических целей. Она преимущественно зависит от содержания ионов кальция и магния, которые после кипячения уравновешиваются сульфатами и хлоридами. Эту часть постоянной жесткости, называемую также остаточной жесткостью, можно найти по разности между общей жесткостью и концентрацией гидрокарбонатов, выраженной в миллимолях на кубический дециметр. Однако кроме остаточной жесткости в воде после кипячения остается небольшое количество ионов кальция и магния, обусловленное растворимостью карбоната кальция и гидроксида магния. Эта часть постоянной жесткости называется неустранимой жесткостью. Поскольку растворимость карбоната кальция и гидроксида магния в присутствии ионов кальция и магния в растворе весьма незначительна, обычно некарбонатную (остаточную) жесткость отождествляют с постоянной жесткостью. Способ расчета постоянной жесткости и составляющих ее остаточной и неустранимой жесткости на основе результатов определения компонентов солевого состава воды приведен в «Руководстве по химическому анализу вод суши». Л.: Гидрометеоиздат. 1973.
Жесткость воды в настоящее время выражают в миллимолях количества вещества эквивалентов (КВЭ) Са 2+ и Mg 2+ , содержащихся в 1 дм 3 воды — ммоль/дм 3 КВЭ (ранее эту единицу обозначали мг-экв/л или мг-экв/дм 3 ). Миллимоль КВЭ Са 2+ и Mg 2+ равны соответственно 20,04 мг/ммоль и 12,15 мг/ммоль.
В естественных условиях ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и при других процессах растворения и химического выветривания горных пород. Источником этих ионов являются также микробиальные процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий: силикатной, металлургической, стекольной, химической промышленности, стоки с сельскохозяйственных угодий.
Общая жесткость поверхностных вод колеблется в основном от единиц до десятков миллимолей КВЭ в кубическом дециметре, причем карбонатная жесткость часто составляет 70 — 80 % от общей жесткости. Она подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Вода с жесткостью менее 4 ммоль/дм 3 КВЭ характеризуется как мягкая; от 4 до 8 ммоль/дм 3 КВЭ — средней жесткости; от 8 до 12 ммоль/дм 3 КВЭ — жесткая; более 12 ммоль/дм 3 КВЭ — очень жесткая.
Обычно преобладает (иногда в несколько раз) жесткость, обусловленная ионами кальция, однако в отдельных случаях, магниевая жесткость может достигать 50 — 60 % общей жесткости и более (часто магниевая жесткость превосходит кальциевую в морских и океанических водах, либо в поверхностных водах суши с высоким содержанием сульфат-ионов).
Высокая жесткость оказывает отрицательное влияние на свойства воды используемой в промышленности и для хозяйственно-бытовых целей. Жесткие требования в отношении величины жесткости предъявляются к воде, питающей паросиловые установки, поскольку в присутствии сульфатов и карбонатов кальций и магний образуют прочную накипь, уменьшающую теплопроводность металла и приводящую к перерасходу топлива и перегреву котлов. Для устранения жесткости применяют различные способы — осаждение труднорастворимых солей кальция и магния химическим или термическим путем, умягчение с помощью ионитов.
Высокая жесткость, особенно, обусловленная превышением солей магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное воздействие на органы пищеварения. Предельно допустимая величина жесткости в питьевых водах 7 ммоль/дм 3 КВЭ, но в некоторых случаях допускается использовать для питьевых целей воду с жесткостью 10 ммоль/дм 3 КВЭ.
ЖЕСТКОСТЬ ВОДЫ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ С ТРИЛОНОМ Б
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) общей и некарбонатной жесткости в пробах природных и очищенных сточных вод в диапазоне от 0,060 до 13,00 ммоль/дм 3 КВЭ (далее — ммоль/дм 3 ) титриметрическим методом с трилоном Б.
При анализе проб воды с величиной жесткости, превышающей 13,00 ммоль/дм 3 , допускается выполнение измерений после соответствующего разбавления пробы дистиллированной водой.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа
РД 52.24.403-2007. Массовая концентрация кальция в водах. Методика выполнения измерений титриметрическим методом с трилоном Б
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, В.3 и В.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих (Р = 0,95)
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s r, ммоль/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, ммоль/дм 3
Показатель правильности (границы систематической погрешности при вероятности Р = 0,95) ± D с, ммоль/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , ммоль/дм 3
источник
«Определение общей жесткости воды»
Используемая в паросиловых установкахвода содержит определенное количество растворенных минеральных веществ, суммарная концентрация которых определяет ведущий показатель качества воды общее солесодержание. От количества растворенньтх солей в значительной степени зависят происходящие в парогенераторе процессы накипеобразования и коррозии, избыточное содержание минеральных веществ может явиться и причиной загрязнения пара.
Общее солесодержание характеризуется наличием в воде солей, образованных катионами Са +2 , Мg +2 , Nа + и т д и анионами Сl — , НСО3 — и др. (см таблицу 1), из них соединения Са +2 , Мg +2 , Fе +2 обуславливают такой параметр качества воды, как жесткость. Под действием высокой температуры для солей кальция и магния достигается предел насыщения, что приводит к кристаллизации одних соединений (МgSiОз, Са10(Ро4)6(ОН)2 и др) в массе воды в виде шлама, других (СаSО4, СаSiОз , Мg(ОН)2) непосредственно на поверхности в виде накипи Образующаяся на внутренних поверхностях нагрева котла накипь, имея малый коэффициент теплопроводности, ведет к увеличению расхода топлива, снижает производительность котла и может стать, вследствие образования вздутий и трещин в кипятильных трубках, причиной аварии Следовательно, жесткость является основным критерием пригодности воды для питания паровых котлов.
В практике различают три вида жесткости карбонатную (гидрокарбонат), некарбонатную (хлориды, сульфаты и др), общую жесткость — как сумму карбонатной и некарбонатной (таблица 1)
Измеряют жесткость числом миллимолей эквивалентов жесткости (Са +2 и Мg +2 ) в 1 л воды (ммоль/л) Общую жесткость по анионному составу подразделяют на карбонатную Жк и некарбонатную Жнк. Таким образом, общая жесткость, с одной стороны, равна сумме кальциевой п магниевой жесткости, а с другой сумме карбонатной и некарбонатной, при этом концентрация ионов Са +2 и Мg +2 в воде, эквивалентная содержанию иона НСО — , определяет карбонатную жесткость воды (Жк), а концентрация ионов Са +2 и Мg +2 , эквивалентная анионам (Сl — , SО4 -2 и тд) — некарбонатную (Жнк) (Таблица 1)
Жо = Жнк + Жк
При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок СаСОз вследствие разложения гидрокарбоната кальция:
Поэтому карбонатную жесткость называют также временной жесткостью Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа Жесткость, оставшаяся после такого кипячения, называется постоянной жесткостью Для снижения жесткости до определенной нормы используются различные методы умягчения воды (электродиализ, обратный осмос, ионный обмен и др) для судовых технологических вод с малым количеством солей (конденсат, дистиллят) жесткость может выражаться в градусах.
Например, французский градус соответствует 10 мг СаСОз в 1 л воды, английский — 1 гран СаСОз (64,79891 мг) в 1 галоне воды (4,54609 л), т е 14,24 мг СаСОз в 1 л воды
Соотношения между единицами солесодержания приведены в таблице №2.
Практически солесодержание определяют солемерами по электропроводности контролируемого потока воды, общую жесткость — с помощью судовых
лабораторий водоконтроля методом титрования воды раствором трилона — Б (комплексона Ш).
Определение общей жесткости основано на способности трилона—Б
НООС-Н2С СН2 -СООН
N-CН2-CН2-N
NаООС — Н2С СН2 – СООNа
— двунатриевой соли этилендиаминтетрауксусной кислоты образовывать с
катионами жесткости хорошо растворимые бесцветные соединения — комплексонаты, которые почти не диссоциируют в водном растворе Реакции комплексообразования могут быть выражены следующими схемами:
где Т- условное обозначение составной части комплекса (лиганды)
Наиболее устойчивые комплексы образуются в щелочной среде при РН = 7,5—10, поэтому при определении общей жесткости исследуемую воду подщелачивают буферной смесью. Титрование проводят в присутствии индикатора хромтемносинего (эриохрома черного), образующего с нонами кальция и магния растворимые комплексные соединения винно-красного цвета по схеме:
Н2R ↔ 2Н+R -2
темно-лиловый синий
Са +2 (Мg +2 ) + R — = Са(Мg)R
синий винно-красный
R- анионы индикатора.
При титровании трилоном — Б комплексы типа СаR. разлагаются, вследствие образования более прочных соединений вида Nа2[СаТ], при этом ноны индикатора переходят в раствор
СаR+ Nа2Н2Т =Nа2[СаТ] +R -2 + 2Н +
винно-красный бесцветный синий
В точке эквивалентности винно-красная окраска раствора изменяется на синюю, в результате появления в растворе анионов индикатора.
Жесткость рассчитывают по закону эквивалентов:
Массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов
Для реагирующих веществ находящихся в растворе, закон эквивалентов записывается следующим образом.
Сэк(1) * V1 = Сэк(2)*V2
где Сэк(1) и Сэк(2) — молярные концентрации эквивалентов растворов, моль экв/л; V1 и V2
— объемы реагирующих веществ, мл.
Молярная концентрация эквивалентов Сэк (нормальная концентрация) — это отношение количества вещества эквивалентов (моль) к объему раствора (л) Единица измерения нормальной концентрации моль/л (СИ) Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,1 н, 0,01 н, и т. п. растворы.
Рассчитывают жесткость воды по закону эквивалентов (ммоль/л)
Где V1 — объем анализируемой воды, мл
V2— объем раствора Трилона Б, мл
Сэк(2) — молярная концентрация эквивалентов раствора Трилона Б, моль/л,
1000 — коэффициент перевода моль/л в ммоль/л
ПРАКТИЧЕСКАЯ ЧАСТЬ.
Опыт №1. «Определение жесткости котловой воды с помощью СКЛАВ-1.»
Оборудование и реактивы:
• Судовая лаборатория СКЛАВ,
• перечень необходимых для анализа реактивов, их состав и концентрация приведены в таблице № 10
Порядок выполнения работы:
Анализ проводят методом титрования 100 мл исследуемой котловой воды 0,ОIн раствором трилона-Б в присутствии индикатора хромтемносинего.
С этой целью мензуркой отбирают 100 мл анализируемой воды и переносят в коническую колбу. Туда же добавляют 5 мл аммиачно-буферного раствора и несколько крупинок сухого хромтемносинего. Установив стрелку трехходового крана «трилон», грушей накачивают в бюретку раствор и доводят уровень жидкости до нулевого деления. Анализируемый раствор титруют до перехода окраски в синий цвет, при интенсивном перемешивании. Ввиду скачкообразного изменения окраски раствора строго следят за процессом титрования, добавляя трилон-Б в конце титрования по каплям
Рассчитывают значения общей жесткости воды по формуле
Ж=1000*VТр*СЭКВ(Тр) / VH2O
где Ж — общая жесткость, ммоль/л
VТр -объем трилона-Б, пошедшего на титрование, мл,
СЭКВ(Тр) — молярная концентрация эквивалентов Трилона-Б, равная 0,01 н.
VH2O—объем исследуемой воды, взятой для анализа, мл
Анализ повторяют три раза.
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
«Определение общей жесткости воды»
1. Анализ проводят с помощью лаборатории_________
2. Исходные данные: а) для анализа взято исследуемой воды________ мл. б) СЭКВ(Тр) =0,01 н. 3. Ход анализа: 4 .В процессе определения получены следующие данные
| № определения | Объем раствора трилона-Б ( VТр , мл) | Общая жесткость ммоль/л | Среднее значение жесткости, ммоль/л |
Опыт 2. «Определениежесткости котловой воды с помощью экспресс лаборатории МАХIСRАD-T фирмы Аmeroid Магinе”
Оборудование и реактивы:
— Экспресс лаборатория МАХIСRАD-T,
— испытательные полоски для измерения жесткости,
— цветовая шкала для установления результатов опыта
Порядок выполнения работы:
Погрузите зеленый конец мягкой испытательной полоски в исследуемую воду, немедленно удалите, встряхните лишнюю воду. Через 15-20 сек. Сравните цвет полоски с цветовой шкалой Приблизительно оцените результат, если полученный цвет оказался между двумя цветовыми позициями.
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
“Определение жесткости котловой воды”
1. Анализ проводят с помощью лаборатории___
2. Исходные данные:
а) для анализа взято исследуемой воды _____мл.
б) бумага для определения жесткости
в) цветная шкала для снятия результатов.
З. Ход анализа.
4 . В процессе определения получены следующие данные.
5. Выводы по работе.
ЛАБОРАТОРНАЯ РАБОТА №2
«Определение щелочности котловой воды»
В котловой воде для предотвращения накипеобразования и подавлениякоррозионных процессов поддерживается некоторый избыток ионов гидроксила, обусловленный наличием растворенной щелочи и гидролизом солей
Nа2СО3 , Nа2РО4, и др.
Nа2СО3+Н2О ↔NaHСО3+NаОН
СО3 -2 +Н2O ↔HСО3 — +ОН —
Nа3РО4— Н2O↔Nа2НРО4+ NаОН
РO4 -3 +H2О ↔HРO4 -2 +ОН —
Суммарная концентрация находящихся в воде гидроксил , карбонат , фосфат
— ионов (табл 1), выраженная в ммоль/л определяет такой показатель качества воды, как общая щелочность (Що).
В переводе на эквивалентное количество NаОН по формуле ЩЧ = 40 Щ (мг/л), где 40 — значение ммоль/л NаОН, получают щелочное число (ЩЧ) (мг/л).
В зависимости от преимущественного содержания в воде ионов, обуславливающих щелочность, различают гидратную щелочность (Щг в ммоль/л), Щг = [ОН — ], карбонатную щелочность (Щк в ммоль/л), Щк = [СO3 -2 ], бикарбонатную (Щбк ммоль/л), Щбк = [НСО3 — ] .
По своему физическому смыслу бикарбонатная щелочность Щбк соответствует карбонатной жесткости Жк, Щбк = Жк.
При эксплуатации котельной установки щелочное число для котловой воды поддерживается в определенных для данного типа котлов пределах (табл 3). При заниженных значениях щелочности не обеспечивается безнакипный режим работы парогенератора, при завышенных возникает опасность щелочной коррозии, вызывающей интеркристаллитное разрушение металла. Корректируют щелочность по результатам анализа введением в котловую воду щелочей, карбонатов и фосфатов натрия, в зависимости от осуществляемого вводно-химического режима. Аналитическое определение щелочности проводят титрованием исследуемой пробы серной кислотой в присутствии индикаторов фенолфталеина и метилоранжа,
Щелочность по фенолфталеину (гидратная щелочность, РН выше 8,2-8,3) позволяет установить наличие ионов ОН — . Все оксиды, половина карбонатов, из фосфатов, все щелочеобразующие при гидролизе вещества (например, силикаты) включены в фенолфталеиновую (Р) щелочность.
В присутствии метилораижа определяется бикарбонатная щелочность (Щбк).
При условии, когда суммарная концентрация ионов Са2 и М8т2 превышает концентрацию нонов НСО3 — , бикарбонатная щелочность Щбк становится равной жесткости карбонатной Жк, а общая щелочность определяется по сумме щелочности гидратной и карбонатной.
Общая щелочность (РН выше 4,2-4,3). Все гидроксиды, все карбонаты, 2/3фосфатов включены в общую щелочность.
Правильный уровень щелочности гарантирует осаждение солей жесткости фосфатами; нейтрализацию кислого характера среды; пассивацию слоем магнетита; защиту от щелочной межкристаллической коррозии.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт 1 «Определение щелочности котловой воды с помощью лаборатории
СКЛАВ-1»
Оборудование к реактивы:
— Лаборатория СКЛАВ-1,
— серная кислота 0,Iн.
— фенолфталеин,
— метилоранж
Порядок выполнения работы:
Отбирают мензуркой 100 мл исследуемой котловой воды и переносят в коническую колбу, добавляя 2—З капли фенолфталеина, при наличии ионов ОН — вода окрасится в малиновый цвет. Установив стрелку трехходового крана на кислоту, грушей накачивают раствор в бюретку до нулевого деления. Затем осторожно, по каплям при перемешивании титруют анализируемый раствор серной кислотой до исчезновения окраски.
Отмечают объем кислоты, пошедшей на титрование V1. После этого вводят в исследуемый раствор 2—З капли метилоранжа, титруют кислотой до перехода окраски от желто-соломенного к оранжевой и фиксируют общий объем израсходованной серной кислоты V1. Анализ повторяют три раза.
Рассчитывают гидратную щелочность, карбонатную жесткость и общую щелочность на основании правила пропорциональности (см. расчет жесткости):
VH2O= 100 мл.
Щон = V1 ммоль/л
Жк = V2 — V1 ммоль/л
Щ= V2 ммоль/л
Щелочность котловой воды выражают также щелочным числом.
Щелочное число (мг/л) рассчитывают по общей щелочности в ммоль/л и умноженной на 40; для подсчета ЩЧ можно воспользоваться таблицей.
ПОДСЧЕТ ЩЕЛОЧНОГО ЧИСЛА ПО РЕЗУЛЬТАТАМ
ТИТРОВАНИЯ (ОБЪЕМ ПРОБЫ ТИТРУЕМОЙ ВОДЫ 1ОО мл)
| Целые числа мл титрованной кислоты | Десятичные доли миллиметров | ||||||||
| 0.0 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 |
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
«Определение щелочности котловой воды»
1. Анализ проводят с помощью лаборатории______
2. Исходные данные
а) для анализа взято исследуемой воды _____мл
б) СЭКВ(H2SO4) =0.1 н.
З. Ход анализа:
4. В процессе определения получены следующие данные
| № определения | Объем кислоты мл, пошедшей на титрование в присутствии индикаторов | Значение щелочности в ммоль/л | Среднее значение общей щелочности | Среднее значение щелочного числа мг/л | |
| Фенол-фталеин | Метил-оранжа | Фенол-фталеин+Метил-оранж | Гидрат-ной | Карбон-атной | общей |
Опыт №2. «Определение щелочности котловой воды с помощью лаборатории SРЕСТRАРАС 311 фирмы UNITOR»
Оборудование и реактивы.
• Лаборатория SРЕСТRАРАС 311,
• таблетки для определения Ф Щелочности,
• таблетки для определения М Щелочности (Т —total общая щелочность)
Порядок выполнения работы:
С начало проводится испытание на Ф Щелочность.
Отбирают 200 мл исследуемой котловой воды в бутылку с красной притертой пробкой. Опускают одну таблетку для определения Ф Щелочности, взбалтывают до полного растворения, если щелочность присутствует, то проба станет голубого цвета. Затем добавляют таблетки по одной (давая время таблетке растворится) до тех пор пока голубой цвет не изменится на устойчивый желтый.
Подсчитывают количество используемых таблеток и делают следующий расчет Ф Щелочность ррm (СаСО3)= (количество таблеток * 20)- 10
Например: 12 таблеток израсходовано для получения устойчивого желтого цвета. Результаты (12*20)-10 = 230 ррm СаСО3
Далее продолжают испытание на М Щелочность.
К пробе с Ф Щелочностью добавляют одну таблетку для определения М Щелочности, взбалтывают до растворения. Продолжают добавлять таблетки по одной (давая время таблетке раствориться) до тех пор, пока образец не станет устойчиво красно-розового цвета.
Подсчитывают количество использованных таблеток и проводят следующий расчет М щелочность или Т щелочность ррm СаСО3 = (количество Ф и М таблеток *20) — 10 Например: Если использовано 12 Ф и 5 М таблеток, то
М(Т) щелочность ((12 + 5)*20) — 10 = 330 ррm СаСО3
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
«Определение щелочности котловой воды»
1. Анализ проводят с помощью лаборатории ___________________
2. Исходные данные
а) для анализа взято исследуемой котловой воды_________ мл
З. Ход работы:
4. В процессе определения получены следующие данные
| Количество Ф таблеток, используемых в ходе работы | Количество М таблеток, используемых в ходе работы | Значение Ф щелочности | Значение М щелочности |
5. Выводы по работе
Примечание: М щелочность по Метилоранжу равна Т щелочности — Total или общая Щелочность.
ЛАБОРАТОРНАЯ РАБОТА №3
«Определение содержания хлоридов»
Растворенные в воде хлориды натрия NаСI, кальция СаСI2 магния МgСl2 являются важнейшим параметром качества используемой в парогенераторе воды (таблица 3) Известно, что СГ — ионы, разрушают на внутренних поверхностях котлоагрегата коррозионно-устойчивую окисную пленку и активизируют коррозионных процессы. являясь деполяризаторами электрохимической коррозии. В этой связи установлены нормы на допустимое содержание хлоридов в конденсате, дистилляте и котловой воде (таблица 3). Источником увеличения хлоридов в котловой воде является добавочная вода, в конденсат хлориды поступают через неплотности в соединениях конденсатора, охлаждаемого забортной морской водой. Вследствие того, что соотношение между содержанием хлор-ионов и солей в морской воде является примерно постоянным, контроль по хлоридам позволяет оценить общее засоление конденсата морской водой при нарушении герметичности конденсатора В случае, если содержание хлоридов в котловой воде превышает допустимые нормы, производится продувание котла, при этом частично удаляемая вода компенсируется питательной. Количество хлоридов оценивается по содержанию в воде нона С1 — в мг/л, хлорида натрия NаСI в мг/л или в градусах Брандта.
Для пересчета одних единиц изменения в другие можно воспользоваться соотношением:
1 0 Бр= 10 мг/л NаСl=6.06 мг/л или таблицами. Контроль за содержанием хлоридов осуществляется методами титрования и калориметрирования.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт №1. “Определение содержания хлоридов в котловой воде с помощью
лаборатории СКЛАВ-1”
Оборудование и реактивы:
• Лаборатория СКЛАВ-1,
° азотнокислое серебро AgNО3
• фенолфталеин, серная кислота,
• хромовокислыи калий К2СгО4,
• дистиллят.
Порядок вьтолнення работы:
Определение основано на реакции хлоридов с азотнокислотным серебром в присутствии индикатора (10% раствор хромата калия К2СгО4):
NaCl + AgNО3= АgCl↓ +NaNО3
После полного осаждения хлор-иона в виде хлорида серебра, нитрат серебра вступает в реакцию с индикатором, в результате образуется осадок кирпично-красного цвета по реакции.
К2СгО4+ 2AgNО3 = Аg2СгО4— 2 КNО3
желтый кирпично-красный
Из отобранной пробы котловой воды берут 100 мл, прибавляют 2—З капли фенолфталеина, которым окрашивают воду. Вмалиновый цвет, затем по каплям добавляют 0,1 н. серную кислоту до обесцвечивания пробы (что указывает на нейтрализацию воды).После этого к этой же пробе добавляют 10 капель раствора хромовокислого калия, хорошо размешивают и из бюретки осторожно по каплям приливают в колбу для титрования раствор азотнокислого серебра, все время интенсивно помешивания воду. Добавку раствора азотнокислого серебра ведут до тех пор, пока в воде не появится бурый оттенок Содержание хлоридов в воде в мл/хлор—ионов на литр воды численно равно количеству мл раствора азотно-кислого серебра, пошедшего на титрование 100 мл пробы; умноженному на 10
Примечание: Содержание хлоридов в котловой воде можно проверить в нейтрализованной воде после определения щелочного числа.
б)для дизельных судов.
Из отобранной пробы котловой водымерной пробиркой берут 10 мл и переливают в колбу для титрования, в которую затем добавляют 40 мл конденсата или дистиллята (для облегчения титрования в большом объеме воды). Разбавленную пробу котловой воды нейтрализуют. для этого сначала к ней прибавляют 2—З капли фенолфталеина, которые окрашивают воду в малиновый цвет, затем по каплям добавляют 0,1 н. серную кислоту до обесцвечивания пробы (что указывает на нейтрализацию воды). После этого к этой же пробе воды добавляют 10 капель раствора хромовокислого калия, хорошо размешивают и из бюретки (осторожно, по каплям), приливают в колбу раствор азотнокислого серебра, все время аккуратно перемешивая. добавку раствора азотнокислого серебра ведут до тех пор, пока не появится бурый опенок.
Содержание хлоридов в воде (в миллиграммах хлориона в 1 л воды) численно равно количеству миллилитров раствора азотнокислого серебра, пошедшего на титрование 10 мл пробы; умноженному на 100).
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
«Определение содержания хлоридов методом титрования»
1. Анализ проводят с помощью лаборатории_________
2. Исходные данные:
а) для анализа взято исследуемой воды________ мл. (конденсата котловой воды)
б) нормальность раствора (AgNО3) ________
З. Ход анализа:
4. В процессе определения получены следующие данные:
| № определения | Объем AgNО3пошедший на титрование | Содержание в мг/л Cl — | Содержание в мг/ г NaCl | Количество хлоридов в градусах Брандта |
Опыт №2. «Определение содержания хлоридов в котловой воде с помощью лаборатории DREW Ameroid Marine Chloride ZMP.”
— Экспресс лаборатория DREW Ameroid Marine Chloride ZMP,
— индикатор фенолфталеин, серная кислота,
— индикатор хромовокислый
—нитрат серебра
Порядок выполнения работы:
В стеклянную трубку — пробирку наливают 2 мл исследуемой котловой воды, добавляют З капли фенолфталеина Окраска образца в розовый цвет говорит о присутствии щелочности Затем нейтрализуем анализируемую воду добавляя серную кислоту по каплям, пока не исчезнет розовая окраска. Вводят в раствор 6 капель. Хромокислого калия, образец пожелтеет. Добавляют нитрат серебра по каплям, пока образец не станет оранжевым (капли считают) Производят расчеты:
капли нитрат серебра x 50 = ppm хлорида
Например 4 капли серебряного нитрата израсходовалось для достижения оранжевой окраски4x 50= 200 ppm Хлоридов
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
“Определение содержания хлоридов”
1.Анализ проводится с помощью лаборатории _________
2. Исходные данные
а) для анализа взято исследуемой воды______ мл
3. Ход анализа:
4. В процессе определения получены следующие данные
| Число капель серебряного нитрата | Содержание хлоридов (ppm) |
Опыт №3 “Определение содержания хлоридов в котловой воде с помощью экспресс лаборатории HACH chloride 7p.”
Оборудование и реактивы:
• экспресс лаборатория HACH chloride 7p,
• пластиковые подушечки индикатора chloride 2,
• нитрат серебра,
• дистилированая вода
Порядок выполнения работы
Пластмассовую мензурку наполняют исследуемой котловой водой и переносят образец в специальную бутылочку Прибавляют дистилированую воду до объема 15 мл. С помощью ножниц вскрывают подушечку с индикатором, пересыпают в бутылочку о разбавленной котловой водой и тщательно перемешивают. Исследуемая вода желтеет. Затем по капле добавляют раствор нитрата серебра, бутылочку с пробой постоянно, считая капли, пока испытуемый раствор не изменит цвет с желтого на красно-коричневый (одна пипетка, заполненная до отметки, 1,0 мл равна 15 каплям)
Производят расчет каплих x 30 содержание хлоридов (ррm)
Например: для достижения красно-коричневой окраски, использовано 4 капли нитрат серебра 4 х 30=120 ррm Cl или 4 х 50=200 ррm NaСl
Содержание хлоридов равно 120 ррm Сl или 200 ррm NаСI.
ПРОТОКОЛ ЛАБОРАТОРИЙ РАБОТЫ
“Определение содержания хлоридов”
1. Анализ проводят с помощью лаборатории _______
2. Исходные данные
а) для анализа взято исследуемой котловой воды__________ мл
3. Ход работы
4. В процессе определения получены следующие данные
| Количество капель нитрата серебра | Содержание хлоридов |
| ррm Cl | ррm NаСI |
ЛАБОРАТОРНАЯ РАБОТА 4
«Определение фосфатного числа»
Основным реагентом внутрикотловой химической обработки воды — фосфатнонитратным, фосфатно-щелочным, фосфатно-коррекционным методами является Nа3Р04 тринатрий фосфат. Функциональное назначение фосфат-нона РО3заключается в связывании ионов жесткости и переводе их в малорастворимые соединения. Последние удаляются из котла периодическими продувками и, таким образом, поддерживается безнакипный режим работы котла. Не исключена для РО4 -3 нона и функция пассивирующего агента, что препятствует протеканию коррозии котлового оборудования.
Реакция взаимодействия кальциевых солей с тринатрийфосфатом идет следующим образом
б Nа3РO4+ 10Са СОз +2NаОН →Са10(Р04)6 (ОН) 2 + 10 NаСО3
где Са10(Р04)6 (ОН) 2 — гидроксилапатит, который представляет собой легкоподвижный шлам, практически нерастворимый в воде. Реакция идет только в сильной щелочной среде при РН>9,0. В нейтральной и кислой средах реакция идет в сторону образования фосфатной накипи
2 Nа3РO4 + 3 СаСО3 → Са3(РО4)2 + 3Nа2СО3
Таким образом, для обеспечения безнакипного режима в соответствии с нормами качества котловой воды (табл 1) следует поддерживать избыток фосфат-ионов и щелочности.
Но при высокой щелочности котловой воды (РН >10) магниевая жесткость выделяется из воды в виде гидроокисного шлама, образующего вторичные накипи
МgСО + 2NаОН→Мg(ОН)2 + Nа2СОз
Водные растворы тринатрийфосфата имеют щелочную реакцию
Nа3РO4+ Н2О →Nа2HРО4 +NаОН
Однако степень гидролиза Nа3РO4сильно зависит от температуры. При давлении в котле менее 1,6 МПа степень гидролиза невысока и в котловую воду следует вводить дополнительную щелочь в виде соды Nа2СОз
Nа2СО3 + Н2О →NаНСО3 + NаОН
При давлениях более 1,6 МПа гидролиз тринатрийфосфата обеспечивает щелочную среду, достаточную для перевода ионов Са +2 в пилам. Поэтому при давлениях более 1,6 МПа соду в котлы вводить не следует и при наличии солей жесткости в питательной воде требуется защита металла от щелочной коррозии.
На судах отечественной постройки для котлов всех типов с давлением от 1,6 МПа до 6,0 МПа рекомендуется фосфатно-нитратный режим.
При давлениях более 6,0 МПа обработку котловой воды следует вести без образования избыточной щелочности. Такой водный режим называется фосфатнокоррекционным и суть его заключается в том, что для предотвращения накипеобразования в котлы вместе с Nа3РO4вводят кислый Nа2HРО4.При этом нормированной щелочности котловой воды добиваются комбинацией относительных масс вышеназванных фосфатных солей
Nа3РO4+ Н2О ↔ Nа3HРО4 + NаОН
При осуществлении фофатно-коррекционного водного режима котлов фосфатное число котловой воды (Ф Ч) и щелочное число по индикатору фенолфталеину (Щ Ч) должны находиться в соотношении: Щ. Ч. = 0,42Ф. Ч.
Фосфатный режим, при котором соблюдается это соотношение, называется также режимом чистофосфатной щелочности.
0,42 — коэффициент, равный отношению молярных масс NаОН / РО4 -3 = 40/90=0,42.
Это соотношение исключает наличие свободной щелочи, т е предупреждает появление межкристаллической коррозии и обеспечивает безнакипный режим котлов.
Практически приемлемым для осуществления режима чистофосфатной щелочности является соотношение 9 6 (28.5 Ж П.В. +φ[РО4 -3 ] К.В. ) кг /сутки,
где Д— паропроизводительность котла, кг/час
С = 0,25— концентрация иона РО3в техническом тринатрийфосфате;
Ж П.В. — жесткость питательной воды, ммоль/л;
φ — коэффициент продувки котла,
[РО4 -3 ] К.В — нормированная концентрация фосфат-иона в котловой воде, мг/л,
которую определяют по формам качества котловой воды (таблица З).
Следует отметить, что значительный избыток фосфатов совместно с окислыми соединениями железа и меди вызывает появление железо—фосфатных накипей, способствующих развитию подшламовой коррозии.
Содержание фосфатов — фосфатное число (Ф Ч) оценивается либо количеством РО4 -3 иона в мг./л, либо оксидом Р2О5мг/л
Пересчет этих форм произведен в таблицах 8,9.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт№1. « Определениефосфатов в котловой воде с помощью экспресс-лаборатории
СКЛАВ-1”
Оборудование и реактивы:
• Лаборатория СКЛАВ-1.
• реактив на фосфаты,
• кювета;
• компаратор,
• сульфомолибденовый раствор, см .табл.
Порядок выполнения работы:
Определение содержания фосфатов в котловой воде основано на образовании растворимого соединения состава Р2О5 *V2О5* MоО3 * nН2О,окрашенного в интенсивно желтый цвет. Содержание фосфатов измеряется в компараторе путем сравнения окрасок испытуемой’ пробы и эталонных пленок. Набор эталонных пленок имеет окраску, соответствующую 10, 20 ЗО и 40 мг/л ионов фосфатов.
Отмерив в две градуированные пробирки по 10 мл котловой воды, добавляют по 2 мл реактива на фосфаты в каждую и содержимое пробирки тщательно перемешивают.
Через 10 минут раствор переливают поочередно в кювету 5, вставляют ее в паз компаратора 4, а в левом пазу последовательно поднимают стандартные пленки желтого цвета до тех пор, пока окраска их не сравняется с окраской испытуемой пробы. Если цвет пробы гуще цвета пленки, соответствующей содержанию РО? = 5Омг / л, пробу разбавляют в 2—4 раза, соответственно увеличив и результат анализаю Анализ повторяют три раза
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
«Определение фосфатногочисла”
1. Анализ проводят с помощью лаборатории _______
2. Исходные данные
а) для анализа взято исследуемой воды__________ мл
3. Ход анализа:
4. В процессе определения получены следующие данные
| № определения | Содержания фосфатов, мг/л | Среднее значение фосфатного числа |
| 1. |
Опыт № 2: “Определение фосфатов в котловой воде с помощью экспресс лаборатории Spectrapak 311 фирмы UNIOR”
Оборудование и реактивы:
· Экспресс лаборатория Spectrapak 311;
· таблетка для определения фосфатов,
· диск с цветными пленками для определения фосфатов;
· цилиндрические пробирки (10мл) с крышками.
Порядок выполнения работы:
Диск с цветными эталонными пленками для определения фосфатов вставляют в компаратор Набор пленок имеет окраску, соответствующую 10; 20; 30; 40 и т.д. 100 ppm фосфатов. Заполняют исследуемой котловой водой две пробирки до отметки 10 мл . Одну пробирку вставляют в левое отделение компаратора В другую опускают одну таблетку для определения фосфатов, взбалтывают и перемешивают до полного растворения Через 10 мин помещают пробирку в правое отделение компаратора Направляют компаратор на свет и вращают диск до совпадения цвета. Записывают результат.
ПРОТОКОЛ ЛАБОРАТОРНОЙ РАБОТЫ
«Определение фосфатов в котловой воде»
1. Анализ проводят с помощью лаборатории
2. Исходные данные
а) для анализа взято исследуемой воды мл
З. Ход анализа.
4. В процессе определения получены следующие данные
5. Выводы по работе
источник