ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Методы измерения массовой концентрации
Methods for determination
Настоящий стандарт распространяется на питьевую воду и устанавливает колориметрические методы измерения массовой концентрации общего железа.
1.1. Пробы воды отбирают по ГОСТ 2874 и ГОСТ 24481.
1.2. Объем пробы воды для измерения массовой концентрации железа должен быть не менее 200 см 3 .
1.3. Способы консервирования, сроки и условия хранения проб воды, предназначенных для измерения массовой концентрации общего железа, — по ГОСТ 24481.
(Измененная редакция, Изм. № 2).
Метод основан на взаимодействии ионов железа в щелочной среде с сульфосалициловой кислотой с образованием окрашенного в желтый цвет комплексного соединения. Интенсивность окраски, пропорциональную массовой концентрации железа, измеряют при длине волны 400-430 нм. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,10-2,00 мг/дм 3 . В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм 3 .
Фотоколориметр любого типа с фиолетовым светофильтром ( 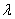
Кюветы с толщиной рабочего слоя 2-5 см.
Весы аналитические лабораторные, класс точности 1, 2 по ГОСТ 24104.
Колбы мерные 2-го класса, вместимостью 50, 100, 1000 см 3 по ГОСТ 1770.
Пипетки мерные без делений вместимостью 50 см 3 и пипетки мерные с ценой наименьшего деления 0,1-0,05 см 3 , вместимостью 1, 5 и 10 см 3 2-го класса по нормативно-техническому документу.
Колбы стеклянные лабораторные конические номинальной вместимостью 100 см 3 , типа Кн по ГОСТ 25336.
Аммоний хлористый по ГОСТ 3773.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота соляная по ГОСТ 3118.
Кислота сульфосалициловая по ГОСТ 4478.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч.д.а).
2.3.1. Приготовление основного стандартного раствора железо-аммонийных квасцов
0,8636 г железоаммонийных квасцов FeNH 4 ( SO 4 )2 × 12 H 2 O взвешивают с точностью, не превышающей 0,0002 г по шкале весов, растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды, добавляют 2,00 см 3 соляной кислоты плотностью 1,19 г/см 3 и доводят до метки дистиллированной водой. 1 см 3 раствора содержит 0.1 мг железа.
Срок и условия хранения раствора — по ГОСТ 4212.
2.3.2. Приготовление рабочего стандартного раствора железоаммонийных квасцов
Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 20 раз. 1 см 3 раствора содержит 0,005 мг железа.
2.3.3. Приготовление раствора сульфосалициловой кислоты
20 г сульфосалициловой кислоты растворяют в мерной колбе вместимостью 100 см 3 в небольшом количестве дистиллированной воды и доводят этой водой до метки.
2.3.4. Приготовление раствора хлористого аммония молярной концентрации 2 моль/дм 3
107 г NH 4 Cl растворяют в мерной колбе вместимостью 1 дм 3 в небольшом количестве дистиллированной воды и доводят этой водой до метки.
2.3.5. Приготовление раствора аммиака (1:1)
100 см 3 25 %-ного раствора аммиака приливают к 100 см 3 дистиллированной воды и перемешивают.
При массовой концентрации общего железа не более 2,00 мг/дм 3 отбирают 50 см 3 исследуемой воды (при большей массовой концентрации железа пробу разбавляют дистиллированной водой) и помещают в коническую колбу вместимостью 100 см 3 . Если проба при отборе не консервировалась кислотой, то к 50 см 3 добавляют 0,20 см 3 соляной кислоты плотностью 1,19 г/см 3 . Пробу воды нагревают до кипения и упаривают до объема 35-40 см 3 . Раствор охлаждают до комнатной температуры, переносят в мерную колбу вместимостью 50 см 3 , ополаскивают 2-3 раза по 1 см 3 дистиллированной водой, сливая эти порции в ту же мерную колбу. Затем к полученному раствору прибавляют 1,00 см 3 хлористого аммония, 1,00 см 3 сульфосалициловой кислоты, 1,00 см 3 раствора аммиака (1:1), тщательно перемешивая после добавления каждого реактива. По индикаторной бумаге определяют значение рН раствора, которое должно быть 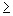
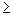
Объем раствора в мерной колбе доводят до метки дистиллированной водой, оставляют стоять 5 мин для развития окраски. Измеряют оптическую плотность окрашенных растворов, используя фиолетовый светофильтр ( 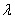
Для построения градуировочного графика в ряд мерных колб вместимостью 50 см 3 наливают 0,0; 1,0; 2,0; 5,0. 10,0; 15,0; 20,0 см 3 рабочего стандартного раствора, доводят до метки дистиллированной водой, перемешивают и анализируют, как исследуемую воду. Получают шкалу растворов, соответствующих массовым концентрациям железа 0,0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0 мг/дм 3 .
Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию железа, а по оси ординат — соответствующие значения оптической плотности. Построение градуировочного графика повторяют для каждой партии реактивов и не реже одного раза в квартал.
Массовую концентрацию железа (X) в анализируемой пробе, мг/дм 3 с учетом разбавления вычисляют по формуле
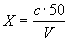
где с — концентрация железа, найденная по градуировочному графику, мг/дм 3 ;
V — объем воды, взятый для анализа, см 3 ;
50 — объем, до которого разбавлена проба, см 3 .
За окончательный результат анализа принимают среднее арифметическое результатов двух параллельных измерений, допустимое расхождение между которыми не должно превышать 25 % при массовой концентрации железа на уровне предельно допустимой. Результат округляют до двух значащих цифр.
Сходимость результатов анализа ( А) в процентах вычисляют по формуле
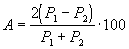
где Р1 — больший результат из двух параллельных измерений;
Р 2 — меньший результат из двух параллельных измерений.
Разд. 2. (Измененная редакция, Изм. № 2).
Метод основан на реакции ортофенантролина с ионами двухвалентного железа в области рН 3-9 с образованием комплексного соединения, окрашенного в оранжево-красный цвет. Интенсивность окраски пропорциональна концентрации железа. Восстановление железа до двухвалентного проводится в кислой среде гидроксиламином. Окраска развивается быстро при рН 3,0-3,5 в присутствии избытка фенантролина и устойчива в течение нескольких дней. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,05-2,0 мг/дм 3 . В этом интервале суммарная погрешность измерения с вероятностью Р = 0,95 находится в пределах 0,01-0,02 мг/дм 3 .
(Измененная редакция, Изм. № 2).
3.2. Аппаратура, материалы и реактивы
Фотоэлектроколориметр различных марок.
Кюветы с толщиной рабочего слоя 2-5 см.
Колбы мерные 2-го класса точности по ГОСТ 1770, вместимостью 50 и 1000 см 3 .
Пипетки мерные без делений, вместимостью 10, 25 и 50 см 3 и пипетки мерные с делениями 0,1-0,01 см 3 вместимостью 1, 2 и 5 см 3 2-го класса точности по нормативно-техническому документу.
Колбы плоскодонные по ГОСТ 25336, вместимостью 150-200 см 3 .
Аммоний уксуснокислый по ГОСТ 3117.
Гидроксиламин солянокислый по ГОСТ 5456.
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота соляная по ГОСТ 3118.
Кислота уксусная по ГОСТ 61.
Вода дистиллированная по ГОСТ 6709.
Аммиак водный по ГОСТ 3760, 25 %-ный раствор.
Все реактивы, используемые для анализа, должны быть квалификации чистые для анализа (ч. д. а.).
3.3.1. Приготовление раствора ортофенантролина
0,1 г моногидрата ортофенантролина ( C 12 Н8 N 2 × H 2 O ), взвешенного с погрешностью не более 0,01 г, растворяют в 100 см 3 дистиллированной воды, подкисленной 2-3 каплями концентрированной соляной кислоты. Реактив сохраняют на холоде в темной склянке с притертой пробкой. 1 см 3 этого реактива связывает в комплекс 0,1 мг железа.
3.3.2. Приготовление 10%-ного раствора солянокислого гидроксиламина
10 г солянокислого гидроксиламина ( NH 2 OH × HCl ), взвешенного с погрешностью не более 0,1 г, растворяют в дистиллированной воде и доводят объем до 100 см 3 .
3.3.3. Приготовление буферного раствора
250 г уксуснокислого аммония ( N Н4С2Н3 O 2 ), взвешенного с погрешностью не более 0,1 г, растворяют в 150 см 3 дистиллированной воды. Добавляют 70 см 3 уксусной кислоты и доводят объем до 1 дм 3 дистиллированной водой.
(Измененная редакция, Изм. № 2).
3.3.4. Приготовление основного стандартного раствора железоаммонийных квасцов — по п. 2.3.1.
3.3.5. Приготовление рабочего стандартного раствора железоаммонийных квасцов — по п. 2.3.2.
3.3.4; 3.3.5. (Измененная редакция, Изм. № 2).
Определению мешают цианиды, нитриты, полифосфаты; хром и цинк в концентрации, превышающей в 10 раз массовую концентрацию железа; кобальт и медь в концентрации более 5 мг/дм 3 и никель в концентрации 2 мг/дм 3 . Предварительное кипячение воды с кислотой превращает полифосфаты в ортофосфаты, добавлением гидроксиламина устраняется мешающее влияние окислителей. Мешающее влияние меди уменьшается при рН 2,5-4.
При отсутствии полифосфатов исследуемую воду тщательно перемешивают и отбирают 25 см 3 (или меньший объем, содержащий не более 0,1 мг железа, разбавленный, до 25 см 3 дистиллированной водой) в мерную колбу вместимостью 50 см 3 . Если при отборе пробы вода была подкислена, то ее нейтрализуют 25 %-ным раствором аммиака до рН 4-5, контролируя потенциометрически или по индикаторной бумаге. Затем добавляют 1 см 3 солянокислого раствора гидроксиламина, 2,00 см 3 ацетатного буферного раствора и 1 см 3 раствора ортофенантролина. После прибавления каждого реактива раствор перемешивают, затем доводят объем до 50 см 3 дистиллированной водой, тщательно перемешивают и оставляют на 15-20 мин для полного развития окраски.
Окрашенный раствор фотометрируют при сине-зеленом светофильтре ( 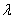
Массовую концентрацию железа находят по градуировочному графику.
В присутствии полифосфатов 25 см 3 исследуемой пробы помещают в плоскодонную колбу вместимостью 100-150 см 3 , прибавляют 1 см 3 концентрированной соляной кислоты, нагревают до кипения и упаривают до объема 15-20 см 3 . После охлаждения раствора его переносят в мерную колбу вместимостью 50 см 3 , добавляют дистиллированную воду до объема примерно 25 см 3 и доводят 25 %-ным раствором аммиака до рН 4-5, контролируя потенциометрически или по индикаторной бумаге.
Далее прибавляют реактивы и проводят анализ, как указано выше (при отсутствии полифосфатов).
Для построения градуировочного графика в мерные колбы вместимостью 50 см 3 вносят 0,0; 0,5; 1,0; 2,0; 3.0; 4,0; 5,0; 10,0; 20,0 см 3 рабочего стандартного раствора, содержащего в 1 см 3 0,005 мг железа, доводят объем дистиллированной водой приблизительно до 25 см 3 и анализируют так же, как и исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 1,0 и 2,0 мг/дм 3 . Фотометрируют в тех же условиях, что и пробу. Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию общего железа в мг/дм 3 а на оси ординат — соответствующие значения оптической плотности.
(Измененная редакция, Изм. № 2).
3.5. Массовую концентрацию общего железа вычисляют по п. 2.5.
(Измененная редакция, Изм. № 2).
Метод основан на взаимодействии ионов двухвалентного железа с 2,2-дипиридилом в области рН 3,5-8,5 с образованием окрашенного в красный цвет комплексного соединения. Интенсивность окраски пропорциональна массовой концентрации железа. Восстановление трехвалентного железа до двухвалентного проводится гидроксиламином. Окраска развивается быстро и устойчива в течение нескольких дней. Диапазон измерения массовой концентрации общего железа без разбавления пробы 0,05-2,00 мг/дм 3 .
В этом интервале суммарная погрешность измерения с вероятностью Р=0,95 находится в пределах 0,01-0,03 мг/дм 3 .
(Измененная редакция, Изм. № 2).
4.2. Аппаратура, материалы, реактивы
Фотоэлектроколориметр любой марки.
Кюветы с толщиной оптического слоя 2-5 см.
Колбы мерные 2-го класса точности по ГОСТ 1770, вместимостью 50, 100 и 1000 см 3 .
Пипетки мерные без делений, вместимостью 25 см 3 н пипетки мерные с делениями 0,1-0,01 см 3 , вместимостью 1, 5 и 10 см 3 2-го класса точности по нормативно-техническому документу.
Аммоний уксуснокислый по ГОСТ 3117.
Гидроксиламин солянокислый по ГОСТ 5456.
2,2-дипиридил ( 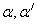
Квасцы железоаммонийные по нормативно-техническому документу.
Кислота уксусная по ГОСТ 61.
Спирт этиловый ректификованный по ГОСТ 18300, высшего сорта.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч. д. а.).
(Измененная редакция, Изм. № 2).
4.3.1. Приготовление основного стандартного раствора железоаммонийных квасцов — по п. 2.3.1.
4.3.2. Приготовление рабочего стандартного раствора железоаммонийных квасцов — по п. 2.3.2.
4.3.1; 4.3.2. (Измененная редакция, Изм. № 2).
4.3.3. Приготовление 10 %-ного раствора солянокислого гидроксиламина — по п. 3.3.2.
4.3.4. Приготовление ацетатного буферного раствора — по п. 3.3.3.
4.3.5. Приготовление 0,1 %-ного раствора 2,2-дипиридила.
0,1 г 2,2-дипиридила, взвешенного с погрешностью не более 0,01 г, растворяют в 5,00 см 3 этилового спирта и разбавляют в 100 см 3 дистиллированной воды.
Для определения массовой концентрации общего железа исследуемую воду тщательно перемешивают и отбирают 25 см 3 (или меньший объем, содержащий не более 0,1 мг железа) в мерную колбу вместимостью 50 см 3 . Прибавляют 1 см 3 раствора гидроксиламина солянокислого, 2,00 см 3 ацетатного буферного раствора, 1,00 см 3 раствора 2,2-дипириднла и доводят до метки дистиллированной водой. После добавления каждого реактива содержимое колбы перемешивают. Раствор оставляют на 15-20 мин для полного развития окраски. Окрашенный раствор фотометрируют, применяя зеленый светофильтр ( 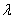
Массовую концентрацию железа находят по градуировочному графику.
Для построения градуировочного графика в мерные колбы вместимостью 50 см 3 вносят 0,0; 2,0; 5,0; 10,0; 15,0; 20,0 см 3 рабочего стандартного раствора железоаммонийных квасцов. Добавляют дистиллированной воды до объема примерно 25 см 3 . Далее растворы проводят через весь ход анализа так же, как исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,2; 0,5; 1,0; 1,5; 2,0 мг/дм 3 . Оптическую плотность измеряют в тех же условиях, что и пробы. Строят градуировочный график, откладывая по оси абсцисс массовую концентрацию железа в мг/дм 3 , а по оси ординат — соответствующие значения оптической плотности.
Массовую концентрацию общего железа вычисляют по п. 2.5.
4.3.5; 4.4; 4.5. (Измененная редакция, Изм. № 2).
1. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 09.10.72 № 1855
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
источник
Настоящий документ устанавливает методику измерений общего железа в питьевых, поверхностных и сточных водах фотометрическим методом с сульфосалициловой кислотой.
Диапазон измерений от 0,05 до 10 мг/дм 3 без разбавления и концентрирования пробы.
Если массовая концентрация железа общего в анализируемой пробе превышает 10,0 мг/дм 3 , необходимо разбавлять пробу таким образом, чтобы массовая концентрация железа общего соответствовала регламентированному диапазону.
Если массовая концентрация железа общего в анализируемой пробе ниже 0,1 мг/дм 3 , пробу необходимо концентрировать путем упаривания.
Мешающие влияния, обусловленные присутствием в пробе органических веществ, нитритов, полифосфатов и др. устраняется специальной подготовкой пробы (см. п. 9.1).
При наличии в анализируемой пробе ионов хрома и цинка в количествах, превышающих в 10 раз концентрацию железа общего; меди и кобальта при массовых концентрациях, превышающих 2,0 мг/дм 3 , следует использовать другую методику.
Значения показателя точности измерений 1 — расширенной относительной неопределенности измерений по настоящей методике при коэффициенте охвата 2 приведены в таблице 1. Бюджет неопределенности измерений приведен в Приложении А.
1 В соответствии с ГОСТ Р 8.563-2009 (п. 3.4) в качестве показателя точности измерений использованы показатели неопределенности измерений).
Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке качества проведения испытаний в лаборатории;
— оценке возможности использования настоящей методики в конкретной лаборатории.
Таблица 1 — Диапазон измерений, показатели неопределенности измерений
Суммарная стандартная относительная неопределенность, и, %
Расширенная относительная неопределенность 2 , U при коэффициенте охвата k = 2, %
2 Соответствует характеристике погрешности при доверительной вероятности Р = 0,95.
При выполнении измерений должны быть применены следующие средства измерений, оборудование и материалы:
3.1 Средства измерений, вспомогательное оборудование
Спектрофотометр или фотоэлектроколориметр, позволяющий измерять оптическую плотность при длине волны l = 425 и l = 500 нм.
Кюветы с толщиной поглощающего слоя 10 и 50 мм.
Весы лабораторные специального класса точности с ценой деления не более 0,1 мг, наибольшим пределом взвешивания не более 210 г по ГОСТ Р 53228-2008.
Плитка электрическая лабораторная с регулятором температуры и закрытой спиралью по ГОСТ 14919-83.
Сушильный шкаф электрический.
Государственные стандартные образцы (ГСО) состава раствора ионов железа с массовой концентрацией 1 мг/дм 3 . Относительная погрешность аттестованных значений массовой концентрации не более 1 % при Р = 0,95.
1 Допускается использование других средств измерений утвержденных типов, обеспечивающих измерения с установленной точностью.
2 Допускается использование другого оборудования с метрологическими и техническими характеристиками, аналогичными указанным.
3 Средства измерений должны быть поверены в установленные сроки.
Колбы мерные 2-(2)-25 (50, 100, 1000)-2, ГОСТ 1770-74.
Бутыли из стекла или полиэтилена с притертыми или винтовыми пробками вместимостью 250 — 500 см 3 для отбора и хранения проб.
1 Допускается использование других средств измерений, вспомогательного оборудования, посуды и материалов с метрологическими и техническими характеристиками не хуже указанных.
2 Средства измерений должны быть поверены в установленные сроки.
Бумага индикаторная универсальная, ТУ 6-09-1181-89.
1 Все реактивы, используемые для измерений, должны быть квалификации ч.д.а. или х.ч.
2 Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных.
Фотометрический метод определения массовой концентрации общего железа основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа ( III ) (красное окрашивание), а в слабощелочной среде — с солями железа (II) и железа (III) (желтое окрашивание).
Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны l = 425 нм, для железа (III) — при длине волны l = 500 нм.
При выполнении измерений необходимо соблюдать следующие требования техники безопасности.
5.1 При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76.
5.2 Электробезопасность при работе с электроустановками по ГОСТ Р 12.1.019-2009.
5.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
5.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5.5 Содержание вредных веществ в воздухе не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
Выполнение измерений может производить химик-аналитик, владеющий техникой фотометрического анализа, изучивший инструкцию по эксплуатации спектрофотометра или фотоэлектроколориметра и получивший удовлетворительные результаты при выполнении контроля процедуры измерений.
Измерения проводятся в следующих условиях: температура окружающего воздуха (20 ± 5) ° С; атмосферное давление (84,0 — 106,7) кПа (630 — 800 мм рт.ст); относительная влажность не более 80 % при t = 25 °C; напряжение сети (220 ± 22) В; частота переменного тока (50 ± 1) Гц.
При подготовке к выполнению измерений должны быть проведены следующие работы: подготовка посуды для отбора проб, отбор проб, подготовка прибора к работе, приготовление вспомогательных и градуировочных растворов, установление и контроль стабильности градуировочной характеристики.
8.1 Подготовка посуды для отбора проб
Бутыли для отбора и хранения проб воды обезжиривают раствором CMC, промывают водопроводной водой, хромовой смесью, опять водопроводной водой, а затем 3 — 4 раза дистиллированной водой.
8 .2.1 Отбор проб питьевых вод производится в соответствии с требованиями ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб».
Отбор проб поверхностных и сточных вод производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб», ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
8 .2.2 Пробы воды отбирают в бутыли из полимерного материала или стекла, предварительно ополоснутые отбираемой водой. Объем отбираемой пробы должен быть не менее 250 см 3 .
8 .2.3 Если анализ выполняется в течение суток, пробу отбирают не консервируя. При невозможности выполнения измерений в указанные сроки пробу консервируют одним из следующих способов:
— если необходимо определять сумму растворенной и нерастворенной форм железа, к пробе добавляют 2 см 3 концентрированной соляной кислоты или 2,5 см 3 концентрированной азотной кислоты на каждые 100 см 3 пробы;
— если необходимо определять железо растворенное, то отобранную пробу сразу фильтруют через мембранный фильтр (0,35 — 0,45 мкм), поместив в приемную колбу 1 см 3 концентрированной соляной кислоты на каждые 100 см 3 пробы.
8 .2.4 При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указываются:
цель анализа, предполагаемые загрязнители;
должность, фамилия отбирающего пробу, дата.
Подготовку спектрофотометра или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
8.4 Приготовление растворов
20,0 г сульфосалициловой кислоты помещают в колбу и растворяют в 80 см 3 дистиллированной воды.
Смешивают равные части концентрированного аммиака и дистиллированной воды.
Навеску хлорида аммония (107 г) помещают в мерную колбу вместимостью 1000 см 3 , растворяют в дистиллированной воде и доводят до метки дистиллированной водой.
3 Приготовление градуировочных растворов из соли железа приведено в Приложении Б.
Раствор готовят в соответствии с прилагаемой к образцу инструкцией. 1 дм 3 раствора должен содержать 100 мг железа.
Срок хранения — один месяц.
Рабочий раствор готовят в день проведения измерений путем разбавлением основного раствора в 10 раз дистиллированной водой в мерной колбе. Раствор готовят в день проведения измерений.
8.5 Построение градуировочных графиков
Для построения градуировочных графиков необходимо приготовить образцы для градуировки с массовой концентрацией железа общего от 0,1 до 10,0 мг/дм 3 . Условия измерений и ход проведения анализа должны соответствовать п.п. 7 и 9.
Состав и количество образцов для построения градуировочных графиков приведены в таблице 2. Неопределенность, обусловленная процедурой приготовления образцов для градуировки, не превышает 2,5 %.
Таблица 2 — Состав и количество образцов для градуировки
Массовая концентрация ионов железа в градуировочных растворах в мг/дм 3
Аликвотная часть раствора (см 3 ), помещаемая в мерную колбу вместимостью 100 см 3
Рабочий градуировочный раствор с концентрацией 10 мг/дм 3 (градуировочный график 1, кювета 50 мм)
Основной градуировочный раствор с концентрацией 100 мг/дм 3 (градуировочный график 2, кювета 10 мм)
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных.
При построении градуировочного графика по оси ординат откладывают значения оптической плотности, а по оси абсцисс — величину концентрации вещества в мг/дм 3 .
Контроль стабильности градуировочной характеристики проводят не реже одного раза в квартал, а также при смене партий реактивов, после поверки или ремонта прибора. Средствами контроля являются вновь приготовленные образцы для градуировки (не менее 3 образцов из приведенных в п. 8.6).
Градуировочную характеристику считают стабильной при выполнении для каждого образца для градуировки следующего условия:
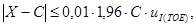
где X — результат контрольного измерения массовой концентрации железа в образце для градуировки;
С — аттестованное значение массовой концентрации железа;
u I(TOE) — стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности, %.
Значения u I(TOE) приведены в Приложении А.
Если условие стабильности градуировочной характеристики не выполняется только для одного образца для градуировки, необходимо выполнить повторное измерение этого образца с целью исключения результата, содержащего грубую погрешность.
Если градуировочная характеристика нестабильна, выясняют причины и повторяют контроль с использованием других образцов для градуировки, предусмотренных методикой. При повторном обнаружении нестабильности градуировочной характеристики строят новый градуировочный график.
9.1.1 Измерению массовой концентрации железа с применением раствора сульфосалициловой кислоты мешает собственная окраска пробы. Если окраска пробы сохраняется после проведения пробоподготовки (п. 9.1.2), то окрашенную пробу обрабатывают по п. 9.2, но без добавления сульфосалициловой кислоты. Измеряют оптическую плотность и найденную величину вычитают из полученного результата.
9 .1.2 Для устранения мешающего влияния органических веществ пробу озоляют. При озолении пробы, в стакан из термостойкого стекла вместимостью 100 см 3 помещают аликвоту пробы в зависимости от содержания в ней железа (0,1 — 10,0 мг/дм 3 ). Последовательно прибавляют 2,0 и 5,0 см 3 концентрированной серной и азотной кислоты соответственно, накрывают часовым стеклом и кипятят смесь в вытяжном шкафу до появления густого белого дыма, после чего нагревание прекращают. Раствор охлаждают до комнатной температуры, разбавляют дистиллированной водой и нагревают до кипения для растворения труднорастворимых солей, фильтруют (в случае необходимости), переносят в мерную колбу вместимостью 100 см 3 и проводят измерения по п.п. 9.2 , 9.1 .
Если в обработке пробы по п. 9.1.2 нет необходимости, то к отобранному объему (100 см 3 и менее) добавляют 0,5 см 3 концентрированной азотной кислоты и упаривают раствор до 1 /3 объема.
Полученный раствор с концентрацией железа от 0,1 до 10,0 мг/дм 3 фильтруют через фильтр «белая лента» в мерную колбу вместимостью 100 см 3 , приливают 2,0 см 3 аммония хлористого (п. 8.4.3), 2,0 см 3 сульфосалициловой кислоты (п. 8.4.1), 2,0 см 3 аммиака (п. 8.4.2), рН раствора должен составлять 7 — 8 (по индикаторной бумаге). Доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 минут до развития окраски. Оптическую плотность полученного раствора измеряют при длине волны l = 425 нм в кювете с длиной поглощающего слоя 50 или 10 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход анализа. По градуировочному графику находят содержание железа общего.
9.3 Определение железа (III)
Определение можно проводить только в тех случаях, когда пробу не обрабатывали с целью разрушения органических компонентов, не кипятили и не консервировали, т.к. при этом железо (II) окисляется до железа (III).
Пробу объемом 80,0 см 3 и менее, в зависимости от концентрации, помещают в мерную колбу вместимостью 100 см 3 , нейтрализуют раствором аммиака или соляной кислоты до рН 3 — 5 по индикаторной бумаге, прибавляют 2 см 3 сульфосалициловой кислоты (п. 8.4.1), доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 мин до полного развития окраски.
Оптическую плотность полученного раствора измеряют при длине волны l = 500 нм в кювете с длиной поглощающего слоя 10 или 50 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход измерений. По градуировочному графику находят массовую концентрацию железа общего.
Массовую концентрацию железа рассчитывают по формуле:
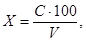
где X — массовая концентрация железа в анализируемой пробе, мг/дм 3 ;
С — массовая концентрация железа, найденная по градуировочному графику, мг/дм 3 ;
100 — объем, до которого была разбавлена проба, см 3 ;
V — объем, взятый для измерений, см 3 .
При необходимости за результат измерений Хср принимают среднее арифметическое значение двух параллельных определений Х1 и Х2
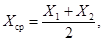
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 3.
Таблица 3 — Значения предела повторяемости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
При невыполнении условия (4) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Результат измерений в документах, предусматривающих его использование, может быть представлен в виде: X ± = 0,01 × U × X, мг/дм 3 ,
где X — результат измерений массовой концентрации, установленный по п. 10, мг/дм 3 ;
U — значение показателя точности измерений (расширенная неопределенность измерений с коэффициентом охвата 2).
Значение U приведено в таблице 1.
Допускается результат измерений в документах, выдаваемых лабораторией, представлять в виде: Х ± 0,01 × U л × X , мг/дм 3 , Р = 0,95, при условии U л U , где U л — значение показателя точности измерений (расширенной неопределенности с коэффициентом охвата 2), установленное при реализации методики в лаборатории и обеспечиваемое контролем стабильности результатов измерений.
При представлении результата измерений в документах, выдаваемых лабораторией, указывают:
— количество результатов параллельных определений, использованных для расчета результата измерений;
— способ определения результата измерений (среднее арифметическое значение или медиана результатов параллельных определений).
Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль процедуры измерений;
— контроль стабильности результатов измерений на основе контроля стабильности среднего квадратического отклонения (СКО) повторяемости, СКО промежуточной (внутрилабораторной) прецизионности и правильности.
Периодичность контроля исполнителем процедуры выполнения измерений и алгоритмы контрольных процедур, а также реализуемые процедуры контроля стабильности результатов измерений регламентируют во внутренних документах лаборатории.
Ответственность за организацию проведения контроля стабильности результатов измерений возлагают на лицо, ответственное за систему качества в лаборатории.
Разрешение противоречий между результатами двух лабораторий проводят в соответствии с 5.3.3 ГОСТ Р ИСО 5725-6-2002.
12.2 Оперативный контроль процедуры измерений с использованием метода добавок
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры K к с нормативом.
Результат контрольной процедуры Кк рассчитывают по формуле:
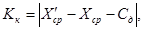
где 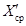
X ср — результат измерений массовой концентрации железа в исходной пробе — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4).
Норматив контроля К рассчитывают по формуле
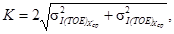
где 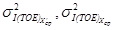
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (7) контрольную процедуру повторяют. При повторном невыполнении условия (7) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
12.3 Оперативный контроль процедуры измерений с использованием образцов для контроля
Оперативный контроль процедуры измерений проводят путем сравнения результата отдельно взятой контрольной процедуры Кк с нормативом контроля К.
Результат контрольной процедуры Кк рассчитывают по формуле:
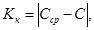
где Сср — результат измерений массовой концентрации железа в образце для контроля — среднее арифметическое двух результатов параллельных определений, расхождение между которыми удовлетворяет условию (4);
С — аттестованное значение образца для контроля.
Норматив контроля К рассчитывают по формуле
где s I(TOE) — стандартное отклонение промежуточной прецизионности, соответствующие массовой концентрации железа в образце для контроля, мг/дм 3 .
Процедуру измерений признают удовлетворительной, при выполнении условия:
При невыполнении условия (10) контрольную процедуру повторяют. При повторном невыполнении условия (10) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата измерений, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 4.
Таблица 4 — Значения предела воспроизводимости при вероятности Р = 0,95
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Таблица А.1 — Бюджет неопределенности измерений
Стандартная относительная неопределенность 4 , %
Приготовление градуировочных растворов, u1, %
Степень чистоты реактивов и дистиллированной воды, и2, %
Подготовка проб к анализу, и3, %
Стандартное отклонение результатов измерений, полученных в условиях повторяемости 5 , иr ( s r), %
Стандартное отклонение результатов измерений, полученных в условиях промежуточной прецизионности 5 , uI(TOE) ( s I(TOE)), %
Стандартное отклонение измерений полученных в условиях воспроизводимости, uR( s R), %
Суммарная стандартная относительная неопределенность, ис, %
Расширенная относительная неопределенность, (Uomн.) при k = 2, %
1 Оценка (неопределенности) типа А получена путем статистического анализа ряда наблюдений.
2 Оценка (неопределенности) типа В получена способами, отличными от статистического анализа ряда наблюдений.
4 Соответствует характеристике относительной погрешности при доверительной вероятности Р = 0,95.
5 Согласно ГОСТ Р ИСО 5725-3-2002 учтено при расчете стандартного отклонения результатов измерений, получаемых в условиях воспроизводимости.
Б.1 Приготовление основного градуировочного раствора из соли железа с концентрацией 100 мг/дм 3
Навеску железоаммонийных квасцов 0,8634 г помещают в мерную колбу вместимостью 1 дм 3 , растворяют в дистиллированной воде, прибавляют 2 см 3 концентрированной соляной кислоты и доводят дистиллированной водой до метки.
Срок хранения — один месяц.
Б.2 Приготовление рабочего стандартного раствора с концентрацией 10 мг/дм 3 из основного градуировочного раствора
Рабочий градуировочный раствор готовят в день проведения измерений разбавлением основного стандартного раствора в 10 раз дистиллированной водой.
источник
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Лабораторная работа № 2.
ВОДОПОДГОТОВКА.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ РАСТВОРЕННОГО ЖЕЛЕЗА В ВОДЕ.
Цель работы: определить содержание железа в сточной или природной воде фотоколориметрическим методом.
Общие сведения.
Железо (Ferrum) – принадлежит к 8 группе химических элементов периодической системы Д.И. Менделеева, атомная масса 55,847, атомный номер 26, плотность 7,874 г/см 3 , серебристо – белый блестящий пластичный металл, температура плавления 1535 o С. Железо достаточно распространено в земле (4 место) находится на 2 месте после алюминия; процентное содержание 4,65 %.
Главными источниками попадания соединений железа в поверхностные воды являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. В питьевой воде железо может содержаться также из-за плохого состояния водопроводов и применения коагулянтов на основе солей железа.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот – единицы миллиграммов. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм 3 ) наблюдается в подземных водах с низкими значениями pH. Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Концентрация железа подвержена сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации ионов железа в придонных слоях воды. Предельно допустимая концентрация общего железа в воде водоемов 0.5 мг/л.
Содержание железа в воде выше 1-2 мг Fe 3+ в 1 дм 3 значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. По органолептическим показателям воды содержание железа в питьевой воде не должно превышать 0.3 мг/л (а по нормам ЕС даже 0.2 мг/л). Лишь в отдельных случаях при использовании подземных вод без установок по обезжелезиванию по согласованию с органами санитарно-эпидемиологической службы содержание железа в воде, поступающей в водопроводную сеть, допускается до 1 мг/л.
В поверхностных пресных водах железо содержится в очень не больших количествах, и, как правило, в трехвалентной форме. Повышенное содержание железа наблюдается в болотистых водах, до нескольких миллиграммов на литр, в таких водах повышенное содержание гумусовых веществ, которые соединены с трехвалентным железом. При высоких значениях pH железо в воде находится в коллоидной форме оксида железа Fe(OH)3. В подземных водах с низкими значениями pHи при минимальном содержании растворенного кислорода железо присутствует в растворенной двухвалентной форме. Трехвалентное железо при определенных условиях также может присутствовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
При содержании в воде железа в концентрациях выше 0.3 мг/л вода после непродолжительного контакта с воздухом окисляется кислородом и становится желтовато – бурого цвета. Такая вода вызывает появление ржавых подтеков на сантехнике, отложения в котельном и бойлерном оборудовании. При концентрациях выше 1 мг/л вода мутная окрашивается в желто-бурый цвет при не длительном контакте с воздухом. Такая вода не допустима для использования, как в питьевых, так и в технических целях.
Железо человек получает в основном с пищей, из воды – максимально 10%. Также возможно попадание железа из воздуха, при этом вероятно возникновение профессиональных заболеваний. ВОЗ не дает рекомендуемой величины потребления железа по показаниям здоровья. В больших количествах железо, как и любое другое химическое вещество, способно вызвать в организме человека нарушения и даже патологии.
Виды железа, содержащегося в воде.
Как правило, в воде встречается несколько видов железа (таблица 1).
Двухвалентное железо (Fe +2 ) –в этой форме железо находится в растворенном состоянии. Иногда при определенных значениях pH гидроксид железа Fe(OH)2, выпадает в осадок.
Трехвалентное железо (Fe +3 ) —Хлорид (FeCl3) и сульфат (Fe2(SO4)3) – в растворимой форме, гидроксид железа Fe(OH)3 – в нерастворимом виде (существуют исключения при низком уровне pH).
Органическое железо – существует в различных комплексах, растворимых или в коллоидной форме. Органическое железо трудно удалить из воды. Органическое железо бывает следующих видов:
· Растворимое органическое железо. Способно связывать и удерживать кальций и другие металлы. Некоторые органические молекулы связывают железо в сложные растворимые комплексы – хелаты. Пример, таких органических соединений: порфириновая группа гемоглобина крови (удерживает железо), хлорофилл (удерживает магний), гуминовая кислота.
· Бактериальное железо. Существуют бактерии, использующие растворенное железо для жизни, они получают энергию, преобразуя двухвалентное железо в трехвалентное.
· Коллоидное железо. Коллоиды –частицы размером менее 1 микрона, которые не растворяются в воде, но трудно фильтруются из-за малого размера. К коллоидным частицам также относятся крупные органические молекулы (танины, лигнины). Коллоидные частицы обладают высоким поверхностным зарядом, поэтому они отталкивают друг друга и не укрупняются, образуя в воде суспензии, находящиеся во взвешенном состоянии, вода становится мутной.
Таблица 1 – Виды железа, содержащиеся в воде.
| Тип железа | Вода из-под крана | Вода после отстаивания |
| Двухвалентное | Чистая | Красно-бурый осадок |
| Трехвалентное | Окрашена | Красно-бурый осадок |
| Коллоидное | Желто-бурая | Не образует осадка, Не фильтруется |
| Растворенное органическое | Желто-бурая | |
| Бактериальное | Радужная пленка, желеобразные образования в водопроводной системе. |
Процесс удаления из воды железа называется обезжелезиванием. Очистка воды от железа – одна из самых сложных задач в водоподготовке. Одного универсального экономически оправданного метода очистки, который можно было бы применить во всех случаях для любой воды, не существует. Основные методы обезжелезивания:
· Окисление (реагентное, каталитическое). В результате окисления загрязнения осаждаются (с помощью коагулянтов или без них), потом фильтруются с помощью специальных систем очистки воды.
· Мембранные методы (осмос, обратный осмос, нанофильтрация)
Поскольку железо образует устойчивые окрашенные соединения, для его определения можно использовать фотоколориметрические методы.
Фотоколориметрия. Теоретические основы метода.
Закон Бугера – Ламберта — Бера
В основе оптических методов анализа лежит эффект избирательного поглощения света определенной длины волны веществом. Если вещество облучается видимым светом, этот раздел оптических методов анализа называется фотоколориметрией.
При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока I согласно закону Бугера – Ламберта — Бера равна
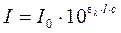
где I – интенсивность падающего потока;
ελ – молярный коэффициент поглощения при данной длине волны;
l – толщина поглощающего слоя (кюветы);
с – концентрация поглощающего вещества, моль/дм 3 .
Или в логарифмической форме:

Величину lg(I/I) в (2), характеризующую поглощающую способность вещества в растворе, называют оптической плотностью. В аналитической практике, стремясь подчеркнуть сущность процесса, лежащего в основе фотометрического определения, а именно поглощение квантов электромагнитного излучения оптического диапазона аналитической формой, эту величину называют поглощением, или светопоглощением и обозначают буквой А (absorption) либо D (density).
Закон Бугера – Ламберта — Бера: оптическая плотность раствора прямо пропорциональна концентрации вещества и толщине поглощающего слоя. Серию аналитических определений выполняют при постоянной толщине поглощающего слоя, тогда оптическая плотность линейно зависит от концентрации (рисунок 1).
Коэффициент линейной регрессии зависимости А = f(С) представляет собой молярный коэффициент поглощения ελ = tg a.
Рисунок 1. – зависимость оптической раствора плотности от концентрации.
Обратите внимание, что эта прямая линия проходит через начало координат. Для раствора поглощающего вещества при постоянных концентрациях и толщине поглощающего слоя оптическая плотность зависит от длины волны, поэтому измерения проводят при длине волны, соответствующей максимальному поглощению.
Приборами для фотоколориметрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Большинство фотометров имеет набор из 10-15 светофильтров и представляет собой прибор, в которых пучок света от источника излучения (лампа накаливания, редко ртутная лампа) проходит через светофильтр и проходит через кювету с исследуемым раствором или раствором сравнения (рисунок 2).
1 – источник света, 2 – щель, 3 – монохроматор (светофильтр),
4 – измерительная ячейка (анализируемый образец, образец сравнения),
5 – детектор, 6 – усилитель, 7 – регистрирующее устройство
(графическое, визуальное, цифровое)
Рисунок 2 – Блок-схема фотоэлектроколориметра (упрощенная)
Количественное определение вещества по светопоглощению основано на применении закона Бугера — Ламберта — Бера. Концентрацию можно определить, пользуясь методом градуировочного графика А = f(C), методом сравнения или методом добавок. Погрешности определения составляют около 5%.
Для перевода вещества в окрашенную форму используются химические реакции. Обязательное требование к реакциям, используемым в количественном анализе – они должны протекать избирательно, быстро и полностью воспроизводимо. Окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, несущее информацию о концентрации поглощающего вещества, должно подчиняться физическим законам, связывающим поглощение и концентрацию, конкретно – закону Бугера – Ламберта – Бера.
Практическая часть.
Ион Fe 3+ с роданид-ионом в зависимости концентрации ионов железа и роданид-ионов дает ряд окрашенных в кроваво-красный цвет комплексов:
Число роданид-анионов n в комплексе железа может изменяться от 1 до 6. В данной работе берется избыток роданид-ионов, при этом образуются комплекс FeSCN6 3- .
Для построения градуировочной кривой используются стандартные растворы, отличающиеся друг от друга по концентрации не менее чем на 10 %.
Растворы готовят непосредственно перед колориметрированием, так как окраска растворов неустойчива.
По серии стандартных растворов соли железа строят градуировочную кривую, выражающую зависимость оптической плотности от концентрации. На оси ординат наносят значения оптической плотности, на оси абсцисс – концентрации. Обычно график строят по 5 – 6 точкам.
Определив плотность исследуемого раствора соли железа, по оси ординат находят точку, которая соответствует данному значению оптической плотности, проводят линию, параллельную оси абсцисс до пересечения ее с градуировочной кривой. Из точки пересечения опускают перпендикуляр на ось абсцисс. Находят Cx.
Определению иона Fe 3+ данным методом мешают некоторые восстановители (S 2- , SO3 2- , Sr 2+ ) и окислители, разрушающие роданид-ион (MnO4 — , NO3 — , H2O2), а также ионы, образующие комплексные соединения с железом (F — , Cl — , PO4 3- ).
Оборудование.
Посуда и материалы
Мерные колбы вместимостью 50 см 3 и 1000 см 3
Пипетки вместимостью 1, 5, 10, 25 см 3 .
1. Основной стандартный раствор железоаммиачных квасцов NH4Fe(SO4)2×12 H2O (додекагидрата сульфата аммония железа III) концентрации 0.1 мг Fe 3+ в 1 см 3 раствора.
2. Рабочий стандартный растворжелезоаммиачных квасцов готовят в день анализа разбавлением основного стандартного раствора в 10 раз (5 см 3 основного раствора отмерить пипеткой, поместить в мерную колбу объемом 50 см 3 и довести до метки дистиллированной водой). В 1 см 3 рабочего стандартного раствора сожержится 0.01 мг железа Fe 3+ .
3. Роданид аммония NH4SCN либо роданид калия KSCN концентрации 50 %.
4. Соляная кислота, плотность 1.12 г/см 3 .
Вопросы для защиты
Информация для лаборантов.
1. железоаммиачные квасцы NH4Fe(SO4)2×12 H2O (додекагидрат сульфата аммония железа III), концентрация 0.1 г Fe 3+ в 1 см 3 .
Навеску свежеперекристаллизованных железоаммиачных квасцов массой 0.8836 г растворяют в мерной колбе объемом 1000 см 3 , добавляют 2 см 3 концентрированной соляной кислоты и доводят до метки дистиллированной водой.
2. Роданид аммония NH4SCN либо роданид калия KSCN концентрации 50 %. Навеску соли массой 50 г растворяют в 50 см 3 дистиллированой воды.
3. Соляная кислота, плотность 1.12 г/см 3 . К 65 см 3 дистиллированной воды приливают 100 см 3 концентрированной соляной кислоты.
4. Аммоний надсернокислый.
5. Вода дистиллированная
1. 7 мерных колб объемом 50 см 3
2. пипетки на 1 (2) и 5 см 3 со шкалой
Оборудование
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Лабораторная работа № 2.
ВОДОПОДГОТОВКА.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ РАСТВОРЕННОГО ЖЕЛЕЗА В ВОДЕ.
Цель работы: определить содержание железа в сточной или природной воде фотоколориметрическим методом.
Общие сведения.
Железо (Ferrum) – принадлежит к 8 группе химических элементов периодической системы Д.И. Менделеева, атомная масса 55,847, атомный номер 26, плотность 7,874 г/см 3 , серебристо – белый блестящий пластичный металл, температура плавления 1535 o С. Железо достаточно распространено в земле (4 место) находится на 2 месте после алюминия; процентное содержание 4,65 %.
Главными источниками попадания соединений железа в поверхностные воды являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. В питьевой воде железо может содержаться также из-за плохого состояния водопроводов и применения коагулянтов на основе солей железа.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот – единицы миллиграммов. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм 3 ) наблюдается в подземных водах с низкими значениями pH. Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Концентрация железа подвержена сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации ионов железа в придонных слоях воды. Предельно допустимая концентрация общего железа в воде водоемов 0.5 мг/л.
Содержание железа в воде выше 1-2 мг Fe 3+ в 1 дм 3 значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. По органолептическим показателям воды содержание железа в питьевой воде не должно превышать 0.3 мг/л (а по нормам ЕС даже 0.2 мг/л). Лишь в отдельных случаях при использовании подземных вод без установок по обезжелезиванию по согласованию с органами санитарно-эпидемиологической службы содержание железа в воде, поступающей в водопроводную сеть, допускается до 1 мг/л.
В поверхностных пресных водах железо содержится в очень не больших количествах, и, как правило, в трехвалентной форме. Повышенное содержание железа наблюдается в болотистых водах, до нескольких миллиграммов на литр, в таких водах повышенное содержание гумусовых веществ, которые соединены с трехвалентным железом. При высоких значениях pH железо в воде находится в коллоидной форме оксида железа Fe(OH)3. В подземных водах с низкими значениями pHи при минимальном содержании растворенного кислорода железо присутствует в растворенной двухвалентной форме. Трехвалентное железо при определенных условиях также может присутствовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
При содержании в воде железа в концентрациях выше 0.3 мг/л вода после непродолжительного контакта с воздухом окисляется кислородом и становится желтовато – бурого цвета. Такая вода вызывает появление ржавых подтеков на сантехнике, отложения в котельном и бойлерном оборудовании. При концентрациях выше 1 мг/л вода мутная окрашивается в желто-бурый цвет при не длительном контакте с воздухом. Такая вода не допустима для использования, как в питьевых, так и в технических целях.
Железо человек получает в основном с пищей, из воды – максимально 10%. Также возможно попадание железа из воздуха, при этом вероятно возникновение профессиональных заболеваний. ВОЗ не дает рекомендуемой величины потребления железа по показаниям здоровья. В больших количествах железо, как и любое другое химическое вещество, способно вызвать в организме человека нарушения и даже патологии.
Виды железа, содержащегося в воде.
Как правило, в воде встречается несколько видов железа (таблица 1).
Двухвалентное железо (Fe +2 ) –в этой форме железо находится в растворенном состоянии. Иногда при определенных значениях pH гидроксид железа Fe(OH)2, выпадает в осадок.
Трехвалентное железо (Fe +3 ) —Хлорид (FeCl3) и сульфат (Fe2(SO4)3) – в растворимой форме, гидроксид железа Fe(OH)3 – в нерастворимом виде (существуют исключения при низком уровне pH).
Органическое железо – существует в различных комплексах, растворимых или в коллоидной форме. Органическое железо трудно удалить из воды. Органическое железо бывает следующих видов:
· Растворимое органическое железо. Способно связывать и удерживать кальций и другие металлы. Некоторые органические молекулы связывают железо в сложные растворимые комплексы – хелаты. Пример, таких органических соединений: порфириновая группа гемоглобина крови (удерживает железо), хлорофилл (удерживает магний), гуминовая кислота.
· Бактериальное железо. Существуют бактерии, использующие растворенное железо для жизни, они получают энергию, преобразуя двухвалентное железо в трехвалентное.
· Коллоидное железо. Коллоиды –частицы размером менее 1 микрона, которые не растворяются в воде, но трудно фильтруются из-за малого размера. К коллоидным частицам также относятся крупные органические молекулы (танины, лигнины). Коллоидные частицы обладают высоким поверхностным зарядом, поэтому они отталкивают друг друга и не укрупняются, образуя в воде суспензии, находящиеся во взвешенном состоянии, вода становится мутной.
Таблица 1 – Виды железа, содержащиеся в воде.
| Тип железа | Вода из-под крана | Вода после отстаивания |
| Двухвалентное | Чистая | Красно-бурый осадок |
| Трехвалентное | Окрашена | Красно-бурый осадок |
| Коллоидное | Желто-бурая | Не образует осадка, Не фильтруется |
| Растворенное органическое | Желто-бурая | |
| Бактериальное | Радужная пленка, желеобразные образования в водопроводной системе. |
Процесс удаления из воды железа называется обезжелезиванием. Очистка воды от железа – одна из самых сложных задач в водоподготовке. Одного универсального экономически оправданного метода очистки, который можно было бы применить во всех случаях для любой воды, не существует. Основные методы обезжелезивания:
· Окисление (реагентное, каталитическое). В результате окисления загрязнения осаждаются (с помощью коагулянтов или без них), потом фильтруются с помощью специальных систем очистки воды.
· Мембранные методы (осмос, обратный осмос, нанофильтрация)
Поскольку железо образует устойчивые окрашенные соединения, для его определения можно использовать фотоколориметрические методы.
Фотоколориметрия. Теоретические основы метода.
Закон Бугера – Ламберта — Бера
В основе оптических методов анализа лежит эффект избирательного поглощения света определенной длины волны веществом. Если вещество облучается видимым светом, этот раздел оптических методов анализа называется фотоколориметрией.
При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока I согласно закону Бугера – Ламберта — Бера равна
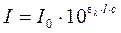
где I – интенсивность падающего потока;
ελ – молярный коэффициент поглощения при данной длине волны;
l – толщина поглощающего слоя (кюветы);
с – концентрация поглощающего вещества, моль/дм 3 .
Или в логарифмической форме:

Величину lg(I/I) в (2), характеризующую поглощающую способность вещества в растворе, называют оптической плотностью. В аналитической практике, стремясь подчеркнуть сущность процесса, лежащего в основе фотометрического определения, а именно поглощение квантов электромагнитного излучения оптического диапазона аналитической формой, эту величину называют поглощением, или светопоглощением и обозначают буквой А (absorption) либо D (density).
Закон Бугера – Ламберта — Бера: оптическая плотность раствора прямо пропорциональна концентрации вещества и толщине поглощающего слоя. Серию аналитических определений выполняют при постоянной толщине поглощающего слоя, тогда оптическая плотность линейно зависит от концентрации (рисунок 1).
Коэффициент линейной регрессии зависимости А = f(С) представляет собой молярный коэффициент поглощения ελ = tg a.
Рисунок 1. – зависимость оптической раствора плотности от концентрации.
Обратите внимание, что эта прямая линия проходит через начало координат. Для раствора поглощающего вещества при постоянных концентрациях и толщине поглощающего слоя оптическая плотность зависит от длины волны, поэтому измерения проводят при длине волны, соответствующей максимальному поглощению.
Приборами для фотоколориметрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Большинство фотометров имеет набор из 10-15 светофильтров и представляет собой прибор, в которых пучок света от источника излучения (лампа накаливания, редко ртутная лампа) проходит через светофильтр и проходит через кювету с исследуемым раствором или раствором сравнения (рисунок 2).
1 – источник света, 2 – щель, 3 – монохроматор (светофильтр),
4 – измерительная ячейка (анализируемый образец, образец сравнения),
5 – детектор, 6 – усилитель, 7 – регистрирующее устройство
(графическое, визуальное, цифровое)
Рисунок 2 – Блок-схема фотоэлектроколориметра (упрощенная)
Количественное определение вещества по светопоглощению основано на применении закона Бугера — Ламберта — Бера. Концентрацию можно определить, пользуясь методом градуировочного графика А = f(C), методом сравнения или методом добавок. Погрешности определения составляют около 5%.
Для перевода вещества в окрашенную форму используются химические реакции. Обязательное требование к реакциям, используемым в количественном анализе – они должны протекать избирательно, быстро и полностью воспроизводимо. Окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, несущее информацию о концентрации поглощающего вещества, должно подчиняться физическим законам, связывающим поглощение и концентрацию, конкретно – закону Бугера – Ламберта – Бера.
Практическая часть.
Ион Fe 3+ с роданид-ионом в зависимости концентрации ионов железа и роданид-ионов дает ряд окрашенных в кроваво-красный цвет комплексов:
Число роданид-анионов n в комплексе железа может изменяться от 1 до 6. В данной работе берется избыток роданид-ионов, при этом образуются комплекс FeSCN6 3- .
Для построения градуировочной кривой используются стандартные растворы, отличающиеся друг от друга по концентрации не менее чем на 10 %.
Растворы готовят непосредственно перед колориметрированием, так как окраска растворов неустойчива.
По серии стандартных растворов соли железа строят градуировочную кривую, выражающую зависимость оптической плотности от концентрации. На оси ординат наносят значения оптической плотности, на оси абсцисс – концентрации. Обычно график строят по 5 – 6 точкам.
Определив плотность исследуемого раствора соли железа, по оси ординат находят точку, которая соответствует данному значению оптической плотности, проводят линию, параллельную оси абсцисс до пересечения ее с градуировочной кривой. Из точки пересечения опускают перпендикуляр на ось абсцисс. Находят Cx.
Определению иона Fe 3+ данным методом мешают некоторые восстановители (S 2- , SO3 2- , Sr 2+ ) и окислители, разрушающие роданид-ион (MnO4 — , NO3 — , H2O2), а также ионы, образующие комплексные соединения с железом (F — , Cl — , PO4 3- ).
Оборудование.
Посуда и материалы
Мерные колбы вместимостью 50 см 3 и 1000 см 3
Пипетки вместимостью 1, 5, 10, 25 см 3 .
1. Основной стандартный раствор железоаммиачных квасцов NH4Fe(SO4)2×12 H2O (додекагидрата сульфата аммония железа III) концентрации 0.1 мг Fe 3+ в 1 см 3 раствора.
2. Рабочий стандартный растворжелезоаммиачных квасцов готовят в день анализа разбавлением основного стандартного раствора в 10 раз (5 см 3 основного раствора отмерить пипеткой, поместить в мерную колбу объемом 50 см 3 и довести до метки дистиллированной водой). В 1 см 3 рабочего стандартного раствора сожержится 0.01 мг железа Fe 3+ .
3. Роданид аммония NH4SCN либо роданид калия KSCN концентрации 50 %.
4. Соляная кислота, плотность 1.12 г/см 3 .
Последнее изменение этой страницы: 2016-09-20; Нарушение авторского права страницы
источник