Содержание стронция в воде – показатель, имеющий немаловажное значение для человеческого здоровья. В РФ предельно допустимая концентрация элемента Sr составляет 8 мг/л. При этом ведутся активные разговоры о необходимости пересмотра нормы. В западных странах, например в США, ПДК стронция в воде вдвое ниже.
Природный стронций входит в состав растений и микроорганизмов. Он является важной частью процесса обмена кальция. Умеренное количество вещества полезно организму для профилактики остеопороза и кариеса. Но если стронций в питьевой воде присутствует в чрезмерной дозировке, он становится очень опасным. Накапливаясь, элемент превращается в источник ядовитых токсинов. В результате, страдают кровь, печень, костная ткань, увеличивается вероятность образования опухолей.
Активное взаимодействие оксида стронция с водой приводит к образованию соединения Sr(OH)2. Этот гидроксид способен вызывать сильнейшие ожоги при попадании на кожу, слизистую оболочку или в глаз. Регулярно вдыхая испарения, можно быстро заполучить болезнь легких. Помимо бронхита или фиброза, резко возрастает риск сердечной недостаточности.
Наиболее наглядно эффект отравления проявляется при «уровской болезни» – «стронциевом рахите». Заболевание возникает вследствие недостатка ионов кальция, активно замещаемых ионами Sr. Повышенный стронций в воде приводит к деформированию костей и суставов, что особенно опасно для детей и подростков. При этом происходит серьезный сбой в функционировании всего организма.
Отбор проб воды на стронций – регулярная процедура, проводимая сотрудниками водоканалов. Однако соблюдение нормы ПДК не означает, что такая жидкость абсолютно безопасна. Особенно, если употребляется в питье. Минимизировать риск накапливания Sr в организме помогает дополнительная очистка воды от стронция. Для решения этой задачи можно использовать один из современных фильтров. В основе очистительных систем могут лежать:
- сильные окислители вроде перманганата калия, гипохлорита натрия или озона;
- коагулянты;
- мембраны обратного осмоса;
- ионообменные смолы.
Для начала стоит узнать реальный уровень стронция в воде. Определение этого показателя можно заказать в специализированной лаборатории. В частных домах наибольшей популярностью пользуются установки каталитического окисления и фильтрации. Внутри резервуара помещаются гранулы, содержащие окисляющие вещества. Стронций реагирует с водой и этими элементами, после чего распадается. Образуются хлопья, которые оседают на дне. То же самое происходит при использовании коагулянтов.
Для квартирных водопроводов рекомендуются фильтры с мембраной обратного осмоса и/или ионообменной смолой. В первом случае жидкость под давлением проходит сквозь тонкую гибкую перегородку с многочисленными отверстиями. На этом барьере отсеивается от 95 до 99% посторонних веществ. Помимо Sr и другого железа, мембрана обратного осмоса снижает уровень содержимого солей.
Если анализ воды на стронций показал необходимость дополнительной очистки, можно воспользоваться фильтром на основе ионообменной смолы. Она задерживает ионы Sr, выделяя взамен ионы натрия. Такая обработка позволяет не только обезжелезить воду, а и смягчить ее. Самым надежным вариантом станет установка многоступенчатой системы, состоящей из нескольких фильтров разного принципа действия.
Как определить стронций в воде? Как очистить питьевую жидкость от вредных примесей? Каким производителям отдать предпочтение? Эту и другую полезную информацию вы найдете на нашем сайте.
источник
Ответов в этой теме: 12
Страница: 1 2
«« назад || далее »»
| Автор | Тема: Стронций в питьевой воде? | |||
| МЕН Пользователь Ранг: 36 | 18.02.2009 // 15:43:27 Может ли содержание стронция в воде одной артезианской скважины колебаться от 1,0 до 21,0 мг/дм3? | |||
| Реклама на ANCHEM.RU Администрация Ранг: 246 Размещение рекламы | ||||
| sinthetic Пользователь Ранг: 3292 | 18.02.2009 // 15:51:01
Очень сомнительно. Не помешало бы сравнить с прочими показателями. Если выскакивает один стронций, тогда, скорее всего, лажа. | |||
| Эксперт Пользователь Ранг: 146 | 18.02.2009 // 23:51:41
А каким методом это определено? | |||
| Symon Пользователь Ранг: 90 | 19.02.2009 // 1:20:48
На будущее — не путайте стронций с его изотопами. | |||
| АнатолийАИ Пользователь Ранг: 1129 | 19.02.2009 // 6:10:46 Редактировано 1 раз(а)
Возможно проблемы не с определением а с пробоотбором, консервацией проб. | |||
| МЕН Пользователь Ранг: 36 | 19.02.2009 // 9:14:51 Стронций нам делала сторонняя лаборатория на атомнике, проба не консервировалась. Есть ли какая литература по колебаниям содержания стронция в питьевой воде. Откуда он может там появиться. | |||
| Реклама на ANCHEM.RU Администрация Ранг: 246 Размещение рекламы |
| |||
| Димитрий Пользователь Ранг: 646 | 19.02.2009 // 9:55:33 Скорее всего стронций в воде естественного происхождения. Значит подземные воды протекают через породы содержащие радиоактивные изотопы. Под Ухтой в посёлке Водный в подземных водах содержится радий. В 30-50-ых годах была организована его добыча. | |||
| sinthetic Пользователь Ранг: 3292 | 19.02.2009 // 10:23:39
Специально для вас писали, чтобы не путали с изотопами. | |||
| sinthetic Пользователь Ранг: 3292 | 19.02.2009 // 10:36:03 Редактировано 1 раз(а)
Стронцию консервация пробы вряд ли нужна, скорее есть шансы при ней его потерять из-за осаждения и последующего неполного перевода в раствор. Он довольно часто содержится в рассеянном виде в карбонатных породах (морских осадках), обычно в виде малорастворимого сульфата, редко карбоната. Аналогично кальцию может переходить в раствор в гидрокарбонатной форме. Причин для резкого повышения концентрации ТОЛЬКО СТРОНЦИЯ в пределах одного водоносного пласта быть не должно; разве что техногенные загрязнения (добыча нефти поблизости, подпитка на площадке для салютов) или вулканическая деятельность. Настоятельно рекомендую провести корреляцию с содержанием сульфата, гидрокарбоната и кальция. | |||
| sinthetic Пользователь Ранг: 3292 | 19.02.2009 // 12:41:07 Редактировано 2 раз(а) Вот такой он, ваш стронций. Минерал целестин. (копирайт неведом) | |||
| МЕН Пользователь Ранг: 36 | 19.02.2009 // 15:33:22 Кто нибудь проводил измерения колебания содержания стронция в артезианской воде по сезонам года? |
| Соли | Едва ощущаемый вкус | Ощущаемый вкус | Неприятный вкус |
NaCl MgCl  NaSO NaSO 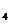 CaSO CaSO 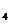 MgSO MgSO 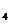 FeSO FeSO 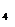 NaNO NaNO   NaHCO NaHCO  | 165 135 150 70 250 1.6 70 415 | 495 400 450 140 625 4.8 205 450 | 660 535 — — 750 — 345 — |
Основным критерием в качестве использования питьевой воды считается показатель степень минерализации. В соответствии стандарта СНГ степень минерализации не должна превышать 1 г/дм 
Но при всех условиях население не возможно обеспечить водой такой минерализации. В некоторых районах используются воды с повышенной минерализацией не вредных для здоровья. По О.А.Алекину
для засушливых районов можно рассчитать граничные нормы согласно нижеприведенной градации:
хорошие 1.0 г/дм 
удовлетворительные 1.0 – 2.0 г/дм 
возможные 2.0 – 2.5 г/дм
предельный 2.5 – 3.0 г/дм
Тем не менее очень низкая минерализация (до100 мг/дм 
В общем это является гигиенической проблемой для Северных регионов, где используются очень
маломинерализованные растопленные воды льда. Так, к примеру на Кольском полуострове жесткость питьевой воды не превышает 0,36 мг-экв/л (1 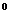
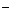
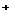

Таблица сравнений стандартов качества питьевой воды (по химическому составу) различных государств.
Стандарты питьевой воды, мг/дм
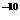 4.0 .10
4.0 .10 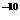
При оценке качества хозяйственно-питьевой воды важен показатель жесткости, определяемая наличием в воде содержания ионов кальция и магния. Центры обеспечиваются водой, согласно ГОСТа с жесткостью не более 7,0 мг-экв/л (19.6 
В таблице 13 показаны нормативы для различных видов микрокомпонент. Обычно в природе у подземных пресных вод величины их состава не достигают цифыр , указанных в таблице. Проявление указанных концентраций – считается следствием загрязнения. Только в кислых водах состав микрокомпонентов может немного превышать величин стандарта. Интенсивность реакции для питьевой воды не ложна превышать пределов (рН) 6,5-9.5. При необходимых обстоятельствах для устранения в воде вредных веществ очищают от их окислением, осаждением и адсорбцией.
В санитарно экономическом отношении обращается большое внимание на два микрокомпонента – фтор и йод.
Фтор поступает в человеческий организм в основном с водой. Но в природной воде его очень мало. Высоко концентрированные фтором подземные воды – артезианские и грунтовые воды. Кариес
зубов порождается нехваткой фтора. На земном шаре эта болезнь одна из широко распространенная. Излишек фтора вызывает заболевание флюороз, разрушая зубы. Выяснено, что фтор улучшает физиологические процессы. Он влияет на рост человека и развитию формирования костей и выполняет
важную роль в обмене фосфором. Исходя из этого, возникает вопрос. Какая величина фтора полезна человеку?
В таблице стандарта питьевой воды йод не включен, так как сейчас в йодном балансе человека он занимает несущественное место. Но в человеческом организме нужное количество йода значительно больше поступающего водой. Так называемый эндемический зоб, разрушающий в общем организм человека, происходит от недостатка в пище йода. Однако, низкая концентрация йода в воде происходит из-за малой величины его в почве и местной пищевой продукции.
Оценка химического состава воды, обеспечиваемой питьевой водой, не ограничивается только важностью значений концентраций растворимых в ней компонентов, а значимостью комбинаций анионов с катионами, т.е. соединений солей. Приведем несколько сведений о значений натрия с хлором, употребляемых человеком с пищей. Уровень натрия с хлором в организме превышает по сравнению с другими минеральными соединениями. NaCl в плазме крови составляет 0,85%. Осмосное давление крови плазмы 7,6 – 8.1 атм, оно проникает с посредством растворенных солей. С помощью осмосного давления соль удерживает воду. Когда в организме повышается содержание слей увеличивается объем жидкости и плазмы. Эти два фактора обуславливают возможному подъему артериального давления. И наоборот, уменьшение солевой плотности приводит к консолидации жидкости и к снижению артериального давления. Поступление в организм с пищей лишней соли приводит к повышению кровяного давления.
Наблюдается связь между уровнем жесткости воды и смертью больных сердцем. Эта проблема изучалась шведскими врачами. Результаты этого исследования показали только одну зависимость между концентрацией ионов кальция в воде и сердечно- сосудистой системой. Эта причина еще не выяснена полностью, но замечены, что с умягчением воды уменьшается сердечно-сосудистое заболевание. Нижний предел концентрации кальция в воде соответствует содовому типу.
В оценке питьевой воды по химическому составу основное место занимает ее микробиологическое состояние. Опасным для питьевой воды является фекальное загрязнение. Для установления возможно загрязнения , исследуемых вод, производственными водами используются микробиологические показатели. Для централизованного водоснабжения вода поставляется с качеством по нормированному ГОСТу не более 3 –х колли индекс (1000 мл – число кишечных палочек), а колли титр (наличие в составе 1-ой кишечной палочки в малом объеме мл.) не менее 300. Если норма превышается, тогда вода на водостанциях хлорируется, озонируется и обезвреживаются соответственными путями.
Подземные воды играют большую роль в водоснабжении. Их, по сравнению с поверхностными водами, больше, поскольку обладают постоянством химического состава и низким уровнем загрязнения. Подземные воды считаются хорошими источниками для водоснабжения, закрыты водонепроницаемыми покровами и надежно сохранены от загрязнения. Они обычно выгодно отличаются прозрачностью и отсутствием микробов. При широком распространении подземных вод они широко используются в водоснабжении.
Основная литература: ОЛ 1 [38 — 58], 3 [27 — 44].
Дополнительная литература: 1 [28 — 32].
Контрольные вопросы:
1) Какие требования к питьевой воде?
2) Что называется агрессивностью воды?
3) Требования к физическим качествам воды?
Лекция-11. Оценка качества подземных вод для использования в технических и ирригационных целях.
В промышленных районах пользуются различными водами. Вода в технологии пищевой промышленности изготовления продукции используется прямо в качестве сырья. Для этих целей к воде предъявляются промышленные требования: в сахарном производстве- маломинерализованной, потому что излишние соли затрудняют процесс сахароварения; в пивоварении не должно быть СаSO 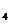
должна быть с низкой температурой. В фото, бумажном и текстильном производствах вода не должна содержать железо, марганец, серную кислоту, особенно радиактивные вещества. В производстве искусственного волокна требуется вода с слабой окисляемостью (кислород менее 2 мг/дм 

Самые высокие требования к химическому составу воды предъявляются для использования в паровых котлах. В этих случаях вредны все компоненты воды, особенно жесткость.
При оценке технической воды, по сравнению с питьевой, главное принимается во внимание степень жесткости. Карбонатная жесткость определяется наличием кальция, магния и гидрокарбонатов, общая жесткость – концентрацией соединений катионов Са и Мg. Жесткость воды в соответствии введенного стандарта показывается соединениями Са 
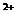

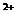

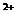

Значения жесткости воды следующие:
очень мягкая — 1.5 мг-экв/дм 
мягкая — 1.5 – 3.0 мг-экв/дм 
средняя — 3.0 – 6.0 мг-экв/дм 
жесткая — 6.0 – 10.0 мг-экв/дм
очень жесткая — 10.0 мг-экв/дм
В производстве и ряде технических процессов использовать жесткую воду неэффективно. Образование накипи понижает тепловую проводимость в производственных котлах и происходит высокий расход топлива. При 1 мм толщины накипи сжигание топлива превышает на 5%.
Образование накипи — сложный физико-химический процесс. В воде в процессе беспрерывного парообразования увеличивается концентрация растворенных солей и при достижении определенной предельной температуры соли выпадают в осадок. Обычно в осадок выпадают соли , отличающиеся малой растворимостью (СаСО 

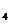



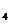
Химический состав накипи связан какие соли состоят в воде. При кипячении воды углекислый газ может полностью улетучится, и тогда гидрокарбонаты кальция и магния превращаются в слаборастворимые карбонаты:
Са(НСО 




Мg(HCO 



потом карбонат кальция подвергается гидролизу:
Mg(HCO 



В этих условиях твердые осадки могут иметь различное физическое строение – от аморфного тверже порошка до правильных кристаллов. Если в воде большое количество кальция сульфата, тогда образуются гипсы. При наличии в составе воды окисла натрий кремния и также соли окисла кремния, тогда в котле происходит взаимодействия кальция и магния между сульфатами, в результате чего формируются слаборастворимые силикаты, например:
СаСО 




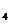
Накипи формируются солями кальция и силикатами магния, окислами кремния или силикатами. Особенности этих солей, как малорастворимые, с повышением температуры совсем не растворяются. Накипи окислов кремния для паровых котлов очень опасные, потому что нагревание котла может привести к взрыву. Неподходящие воды для питания паровых котлов, требуются смягчивать. Этот процесс понижения жесткости воды может называться как уменьшение в воде концентрации кальция и магния.
Для смягчении воды имеются различные методы: термические, химические с помощью катионов (содовая-известковая) и др.
Подземные воды бывают агрессивными к бетону, железобетону и металлам. Агрессивность воды в основном определяется ионами водорода (кислые воды), сульфатами с магнием при свободной углекислоты. ГОСТ 4796-49 подразделяет агрессивность на пять вида.
Щелочная агрессивность водыопределяется степенью карбонатной агрессивности. Вода в сильно водопроводящих породах считаются агрессивными с карбонатной жесткостью до 2.14 мг-экв/дм 
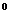

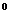
Общая кислотная агрессивность водыопределяется величиной содержания ионов водорода (по степени рН). Для вышесказанных цементов воды с карбонатной жесткостью в сильно вдопроводимых породах считаются агрессивными когда: а) карбонатная жесткость 8.6 мг-экв/дм 
Воды в слабо водопроводимых породах на агрессивность не нормируется.
Интенсивность углекислой, сульфатной и другой агрессивности зависит от скорости течения агрессивной воды.
Основная литература:ОЛ 1 [38-58], 3 [27-44]..
Дополнительная литература:ДЛ 1[28-32].
Контрольные вопросы:
2) Что называют агрессивностью?
3) Какие требования для производственных вод?
12 — лекция. ИЗОТОПНЫЙ СОСТАВ ВОДОРОДА, КИСЛОРОДА И СЕРЫ
Изотопный состав воды. Под термином «изотопный состав вод» понимают изотопные составы водорода и кислорода, входящих в состав молекулы воды.
При изотопном анализе воды физические константы исследуемой воды сравниваются с константами пресной речной воды, принимаемой за эталон. При оценке суммарного изотопного состава той или иной воды поступают так: если исследуемая вода тяжелее стандартной, то перед разностью плотностей, выражаемой вставят плюс, если легче — минус. Гамма же определяется в единицах плотности: 1γ равна 0,000001 единиц плотности и эквивалентна 9,3 -10 -4 мол % дейтерия или избыточному его содержанию сверх стандартного на 6,1%.
Согласно данным различных авторов, суммарная изотопная плотность природных вод испытывает колебания от минус 23 до плюс 21γ. Значения плотности от 0 до минус 3,5γ свойственны подземным водам вблизи области питания и на небольших глубинах. Утяжеление подземных вод в зоне свободного водообмена невелико и близко к речному стандарту. С увеличением закрытости недр количество тяжелых изотопов в воде при прочих равных условиях обычно возрастает, достигая + 7 -8γ. Большое уплотнение свойственно поровым водам (горным растворам) и капельно-жидким включениям в минералах. У них отмечается плотность + 8γ, иногда -14,4γ .
По суммарному изотопному составу различают следующие типы природных вод : 1) легкие воды, снеговые и ледниковые (минус 3, минус 23 гаммы); 2) нулевые воды больших рек Русской равнины ( 


Воды Антарктиды (снег и фирн) относятся, по-видимому, к самым легким водам на Земле. Суммарный изотопный состав большинства их проб оказался ниже минус 13 и достигает минус 23,1 гамм. Предполагают, что льды Антарктиды образовались в результате многократных фракционных перегонок атмосферных осадков, сформировавшихся над океаном, которые проникли вглубь Антарктиды на значительных высотах. Большая плотность холодного воздуха нижних горизонтов препятствовала проникновению паров воды непосредственно из океана.
Л. И. Бродский указывает, что большинство элементов в природных условиях существует в виде механических смесей изотопов. Соответственно этому атомный вес таких элементов является арифметическим средним из атомных весов их изотопов. Эти средние атомные веса отличаются большей частью замечательным постоянством. Казалось бы в геологическом масштабе времени подобное постоянство не должно сохраняться, но изменению изотопного состава противодействуют природные фракционирующие процессы. Последние недостаточно односторонне направлены для того, чтобы вызывать значительное разделение изотопов.
Нарушения постоянства атомных весов наблюдаются в двух случаях: 1) если тот или иной изотоп является продуктом, радиоактивного распада; 2) если элементы в природных условиях подвержены интенсивному направленному круговороту или односторонней миграции, как например: водород и кислород воды, углерод органического мира, сера и т. д. В первом случае наблюдаются резкие различия в изотопном составе, во втором — незначительные. Какие же природные процессы вызывают фракционирование изотопов? К числу их относятся повторяющиеся процессы растворения и кристаллизации, испарения и конденсации, диффузия, различные реакции химического взаимодействия, в частности реакции изотопного обмена, и ряд других. Особая роль в разделении изотопов принадлежит процессам, происходящим при участии живых организмов — фотосинтезу. Дыханию и прочее. Поэтому испарению отводится главная роль в разделении изотопов. Другие факторы имеют второстепенное значение.
Изотоп водорода. В последнее время особое внимание уделяется изучению изотопного состава водорода с целью использования его для решения некоторых теоретических и практических вопросов гидрогеологии. Результаты определения изотопов водорода выражаются по-разному: в мол % D2O, ат.% D, в гаммах. (1γ эквивалентна 0,000927 ат.%), в виде относительной величины, причем за стандарт, приравненный 1, принимается обычно вода Московского водопровода, абсолютная концентрация дейтерия» в которой составляет 0,0147 
По данным многочисленных определений, воды рек средней полосы Европейской территории СНГ характеризуются содержанием дейтерия, близким к 1. Меньше дейтерия в поверхностных водах Сибири: р. Иртыш 0,96; оз. Байкал 0,95:. р. Слюдянка 0,94; р. Енисей 0,93, — что объясняется, по всей вероятности, уменьшением эффекта фракционирования при испарении с понижением температуры. В водах морей и бессточных озер аридных областей концентрация дейтерия намного превышает принятый стандарт: Каспийское море от 1,08 до 1.09, Японское море 1,10, Черное море 1,11, Красное море 1,13.
Вариации изотопного состава водорода подземных вод из водоносных горизонтов различного возраста неодинаковых по геологическому строению артезианских бассейнов не выходят за пределы изменений дейтерия в поверхностных водах. Лишь в некоторых пробах найдено содержание дейтерия, более свойственное морским водам. Воды артезианских бассейнов Средней Азии характеризуются низкими концентрациями дейтерия, что можно поставить в связь с питанием их талыми водами высокогорных снегов, тоже содержащих относительно мало дейтерия (0,91—0,93). В водах артезианских бассейнов Азербайджана, Поволжья, Краснодарского края больше дейтерия, поскольку в области питания развиты воды с концентрацией дейтерия, близкой к 1.
В действительности наблюдается закономерное изменение концентрации дейтерии в водах артезианских бассейнов в зависимости от не в интенсивности водообмена, а в генезисе воды. В нижних непромытых горизонтах обычно сохраняются седиментационные воды морского генезиса. В зоне замедленного водообмена еще сохраняется примесь морских вод. Брезгунов с соавторами по содержанию дейтерия произвели ориентировочный подсчет пропорций седиментационных и инфильтрационных вод. При благоприятных условиях морские воды иногда проникают в верхнюю зону, свободного водообмена и тогда здесь будут фиксироваться повышенные концентрации дейтерия.
Надо иметь в виду, что минерализованные воды континентального засоления, образовавшиеся путем испарительного концентрирования, будут всегда обогащены дейтерием, независимо от того, в какой гидродинамической зоне они будут находиться.
Изотоп кислорода. Обогащение вод тяжелыми изотопами кислорода приписывается одному изотопу О 18 , хотя в значительно меньших количествах существует еще один тяжелый стабильный изотоп О 17 . Найдено, что изотопный состав кислорода в природных водах может значительно отличаться. Например, разность плотностей воды. Мертвого моря и одного из глетчеров Канады за счет различия концентрации О 18 достиг
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9949 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
