Нормативные документы — РД 52.24.419-95, ИСО 5813:1983.
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, а также как косвенная характеристика оценки качества поверхностных вод и регулирования процесса очистки стоков. Содержание растворенного кислорода существенно для аэробного дыхания и является индикатором биологической активности (т. е. фотосинтеза) в водоеме.
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического окисления органических и неорганических соединений.
Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мг О2/дм 3 . Понижение его содержания до 2 мг/дм 3 вызывает массовую гибель рыб. Неблагоприятно сказывается на их состоянии и пересыщение воды кислородом.
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, косвенной характеристики качества воды, интенсивности процессов продуцирования и деструкции органических веществ, самоочищения водоемов и т. д.
Концентрацию кислорода выражают либо в мг/дм 3 , либо в процентах насыщения, вычисление кислорода производится по формуле
где Сх — концентрация кислорода, найденная экспериментально, мг/дм 3 ; Со — нормальная концентрация при данной температуре, нормальности и атмосферном давлении 760 мм; р — атмосферное давление в момент анализа.
Кислород является неустойчивым компонентом, определение которого вследствие зависимости его содержания от температуры воды должно производиться на месте отбора проб (Скопин-цев, Овчинников, 1933).
Метод предназначен для анализа неокрашенных или слабо-окрашенных вод с содержанием кислорода выше 0,05 мг О2/дм 3 .
Метод основан на взаимодействии в щелочной среде гидро-окиси марганца с растворенным в воде кислородом. Гидроокись марганца, количественно связывая растворенный в воде кисло-род, переходит в нерастворимое соединение четырехвалентного марганца коричневого цвета. При подкислении раствора в присутствии избытка йодистого калия образуется йод, количество которого эквивалентно содержанию растворенного кислорода и учитывается титрованием раствора тиосульфата:
Mn 2+ + 2OH — > Mn(OH)2 (белый) (6)
MnO(OH)2 + 4H + + 3 I — > Mn 2+ + I 3- + 3H2O (8)
Минимально определяемая концентрация 0,05 мг О2/дм 3 . Относительное стандартное отклонение U при концентрациях 7-10 мг О2/дм 3 составляет 0,3 % (n=20). Продолжительность определения единичной пробы с учетом ее отстаивания 40 мин. Серия из шести проб определяется в течение 1,5 ч.
Пробу воды для определения растворенного кислорода отбирают батометром, к крану которого прикреплена резиновая трубка длиной 20-25 см. Фиксирование кислорода производят сразу после отбора пробы. Для этого кислородную склянку 2-3 раза ополаскивают и затем наполняют исследуемой водой. Резиновая трубка при этом должна касаться дна склянки. После заполнения склянки до горлышка ее наполнение продолжают до тех пор, пока не выльется приблизительно 100 мл воды, т. е. пока не вытиснится вода, соприкасавшаяся с воздухом, находящимся в склянке. Трубку вынимают, не прекращая тока воды, из батометра. Склянка должна быть заполнена пробой до краев и не иметь внутри на стенках пузырьков воздуха.
Затем в склянку с пробой воды вводят 1 мл щелочного раствора йодистого калия.
При этом необходимо пользоваться отдельными пипетками. Пипетку погружают каждый раз до половины склянки и по мере выливания раствора поднимают вверх. Затем быстро закрывают склянку стеклянной пробкой таким образом, чтобы в ней не оставалось пузырьков воздуха, и содержимое склянки тщательно перемешивают.
Образовавшемуся осадку гидроокиси марганца дают отстояться не менее 10 мин. и не более суток. Затем приливают 5 мл раствора HCI. Пипетку погружают до осадка и медленно поднимают вверх. Вытеснение из склянки раствором соляной кислоты прозрачной жидкости для анализа значения не имеет.
Склянку закрывают пробкой и содержимое тщательно перемешивают. Отбирают пипеткой 50 мл раствора (пипетку предварительно необходимо ополоснуть этим раствором) и переносят его в коническую колбу объемом 250 мл. Раствор титруют 0,02 н. раствором тиосульфата до тех пор, пока он не станет светло-желтым. Затем прибавляют 1 мл свежеприготовленного раствора крахмала и продолжают титрование до исчезновения синей окраски.
Содержание растворенного кислорода С в мг О2/дм 3 находят по формуле:
Cx = (8 Nn Е 1000V)/[50(V-2)] = (160 NnV)/(V — 2) (9)
где N — нормальность тиосульфата; n — объем тиосульфата, пошедшего на титрование, мл; V — объем склянки, в которую отбиралась проба, мл; 2 — объем пробы, вылившийся при фиксации растворенного кислорода, мл.
Степень насыщения воды кислородом в процентах вычисляют по формуле:
где Сх — концентрация кислорода, найденная путем анализа, мг/дм 3 , Со — нормальная концентрация кислорода для температуры, измеренной при отборе пробы, атмосферном давлении 760 мм рт. ст. и поправкой на минерализацию воды.
Характеристика погрешности — при содержании кислорода от 0,5 до 5,0 мг/дм 3 — 10 %, от 5 до 10 мг/дм 3 — 5 %.
Определение нормальности тиосульфата
В коническую колбу 250 мл наливают 35 мл дистиллированной воды, всыпают 1 г сухого KI, 15 мл 0,02 н. раствора K2Cr2O7, точно отмеренных пипеткой, и 10 мл раствора НСl (2:1).
Титрование раствором тиосульфата начинают сразу после растворения КI, непрерывно помешивая, до появления слабожелтой окраски. Затем добавляют 50-100 мл дистиллированной воды и 1 мл раствора крахмала и продолжают титрование до исчезновения окраски.
Определение повторяют и при отсутствии расхождения более 0,05 мл, за результат определения берут среднее арифметическое. Вычисляют нормальность раствора тиосульфата до пятого знака после запятой по формуле:
где N1— нормальность раствора Na2S2O3; N2 — нормальность раствора K2Cr2O7; n — объем расвора Na2S2O3, пошедшего на титрование, мл; a-объем раствора K2Cr2O7, взятого для определения нормальности, мл.
Характеристика погрешности: при содержании кислорода 1,0-3,0 мг/дм 3 д=0,1с; при содержании кислорода св. 3 до 15 мг/дм 3 д = 0,034 С, где С — найденная концентрация кислорода в мг/дм 3 .
Чисто вымытую и высушенную склянку взвешивают с точностью до 0,01 г. Затем наполняют ее до краев дистиллированной водой, закрывают пробкой так, чтобы не осталось пузырьков воздуха, склянку вытирают и снова взвешивают до 0,01 г.
Объем склянки V рассчитывают по формуле
где P1 — масса пустой склянки, г; P2 — масса склянки с водой, г; d — плотность воды при температуре взвешивания, г/см 3 (d при температурах 15, 20 и 25 С равны соответственно 0,998; 0,997 и 0,996 г/см 3 ).
источник
Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) массовой концентрации растворенного кислорода в пробах поверхностных вод суши и очищенных сточных вод в диапазоне от 1,0 до 15,0 мг/дм 3 иодометрическим методом.
2.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих
Показатель повторяемости (среднеквадратическое отклонение повторяемости) s r, мг/дм 3
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости) s R, мг/дм 3
Показатель точности (границы погрешности при вероятности Р = 0,95) ± D , мг/дм 3
Предел обнаружения кислорода иодометрическим методом составляет 0,2 мг/дм 3 .
2.2 Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения измерений;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
3.1.1 Весы аналитические 2 класса точности по ГОСТ 24104-2001.
3.1.2. Весы технические лабораторные 4 класса точности по ГОСТ 24104-2001 с пределом взвешивания 200 г, 500 г.
3.1.3 Колбы мерные не ниже 2 класса точности по ГОСТ 1770-74 вместимостью:
3.1.4 Пипетки градуированные не ниже 2 класса точности по ГОСТ 29227-91 вместимостью: 1 см 3 — 8 шт.
3.1.5 Пипетка с одной отметкой не ниже 2 класса точности по ГОСТ 29169-91 вместимостью: 5 см 3 — 1 шт.
3.1.6 Бюретки не ниже 2 класса точности по ГОСТ 29251-91 вместимостью:
3.1.7 Микробюретка не ниже 2 класса точности по ГОСТ 29251-91 вместимостью:
3.1.8 Цилиндры мерные по ГОСТ 1770-74 вместимостью:
3.1.9 Колбы конические по ГОСТ 25336-82 вместимостью:
3.1.10 Стаканы химические по ГОСТ 25336-82 вместимостью:
3.1.11 Трубка хлоркальциевая по ГОСТ 25336-82 — 1 шт.
3.1.12 Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82 — 2 шт.
3.1.13 Воронка лабораторная по ГОСТ 25336-82 диаметром 7 — 10 см — 1 шт.
3.1.14 Колба с тубусом (Бунзена) по ГОСТ 25336-82 вместимостью:
3.1.15 Воронка Бюхнера № 1 или 2 по ГОСТ 9147-80 — 1 шт.
3.1.16 Склянки калиброванные с притертыми пробками (кислородные) для проб воды вместимостью 100 — 200 см 3 , 500 — 1000 см 3 .
3.1.17 Шкаф сушильный общелабораторного назначения.
3.1.18 Плитка электрическая по ГОСТ 14919-83.
3.1.19 Насос вакуумный любого типа.
3.1.21 Отрезок гибкой пластиковой трубки длиной 50 — 70 см (сифон).
3.1.22 Шпатель (стеклянная лопатка).
Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 3.1.
3.2.1 Марганец ( II ) хлористый 4-водный (хлорид марганца) по ГОСТ 612-75, ч.д.а. или марганец ( II ) сернокислый 5-водный, или 7-водный (сульфат марганца) по ГОСТ 435-77, ч.д.а. (допустимо ч.).
3.2.2 Калий йодистый (иодид калия) по ГОСТ 4232-74, ч.д.а. или натрий йодистый 2-водный (иодид натрия) по ГОСТ 8422-76, ч.д.а.
3.2.3 Калий двухромовокислый (дихромат калия) по ГОСТ 4220-75, х.ч. или калий двухромовокислый, стандарт-титр с молярной концентрацией количества вещества эквивалента (КВЭ) 0,1 моль/дм 3 по ТУ 6-09-2540-72.
3.2.4 Натрий серноватистокислый 5-водный (натрия тиосульфат) по ГОСТ 27068-86, ч.д.а. или натрий серноватистокислый (натрия тиосульфат), стандарт-титр 0,1 моль/дм 3 КВЭ по ТУ 6-09-2540-72.
3.2.5 Натрия гидроокись (натрия гидроксид) по ГОСТ 4328-77, ч.д.а., или калия гидроокись (калия гидроксид) по ГОСТ 24363-80, ч.д.а.
3.2.6 Натрий углекислый безводный (карбонат натрия) по ГОСТ 83-79, ч.д.а.
3.2.7 Раствор гипохлорита натрия с содержанием активного хлора не менее 3 %, или известь хлорная медицинская.
3.2.8 Натрий сернокислый (сульфат натрия) по ГОСТ 4166-76, ч.д.а.
3.2.9 Калий фтористый 2-водный (фторид калия) по ГОСТ 20848-75, ч.д.а.
3.2.10 Калий роданистый (тиоцианат калия) по ГОСТ 4139-75, ч.д.а.
3.2.11 Алюминий сернокислый 18-водный (сульфат алюминия) по ГОСТ 3758-75, ч.д.а.
3.2.12 Кислота соляная по ГОСТ 3118-77, ч.д.а., или кислота серная по ГОСТ 4204-77, ч.д.а.
3.2.13 Сульфаминовая кислота по ТУ 6-09-2437-79, ч.
3.2.14 Медь (II) сернокислая 5-водная (сульфат меди) по ГОСТ 4165-78, ч.д.а.
3.2.15 Аммиак водный, 25 % раствор по ГОСТ 3760-79, ч.д.а.
3.2.17 Хлороформ по ГОСТ 20015-88, очищенный.
3.2.18 Салициловая кислота фармакопейная.
3.2.19 Крахмал растворимый по ГОСТ 10163-76, ч.д.а.
3.2.22 Фильтры обеззоленные «белая лента» или «красная лента» и «синяя лента» по ТУ 6-09-1678-86.
Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 3.2.
Иодометрический метод измерения массовой концентрации растворенного кислорода основан на реакции последнего с гидроксидом марганца (II) в щелочной среде с образованием соединения марганца ( IV ). При подкислении пробы в присутствии избытка иодида калия марганец (IV) окисляет иодид до свободного иода, количество которого эквивалентно концентрации растворенного кислорода и определяется титрованием раствором тиосульфата натрия.
5.1 При выполнении измерений массовой концентрации кислорода в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в государственных стандартах и соответствующих нормативных документах.
5.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся ко 2, 3 классам опасности по ГОСТ 12.1.007-76.
5.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005-88.
5.4 Вреднодействующие вещества подлежат сбору и утилизации в соответствии с установленными правилами.
5.5 Дополнительных требований по экологической безопасности не предъявляется.
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы в лаборатории не менее года, освоившие методику.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
температура воздуха (22 ± 5) °С;
атмосферное от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
влажность воздуха не более 80 % при 25 °С;
напряжение в сети (220 ± 10) В;
частота переменного тока (50 ± 1) Гц.
Отбор проб производят в соответствии с ГОСТ 17.1.5.05-85, ГОСТ Р 51592-2000 с помощью батометра, к крану которого прикреплена резиновая трубка длиной 20 — 25 см. Из поверхностных горизонтов допускается отбор проб эмалированной посудой или прямо в склянку для определения кислорода. Склянку перед отбором ополоснуть отбираемой водой. При отборе опустить ее на глубину не менее 20 см и держать наклонно против течения.
Проба для определения кислорода должна быть первой, взятой из пробоотборника для дальнейшей обработки. При отборе аликвот пробы следует свести к минимуму возможность контакта пробы с атмосферой во избежание растворения кислорода из воздуха или улетучивания его из пробы в атмосферу. Взбалтывание, перемешивание пробы недопустимо.
При переливе отобранной пробы воды в кислородную склянку из батометра резиновую трубку опускают до дна кислородной склянки и открывают кран, при переливе из другого пробоотборника пользуются сифоном, погруженным примерно до половины высоты водного столба. После заполнения склянки до горлышка её наполнение продолжают до тех пор, пока не вытеснится вода, соприкасавшаяся с воздухом, находившимся в склянке. Трубку вынимают, не прекращая тока воды из батометра или сифона, и закрывают склянку пробкой. Склянка должна быть заполнена пробой до краёв и не иметь внутри на стенках пузырьков воздуха. Пробка должна плотно прилегать к горлышку склянки. Для того, чтобы не образовались пузырьки при закрывании, шлиф пробки срезают наискось примерно до половины высоты. Для каждой пробы заполняют не менее двух склянок.
Сразу после заполнения склянки производят фиксацию кислорода в соответствии с 10.1.
При наличии в пробе мешающих определению веществ осуществляют предварительную подготовку проб и определение кислорода в соответствии с 10.2.
Срок хранения зафиксированных проб не более 24 ч в темном, защищенном от света месте.
9.1 Приготовление растворов и реактивов
9.1.1 Раствор хлорида (сульфата) марганца
210 г хлорида марганца тетрагидрата ( MnCl 2 × 4Н2O) или 260 г сульфата марганца пентагидрата ( MnSO 4 × 5H 2 О) или 290 г сульфата марганца гептагидрата ( MnSO 4 × 7Н2О) растворяют в 300 — 350 см 3 дистиллированной воды, фильтруют в мерную колбу вместимостью 500 см 3 через обеззоленный фильтр «белая лента» и доливают дистиллированной водой до метки на колбе. Хранят в плотно закрытой склянке.
9.1.2 Щелочной раствор иодида калия (или натрия)
15 г иодида калия ( KI ) (или 18 г иодида натрия NaI · 2Н2O) растворяют в 20 см 3 , 50 г гидроксида натрия — в 50 см 3 дистиллированной воды. Полученные растворы смешивают в мерной колбе вместимостью 100 см 3 и доводят объем дистиллированной водой до метки на колбе. При наличии мути раствор фильтруют. Хранят в склянке из темного стекла с плотной резиновой пробкой.
340 см 3 концентрированной соляной кислоты добавляют к 170 см 3 дистиллированной воды.
Вместо раствора соляной кислоты можно использовать раствор серной кислоты 1:4. Для его приготовления 100 см 3 концентрированной серной кислоты смешивают с 400 см 3 дистиллированной воды.
ВНИМАНИЕ! СЕРНУЮ КИСЛОТУ ОТМЕРИВАЮТ СУХИМ ЦИЛИНДРОМ И ОСТОРОЖНО ПРИЛИВАЮТ К 400 СМ 3 ДИСТИЛЛИРОВАННОЙ ВОДЫ ПРИ ПЕРЕМЕШИВАНИИ.
Проверку чистоты растворов соли марганца, иодида калия (или натрия), соляной (или серной) кислоты и их очистку осуществляют, как описано в 9.2.
0,5 г крахмала взбалтывают с 15 — 20 см 3 дистиллированной воды.
Суспензию постепенно приливают к 80 — 85 см 3 кипящей дистиллированной воды и кипятят еще 2 — 3 мин. После охлаждения консервируют добавлением 2 — 3 капель хлороформа или нескольких кристалликов салициловой кислоты. Раствор используют до помутнения.
9.1.5 Раствор дихромата калия с молярной концентрацией количества вещества эквивалента (КВЭ) 0,0200 моль/дм 3
При использовании стандарт-титра последний растворяют в дистиллированной воде в мерной колбе вместимостью 500 см 3 , затем пипеткой отбирают 50 см 3 полученного раствора, переносят в мерную колбу вместимостью 500 см 3 и доводят объем дистиллированной водой до метки.
Для приготовления раствора из навески 0,4904 г дихромата калия (K 2 Cr 2 O 7 ), предварительно высушенного в сушильном шкафу при 105 ° С в течение 1 — 2 ч, переносят количественно в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде и доводят объем раствора до метки на колбе. Хранят в склянке с притертой пробкой в темном месте не более 6 мес.
9.1.6 Раствор тиосульфата натрия с молярной концентрацией КВЭ 0,02 моль/дм 3
При использовании стандарт-титра последний растворяют в дистиллированной воде в мерной колбе вместимостью 500 см 3 , затем отбирают пипеткой 50 см 3 полученного раствора, переносят в мерную колбу вместимостью 500 см 3 и доводят объем дистиллированной водой до метки.
Для приготовления раствора из навески 2,5 г тиосульфата натрия (Na 2 S 2 O 3 × 5Н2O) переносят в мерную колбу вместимостью 500 см 3 , растворяют в дистиллированной воде и доводят объем раствора до метки на колбе.
В качестве консерванта к полученному раствору добавляют 3 см 3 хлороформа. Перед определением точной концентрации раствор выдерживают не менее 5 сут. Хранят в склянке из темного стекла, закрытой пробкой с вставленными в нее сифоном с бюреткой и хлоркальциевой трубкой, заполненной гранулированным гидроксидом калия или гидроксидом натрия.
Точную концентрацию раствора тиосульфата натрия определяют как описано в 9.4 не реже 1 раза в неделю. Результаты проверки заносят в специальный журнал.
Навески 12,6 г сульфата меди, пентагидрата ( CuSO 4 × 5Н2O) и 8 г сульфаминовой кислоты ( NH 2 SO 3 H) растворяют в 100 см 3 дистиллированной воды. Хранят в склянке из темного стекла.
9.1.8 Раствор фторида калия, 40 %
40 г фторида калия растворяют в 60 см 3 дистиллированной воды, хранят в полиэтиленовом или полипропиленовом флаконе.
25 г сульфата натрия растворяют в 80 см 3 дистиллированной воды и добавляют такое количество раствора гипохлорита натрия, чтобы смешанный раствор содержал около 0,3 % активного хлора. Раствор хранят в темной склянке в холодильнике не более 1 мес.
При отсутствии готового раствора гипохлорита натрия его готовят из хлорной извести и карбоната натрия следующим образом. 35 г карбоната натрия растворяют в 85 см 3 дистиллированной воды. К 50 г хлорной извести добавляют 85 см 3 дистиллированной воды, тщательно размешивают, добавляют весь раствор карбоната натрия и перемешивают. При этом масса загустевает, затем начинает разжижаться. Массу фильтруют через фильтр «синяя лента» на воронке Бюхнера.
Полученный раствор гипохлорита натрия хранят в склянке из темного стекла в холодильнике.
Для определения содержания активного хлора в растворе гипохлорита натрия в коническую колбу вместимостью 250 см 3 вносят 50 см 3 дистиллированной воды, 1 см 3 раствора гипохлорита, 1 г сухого KI , 10 см 3 раствора соляной кислоты (9.1.3), тщательно перемешивают, выдерживают 5 мин в темном месте и титруют титрованным раствором тиосульфата натрия до светло-желтого цвета, а затем после добавления 1 см 3 раствора крахмала — до полного обесцвечивания. Массовую долю активного хлора вычисляют по формуле
где: Сах — массовая доля активного хлора, %;
Ст — молярная концентрация тиосульфата натрия, моль/дм 3 КВЭ;
V т — объем раствора тиосульфата натрия, пошедший на титрование гипохлорита натрия, см 3 .
9.1.10 Смешанный раствор сульфата натрия и тиоцианата калия
25 г сульфата натрия и 1 г тиоцианата калия растворяют в 100 см 3 дистиллированной воды. Раствор хранят в плотно закрытой склянке не более месяца.
35 г сульфата алюминия (Al 2 (SO 4 )3 × 18Н2O) растворяют в 50 см 3 дистиллированной воды.
4 г сульфаминовой кислоты растворяют в 10 см 3 дистиллированной воды. Хранят в холодильнике.
4 — 5 г йодида калия или натрия растворяют в небольшом количестве воды (не более 20 см 3 ), добавляют примерно 130 мг йода. После растворения йода объем раствора доводят до 100 см 3 .
Для проверки чистоты 1 г йодида калия растворяют в 100 см 3 свежепрокипяченной и охлажденной до комнатной температуры дистиллированной воды, приливают 10 см 3 раствора соляной кислоты, проверенного на чистоту и 1 см 3 раствора крахмала.
Если в течение 5 мин голубая окраска не появляется, реактив пригоден для использования. В противном случае йодид калия должен быть очищен от свободного йода. Для этого 30 — 40 г йодида калия помещают в воронку Бюхнера и промывают при перемешивании охлажденным до 3 — 5 °С этиловым спиртом до появления бесцветной порции последнего. Промытый йодид калия сушат в темноте между листами фильтровальной бумаги в течение суток. Хранят в плотно закрытой склянке из темного стекла.
Проверку чистоты и очистку йодида натрия проводят аналогичным образом.
9.2.2 Раствор хлорида (сульфата) марганца
К 100 см 3 свежепрокипяченной и охлажденной дистиллированной воды добавляют 1 см 3 раствора соли марганца, 0,2 г сухого йодида калия (проверенного на чистоту), 5 см 3 раствора соляной кислоты и 1 см 3 раствора крахмала. Отсутствие через 10 мин синей окраски указывает на чистоту реактива. В противном случае для очистки раствора на каждые 100 см 3 его добавляют около 1 г безводного карбоната натрия, хорошо перемешивают, отстаивают в течение суток, а затем фильтруют.
9.2.3 Раствор соляной (серной) кислоты
К 50 см 3 дистиллированной воды добавляют 1 см 3 раствора крахмала, 1 г сухого чистого йодида калия и 10 см 3 раствора соляной кислоты (или серной кислоты).
Если в течение 5 мин не появится синяя окраска, раствор кислоты может быть использован в анализе, в противном случае следует заменить исходный реактив.
9.3 Установление точной вместимости кислородных склянок
Чтобы установить вместимость склянки для фиксации кислорода, ее тщательно моют, высушивают (снаружи и изнутри) и взвешивают вместе с пробкой на технических весах с точностью до 0,01 г.
Затем склянку наполняют дистиллированной водой до краев и закрывают стеклянной пробкой так, чтобы под пробкой не оставалось пузырьков воздуха. Обтирают склянку досуха и снова взвешивают с точностью до 0,01 г.
Разность в весе дает массу воды в объеме склянки, которую для перевода в объем следует разделить на коэффициент, равный 0,998 при температуре воды 15 ° С, 0,997 — при 20 °С; 0,996 — при 25 ° С.
В колбу для титрования вносят 80 — 90 см 3 дистиллированной воды, 10 см 3 раствора дихромата калия, 0,0200 моль/дм 3 КВЭ, добавляют 1 г сухого KI и 10 см 3 раствора соляной кислоты. Раствор перемешивают, выдерживают 5 мин в темном месте и титруют раствором тиосульфата натрия до появления слабо-жёлтой окраски. Затем добавляют 1 см 3 раствора крахмала и продолжают титрование до исчезновения синей окраски. Повторяют титрование и, если расхождение между величинами объемов титранта не более 0,05 см 3 , за результат принимают их среднее значение.
В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 .
Точную молярную концентрацию КВЭ тиосульфата натрия в растворе находят по формуле
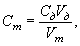
где Cm — молярная концентрация раствора тиосульфата натрия, моль/дм 3 КВЭ;
Сд — молярная концентрация раствора дихромата калия, моль/дм 3 КВЭ;
Vm — объём раствора тиосульфата натрия, пошедший на титрование, см 3 ;
V д — объём раствора дихромата калия, взятый для титрования, см 3 .
Сразу же после заполнения склянок фиксируют растворенный кислород, для чего в склянку с пробой воды вводят отдельными пипетками 1 см 3 (при вместимости склянки до 150 см 3 ) или 2 см 3 (при вместимости более 150 см 3 ) раствора хлорида (сульфата) марганца и 1 или 2 см 3 щелочного раствора йодида калия (при вместимости склянки до 150 см 3 и более 150 см 3 , соответственно). Пипетку погружают каждый раз до половины склянки и по мере выливания раствора поднимают вверх. Затем быстро закрывают склянку стеклянной пробкой таким образом, чтобы в ней не оставалось пузырьков воздуха, и содержимое тщательно перемешивают 15 — 20-кратным переворачиванием склянки до равномерного распределения осадка в воде. Склянки с зафиксированными пробами помещают в темное место для отстаивания (не менее 10 мин и не более 24 ч).
После того, как опустившийся на дно склянки осадок будет занимать менее половины высоты склянки, к пробе приливают 5 см 3 или 10 см 3 (в зависимости от вместимости склянки) раствора соляной кислоты, погружая при этом пипетку до осадка (не взмучивать) и медленно поднимая ее вверх по мере опорожнения. Вытеснение из склянки части прозрачной жидкости для анализа значения не имеет.
Склянку закрывают пробкой и содержимое тщательно перемешивают.
Отбирают 50 см 3 раствора (пипетку предварительно ополаскивают этим раствором), переносят его в колбу для титрования и титруют раствором тиосульфата натрия из бюретки вместимостью 10 или 25 см 3 (если предполагается, что концентрация кислорода менее 3 мг/дм 3 — из микробюретки) до тех пор, пока он не станет светло-желтым. Затем прибавляют 1 см 3 раствора крахмала и продолжают титрование до исчезновения синей окраски. Повторяют определение, отбирая аликвоту из второй склянки.
При низкой концентрации кислорода в воде (менее 3 мг/дм 3 ) рекомендуется не отбирать аликвоту из кислородной склянки, а титровать весь объем, если объем склянки менее 150 см 3 . Если объем склянки превышает 150 см 3 , следует отбирать аликвоту 100 см 3 .
Наличие мешающих веществ проверяют при анализе загрязненных природных и очищенных сточных вод.
Наличие окислителей или восстановителей устанавливают следующим образом.
Отбирают 50 см 3 анализируемой воды, добавляют 0,5 см 3 раствора серной кислоты (1:4), несколько крупинок (приблизительно 0,5 г) йодида калия или натрия и несколько капель раствора крахмала. Появление голубой окраски свидетельствует о наличии в воде окислителей (железа ( III ), активного хлора и других). Если раствор остается бесцветным, то добавляют 0,2 см 3 раствора йода и взбалтывают. Если голубая окраска не появляется, значит в пробе присутствуют восстановители (сульфиты, сульфиды и т.п.).
Влияние взвешенных и большого количества окрашенных веществ устраняют предварительным соосаждением их с гидроксидом алюминия. Для этого воду из пробоотборника сифоном переносят в склянку с притертой пробкой вместимостью не менее 500 см 3 , опуская сифон до дна склянки. После заполнения склянки её наполнение продолжают до тех пор, пока не вытеснится вода, соприкасавшаяся с воздухом, находившимся в склянке.
Склянка должна быть заполнена пробой до краёв и не иметь внутри на стенках пузырьков воздуха. Добавляют в пробу 4 см 3 раствора сульфата алюминия (9.1.11), 2 см 3 раствора аммиака, при этом пипетку погружают каждый раз до половины склянки, по мере выливания раствора поднимают вверх, затем закрывают склянку и перемешивают содержимое. После отстаивания надосадочную жидкость переливают сифоном в кислородную склянку и производят фиксацию и определение кислорода, в соответствии с 10.1.
Если вода содержит трудноосаждаемые взвешенные вещества, которые могут вызвать снижение концентрации кислорода вследствие деятельности микроорганизмов, к ней перед добавлением растворов сульфата алюминия и аммиака добавляют 2 см 3 смешанного раствора сульфаминовой кислоты и сульфата меди (9.1.7).
При концентрации нитритов в воде более 0,05 мг/дм 3 перед растворением осадка гидроксида марганца в пробу следует внести 1 см 3 раствора сульфаминовой кислоты (9.1.12). Эта операция не выполняется, если в ходе осаждения взвесей в пробу уже добавляли смешанный раствор, содержащий сульфаминовую кислоту.
Если в пробе присутствует активный хлор, после заполнения склянки добавляют 1 см 3 смешанного раствора тиоцианата калия и сульфата натрия.
В присутствии восстановителей последовательность анализа изменяется. В этом случае после заполнения кислородной склянки пробой воды в нее добавляют 0,5 см 3 раствора соляной кислоты и 0,5 см 3 смешанного раствора гипохлорита и сульфата натрия (9.1.9). Склянку закрывают пробкой, перемешивают и оставляют в тёмном месте. Через 30 мин для устранения избытка непрореагировавшего гипохлорита добавляют 1 см 3 смешанного раствора тиоцианата калия и сульфата натрия. Пробу перемешивают и через 10 мин выполняют фиксацию и определение кислорода, в соответствии с 10.1.
При содержании в анализируемой воде более 1 мг/дм 3 железа (III) в пробу перед добавлением раствора кислоты следует внести 1 см 3 раствора фторида калия.
11.1 Массовую концентрацию растворённого в воде кислорода находят по формуле
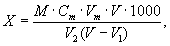
где Х — массовая концентрация растворенного кислорода в анализируемой пробе воды, мг/дм 3 ;
С m — молярная концентрация раствора тиосульфата натрия, моль/дм 3 КВЭ;
Vm — объём раствора тиосульфата натрия, пошедший на титрование, см 3 ;
V — объём кислородной склянки, см 3 ;
V 1 — суммарный объем растворов хлорида марганца и йодида калия, добавленных в склянку при фиксации растворенного кислорода, см 3 (если проводилось устранение мешающего влияния нитритов и других восстановителей, а также активного хлора, V 1 должен включать также суммарный объем растворов сульфаминовой кислоты, гипохлорита натрия или тиоцианата калия);
М — масса миллимоля КВЭ кислорода, равная 8 мг/ммоль;
V 2 — объем аликвоты пробы, титруемой тиосульфатом, см 3 .
За результат 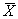
Если расхождение превышает предел повторяемости, выполняют повторное титрование растворов из обеих склянок. При повторном расхождении результаты анализа бракуются, а в лаборатории проводится выяснение причин, приводящих к неудовлетворительным результатам.
Если для титрования содержимое склянки использовано полностью (при концентрации кислорода менее 3 мг/дм 3 ) и провести повторное определение невозможно, результаты также бракуются.
11.2 Степень насыщения растворенным кислородом пробы воды х, %, вычисляют по формуле
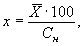
где 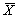
Сн — нормальная концентрация кислорода с учетом реального давления и минерализации пробы, мг/дм 3 .
11.3 Для расчета нормальной концентрации кислорода в соответствии с реальным атмосферным давлением и минерализацией по приложению А находят равновесную концентрацию растворенного кислорода при измеренной в момент отбора температуре воды. Из найденной величины равновесной концентрации вычитают на каждые 1000 мг/дм 3 солей 0,0840 мг/дм 3 при температуре 0 °С, 0,0622 мг/дм 3 при 10 °С, 0,0478 мг/дм 3 при 20 °С и 0,0408 мг/дм 3 при 30 °С. Поправку для промежуточных значений температуры и минерализации находят методом интерполяции.
Расчет равновесной концентрации Снпри реальном давлении проводят по формуле
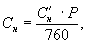
где 
Р — реальное атмосферное давление, мм рт. ст.
Численные значения результата измерений должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
11.4 Результат измерений в документах, предусматривающих его использование, представляют в виде:
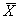
где 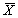
± D — границы характеристик погрешности измерений для данной массовой концентрации кислорода (таблица 1).
11.5 Допустимо представлять результат в виде
X ± D л Р = 0,95, при условии D л D , (7)
где ± D л — границы характеристики погрешности результатов измерений, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
Примечани е — Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения: D л = 0,84 D , с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов измерений.
12.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости и внутрилабораторной прецизионности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, среднеквадратического отклонения внутрилабораторной прецизионности).
12.2 Алгоритм контроля повторяемости (для двух измерений с использованием рабочих проб)
12.2.1 Контроль повторяемости осуществляют для каждого из результатов измерения рабочих проб, получаемых в соответствии с методикой анализа.
12.2.2 Процедура контроля предусматривает сравнение абсолютного расхождения r к между двумя результатами определения концентрации кислорода в рабочих пробах с пределом повторяемости
где r = 2,77 s r . Значения s r приведены в таблице 1.
12.2.3 Если условие (8) не выполнено, процедуру измерения повторяют. При повторном превышении предела повторяемости выясняют причины, приводящие к неудовлетворительным результатам, и устраняют их.
12.3 Алгоритм контроля внутрилабораторной прецизионности
12.3.1 Контрольные процедуры при контроле внутрилабораторной прецизионности осуществляют с использованием двух контрольных проб (с учетом проведения двух параллельных измерений каждой пробы), отбираемых дополнительно к рабочим пробам.
12.3.2 При реализации контрольной процедуры получают два усредненных результата контрольных измерений (в рабочей 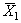
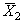
12.3.3 Результат контрольной процедуры R к рассчитывают по формуле
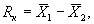
и сравнивают с пределом внутрилабораторной прецизионности ( R л ).
12.3.4 Качество контрольной процедуры признают удовлетворительным, если выполняется условие
Примечани е — На стадии внедрении методики в лаборатории допустимо Rл устанавливать на основе выражения: Rл= 0,84R с последующим уточнением по мере накопления информации в процессе контроля стабильности результатов измерений. Значение R рассчитывают по формуле R = 2,77 s R.
При невыполнении условия (10) процедуру контроля повторяют с использованием второй контрольной пробы. При повторном невыполнении условия (10) выясняют причины, приводящие к неудовлетворительным результатам и устраняют их.
12.4 Периодичность оперативного контроля исполнителем процедуры выполнения измерений, а также реализуемые процедуры контроля стабильности результатов выполняемых измерений регламентируются в Руководстве по качеству лаборатории.
Расхождение между результатами измерений, полученными в двух лабораториях не должно превышать предела воспроизводимости R (2,77 s R ). Значения s R приведены в таблице 1. При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение.
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно разделу 5 ГОСТ Р ИСО 5725-6-2002.
Примечани е — Оценка приемлемости проводится при необходимости сравнения результатов измерений, полученных двумя лабораториями.
Равновесная концентрация растворенного кислорода в дистиллированной воде в зависимости от температуры воды (атмосферное давление 760 мм рт. ст., парциальное давление О2 0,209 атм)
источник
Большинство химических и биологических процессов влияют на уровень растворенного в воде кислорода. Поэтому в обработке промышленных, муниципальных вод и в области аквакультуры важной задачей является непрерывное и точное измерение концентрации растворенного кислорода.
В данной статье описаны три стандартных метода определения концентрации растворенного кислорода. Приведены принцип работы этих методов, их преимущества и недостатки, а также результаты сравнения точности и надежности измерений в различных условиях среды.
Процедура титрования исторически является первым методом определения концентрации кислорода в воде.
Образец воды обрабатывают сульфатом марганца, гидроксидом калия и йодидом калия с образованием гидроксида марганца, Mn(OH)2. Кислород в воде реагирует с Mn(II), переводя его в Mn(III). Нестабильный Mn(III) затем реагирует с другой молекулой O2, переходя в Mn(IV). Для фиксации реакции в раствор добавляют сильную кислоту (серную или соляную), переводят осадок MnO(OH)2 в сульфат марганца, при этом MnO(OH)2 действует как окисляющий агент на йод, I2. Этот йод — стехиометрический эквивалент к растворенному кислороду в образце, его титруют тиосульфатом натрия или фениларсиноксидом с крахмалом. Крахмал нужен для более точного определения окончания реакции.
J2 + крахмал -> синее окрашивание
Метод имеет многочисленные помехи, которые вносят ионы нитрита, двух и трехвалентные ионы железа, взвешенные частицы и органика. Он показывает завышенные значения растворенного кислорода в аноксической среде и заниженные значения в гипероксичной среде, потому что проба воды и сами реагенты испаряются во время работы.
Для измерения кислорода в воде обычно используют датчик, состоящий из мембраны, которая покрывает амперометрический сенсор. В ноябре 1959 года изобретатель Кларк (H. A. Clark) получил патент (US Patent 2913386), «Электрохимическое устройство для химического анализа».
В пластмассовом цилиндрическом корпусе 1 имеются сквозные отверстия для проводников, в которых находятся индикаторный (рабочий) электрод 2 из платины и электрод сравнения 3 из серебряных проволок, концы которых покрыты пастой из хлорида серебра. Нижний конец корпуса обтягивают газопроницаемой полимерной мембраной 4 из полипропилена (тефлона, полиэтилена, фторопласта, целлофана и т.п.), которую механически фиксируют на корпусе с помощью резинового кольца 5. В пространство между электродами и мембраной залит водный раствор хлорида кальция 6. Извне мембрана 4 контактирует с контролируемой средой 7. Это может быть как жидкость, так и газ.
Если в контролируемой среде кислорода нет, то при подаче напряжения между электродом сравнения (анод) и рабочим электродом установившийся стационарный ток очень слаб. При наличии в контролируемой среде кислорода его молекулы диффундируют сквозь мембрану 4 и через раствор 6. Когда они достигают индикаторного электрода 2, то благодаря каталитическим свойствам платины здесь происходит реакция восстановления:
O2 + 4e- + 4H+ = 2H2O, вследствие которой ток через электрохимический элемент значительно возрастает.
Стационарный ток линейно зависит от концентрации кислорода в контролируемой среде.
Специально подбирая материал электродов, состав внутреннего электролита, электродное напряжение, удается построить амперометрические сенсоры подобной конструкции также для определения концентраций таких газов, как хлор, сероводород, серный газ, водород, угарный газ, окислы азота и т.д.
Вследствие потребления кислорода катодом и необходимостью диффузии кислорода через мембрану, для точности измерений следует поддерживать достаточный поток свежей воды. Загрязнение воды маслами и другими полимерами снижает диффузию и искажает результаты. С течением времени, мембрана разрушается, электролит становится грязным, а электроды расходуются до такой степени, что дают ограниченный ответ на присутствие кислорода.
Тушение люминофоров кислородом описано в далеком 1939 году (Kautsky, 1939), но в области анализа воды технология, основанная на этом феномене, является относительно новой (Klimant et al., 1995; Glud et al., 1999; Wenzhöffer et al., 2001). Много позже, получили развитие оптические устройства, детекторы, устройства обработки информации. Значительного прогресса в 1990-х годах достигли технологии регистрации растворенного кислорода в жидкости с использование люминофоров, оптод (оптические датчики) и портативных компьютеров. Успехи в области создания диодов с синим спектром свечения и маломощной высокоскоростной электроники позволили миниатюризировать чувствительные к кислороду оптоды до размера портативных устройств. Датчики не потребляют кислород и стабильны длительное время. Они имеют быстрое время отклика, обычно τ63% менее 60 секунд, часто менее 30 секунд для изменений концентрации кислорода ниже 8 мг/л. Оптоды имеют температурную зависимость, их значения корректируются с помощью локального температурного датчика.
Приложение технологии тушения люминофоров кислородом для оценки качества воды активно изучается. Обнаружено, что технология чрезвычайно хорошо подходит для анализа качества воды, и для коммерческого внедрения необходимо преодолеть два препятствия:
— защитить люминофор от фотовыгорания, чтобы датчик мог работать длительный срок в полевых условиях;
— обеспечить воспроизводимость процесса печати, чтобы последовательно и недорого интегрировать люминофор в колпачок датчика.
Кислородная оптода обеспечивает более удобный и надежный способ измерения растворенного кислорода, чем титрование и электрохимические датчики . Фундаментальный принцип основан на способности некоторых веществ действовать как динамические гасители флюоресценции. В случае определения концентрации кислорода, если рутениевый комплекс освещают синим светом, он возбуждается и испускает красную люминесценцию с интенсивностью и сроком жизни, которые зависят от концентрации кислорода в образце воды.
Важно отметить три параметра, на которых строятся измерения: интенсивность (насколько возвратное излучение сильное), срок жизни (как быстро возвратная люминесценция прекращается) и смещение фаз.
Измерения, базирующиеся на интенсивности, легче провести, но полученные значения меняются с течением времени. Различные технологии определения сигнала и области их приложения обобщены в работах Wolfbeis (1991), Demas et al. (1999) и Glud et al. (2000).
Сенсорная пленка состоит из чувствительного к кислороду люминесцентного вещества (люминофор), который погружен в полимерный слой, который, в свою очередь, тонким слоем покрывает полиэстеровую подложку.
Чаще всего в качестве люминофора используют рутениевые комплексы, но иногда платиновые комплексы порфиринов [полициклические ароматические углеводорода, Ru(II), Os(II), Rh(II), фосфоресцентные порфирины]. В последнем случае датчик имеет в пять раз больший срок жизни сигнала, поэтому сигнал проще считывать, и показания более стабильные. Кроме того, платиновые комплексы порфиринов менее чувствительны к фотовыгоранию.
Газопроницаемый защитный черный силиконовый слой работает как оптический изолятор, защищает от возможных люминесцентных/флюоресцентных материалов в воде, от солнечного излучения.
Пленку освещают синим/зеленым светодиодом с частотой 5 кГц. Возвратное красное флюоресцентное свечение от пленки принимает фотодиод. Красный оптический фильтр снижает отраженный свет, поступающий в фотодиод непосредственно от синего/зеленого излучателя.
Хотя детектор измеряет интенсивность флюоресцентного свечения, эта интенсивность восприимчива к оптическим связям и фотовыгоранию люминофора. Для измерения уровня тушения люминесценции кислородом гораздо лучше определять время жизни излучения от возбужденных люминофоров в пленке по отношению к возбуждающему сигналу. Время жизни измеряют опосредованно, через фазовое смещение между возбуждающим синим/зеленым сигналом и испускаемым от люминофора красным сигналом. Дополнительный красный светодиод включен в качестве невозбуждаемого сигнала сравнения как средство компенсации потенциального дрейфа в электронных схемах передатчика и приемника.
Использование техники фазовой модуляции означает, что флуктуации интенсивности излучения от синего/зеленого светодиода и излучения от люминофора не вносят помехи в измерения на протяжении всего срока службы оптического датчика. Кроме того, так как между концентрацией растворенного кислорода и фазовым смещением возвратной красной флюоресценции отмечается обратная зависимость, «отношение сигнал шум» имеет особое значение для измерения очень низкой концентрации растворенного кислорода. Наконец, между циклами измерения поочередно включаются синий и красный светодиоды, что обеспечивает внутреннее сравнение для оптического и электронного прохождения сигнала. Этот внутренний контроль обеспечивает стабильность в условиях корректировки температуры.
- Оптический датчик проводит измерения, последовательно включая синий и красный светодиоды.
- Синий свет возбуждает молекулы красителя люминофора на чувствительной пленке.
- Испускаемый светодиодом красный свет обеспечивает нулевое сравнительное значение; он не возбуждает молекулы люминофора.
- Возбужденные молекулы люминофора испускают красный свет в обратную сторону.
- Фотодиод обнаруживает возвратный красный свет от возбужденных молекул люминофора и красный свет от светодиода.
Оптическое тушение люминофора сильно зависит от температуры. Важно с высокой точностью измерять температуру (с множеством повторений), при этом датчик температуры и оптода должны располагаться близко друг к другу. Во время калибровки необходимо равенство температур образца воды, колпачка оптоды и температурного датчика.
Например, когда для калибровки значения 100% насыщения используется водонасыщенный воздух, колпачок оптоды и температурный датчик должны находиться на воздухе в температурном равновесии. Аналогично, когда для калибровки значения 100% насыщения используется насыщенная воздухом вода, колпачок оптоды и температурный датчик должны погружаться в воду и находится в температурном равновесии друг с другом и с водой.
Во время калибровки в полевых условиях рекомендуют защищать колпачок от термического нагревания при помощи солнечного щита.
Для создания уравновешенных образцов воды с известными значениями температуры и давления использовали поверочную газовую O2/N2 смесь Национального института стандартов и технологий (NIST, США). Измерения концентрации растворенного кислорода титрованием, электродом Кларка и оптическим датчиком Hach LDO сравнивали с теоретическими значениями растворенного кислорода (Hitchman, 1978).
Измерения концентрации растворенного кислорода титрованием, электродом Кларка и оптическим датчиком Hach LDO сравнивали с теоретическими значениями растворенного кислорода (Hitchman, 1978)
Используя автоматический титратор по методике Виклера, измерения модели зонда Hydrolab Series 5 от компании Hach LDO показали высокую степень корреляции со значениями титратора. Каждая группа данных включала два образца, и эти данные перекрывались.
Сравнения показаний оптоды с автоматическим титрованием по Виклеру Измерения при высокой солености. Сравнение показаний оптоды Hach LDO и электрода Кларка
В контролируемых лабораторных условиях с помощью коммерческой морской соли корректировали соленость воды до желаемого уровня. Емкость продували азотом, снижая концентрацию кислорода, а затем растворяли кислород, продувая емкость кислородом. Сравнения оптоды Hach LDO с электрохимическим мембранным датчиком при средней (6.9 млрд -1 ) и высокой солености (45.5 млрд -1 ) показали аналогичные значения, с ошибками ±0.2 мг/л для мембранного датчика и ±0.1 мг/л для Hach LDO датчика (значения ниже 8 мг/л) и ±0.2 мг/л для Hach LDO датчика (значения выше 8 мг/л).
В контролируемых лабораторных условиях корректировали концентрацию растворенного кислорода при помощи продувки азотом и кислородом. Емкость продували азотом, снижая концентрацию кислорода, а затем растворяли кислород, продувая емкость кислородом. Брали несколько сотен значений на кривой концентрации кислорода для датчика Hach LDO. Значения насыщения для датчика Hach LDO и электрохимического датчика аналогичные. Процент насыщения, рассчитанный через измерения в абсолютных значениях (мг/л) одинаков для двух методов регистрации.
Определения процента насыщения
Время отклика оптического датчика изменялось поэтапно, менее 30 секунд, достигая τ95%, когда концентрация снижалась с 8 мг/л до 0 мг/л и когда она возрастала от 0 мг/л до 8 мг/л.
Время отклика оптического датчика Hach LDO
Сравнения измерений Hach LDO и титрования по Виклеру в условиях низкой концентрации кислорода и температур показали аналогичные результаты. Это говорит о способности оптического датчика достигать нуля и работать при низких температурах.
Сравнение измерений оптического датчика Hydrolab Series 5 с датчиком Hach LDO и электрода Кларка в течение недели проводилось в естественном водоеме города Найвот, Колорадо. Регистрация проводилась каждые 15 минут, и результаты измерений показали четкий суточный ритм в зеленом пруду.
Тестирование в природных водоемах
| Параметр | Титрование по Виклеру | Оптический датчик | Электрохимический электрод | Гальванический электрод | |
| Средняя исходная ошибка, net bias, мг/л | — | 0.19 | 0.55 | 0.22 | Насколько датчик точен в начале |
| Частота исходных ошибок 0.2 мг/л или меньше, % | — | 50 | 40 | 10 | |
| Частота исходных ошибок 0.2 мг/л или больше, % | — | 10 | 60 | ||
| Расброс значений в начале измерений, мг/л | 0.9 | 3.1 | 9.5 | ||
| Индивидуальная точность, % | 0.22 | 0.11 | 0.11 | 0.18 | Насколько идентичны одинаковые модели датчиков |
| Обычное отклонение за первую неделю, мг/л | — | 0.39 | 0.77 | 1.01 | Насколько высокие отклонения измерений |
| Вариабельность отклонений (завышает или занижает), мг/л | — | 0.58 | 3.94 | 0.74 | |
| Ранний срок начала отклонений более 2.0 мг/л, дни | — | 14 | 3 | 8 | |
| Mooney R., Arnerich T., Performance of optical dissolved oxygen sensors in seven site, mix matrix study | |||||
Рассмотрены три стандартных метода определения концентрации растворенного кислорода в воде.
Титрование по Винклеру подходит для точного измерения кислорода в природных водоемах, но имеет ограничения, касающиеся токсичной природы химических реактивов и трудозатрат на выполнение процедуры. Кроме того, сложно анализировать образцы, далекие от равновесного состояния (слишком аноксические и гипероксические).
В электродах Кларка мембрана покрывает амперометрический сенсор. Полвека назад этот датчик стал шагом вперед в реал-тайм мониторинге уровня растворенного кислорода. Электроду присущи ограничения, так как он потребляет кислород и требует частого обслуживания.
Оптические датчики, работающие на технологии фазового смещения сигнала и принципе гашения люминесценции кислородом, имеют существенные преимущества. Они наиболее точные и имеют самый долгий срок службы среди других датчиков, включая оптоды, использующие оценку интенсивности сигнала. В условии нормальных концентраций веществ, они лишены каких-либо помех, и в этом плане превосходят электрохимический метод измерения и титрование.
Таким образом, метод не имеет таких ограничений, какие имеет химический мембранный метод. Мембрана не взаимодействует с кислородом, поэтому нет необходимости помешивания датчика. Кроме того, прочная конструкция датчика обеспечивает калибровку на долгие годы.
В качестве рабочего варианта приведу характеристики модели In-Situ ®Inc.’s Rugged Dissolved Oxygen (RDO) Titan Probe. Далее следуют выдержки из руководства по эксплуатации.
Прочность конструкции
Датчик устойчив к стиранию и потери флуоресценции в ходе фотовыгорания. Выдерживает высокую соленость раствора, состоит из устойчивых к коррозии материалов. Нечувствителен к помехам, которые обычно возникают у датчиков с мембраной (сероводород, хлор, аммоний и другие).
Простота обслуживания
Датчик не требует частой калибровки. Включает средства диагностики состояния датчика. Работает с очень малыми отклонениями в течение длительного периода времени. Быстро реагирует на изменения концентрации кислорода и температуры. Обеспечивает стабильные, воспроизводимые результаты ( 5%, перекись водорода >3%, раствор гипохлорита (белизна) >3%, газообразный диоксид серы, газообразный хлор.
источник
Измерение растворенного кислорода в технологических водах котельных и теплосетей. Приборный или химический анализ
А.Г. Кутин, ведущий специалист, ООО «ВЗОР», г. Нижний Новгород
Надежность работы оборудования, трубопроводов котельной и тепловой сети зависит в большой степени от качества водоподготовки, которая, в свою очередь, немыслима без должного контроля на всех участках технологического процесса. Контроль содержания растворенного кислорода в теплоэнергетике является важнейшей задачей для предотвращения повреждаемости металла кислородной коррозией.
Содержание кислорода в технологических водах нормируется жестко и обычно лежит в пределах, не превышающих 50 мкг/дм 3 . В отечественной теплоэнергетике середины-конца прошлого века для контроля содержания растворенного кислорода широко применялись химические методы анализа, изложенные, например, в ОСТ 34-70-953.23-92, ГОСТ-26449.3-85. Наиболее часто применяемым являлся визуально-колориметрический метод с использованием метиленового голубого индикатора, причем персоналом химических лабораторий иногда применялись не только типовые шкалы с максимальным определением кислорода до 100 мкг/дм 3 , но и с более широкими диапазонами до 200 и 400 мкг/дм 3 . Немногим реже встречается использование колориметрического метода с использованием индигокармина. На многих объектах использовались шкалы до 100, 140, 170 мкг/дм 3 . Достаточно редко встречается применение колориметрического метода с использованием сафранина «Т» со шкалой до 30 мкг/дм 3 . В некоторых случаях лабораториями применялся йодометрический анализ с возможностью измерения высоких концентраций (от 200 мкг/дм 3 ) при контроле нарушений в работе оборудования, но применение данного анализа для контроля высоких концентраций кислорода не распространено, т.к. считается, что шкалы колориметрических методов достаточны не только для контроля нормативного содержания кислорода, но и для выявления превышения данных норм.
В последние два десятилетия в российской теплоэнергетике все более широко стали применяться анализаторы растворенного кислорода.
Опыт внедрения кислородомеров МАРК производства ООО «ВЗОР» более чем на 300 ТЭС и теплосетей России и ближнего зарубежья показал, что многие объекты работали с существенными нарушениями норм растворенного кислорода, и данные нарушения не всегда выявлялись колориметрическими методами, а йодометрический метод для определения высоких концентраций кислорода не применялся лабораториями, т.к. считалось, что нарушений нет либо они незначительны. Иногда, в случаях несоответствия показаний приборов и химического анализа, правильность показаний кислородомеров ставилась под сомнение как персоналом химических лабораторий, так и руководством. Необходимо отметить, что анализаторы растворенного кислорода МАРК всех поколений, включая самые ранние разработки, включены в госреестр СИ РФ. Также главным конструктором ООО «ВЗОР» Родионовым А.К. опубликована методика проверки такой важнейшей характеристики датчиков растворенного кислорода приборов МАРК как линейность [1]. Данная методика позволяет проверить погрешность прибора на всем диапазоне измерения (от 1-3 до 20000 мкг/дм 3 ) и свидетельствует о высокой линейности характеристики датчиков (отклонение от линейности не более 0,5% на всем диапазоне).
Случаи несоответствия данных, полученных поверенными анализаторами растворенного кислорода и визуально-колориметрическим методом с использованием метиленового голубого, был выявлен и опубликован, например, специалистами ГУП ТЭК-СПб [2]. Выяснилось, что при реально больших концентрациях растворенного кислорода метиленовый голубой реактив дает существенное занижение результатов (рис.1-2).
При концентрации свыше 200 мкг/дм 3 показания, полученные кислородомером, совпадают с методом Винклера, при этом анализ с использованием метиленового голубого не только не показывает высоких концентраций, но и главное, не показывает максимума шкалы 100 мкг/дм 3 , что не позволяет при использовании только лишь этого метода выявить серьезные нарушения в работе теплоэнергетического оборудования.
Для проверки достоверности анализа с применением метиленового голубого реактива авторами статьи была предложена методика насыщения деаэрированной воды кислородом воздуха, диффундирующего через стенки силиконового шланга. При постоянном потоке деаэрированной воды концентрация кислорода в ней оказывается пропорциональной длине шланга. На рис. 3 показаны результаты замеров приборным методом и методом с использованием метиленового голубого. Как видно из графиков, зависимость результатов измерений метиленовым голубым от длины шланга является весьма нелинейной. Результаты существенно занижены по сравнению с результатами приборного анализа.
Подобный метод позволяет оперативно и наглядно проводить «сверку» показаний кислородомеров с результатами химического анализа. Метод неоднократно использовался специалистами ООО «ВЗОР» совместно со специалистами теплоэнергетических предприятий для анализа качества проводимых кислородных измерений. На одной из ТЭС был проведен опыт сличения результатов замеров поверенным анализатором растворенного кислорода с результатами анализа двумя химическими методами, применявшимися на данной ТЭС. До этого между собой на станции два метода никогда не сравнивались. Результаты испытаний приведены на рис. 4.
Как видно из эксперимента, показания кислородомера пропорциональны длине шланга, показания химических анализов не только ниже, но, главное, не соответствуют друг другу, отличаясь в 2-3 раза. Сходимость есть только на нулевой точке.
В некоторых случаях при выявлении серьезных нарушений в работе энергетического оборудования с помощью кислородомера проводилась проверка реакции метода с использованием метиленового голубого на сырой воде, насыщенной кислородом (табл. 1).
Таблица 1. Пример искажения измерений при использовании метиленового голубого.
Очевидно, что в сырой недеаэрированной воде содержание растворенного кислорода составляет несколько тысяч микрограмм на литр и соответственно колориметрический метод должен давать окраску, соответствующую максимальному значению по шкале. Иногда это выполняется, однако выявлены десятки случаев, когда максимальной окраски не получалось, метод показывал некое промежуточное значение, что является ошибкой измерения в 50-200 (!) раз. Метод с индигокармином не давал максимальной окраски в сырой воде дважды за всю историю сравнений. При сравнении результатов приборного анализа с методом с использованием сафранина «Т» расхождений не было выявлено ни разу. В итоге можно отметить, что наиболее часто применяемый метод с использованием метиленового голубого может давать существенное занижение результатов при анализе растворенного кислорода и, как следствие, не удается выявить и устранить нарушения ведения водно-химического режима.
Надо отметить, что на достаточно большом количестве объектов при внедрении анализаторов растворенного кислорода их показания соответствовали результатам химического анализа. Как правило, на этих станциях концентрация растворенного кислорода не превышала установленных норм, а нарушения выявлялись и своевременно устранялись. Персонал таких объектов, в первую очередь, и отказывался от химического анализа в пользу приборного контроля. Причинами же серьезных искажений при измерении растворенного кислорода визуально-колориметрическими методами может быть как низкое качество химреактивов, так и ошибки персонала при проведении анализа. Для примера ниже показаны результаты измерений относительно высокой концентрации кислорода разными методами и разными операторами. Виден исключительно большой разброс полученных результатов (табл. 2).
Таблица 2. Результаты измерения кислорода различными методами и операторами.
| ГРЭС, прямоточные котлы, блоки 300 МВт | |
| метод | питательная вода |
| МАРК-ЗОЗТ, МАРК-409, мкг/л | 200-205 |
| Индигокарминовый, мкг/л | 90 |
| Метод Винклера (лаборант), мкг/л | 480 |
| Метод Винклера (инженер), мкг/л | 320 |
На данный момент подавляющее большинство химических лабораторий тепловых электростанций и тепловых сетей РФ перешли на приборный контроль растворенного кислорода. Тем не менее, есть объекты, где применение кислородомеров саботируется инженерным персоналом и лаборантами, либо находится под запретом руководства из-за высоких показаний и выявления неудовлетворительного кислородного режима. В журнале фиксируются некие нормативные цифры, полученные с помощью визуально-колориметрического анализа, притом что на объектах и теплосетях выявляются высокие уровни язвенной кислородной коррозии.
Анализ опыта внедрений кислородомеров МАРК на многих ТЭС показал, что примерно в 30% случаях, даже при использовании исправного поверенного анализатора растворенного кислорода, результат измерения оказывается некорректным. Самой распространенной ошибкой персонала было применение силиконовых присоединительных шлангов для подачи пробы к проточным кюветам. Диффузия кислорода из атмосферного воздуха приводила к сильным завышениям результатов. Типовые шланги из резины либо ПВХ не допускают диффузии кислорода из атмосферы в пробу. Тем не менее, они имеют свойство накапливать кислород в стенках при нахождении на воздухе, и при малых потоках пробы результаты могут быть завышены на несколько микрограмм. Рекомендуемая скорость потока через кювету датчика должна быть в пределах 400-800 мл/мин, однако на многих пробоотборных точках такой поток обеспечить невозможно в силу ряда причин, в первую очередь, проблем с охлаждением. Предприятием ВЗОР разработан принципиально новый кислородомер, адаптированный к реальным условиям эксплуатации на отечественных ТЭС и котельных.
Рис. 5. Измерительный узел кислородомера.
Конструкция их измерительного узла (см. рис. 5) позволяет отказаться от применения классических гибких шлангов для подачи пробы. Датчик с помощью специального устройства крепится на любую пробоотборную линию диаметром от 5 до 20 мм. Отказ от гибких полимерных шлангов позволяет производить измерения на любых, даже сверхмалых, скоростях потока (от 25 мл/мин) и производить измерения без искажений остаточным кислородом с внутренних стенок подводящих шлангов. Типовое время измерения 2-3 минуты. Также расширен температурный диапазон прибора, можно производить измерения на пробах с температурой до 70 О С.
1. Родионов А.К. Методика измерения метрологических характеристик датчика растворенного кислорода // Теплоэнергетика. 2009. № 7. С. 2-6.
источник