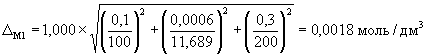Соль и перец – две основные специи современной русской кухни. С первой отношение у людей складываются довольно противоречиво. В семнадцатом веке люди в Москве устроили бунт, названный впоследствии Соляным. Его причиной стало повышение цен на продукт, без которого невозможно представить себе консервацию, закваску и хранение мясо в то время. А вот в наши дни люди отказываются от его использования. Потому что врачи и диетологи нам твердят о вредности поваренной соли. Но так ли это?
Прежде чем бездумно следовать моде и отказываться от поваренной соли нужно разобраться, что это такое и почему она веками была так нужна человечеству. Этот пищевой продукт химики называют хлорид натрия (NaCl). И он действительно жизненно необходим человеческому организму. Хлор участвует в образование желудочного сока. А вот многофункциональный натрий:
- поддерживает водно-солевой баланс и осмотическое давление в кровеносных и лимфатических сосудах;
- участвует в передаче нервных импульсов, транспортировке аминокислот и глюкозы через клеточные мембраны;
- помогает снабжать ткани кислородом и способствует усвоению питательных веществ;
- отвечает за сокращение мышечных волокон.
Естественно, во всем нужна мера. Суточная норма потребления этого макроэлемента составляет 1300 мг для взрослого человека и уменьшается вместе с возрастом. Но вот откуда нам ждать опасности: от соленых продуктов или от солей натрия в питьевой воде.
В природе любой водный источник в своем составе может похвастаться многими элементами периодической системы. В то числе, натрием. Этот мягкий металл попадает в грунтовые и артезианские воды в результате размывания магматических пород. В реках и озерах этот загрязнитель оказывается вместе со стоками промышленных предприятий, канализационными отходами, удобрениями с орошаемых сельскохозяйственных полей и ферм. В результате круговорота веществ в Мировом океане и отсутствия или неисправности водоочистных сооружений, он оказывается в водопроводе или скважине. Предельно допустимая концентрация (ПДК) натрия в воде составляет 200 мг/дм³. Превышение этого уровня негативно сказывается на здоровье. Первыми сигналами большого количества Na будут:
- отечность;
- тошнота;
- потеря аппетита;
- тяжелая отдышка;
- сильная жажда;
- высокое давление;
- гиперактивность;
- судороги в мышцах.
В дальнейшем избыток натрия в воде может привести к серьезным нарушениям в работе почек и сердечно-сосудистой системы.
Мы не будем разбираться в том, кто в этом виноват. Мы поделимся решением проблемы с вечным лозунгом: «Что делать?». Солоноватый (а иногда даже с привкусом горечи) вкус воды говорит о содержании большого количества натрия в воде. Чтобы узнать точное значение, закажите химический анализ в лаборатории «ИОН». Наши сотрудники работают оперативно и качественно: консультанты помогут подобрать нужный анализ, курьеры в кратчайшие сроки отберут пробу, соблюдая все тонкости и правила забора (если вы решите отвезти ее самостоятельно, ознакомьтесь с инструкцией). Лаборанты определяют количество металла методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и разрабатывают рекомендации для дальнейшей работы – установки очистных сооружений.
Большинство регионов России отличаются повышенным содержанием кальция в скважинах и водопроводах. Это объясняется природными процессами. К ним можно отнести выветривание, размывание грунтовыми источниками горных и осадочных пород.
источник
Натрий является одним из главных компонентов химического состава природных вод и по распространённости среди катионов стоит на первом месте, составляя больше половины их общего содержания.
Основными источниками поступления натрия в поверхностные воды суши являются изверженные, осадочные породы и самородные растворимые хлористые (галит, сильвинит) и сернокислые (мирабилит) соли натрия. Кроме того, натрий поступает в природные воды с хозяйственно-бытовыми и промышленными сточными водами и с водами, сбрасываемыми с орошаемых полей. Источником его также могут быть засоленные почвы, из которых он вымывается атмосферными осадками. Большое значение имеют и биологические процессы, протекающие на водосборе, в результате которых образуются растворимые соединения натрия.
Натрий обладает высокой миграционной способностью, что обусловлено хорошей растворимостью его соединений в воде, слабо выраженной способностью к сорбции взвесями и донными отложениями. В поверхностных водах натрий мигрирует преимущественно в растворённом состоянии в виде иона. Концентрация его в речных водах колеблется от первых единиц до сотен миллиграммов в кубическом дециметре в зависимости от физико-географических условий и геологических особенностей бассейнов водных объектов. Обычно в поверхностных водах суши концентрация натрия не превышает 300 мг/дм 3 , но в некоторых случаях может достигать граммов в кубическом дециметре (например, в солёных озерах, небольших реках засушливых регионов с преимущественно подземным питанием).
В подземных водах концентрация натрия колеблется в более широких пределах — от миллиграммов до граммов и десятков граммов в кубическом дециметре. Это определяется составом водовмещающих пород, глубиной залегания подземных вод и другими условиями.
Внутригодовые изменения концентрации хлоридов в поверхностных водах суши связаны, в основном, с гидрологическим режимом водных объектов.
Для водных объектов рыбохозяйственного назначения предельно-допустимая концентрация (ПДК) натрия составляет 120 мг/дм 3 ; для объектов хозяйственно-питьевого и культурно-бытового назначения ПДК равна 200 мг/дм 3 .
МАССОВАЯ КОНЦЕНТРАЦИЯ НАТРИЯ В ВОДАХ.
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ С
ИОНСЕЛЕКТИВНЫМ ЭЛЕКТРОДОМ
1.1 Настоящий руководящий документ устанавливает методику выполнения измерений (далее — методика) массовой концентрации натрия в природных и очищенных сточных водах в диапазоне от 0,23 до 2300 мг/дм 3 потенциометрическим методом с ионселективным электродом.
При анализе проб воды с массовой концентрацией натрия, превышающей 2300 мг/дм 3 , допускается выполнение измерений после разбавления пробы дистиллированной водой таким образом, чтобы массовая концентрация натрия в разбавленной пробе находилась в пределах указанного выше диапазона измеряемых концентраций.
1.2 Настоящий руководящий документ предназначен для использования в лабораториях, осуществляющих анализ природных и очищенных сточных вод.
В настоящем руководящем документе использованы ссылки на следующие нормативные документы
ГОСТ 12.1.005-88 ССБТ Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 ССБТ Вредные вещества Классификация и общие требования безопасности
ГОСТ 17.15.04-81 Охрана природы Гидросфера Приборы и устройства для отбора, первичной обработки и хранения проб природных вод Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
МИ 2881-2004 Рекомендация. ГСИ. Методики количественного химического анализа. Процедуры проверки приемлемости результатов анализа.
Примечание — Ссылки на остальные нормативные документы приведены в разделах 4, А.3, А.4.
3.1 При соблюдении всех регламентируемых методикой условий проведения измерений характеристики погрешности результата измерения с вероятностью 0,95 не должны превышать значений, приведенных в таблице 1.
Таблица 1 — Диапазон измерений, значения характеристик погрешности и ее составляющих при принятой вероятности Р = 0,95
Показатель повторяемости (среднеквадратическое отклонение повторяемости)
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости)
Показатель правильности (границы систематической погрешности)
Показатель точности (границы погрешности)
При выполнении измерений в пробах с массовой концентрацией натрия свыше 2300 мг/дм 3 после соответствующего разбавления погрешность измерений массовой концентрации натрия в исходной пробе ± D находят по формуле
где ± D 1 — показатель точности измерения массовой концентрации натрия в разбавленной пробе, рассчитанный по уравнению таблицы 1;
Предел обнаружения натрия потенциометрическим методом равен 0,2 мг/дм 3 .
3.2 Значения показателя точности методики используют при:
— оформлении результатов измерений, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения измерений;
— оценке возможности использования результатов измерений при реализации методики в конкретной лаборатории.
4.1.1 Мономер любого типа или рН-метр, работающий в режиме милливольтметра, снабжённый магнитной мешалкой (например, И-500, ТУ 4215-002-18294344-02; «Экотест-2000», ТУ 4215-005-41541647-99 и др.).
4.1.2 Электрод измерительный ЭСЛ-51-07, ТУ 25-05.1744-77, ЭС-10-07, ТУ 25-0519.072-86, или другого типа с аналогичными характеристиками.
4.1.3 Электрод вспомогательный хлорсеребрянный ЭВЛ-1МЗ, ТУ 25.05.2181-77 с минимальной скоростью истечения раствора хлорида калия через ключ (не более 1,0 см 3 в сутки) или другого типа с аналогичными характеристиками.
4.1.4 Весы лабораторные высокого (II) класса точности по ГОСТ 24104-2001.
4.1.5 Весы лабораторные среднего (III) класса точности по ГОСТ 24104-2001 с наибольшим пределом взвешивания 500 г.
4.1.6 Термометр с диапазоном измерения температур от 0 °С до 50 °С и ценой деления не более 0,5 °С, по ГОСТ 29224-91.
4.1.7 Колбы мерные 2 класса точности исполнения 2, 2а по ГОСТ 1770-74 вместимостью 100 см 3 — 9 шт., 200 см 3 — 4 шт., 500 см 3 — 1 шт.
4.1.8 Пипетки градуированные 2 класса точности исполнения 1, 2 по ГОСТ 29227-91 вместимостью 1 см 3 — 1 шт., 2 см 3 — 2 шт., 5 см 3 — 3 шт.
4.1.9 Пипетки с одной отметкой 2 класса точности исполнения 2, по ГОСТ 29169-91 вместимостью 5 см 3 — 3 шт., 10 см 3 — 1 шт., 20 см — 3 шт., 25 см — 1 шт.
4.1.10 Цилиндры мерные исполнения 1, 2 по ГОСТ 1770-74 вместимостью 50 см 3 — 2 шт., 100 см 3 — 1 шт., 500 см 3 — 1 шт.
4.1.11 Стаканы В-1, ТХС по ГОСТ 25336-82 вместимостью 50 см 3 — 30 шт., 250 см 3 — 2 шт., 600 см 3 — 1 шт., 1000 см 3 — 1 шт.
4.1.12 Стаканчик для взвешивания (бюкс) СВ-24/10 по ГОСТ 25336-82 — 1 шт.
4.1.13 Воронки лабораторные, тип В по ГОСТ 25336-82 диаметром 56 мм — 2 шт.
4.1.14 Чашка выпарительная № 2 по ГОСТ 9147-80.
4.1.15 Эксикатор исполнения 2 с диаметром корпуса 140 мм или 190 мм по ГОСТ 25336-82.
4.1.16 Посуда полиэтиленовая (полипропиленовая) для хранения проб и растворов вместимостью 0,1; 0,25; 1 дм 3 .
4.1.17 Электроплитка с закрытой спиралью по ГОСТ 14919-83.
4.1.18 Шкаф сушильный общелабораторного назначения с диапазоном температур до 300 °С.
Примечание — Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2.1 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, х.ч.
4.2.2 Калий хлористый (хлорид калия) по ГОСТ 4234-77, х.ч.
4.2.4 Кислота соляная по ГОСТ 3118-77, х.ч.
4.2.5 Кальций углекислый (кальция карбонат) по ГОСТ 4530-76, х.ч. или кальция хлорид импортный с содержанием натрия не более 0,01 %.
4.2.6 Хлорид кальция обезвоженный, ТУ 6-09-4711-81, ч. (для эксикатора).
4.2.6 Вода дистиллированная по ГОСТ 6709-72.
4.2.7 Фильтры мембранные «Владипор МФАС-ОС-2», 0,45 мкм, ТУ 6-55-221-1-29-89 или другого типа, равноценные по характеристикам или фильтры бумажные обеззоленные «синяя лента», ТУ 6-09-1678-86.
4.2.8 Фильтровальная бумага по ГОСТ 12026-76.
Примечание — Допускается использование реактивов, изготовленных по другой нормативно- технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
Выполнение измерений основано на изменении потенциала ионселективного электрода в зависимости от активности ионов натрия в растворе. Измерения проводят в присутствии аммиака и индифферентного электролита (хлорида кальция), поддерживающих в анализируемом растворе определенное значение рН и ионной силы, что позволяет градуировать прибор в единицах концентрации, а не активности ионов натрия. Концентрацию натрия в пробе находят, исходя из градуировочной зависимости величины электродного потенциала от значения обратного логарифма активности (концентрации) ионов натрия ( pNa ).
6.1 При выполнении измерений массовой концентрации натрия в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в национальных стандартах и соответствующих нормативных документах.
6.2 По степени воздействия на организм вредные вещества, используемые при выполнении измерений, относятся к 3, 4 классам опасности по ГОСТ 12.1.007.
6.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
6.4 Особых требований по экологической безопасности не предъявляется.
К выполнению измерений допускаются лица со средним профессиональным образованием или без профессионального образования, но имеющие стаж работы в лаборатории не менее года и освоившие методику анализа.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— температура окружающего воздуха (22 ± 5) °С;
— атмосферное давление от 84,0 до 106,7 кПа (от 630 до 800 мм рт. ст.);
— влажность воздуха не более 80 % при 25 °С;
— напряжение в сети (220 ± 10) В;
— частота переменного тока в сети питания (50 ± 1) Гц.
Отбор проб для выполнения измерений массовой концентрации натрия производится в соответствии с ГОСТ 17.1.5.05 и ГОСТ Р 51592. Оборудование для отбора проб должно соответствовать ГОСТ 17.1.5.04 и ГОСТ Р 51592. Пробы помещают в плотно закрывающуюся полиэтиленовую или полипропиленовую посуду. Мутные пробы фильтруют через мембранный фильтр 0,45 мкм, очищенный кипячением в дистиллированной воде, или бумажный фильтр «синяя лента». Первые порции фильтрата отбрасывают. Объем отбираемой пробы не менее 100 см 3 .
10.1.1 Раствор хлорида кальция, 1 моль/дм 3
10.1.1.1 При наличии в лаборатории хлорида кальция необходимой степени чистоты, взвешивают в химическом стакане вместимостью 250 см 3 110 г хлорида кальция 6-водного или 56 г безводного и растворяют в дистиллированной воде. Раствор количественно переносят в мерную колбу вместимостью 500 см 3 . Объем раствора доводят дистиллированной водой до метки на колбе и перемешивают.
10.1.1.2 Для приготовления раствора из карбоната кальция взвешивают в химическом стакане вместимостью 600 см 3 50 г карбоната кальция, смачивают его 60 — 80 см 3 дистиллированной воды и медленно (вначале — по каплям) приливают при перемешивании 90 см 3 соляной кислоты. Выдерживают до растворения карбоната и проверяют рН универсальной индикаторной бумагой. Значение рН должно быть в пределах от 5 до 7. Если в полученном растворе рН оказался ниже 5, следует добавить несколько капель аммиака до получения требуемого значения рН. Раствор количественно переносят в мерную колбу вместимостью 500 см 3 . Объем раствора доводят дистиллированной водой до метки на колбе и перемешивают.
10.1.1.3 Хранят раствор хлорида кальция в плотно закрытой полиэтиленовой или полипропиленовой посуде.
10.1.2 Раствора аммиака 0,1 моль/дм 3
В стакан вместимостью 1000 см 3 помещают 500 см 3 дистиллированной воды, приливают пипеткой 3,8 см аммиака водного и перемешивают. Хранят раствор в плотно закрытой полиэтиленовой или полипропиленовой посуде.
10.1.3 Насыщенный раствор хлорида калия
В 140 см 3 дистиллированной воды при температуре 50 — 60 °С растворяют 60 г хлорида калия. После охлаждения используют раствор над осадком для заполнения вспомогательного электрода.
10.2.1 Градуировочные растворы готовят из аттестованного раствора с массовой концентрацией натрия 22,99 г/дм 3 (молярной концентрацией 1,000 моль/дм 3 ). Методика приготовления аттестованного раствора приведена в приложении А.
10.2.2 Для приготовления градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 аттестованного раствора с молярной концентрацией 1,000 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 1,00.
10.2.3 Для приготовления градуировочного раствора № 2 с молярной концентрацией натрия 2,50 · 10 -2 моль/дм 3 отбирают пипеткой с одной отметкой 25,0 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 1,60.
10.2.4 Для приготовления градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,00.
10.2.5 Для приготовления градуировочного раствора № 4 с молярной концентрацией натрия 5,00 · 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 1 с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,30.
10.2.6 Для приготовления градуировочного раствора № 5 с молярной концентрацией натрия 2,00 × 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см 3 градуировочного раствора № 3 с молярной концентрацией натрия 1,00 × 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 2,70.
10.2.7 Для приготовления градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 отбирают пипеткой с одной отметкой 20,0 см градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 200 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,00.
10.2.8 Для приготовления градуировочного раствора № 7 с молярной концентрацией натрия 5,00 · 10 -4 моль/дм 3 отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 3 с молярной концентрацией натрия 1,00 · 10 -2 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,30.
10.2.9 Для приготовления градуировочного раствора № 8 с молярной концентрацией натрия 2,00 · 10 -44 моль/дм 3 отбирают пипеткой с одной отметкой 20,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 3,70.
10.2.10 Для приготовления градуировочного раствора № 9 с молярной концентрацией натрия 1,00 · 10 -4 моль/дм отбирают пипеткой с одной отметкой 10,00 см градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,00.
10.2.11 Для приготовления градуировочного раствора № 10 с молярной концентрацией натрия 5,00 · 10 -5 моль/дм отбирают пипеткой с одной отметкой 5,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,30.
10.2.12 Для приготовления градуировочного раствора № 11 с молярной концентрацией натрия 2,00 · 10 -5 моль/дм 3 отбирают градуированной пипеткой 2,00 см градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 4,70.
10.2.13 Для приготовления градуировочного раствора № 12 с молярной концентрацией натрия 1,00 · 10 -5 моль/дм 3 отбирают градуированной пипеткой 1,00 см 3 градуировочного раствора № 6 с молярной концентрацией натрия 1,00 · 10 -3 моль/дм 3 , помещают его в мерную колбу вместимостью 100 см 3 , доводят дистиллированной водой до метки и перемешивают. Полученному раствору приписывают величину pNa равную 5,00.
10.2.14 Градуировочные растворы натрия хранят в полиэтиленовой или полипропиленовой посуде с плотно закрывающейся пробкой. Градуировочные растворы № 1 — 3 хранят не более 3 мес, растворы № 4 — 6 — не более мес, № 7 — 12 не более недели.
Подготовку иономера, измерительного и вспомогательного электродов к работе осуществляют в соответствии с руководством по эксплуатации или паспортом.
Вспомогательный электрод хранят в насыщенном растворе хлорида калия.
Измерительный электрод между измерениями следует хранить в растворе с молярной концентрацией натрия 1,00 · 10 -1 моль/дм 3 , не допуская высыхания мембраны электрода. Перед выполнением измерений электрод выдерживают в дистиллированной воде в течение часа.
10.4.1 Для установления градуировочных зависимостей в диапазоне pNa от 2,70 до 5,00 в три стакана вместимостью 50 см 3 мерным цилиндром вместимостью 50 см 3 вносят по 30 см 3 каждого из градуировочных растворов № 5 — 12, добавляют в каждый стакан по 2,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см раствора аммиака, 0,1 моль/дм 3 .
10.4.2 Для установления градуировочных зависимостей в диапазоне pNa от 1,00 до 2,70 в три стакана вместимостью 50 см 3 мерным цилиндром вместимостью 50 см 3 вносят по 30 см 3 каждого из градуировочных растворов № 1 — 5, добавляют в каждый стакан по 4,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
10.4.3 Один из трех стаканов устанавливают на магнитную мешалку, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и перемешивают раствор в течение 3 мин. Затем этот стакан убирают (не регистрируя значение потенциала), помещают на мешалку стакан со второй аликвотой этого же градуировочного раствора, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и после установления постоянного значения потенциала записывают показания иономера. Повторяют измерение с третьей аликвотой этого градуировочного раствора.
10.4.4 Измерения проводят, начиная от меньшей концентрации натрия ( pNa = 5,00) к большей (pNa = 1,00). За результат принимают среднее арифметическое двух измерений. Градуировочные зависимости для диапазонов pNa от 5,00 до 4,00 включительно, от 4,00 до 2,70 включительно и от 2, 70 до 1,00 включительно рассчитывают методом наименьших квадратов в координатах: значения pNa градуировочных растворов (отрицательный логарифм молярной концентрации натрия — lg [Na + ]) — соответствующие им значения потенциала в милливольтах. Одновременно измеряют и записывают температуру градуировочных растворов. Разница в температуре для разных градуировочных растворов не должна составлять более 1 °С.
10.4.5 Градуировочные зависимости устанавливают перед каждой серией измерений массовой концентрации натрия в пробах воды, а также при замене измерительного и (или) вспомогательного электродов.
Допускается устанавливать градуировочные зависимости для одного или двух диапазонов pNa, если в анализируемых пробах воды концентрация натрия не выходит за их пределы.
10.4.6 Если руководством по эксплуатации прибора предусмотрен иной способ установления градуировочной зависимости (градуировки), то допускается устанавливать её в соответствии с руководством по эксплуатации данного прибора для каждого из диапазонов, указанных в 10.4.4. Установление одной градуировочной зависимости для всего диапазона измеряемых концентраций не допускается.
В том случае, когда градуировочные зависимости для конкретного прибора устанавливают по меньшему числу градуировочных растворов, чем предусмотрено в 10.4.1 и 10.4.2, после их установления следует выполнить контроль стабильности градуировочных характеристик в соответствии с 10.5.
10.5.1 Средствами контроля являются градуировочные растворы № 1 — 12 по 10.2 (не менее 2-х растворов для каждого диапазона). Градуировочная характеристика считается стабильной при выполнении условия
где X — результат контрольного измерения массовой концентрации натрия в градуировочном растворе, мг/дм 3 ;
С m — приписанное значение массовой концентрации натрия в градуировочном растворе, мг/дм 3 ;
s R — показатель воспроизводимости для концентрации С, мг/дм 3 (таблица 1).
10.5.2 Если условие стабильности не выполняется для одного градуировочного раствора, необходимо выполнить повторное измерение этого раствора для исключения результата, содержащего грубую погрешность. При повторном невыполнении условия, выясняют причины нестабильности, устраняют их и повторяют измерения. Если градуировочная характеристика вновь не будет удовлетворять условию (1), устанавливают новую градировочную зависимость, либо проводят измерения в режиме милливольтметра и устанавливают градуировочные зависимости согласно 10.4.1 — 10.4.4.
11.1 В три стакана вместимостью 50 см 3 вносят мерным цилиндром вместимостью 50 см 3 по 30 см 3 анализируемой пробы, добавляют в каждый стакан по 2,0 см раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
Один из трех стаканов устанавливают на магнитную мешалку, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и перемешивают пробу в течение 3 мин. Затем этот стакан убирают (не регистрируя значение потенциала), помещают на мешалку стакан со второй аликвотой пробы, погружают в раствор перемешивающий элемент, измерительный и вспомогательный электроды, включают мешалку и после установления постоянного значения потенциала записывают показания иономера. Повторяют измерение с третьей аликвотой пробы. По окончании измерения электроды отмывают дистиллированной водой. Отмывание электродов происходит достаточно быстро при её трехкратной замене. Остатки воды с поверхности электрода удаляют фильтровальной бумагой.
Температура анализируемых проб не должна отличаться от температуры градуировочных растворов более, чем на ± 1 °С.
11.2 Если величина измеренного потенциала ниже, чем потенциал соответствующий значению pNa 2,70 градуировочной зависимости, повторяют измерения, добавляя в пробу 4,0 см 3 раствора хлорида кальция, 1 моль/дм 3 , и 1,0 см 3 раствора аммиака, 0,1 моль/дм 3 .
11.3 Выполнению измерений натрия с ионселективным электродом могут мешать высокие концентрации калия (30-кратный избыток по отношению к натрию), магния (10-кратный избыток), лития (концентрации, превышающие концентрацию натрия), однако для природных и очищенных сточных вод такие мешающие влияния маловероятны.
Наиболее существенное влияние на результаты измерения натрия оказывает концентрация ионов водорода (рН среды). Для получения правильных результатов разность (рН — pNa) должна быть более 3, что достигается подщелачиванием анализируемых проб раствором аммиака.
12.1 Значения pNa в анализируемых пробах воды находят по соответствующей градуировочной зависимости. Массовую концентрацию натрия X, мг/дм 3 , рассчитывают по следующим соотношениям:
pNa = — lg[ Na + ]; [ Na + ] = 10 — pNa , моль/дм 3 ;
X = 10 — pNa · 22,99 · 10 3 мг/дм 3
или находят по таблице Б.1 (см. приложение Б) для значений pNa в диапазоне от 3,00 до 4,00 включ. Массовую концентрацию натрия в мг/дм 3 для значений pNa от 2,00 до 3,00 включ. и от 1,00 до 2,00 включ. получают, увеличивая табличные значения в диапазоне от 3,00 до 4,00 включ., имеющие одинаковые значения дробной части, в 10 и в 100 раз, соответственно, а для значений pNa от 4,00 до 5,00 — уменьшая в 10 раз.
Например, pNa 3,10 соответствует 18,2 мг/дм 3 ионов натрия, pNa 2,10 — 182 мг/дм 3 , pNa 4,10 — 1,82 мг/дм 3 .
При использовании для выполнения измерений иономера, имеющего программу обработки данных, значение массовой концентрации натрия считывают непосредственно с дисплея.
12.2 Результат измерений в документах, предусматривающих его использование, представляют в виде
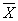
где 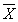
± D — границы характеристики погрешности результатов измерений для данной массовой концентрации натрия (таблица 1).
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности, которые не должны содержать более двух значащих цифр.
12.3 Допустимо представлять результат в виде:
X ± D л Р = 0,95, при условии D л D , (5)
где ± D л — границы характеристики погрешности результатов измерений, установленные при реализации методики в лаборатории и обеспечиваемые контролем стабильности результатов измерений.
12.4 Результаты измерений оформляют протоколом или записью в журнале, по формам, приведенным в Руководстве по качеству лаборатории.
13.1.1 Контроль качества результатов измерений при реализации методики в лаборатории предусматривает:
— оперативный контроль исполнителем процедуры выполнения измерений (на основе оценки повторяемости, погрешности при реализации отдельно взятой контрольной процедуры);
— контроль стабильности результатов измерений (на основе контроля стабильности среднеквадратического отклонения повторяемости, внутрилабораторной прецизионности, погрешности).
13.1.2 Периодичность контроля исполнителем процедуры выполнения измерений, а также реализуемые процедуры контроля стабильности результатов выполняемых измерений регламентируются в Руководстве по качеству лаборатории.
13.2.1 Контроль повторяемости осуществляют для каждого из результатов измерений, полученных в соответствии с методикой. Для этого отобранную пробу воды делят на три части, и выполняют измерения в соответствии с разделом 11.
13.2.2 Результат контрольной процедуры r к , мг/дм 3 , рассчитывают по формуле
где X 1 , Х2 — результаты единичных измерений массовой концентрации натрия в пробе, мг/дм 3 .
13.2.3 Предел повторяемости rn, мг/дм 3 , рассчитывают по формуле
где s r — показатель повторяемости, мг/дм 3 (таблица 1).
13.2.4 Результат контрольной процедуры должен удовлетворять условию
13.2.5 При несоблюдении условия (8) выполняют еще два измерения и сравнивают разницу между максимальным и минимальным результатами с нормативом контроля равным 3,6 s r . В случае повторного превышения предела повторяемости, поступают в соответствии с разделом 5 ГОСТ Р ИСО 5725-6.
13.3 Алгоритм оперативного контроля процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления проб
13.3.1 Оперативный контроль процедуры выполнения измерений с использованием метода добавок совместно с методом разбавления пробы проводят, если массовая концентрация натрия в рабочей пробе составляет 1,0 мг/дм 3 и более. В противном случае оперативный контроль проводят с использованием метода добавок согласно 13.4. Для введения добавок используют аттестованный раствор натрия (см. приложение А).
13.3.2 Оперативный контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.3.3 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
Кк = 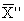
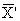
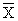
где 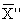

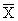
С — концентрация добавки, мг/дм 3 .
13.3.4 Норматив контроля К1, мг/дм 3 , рассчитывают по формуле
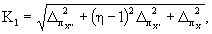
где 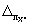
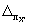
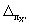
Примечание. Допустимо характеристику погрешности результатов измерений при внедрении методики в лаборатории устанавливать на основе выражения: 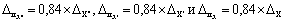
13.3.5 Если результат контрольной процедуры удовлетворяет условию:
процедуру анализа признают удовлетворительной.
При невыполнении условия (11) контрольную процедуру повторяют. При повторном невыполнении условия (11), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
13.4.1 Контроль исполнителем процедуры выполнения измерений проводят путем сравнения результатов отдельно взятой контрольной процедуры Кк с нормативом контроля К.
13.4.2 Результат контрольной процедуры Кк, мг/дм 3 , рассчитывают по формуле
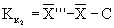
где 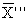
13.4.3 Норматив контроля погрешности К, мг/дм 3 , рассчитывают по формуле
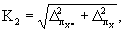
где 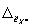
Примечание — Допустимо для расчета норматива контроля использовать значения характеристик погрешности, полученные расчетным путем по формулам 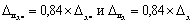
13.4.4 Если результат контрольной процедуры удовлетворяет условию
процедуру признают удовлетворительной.
При невыполнении условия (14) контрольную процедуру повторяют. При повторном невыполнении условия (14), выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры по их устранению.
14.1 Расхождение между результатами измерений, полученными в двух лабораториях, не должно превышать предела воспроизводимости R . При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение. Значение предела воспроизводимости рассчитывают по формуле
14.2 При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов измерений согласно разделу 5 ГОСТ Р ИСО 5725-6 или МИ 2881.
14.3 Проверку приемлемости проводят при необходимости сравнения результатов измерений, полученных двумя лабораториями.
А.1 Назначение и область применения
Настоящая методика регламентирует процедуру приготовления аттестованного раствора натрия, предназначенного для установления градуировочных характеристик иономера и контроля точности результатов измерений массовой концентрации натрия в природных и очищенных сточных водах потенциометрическим методом.
А.2 Метрологические характеристики
Метрологические характеристики аттестованного раствора приведены в таблице А.1.
Таблица А.1 — Метрологические характеристики аттестованного раствора AP1-Na
Значение характеристики для аттестованного раствора AP1-Na
Аттестованное значение концентрации натрия
Границы погрешности аттестованного значения концентрации натрия (Р = 0,95)
А.3.1 Весы лабораторные высокого (II) класса точности по ГОСТ 24104-2001.
А.3.2 Колбы мерные 2 класса точности исполнения 2 по ГОСТ 1770-74 вместимостью 200 см 3 — 1 шт.
А.3.3 Стаканчик для взвешивания (бюкс) по ГОСТ 25336-82 СВ-24/10 .
А.3.4 Воронка лабораторная по ГОСТ 25336-82 диаметром 56 мм.
А.3.5 Чашка выпарительная № 2 по ГОСТ 9147-80.
А.3.6 Эксикатор исполнения 2, диаметром корпуса 190 мм по ГОСТ 25336-82, заполненный обезвоженным хлоридом кальция.
А.3.7 Шкаф сушильный общелабораторного назначения с диапазоном температур до 300 °С.
А.4.1 Натрий хлористый (хлорид натрия) по ГОСТ 4233-77, х.ч., с содержанием основного вещества не менее 99,9 %.
А.4.2 Вода дистиллированная по ГОСТ 6709-72.
А.5 Процедура приготовления аттестованного раствора натрия AP1-Na
Для приготовления аттестованного раствора AP1- Na взвешивают в бюксе с точностью до четвертого знака после запятой 11,6880 г хлорида натрия, предварительно высушенного в сушильном шкафу при температуре от 250 °С до 270 °С в течение 2 ч. Количественно переносят навеску в мерную колбу вместимостью 200 см 3 , растворяют в дистиллированной воде, доводят объём раствора до метки и перемешивают.
Полученному раствору приписывают молярную концентрацию натрия 1,000 моль/дм 3 и массовую концентрацию 22,99 мг/см 3 (г/дм 3 ).
А.6 Расчет метрологических характеристик аттестованного раствора AP 1-Na
А.6.1 Аттестованное значение молярной концентрации натрия M 1 , моль/дм 3 , и массовой концентрации С1, мг/см 3 (г/дм 3 ), рассчитывают по формулам
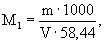
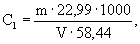
где m — масса навески хлорида натрия, г;
V — вместимость мерной колбы, см 3 .
22,99 и 58,44 — молярная масса иона натрия и хлорида натрия, соответственно, г/моль.
А.6.2 Расчет значений границ погрешности приготовления аттестованного раствора D C1 , г/дм 3 , или D М1 , моль/дм 3 , выполняют по формулам
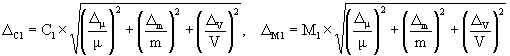
где D m — предельное значение возможного отклонения массовой доли основного вещества ( NaCl ) в реактиве от приписанного значения m , %;
m — массовая доля основного вещества (NaCl) в реактиве, приписанная реактиву квалификации «х.ч.», %;
D m — погрешность взвешивания, г;
D V — предельное значение возможного отклонения вместимости мерной колбы от номинального значения, см 3 .
А.6.3 Погрешности приготовления аттестованного раствора AP 1-Na равны
и
А.7 Требования безопасности
Необходимо соблюдать общие требования техники безопасности при работе в химических лабораториях.
А.8 Требования к квалификации операторов
Аттестованный раствор может готовить инженер или лаборант со средним профессиональным образованием, прошедший специальную подготовку и имеющий стаж работы в химической лаборатории не менее 6 мес.
А.9 Требования к маркировке
На склянку с аттестованным раствором должна быть наклеена этикетка с указанием условного обозначения раствора, величины массовой и молярной концентрации натрия, погрешности ее установления и даты приготовления раствора.
Аттестованный раствор следует хранить в герметично закрытой полиэтиленовой или полипропиленовой посуде при комнатной температуре не более 6 мес.
источник
Химическое обозначение: Na
Синонимы: сода, едкий натр, содий.
Описание: элемент 1 группы 3 периода с атомным номером 11. Мягкий металл серебристого цвета с повышенной способностью вступать в реакции.
Методы определения: потенциометрия, титрование, масс-спектрометрия, атомная абсорбция и эмиссия.
Методики, используемые в Испытательном центре МГУ для определения концентрации натрия в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ЦВ 3.18.05-2005 (ФР.1.31.2005.01714) | масс-спектрометрия | AGILENT 7500A ICP-MS |
| РД 52.24.391-2008 | пламенно-фотометрический | ANALYTIK JENA CONTRAA 300 |
| Почва | ||
| ФР.1.31.2009.06787 | масс-спектрометрия | AGILENT 7500A ICP-MS |
| ФР.1.29.2006.02149 | масс-спектрометрия | AGILENT 7500A ICP-MS |
Контроль измерений проводят на оборудовании: AGILENT 5110 ICP-OES и BRUKER S2 PICOFOX.
Распространённость: в свободном виде натрий не встречается в природе, однако распространён в составе соединений. В земной коре на тонну породы приходится до 25 кг натрия, а в литре морской воды содержание этого элемента превышает 10,6 г. Самая распространённый форма натрия, с которой сталкивается человек — поваренная соль NaСl. Наряду с другими макроэлементами концентрация натрия в воде обуславливает минерализацию воды.
В воде систем централизованного водоснабжения, как и в бутилированной воде, содержание натрия нормируется напрямую. Для бутилированной воды высшей категории концентрация натрия находится в жёстких рамках. Несмотря на наличие положительной роли натрия в работе организма, допускается его полное отсутствие в питьевой воде: это связано с тем, что значительное количество натрия мы получаем с пищей.
Предельно допустимая концентрация (ПДК) натрия в различных водных объектах
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–200 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 0–20 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | 0-200 |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | 0–120 |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Хозяйственно-бытовые стоки Постановление Правительства РФ № 644 | — |
| Ливневые стоки Постановление Правительства РФ № 644 | — |
Норма потребления натрия составляет 5 г в сутки.
Натрий участвует в:
- поддержании постоянного осмотического давления в клетках и тканях;
- перераспределении воды в организме;
- регуляции кислотно-щелочного равновесия;
- проводимости нервных импульсов;
- сокращении мышц;
- пищеварении и всасывании.
При недостатке элемента наблюдаются:
- сокращение содержания воды в жидкой части крови;
- повышение содержания в крови азотсодержащих продуктов метаболизма;
- сокращение объема жидкости, находящейся вне клеток организма.
При избытке натрия наблюдается:
- аккумуляция избытка жидкости в организме;
- рост возбудимости миокарда;
- повышение артериального давления;
- головная боль.
Натрий сам по себе является побочным продуктом фильтрования воды от солей жесткости посредством ионообменных смол. Очень часто излишнее умягчение приводит к повышению содержания натрия и выходу за рамки предельно допустимых концентраций.
- в Вашей воде превышено содержание натрия;
- Вы используете водоподготовительную (фильтрационную) систему;
- жёсткость Вашей воды (согласно результатам испытаний) не превышает 0,5 мг-экв/л.
Вам обязательно нужно настроить умягчитель таким образом, чтобы интенсивность умягчения снизилась, а показатель жёсткости находился в оптимальном диапазоне 1,5–2,5 мг-экв/л. Такая жёсткость воды после умягчения не только позволит сохранить полезные для организма уровни содержания кальция и магния, но и снизить дозу натрия, поступающего в воду при умягчении.
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды натрий. Поскольку метода избирательного удаления натрия из воды нет или он не распространен, удалить излишки натрия из воды можно с помощью обратного осмоса.
Натрий относится к элементам, которые характеризуются как отрицательным, так и положительным влиянием на организм человека. Поэтому необходимо контролировать содержания натрия в питьевой воде и регулировать его содержание таким образом, чтобы концентрация находилась в оптимальном диапазоне.
источник
Еще с древних времен каждому человеку известно о пользе соли для организма. Компонент присутствует на каждом столе, и без него обойтись никто не способен. Значимость данного элемента оспаривать никак нельзя, потому что он влияет на общее состояние человека.
Уже с давних времен врачи диагностировали кровь пациентов на содержание различных микроэлементов. Благодаря этому можно составить точное представление о состоянии человека. Состав крови:
- 90 % воды;
- 8 % белков;
- по 1 % органических веществ и электролитов.
Одним из основных электролитов, чья роль — образование солей, кислот и щелочных соединений, является натрий.
Уже многими специалистами доказано, что потеря компонента происходит через выделение пота при нагрузках, поэтому именно этот элемент нуждается в постоянном пополнении. Под отдельную категорию лиц, которым это делать обязательно необходимо, попадают те, кто занимается спортом.
Также необходимо не забывать и о том, что организм сам не в состоянии вырабатывать натрий в крови. Именно поэтому следует организовывать свое питание таким образом, чтобы элемент поступал внутрь во время еды и при помощи введения различных добавок. Если вы не знаете, где можно найти натрий, то первым продуктом стоит отметить именно соль. Обычная поваренная соль содержит в одной стограммовой порции своего состава 40 процентов натрия.
Помимо этого, существуют еще разнообразные компоненты: соусы различных составов, соленая пища, морская соль и многое другое. Полезнее всего будет употребление морской соли, потому что она дает воде возможность выводиться.
Норма натрия в крови зависит от того, в каком состоянии на данный момент прибывает водный баланс организма:
- Если человек интенсивно теряет воду, то соли натрия накапливаются и их количество возрастает.
- Если же организм получает много жидкости, то натрий в крови из него выводится.
Норма для здорового человека, который уже достиг подросткового возраста, составляет от 130 до 150 ммоль/л. Для взрослого человека натрий, который содержится в эритроцитах, не должен покидать границу от 135 до 220 ммоль/л.
Если говорить о норме выведения, то для взрослого человека она должна оставаться в пределах от 3 до 6 граммов в сутки.
У детей концентрация будет ниже, и находится на отметке от 130 до 140 ммоль/л. Когда речь заходит о норме выведения, то здесь она разнится в зависимости от возраста. Но в целом она составляет от 0,5 до 2,5 граммов в сутки.
Норма калия и натрия в крови, как у взрослых, так и у детей складывается из того, как проходят обменные процессы, и какое питание имеется. Маленькие дети обычно употребляют меньше поваренной соли, а почки у них работают эффективнее, если сравнивать со взрослыми.
Если говорить о роли, то натрий в крови оказывает следующие воздействия:
- Элемент способствует поддержанию давления в крови, а также и водного баланса.
- Перемещение разнообразных аминокислот.
- Перемещение углекислого газа.
- Контроль обмена белков.
- Непосредственное воздействие на выработку желудочного сока.
- Контроль обмена веществ.
- Активизирует работу поджелудочной железы.
- Способен проникать в эпителий и кожу, что увеличивает усвоение витамина Д.
Если говорить о норме натрия, который должен присутствовать каждый день, то это количество составляет 5 граммов. Если перевести на количество поваренной соли, то от 10 до 15 г. В том случае, когда у вас присутствуют сильные физические нагрузки или высокое потоотделение при жарком климате, то количество увеличивается.
Повышенный натрий в крови указывает на состояние, которое называется гипернатриемией. Она бывает как абсолютной, так и относительной. Возникать данное заболевание может по ряду случаев:
- Выплеск всего составляющего гормональной основы в кровь.
- Неправильное количество воды в организме.
- Натрий в крови накоплен из-за большого употребления соленой пищи.
- Имеется заболевание, которое задерживает соль в организме.
Главные симптомы при повышенном натрии:
- сухая кожа;
- стрессовое состояние;
- скачки давления;
- непроизвольное дрожание конечностей;
- напряжение в мышцах.
Это главные симптомы, но у каждого человека это индивидуально. Если повышение содержания натрия происходит длительное время, то может произойти нарушение водного баланса в организме. Что в дальнейшем приводит к нарушениям сосудистой, сердечной, нервной систем. Основным способом нормализации содержания натрия в крови является специальная диета.
Если вы думаете, что у вас возникло это заболевание, то стоит просмотреть некоторые показатели:
- Повышается температура тела.
- Увеличивается артериальное давление.
- Учащается сердцебиение.
- Человек постоянно испытывает сильную жажду.
В том случае, когда вы у себя на теле видите множество отеков, то уровень натрия в крови повышен. В сыворотке при этом концентрация может быть понижена. Это происходит потому, что увеличивается поступление гормона, и катионы неправильно перераспределяются в жидкости.
В том случае, когда у человека обнаруживается пониженный натрий в крови, то это заболевание называется гипонатриемией. Она также бывает абсолютной и относительной, но в обоих случаях имеет стабильную клиническую картину. Заболевание обычно возникает из-за того, что имеются показатели:
- Вы недостаточно потребляете пищи с содержанием натрия.
- У вас имеется надпочечная недостаточность.
- Сахарный диабет.
- Потеря жидкости в организме.
- Сердечная недостаточность.
Чтобы понять, что у вас именно данный недуг, стоит обратить внимание на симптоматику:
- Аппетит пропадает.
- Постоянная тошнота.
- Учащение сердечного ритма.
- Снижение артериального давления.
- Апатия и устранение адекватной реакции на происходящее.
- Низкая трудоспособность.
У пациентов данная симптоматика может встречаться как по отдельным пунктам, так и всем вместе. Все аспекты вам подскажет лечащий врач, который назначит детальное обследование, и, после того как анализ крови на натрий будет проведен, определяются методы решения проблемы и лечения. Стоит помнить, что при возникновении недугов стоит сразу обращаться к лечащему врачу, чтобы он вовремя устранил все последствия, и это не привело к дальнейшему негативному воздействию на организм.
В том случае, когда вы хотите нормализовать уровень самостоятельно, то вам поможет диета. Назначается только лечащим специалистом и ведется под его наблюдением. Не нужно заниматься самолечением, потому что это может вести к пагубным последствиям.
источник
Вода, проходя сквозь магматические породы, состоящие из хлорсодержащих минералов и соленосных отложений, растворяет хлориды, то есть соли соляной кислоты, которые чаще всего встречаются в виде солей натрия, магния и кальция. Их большое количество в грунтовых и артезианских водах обусловлено не только вулканическими выбросами, но и в результате круговорота – насыщения атмосферных осадков при прохождении через почву и затем обмен через атмосферу с океаном. Повышенное содержание натрия может наблюдаться вследствие вымывания растворимых соединений с хлором или поваренной соли из слоев имеющих соприкосновение с водой. Поэтому она становится непригодной ни для хозяйственных и технических нужд, ни для орошения в сельском хозяйстве. Следовательно, необходима очистка воды от натрия. Понятно, что соленая вода имеет повышенную предельно допустимую концентрацию солей хлоридной группы, а катионный состав их представлен натрием, образующим с хлором поваренную соль, что и обеспечивает ей соленый вкус. Следовательно, натрий попадает в водопроводную воду следующими путями: проходя сквозь горные породы и растворяя углекислые, сернокислые и хлористые соли натрия, из промышленных и хозяйственных сточных вод, с орошаемых полей. Чаще всего во всех соленых водах больше всего хлористого натрия относительно других солей, в связи с чем специалисты рекомендуют устанавливать системы очистки воды для дома. Если преобладает хлористый магний, то она имеет горько-соленый вкус.
При избыточной концентрации хлоридов и соответственно натрия может наблюдаться:
- раздражение слизистой оболочки глаз, кожных покровов, дыхательных путей;
- ухудшается пищеварение и негативно влияет на секрецию желудка;
- в организме нарушается водно-солевой баланс;
- могут развиться заболевания системы кровообращения;
- возникает вероятность новообразований мочеполовых органов, желудка, пищевода и других органов пищеварения;
- могут возникнуть желче- и мочекаменные заболевания;
- увеличивается частота сердечнососудистых заболеваний.
Очистка воды от натрия необходима, потому что избыточное содержание хлоридов, которое взаимосвязано с избыточным количеством натрия вредно для бытового оборудования:
- значительно увеличивается коррозия металлических поверхностей и деталей бытовых приборов;
- появляется осадок на нагревательных элементах чайников, стиральных и посудомоечных машин, бойлерах, что способствует преждевременному выходу их из строя.
Разные микроэлементы необходимы для каждой клетки и для всего организма. Натрий это микроэлемент, который играет важную роль в образовании желудочного сока, при его участии регулируется выделение почками продуктов жизнедеятельности человека. Он способствует нормальному водно-солевому балансу в клетках, нормализует нервно-мышечную деятельность. Он обеспечивает сохранение в растворимом состоянии минеральных веществ в крови и предотвращает перемещение жидкости из кровеносных сосудов в прилежащие к ним ткани. Известно, что организм человека не приспособлен самостоятельно вырабатывать натрий, поэтому его запас должен пополняться из различных естественных источников, например воды. Сбалансированное содержание натрия обеспечивают почки. Избыточное же его содержание может вызвать такие заболевания как гипертония, сахарный диабет, невроз. При этом наблюдается повышенная возбудимость, гиперактивность, впечатлительность, в некоторых случаях наблюдается чрезмерная жажда, потливость, частое мочеиспускание.
Очистка воды от натрия в бытовых условиях необходима, если наблюдается его переизбыток. В питьевой воде концентрация натрия не должна превышать 200 мг/л. Ведь его переизбыток в организме способствует повышению давления крови и соответственно накоплению жидкости и образованию отеков, а также истощает запасы калия, который необходим для стабильной работы сердечнососудистой системы.
Существуют два основных метода очистки соленой воды – ионообменный метод и обратный осмос воды. Ионообменный метод обладает следующими преимуществами: получение воды высокого качества, возможность работать при резко изменяющемся составе питающей воды, невысокие энергетические и капитальные затраты, невысокий расход на собственные нужды особенно для противоточных фильтров. Недостатки: приличный расход реагентов, и как следствие увеличение эксплуатационных расходов пропорционально содержанию солей, в зависимости от состава исходной воды требуется в некоторых случаях весьма сложная дополнительная подготовка.
Очистка при использовании технологии обессоливания воды имеет множество преимуществ: получение воды высокой степени очистки, небольшое потребление энергии, производительность неограниченна, надежность, невысокие эксплуатационные затраты и расходы на регенерацию мембран. Недостатки: необходимость тщательной дополнительной подготовки воды, обязательна непрерывность работы аппаратуры, но весьма значительные капитальные затраты на оборудование.
источник