Поставить точно диагноз «онкология» без проведения специальных исследований практически невозможно. В настоящее время медицина обладает такими возможностями. Поэтому если имеется подозрение на рак, то проводится иммуногистохимическое исследование. Рассмотрим, что собой представляет данный анализ, в каких случаях назначается и что позволяет выявить.
Под данным исследованием подразумевается изучение образца тканей под микроскопом. Их получают при помощи биопсии и предварительно обрабатывают специфическими антителами.
Онкологические заболевания давно находятся в поле зрения врачей и ученых. В ходе многочисленных исследований было установлено, что злокачественные клетки в процессе жизнедеятельности продуцируют специфические белки, которые называют антигенами. Они связываются с антителами, именно на этом основано иммуногистохимическое исследование, когда ткань пациента, взятая для изучения, после обработки тщательно изучается при помощи микроскопии.
Когда антитела взаимодействуют с раковыми клетками, то можно наблюдать явление флуоресценции. Это дает основания практически на 100 % быть уверенным, что имеет место онкология.
Сейчас уже разработаны и активно внедрены в медицинскую практику антитела практически ко всем новообразованиям.
Иммуногистохимическое исследование при раке позволяет:
- Распознать новообразование и определить его разновидность.
- Выяснить распространенность первичного очага по организму.
- При взятии биологического материала из вторичных очагов можно определить источник распространения метастазов.
- Исследование позволяет оценить эффективность терапии.
- При помощи анализа можно выяснить, на какой стадии развития находится раковая опухоль.
- Иммуногистохимическое исследование позволяет также выяснить скорость роста новообразований.
Данный метод исследования считается более информативным по сравнению с обычным гистологическим. Если использовать оба метода исследования, то можно получить полнейшую картину, поэтому на практике чаще всего врачи так и поступают.
Исследовать при помощи этого метода можно практически все ткани человеческого организма, но чаще всего такой анализ назначают при подозрении на онкологию.
- Для определения первичных новообразований.
- Для выявления метастазов.
- Данный анализ помогает определить прогноз развития и протекания патологии.
- Анализ служит одним из методов исследования рецепторов к ряду гормонов.
- ИГХ-исследование позволяет обнаружить микроорганизмы.
- Метод исследования применяют для выяснения чувствительности раковых клеток к химиотерапии и радиотерапии.
Иммуногистохимическое исследование проводится в несколько этапов, первым из них является сбор биологического материала. Его получают путем биопсии или изъятия материала во время проведения операции.
Кусочек ткани помещают в формалин и направляют в лабораторию, где его подвергают изменениям:
- Материал обезжиривают специальными составами и заливают парафином. В таком состоянии он может храниться практически вечно, поэтому при необходимости исследование можно повторять.
- На следующем этапе получают тончайшие срезы — проводят микротомирование. Их размещают на специальных стеклах.
- Приготовленные срезы обрабатывают растворами антител определенной концентрации. Использовать для обработки могут составы, содержащие разное количество антител. Какие из них вступят во взаимодействие с раковыми клетками, будет зависеть от разновидности опухоли.
Такой анализ просто незаменим, если есть подозрение на наличие раковых клеток в груди. Обязательно определение количества рецепторов эстрогена и прогестерона. При их повышении активизируется процесс роста злокачественных клеток.
ИГХ-исследование позволяет не только распознать онкологическое заболевание, но и определить его стадию. При помощи исследования врачи выясняют, показана ли гормональная терапия.
Опухоли, имеющие большую концентрацию гормонов, чаще всего вполне эффективно лечатся антигормональными препаратами.
Во время проведения анализа обязательно определяют показатель Ki-67, он помогает определить злокачественность процесса. Если иммуногистохимическое исследование молочной железы показывает Ki-67 до 15 %, то исход заболевания считается благоприятным. Если показатель доходит до 30 %, то без химиотерапии не обойтись, потому что опухоль растет довольно быстро. Отметка в 90 % чаще всего свидетельствует о неизбежности летального исхода.
Данный анализ назначается не только при подозрении на онкологию груди, но еще он оказывается довольно информативным, если:
- Имеется бесплодие.
- Обнаружены злокачественные образования матки.
- Наблюдаются патологические изменения в репродуктивной системе.
Такой анализ проводится, если:
- Часто наблюдаются выкидыши.
- У женщины было несколько неудачных попыток ЭКО.
- Диагностирована хроническая форма эндометрита.
Данное исследование помогает выяснить, имеются ли клетки, мешающие зачатию естественным путем.
ИГХ-исследование тканей эндометрия назначается женщинам, у которых уже было несколько неудачных попыток искусственного оплодотворения.
Взятие тканей эндометрия проводится в разные дни цикла, которые назначает врач.
Необходимо иметь в виду, что исследовать подготовленные образцы тканей имеет право только врач, имеющий сертификат, подтверждающий специальную подготовку по проведению анализов по методу ИГХ.
В заключении должно быть указано:
- Показатели антител, к которым определена тропность исследуемой ткани.
- Указывается разновидность раковых клеток и их количество.
- Указываются выявленные антигены, которые помогают установить вид онкологии.
По результатам исследования нельзя ставить окончательный диагноз. Врач-онколог имеет право это сделать только после получения интерпретации всех диагностических процедур.
Таким образом, можно сделать вывод, что эффективно иммуногистохимическое исследование при раке молочной или других желез и других видах онкологии. Анализ дает исчерпывающую информацию и позволяет распознать начинающийся патологический процесс на клеточном уровне.
источник
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
ИГХ-исследование ткани легкого
Подскажите,пожалуйста, что означает следующее заключение ИГК-исследования:
С целью верификации гистологического диагноза в легком — картина воспалительной миофибробластической опухоли, проведено ИГК-исследование.
Клетки опухоли позитивны по экспрессии виментина +++, a-SMA++, ALK-1++ и СД 68++
Клетки опухоли не экспрессируют SMMS-1, десмин, AE1/AE3
Таким образом,морфо-ИГХ картина опухоли соответствует воспалительной миофибробластической опухоли
Регистрация: 15.01.2006 Сообщений: 236 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
По результату ИГХ я вижу что в опухоли есть миофибробласты или гладкие мышечные клетки с макрофагами. такая комбинация может быть в реактивной ткани любого воспалительного процесса (не обязательно но включая инфекционные) или «воспалительной опухоли». Признаков карциномы похоже нет. Результат зависит от места ткани потомучто реактивная ткань может на периферии другой опухоли, инфаркта. Биопсии могут «промазать». Ваш материал биопсия или резекция?
Регистрация: 27.02.2009 Сообщений: 23 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Соглашусь в В.В. Яковлев, с той лишь оговоркой, что без рутинного гистологического исследования такая ИГХ-картина мало что означает. Пожалуй можно сказать лишь, что в исследованном материале нет эпителиальной опухоли. В остальном вполне может быть и воспалительная миофибробластическая псевдоопухоль.
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Спасибо больше за ответы.
Материал — биопсия, исследован дважды,в Москве и в Кишиневе:результат один и тот же. При биопсии был взят довольно крупный кусок ткани. В Кишиневе исследовали 6 стеклышек,в Москве сделали ещё 9 стеклышек, которые потом тоже исследовали. В итоге пришли к одному и тому же результату. Насчет «промазали с биопсией» — когда делали надрез,чтобы взять кусок ткани на анализ, пришлось увеличить надрез, чтоб взять самый крупный пораженный участок (кусочек ткани на анализ).
Сейчас стоит вопрос лечения данного заболевания. Здесь в Кишиневе врачи не сталкивались с таким диагнозом и не знают как это лечится.
Мне 22 года.
Очень надеюсь на вашу помощь.
Регистрация: 15.01.2006 Сообщений: 236 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
В 22 года дифференциальный диагноз немного другой. Можете ли вы скопировать полное гистологическое описание, а так же немного истории (рентгенологическое описание, симптомы, другие заболевания или анализы отклоняюшиеся от нормы).
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Добрый день.
Начнем с самого начала болезни: Выпил очень холодную воду с холодильника. На второй день почувствовал недомогание и поднялась температура. Выпил ампиокс так как и горло тоже как бы чувствовал. Обратился в санчасть, сделали рентген и поставили диагноз подозрение на пневмонию. Неделю принимал парацетамол и трикаксон и витамины. Изменений ни каких не было даже хуже температура до 38-40. Взяли в больницу , опять рентген и томографию там написали что видят десимилированный процес неясной этиологии. Тем не менее лечили от пневмонии около месяца. Результат не дало Решили что наверное туберкулез. В другой больнице институт пульмонологии начали пробный курс 10 дней от туберкулеза еще хуже стало. Решили делать операцию и брать гистологию на обследовании. В Кишиневе такой результат после лаборатории:
внутри сосудистая бронхо-альвиолярная склерозирующая опухоль. Хронический воспалительный процесс с очагами некроза , периваскулярный пневмосклероз с очагами отека легких и фиброноидного некроза в гранулематозных образованиях.
В Москве провели исследование материала ИГХ:
Микроскопическое описание:
С целью верификации гистологического диагноза (Б. 168559/09) в легком- картина воспалительной миофибробластической опухоли, проведено иммуногистохимическое иследование.
Клетки опухоли позитивны по экспрессии виментина+++, а-SMA++,ALK-1++ и СД 68++. Клетки опухоли не экспрессируют SMMS-1,AE1/AE3.
Таким образом, морфо-иммуногистологическая картина опухоли соответствует воспалительной миофибробластической опухоли.
Вот это то что дало исследование. Наши врачи не знают как лечить это.
Анализы крови все хорошие кроме лейкоцитов сейчас 20 и СОИ 56, гемоглобин 120.
Как таково врачи нам описали рентген не ода опухоль а разбросанно по всем легким и не опухоль а гранулезного типа. Это длится 4 месяца, Самое главное температура каждый день. до 38 обычно после обеда поднимается. Принимаю сейчас капли Psorinoheel и Lymphomyosot и от температуры МИГ-400. Не кашляю, месяц назад кашлял была одышка когда поднимался по лестнице сейчас лучше не чувствую. Вот это все.
С уважением,
Алексей.
Регистрация: 15.01.2006 Сообщений: 236 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Судя по описанию, не опухоль. Была ли сделана бактериальная культура? Антибиотики?
По биопсии, мне нужно посмотреть хоть бы на фотографии стекол сделанных в микроскопе. Ни диагноз, ни выбор ИГХ пока не сходятся с клинической картиной. Я бы в первую очередь думал бы об инфекции (нужны окраски на ТБ, грипковые организмы и по Граму) и о воспалительных неинфекционных (саркоидоз, пневмониты. ). Можете ли вы попросить сфотографировать стекла в микроскопе и отсканировать рентген легких.
iakovlev.v@gmail.com
Добавлено через 2 минуты 59 секунд
Есть ли симптомы в носу и носоглотке? Кем вы работете? Контакт с сеном, землей, животными?
Добавлено через 5 минут 43 секунды
функция почек (креатинин?)
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
добрый день .
Пишет мама Леши так как его дома нет.
Сегодня проверили почки и мы в ужасе, сделали узи и томографию с контрастом (в вену). Поставили диагноз непроходимость почки левой , хотя 2 месяца назад делали томографию и ничего не было. До этого неоднократно было сделано узи и ничего не было обнаружено.
Вот сейчас вы наверное поймете что у нас, Даже не знаем что делать. Завтра идем к онкологу урологу.
До свидания. Мы еще напишем.
Регистрация: 15.01.2006 Сообщений: 236 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Пока все равно не понятно с определенностью. Оптимально было бы выслать стекла и гистологические блоки мне (укажите как документы, не говорите что в посылке ткань или стекла):
Dr. Vladimir Iakovlev
Division of Pathology
St. Michael’s Hospital
30 Bond St., Cardinal Carter 2-093
Toronto Ontario M5B1W8
Canada
Tel: 1-416-864-6060#3176
Я их верну за свой счет. В худшем случае сфотографировать стекла в микроскопе с разным увеличением. Мне в основном нужны снимки обычных гематоксили-еозин, фотографировать ИГХ пока не надо (но для пересылки нужно все).
Добавлено через 2 минуты 48 секунд
Кровь в моче? Уровень креатинина в крови?
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
здравствуйте.
Это опять мама Леши. Вы знаете наши блоки и стекла остались в Москве. Если у Вас кто то там есть мы бы дали адрес даже выслали денек на отправку чтобы от туда вам их отправить. Мы Вам позвоним . Это Ваш телефон? Объясните как звонить.
Почки только сегодня идем к врачу, но дома смотрим нет никакой крови в мочи.
Пишите. Спасибо.
Регистрация: 15.01.2006 Сообщений: 236 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
У меня к сожалению контактов в Москве нет, только очень далекие и я связь не держу. Я переехал в Канаду много лет назад из Сибири.
Можете ли вы попросить саму лабораторию отправить материал? Сложности могут возникнуть если в таможенной декларации указан биологический материал. К сожалению Российская таможня (как и многие бюрократические машины) немного квадратноголовая и не до конца понимают что материал фиксирован и безвреден. Посылку легче всего отправить указав содержание как «документы».
Другой вариант поросить их (лаборатотию) сфотографировать стекла.
Третий вариант, самый крайний, обьяснить ситуацию что диагноз не совпадает с клиническои картиной и потребовать пересмотра стекол в другом учреждении. Где сейчас стекла и блоки?
Звонить можно, я только не всегда в оффисе(1-416-864-6060 потом после ответа машины 3176). Мои сотовый: 1-647-6801500 (от вас набор наверно ?8-001-647-68-1500) сотовый в госпитале иногда попадает в зону без связи.
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Доброго Вам времени суток. Уважаемый Владимир В.(извиняюсь, -не знаю как Вас по отчеству)Вас опять беспокоят из Кишинёва. это отец Алексея. Долго не выходили на связь-измотались немного. Я хотел Вас поблагодарить за понимание, неравнодушие и поддержку.
В Кишинёве в архиве оставалось одно стекло и кусочек биоматериала, но Алексея попросили взять с собой в Германию. Он там уже почти две недели.Рак, Слава Богу, исключили. 17-го числа сдал дополнительные анализы, завтра-послезавтра (21-22-го), дай Бог, будут результаты и, может быть, назначат лечение.А пока подозревают саркоидоз или туберкулёз костей.Сделали сканирование скелета и пункцию (опухоли?) на позвонке-ждём результатов.
С уважением, Иван
Регистрация: 15.01.2006 Сообщений: 236 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Рад что события развиваются таким образом. Сейчас и диагностика и лечение похоже идут в комплексе и грамотные.
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
Добрый день, Владимир!Вы оказались правы по поводу «биопсии промазали». Действительно пришлось ещё раз делать биопсию, а до этого исследовали и на туберкулёз костей , и на бактерии. Сначала поставили диагноз » Саркома Юинга» и получил дважды по три дня химиотерапию по этому диагнозу, (но продолжали исследования) После чего исключили и этот диагноз и поставили » Анопластическая Т-крупноклеточная лимфома стадия IVB(CD30+:CD4+;CD43+CD56-/+;EMA+; GranzymeB+:monoklonalek TCR-gamma: ALK1+/- .По этому диагнозу получил ещё шесть химиотерапии по три дня. Закончил 13.01.10. Провели проверку (анализы, сканирование, томографию. )-Всё хорошо.Только рубцы остались на лёгких. Медики очень довольны результатами, но очень боятся ремиссии и предлагают сделать пересадку стволовых клеток, для большей гарантии. Мы вроде согласны, но некоторые родственники наши опасаются, чтоб обратной реакции не было. Вы, как специалист-медик, что нам можете посоветовать?Как нам поступить? С огромным уважением , Иван
Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
[QUOTE=xorovod]Добрый день, Владимир!Вы оказались правы по поводу «биопсии промазали». Действительно пришлось ещё раз делать биопсию, а до этого исследовали и на туберкулёз костей , и на бактерии. Сначала поставили диагноз » Саркома Юинга» и получил дважды по три дня химиотерапию по этому диагнозу, (но продолжали исследования) После чего исключили и этот диагноз и поставили » Анопластическая Т-крупноклеточная лимфома стадия IVB(CD30+:CD4+;CD43+CD56-/+;EMA+; GranzymeB+:monoklonalek TCR-gamma: ALK1+/- .По этому диагнозу получил ещё шесть химиотерапии по три дня. Закончил 13.01.10. Провели проверку (анализы, сканирование, томографию. )-Всё хорошо.Только рубцы остались на лёгких. Медики очень довольны результатами, но очень боятся рецидива и предлагают сделать пересадку стволовых клеток, для большей гарантии. Мы вроде согласны, но некоторые родственники наши опасаются, чтоб обратной реакции не было. Вы, как специалист-медик, что нам можете посоветовать?Как нам поступить? С огромным уважением , Иван.Регистрация: 16.06.2009 Сообщений: 9 Поблагодарил(а): 0 раз Поблагодарили: 0 раз —>
не ремиссии а рецидива, я извиняюсь там ошибся
источник
Иммуногистохимия рака легкого
Иммуногистохимия представляет собой инновационный метод морфологической диагностики раковых заболеваний. Суть исследования заключается в лабораторном изучении образцов опухолевой ткани, полученной во время биопсии, после их предварительной обработки специальными антителами. Данный метод НЕ ИМЕЕТ противопоказаний, поэтому не может быть выполнен только при невозможности проведения биопсии.
Патогенные клетки продуцируют характерные определенной раковой опухоли специфические белки, называемые антигенами, которые способны взаимодействовать с некоторыми антителами. При проведении иммуногистохимии рака легкого полученный образец опухолевой ткани подвергается обработке определенными антителами, а затем изучается в лаборатории. В результате обработки вещества, связывающиеся с бластными клетками, начинают светиться, что позволяет выявить наличие аномальных клеток.
Метод исследования позволяет исследовать любые ткани, поэтому часто выполняется при подозрении опухолевого процесса.
Исследование может быть выполнено с различными целями:
- Определить тип и подтип злокачественной опухоли,
- Выявить источник метастазов,
- Определить распространенность опухолевого очага,
- Оценить эффективность терапии рака,
- Определить степень онкологии,
- Оценить скорость роста новообразования,
- Определить прогноз болезни.
Результаты исследования позволяют осуществлять высокоэффективное лечение с помощью современных противоопухолевых препаратов, подавляющих пролиферацию раковых клеток.
Обследование включает четыре основные этапы.
Первый этап предполагает взятие образца опухолевой ткани во время биопсии либо во время оперативного вмешательства. Выбор метода забора биоптата (опухолевой ткани) зависит от места нахождения злокачественного новообразования. После взятия материала его помещают в раствор формалина (как правило, 10%-й) и передают в лабораторию.
На следующем этапе проводится обработка материала исследования, при которой лаборант делает тончайшие срезы биоптата и помещает их на гистологические стекла.
Третий этап иммуногистохимии предполагает окрашивание полученных срезов специальными препаратами – растворами специфических антител. После каждого этапа окрашивания материалы изучаются врачом, принимающим решение о необходимости продолжения поиска опухолевых маркеров либо о постановке диагноза. Окрашивание срезов выполняется вручную лаборантом, либо автоматически с помощью медицинского оборудования. Второй способ является более достоверным и исключает ошибки.
Количество используемых маркеров может отличаться в зависимости от конкретного клинического случая и, как правило, зависит от предварительного диагноза. Исследование предполагает использование малой панели (до 5 антител) либо большой (от 6 единиц до десятков антител). Результаты исследования при стандартной «малой панели» пациент получает через неделю, в случае использования «большой панели» ждать приходится около двух недель.
Изучение полученных данных проводит патологоанатом. В заключение процедуры специалист нашего Специализированного Онкоцентра отмечает реагенты, с которыми было определено сродство ткани, также описывается морфологическая картина биоптата: выявленный тип бластных клеток и их количество. Сродство биопсийного материала и используемых опухолевых антител указывает на конкретный тип раковой опухоли.
Иммуногистохимия рака легкого считается наиболее достоверным и точным методом исследования онкологии, позволяющим почти со 100% точностью поставить диагноз, определить тип новообразования и выявить место локализации опухоли.
Характерным отличием данного исследования от других диагностических процедур, в основе которых также заложена реакция антиген-антител, считается структурная специфика проведения обследования. В процессе диагностики врач изучает наличие реакции, а также ее интенсивность и распространение сигнала в биоптате.
источник
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами — антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR — протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны — эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu — это рецептор эпидермального фактора роста раковой клетки. Это — ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.
Ki-67 — это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот — чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке — активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется — индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.
VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF — для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Иммунотерапия в онкологии появилась сравнительно недавно, но уже успела показать удивительные результаты в лечении опухолей. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету увидеть опухоль и уничтожить её. Ответственные за «видимость» опухоли белки PD-1, PDL-1 и PDL-2 в достаточном количестве присутствуют не во всех опухолях. Именно поэтому одним пациентам иммунотерапия помогает, а другим нет.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
источник
Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.
Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1941 году американский иммунолог Альберт Кунс впервые решил использовать антитела в лаборатории, чтобы «распознавать» с помощью них белки бактерий. В 1984 году биохимик из Аргентины Сезар Мильштейн получил Нобелевскую премию за то, что создал гибрид опухолевой клетки с лимфоцитом, которая могла синтезировать моноклональные антитела. После этого началось производство моноклональных антител для диагностических и лечебных целей.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
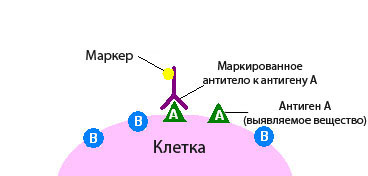
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
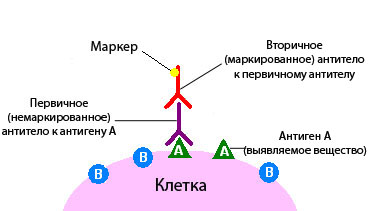
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
- Он обладает более высокой чувствительностью, потому что с одним первичным антителом (тем, которое связывается с белком-мишенью) может связаться несколько вторичных антител.
- Исследование занимает немного времени: для того, чтобы произошла реакция, нужно примерно 3 часа.
- Непрямая иммуногистохимия требует небольшого количества антител. Например, вторичное антитело, направленное на иммуноглобулины кролика, будет реагировать на любое первичное антитело «кроличьего» происхождения. Не нужно создавать много разных видов вторичных антител с окрашивающей или флуоресцентной меткой.
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
источник
Эффективность лечения рака зависит не только от развития методов терапии — без постановки точного морфологического диагноза врач-онколог не может выбрать подходящий для конкретной опухоли вид лечения. Важным компонентом современной онкологической помощи, который, к сожалению, часто остается в тени достижений технологий разрушения опухолей, является правильная постановка диагноза. А точнее — определение типа опухолевых клеток и, соответственно, их устойчивости к различным видам внешнего воздействия. Решает эту задачу морфологическая диагностика, базовый принцип которой — исследование образцов опухолевых клеток.
Базой для морфологической диагностики являются образцы тканей (фрагменты опухолей). Наиболее частым способом забора материала является трепан-биопсия, которая осуществляется при помощи специальной толстой иглы, также используется инцизионная биопсия, которая выполняется при помощи скальпеля и эксцизионная биопсия с тотальным забором пораженного участка (например, биопсия лимфоузла при диагностике лимфом).
После образцы тканей проходят этапы специальной подготовки (фиксации и проводки), после чего пропитываются парафином с формированием блока. Из блоков на специальных устройствах (микротомах) приготавливаются тонкие срезы толщиной 4-5 микрон. Полученные срезы помещаются на стекла, подвергающиеся различным методам окраски с целью выделения различий в клеточных структурах. Эти, так называемые, “стекла”, подлежат тщательному рассмотрению врачом-патоморфологом.
Каждый из этапов подготовки образцов критичен для возможности и точности последующих молекулярных методов исследования, поэтому нарушение технологии подготовки может привезти к неправильному назначению лечения.
Количество известных разновидностей опухолей — велико. Наиболее полной считается классификация Всемирной организации здравоохранения (ВОЗ), которая в печатном виде представляет собой 11 томов, около 400 страниц в каждом. Итог — ошибки в постановке диагноза неизбежны.
Патоморфологическая классификация опухолей Всемирной организации здравоохранения (ВОЗ) едва уместилась в 11 томов
Показатель ошибок при постановке диагноза поражает: от 5 до 50% всех онкологических диагнозов в мире — неверны. Половина этих ошибок не становятся фатальными — различные виды рака могут одинаково реагировать на определенный подход к лечению. Но значительная часть неточностей приводит к неадекватному лечению рака у пациентов, которое может способствовать прогрессированию заболевания.
Среди объективных причин ошибочных диагнозов, связанных с морфологической диагностикой, лидирует невозможность получения образца опухолевой ткани для ее морфологического исследования ввиду трудности доступа либо тяжелого состояния пациента.
Среди субъективных причин ошибок морфологической диагностики наиболее распространены:
- ошибка при заборе материала (например, при раке простаты следует проводить множественный забор образцов, т.к. опухоль в этом органе может иметь крайне сложную пространственную форму);
- отсутствие возможности конкретного лечебного учреждения провести морфологическую диагностику в необходимом объеме (собственная морфологическая лаборатория — это сложный и дорогой институт);
- нарушения протоколов как в части отказа от забора и морфологического исследования образцов, так и в части стандартов проведения морфологической диагностики опухоли (в том числе и устаревшие методики, отсутствие необходимого оборудования, низкая квалификация специалистов, на повышение которой не выделяется средств).
И только морфологическая диагностика, проведенная с соблюдением всех стандартов взятия материала, подготовки и рассмотрения образцов, способна дать окончательный ответ о типе опухоли и ее особенностях.
Первоначально, морфологическая диагностика решала задачу определения наличия злокачественного процесса в ткани. Для этого применялся метод, который в современной медицине называется “гистологическое морфологическое исследование”, или, как часто можно услышать от пациентов “гистология”.
С помощью гистологического морфологического исследования может быть проведена дифференциальная диагностика доброкачественных процессов и злокачественной опухоли — т.е. определение наличия измененных (атипичных) клеток в образце тканей. Простое гистологическое исследование в любом случае носит субъективный характер и зависит от профессионализма проводящего его врача. Поэтому, при подозрении на наличие опухоли, второе мнение от ведущих экспертов МИБС в этой области значительно снижает риск ошибочного диагноза.
При подтверждении опухолевого процесса в тканях, пациенту требуется более точная диагностика, которая точно определит тип опухоли и укажет на наиболее эффективный подход к ее лечению — иммуногистохимия.
Основой иммуногистохимии является окрашивание клеток специфическими веществами, которые реагируют на определенные типы опухолевых клеток и “мишени”, специфические свойства и мутации генов конкретного типа рака.
Пример иммуногистохимии в МИБС: Позитивная реакция на СК14 (коричневое окрашивание) вокруг всех подозрительных структур исключает рак молочной железы – дополнительное лечение пациентке не требуется
Таким образом, иммуногистохимия позволяет точно указать нозологию (разновидность) опухоли, что чрезвычайно важно для проведения адекватного лечения, а также – для прогнозирования развития заболевания. Например, некоторые разновидности рака молочной железы (тубулярный, фиброматоз-подобный) не требуют иного лечения, кроме хирургического.
Иммуногистохимия в МИБС: Позитивная реакция на bcl10 в лимфоидных клетках конъюнктивы глаза (коричневое окрашивание вокруг фолликула) подтверждает диагноз MALT-лимфомы, при которой наибольшего эффекта покажет химиотерапия, а не хирургическое лечение
Метастазы представляют собой “копию” злокачественных клеток первичной опухоли, точнее, того типа тканей, из которых развилось новообразование. Поэтому тип клеток метастаза может указать на локализацию первичного рака. Это крайне важно, если первичная опухоль не проявляет себя симптомами и не диагностирована. С другой стороны, если первичная опухоль, имеет уязвимость к препаратам таргетной терапии, то ее метастазы могут утратить это свойство. В таком случае иммуногистохимия образца метастазов покажет, что для первичной опухоли лечение будет прежним, а вот для метастазов следует избрать другой подход.
Благодаря развитию методов молекулярной диагностики (иммуногистохимия, ПЦР, секвенирование), лекарственная терапия рака идет большими шагами вперед. Помимо химиотерапии, сейчас активно используются таргетные препараты, целенаправленно воздействующие на мишени в опухолевых клетках (HER2, CD20, c-kit, мутантный b-Raf и др.).
Кроме того, в настоящее время онкология переживает «бум» иммунотерапии, при применении которой лекарственные препараты разрывают порочный механизм, препятствующий уничтожению опухолей собственными иммунными клетками.
Однако для правильного назначения таких препаратов необходимым условием является определение специфических маркеров при помощи иммуногистохимического или молекулярно-генетического исследования опухолевой ткани. Более того, часто маркеры, указывающие на чувствительность к иммунотерапии (MMR, MSI), также говорят о том, что пациенту не следует назначать химиотерапию, в особенности это касается рака толстой кишки и желудка.
Иммуногистохимия показала, что негативная реакция на MSH2 (синее окрашивание ядер опухоли, коричневое окрашивание неопухолевой ткани) свидетельствует о том, что рак тела матки, представленный на данном слайде, чувствителен к иммунотерапии
Некоторые разновидности опухоли не только не требуют хирургического лечения, но оно им противопоказано, так как может привести к прогрессированию заболевания. Это прежде всего лимфома, опухоль, возникающая из лимфоцитов, которые располагаются как в лимфоузлах, так и в паренхиматозных органах.
Развитие иммуногистохимии и основанных на ее результатах таргетной терапии и иммунотерапии постоянно расширяют спектр видов рака, которые можно вылечить “точечным” воздействием исключительно на опухолевые клетки. Помимо лечения лимфомы, по состоянию на начало 2019 года наибольшее применение методы иммунотерапии и таргетного лечения получили при лечении таких заболеваний, как:
при которых современные протоколы лечения требуют выполнение иммуногистохимии. Большинство ошибок в диагностике и лечении данных заболеваний связано либо с не проведением иммуногистохимии, либо с ее неправильной интерпретацией. Цена ошибки, к сожалению, может быть фатальной, так как назначение неправильного лечения может привести к резистентности (устойчивости) опухолевых клеток к лекарственным препаратам, которые при правильном назначении часто приводят к выздоровлению пациента.
Выбирайте МИБС как для первого проведения базовой морфологической диагностики либо иммуногистохимического исследования, так и для получения второго мнения от ведущих специалистов нашей медицинской компании относительно имеющихся образцов ткани опухоли (часто называемого пациентами “пересмотр стёкол”), полученных при обследовании в другом онкоцентре.
источник
Определение перестройки гена ALK при раке легкого методом ИГХ – исследование гистологических препаратов биопсийного материала рака легкого, проводимое с использованием меченных флюоресцирующими веществами антител, которое позволяет выявить наличие в опухолевых клетках продукта экспрессии мутированного гена, ответственного за злокачественную трансформацию.
Определение транслокации гена ALK (иммуногистохимический анализ).
ALK Mutation (Gene Rearrangement), EML4-ALK Fusion Protein, ALK (Anaplastic Lymphoma Receptor Tyrosine Kinase) Gene Rearrangement, ALK Gene Fusion.
Какой биоматериал можно использовать для исследования?
Образец ткани, образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Общая информация об исследовании
Современные успехи в лечении онкологических заболеваний во многом связаны с обнаружением молекулярных механизмов возникновения и развития злокачественных новообразований, отличающих их от клеток нормальных тканей, и появлением лекарственных препаратов, способных воздействовать на них. Такие лекарства называются таргетными, то есть действующими на определенную «цель» в опухолевой клетке. Они обладают хорошим профилем безопасности, так как в отличие от стандартной химиотерапии практически не действуют на нормальные ткани, а также характеризуются большей эффективностью. Однако назначение таргетных препаратов возможно лишь при обнаружении в опухолевых клетках специфической мишени для их действия. Сравнительно часто патологическим механизмом злокачественной трансформации клеток является нарушение в так называемых сигнальных путях. Сигнальный путь представляет собой цепь, по которой активирующий сигнал от рецептора, располагающегося на поверхности клетки, через несколько внутриклеточных белков передается в ядро. Такие внутриклеточные белки называются тирозинкиназами, их основная роль – передача сигнала от активированного рецептора путем биохимических реакций.
При немелкоклеточном раке легкого в некоторых случаях причиной злокачественной трансформации клеток может быть перестройка в гене, кодирующем одну из рецепторных тирозинкиназ – ALK (anaplastic lymphoma receptor tyrosine kinase – киназа анапластической лимфомы). В норме активация рецептора сигнального пути, в котором участвует ALK, приводит к пролиферации клеток. В гене ALK зашифрована аминокислотная последовательность как активной части фермента, так и белка-регулятора, который контролирует активность тирозинкиназы. Перестройка в гене приводит к тому, что шифр белка регулятора заменяется на другой – чаще всего кодирующий белок EML4. В результате образуется химерный – сливной – ген EML4-ALK. Белок EML4 способен облегчать белковые взаимодействия, поэтому вследствие генной перестройки ALK попадает под регулирующее влияние EML4, становится независимой от возбуждения своих рецепторов и постоянно посылает пролиферативные сигналы, что приводит к неконтролируемому делению клеток.
Транслокации EML4-ALK в клетках рака легкого были впервые выявлены в 2007 году, а через три года появился таргетный препарат, способный ингибировать активность тирозинкиназы ALK – кризотиниб (ксалкори). Встречаемость перестройки EML4-ALK при раке легкого, по разным данным, колеблется от 3 до 13 %.
Наличие в опухолевых клетках химерной тирозинкиназы может быть выявлено при иммуногистохимическом исследовании биоптата или операционного материала опухоли. Для анализа из готового парафинового блока с помощью специального микроножа нарезают тончайшие срезы, которые затем прикрепляют к предметным стеклам и красят рутинными красителями, чтобы было возможно отличить клетки друг от друга и от межклеточного вещества. Затем срезы на стеклах окрашиваются раствором антител, меченных флюоресцирующими метками, специфичными к мутированной ALK. Если в опухолевой клетке присутствует искомый фермент, антитела связываются с ним и при просмотре стекла под специальным микроскопом можно увидеть флюоресценцию, что будет свидетельствовать о положительном результате теста.
Для чего используется исследование?
- Для выявления показаний к терапии ингибитором ALK кризотинибом.
Когда назначается исследование?
- У пациентов с метастатическим или местнораспространенным немелкоклеточным раком легкого с отсутствием мутации гена EGFR.
Результат выдается с заключением врача.
Положительный результат – обнаружение флюоресценции, свидетельствующее о наличии в клетках продукта экспрессии мутированного гена;
отрицательный результат – отсутствие флюоресценции.
Что может влиять на результат?
Качество предоставленных парафиновых блоков, опыт и квалификация врача-патоморфолога, так как иммуногистохимический метод не в полной мере стандартизирован и оценка его результатов в некоторой степени субъективна.
Несмотря на отсутствие транслокации ALK, пациентам может быть показана терапия кризотинибом – при выявлении транслокации гена ROS1, в ходе которой образуется тирозинкиназа, родственная ALK. Исследование проводится у пациентов с немелкоклеточным раком легкого с отрицательным статусом мутаций EGFR и ALK.
Позитивный и сомнительные результаты иммуногистохимического теста на транслокацию гена ALK обязательно должны быть проверены с помощью молекулярной диагностики – FISH-исследования. При этом кризотиниб может назначаться пациентам с положительным результатом иммуногистохимического исследования без ожидания результатов подтверждающего теста.
- Цитологическое исследование материала, полученного при оперативном вмешательстве
- Цитологическое исследование материала, полученного при эндоскопии (бронхоскопия)
- Гистологическое исследование биопсийного материала
- Гистологическое исследование биоптата лимфатического узла (1 узел) с использованием рутинных методик окраски
- Определение мутации гена EGFR в тканях опухолей
- Определение мутации гена BRAF в тканях опухолей
- Определение перестройки гена ALK при раке легкого методом FISH
- Определение транслокации гена ROS1 при раке легкого
источник
Комбинированная иммуногистохимия β-катенина, цитокератина 7 и цитокератина 20 полезна при распознавании первичных аденокарциномов легкого при метастатическом колоректальном раке
Это статья открытого доступа, распространяемая в соответствии с лицензией Creative Commons Attribution License (), которая допускает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа была правильно указана.
Важно различать первичный и вторичный рак легких. Однако часто диагностический диагноз аденокарциномы первичного легкого ацинара и метастазирования легких колоректального рака на основе морфологических и патологических находок затруднен. Целью данного исследования было оценить клиническую пригодность иммуногистохимии β-катенина, цитокератина (CK) 7 и CK20 для распознавания диагноза рака легких.
Мы провели иммуногистохимию β-catenin, CK7 и CK20 в 19 метастазах в легкие метастазирования образцов колоректального рака, 10 соответствующих первичных образцов колоректального рака и 11 первичных образцов аденокарциномы легкого ацинара и сравнили уровни точности диагностического диагноза с использованием антител против этих антигенов ,
Положительное окрашивание β-катенина наблюдалось во всех метастазах легких образцов колоректального рака, а также в первичных образцах колоректального рака, но ни в одном из первичных образцов ацинарной ацинарной ацинальной аллергии легких. Положительное окрашивание CK7 наблюдалось у 90,9% первичных образцов аденокарциномы легкого ацинара и в 5,3% метастазирования легких образцов колоректального рака, но ни в одном из первичных образцов колоректального рака. Положительное окрашивание CK20 наблюдалось во всех первичных образцах колоректального рака и в 84,2% метастазирования легких образцов колоректального рака, но ни в одном из первичных образцов ацинарной ацинарной агонии легких.
Комбинированная иммуногистохимия β-catenin, CK7 и CK20 полезна для проведения различающего диагноза между метастазами в легкие с колоректальным раком и аденокарциномой первичного ацината легких. Этот метод позволит точно диагностировать опухоль легкого и будет полезен для выбора соответствующих терапевтических стратегий, включая химиотерапевтические агенты и методы работы.
После операции колоректального рака метастатический рак печени является наиболее часто встречающимся раком, за которым следует метастатический рак легких. Однако из-за клинических особенностей иногда бывает трудно определить, является ли опухоль легкого первичным раком легкого или метастазом легких при колоректальном раке; это потому, что есть случаи метастазирования легких на ранних стадиях колоректального рака и те, которые происходят более 5 лет после операции колоректального рака. Кроме того, патологические особенности аденокарциномы первичного легкого ацинара сходны с таковыми при дифференцированной колоректальной аденокарциноме. Следовательно, правильная диагностика опухоли легкого важна для принятия терапевтических решений, таких как выбор химиотерапевтических агентов и методы работы.
β-catenin-белок является компонентом сигнального пути Wnt, который регулирует трансдукцию сигнала в росте, подвижности и дифференцировке клеток [1]. Недавние исследования показали, что изменения в сигнальном пути Wnt, включая мутации в генах аденоматозного полипоза (APC), β-catenin и Axin, играют важную роль в канцерогенезе различных злокачественных опухолей [2]. Мутации в этих генах приводят к накоплению белка β-catenin в цитоплазме, а накопленные β-catenin-транслокаты в ядро [3]. Ядерный β-катенин активирует члены семейства связывающих факторов фактора Т-клеток / лимфоцитов (TCF / LEF) и способствует транскрипции их целевых генов, таких как c-myc и cyclin D1 [4,5]. Интересно отметить, что изменения в сигнальном пути Wnt существуют почти во всех случаях колоректального рака и приводят к ядерному накоплению белка β-catenin [6-8].
Цитокератин (CK) является одним из компонентов внутрицитоплазматического цитоскелета. КК представляют собой семейство из более чем 30 полипептидов, которые классифицируются на основе их молекулярных масс и изоэлектрических точек [9]. Сообщалось, что CK распределяется тканеспецифическим образом и что иммуногистохимия некоторых CKs полезна для определения тканей происхождения в нескольких типах опухолей [10].
Это исследование было проведено для оценки клинической пользы иммуногистохимического исследования β-catenin, а также CK7 и CK20 для дискриминирующего диагноза аденокарциномы первичного легкого ацинара и метастазирования рака колоректального рака.
В период с 1992 по 2002 год во втором отделении хирургии, Университетской больницы Хиросимы, было выполнено 269 операций легких для первичного рака легких, 33 — для метастазирования рака толстой кишки и 725 — для первичного колоректального рака. Патологическим находкой у 38 первичных пациентов с раком легкого была ацинарная аденокарцинома. Образцы тканей, используемые в этом исследовании, были получены у этих пациентов. Мы проанализировали 19 образцов у пациентов с метастазами в легкие при колоректальном раке, 10 — у пациентов с первичным колоректальным раком и 11 — у пациентов с первичной аденокарциномой ацинана легких; это было связано с тем, что, к сожалению, несколько образцов были потеряны и недоступны для использования в этом исследовании. Каждый образец был гистологически оценен патологом на основе критериев классификации, за которыми следует ВОЗ [11]. Десять образцов тканей первичного колоректального рака были получены у соответствующих пациентов, перенесших операции по метастазированию рака колоректального рака. Мы также проанализировали образец ткани метастазирования легкого метастазирования колоректального рака, полученный путем биопсии иглы из хирургически резецированной опухоли легкого.
Каждая опухолевая секция (толщиной 4 мкм) депарафинизировалась и подвергалась антигенному извлечению путем микроволнового восстановления в 10 мМ цитратного буфера (цитрат натрия, pH 6,0) в течение 30 мин. Секции инкубировали с анти-β-катенином (Transduction Laboratories, Lexington, KY), анти-CK7 (DAKO Corporation, Carpinteria, CA) и моноклональными антителами против CK20 (DAKO Corporation, Carpinteria, CA) при разведениях 1: 250, 1: 100 и 1: 100, соответственно, в течение 12 ч при 4 ° С; и затем их окрашивали комплексным методом авидин-биотин с использованием набора Histofine (Nichirei, Tokyo, Japan). Результаты иммуноокрашивания β-catenin были основаны на ядерном и цитоплазматическом окрашивании, а результаты CK7 и CK20 были основаны на цитоплазматическом окрашивании опухолевых клеток. Результаты иммуноокрашивания β-катенина оценивали путем сравнения интенсивности окрашивания опухолевых клеток с клетками соседних неопухолевых клеток [12]. Иммуноокрашивание определялось как положительное, когда более 10% опухолевых клеток окрашивались каждым антителом.
окрашивание β-катенином было локализовано в клеточной мембране и отсутствовало в цитоплазме и ядре нормальных колоректальных эпителиальных клеток, нормальных бронхиальных эпителиальных клеток, клеток бронхиальной железы и альвеолярных клеток (данные не показаны). Положительное цитоплазматическое и / или ядерное окрашивание β-catenin наблюдалось во всех (100%) 10 первичных образцах колоректального рака, а также в 19 метастазах легких образцов колоректального рака, тогда как положительное ядерное окрашивание было обнаружено ни в одном из 11 первичных легкие ацинарные аденокарциномы (рис. 1А, В и 1С, таблица 1). Три первичных ацинарных ацинарокарциномы легких показали слабое положительное окрашивание β-catenin в цитоплазме; однако в ядре не наблюдалось окрашивания (данные не показаны). Окрашивание CK7 локализовалось в цитоплазме в нормальных альвеолярных клетках, но не в отношении нормальных колоректальных эпителиальных клеток. Цитоплазматическое окрашивание CK7 наблюдалось у 10 (90,9%) из 11 образцов первичной ацинарной аденокарциномы легкого, но не у 18 (94,7%) из 19 метастазов в легких образцов колоректального рака и ни в одном из первичных образцов колоректального рака (рис. 1D, E и 1F, таблица 1). С другой стороны, окрашивание CK20 локализовалось в цитоплазме в нормальных колоректальных эпителиальных клетках, но не в нормальных альвеолярных клетках. Положительное цитоплазматическое окрашивание CK20 наблюдалось во всех (100%) 10 первичных образцах колоректального рака и у 16 (84,2%) из 19 метастазов в легкие метастазов колоректального рака, но ни в одном из первичных образцов ацинарной ацинарной агонии легких (рис. 1G, H и 1I, таблица 1).
Образцы экспрессии, полученные иммуногистохимическим анализом, показаны в таблице 2. Все (100%) 10 первичных образцов колоректального рака и 15 (78,9%) из 19 метастазов в легкие метастазов колоректального рака показали β-catenin + / CK7 — / CK20 +. Из 19 метастазов легких образцов колоректального рака 3 (15,8%) и 1 (5,3%) показало образцы β-catenin + / CK7- / CK20- и β-catenin + / CK7 + / CK20 + соответственно. Из 11 первичных ацинарных аденокарциномы легкого ацинара 10 (90,9%) и 1 (9,1%) показали соответственно образцы β-catenin — / CK7 + / CK20- и β-catenin — / CK7 — / CK20. Мы сравнили уровни диагностической точности окрашивания в метастазировании легких образцов колоректального рака и в образцах первичной ацинарной ацинальной ацинальной аллергии. Уровень диагностической точности положительного окрашивания β-catenin был выше, чем у других комбинаций иммуногистохимических образцов. Кроме того, мы провели иммуногистохимию на небольшом образце, полученном с помощью биопсии иглой, и патологический диагноз легкого метастазов колоректального рака. Результаты иммуногистохимии показали, что β-catenin и CK20 были положительными и CK7 был отрицательным (данные не показаны).
Важно определить, является ли опухоль легкого первичным или вторичным раком легких, поскольку стратегии лечения для этих двух клинических ситуаций различны. Однако иногда бывает трудно сделать дискриминирующий диагноз аденокарциномы ацинарного агониста легких и метастазов в легкие при колоректальном раке у пациентов с опухолями легких, которые ранее подвергались операциям колоректального рака. Это исследование было, таким образом, предназначено для определения того, является ли иммуногистохимия β-catenin, CK7 и CK20 полезной для дискриминирующего диагноза этих двух клинических ситуаций.
β-catenin является ключевой молекулой не только в адгезии, связанной с кадгерином, но также и в сигнальном пути Wnt [13]. Устойчивость белка β-catenin регулируется сигнальным путем Wnt [1]. Гликогенсинтаза-киназа-3β фосфорилирует β-катенин, а фосфорилированная форма β-катенина убиквитирована и деградируется протеасомой. Таким образом, белок β-catenin поддерживается на низком уровне в нормальных клетках. Изменения в сигнальном пути Wnt, включая мутации в генах APC, β-catenin и Axin, приводят к накоплению β-catenin в ядре. Ген APC определяется как гейткипер в теории последовательности аденома-карциномы колоректального канцерогенеза, поскольку изменения APC, такие как мутации и потеря гетерозиготности, происходят на ранней стадии колоректального канцерогенеза [14]. Сообщалось, что изменения в генах APC присутствуют в более чем 80% случаев колоректального рака [6,7]. Кроме того, накопление β-катенина в ядре и / или цитоплазме было обнаружено иммуногистохимией в 80% -90% случаев колоректального рака [8,15,16]. Хотя в настоящем исследовании использовалось небольшое количество образцов, как и ожидалось, положительное ядерное и / или цитоплазматическое окрашивание -катенина наблюдалось во всех образцах первичного колоректального рака; это согласуется с предыдущими отчетами. Результаты иммуногистохимии β-catenin для метастазирования легких образцов колоректального рака были такими же, как и для образцов первичного колоректального рака. Кроме того, изменения в сигнальном пути Wnt при раке легкого неясны. Сообщалось, что при раке легких мутации в гене APC не часто встречаются. Однако сообщалось о частых аллельных потерях при 5q, в которых был обнаружен ген APC, и частых гиперметилировании в промоторной области гена APC [17-20]. Хотя неизвестно, влияют ли такие изменения в генах APC на накопление белка β-катенина в цитоплазме и / или ядре, накопление β-катенина не наблюдалось ни в одном из образцов первичной ацинарной ацинарной аденомы легкого в настоящем исследовании. Сообщалось также, что иммуногистохимическое положительное окрашивание β-катенина в ядре наблюдалось менее чем на 10% от первичных образцов неаденома легких легких аденокарциномы [21], аналогично нашему обнаружению. Наши результаты показывают, что иммуногистохимия β-катенина полезна для распознавания диагноза метастазов в легкие при колоректальном раке и аденокарциноме первичной ацинальной аллергии легких.
Существует много сообщений о пользе иммуногистохимии СК с целью выявления диагноза опухолей различного происхождения [22-27]. CKs представляют собой семейство из более чем 30 полипептидов и распределены специфически и специфично для тканей образом [9,10]. Фенотипирование CK комбинированной иммуногистохимией нескольких CK, особенно CK7 и CK20, обычно используется в хирургической патологии для определения происхождения типа клетки или ткани, в которой развилась злокачественная опухоль. Интересно отметить, что фенотип CK различен для каждого гистологического типа рака легкого, включая аденокарциному, плоскоклеточный рак и мелкоклеточный рак [28]. Сообщалось, что CK7 экспрессируется в 97-100% случаев первичной аденокарциномы легких и в 5% -27% случаев первичной аденокарциномы толстой кишки. Напротив, сообщалось, что CK20 экспрессируется в 7-10% случаев первичной аденокарциномы легкого и 92% -100% случаев первичной аденокарциномы толстой кишки [10,23,26]. Мы также проводили иммуногистохимию CK7 и CK20 в наших образцах, и наши результаты согласуются с данными, о которых сообщалось ранее. Наиболее распространенным рисунком окрашивания метастазов в легкие при колоректальном раке является β-catenin + / CK7 — / CK20 +. Из 19 метастазов легких образцов колоректального рака, используемых в нашем исследовании, 78,9% показали β-catenin + / CK7 — / CK20 +. Мы проанализировали несколько комбинаций иммуногистохимических моделей β-catenin, CK7 и CK20. Уровень точности различающего диагноза метастазов в легкие при колоректальном раке и аденокарциноме первичного легкого ацинара, основанный на результатах иммуногистохимии только β-катенина, был выше, чем уровень дискриминационного диагноза, основанного на иммуногистохимии других комбинаций. Однако следует отметить, что приблизительно 10% первичных колоректального рака и первичных образцов рака легкого показали отрицательное и положительное окрашивание β-catenin, соответственно [8,21]. Кроме того, в нескольких образцах были обнаружены необычные образцы окрашивания CK7 или CK20. Полученные результаты свидетельствуют о том, что комбинированная иммуногистохимия β-catenin, CK7 и CK20 полезна для получения более точного распознавания диагноза, чем при использовании иммуногистохимии одного из этих антигенов отдельно или в других комбинациях. В дополнение к β-catenin, CK7 и CK20 коэффициент транскрипции щитовидной железы-1 (TTF-1) может быть полезным маркером для распознавания диагноза метастазов в легкие при колоректальном раке и аденокарциноме первичной ацинальной агонии. TTF-1 является тканеспецифическим транскрипционным фактором, который играет ключевую роль в дифференциации и морфогенезе легких и щитовидной железы. Сообщалось, что положительное окрашивание TTF-1 наблюдалось в 70% -90% случаев первичного рака легких, но не в метастазировании легких при колоректальном раке [29-31]. Поскольку CK7 и TTF-1 являются специфическими маркерами для первичного рака легкого и CK20 и β-catenin для колоректального рака, комбинированная иммуногистохимия этих маркеров может быть ценной для диагностики. Однако важно отметить, что муцинозная бронхиоально-альвеолярная карцинома, являющаяся подтипом аденокарциномы легких, показывает другой фенотип КК. Сообщалось, что 60% случаев муцинозной бронхиоально-альвеолярной карциномы показали CK7 + / CK20 + и что трудно различить муцинозную бронхиоально-альвеолярную карциному от муцинозной колоректальной аденокарциномы, метастатической в легкие, на основе фенотипа CK7 и CK20 [32]. Кроме того, с использованием материала, полученного из опухоли метастазов в легкие при колоректальном раке с помощью биопсии иглой, нам удалось сделать точный дискриминационный диагноз, основанный на результатах иммуногистохимии β-catenin, CK7 и CK20. Трансбронхиальная биопсия легкого и биопсия, основанная на КТ, часто выполняются для получения патологического диагноза опухолей легких. Тем не менее, количество полученного материала иногда недостаточно, чтобы дать возможность диагностировать первичный и вторичный рак легких на основании патологических находок. Тем не менее, иммуногистохимические исследования могут быть легко выполнены с использованием только небольшого количества материала, а результаты позволяют точную диагностику при опухолях легких.
Комбинированная иммуногистохимия β-catenin, CK7 и CK20 полезна для проведения дифференцированного диагноза метастазов в легкие при колоректальном раке и аденокарциноме первичной ацинальной аллергии легких. Часто бывает трудно отличить опухоль легкого от аденокарциномы легкого ацинара или метастазирования рака колоректального рака на основе патологических и морфологических особенностей, особенно при получении небольшого количества материала. Иммуногистохимия с β-катенином, а также с антителами CK7 и CK20 полезна для проведения дискриминационного диагноза, и точный диагноз важен для соответствующего выбора терапевтических стратегий в случаях опухолей легких.
Автор (ы) заявляют, что у них нет конкурирующих интересов.
SI, MF и SS участвовали в иммуногистохимическом анализе. МО и ТП составили рукопись. YI и SO провели статистический анализ. SI и TK участвовали в разработке и координации исследований. YM, MI, YS и NT выбрали образцы тканей. Все авторы прочитали и утвердили окончательную рукопись.
Доступ к этой публикации можно получить здесь:
Эта работа была частично поддержана грантом для научных исследований из Японского общества содействия науке и грантом в помощь от Фонда Мемориала Цучия.
Иммуногистохимический анализ β-catenin, цитокератина 7 и цитокератина 20. (A) Положительное ядерное окрашивание β-катенина при первичном колоректальном раке. (B) Положительное ядерное и цитоплазматическое окрашивание β-catenin в метастазировании легких при колоректальном раке. (C) Отрицательное ядерное и цитоплазматическое окрашивание β-catenin и положительное мембранное окрашивание β-catenin в аденокарциноме первичного ацината легкого. (D и E) Отрицательное окрашивание цитокератина 7 при первичном колоректальном раке и метастазировании легких при колоректальном раке. (F) Положительное цитоплазматическое окрашивание цитокератина 7 в аденокарциноме первичного ацината легкого. (G и H) Положительное цитоплазматическое окрашивание цитокератина 20 при первичном колоректальном раке и метастазировании легкого при колоректальном раке. (I) Отрицательное окрашивание цитокератина 7 в аденокарциноме первичного ацината легкого. Бар 50 мкм
Результаты иммуногистохимии β-catenin, CK 7 и CK 20.
Экспрессионные схемы иммуногистохимии β-catenin, CK 7 и CK 20.
источник