Когда в 1962 году американский ученый обнаружил в экстракте слюнной железы мышей сложное вещество, эпидермальный фактор роста (EGF), состоящий из более чем пяти десятков аминокислот, он и не представлял, что сделал первый шаг к большому открытию, которому будет суждено изменить представление о раке легкого. Но лишь в начале XXI века станет достоверно известно, что мутации рецептора, с которым связывается EGF, могут становиться отправной точкой в развитии одной из самых агрессивных опухолей – рака легкого.
Что такое эпидермальный фактор роста?
Следует отметить, что EGF – белок, необходимый нашему организму. Так, находящийся в слюнных железах эпидермальный фактор роста обеспечивает нормальный рост эпителия пищевода и желудка. Кроме того, EGF содержится в плазме крови, моче, молоке.
Свою работу EGF выполняет, связываясь с рецептором эпидермального фактора роста, EGFR, расположенным на поверхности клеток. Это приводит к активации ферментов тирозинкиназ, которые и передают сигнал о необходимости активной деятельности. В результате происходят несколько последовательных процессов, в том числе увеличение скорости выработки белков и синтез молекулы, которая обеспечивает хранение и реализацию программы развития живых организмов, ДНК. Итогом этого и становится деление клеток.
В 90-х годах прошлого века стала очевидна роль рецептора эпидермального фактора роста как онкогена, играющего одну из ведущих ролей в развитии ряда злокачественных заболеваний.
Эпидермальный фактор роста и рак
В конце XX века было проведено несколько исследований, подтверждающих значение EGF в развитии злокачественных заболеваний. В 1990 году американские ученые доказали, что блокирование связывания эпидермального фактора роста с рецепторами и, как следствие, предотвращение активации фермента тирозинкиназы останавливает рост злокачественных клеток [1].
Конечно, далеко не у всех и не всегда эпидермальный фактор роста «запускает» процессы ненормируемого деления клеток. Чтобы нормальный белок, необходимый для жизнедеятельности нашего организма, вдруг стал его злейшим врагом, в молекуле рецептора эпидермального фактора роста должны произойти генетические изменения, или мутации, которые приводят к многократному увеличению числа рецепторов EGF – их гиперэкспрессии.
Причиной мутаций могут быть потенциально агрессивные факторы окружающей среды, например, токсины, а также курение, поступление канцерогенных веществ с пищей. В некоторых случаях «поломки» в рецепторе эпидермального фактора роста накапливаются на протяжении нескольких поколений, передаваясь от родителей детям. Тогда говорят о наследственных мутациях.
Следует отметить, что «поломки» в молекуле рецептора эпидермального фактора роста связаны с несколькими видами рака. Прежде всего, это немелкоклеточный рак легкого (НМРЛ). Гораздо реже мутации и, как следствие, гиперэкспрессия EGFR приводят к развитию опухолей шеи, головного мозга, толстой кишки, яичника, шейки матки, мочевого пузыря, почки, молочной железы, эндометрия.
Есть ли у вас мутация эпидермального фактора роста?
У некоторых категорий больных вероятность «поломки» значительно повышена. Так, известно, что мутация рецептора эпидермального фактора роста гораздо чаще происходит у людей, которые никогда не курили. Это вовсе не означает, что приверженцы табакокурения реже болеют раком легкого – напротив, известно, что вредная привычка становится причиной развития заболевания в 90% случаев. Просто у курильщиков рак легкого развивается по другому механизму.
Показательные результаты, отражающие распределение мутаций эпидермального фактора роста среди россиян, были получены в одном крупном отечественном исследовании, в котором были изучены данные более 10 тысяч больных раком легкого [2]. Они показали, что мутации EGFR обнаруживались:
- У 20,2% больных аденокарциномой, 4,2% больных плоскоклеточным раком и 6,7% больных крупноклеточной карциномой легкого
- У 38,2% некурящих женщин и только у 15,5% некурящих мужчин
- У 22% курящих женщин и 6,2% курящих мужчин
Кроме того, в исследовании было выявлено, что вероятность появления «поломки» в рецепторе эпидермального фактора роста увеличивается у больных аденокарциномой с возрастом, вырастая от 3,7% в 18-30 лет до 18,5% в 81-100 лет.
Результаты зарубежного исследования, в котором участвовали более 2000 больных аденокарциномой легкого [3], показали, что мутация EGFR была выявлена:
- У 15% больных, которые курили в прошлом
- 6% больных, куривших в настоящем
- 52% больных, которые никогда не курили
Эти данные подтверждают: мутации рецептора эпидермального фактора роста могут быть обнаружены и у тех, кто не представляет жизни без сигареты, просто гораздо реже, чем у приверженцев здорового образа жизни.
Несмотря на вполне однозначную тенденцию распространения «драйвер-мутации» EGFR, точный ответ на вопрос, есть ли эта «поломка» у вас, можно получить только по результатам молекулярно-генетического тестирования, которое проводят всем больным раком легкого.
Если у вас обнаружена мутация EGFR
Еще каких-то десять лет назад у половины больных раком легкого было гораздо меньше шансов успешно бороться с опухолью. Однако сегодня стали доступны препараты, которые позволили в корне изменить эту ситуацию. Речь идет о таргетной терапии, которая стала доступной в последнее десятилетие.
Наличие мутации эпидермального фактора роста, подтвержденное результатами молекулярно-генетического исследования, предоставляет онкологам возможность ввести в схему лечения таргетные препараты. Создание таргетных лекарственных средств для лечения рака легкого стало прорывом в современной онкологии.
Таргетные препараты действуют на первопричину злокачественного заболевания, влияя на сам механизм, запускающий неограниченный клеточный рост и деление. Они блокируют фермент тирозинкиназу, которая передает сигнал к «началу боевых действий» и, собственно, активирует процессы размножения и роста клеток.
Таргетная терапия рака позволяет значительно отдалить его прогрессирование, в том числе и по сравнению со стандартной химиотерапией. Это – значимое преимущество таргетных лекарств.
Способность таргетных препаратов (ингибиторов тирозинкиназы EGFR) продлевать время до прогрессирования опухоли была доказана в крупном анализе, изучающем результаты 23 исследований, в которых участвовало более 14 тысяч больных немелкоклеточным раком легкого с мутацией рецептора эпидермального фактора роста [6].
Важно отметить, что при наличии мутации EGFR лечение рака, как правило, не исчерпывается только таргетными препаратами. Вы должны быть готовым к сложной, длительной и комплексной терапии, в том числе оперативному вмешательству, лучевой терапии и др.
Если у вас не обнаружена мутация EGFR
Отрицательный результат молекулярно-генетического анализа на мутацию EGFR еще не говорит о том, что таргетная терапия вам не поможет. Прежде всего, важно выяснить, обнаружены ли в вашей опухоли какие-либо другие «поломки». Хотя мутация рецептора эпидермального фактора роста является самой распространенной среди больных раком легкого, не исключена вероятность и других, более редких «ошибок».
В современных протоколах, на которые опираются онкологи при подборе индивидуальной схемы лечения НМРЛ, настоятельно рекомендуют проводить развернутый молекулярно-генетический анализ для выявления не только самых распространенных «драйвер-мутаций», но и редких «поломок». Современный выбор таргетных препаратов позволяет подобрать «целевое» лекарство для большинства известных мутаций при раке легкого.
Если же в образце вашей опухоли не было обнаружено ни одной генетической «ошибки», таргетная терапия вам действительно не показана. Препараты, которые созданы для того, чтобы попадать «в яблочко», бесцельно не принимают, поскольку они просто не будут работать. Но у онкологов есть и другие терапевтические возможности, которые в вашем случае будут эффективны: это химиотерапия и, возможно, иммунотерапия. И все же вы должны помнить – индивидуальную схему лечения будет определять ваш лечащий врач, опираясь на данные о гистологическом типе вашей опухоли, стадии заболевания и др.
- Divgi C.R., et al. Phase I and Imaging Trial of Indium 111-Labeled Anti-Epidermal Growth Factor Receptor Monoclonal Antibody 225 in Patients With Squamous Cell Lung Carcinoma. JNCI J. Natl. Cancer Inst. Oxford University Press, 1991. Vol.83, №2, P. 97-104.
- Imyanitov E.N., et al. Distribution of EGFR Mutations in 10,607 Russian Patients with Lung Cancer. Mol. Diagn. Ther. Springer International Publishing, 2016. Vol.20, №4, P. 40-406.
- D’Angelo S.P., et al. Incidence of EGFR exon 19 deletions and L858R in tumor specimens from men and cigarette smokers with lung adenocarcinomas. J. Clin. Oncol. American Society of Clinical Oncology , 2011. Vol.29, №15, P. 2066-2070.
- Sharma S.V., et al. Epidermal growth factor receptor mutations in lung cancer. Nat. Rev. Cancer. 2007. Vol.7, №3, P. 169-181.
- Lynch T.J., et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non-Small-Cell Lung Cancer to Gefitinib. N. Engl. J. Med. Massachusetts Medical Society, 2004. Vol.350, №21, P. 2129-2139.
- Lee C.K., et al. Impact of EGFR Inhibitor in Non-Small Cell Lung Cancer on Progression-Free and Overall Survival: A Meta-Analysis. JNCI J. Natl. Cancer Inst. Oxford University Press, 2013. Vol.105, №9, P. 595-605.
При копировании материалов
ссылка на сайт обязательна.
источник
Раздел находится в стадии наполнения
Исследование клеток опухолевой ткани легких, взятой при помощи биопсии проводится наряду с гистологическими исследованиями для более точной диагностики заболевания и назначения правильного лечения. Наличие какой-либо мутации помогает определить резистентность опухоли к различным видам воздействия, а также проверить целесообразность использования того или иного вида терапии.
Для рака легких характерно разрастание определенных видоизмененных клеток, которые и образуют опухоль. Данное заболевание может протекать совершенно бессимптомно на ранних стадиях, поэтому любое подозрение на злокачественные новообразования в легких должно быть проверено лечащим врачом.
Генетический тест на рак легких (выявление соматических мутаций в опухолевой ткани, связанных с данной формой рака) проводится при уже подтвержденном диагнозе. Это исследование становится обязательным для всех пациентов, так как от его результатов зависит метод лечения.
Данный ген кодирует один из рецепторов, активирующихся при связывании с эпидермальным фактором роста. При нарушении хотя бы в одном из кодонов этого участка ДНК, EGFR запускает клеточный рост в различных тканях, что приводит к образованию опухоли.
Повышенная активность гена является неблагоприятным фактором для течения уже имеющейся болезни. EGFR мутации ведут к активной пролиферации клеток опухоли, и в большинстве случаев запускают механизм развития метастазов в раннем периоде болезни.
Существует два вида нарушений в генетическом материале – герминальные и соматические мутации. Первые являются врожденными и не зависят от образа жизни и влияния различных факторов на человека. Соматические мутации возникают у каждого конкретного пациента и не передаются по наследству.
Большинство соматических мутаций EGFR при раке легкого обнаруживаются в 18 и 21 экзонах. Наиболее распространены делеции в 19 экзоне.
Ген EGFR имеет ряд мутаций, непосредственно связанных с раком легких, практически все они являются соматическими. Наличие изменений в данном отрезке ДНК наиболее часто провоцирует аденокарциному при немелкоклеточном раке. Наиболее часто встречаются данные мутации у представителей азиатской расы.
Федеральные клинические рекомендации по диагностике и лечению больных раком легкого Общероссийского союза общественных объединений Ассоциации онкологов России от разработали тактики лечения новообразований в легких согласно статусу мутаций в генах EGFR и ALK.
Описанный ген является не единственным маркером рака легких. Структурные изменения в гене KRAS присутствуют практически в 50% опухолей немелкоклеточного рака легких. Клетки, несущие такие мутации, проявляют резистентность к тирозинкиназе, поэтому требуется применения других лекарственных препаратов.
Ген TP53 является супрессором, предотвращающим неконтролируемое деление клеток и отвечающим за восстановление ДНК. Мутация Arg72Pro в гене ТР53 провоцирует около 50-75% спорадических форм немелкоклеточного рака легких, а также является одной из причин синдрома Ли-Фраумени.
Мутации в гене PTEN характерны для синдрома Коудена. Он запускает возникновение новообразований, которые могут быть как доброкачественными, так и онкогенными.
Ген PIK3CA связан с канцерогенезом во многих видах рака (рак легких, груди, толстой кишки и др.). Этот белок запускает чрезмерное размножение злокачественных клеток в тканях организма. Мутации в этом отрезке ДНК сопутствуют многим разновидностям рака и ухудшают течение болезни. При выявлении данной мутации врач определяет индивидуальную терапевтическую стратегию, направленную на максимальное увеличение продолжительности и улучшение качества жизни пациента.
Современные научные исследования определили две тактики блокады EGFR – терапия с помощью моноклональных антител и ингибирование тирозинкиназы. Опухоли с различными мутациями в экзонах 18, 19, 21 с большой вероятностью откликаются на оба метода воздействия.
Для выбора тактики лечения, а также для контроля эффективности методов, предложенных врачом, проводится молекулярно-генетическое исследование. Для анализа используется опухолевая ткань, а также венозная кровь пациента. Обнаружение мутации в крови дает основание предполагать наличие схожих изменений ДНК у ближайших родственников.
Наиболее надежным и современным способом исследования является пиросеквенирование. Данный вид анализа позволяет выявить различные изменения в определенных участках хромосом, с высокой точностью определить мутацию и назначить таргетные препараты для лечения.
источник
Современная медицина сделала впечатляющий рывок вперед. Значительно повысилась продолжительность жизни у людей на поздних стадиях рака легких. Опыт специалистов клиники «ВитаМед» позволяет гарантировать внимательную и точную дифференциацию мутаций при раке легких, с подбором подходящего курса лечения для повышения качества жизни и высоких шансов на успешное лечение.
Мутация EGFR
Эта мутация встречается преимущественно у некурящих людей. Обнаружение такой мутации на поздних стадиях рака представляет собой обнадеживающий признак, поскольку предполагает восприимчивость к лечению ингибиторами тирозинкиназы (препараты эрлотиниб и гефитиниб).
Транслокации ALK
По данным исследований, эта мутация при раке легкого более характерна у молодых и некурящих пациентов. Её обнаружение говорит о чувствительности к кризотинибу.
Мутация KRAS
Обычно данная мутация при лаке легкого встречается у курильщиков. Особой роли для прогноза не играет. При анализе статистических данных указано – встречались и случаи ухудшения состояния, и улучшения, что не позволяет сделать однозначный вывод о её влиянии.
Транслокация ROS1
Эта мутация, подобно транслокации ALK, преимущественно встречается у молодых, некурящих пациентов. В ходе клинических испытаний установлена высокая чувствительность таких опухолей к лечению кризотинибом, сейчас ведутся исследования препаратов нового поколения.
Мутация HER2
Обычно изменения представлены точечными мутациями. Опухолевые клетки в своей жизнедеятельности не зависят критическим образом от этой мутации, однако по результатам новых испытаний выявлен частичный положительный эффект у пациентов с комбинированным лечением посредством трастузумаба и цитостатических средств.
Мутация BRAF
Некоторые больные с мутациями этого гена (вариант V600E) поддаются лечению дабрафенибом, ингибитора белка B-RAF, кодируемого геном BRAF.
Мутация МЕТ
Ген МЕТ кодирует тирозинкиназный рецептор фактора роста гепатоцитов. Встречается увеличение числа копий этого гена (амплификация), при этом сам ген редко подвергается мутациям, и их роль изучена недостаточно.
Амплификация FGFR1
С данной амплификацией сталкиваются 13-26% пациентов с плоскоклеточным раком легких. Обычно распространена среди курящих пациентов, на практике предполагает неблагоприятный прогноз. Однако ведется соответствующая работа по разработке препаратов, направленных на это нарушение.
Чтобы точно диагностировать рак легких, предусмотрена бронхоскопия с забором биоптата для проведения цитологического и гистологического исследований. После того как из лаборатории поступит заключение о наличии мутации и выявленном типе мутации, будет составляться подходящая тактика медикаментозного лечения, назначаются соответствующие биологические препараты.
Каждая программа терапии индивидуальна. Биологическая терапия предполагает работу с двумя типами лекарств, которые различаются по принципу воздействия на опухоль, но направлены на одинаковый окончательный эффект. Их цель – блокирование мутации клеток на молекулярном уровне, без вредного последствия для здоровых клеток.
За счет стабильного целевого действия исключительно на клетки опухоли удается приостановить рост злокачественных клеток уже спустя несколько недель. Чтобы поддержать достигнутый эффект, требуется продолжение курса приема препаратов. Лечение с помощью препаратов практически не сопровождается побочными эффектами. Но постепенно возникает невосприимчивость клеток к действующим компонентам лекарств, поэтому нужно корректировать лечение по мере необходимости.
На долю мутации гена EFGR приходятся порядка 15% всех случаев. В таком случае для лечения может использоваться один из ингибиторов EGFR: эрлотиниб (Тарцева) или гефитиниб (Иресса); созданы и более активные препараты нового поколения. Данные лекарства обычно не вызывают тяжелых побочных эффектов, выпущены в форме капсул либо таблеток.
Транслокация генов ALK/EML4, на долю которой приходятся 4-7% всех случаев, предполагает назначение кризотиниба (Ксалкори); разрабатываются его более активные аналоги.
При опухолевом ангиогенезе для его подавления предполагается терапия с препаратом бевацизумаб (Авастин). Назначается препарат вместе с химиотерапией, значительно повышая эффективность данного лечения.
Онкологические заболевания требуют тщательной диагностики и индивидуального подхода для определения курса эффективного лечения – обязательные условия, которые готовы обеспечить специалисты клиники «ВитаМед».
источник
Три эксперта в области онкологии о раке, наследственности и генетическом тестировании
Онкологические заболевания ежегодно уносят миллионы жизней. Среди причин смерти рак занимает второе место после сердечно-сосудистых заболеваний, а по сопровождающему его страху — определённо первое. Такая ситуация сложилась из-за представления, что рак сложно диагностировать и практически невозможно предотвратить.
Однако каждый десятый случай заболеваемости раком — это проявление мутаций, заложенных в наших генах с самого рождения. Современная наука позволяет их отловить и значительно уменьшить риск возникновения заболевания.
Эксперты в области онкологии рассказывают, что такое рак, как сильно на нас влияет наследственность, кому показано генетическое тестирование в качестве меры профилактики и как оно может помочь, если рак уже обнаружен.
Рак — это, по сути, генетическое заболевание. Мутации, вызывающие онкологические заболевания, либо наследуются, и тогда они есть во всех клетках организма, либо появляются в какой-то ткани или конкретной клетке. Человек может унаследовать от родителей определённую мутацию в гене, который защищает от рака, или мутацию которая сама по себе может привести к раку.
Ненаследственные мутации возникают в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения.
В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет. Этот путь люди проходят гораздо быстрее, если уже при рождении они унаследовали поломку. Поэтому при опухолевых синдромах рак возникает в гораздо более молодом возрасте.
Прошлой весной вышла замечательная статья в Science — о случайных ошибках, которые возникают в ходе удвоения молекул ДНК и являются основным источником появления онкогенных мутаций. При таких видах рака, как рак простаты, их вклад может достигать 95%.
Чаще всего причиной возникновения рака являются именно ненаследственные мутации: когда никаких генетических поломок человек не унаследовал, но в течение жизни в клетках накапливаются ошибки, которые рано или поздно приводят к возникновению опухоли. Дальнейшее накопление этих поломок уже внутри опухоли может сделать её более злокачественной или привести к возникновению новых свойств.
Несмотря на то, что в большинстве случаев онкологические заболевания возникают из-за случайных мутаций, надо очень серьёзно относиться к наследственному фактору. Если человек знает об имеющихся у него унаследованных мутациях, он сможет предотвратить развитие конкретного заболевания, риск возникновения которого у него очень велик.
Есть опухоли с ярко выраженным наследственным фактором. Это, например, рак молочной железы и рак яичников. До 10% случаев заболеваемости этими видами рака связаны с мутациями в генах BRCA1 и BRCA2. Самый распространенный среди нашего мужского населения вид рака — рак лёгкого — в основной массе вызывается внешними факторами, а конкретнее — курением.
Но если предположить, что внешние причины исчезли, то роль наследственности стала бы примерно такой же, как и у рака молочной железы. То есть, в относительном соотношении для рака лёгкого наследственные мутации видны довольно слабо, но в абсолютных числах это всё же вполне существенно.
Кроме того, наследственный компонент довольно значительно проявляет себя в раке желудка и поджелудочной железы, колоректальном раке, опухолях головного мозга.
Большая часть онкологических заболеваний возникает за счёт сочетания случайных событий на клеточном уровне и внешних факторов. Однако в 5-10% случаев предопределяющую роль в возникновении рака играет наследственность.
Представим себе, что одна из онкогенных мутаций появилась в половой клетке, которой повезло стать человеком. Каждая из примерно 40 триллионов клеток этого человека (а также его потомков) будет содержать мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой, а риск заболеть определённым видом рака у носителя мутации будет существенно выше.
Повышенный риск развития рака передаётся из поколения в поколение вместе с мутацией и называется наследственным опухолевым синдромом. Опухолевые синдромы встречаются достаточно часто — у 2-4% людей, и вызывают 5-10% случаев рака.
Анджелина Джоли сделала профилактические операции, поскольку три её близких родственницы умерли от рака молочных желез и яичников (источник: fs.kinomania.ru)
Благодаря Анджелине Джоли самым известным опухолевым синдромом стал наследственный рак молочной железы и яичников, который вызывается мутациями в генах BRCA1 и BRCA2. У женщин с этим синдромом риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания гораздо ниже — 5,6%. Увеличивается вероятность развития рака и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин еще и предстательной железе.
Наследственные формы есть практически у любого онкологического заболевания. Известны опухолевые синдромы, которые вызывают рак желудка, кишечника, мозга, кожи, щитовидной железы, матки и другие, менее распространённые типы опухолей.
Знать о том, что у вас или и у ваших родственников есть наследственный опухолевый синдром, может быть очень полезно для того, чтобы снизить риск развития рака, диагностировать его на ранней стадии, и эффективнее лечить заболевание.
Носительство синдрома можно определить с помощью генетического теста, а на то, что вам стоит сдать тест, укажут следующие особенности семейной истории.
- Несколько случаев одного вида рака в семье;
- Заболевания в раннем для данного показания возрасте (для большинства показаний – раньше 50 лет);
- Единичный случай определенного вида рака (например, рак яичников);
- Рак в каждом из парных органов;
- Больше одного типа рака у родственника.
Если для вашей семьи характерно что-либо из вышеперечисленного, вам следует проконсультироваться у врача-генетика, который определит, есть ли медицинские показания для того, чтобы сдавать генетический тест. Носителям наследственных опухолевых синдромов следует проходить тщательный скрининг на онкологические заболевания для того, чтобы обнаружить рак на ранней стадии. А в некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Несмотря на то, что наследственные опухолевые синдромы встречаются очень часто, западные национальные системы здравоохранения пока не ввели генетическое тестирование на носительство мутаций в широкую практику. Тесты рекомендуется сдавать лишь при наличии определённой семейной истории, указывающей на определённый синдром, и только в том случае, если известно, что тестирование может принести человеку пользу.
К сожалению, такой консервативный подход пропускает множество носителей синдромов: слишком мало людей и врачей подозревает о существовании наследственных форм рака; высокий риск заболевания далеко не всегда проявляется в семейной истории; многие пациенты не знают о заболеваниях своих родственников, даже когда есть, кого спросить.
Всё это — проявление современной медицинской этики, которая гласит, что знать человеку стоит только то, что принесет ему больше пользы, чем вреда.
Причём право судить о том, что такое польза, что такое вред, и как они соотносятся друг с другом, врачи оставляют исключительно себе. Медицинское знание — такое же вмешательство в мирскую жизнь, как таблетки и операции, и поэтому меру знания должны определять профессионалы в светлых одеждах, а то как бы чего не вышло.
Я, как и мои коллеги, считаю, что право на знание о собственном здоровье принадлежит людям, а не врачебному сообществу. Мы делаем генетический тест на наследственные опухолевые синдромы, чтобы те, кто хочет узнать о своих рисках развития рака, могли реализовать это право, и взять на себя ответственность за собственную жизнь и здоровье.
В процессе развития рака клетки изменяются и теряют свой первоначальный генетический «вид», унаследованный от родителей. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Чтобы узнать слабые места опухоли, нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
Нестабильность генома позволяет опухоли копить генетические нарушения, которые могут быть выгодными для самой опухоли. К ним относятся мутации в онкогенах — генах, которые регулируют деление клеток. Такие мутации могут многократно повышать активность белков, делать их нечувствительными к тормозящим сигналам или вызывать повышенную выработку ферментов. Это приводит к неконтролируемому делению клеток, а впоследствии и к метастазированию.
Некоторые мутации имеют известные эффекты: мы знаем, как именно они меняют структуру белков. Это даёт возможность разработать лекарственные молекулы, которые будут действовать только на опухолевые клетки, и при этом не будут уничтожать нормальные клетки организма. Такие препараты называют таргетными. Чтобы современная таргетная терапия работала, нужно до назначения лечения знать, какие мутации есть в опухоли.
Эти мутации могут различаться даже в пределах одного типа рака (нозологии) у разных пациентов, и даже в опухоли одного пациента. Поэтому для некоторых лекарств молекулярно-генетическое тестирование рекомендовано в инструкции к препарату.
Определение молекулярных изменений опухоли (молекулярное профилирование) — важное звено в цепочке принятия клинических решений, а его значимость будет только расти со временем.
На сегодняшний день в мире проводится более 30 000 исследований противоопухолевой терапии. По разным данным, до половины из них используют молекулярные биомаркеры для включения больных в исследование или для наблюдения в ходе лечения.
Но что даст пациенту молекулярное профилирование? Где его место в клинической практике сегодня? Хотя для ряда лекарств тестирование является обязательным, это всего лишь «надводная часть айсберга» современных возможностей молекулярного тестирования. Результаты исследований подтверждают влияние различных мутаций на эффективность лекарств, а некоторые из них можно встретить в рекомендациях международных клинических сообществ.
Однако известно ещё не менее 50 дополнительных генов и биомаркеров, анализ которых может быть полезным в выборе лекарственной терапии (Chakravarty et al., JCO PO 2017). Их определение требует использования современных методов генетического анализа, таких как высокопроизводительное секвенирование (NGS). Секвенирование позволяет обнаружить не только распространенные мутации, но «прочитать» полную последовательность клинически значимых генов. Это позволяет выявить все возможные генетические изменения.
На этапе анализа результатов используются специальные биоинформатические методы, которые помогают выявить отклонения от нормального генома даже если важное изменение встречается в небольшом проценте клеток. Интерпретация полученного результата должна опираться на принципы доказательной медицины, так как не всегда ожидаемый биологический эффект подтверждается в клинических исследованиях.
Из-за сложности процесса проведения исследований и интерпретации результатов молекулярное профилирование пока не стало «золотым стандартом» в клинической онкологии.
Однако есть ситуации, в которых этот анализ может существенно повлиять на выбор лечения:
К сожалению, даже на фоне правильно подобранного лечения заболевание может прогрессировать, и не всегда есть выбор альтернативной терапии в рамках стандартов для данного онкологического заболевания. В этом случае молекулярное профилирование может выявить «мишени» для экспериментальной терапии, в том числе в рамках клинических исследований (например TAPUR).
Некоторые виды рака, например, немелкоклеточный рак лёгкого или меланома, известны множеством генетических изменений, многие из которых могут быть мишенями для таргетной терапии. В таком случае молекулярное профилирование может не только расширить выбор возможных вариантов лечения, но и помочь расставить приоритеты при выборе препаратов.
Молекулярное исследование в таких случаях помогает на начальном этапе определить более полный спектр возможных вариантов лечения.
Молекулярное профилирование и персонализация лечения требуют сотрудничества специалистов из нескольких областей: молекулярной биологии, биоинформатики и клинической онкологии.
Поэтому такое исследование, как правило, стоит дороже обычных лабораторных тестов, а его ценность в каждом конкретном случае может определить только специалист.
источник
Немелкоклеточный рак легкого (НМРЛ)
- плоскоклеточный рак (40% больных)
- аденокарцинома (40–50% больных)
- крупноклеточный рак (5–10% больных)
Мелкоклеточный рак легкого (МРЛ)
Таргетная терапия является основой лечения пациентов с НМРЛ. Интенсивное исследование точных молекулярных механизмов рака легких выявило возможность не только избирательно влиять на патологический молекулярный каскад в опухолевой клетке при помощи таргетных препаратов, но также определять эффективность / побочные эффекты классической химиотерапии и давать прогноз развития заболевания и метастатического потенциала опухоли.
Возможность исследования свободноциркулирующей опухолевой ДНК ( технология жидкостной биопсии ) открывает новые горизонты в диагностике, мониторинге и лечении рака легкого.
В последнее время генетическое тестирование позволило выделить подтипы рака легкого с наличием активирующих мутаций в ряде онкогенов. Наибольшее значение имеют мутации в генах EGFR, BRAF, MET и транслокации с участием генов ALK и RET. Нарушения в этих генах являются мишенями для таргетной терапии.
В отличие от химиотерапии, которая убивает любые клетки, включая здоровые, таргетная терапия действует на раковые клетки специфическим образом, точечно на конкретную мишень. Таргетная терапия обладает гораздо меньшим спектром побочных эффектов в сравнении со стандартной химиотерапией.
Становится очевидной необходимость комплексного генетического тестирования, позволяющего одномоментно диагностировать все возможные «мишени» для таргетной терапии
Представляем тесты для анализа мутаций, связанных с эффективностю таргетных препаратов
| ХАРАКТЕРИСТИКА | NGS | ПЦР | СЕКВЕНИРОВАНИЕ ПО СЭНГЕРУ |
|---|---|---|---|
| Чувствительность (доля мутантного аллеля в образце) | 0.1% | 1% | 15-20% |
| Возможность определения точных координат мутации | + | — | + |
| Возможность исследования ранее не описанных мутации | + | — | + |
| Возможность исследования соматических мутаций в плазме | + | + | — |
Панели генов позволяют определить наличие мутаций сразу в нескольких генах, что дает возможность сразу подобрать оптимальное лечение и делают исследование экономически эффективным
Панель для рака легкого базовая
Базовая панель позволяет подобрать лечение таргетными препаратами за короткое время.
Гены входящий в панель: EGFR, BRAF, KRAS, NRAS
- Частота мутаций в гене EGFR при аденокарциноме легкого составляет 25%.
- Мутация L858R и делеции 19 экзона гена EGFR ассоциированы с наибольшим ответом на лечение ингибиторами тирозинкиназ: гефитинибом, эрлотинибом и афатинибом.
- Мутации в гене BRAF встречаются в 4% случаев немелкоклеточного рака легкого.
- Обнаружение мутации в гене позволяет назначить препараты ингибиторы BRAF: вемурафениб и траметиниб.
Мутации в генах KRAS и NRAS обнаруживаются почти у 30% пациентов с немелкоклеточным раком легкого. Наибольшая частота драйверных мутаций обнаруживается в гене KRAS. Мутации в генах KRAS и NRAS чаще всего взаимоисключающие с мутациями в гене EGFR и транслокациями гена ALK.
Базовая панель для рака легкого предоставляет почти половине пациентов с немелкоклеточным раком легкого важную информацию, определяющую дальнейшую тактику диагностики и лечения.
Обнаружение мутаций в генах EGFR и BRAF позволяет назначить пациенту таргетную терапию. В то же время наличие мутации в генах KRAS и NRAS избавляет пациента от дальнейшего поиска транслокаций с участием гена ALK.
Базовая панель выполняется с помощью секвенирования нового поколения (NGS), что позволяет одномоментно диагностировать несколько сотен мутаций по низкой цене.
Стоимость исследования 4 генов методом NGS соответствует стоимости исследования одного гена методом ПЦР, а в ряде случаев даже дешевле.
Вместе с базовой панелью возможно выполнение
исследования на транслокации гена ALK
Исследование транслокаций с участием ген ALK выполняется методом
флуоресцентной гибридизации in situ или FISH методом
- Транслокации с участием гена ALK встречается в 4% случаев НМРЛ. Обнаружение транслокации с участием гена ALK позволяет назначить таргетные препараты, ингибиторы тирозинкиназы ALK кризотиниб, церитиниб.
Панель для рака легкого базовая
Панель для рака легкого базовая
+ транслокации ALK
источник
У многих людей, страдающих раком лёгких, появилась надежда на возврат к полноценной жизни и даже полное выздоровление. Применение на практике принципов персонализированной медицины позволило ведущим израильским онкологам перейти на качественно новую ступень лечения этого тяжёлого недуга. Персонализированная медицина базируется на строго индивидуальном подходе к разработке программы терапии для каждого больного, что предполагает такие мероприятия, как: изучение особенностей клеток обнаруженной опухоли; назначение лекарственных средств последнего поколения; экспериментальная проверка схемы лечения, вплоть до создания целевых препаратов для конкретного пациента.
Несмотря на неутешительные данные мировой статистики о том, что более чем у половины (53,4%) больных рак лёгких обнаруживают на поздних стадиях и их шанс на выздоровление равен всего лишь 3,4%, профессор Нир Пелед уверен: уровень выживаемости таких пациентов в ближайшее время можно увеличить до 20%. Это утверждение председателя Международной ассоциации рака лёгких, ведущего онколога-пульмонолога Герцлия Медикал Центр и клиники Бейлинсон базируются на анализе уже полученных результатов лечения больных с онкологическими патологиями лёгких.
Так, если два десятилетия тому назад после диагностики злокачественной опухоли лёгких на поздних стадиях развития средняя продолжительность жизни пациентов составляла около 4 месяцев, сейчас этот срок увеличился в 10 раз – 3,5 года. При этом и качество жизни больных значительно улучшилось. Одним из важных факторов такого успеха является применение на практике принципов персонализированной медицины при лечении онкологических патологий дыхательной системы.
Для рака лёгких характерно агрессивное течение: новообразование может всего за месяц увеличиться вдвое, тогда как выраженная симптоматика появляется только на поздних стадиях. При этом еще в недавнем прошлом протоколы консервативного лечения различных видов этой патологии были идентичны, без учета гистологии и цитологии опухоли. На основе практического опыта израильские врачи пришли к выводу о необходимости разработки индивидуальных планов терапии в зависимости от цитологического типа раковых клеток, выявленных у конкретного больного.
С целью точной дифференциации рака лёгких проводят бронхоскопию с забором биоптата для гистологического и цитологического исследований. После получения из лаборатории заключения о наличии мутагенеза и обнаруженном типе мутации клеток опухоли разрабатывается тактика медикаментозного лечения с назначением биологических препаратов. Благодаря использованию израильскими врачами биомолекулярного анализа и назначению по его результатам целевой терапии у многих пациентов с последней стадией рака лёгких продолжительность жизни превышает 3,5 года.
В настоящее время проведение таргетной терапии при онкологических патологиях лёгких актуально приблизительно для 30% пациентов. В эту группу входят те, у кого выявлены определенные виды мутагенеза, поддающиеся лечению уже созданными препаратами. Однако израильские онкологи под руководством профессора Нира Пеледа продолжают изучение механизмов мутации и разработку новых лекарств, поэтому вполне вероятно, что уже скоро список показаний для назначения биологических препаратов будет расширен.
Для биологической терапии используется лекарства двух видов, они различаются принципом действия на опухоль, но обладают одинаковым окончательным эффектом. Эти препараты блокируют механизм мутации клеток на молекулярном уровне, не оказывая негативного влияния на здоровые клетки, как это происходит при химиотерапии. Постоянное целевое воздействие только на клетки самой опухоли через 3–4 месяца приводит к прекращению злокачественного процесса. Для поддержания этого состояния прием биологических лекарств необходимо продолжать на протяжении всей жизни. Биологическое лечение назначется вместо традиционно применяемой при лечении рака легких химиотерапии и лучевой терапии и практически почти не имеет побочных эффектов.
Однако постепенно (в течение 1-2 лет) формируется невосприимчивость злокачественных клеток к действующим веществам препаратов таргетной терапии, в этом случае возникает необходимость в незамедлительной коррекции назначенного лечения. Основным методом наблюдения за течением опухолевого процесса является регулярное (через каждые 3 месяца) проведение компьютерной томографии. Если при очередном обследовании положительная динамика отсутствует, выполняют биопсию и, в зависимости от ее результатов, принимают решение о тактике дальнейшего лечения.
- При обнаружении мутации гена EFGR (приблизительно 15% случаев) возможно проведение лечения одним из трех препаратов, прошедших лицензирование в американской организации FDA: «Иресса», «Тарцева», «Афатиниб». Эти лекарственные средства не обладают тяжёлыми побочными эффектами, выпускаются в виде таблеток или капсул для перорального приёма.
- При наличии транслокации генов ALK/EML4 (от 4 до 7 процентов случаев) назначают лицензированное в Израиле лекарственное средство «Кризотиниб».
- Для подавления опухолевого ангиогенеза применяют препарат «Авастин», который опосредованно влияет на этот процесс за счёт связывания белка VEGF. «Авастин» назначают совместно с химиотерапией, что существенно увеличивает её эффективность.
При разработке схемы терапии злокачественной патологии у конкретного больного израильские специалисты ориентируются не только на результаты диагностических тестов, в частности гистологического и цитологического исследований опухолевых клеток. Они выбирают программу терапии и экспериментальным путем с использованием лабораторных животных. Фрагменты ткани, взятой из опухоли пациента, вживляют нескольким мышам, затем каждой из 5-6 заболевших особей проводят лечение по тому или иному плану с назначением как уже апробированных, так и новых препаратов, находящихся на стадии клинических испытаний. Для пациента используют терапевтическую программу, которая оказалась наиболее эффективной при лечении лабораторных мышей.
источник
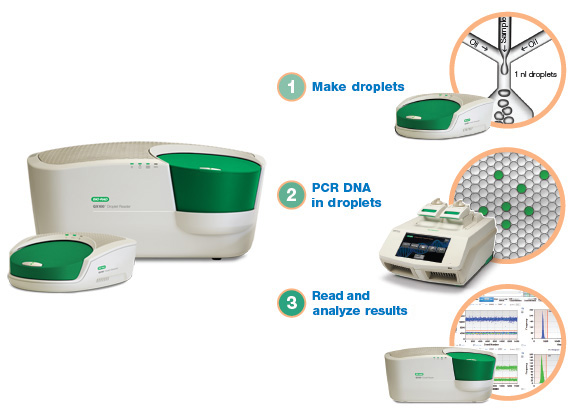
Простой анализ крови может быстро и точно обнаружить мутации в двух основных генах при немелкоклеточных опухолях легких, демонстрируя потенциал теста в качестве клинического инструмента для выявления пациентов, которые могут получить положительный результат от лекарственных препаратов, направленных на борьбу с данными мутациями.
Немелкоклеточные опухоли легких являются наиболее распространенной формой рака легких, которые обнаруживаются более чем у 200,000 человек в США каждый год. Приблизительно 30% пациентов с немелкоклеточным раком легких имеют мутации в одном из генов, включенных в недавно проведенное исследование, и часто могут проходить лечение с использованием методов таргетной терапии.
Врачи-онкологи в Онкологическом институте Дана-Фарбера (Бостон, штат Массачусетс, США) и их коллеги в плановом порядке включили в исследование 180 пациентов с немелкоклеточным раком легких, из которых у 120-ти болезнь была впервые диагностирована, а у 60-ти возникла устойчивость к предыдущему лечению, что позволило болезни повториться. Бесклеточная ДНК участников исследования была проверена на мутации в генах рецептора эпидермального фактора роста (EGFR) и гомолога вирусного онкогена саркомы крыс Кирстен (KRAS), а также на отдельную мутацию в EGFR, которая позволяет опухолевым клеткам становиться устойчивыми к первой линии лекарственных препаратов направленного действия.
Тест был выполнен с использованием технологии, известной как капельная цифровая полимеразная цепная реакция (ПЦР) (Bio-Rad; Геркулес, штат Калифорния, США), которая вычисляет количество отдельных символов генетического кода в бесклеточной ДНК, чтобы определить, присутствуют ли характерные мутации. Каждому участнику также была проведена обычная биопсия ткани, чтобы проверить на наличие тех же самых мутаций. Затем результаты жидких биопсий сравнили с результатами биопсий ткани. Время выполнения генотипирования тканей было измерено от даты предварительного генотипирования до сообщения заключительного результата генотипирования.
Данные показали, что жидкие биопсии обеспечивали результаты намного быстрее. Среднее время выполнения жидких биопсий составляло 3 дня, по сравнению с 12 днями, необходимыми для выполнения биопсий ткани пациентам, у которых болезнь была впервые диагностирована, и 27 днями для больных, устойчивых к действию лекарственных препаратов. Также было определено, что жидкая биопсия является очень точной. У пациентов с впервые диагностированным заболеванием прогностическая ценность капельной цифровой ПЦР плазмы крови составляла 100% для первичной мутации EGFR и мутации KRAS, означая, что пациент, который получил положительный результат теста на любую мутацию, должен был точно иметь данную мутацию в своей опухоли. Для пациентов с мутацией EGFR, связанной с устойчивостью, прогностическая ценность капельного цифрового ПЦР-анализа составляла 79%, и это позволяет предположить, что анализ крови смог обнаружить новые случаи заболевания вследствие мутации, которые были пропущены при использовании стандартного метода проведения биопсий.
Доктор Линетт Шолл (Lynette Sholl), патолог, сказала: “Данные исследования являются убедительными. Мы проверили полученные авторами данные результатов исследования путем перекрестного сравнения результатов жидких биопсий и биопсий ткани у 34 больных немелкоклеточным раком легких. Чтобы использоваться в качестве реального клинического теста, жидкая биопсия должна обеспечивать надежные, точные данные и быть практичной с точки зрения логистики. Это как раз было продемонстрировано при использовании анализа крови, основанного на капельной цифровой ПЦР. Тест имеет большую практическую ценность и для пациентов, у которых немелкоклеточный рак легких был впервые диагностирован, и для тех, у кого произошел рецидив заболевания. Он экономит время и позволяет провести количественную оценку, поскольку указывает на количество мутировавшей ДНК в образце, что может быть легко использовано в центрах лечения рака”.
Исследование было опубликовано 7 апреля 2016 года в журнале JAMA Oncology.
источник
Определение перестройки гена ALK при раке легкого методом ИГХ – исследование гистологических препаратов биопсийного материала рака легкого, проводимое с использованием меченных флюоресцирующими веществами антител, которое позволяет выявить наличие в опухолевых клетках продукта экспрессии мутированного гена, ответственного за злокачественную трансформацию.
Определение транслокации гена ALK (иммуногистохимический анализ).
ALK Mutation (Gene Rearrangement), EML4-ALK Fusion Protein, ALK (Anaplastic Lymphoma Receptor Tyrosine Kinase) Gene Rearrangement, ALK Gene Fusion.
Какой биоматериал можно использовать для исследования?
Образец ткани, образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Общая информация об исследовании
Современные успехи в лечении онкологических заболеваний во многом связаны с обнаружением молекулярных механизмов возникновения и развития злокачественных новообразований, отличающих их от клеток нормальных тканей, и появлением лекарственных препаратов, способных воздействовать на них. Такие лекарства называются таргетными, то есть действующими на определенную «цель» в опухолевой клетке. Они обладают хорошим профилем безопасности, так как в отличие от стандартной химиотерапии практически не действуют на нормальные ткани, а также характеризуются большей эффективностью. Однако назначение таргетных препаратов возможно лишь при обнаружении в опухолевых клетках специфической мишени для их действия. Сравнительно часто патологическим механизмом злокачественной трансформации клеток является нарушение в так называемых сигнальных путях. Сигнальный путь представляет собой цепь, по которой активирующий сигнал от рецептора, располагающегося на поверхности клетки, через несколько внутриклеточных белков передается в ядро. Такие внутриклеточные белки называются тирозинкиназами, их основная роль – передача сигнала от активированного рецептора путем биохимических реакций.
При немелкоклеточном раке легкого в некоторых случаях причиной злокачественной трансформации клеток может быть перестройка в гене, кодирующем одну из рецепторных тирозинкиназ – ALK (anaplastic lymphoma receptor tyrosine kinase – киназа анапластической лимфомы). В норме активация рецептора сигнального пути, в котором участвует ALK, приводит к пролиферации клеток. В гене ALK зашифрована аминокислотная последовательность как активной части фермента, так и белка-регулятора, который контролирует активность тирозинкиназы. Перестройка в гене приводит к тому, что шифр белка регулятора заменяется на другой – чаще всего кодирующий белок EML4. В результате образуется химерный – сливной – ген EML4-ALK. Белок EML4 способен облегчать белковые взаимодействия, поэтому вследствие генной перестройки ALK попадает под регулирующее влияние EML4, становится независимой от возбуждения своих рецепторов и постоянно посылает пролиферативные сигналы, что приводит к неконтролируемому делению клеток.
Транслокации EML4-ALK в клетках рака легкого были впервые выявлены в 2007 году, а через три года появился таргетный препарат, способный ингибировать активность тирозинкиназы ALK – кризотиниб (ксалкори). Встречаемость перестройки EML4-ALK при раке легкого, по разным данным, колеблется от 3 до 13 %.
Наличие в опухолевых клетках химерной тирозинкиназы может быть выявлено при иммуногистохимическом исследовании биоптата или операционного материала опухоли. Для анализа из готового парафинового блока с помощью специального микроножа нарезают тончайшие срезы, которые затем прикрепляют к предметным стеклам и красят рутинными красителями, чтобы было возможно отличить клетки друг от друга и от межклеточного вещества. Затем срезы на стеклах окрашиваются раствором антител, меченных флюоресцирующими метками, специфичными к мутированной ALK. Если в опухолевой клетке присутствует искомый фермент, антитела связываются с ним и при просмотре стекла под специальным микроскопом можно увидеть флюоресценцию, что будет свидетельствовать о положительном результате теста.
Для чего используется исследование?
- Для выявления показаний к терапии ингибитором ALK кризотинибом.
Когда назначается исследование?
- У пациентов с метастатическим или местнораспространенным немелкоклеточным раком легкого с отсутствием мутации гена EGFR.
Результат выдается с заключением врача.
Положительный результат – обнаружение флюоресценции, свидетельствующее о наличии в клетках продукта экспрессии мутированного гена;
отрицательный результат – отсутствие флюоресценции.
Что может влиять на результат?
Качество предоставленных парафиновых блоков, опыт и квалификация врача-патоморфолога, так как иммуногистохимический метод не в полной мере стандартизирован и оценка его результатов в некоторой степени субъективна.
Несмотря на отсутствие транслокации ALK, пациентам может быть показана терапия кризотинибом – при выявлении транслокации гена ROS1, в ходе которой образуется тирозинкиназа, родственная ALK. Исследование проводится у пациентов с немелкоклеточным раком легкого с отрицательным статусом мутаций EGFR и ALK.
Позитивный и сомнительные результаты иммуногистохимического теста на транслокацию гена ALK обязательно должны быть проверены с помощью молекулярной диагностики – FISH-исследования. При этом кризотиниб может назначаться пациентам с положительным результатом иммуногистохимического исследования без ожидания результатов подтверждающего теста.
- Цитологическое исследование материала, полученного при оперативном вмешательстве
- Цитологическое исследование материала, полученного при эндоскопии (бронхоскопия)
- Гистологическое исследование биопсийного материала
- Гистологическое исследование биоптата лимфатического узла (1 узел) с использованием рутинных методик окраски
- Определение мутации гена EGFR в тканях опухолей
- Определение мутации гена BRAF в тканях опухолей
- Определение перестройки гена ALK при раке легкого методом FISH
- Определение транслокации гена ROS1 при раке легкого
источник
Анализ мутации в гене EGFR при раке легких для определения чувствительности к препаратам Иресса и Тарцева
Рецептор эпидермального фактора роста EGFR (HER1) играет важную роль в пролиферации эпителиальных клеток. Белок EGFR имеет тирозин-киназную (ТК) активность, которая необходима для передачи сигнала при его активации. От 15% до 50% случаев немелкоклеточного рака легких (НМРЛ) несут активирующие мутации в гене EGFR. Частота мутаций EGFR зависит от клинических характеристик пациентов (курение,пол, этническое происхождение).
Препараты Iressa® (Гефитиниб), Tarceva® (Эрлотиниб) и Gilotrif® (Афатиниб) являются ингибиторами TK EGFR которые применяются в современной таргетной терапии НМРЛ. Эффективность лечения этими препаратами зависит от статуса генов EGFR, KRAS и других факторов.
Известны активирующие мутации гена EGFR связанные с чувствительностью либо устойчивостью к ингибиторам TK. Подавляющее большинство мутаций связанных с чувствительностью (
90%) — это делеции в 19 экзоне (Del19) или замена L858R в 21 экзоне; каждая из этих мутаций составляет
45% случаев опухолей с мутациями. Опухоли с мутациями Del19 или L858R наиболее чувствительны к терапии ингибиторами TK EGFR. Прочие мутации связанные с чувствительностью (G719X, L861Q, S768I и некоторые другие) составляют в сумме
Инсерции 20 экзона связаны с устойчивостью к ингибиторам ТК и составляют
3% опухолей с мутациями. Еще одна мутация связанная с устойчивостью – T790M — составляет 1-3% случаев de novo и около 50% случаев резистентности которая развивается после химиотерапии ингибиторами TK. По рекомендациям Евро-пейского общества медицинских онкологов (ESMO) и Американского общества клинической онкологии (ASCO) наличие активирующих мутаций в гене EGFR связанных с чувствительностью к ингибиторам TK EGFR является показанием к применению этих препаратов.
Кому рекомендуется EGFR тест?
Тест на мутации гена EGFR рекомендуется пациентам с НМРЛ для оценки возможности химиотерапии ингибиторами ТК EGFR.
Наличие в опухоли активирующих мутаций связанных с чувствительностью к ингибиторам ТК EGFR является показанием к химиотерапии этими препаратами. Стоимость EGFR теста составляет незначительную часть стоимости курса лечения и позволяет избирательно применять ингибиторы TK EGFR только для лечения тех пациентов, для которых эти препараты эффективны.
Какие мутации в гене EGFR являются показанием к применению ингибиторов TK-EGFR?
Согласно решениям Европейского медицинского агенства (ЕМА) в ЕС показанием к применению Гефитиниба, Эрлотиниба и Афатиниба при НМРЛ является наличие в опухоли активирующих мутаций EGFR – Del19, L858R или других более редких мутаций (L861Q, G719X и др.). В США по решению FDA показаниями к применению Эрлотиниба и Афатиниба является наличие мутаций Del19 или L858R.
Какие методы применяются в лаборатории генодиагностики «БиоЛинк» для детекции мутаций EGFR?
В лаборатории генодиагностики «БиоЛинк» используются ПЦР тест на делеции EGFR Del19 с визуализацией результатов методом гель-элетрофореза и тесты на основе аллель-специфичной ПЦР в режиме реального времени для детекции мутаций Del19, L858R, L861Q, G719A/C/S, S768I, T790M.
Материал для исследования
Материалом для выявления мутаций в гене EGFR может служить:
источник
Обнаружение мутаций гена EGFR при немелкоклеточном раке легкого: уроки одноуровневого рутинного анализа 1403 образцов опухолей
Активация мутаций рецептора эпидермального фактора роста (EGFR) в опухолях легких связана с драматическим ответом на ингибиторы тирозинкиназы. Поэтому рутинный анализ патологических образцов является обязательным в клинической практике. Мы проспективно тестировали опухоли у кавказских пациентов с опухолями легких в период с января 2010 года по июнь 2012 года. ДНК была экстрагирована из фиксированных формалином тканей, содержащих парафин, после макродиссекции. Замещение p.L858R оценивали с помощью аллельспецифических ПЦР и экзонов 19 с помощью ПЦР и анализа фрагментов ДНК. Используя прочный процесс от отбора проб пациентов до методов скрининга, мы проанализировали образцы у 1403 пациентов. Статус EGFR можно было бы успешно определить для 1 322 пациентов. Мутации EGFR были обнаружены у 179 (13,5%) пациентов с преобладанием гистологии женщин и аденокарциномы. Мутированные пациенты были значительно старше, чем не мутировавшие пациенты. Аналогичные скорости мутаций были получены с первичными опухолями и метастазами, а также с хирургической резекцией, бронхиальной биопсией, биопсией иглы с КТ и аспирацией трансбронхиальной иглы. Чувствительность наших анализов позволила нам обнаружить мутации EGFR в бедных ( G) или делецию экзона 19 (NCI-H1650: p.E746-A750del, c.2235 -2249del) в ДНК дикого типа. Это показало, что наши методы позволили нам обнаружить изменение EGFR, когда оно присутствует, по крайней мере, на 1% (мутация p.L858R) или 2% клеток (удаление exon 19). Однако ДНК, экстрагированная из образцов FFPE, имеет гораздо более низкое качество, чем ДНК, выделенная из клеточных линий. Поэтому, чтобы избежать ложных отрицательных результатов, мы полагали, что в образце должно присутствовать минимум 10% опухолевых клеток. Если в образце, имеющем менее 10% опухолевых клеток, не было обнаружено изменений, мы пришли к выводу, что тест не был связан с этим.
Чтобы оценить специфичность наших анализов, мы повторили анализ большого количества образцов с использованием утвержденного набора (Therascreen EGFR RGQ kit, Qiagen, Hilden, Germany). Мы опробовали 160 образцов, которые не представили мутацию на экзонах 19 и 21 и 98 образцов, представляющих делецию 19 или точную мутацию L858R. Для всех этих образцов были получены одинаковые результаты.
Наконец, наша лаборатория была вовлечена во внешние схемы качества, организованные в Западной Франции в 2010 и 2011 годах. В течение этого периода были протестированы двадцать образцов NSCLC, и мы нашли согласованные результаты с 5 другими центрами во всех этих случаях. Совсем недавно мы также участвовали в первой схеме внешнего контроля качества, организованной Французским национальным институтом рака. Разделы из 10 образцов NSCLC были отправлены во все лаборатории, проводящие тестирование EGFR во Франции. Мы получили ожидаемый результат для всех этих образцов, используя наши процедуры.
В обычной практике секторы FFPE были отправлены из отдела патологии в отдел молекулярной биологии каждый раз в среду, и отчеты были отправлены онкологам в следующую пятницу. Таким образом, время обработки лаборатории молекулярной биологии составляет 48 часов.
Наше исследование состояло из 1403 пациентов с НМРЛ (417 женщин и 725 мужчин, средний возраст 64). Тесты не удались в 43 случаях (3,1%) из-за недостаточного качества ДНК (
). В 38 случаях (2,7%), где мы не смогли обнаружить изменение EGFR, содержание опухолевых клеток в образце считалось слишком низким для заключения. Оставшиеся 1 322 выполненных теста (94,2%) были полезными. Мы смогли идентифицировать изменение EGFR у 179 пациентов (13,5%). Они включали 93 исключения exon 19 (52,7% обнаруженных изменений) и 86 точечных мутаций L858R (48,3%) (
Клинико-патологические особенности пациентов с EGFR-мутантными или опухолями дикого типа в нашей когорте суммируются в
источник