Вы наверняка не раз задавались этим вопросом, если у кого-то из ваших родственников обнаруживали онкологическое заболевание. Многие люди теряются в догадках – что делать, если бабушки и прабабушки умирали в 30-40 лет, а никакой информации об их заболеваниях нет? А если они умирали в 60 «по старости», как и все в то время, была ли это онкология? Может ли она возникнуть у меня?
Когда родственник заболевает раком, нам страшно. В какой-то мере страшно и за свое здоровье – передается ли рак по наследству? Прежде чем делать поспешные выводы и впадать в панику, давайте разберемся с этим вопросом.
Мы в клинике «Медицина 24/7» стараемся активно применять достижения генетиков в повседневной практике: определяем предрасположенность к различным видам рака и наличие мутаций – с помощью генетических исследований. Если вы входите в группу риска – о ней мы расскажем чуть позже – вам стоит обратить внимание на эти исследования. А пока – вернемся к вопросу.
По своей сути, рак – генетическое заболевание, которое возникает вследствие поломки генома клетки. Раз за разом в клетке происходит последовательное накопление мутаций, и она постепенно приобретает свойства злокачественной – малигнизируется.
Генов, которые участвуют в поломке, несколько, и перестают работать они не одновременно.
- Гены, кодирующие системы роста и деления, называются прото-онкогенами. При их поломке клетка начинает бесконечно делиться и расти.
- Есть гены-супрессоры опухолей, отвечающие за систему восприятия сигналов от других клеток и тормозящие рост и деление. Они могут сдерживать рост клетки, а при их поломке этот механизм выключается.
- И, наконец, есть гены репарации ДНК, кодирующие белки, которые чинят ДНК. Их поломка способствуют очень быстрому накоплению мутаций в геноме клетки.
Существует два сценария возникновения мутаций, вызывающих онкологические заболевания: ненаследственный и наследственный. Ненаследственные мутации появляются в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения. В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет.
Однако, в 5-10% случаев предопределяющую роль играет наследственность. Происходит это в том случае, когда одна из онкогенных мутаций появилась в половой клетке, которой посчастливилось стать человеком. При этом каждая из примерно 40*1012 клеток организма этого человека также будет содержать начальную мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой.
Повышенный риск развития рака передается из поколения в поколение и называется наследственным опухолевым синдромом. Встречается данный синдром довольно часто – примерно у 2-4% населения.
Несмотря на то, что основную массу онкологических заболеваний вызывают случайные мутации, наследственному фактору также необходимо уделять серьезное внимание. Зная об имеющихся унаследованных мутациях, можно предотвратить развитие конкретного заболевания.
Предрасположенность к раку наследуется как Менделевский доминантный признак, иными словами, как обычный ген с различной частотой возникновения. При этом вероятность возникновения в раннем возрасте у наследственных форм выше, чем у спорадических.
Коротко расскажем вам об основных видах генетических исследований, которые показаны людям из группы риска. Все эти исследования можно провести в нашей клинике.
Определение мутации в гене BRCA
В 2013 году благодаря Анджелине Джоли весь мир активно обсуждал наследственный рак молочной железы и яичников, о мутациях в генах BRCA1 и BRCA2 теперь знают даже неспециалисты. Из-за мутаций теряются функции белков, кодируемых этими генами. В результате основной механизм репарации (восстановления) двунитевых разрывов молекулы ДНК нарушается, и возникает состояние геномной нестабильности – высокой частоты мутаций в геноме клеточной линии. Нестабильность генома является центральным фактором канцерогенеза.
Учеными описано более тысячи различных мутаций в этих генах, многие из которых (но не все) связаны с повышенным риском возникновения онкологического заболевания.
У женщин с нарушениями в BRCA1/2 риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания – всего 5,6%. Растет вероятность развития злокачественных опухолей и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин – и в предстательной железе.
Генетическая предрасположенность к наследственному неполипозному колоректальному раку (синдром Линча)
Колоректальный рак – одно из самых распространенных онкологических заболеваний в мире. Около 10% населения имеет генетическую предрасположенность к нему.
Генетический тест на синдром Линча, также известного как наследственный неполипозный колоректальный рак (НПКР), определяет заболевание с точностью 97%. Синдром Линча – наследственное заболевание, в результате которого злокачественная опухоль поражает стенки толстого кишечника. Считается, что около 5% всех случаев колоректального рака связаны с этим синдромом.
Определение мутации в гене BRaf
При наличии меланомы, опухолей щитовидной или предстательной железы, опухоли яичников или кишечника рекомендуется (а в некоторых случаях обязательно) проведение анализа на BRaf мутацию. Это исследование поможет выбрать необходимую стратегию лечения опухоли.
BRAF – это онкоген, который отвечает за кодировку белка, располагающегося в сигнальном пути Ras-Raf-MEK-MARK. Этот путь, в норме, регулирует деление клеток под контролем фактора роста и различных гормонов. Мутация в онкогене BRaf приводит к избыточному неконтролируемому разрастанию и устойчивости к апоптозу (запрограммированной смерти). Результатом является в несколько раз ускоренное размножение клеток и рост новообразования. По показаниям данного исследования специалист делает заключение о возможности использования ингибиторов BRaf, которые продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией.
Методика проведения анализа
Любой генетический анализ – сложная многоэтапная процедура.
Генетический материал для анализа берут из клеток, как правило, из клеток крови. Но в последнее время лаборатории переходят на неинвазивные методы и иногда выделяют ДНК из слюны. Выделенный материал подвергается секвенции – определению последовательности мономеров при помощи химических анализаторов и реакций. Эта последовательность и является генетическим кодом. Полученный код сравнивают с эталонным и определяют, какие участки относятся к тем или иным генам. На основании их наличия, отсутствия или мутации делают заключение о результатах теста.
Сегодня в лабораториях множество методов генетического анализа, каждый из них хорош в тех или иных ситуациях:
- FISH–метод (fluorescence in situ hybridization ). В полученный от пациента биоматериал вводят специальный краситель – ДНК-пробу с флуоресцентными метками, которые способны показать хромосомные аберраций (отклонения), значимые для определения наличия и прогноза развития некоторых злокачественных процессов. Например, метод удобен при определении копий гена HER-2, важного признака при лечении рака молочной железы.
- Метод сравнительной геномной гибридизации (CGH). Метод позволяет сравнить ДНК здоровой ткани пациента и ткани опухоли. Точное сравнение дает понять, какие именно участки ДНК повреждены, а это дает инструменты для выбора целенаправленного лечения.
- Секвенирования нового поколения (NGS) – в отличие от более ранних методов секвенирования, «умеет читать» сразу несколько участков генома, поэтому успоряет процесс «чтения» генома. Применяется для определения в определенных участках генома полиморфизмов (замена нуклеотидов в цепи ДНК) и мутаций, связанных с развитием злокачественных опухолей.
За счет большого количества химических реактивов процедуры генетических исследований достаточно финансово затратные.. Мы стараемся устанавливать оптимальную стоимость всех процедур, поэтому цена на такие исследования у нас начинается от 4 800 рублей.
В группы риска по наследственному раку попадают люди, у которых наблюдается хотя бы один из перечисленных факторов:
- Несколько случаев одного вида рака в семье
(например, рак желудка у деда, отца и сына); - Заболевания в раннем для данного показания возрасте
(например, колоректальный рак у пациента моложе 50 лет); - Единичный случай определенного вида рака
(например, рак яичников, или трижды негативный рак молочной железы); - Рак в каждом из парных органов
(например, рак левой и правой почки); - Больше одного типа рака у родственника
(например, сочетание рака молочной железы и рака яичников); - Рак, нехарактерный для пола пациента
(например, рак молочной железы у мужчины).
Если для человека и его семьи характерен хотя бы один фактор из списка, то следует получить консультацию у врача-генетика. Он определит, есть ли медицинские показания для того, чтобы сдавать генетический тест.
Чтобы обнаружить рак на ранней стадии, носителям наследственного опухолевого синдрома следует проходить тщательный скрининг на онкологические заболевания. В некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Генетический «вид» раковой клетки в процессе развития изменяется и теряет свой первоначальный вид. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Для выявления слабых мест опухоли нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
При проведении теста опухоль анализируется, составляется индивидуальный молекулярный паспорт. В комплексе с анализом крови, в зависимости от требуемого теста, проводится комбинацирование различных анализов на геном и белок. В результате данного теста появляется возможность назначения таргетной терапии, эффективной для каждого типа имеющейся опухоли.
Бытует мнение, что для определения предрасположенности к раку можно сделать простой анализ на наличие онкомаркеров – специфических веществ, которые могут быть продуктами жизнедеятельности опухоли.
Повышение показателя может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. В то же время, есть примеры людей с онкологическими заболеваниями, у которых значения онкомаркера оставались в пределах нормы. Специалисты используют онкомаркеры как метод для отслеживания протекания уже обнаруженного заболевания, результаты которого нужно перепроверять.
Для выявления вероятности генетической наследственности в первую очередь, если вы входите в группу риска, нужно обратиться за консультацией к врачу-онкологу. Специалист, исходя из вашего анамнеза, сделает вывод о необходимости проведения тех или иных исследований.
Важно понимать, что решение о проведении какого-либо теста должен принять именно врач. Самолечение в онкологии неприемлемо. Неправильно интерпретированные результаты не только могут вызвать преждевременную панику – вы попросту можете упустить наличие развивающегося онкологического заболевания. Выявление рака на ранней стадии при наличии вовремя поставленного правильного лечения дает шанс на выздоровление.
Рак – неизбежный спутник долгоживущего организма: вероятность накопления соматической клеткой критического числа мутаций прямо пропорциональна времени жизни. То, что рак – генетическое заболевание, не значит, что оно наследственное. Он передается в 2-4% случаев. Если у вашего родственника обнаружили онкологическое заболевание – не впадайте в панику, этим вы навредите и себе, и ему. Обратитесь к врачу-онкологу. Пройдите исследования, которые он вам назначит. Лучше, если это будет специалист, который следит за прогрессом в области диагностики и лечения рака и в курсе всего, что вы сами только что узнали. Следуйте его рекомендациям и не болейте.
источник
Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Каждая клетка человеческого организма содержит около 30 тысяч генов. Среди них есть те, которые контролируют рост и размножение клетки, ее продолжительность жизни, отвечают за «починку» поврежденной ДНК.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Генетические исследования в онкологии помогают решать важные задачи:
- Обнаружить наследственные мутации и оценить риск развития рака, своевременно принять профилактические меры.
- Разобраться, есть ли у человека генетические дефекты, связанные с повышенным риском онкологических заболеваний, которые он может передать своим детям.
- Составить «молекулярно-генетический портрет» опухоли и выяснить, к каким препаратам она чувствительна.
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Протоонкогены кодируют белки, активирующие деление клеток. В норме они должны «включаться» лишь в определенное время. Если в протоонкогене возникает мутация, либо он становится чрезмерно активным (например, из-за увеличения количества копий), он превращается в онкоген, и нормальная клетка становится опухолевой.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Гены-супрессоры опухолей ограничивают размножение клеток, восстанавливают поврежденную ДНК, отвечают за «смерть» отработавших своё клеток. Рак возникает из-за того, что в результате мутаций эти гены перестают справляться со своей функцией. Например, гены BRCA1 и BRCA2 отвечают за репарацию ДНК. При наследственных мутациях в них у женщин повышен риск того, что будет диагностирован рак молочной железы, яичников.
Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
- замену оснований — «букв» генетического кода;
- делеции — утрату участка хромосомы;
- инсерции — «лишние» вставки ДНК в хромосомах;
- изменение числа копий определенного гена;
- фьюжн-мутации — слияние генов, в результате которого образуется новый, гибридный ген;
- микросателлитную нестабильность;
- мутационную нагрузку опухоли.
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Если речь идет о наследственных мутациях, для анализа достаточно сдать кровь из вены. Для составления «молекулярно-генетического портрета» рака чаще всего нужен биоптат — образец ткани злокачественной опухоли. Существует и более современная методика — жидкостная биопсия, когда исследуют ДНК опухолевых клеток, циркулирующую в крови.
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь. Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
источник
Высокая заболеваемость раком заставляет онкологов ежедневно трудиться над вопросами ранней диагностики и эффективного лечения. Генетический анализ на рак – это один из современных способов профилактики онкозаболеваний. Однако, так ли достоверно это исследование и всем ли оно должно назначаться? – вопрос, который беспокоит и ученых, и врачей, и пациентов.
Сегодня генетический анализ на рак позволяет выявить риск развития онкопатологий:
- молочной железы;
- яичников;
- шейки матки;
- простаты;
- легких;
- кишечника и толстой кишки в частности.
Также, существует генетическая диагностика на некоторые врожденные синдромы, существование которых повышает вероятность развития рака нескольких органов. Например, синдром Ли-Фраумени говорит о риске рака мозга, надпочечников, поджелудочной железы и крови, а синдром Пейтца-Егерса говорит о вероятности онкопатологий пищеварительной системы (пищевод, желудок, кишечник, печень, поджелудочная железа).
На сегодня ученые обнаружили ряд генов, изменения в которых в большинстве случаев приводят к развитию онкологии. Ежедневно в нашем организме развиваются десятки злокачественных клеток, но иммунная система, благодаря особым генам, способна с ними справиться. А при поломках в тех или иных структурах ДНК, эти гены работают неправильно, что дает шанс развитию онкологии.
Так, гены BRCA1 и BRCA2 защищают женщин от развития рака яичников и молочных желез, а мужчин – от рака предстательной железы. Поломки в этих генах напротив показывают, что имеется риск развития карциномы данной локализации. Анализ на генетическую предрасположенность к раку как раз дает информацию об изменениях в этих и других генах.
Поломки в этих генах передаются по наследству. Всем известен случай Анджелины Джоли. В ее семье был случай рака молочной железы, поэтому актриса решила пройти генетическую диагностику, которая и выявила мутации в генах BRCA1 и BRCA2. Правда, единственное, чем смогли помочь врачи в этом случае – провести операцию по удалению груди и яичников, чтобы не было точки приложения для мутировавших генов.
Противопоказаний к сдаче данного анализа не существует. Однако, не стоит его делать в качестве рутинного обследования и приравнивать к анализу крови. Ведь не известно, как результат диагностики повлияет на психологическое состояние пациента. Поэтому назначаться анализ должен только при наличии строгих к тому показаний, а именно зарегистрированных случаев рака у кровных родственников или при имеющемся у пациента предраковом состоянии (например, доброкачественное образование молочной железы).
Генетический анализ достаточно прост для пациента, так как проводится путем одного забора крови. После кровь подвергается молекулярно-генетическому исследованию, что позволяет определить мутации в генах.
В лаборатории имеется несколько реактивов, специфичных для той или иной структуры. За один забор крови может проводиться обследование на поломки в нескольких генах.
Специальной подготовки исследование не требует, однако следовать общепринятым правилам при сдаче крови не помешает. К таким требованиям относится:
- Исключение алкоголя за неделю до диагностики.
- Не курить в течение 3-5 дней перед сдачей крови.
- За 10 часов до обследования не есть.
- В течение 3-5 дней до сдачи крови придерживаться диеты с исключением жирных, острых и копченых продуктов.
Наиболее изученным является обнаружение поломок в генах BRCA1 и BRCA2. Однако, с течением времени врачи стали замечать, что годы генетического исследования значительно не повлияли на смертность женщин от рака молочной железы и яичников. Поэтому в качестве скринингового метода диагностики (проводимого каждому человеку) метод не годиться. А как обследование групп риска генетическая диагностика имеет место.
Основной акцент анализа на генетическую предрасположенность к раку состоит в том, что при поломке в определенном гене человек имеет риск развития рака или же риск передачи этого гена своим детям.
Доверять или нет полученным результатам – личное дело каждого пациента. Возможно, не следует при отрицательном результате проводить превентивное лечение (удаление органа). Однако, если поломки в генах обнаружены, то пристально следить за своим здоровьем и регулярно проводить профилактическую диагностику определенно стоит.
Чувствительность и специфичность – это понятия, которые показывают достоверность теста. Чувствительность говорит о том, сколько процентов пациентов с дефектным геном будет выявлено данным тестом. А показатель специфичности говорит о том, что с помощью данного теста будет обнаружена именно та поломка гена, которая кодирует предрасположенность к онкологии, а не к другим заболеваниям.
Определить процентные показатели для генетической диагностики рака достаточно сложно, так как исследовать нужно много случаев положительных и отрицательных результатов. Возможно, позже ученые смогут дать ответ на данный вопрос, но уже сегодня можно с точностью утверждать, что обследование имеет высокую чувствительность и специфичность, и на его результаты можно полагаться.
Полученный ответ не может на 100% уверить пациента в том, что он заболеет или не заболеет раком. Отрицательный результат генетического тестирования говорит о том, что риск развития рака не превышает средних цифр в популяции. Положительный ответ дает более точную информацию. Так, у женщин с мутациями в генах BRCA1 и BRCA2 риск карциномы груди составляет 60-90%, а карциномой яичников – 40-60%.
Данный анализ не имеет четких показаний к сдаче, будь то определенный возраст или состояние здоровья больного. Если у матери 20-ти летней девушки был обнаружен рак молочной железы, то ей не стоит ждать 10 или 20 лет чтобы обследоваться. Рекомендовано тут же пройти генетическое исследование на рак, чтобы подтвердить или исключить мутацию генов, кодирующих развитие онкопатологий.
Касательно опухолей предстательной железы, каждому мужчине после 50 лет с аденомой простаты или хроническим простатитом полезно будет провести генетическую диагностику, чтобы так же оценить риск. А вот выполнять диагностику лицам, в семье которых не было случаев злокачественной болезни, скорее всего неуместно.
Вы не уверены в правильности поставленного диагноза и назначенного Вам лечения? Ваши сомнения поможет развеять видеоконсультация специалиста мирового уровня. Это реальная возможность воспользоваться квалифицированной помощью лучших из лучших и при этом ни за что не переплачивать.
Показанием к проведению генетического анализа на рак являются случаи выявления злокачественных новообразований у кровных родственников. А назначаться обследование должно врачом-генетиком, который после и оценит результат. Возраст пациента для сдачи теста не имеет никакого значения, так как поломка в генах заложена с рождения, поэтому если в 20 лет гены BRCA1 и BRCA2 в норме, то выполнять то же исследование через 10 и более лет смысла нет.
При правильном проведении диагностики каких-либо экзогенных факторов, которые могут повлиять на результат нет. Однако, у небольшого количества пациентов в ходе обследования могут обнаруживаться генетические поломки, интерпретация которых невозможна по причине недостаточной изученности. И в сочетании неизвестных изменений с мутациями в раковых генах, могут повлиять на результат тестирования (т.е. снижается специфичность метода).
Генетический анализ на рак – это не исследование с четкими нормами, не стоит надеяться, что пациент получит на руки результат, где будет четко написано “низкий”, “средний” или “высокий” риск развития рака. Результаты обследования могут оцениваться только врачом-генетиком. На окончательный вывод влияет история семьи пациента:
- Развитие злокачественных патологий у родственников до 50 лет.
- Возникновение опухолей одной и той же локализации в нескольких поколениях.
- Повторные случаи рака у одного и того же человека.
Сегодня подобная диагностика не оплачивается страховыми компаниями и фондами, поэтому все расходы пациент вынужден брать на себя.
В Украине исследование одной мутации стоит около 250 грн. Однако, для достоверности данных должно быть исследовано несколько мутаций. Например, для рака молочной железы и яичников исследуется 7 мутаций (1750 грн.), для рака легких – 4 мутации (1000 грн.).
В России генетический анализ на рак молочной железы и яичников стоит порядка 4500 руб.
источник
Простата — это небольшая железа, часть мужской репродуктивной системы. Она производит секрет простаты, входящий в состав семенной жидкости. Предстательная железа находится прямо под мочевым пузырем, по форме и размеру напоминает грецкий орех. Она может увеличиваться с возрастом. Через нее проходит мочеиспускательный канал — уретра. Простата есть только у мужчин, поэтому рак предстательной железы также встречается только у мужчин.
Согласно статистике Национального Института Онкологии США рак простаты является третьим по распространенности и составляет 9.5% от всех новых зарегистрированных случаев развития рака в Америке на 2018 год. Наиболее часто (почти в 40% случаев) он диагностируется у мужчин в возрасте от 65 до 74 лет.
Рак предстательной железы часто растет настолько медленно, что большинство мужчин умирают от других причин до того, как болезнь станет клинически продвинутой.
Выживаемость мужчин с раком простаты связана со многими факторами, особенно с распространенностью опухоли во время диагностики. Так, 100% мужчин проживут 5 и более лет с раком, который не вышел за пределы простаты.
- трудности с мочеиспусканием: частое (больше семи раз в сутки) и/или болезненное мочеиспускание;
- кровь в моче или сперме;
- затрудненная эрекция;
- боль в нижней части спины, бедрах, костях.
Есть несколько типов рака простаты, но наиболее распространённым является аденокарцинома, развивающаяся из клеток железы. К другим, более редким, типам рака простаты относятся: саркомы, мелкоклеточный рак, нейроэндокринные опухоли и переходноклеточный рак.
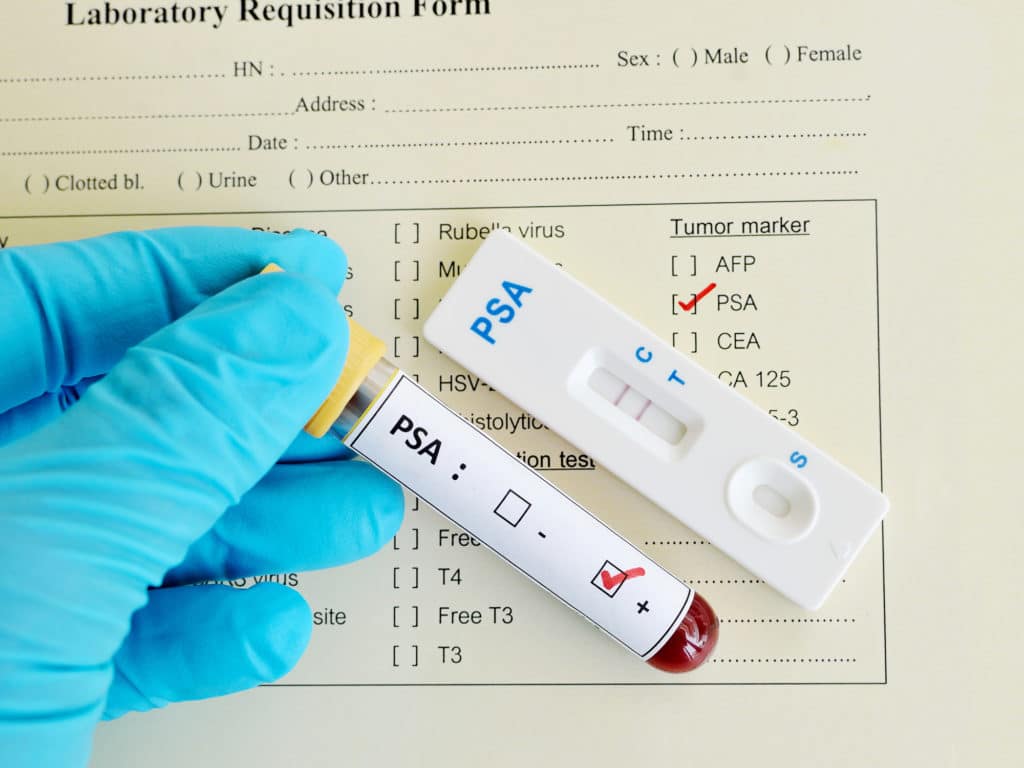
Большинство случаев рака простаты на ранних стадиях выявляется в результате анализа крови на простатический специфический антиген (ПСА) или ректального обследования.
Пока нет единого мнения о пользе скрининга рака предстательной железы, поскольку его результаты могут привести к гипердиагностике и ненужному лечению.
Однако обсудить возможность скрининга с лечащим врачом следует:
- мужчинам старше 50 лет в средней группе риска;
- мужчинам старше 45 лет в высокой группе риска. Например, если у близкого родственника мужчины был диагностирован рак предстательный железы в возрасте до 65 лет;
- мужчинам до 40 лет в очень высокой группе риска. Если у нескольких родственников был диагностирован рак простаты в молодом возрасте.
При этом врач должен четко объяснить всю последовательность действий, которые ждут человека во время диагностики.
Простатический специфический антиген или ПСА — это белок, вырабатываемый как здоровыми, так и пораженными клетками предстательной железы. Раньше нормальным для здорового мужчины считался показатель ПСА 4.0 нг/мл и ниже. Однако дополнительные исследования показали, что уровень ПСА в крови зависит от множества факторов и может варьироваться у одного и того же мужчины.
Бывали случаи, когда рак простаты развивался у мужчин с ПСА ниже 4. И, наоборот, повышенный результат ПСА не всегда означает наличие рака.
Наличие инфекции мочевыводящих путей или простатита повышает уровень ПСА в крови. Кроме того, некоторые лекарства занижают его. К ним относятся финастерид и дутастерид, предназначенные для лечения доброкачественной гиперплазии предстательной железы.
Тестирование крови на уровень ПСА часто дает ложноположительный (когда мужчина, не имеющий рака предстательной железы, диагностируется с этим заболеванием) или ложноотрицательный результат. Чтобы уточнить диагноз, пациенту приходится проходить дополнительные обследования. Это пальцевое ректальное обследование, а также биопсию. Биопсия в редких случаях вызываетболь, провоцирует инфекции, кровотечения и кровь в моче или сперме.
Кроме того, с тестом на ПСА врачи обнаруживают небольшие бессимптомные опухоли. Они могут медленно расти в течение многих лет и никак не влиять на жизнь мужчины. Однако процесс их лечения (хирургическое вмешательство и лучевая терапия) может значительно снизить качество жизни и оказать негативное влияние на нормальное функционирование кишечника и половых органов, на процесс мочеиспускания.
- У 720 мужчин будет отрицательный результат ПСА-теста.
- 178 мужчин будут с положительным ПСА-результатом, но при повторном анализе выяснится, что у них нет рака простаты.Четверо из этих 178 столкнутся с осложнениями биопсии — инфекциями и кровотечениями вплоть до госпитализации.
- У 102 мужчин подтвердится диагноз “рак простаты”.
- 33 из этих 102 диагностированных раков простаты не приведут к развитию заболевания или смерти. Однако из-за того, что неясно, будет ли прогрессировать опухоль, мужчины скорее выберут лечение с его вероятными осложнениями.
- Пять человек все равно умрут от рака простаты, несмотря на ПСА-анализ.
- Один человек избежит смерти от рака простаты благодаря ПСА-тесту.
Если результаты теста показали высокий уровень ПСА в крови, но у мужчины нет других симптомов развития рака простаты, врач может рекомендовать повторно пройти тестирование. Если высокий уровень ПСА в крови подтверждается, врач порекомендует пройти ректальное обследование и регулярно повторять тестирование на уровень ПСА в крови, чтобы отслеживать любые изменения.
При продолжении роста уровня ПСА в крови, могут быть рекомендованы дополнительные обследования, чтобы проверить наличие других заболеваний. В этот список входят анализ мочи на инфекции мочевыводящих путей, а также трансректальное УЗИ, рентген и цистоскопия. При подозрении на рак предстательной железы врач назначает биопсию простаты. Небольшие образцы ткани предстательной железы изучают патоморфологи для определения стадии заболевания.
источник
Заболеваемость онкологией в мире растет из года в год. Если 30 лет назад сердечные болезни окончательно вытеснили инфекции с первого места, то сейчас раковые опухоли постепенно приближаются к сердечно-сосудистым патологиям по абсолютному показателю смертности. Резонно, что вопрос, какова вероятность заболеть раком, является волнующим для большинства населения.
Не смотря на то, что причины рака множественны и до конца не изучены, на сегодняшний день накоплен ряд прямых и косвенных связей между набором внешних и внутренних факторов и онкологической заболеваемостью. Исключая тот или иной фактор влияния можно существенно снизить риск развития определенных видов рака. Статистика заболеваемости показывает, что первичная профилактика многих видов онкологии не только реальна, но и очень эффективна.
Кроме первичной профилактики рака в виде коррекции образа жизни и экологии, существуют еще такие крайне важные факторы, как вторичная профилактика в виде ранней диагностики и качественное медицинское обслуживание. Медицинская практика четко продемонстрировала прямую зависимость между тем, на какой стадии была обнаружена опухоль и прогнозом эффективного лечения онкологии.
На этом видео о рисках развития онкологии рассказывает доктор биологических наук, профессор Геннадий Белецкий
Именно поэтому в развитых странах основное внимание уделяется всевозможным скриннингам, мониторингу и ранней диагностике. Универсальный тест на возможность заболеть раком — это миф. И тем не менее, в Израиле, США и западной Европе во всех онкоцентрах анализ крови на онкомаркеры уже является золотым стандартом.
Кроме этого, в обязательные протоколы лечения внедряются генетические и молекулярные тесты на степень агрессивности разных видов онкологии, восприимчивость их к химиотерапии и на подбор таргетного вида терапии. К ним относятся:
- тест MammaPrint — при раке молочной железы,
- тест Foundation One — при оценке антигенного профиля солидных опухолей,
- тест Oncotype DX — при раке толстой кишки и раке груди.
В последние годы заболеваемость онкологией значительно “омолодилась” — вероятность рака в 20 лет и вообще в молодом возрасте растет. Это связано с ухудшением экологической обстановки и дрейфом онкогенов в социуме.
Если развитие опухоли в пожилом возрасте является следствием сбоя иммунной системы и ее неспособность справиться с неконтролируемым размножением клеток в тканях, то в у молодых людей это является результатом генных мутаций. В связи с этим в обществе растет боязнь заболеть раком.
Немаловажным фактором в профилактике является способность самого пациента
вовремя распознать грозные симптомы и обратиться к врачу. А для этого очень полезно будет знать, в каком возрасте, что делать, чтобы не заболеть раком той или иной локализации. Да, в разных возрастных категориях преобладают те или иные виды онкологии.
От 20 до 30 лет высока вероятность развития гемобластозов — онкологических заболеваний крови (лейкоз, лимфома, лимфогранулематоз). Ведущими симптомами будут — увеличение группы или многих лимфатических узлов без видимой причины, быстрая утомляемость, периодическое повышение температуры тела.
Какой процент заболеть раком крови, если есть генетическая предрасположенность? К сожалению, однозначной трактовки по этой линии онкологии нет. Достоверно известно лишь то, что повышенный уровень ионизирующего излучения увеличивает риск развития гемобластозов.
Также в этом возрасте существует риск заболеть раком мозга, яичек и меланомой. Первые два вида опухоли — специфические и четкой симптоматики не имеют, здесь эффективна будет ранняя диагностика в виде периодических диагностических обследований. Хотим, заметить, что после лечения рака яичек в Израиле, у мужчин сохраняется возможность иметь детей.
А вот меланому можно предотвратить путем нивелирования воздействия ультрафиолета. Ограничив время пребывания на открытом солнце, можно предупредить развитие агрессивной формы рака в 25 лет. Кроме этого, надо обращать внимание на внезапно появившуюся пигментацию на коже или изменение внешнего вида родинок.
В возрасте от 30 до 40 лет наибольший риск связан с возникновением онкологических патологий пищеварительного тракта, которые передаются по наследству. Наиболее распространенные виды — рак желудка и ободочного кишечника. В первом случае следует особое внимание обратить на немотивированную потерю веса и отвращение к мясным блюдам — это первые симптомы рака желудка. При опухолях ободочной кишки рано выявить заболевание поможет периодический анализ на скрытую кровь в кале и колоноскопия.
Еще нужно учитывать фактор наследственности. Если родители болели онкологическими заболеваниями желудочно-кишечного тракта, нужно как минимум раз в год после 40 лет проходить гастродуоденоскопию, сдавать анализы на присутствие бактерии Helicobacter Pilory.
В этой же возрастной категории особняком стоит грозная и одна из наиболее распространенных онкологических патологий — рак легкого. Один из самых агрессивных видов рака часто встречается в 30 лет и даже ранее. Как раз этот вид онкологии практически невозможно выявить на ранней стадии, из-за этого у этой опухоли показатели смертности одни из самых высоких. Однако, и профилактические меры однозначны — отказ от курения, так как более 90% пациентов с раком легких являются курильщиками.
В средней возрастной категории от 40 до 50 лет преобладает заболеваемость раком верхних мочевыводящих путей, почки и мочевого пузыря. Предрасполагающие факторы — излишний вес, табакокурение, злоупотребление алкоголем. Начальные симптомы в основном проявляются болью при мочеиспускании, повышением температуры. Рак мочевого пузыря также связан с дрейфом генов по родительской линии. Если болели родственники первой линии этим видом онкологии, риск развития увеличивается на 15%.
Пожилые люди от 50 до 60 лет и старше чаще всего болеют раком предстательной железы, раком шейки матки и молочной железы. Этиология этого вида онкологии тесно связана с образом жизни — характером питания, подвижностью и состоянием окружающей среды. Как питаться, чтобы не заболеть раком? Уменьшить потребления животных жиров и среднесуточную калорийность рациона.
Рак простаты обычно начинается с нарушения мочеиспускания и ознобом. Обнаружив эти симптомы, надо незамедлительно обратиться к врачу.
Рак шейки матки один из немногих видов онкологии, который имеет 100% подтвержденную профилактическую вакцину. Это связано с тем, что эта опухоль вызывается вирусом папилломы человека. После открытия этой связи, многие ученые начали открыто поднимать вопрос, можно ли заразиться раком от другого человека, подразумевая вирус папилломы. Однако, в дальнейшем такая возможность была отвергнута.
В Израиле вакцинация от рака шейки матки входит в календарь обязательных прививок. Для женщины, которая не вакцинировалась, рассматриваются дополнительные факторы — если болела мама раком шейки матки, гинекологическое обследование должно проводиться ежегодно после 40 лет.
Для снижения риска развития рака молочной железы все женщины после 40 лет или после 35 лет, если есть модифицирующие факторы (курения, прием гормональных контрацептивов, после ЭКО), должны проходить маммографию или МРТ молочных желез. При ручном обнаружении новообразования в груди, следует немедленно обратиться к маммологу.
Дополнительным фактором риска является ситуация, если рак молочной железы был у родственников по материнской линии. К примеру, если бабушка болела этим видом онкологии, вероятность заболеть повышается на 7%. С таким анамнезом, пациенткам рекомендуют проходить периодические маммографии в 1,5-2 раза чаще, чем остальным женщинам.
Таким образом, можно приблизительно рассчитать, какой шанс заболеть раком в разных возрастных периодах. Совместив эту информацию с периодическими скриннингами и осмотрами у врача, можно значительно снизить риск болезни. В комплексе с ранней диагностикой это и будет полноценной вторичной профилактикой онкологических заболеваний.
Подводя итог, можно сказать, что в последнее время многих людей волнуют вопросы, какая вероятность заболеть раком, можно ли от этого уберечься и что для этого делать. Однозначный ответ — да! Профилактика онкологии заключается в многих факторах, но придерживаясь определенных рекомендаций, можно в значительной мере снизить этот риск.
источник
В современной онкологии огромную роль играет именно ранняя диагностика опухолевого процесса. От этого зависит дальнейшая выживаемость и качество жизни больных. Онкологическая настороженность очень важна, так как рак может проявлять себя на последних стадиях либо маскировать свои симптомы под другие заболевания.
Существует множество теорий развития рака, но ни одна из них не дает развернутый ответ, почему же он все-таки возникает. Врачи могут лишь предполагать, что тот или иной фактор ускоряет канцерогенез (рост опухолевых клеток).
Факторы риска заболеваемости раком:
- Расовая и этническая предрасположенность – немецкие ученые установили тенденцию: у белокожих людей меланома возникает в 5 раз чаще, чем у чернокожих.
- Нарушение диеты – рацион человека должен быть сбалансированным, любой сдвиг соотношения белков, жиров и углеводов может привести к нарушению метаболизма, и как следствие к возникновению злокачественных новообразований. Например, ученые доказали, что чрезмерное употребление продуктов, повышающих холестерин, приводит к развитию рака легких, а избыточный прием легкоусвояемых углеводов повышает риск развития рака молочной железы. Так же обилие химических добавок в пище (усилители вкуса, консерванты, нитрат и пр.), генетически модифицированные продукты увеличивают риск онкологии.
- Ожирение – согласно проведенным американским исследованиям, избыточная масса тела увеличивает риск возникновения рака на 55% у женщин и 45% у мужчин.
- Курение – врачи ВОЗ доказали, что между курением и раком (губы, языка, ротоглотки, бронхов, легких) существует прямая причинно-следственная связь. В Великобритании были проведены исследование, которое показало, что люди, выкуривающие 1,5-2 пачки сигарет в день, предрасположены к развитию рака легких в 25 раз выше некурящих людей.
- Наследственность – существуют определенные виды рака, наследуемые по аутосомно-рецессивному и аутосомно-доминантному типу, например, рак яичника или семейный полипоз кишечника.
- Воздействие ионизирующего излучения и ультрафиолетовых лучей – ионизирующее излучение природного и промышленного происхождения вызывает активацию проонкогенов рака щитовидной железы, а длительное воздействие ультрафиолетовых лучей при инсоляции (загаре) способствует развитию злокачественной меланомы кожи.
- Иммунные нарушения – снижение активности иммунной системы (первичные и вторичные иммунодефициты, ятрогенная иммуносупрессия) приводит к развитию опухолевых клеток.
- Профессиональная деятельность – в эту категорию попадают люди, контактирующие в процессе своей трудовой деятельности с химическими канцерогенами (смолы, красители, сажа, тяжелые металлы, ароматические углеводы, асбест, песок) и электромагнитным излучением.
- Особенности репродуктивного возраста у женщин – ранняя первая менструация (младше 14 лет) и поздняя менопауза (старше 55 лет) увеличивают риск возникновения рака молочной железы и яичников в 5 раз. При этом беременность и роды снижают склонность появления новообразований репродуктивных органов
- Длительно незаживающие раны, свищи
- Выделение крови в моче, крови в кале, хронические запоры, лентовидная форма кала. Нарушение функций мочевого пузыря и кишечника.
- Деформация молочных желез, появление припухлости других частей тела.
- Резкое похудение, снижение аппетита, трудности глотания.
- Изменение цвета и формы родинок или родимых пятен
- Частые маточные кровотечения или необычные выделения у женщин.
- Длительный сухой кашель, не поддающийся терапии, осиплость голоса.
После обращения к врачу пациент должен получить полную информацию, какие анализы указывают на рак. Определить онкологию по анализу крови невозможно, он является неспецифичным по отношению к новообразованиям. Клинико-биохимические исследования направлены в первую очередь на определение состояния пациента при опухолевой интоксикации и изучение работы органов и систем.
Общий анализ крови при онкологии выявляет:
- лейкопения или лейкоцитоз (повышенные или пониженные лейкоциты)
- сдвиг лейкоцитарной формулы влево
- анемия (низкий гемоглобин)
- тромбоцитопения (низкие тромбоциты)
- повышение СОЭ (постоянно высокая СОЭ более 30 при отсутствии серьезных жалоб — повод бить тревогу)
Общий анализ мочи при онкологии бывает довольно информативен, например, при миеломной болезни в моче выявляется специфический белок Бенс-Джонса. Биохимический анализ крови позволяет судить о состоянии мочевыделительной системы, печени и белковом обмене.
Изменение показателей биохимического анализа при различных новообразованиях:
| Показатель | Результат | Примечание |
| Общий белок |
возможно как его превышение, так и снижение | Новообразования обычно усиливают катаболические процессы и распад белка, неспецифически угнетают синтез протеинов. |
| гиперпротеинемия, гипоальбуминемия, обнаружение парапротеина (М-градиент) в сыворотке крови | Такие показатели позволяют заподозрить миеломную болезнь (злокачественная плазмоцитома). | |
| Мочевина, креатинин |
Возрастание уровня мочевины и креатинина | Это говорит об усиленном белковом распаде, косвенном признаке раковой интоксикации либо о неспецифическом снижении функции почек |
| Увеличение мочевины при нормальном креатинине | Свидетельствует о распаде опухолевой ткани. | |
| Щелочная фосфатаза |
Увеличение ЩФ свыше 270 ЕД/л | Говорит о наличие метастазов в печени, костной ткани, остеогенной саркоме. |
| Возрастание фермента на фоне нормальных показателей АСТ и АЛТ | Также эмбриональные опухоли яичников, матки, яичков могут эктопический плацентарный изофермент ЩФ. | |
| АЛТ, АСТ |
Повышение ферментов свыше верхней границе нормы | Свидетельствует о неспецифическом распаде печеночных клеток (гепатоцитов), который может быть вызван как воспалительным, так и раковым процессом. |
| Холестерин |
Снижение показателя меньше нижней границе нормы | Говорит о злокачественных новообразованиях печени (так как холестерин образуется именно в печени) |
| Калий |
Увеличение уровня электролита при нормальном уровне Na | Свидетельствует о раковой кахексии |
Анализ крови при онкологии также предусматривает исследование системы гемостаза. Вследствие выделения в кровь опухолевых клеток и их фрагментов возможно усиление свертываемости крови (гиперкоагуляция) и микротромбообразование, затрудняющие продвижение крови по сосудистому руслу.
Помимо анализов для определения рака существует целый ряд инструментальных исследований, способствующих диагностики злокачественных новообразований:
- Обзорная рентгенография в прямой и боковой проекции
- Контрастная рентгенография (ирригография, гистеросальпингография)
- Компьютерная томография (с контрастом и без)
- Магнитно-резонансная томография (с контрастом и без)
- Радионуклидный метод
- Ультразвуковое исследование с допплерографией
- Эндоскопическое исследование (фиброгастроскопия, колоноскопия, бронхоскопия).
Рак желудка является второй по частоте встречаемости опухолью среди населения (после рака легкого).
- Фиброэзофагастродуоденоскопия — является золотым методом диагностики рака желудка, обязательно сопровождается большим количеством биопсий в разных областях новообразования и неизмененной слизистой оболочки желудка.
- Рентгенография желудка с использованием перорального контраста (бариевой смеси) – метод был довольно популярным до внедрения в практику эндоскопов, позволяет увидеть на рентгенограмме дефект наполнения в желудке.
- Ультразвуковое исследование органов брюшной полости, КТ, МРТ – используются при поиске метастазов в лимфатические узлы и другие органы пищеварительной системы (печень, селезенка).
- Иммунологический анализ крови – показывает рак желудка на ранних стадиях, когда сама опухоль еще не заметна для человеческого глаза (СА 72-4, РЭА и другие)
| Исследование: | Факторы риска: |
| с 35 лет: Эндоскопическое исследование один раз в 3 года |
|
- Пальцевое исследование прямой кишки – определяет рак на расстоянии 9-11 см от анального отверстия, позволяет оценить подвижность опухоли, ее эластичность, состояние соседних тканей;
- Колоноскопия – введение видеоэндоскопа в прямую кишку – визуализирует раковый инфильтрат вплоть до баугиниевой заслонки, позволяет провести биопсию подозрительных участков кишки;
- Ирригоскопия – рентгенология толстого кишечника с использованием двойного контрастирования (контраст-воздух);
- УЗИ органов малого таза, КТ, МРТ, виртуальная колоноскопия – визуализируют прорастание рака толстой кишки и состояние смежных органов;
- Определение онкомаркеров – РЭА, С 19-9, Sialosyl – TN
- один раз в год пальцевое ректальное исследование
- Анализ кала на скрытую кровь иммуноферментный один раз в 2 года
- колоноскопия один раз в 3 года
- ректороманоскопия один раз в 3 года
- старше 50 лет
- аденома толстой кишки
- диффузный семейный полипоз
- язвенный колит
- болезнь Крона
- ранее перенесенный рак груди или женских половых органов
- колоректальный рак у кровных родственников
- семейный полипоз
- язвенный колит
- хронический спастический колит
- полипы
- запоры при наличии долихосигмы
Данная злокачественная опухоль занимает ведущее место среди женских новообразований. Такая неутешительная статистика в некоторой степени обусловлена низкой квалификацией врачей, непрофессионально проводящих осмотр молочных желез.
- Пальпация железы – позволяет определить бугристости и припухлости в толще органа и заподозрить опухолевый процесс.
- Рентгенография молочной железы (маммография) – один из наиболее важнейших методов для обнаружения непальпируемых опухолей. Для большей информативности используется искусственное контрастирование:
- пневмокистография (изъятие жидкости из опухоли и введение в нее воздуха) – позволяет выявить пристеночные образования;
- дуктография – метод основывается на введение контрастного вещества в млечные протоки; визуализирует строение и контуры протоков, и аномальные образования в них.
- Сонография и допплерография молочных желез – результаты клинических исследований доказали высокую эффективность этого метода в обнаружении микроскопического внутрипротокового рака и обильно кровоснабжаемых новообразований.
- Компьютерная и магнитно-резонансная томографии – позволяют оценить прорастание рака молочной железы в близлежащие органы, наличие метастазов и поражение регионарных лимфатических узлов.
- Иммунологические анализы на рак молочной железы (онкомаркеры) — СА-15-3, раковоэмбриональный антиген (РЭА), СА-72-4, пролактин, эстрадиол, TPS.
| Исследования: | Факторы риска: |
|
|
Рак легких лидирует среди злокачественных новообразований у мужчин и занимает пятое место среди женского пола в мире.
- Обзорная рентгенография органов грудной клетки
- Компьютерная томография
- МРТ и МР-ангиография
- Чрезпищеводное УЗИ
- Бронхоскопия с биопсией – метод позволяет своими глазами увидеть гортань, трахею, бронхи и получить материал для исследования с помощью мазка, биопсии или смыва.
- Цитологическое исследование мокроты – процент выявления рака в доклинической стадии с помощью этого метода составляет 75-80%
- Чрезкожное пунктирование опухоли – показано при периферическом раке.
- Контрастное исследование пищевода для оценки состояния бифуркационных лимфатических узлов.
- Диагностическая видеоторакоскопия и торакотомия с биопсией регионарных лимфатических узлов.
- Иммунологический анализ крови при раке легких
- Мелкоклеточный рак – НСЕ, РЕА, Тu М2-РК
- Крупноклеточный рак – SСС, CYFRA 21-1, РЭА
- Плоскоклеточный рак – SСС, CYFRA 21-1, РЭА
- Аденокарцинома — РЕА, Тu М2-РК, СА-72-4
| Исследования: | Факторы риска: |
|
|
Рак шейки матки определяется примерно у 400000 женщин в год во всем мире. Чаще всего диагностируется на очень запущенных стадиях. В последние годы наблюдается тенденция омоложения заболевания – чаще возникает у женщин моложе 45 лет (то есть, до начала климакса). Диагностика рака шейки матки:
- Гинекологический осмотр в зеркалах – выявляет только видимые формы рака в запущенной стадии.
- Кольпоскопическое исследование – осмотр опухолевой ткани под микроскопом, проводится с использованием химических веществ (уксусная кислота, раствор йода), которые позволяют определить локализацию и границы опухоли. Манипуляция обязательно сопровождается биопсией раковой и здоровой ткани шейки матки и цитологическим исследованием.
- КТ, МРТ, УЗИ органов малого таза – применяется с целью выявления прорастания рака в соседние органы и степень его распространенности.
- Цистоскопия – используется при инвазии рака шейки матки в мочевой пузырь, позволяет увидеть его слизистую оболочку.
- Иммунологический анализ на рак шейки матки – SCC, ХГ, альфа-фетопротеин; рекомендуется исследование онкомаркеров в динамике