Раздел находится в стадии наполнения
Злокачественные новообразования, возникающие в желудке, происходят из эпителиальной ткани, выстилающей его полость. Данное заболевание является одной из наиболее распространенных онкологических патологий. Болезнь опасна тем, что может распространяться и на другие органы – пищевод, легкие, печень.
Рак желудка очень сложно диагностировать на ранних стадиях, так как зарождающаяся опухоль никак не проявляет себя и практически не заметна при исследовании. В большинстве случаев болезнь проявляется тогда, когда опухоль распространилась на другие ткани.
Желудок является частью верхнего отдела пищеварительного тракта. Он отвечает за переваривание пищи и осуществляет перемещение питательных веществ вниз, к остальным органам пищеварения.
Причина возникновения опухоли – активное деление клеток эпителиальной оболочки, которые имеют злокачественный характер. Данный процесс происходит в течение долгого времени и может быть следствием каких-либо заболеваний желудка. Так, наличие бактерии Helicobacter pylori является важным фактором риска развития рака желудка.
Российские медики отмечают, что существует ряд факторов, провоцирующих образование опухоли. Такие причины рака желудка могут зависеть от образа жизни человека, а могут быть следствием некоторых заболеваний. На возникновение новообразований влияют следующие факторы:
перенесенный гастрит или язвенная болезнь;
скудная диета или постоянное употребление большого количества жирной пищи;
неправильный режим питания;
некачественные продукты с повышенным содержанием нитратов и нитритов;
употребление продуктов, богатых азотом (сыр, вяленые и копченые изделия);
лечение с помощью антибиотиков и других лекарственных препаратов, оказывающих воздействие на желудочно-кишечный тракт.
Некоторые пациенты отмечают определенные симптомы, характерные для болезни. Рак желудка провоцирует снижение аппетита и как следствие – потерю веса, боли в желудке, чувство наполненности при небольшом количестве съеденной пищи. Также сопутствующими недомоганиями являются изжога или расстройство желудка, тошнота и рвота с кровью или без нее.
Развитие любых злокачественных новообразований возникает чаще всего при неправильном образе жизни. Одним из вредных веществ, провоцирующих заболевание желудка, печени и других органов является этиловый спирт, содержащийся в алкоголе. Попадая в пищевод, он повреждает слизистую оболочку, провоцируя образование эрозий, которые затем могут превратиться в опухоль.
Курение имеет схожий принцип действия, и негативно воздействует не только на желудок, но и на легкие.
К группе риска относятся также люди, имеющие постоянный контакт с радиоактивным излучением, или получившие большую дозу облучения. Негативные последствия могут быть даже после взаимодействия с зараженными предметами.
Генетический фактор также является причиной возникновения онкологической патологии. Если в ближайшем окружении пациента есть человек с диагностированной формой рака, необходимо сделать молекулярно-генетический анализ для выявления характерных мутаций ДНК.
Если изменения обнаружены, следует принять ряд мер по снижению возможности проявления болезни. Превентивные мероприятия включают регулярное обследование у врача и проведение определенных диагностических процедур.
Генетическая предрасположенность к раку желудка не является гарантией развития опухоли, но требует постоянного мониторинга состоянии здоровья.
Развитие рака желудка имеет длительный латентный период – именно по этой причине невозможно его диагностировать на ранних сроках. Образование опухоли может занимать более 20 лет.
Для запуска процесса образования рака должно произойти изменение свойств слизистой. Это может происходить под воздействием неблагоприятных факторов или неправильного питания. Эпителий желудка истончается, появляются мелкие язвы и эрозии.
Сначала опухоль имеет размер до 2 сантиметров и располагается в слизистой. Далее новообразование разрастается в подслизистую и мышечную ткань. На этом этапе рак уже хорошо диагностируется и может подвергаться лечению. Пациент может жаловаться на боль в желудке, чувствовать тяжесть и непроходимость пищи, резко терять вес.
Разрастание сквозь наружный серозный слой является запущенной формой заболевания. В этом случае риск поражения соседних органов возрастает в десятки раз. Возникновения метастазов при злокачественных образованиях желудка происходит гематологическим и лимфатическим способом, что является серьезным отягчением болезни.
Выявить причины, от которых бывает рак желудка, и не допустить развития заболевания – основная задача врачей. Общие рекомендации медиков предполагают ведение здорового образа жизни, отказ от вредных привычек и регулярную диагностику.
источник
В России рак желудка (РЖ) является одной из самых актуальных проблем онкологии. Около 40 тысяч россиян ежегодно умирают от этой патологии. За год в нашей стране регистрируется 48,8 тысяч новых случаев этого заболевания, что составляет около 11 % от всех злокачественных опухолей [1].
РЖ, как правило, возникает спорадически при участии внешних факторов риска, таких как инфекция Helicobacter pylori (HP-инфекция), особенности питания и образа жизни. Однако около 5–10 % пациентов, страдающих РЖ, имеют отягощенный онкологический семейный анамнез. Это, в свою очередь, подразумевает генетическую предрасположенность к развитию таких форм РЖ, как перстневидно-клеточный рак и низкодифференцированная аденокарцинома. В 1998 г. было продемонстрировано, что ген, кодирующий молекулу белка Е-кадгерина (CDH1), является ответственным за высокую распространенность диффузного рака желудка (ДРЖ) во многих поколениях большой семьи маори из Новой Зеландии [11]. Более того, герминальные мутации были обнаружены также у более 90 семей с историей ДРЖ. Выделение наследственного диффузного рака желудка (НДРЖ), ассоциированного с CDH1, привело в 1999 г. к формированию группы ученых разных специальностей, объединившихся в Международный консорциум (International Gastric Cancer Linkage Consortium – IGCLC) по разработке критериев наследственного РЖ. Задачей консорциума была также разработка рекомендаций по диагностике и медико-генетическому консультированию [13].
Всего было идентифицировано свыше 80 различных герминальных мутаций в кодирующем CDH1 регионе. Мутации 1137G>A и 1901C>T были выявлены в шести и пяти различных семьях соответственно. Однако до сих пор не выявлены очевидные корреляции генотипа с фенотипическими проявлениями, а результаты многих исследований указывают на возможность влияния разных мутаций на проявления заболевания и пенетрантность [32, 34]. В противоположность другим синдромам предрасположенности к раку, таким как семейный аденоматозный полипоз, только 50 % CDH1 герминальных мутаций полностью инактивируют эту копию гена (сдвиг рамки считывания или нонсенс мутация). Мутации сайта сплайсинга и миссенс мутации составляют 20 и 30 % соответственно от всего спектра мутаций, и это наталкивает на мысль, что снижение, а не потеря активности Е-кадгерина может уже быть достаточным для инициации заболевания [34]. Герминальные CDH1 мутации являются редкими и оцениваются приблизительно в 1 % от всех случаев РЖ как в популяциях с низкой распространенностью РЖ, так и в странах с высокой распространенностью, таких как Япония, Корея, Италия и Португалия [5].
В России недавно проведено молекулярно-генетическое исследование у 9 пробандов с перстневидноклеточным РЖ. Поиск наследственных мутаций проводился в гене-супрессоре диффузного РЖ – гене CDH1, обнаружена новая наследственная мутация (c.1005delA) и один редкий вариант (с.2253С>Т). Частота наследственных мутаций в выборке Российских пациентов составила 1/9 (11,1 %) [2].
Пенетрантность и клинический фенотип
Классификация Lauren, предложенная еще в 60-е годы, разделила аденокарциному желудка на два основных гистологических типа: 1 – хорошо дифференцированный или интестинальный тип, и 2 – недифференцированный или диффузный тип [21]. Опухоли интестинального типа, как правило, ассоциированы с атрофическим гастритом тела желудка, кишечной метаплазией и чаще встречаются у мужчин в старших возрастных группах. Рак диффузного типа обычно развивается при пангастрите без атрофии, имеет примерно одинаковое соотношение между полами и чаще выявляется в молодом возрасте [21, 25]. Герминальные CDH1 мутации специфически ассоциированы с диффузным типом аденокарцином желудка, но не с другими типами РЖ при отсутствии диффузного компонента [18]. ДРЖ наследуется по аутосомно-доминантному типу среди семей с НДРЖ. Начальная пенетрантность была получена в 11 семьях и оценивала кумулятивный риск ДРЖ в 67 % и 83 % для мужчин и женщин носителей мутации соответственно [32]. Средний возраст наступления заболевания может также варьировать в зависимости от генотипа [29]. Самый молодой случай НДРЖ описан для 14 летнего возраста, а самый старший – для 82 лет. Генетические/эпигенетические вариации и факторы внешней среды являются дополнительными параметрами, модулирующими последствия наследственных CDH1 мутаций. Было обнаружено, что в семьях с НДРЖ с той же частотой выявляется лобулярный рак груди (ЛРГ). Ожидаемая пенетрантность ЛРГ в семьях носителях мутации находится в пределах от 39 до 54 %, но эти цифры получены из малого числа наблюдений и могут быть интерпретированы с осторожностью [32]. CDH1 герминальные мутации были также диагностированы в семьях с НДРЖ у пациентов с колоректальным раком, опухолями легких и слюнных желез [10]. Однако настоящее число раков кроме ЛРГ очень мало, чтобы говорить о значимой ассоциации с НДРЖ.
Главное правило в лечении семей с НДРЖ заключается в пресимптоматической идентификации носителей мутации, проведении профилактической гастрэктомии в определенном возрасте или эндоскопическом наблюдении и терапевтической гастрэктомии в случае обнаружения рака. Опубликовано несколько клинических руководств, рекомендованных для ведения таких пациентов [5, 6].
Клинические критерии, определение мутации и пресимптоматическое тестирование
Первый шаг заключается в определении CDH1 герминальной мутации в семьях с подозрением на НДРЖ. По определению IGCLC ДРЖ считается наследственным, если: 1) у родственников первой или второй степени родства имеется два и более случаев морфологически доказанного диффузного рака, при этом, по крайней мере в одном случае, диагноз установлен в возрасте до 50 лет; 2) у родственников первой или второй степени родства три случая и более доказанного ДРЖ в любом возрасте; 3) симплексный случай (то есть, единственное возникновение в семье) ДРЖ, возникающего в возрасте до 40 лет; 4) индивидуальный или семейный случай ДРЖ или лобулярного рака молочной железы (ЛРМЖ), один из которых диагностирован в возрасте до 50 лет [5, 13]. Герминальные CDH1 мутации определяются примерно в 50 % семей с вышеперечисленными критериями. Brooks-Wilson и соавт. предложили более расширенный набор критериев по включению семей, у которых могут быть такие мутации [6]. Но, даже применяя эти критерии, семьи с герминальными мутациями могут быть пропущены. Поэтому всесторонний скрининг CDH1 мутации требует включения в поиск пограничных семей и случаев. Диагностическое тестирование на наличие известной мутации обычно предлагается членам семьи, начиная с 16 лет (нижняя граница возраста лимитирована дачей информированного согласия) [5]. В этом возрасте риск развития симптоматического ДРЖ составляет менее 1 % [32]. Однако в семьях с доказанным НДРЖ тестирование должно проводиться и в более раннем возрасте, и такие семьи должны рассматриваться с индивидуальным подходом (с учетом зрелости ребенка, беспокойства внутри семьи, тяжести семейного анамнеза и др.).
Профилактическая гастрэктомия – это только возможность предотвратить развитие и/или распространение НДРЖ. Однако не каждый носитель мутации готов перенести такого рода профилактическую инвалидизирующую операцию. Это касается, в основном, молодых пациентов, которые не понимают проблемы и беспокоятся по поводу влияния такого лечения на физическое и психологическое здоровье. Эндоскопическое наблюдение особенно важно в случае отказа от профилактической гастрэктомии и должно проводиться врачом с опытом эндоскопии НДРЖ. Однако эндоскопический контроль может быть проблематичен в случае ДРЖ, так как опухоль может прогрессировать и под нормальной слизистой желудка. Даже поздние стадии рака с вовлечением в процесс тканей, окружающих желудок, могут не вызывать видимых изменений поверхностного эпителия [33]. Тем не менее, ранние стадии НДРЖ, ограниченные слизистой оболочкой желудка, для опытного глаза могут быть заметными и выглядеть бледными, иногда белыми поврежденными участками. Окрашивание во время эндоскопии конго-красным и метилен-синим делает эти белесые участки более видимыми, но ограничивает их применение в рутинной практике из-за предполагаемого канцерогенного эффекта [33]. Таким образом, эндоскопический контроль с использованием стандартной эндоскопии может выявлять подозрительные повреждения, если проводится опытным врачом. В настоящее время широко обсуждается применение узкоспектральной эндоскопии (narrow band imaging – NBI) в плане диагностики патологических изменений слизистой желудка, включая предраковые изменения и ранний РЖ. Однако при эндоскопическом наблюдении существует риск пропустить заболевание и поэтому профилактическая гастрэктомия является рекомендуемой стратегией. По мнению Guilford P. и соавт. такое решение основывается на рекомендации генетиков, дающих заключение о большом риске пропуска рака при эндоскопическом контроле [10]. Если же пациент выбирает наблюдение, то рекомендации должны также включать инструкцию по минимизации общепринятых факторов риска рака, таких как курение, употребление соленой, копченой пищи, а также увеличение в рационе питания овощей и фруктов и улучшение общей физической формы [19]. Более того, в случае выявления H. pylori инфекции, носители мутации должны подвергаться обязательному лечению.
Только тотальная гастрэктомия гарантирует удаление всей слизистой желудка. Стандартная процедура гастрэктомии как для асимптомных пациентов, так и для пациентов с ранним НДРЖ, выявленном при наблюдении, заключается в D2 диссекции с сохранением селезенки и поджелудочной железы, реконструкции с наложением эзофагоеюностомы по Roux-en-Y без создания резервуара из тощей кишки. Такая техника позволяет увеличить время транзита по кишечнику и уменьшить возникающий при отсутствии желудка дефицит всасывания у таких пациентов [24].
Несмотря на отсутствие симптомов у носителей мутации, микроскопическое обследование профилактически удаленного желудка, выявляет множественные очаги перстневидноклеточной карциномы под неповрежденным поверхностным эпителием [7, 14]. Перстневидноклеточная карцинома (ПК) и низкодифференцированная карцинома являются основными подтипами ДРЖ и частью фенотипа НДРЖ. Разное число (от единичных до нескольких сотен) очагов ПК было обнаружено в каждом удаленном желудке с НДРЖ независимо от возраста пациента. Эти очаги, обычно маленькие по размеру (≤ 1 мм в диаметре), ограничиваются слизистой желудка без вовлечения лимфатических узлов (TNM стадия T1a) и состоят в основном из перстневидных клеток (при окраске гематоксилином и эозином опухолевые клетки содержат пустые вакуоли с оттеснением ядра на периферию клетки, вид перстня). В глубокой части таких очагов находятся менее дифференцированные клетки, а более крупные очаги (≥ 3 мм) могут содержать большую пропорцию таких клеток [15]. При проведении эндоскопии такие большие повреждения выглядят белыми поврежденными участками на слизистой [33]. Такие очаги ПК внутри слизистой являются универсальными находками у носителей мутации, поэтому они считаются ранним НДРЖ. В противоположность ранней стадии НДРЖ, поздние стадии НДРЖ (стадия ≥ T3, вовлечение серозной оболочки) гистологически представлены низкодифференцированной карциномой [15, 34]. Таким образом, ПК характерна для ранней стадии НДРЖ. Данный вывод подтверждается детально изученной стадией Т2 (с инвазией с мышечный слой) НДРЖ, которая показывает морфологический спектр с наличием перстневидных клеток в поверхностной слизистой и низкодифференцированных раковых клеток в более глубоких слоях [15, 34]. Такие морфологические находки указывают на то, что прогрессия при НДРЖ связана с приобретением раковой клетки низкодифференцированного фенотипа. Более того, гистология ПК также чаще встречается и на ранних стадиях спорадического ДРЖ в сравнении с более поздними стадиями [16].
Данные по долгосрочному выживанию пациентов с НДРЖ после гастрэктомии еще не доступны, но могут быть рассчитаны на основании данных о выживаемости в случае спорадического ДРЖ. Как сказано выше, пациенты с НДРЖ, прошедшие скрининг или с показаниями к проведению профилактической гастрэктомии, уже имеют ранний НДРЖ. Считается, что диффузный тип карцином, а также ПК имеют более плохой прогноз в сравнении с интестинальным типом рака [25]. Это может быть результатом задержки постановки диагноза ДРЖ, начала заболевания в молодом возрасте и трудностями диагностики ранних стадий ДРЖ. Однако внимательное сравнение интестинального и диффузного типов рака желудка предполагает схожий результат [17]. Более того, большинство исследований обнаружили значительно лучшие исходы для раннего перстневидноклеточного рака в сравнении с опухолями, принадлежащими к другим гистологическим типам [16, 36]. А 5-ти летняя выживаемость пациентов с ранней стадией ПК составляет более 90 % [16]. Послеоперационный прогноз для ранней стадии НДРЖ (при отсутствии метастазов в лимфатические узлы), вероятно, будет прекрасным. Однако очень важно иметь в виду то, что риск развития рака других локализаций у носителей мутации в гене CDH1 пока неизвестен [10].
Женщины – носительницы CDH1 мутации должны наблюдаться в плане выявления лобулярного рака груди (ЛРГ). Из двух основных форм рака груди, дистальной и лобулярной, лобулярный сложнее диагностировать из-за диффузного характера роста и отсутствия микрокальцификации [23]. Ультразвук и магнитно-резонансная томография (МРТ), по сравнению с маммографией, являются более эффективными в плане диагностики ЛРГ [23]. Протоколы наблюдений за женщинами носительницами CDH1 мутации основаны на опыте скрининга семей с мутациями в гене BRCA1, c рекомендацией проводить дважды в год клиническое обследование и ежегодную маммографию совместно с ультразвуком и МРТ у лиц старше 35 лет [10].
Низкоуровневая регуляция Е-кадгерина и начало заболевания
Белок Е-кадгерин, кодируемый геном CDH1, является ключевым компонентом, обеспечивающим адгезивные межклеточные контакты эпителиальных клеток [20]. Потеря активности Е-кадгерина продемонстрирована при многих эпителиальных раках и обычно связана с прогрессией заболевания [8]. В случае НДРЖ (с мелкими очагами перстневидноклеточной карциномы) дефицит Е-кадгерина, возникающий в результате снижения регуляции белка, важен для начала заболевания [15]. Постоянная низкоуровневая регуляция Е-кадгерина указывает на то, что ген CDH1 действует как классический супрессор опухоли. Миссенс мутации, делеции и эпигенетические нарушения (гиперметилирование промотора) относятся к потенциальным механизмам, необходимым для начала заболевания [28].
Дефицит Е-кадгерина, механизмы онкогенеза
Потеря адгезивных свойств эпителиальной пластинки, вследствие низкоуровневой регуляции Е-кадгерина, считается одним из условий прогрессии заболевания [15]. Как дефицит Е-кадгерина может инициировать рост опухоли, пока не понятно. Известно, что потеря адгезивности имеет серьезные последствия на клеточном уровне. Так, межэпителиальные соединения позволяют определять местоположение для правильной дифференцировки, они также необходимы для формирования апикально-базальной полярности (что является отличительным признаком эпителиальных клеток) и обеспечивают фиксированные точки для митотического шпинделя (что необходимо для контроля над клеточным делением) [22, 31]. Полярность клетки влияет на распределение исходных клеточных детерминантов (индукторов специфического пути дифференцировки) к одному полюсу клетки [4]. Направление митотического шпинделя может влиять на равномерность распределения исходных клеточных детерминант между дочерними клетками. Результатом деления могут быть две одинаковые дочерние клетки, т.е. симметричное деление с расположением оси деления параллельно градиенту клетки или асимметричное деление с неравномерным распределением и разделением клеточного градиента осью деления. Определение судьбы клетки особенно важно в контексте биологии стволовых клеток. Стволовые клетки могут регенерировать целые органы из-за их уникальной способности производить две дочерние стволовые клетки (симметричное деление) или одну дочернюю стволовую клетку и одну клетку предшественницу (асимметричное деление), что вызывает дифференцировку [10]. Нарушение баланса между симметричным и асимметричным делением может быть опасным и, как считают многие, лежать в основе малигнизации [3]. В случае возникновения некоторых эпителиальных раков показана роль субпопуляции так называемых раковых стволовых клеток, способных инициировать и поддерживать успешный рост опухоли. Как и нормальные стволовые клетки, недифференцированные раковые стволовые клетки могут производить дифференцированные раковые клетки (асимметричное деление) или повышать свой собственный пул (симметричное деление) на неограниченное время [3]. Пропорция таких раковых стволовых клеток в опухоли определяет ее агрессивность [9, 27]. Учитывая тот факт, что Е-кадгерин важен для межклеточной адгезии, установления полярности и правильного направления митотического шпинделя, считается, что низкоуровневая регуляция CDH1, возможно, оказывает прямой эффект на контроль над делением стволовых клеток и обеспечивает необходимые условия для развития опухоли [10].
Формирование ранних очагов НДРЖ
Ранние очаги НДРЖ имеют очевидное происхождение в верхнем перешейке, части пролиферативной зоны желез желудка (шеечная область) и предполагаемом местонахождении стволовых клеток желудка [15]. Раковые клетки, расположенные близко к верхнему перешейку, являются пролиферативными, часто плохо дифференцированными, и ведут к образованию типичных перстневидных клеток, локализованных в поверхностной слизистой желудка. В такого рода очагах типичные перстневидные клетки составляют подавляющее большинство [15]. В отличие от многих других карцином на начальных стадиях развития ранний НДРЖ характеризуется гипопролиферативностью. Другая отличительная особенность заключается в том, что ранний НДРЖ развивается в пределах собственной пластинки, хотя обычно раковые клетки проникают через базальную мембрану, что классифицирует такое повреждение как малигнизацию. Более того, такие очаги не экспрессируют протеины, ассоциированные с инвазией, что наблюдается на более поздних стадиях НДРЖ (стадия ≥ T1b, с вовлечением подслизистого слоя). Humar B. и соавт. объясняют это тем, что пролиферирующие раковые клетки, расположенные близко к перешейку, первоначально происходят из шейных клеток слизистой желудка, которые, созревая, превращаются в пепсиногенпродуцирующие главные клетки [15]. В нормальных условиях пепсиноген секретируется в просвет желудка, однако, ранние раковые клетки теряют свою полярность и начинают выделять пепсиноген во всех направлениях. Это приводит к частичному перевариванию основной мембраны и образованию окон, через которые клетки, потерявшие адгезивные свойства, могут проникать в собственную пластинку. Таким образом, возможно формирование ранней стадии НДРЖ происходит из региона стволовых клеток желудка с дифференцировкой к неделящимся перстневидным клеткам с низким инвазивным потенциалом. По мнению Guilford P. и соавт. это объясняет наличие длительного асимптомного течения раннего НДРЖ у носителей CDH1 мутации и значительно лучший прогноз, связанный с выявлением ранней перстневидноклеточной карциномы [10].
Прогрессирование очагов рака, локализованных внутри слизистой в подслизистую оболочку, связано с приобретением опухолью низкодифференцированного фенотипа. Значительное число низкодифференцированных клеток в начале заболевания встречаются в больших очагах внутри слизистой и часто демонстрируют морфологию по типу мезенхимальной. В противоположность перстневидным клеткам, низкодифференцированные клетки экспрессируют активную c-Src киназу, являющуюся индуктором эпителиально-мезенхимальных переходов (EMTs) с инвазивным раковым фенотипом. Активация c-Src в основном наблюдается на более поздних стадиях, указывая на то, что киназы имеют отношение к прогрессированию заболевания [15]. Более того, низкодифференцированные клетки также экспрессируют Fak, Stat3 и мезенхимальный маркер фибронектин. К другим протеинам, ассоциированным с инвазией, которые также определяются на низкодифференцированных клетках, но не на перстневидных, относятся Mmp-2 и Mmp-9. Таким образом, между низкодифференцированными и перстневидными клетками внутри слизистой существуют различия, что говорит о «ленивой» природе последних. Эти находки говорят также о том, что одна низкоуровневая регуляция CDH1 не индуцирует эпителиально-мезенхимальный переход в ткани желудка. Что же приводит к активации c-Src киназы и к индукции эпителиально-мезенхимального перехода, неизвестно. Данные, полученные при изучении спорадических случаев заболевания, предполагают амплификацию 20q, региона, включающего c-Src ген с переходом от перстневидноклеточной карциномы к низкодифференцированному раку [29]. Такого рода эпителиально-мезенхимальные переходы могут быть видны в больших очагах внутри слизистой и при проведении эндоскопии выглядеть в виде бледных пятен (возможно из-за уменьшения кровоснабжения и гипоксии). Гипоксия, в свою очередь, может также выступать в качестве индуктора эпителиально-мезенхимальго перехода и может способствовать прогрессии заболевания [26].
Эндоскопическое наблюдение или профилактическая гастрэктомия значительно сократили число смертей от РЖ в пораженных семьях. Однако эндосокпическое наблюдение ДРЖ сопряжено с риском пропуска заболевания. Хотя молекулярная биология и предполагает, что ранний НДРЖ «ленив», однако потенциал таких очагов к прогрессированию остается непредсказуемым [10]. Профилактическая гастрэктомия, с одной стороны, устраняет этот риск, но с другой – может добавлять его в послеоперационном периоде. Ожидается, что применение новых молекулярных технологий поможет в описании биологии перстневидных и низкодифференцированных раковых клеток и их окружения. Такого рода знания должны позволить разработать in vivo маркеры, характерные для перстневидных клеток, с целью улучшения их обнаружения при проведении эндоскопии. Это может быть полезным и для выявления очагов перстневидноклеточной карциномы при диагностике спорадических случаев заболевания. Несмотря на то, что РЖ занимает 2-ое место по причине смерти от рака во всем мире, до сих пор не существует химиотерапевтических агентов, воздействующих на эту патологию. Однако молекулярные исследования НДРЖ выявили новые потенциальные мишени, приемлемые и для ДРЖ. Например, роль ингибитора c-Src киназы исследуется при других раках и показывает благоприятный токсикологический профиль [12]. Ингибитор c-Src может подавить инвазию очагов внутри слизистой в подслизистый слой и теоретически может отложить проведение гастрэктомии. Более того, изучение эпигенетических поломок, вероятно, скажется на выявлении этиологических причин НДРЖ и сможет открыть пути к разработке новых эпигенетических лекарств, таких, как агенты деметилирования и ингибиторы гистондецетилазы (histone deacetylase) [37].
Обновленные в 2015 г. Международные Рекомендации включают пересмотренные критерии тестирования CDH1 (с учетом первой степени и второй степени родства): 1) семьи с двумя или больше пациентов с раком желудка в любом возрасте, один подтвержденный НДРЖ; 2) лица с НДРЖ в возрасте до 40 лет и 3) семьи с диагнозами НДРЖ и лобулярного рака груди (один диагноз в возрасте до 50 лет). Кроме того, тестирование CDH1 необходимо у пациентов с двусторонним или семейным ЛРГ в возрасте до 50 лет, пациенты с ДРЖ и расщелиной губы или нёба, и лица с предшественниками перстневидно-клеточной карциномой. Учитывая высокий уровень смертности, связанный с инвазивной стадией, профилактическая тотальная гастрэктомия в рекомендуется для лиц с патогенными CDH1 мутациями. Наблюдение рака молочной железы с ежегодной МРТ груди, начиная с возраста 30 для женщин с мутацией в CDH1 рекомендуется. Стандартное эндоскопическое наблюдение рекомендуется для тех, у кого невозможна резекция желудка в текущий момент времени, лицам с вариантами CDH1 неопределенного значения и тех, кто соответствует критериям ДРЖ без герминальных мутаций [35].
источник
Цена исследования 35 000 руб.
Срок выполнения
35 раб.дн.
Записаться на исследование
+7 (495) 150-66-47
Исследуем: 24 гена
Панель «Наследственный рак желудка» направлена на обнаружение патогенных мутаций в генах, ассоциированных с наследственными формами рака желудка и наследственными опухолевыми синдромами, связанными с повышенным риском развития опухолей этой локализации.
Назначение этой панели показано следующим группам обследуемых:
Здоровым людям с имеющимися случаями онкологических заболеваний желудка в семье, например, если известны
- три и более случаев рака желудка в семье в одной линии,
- один случай рака желудка у близкого родственника в возрасте до 40 лет,
- два случая рака желудка у близких родственников в возрасте до 50 лет,
- случай рака желудка и рака молочной железы у близкого родственника с ранним (до 50 лет) выявлением хотя бы одной из этих локализаций, ювенильный полипоз и аденоматозный полипоз у близких родственников.
Здоровым людям без семейного анамнеза онкологических заболеваний наше исследование может дать важную информацию о генетической предрасположенности к онкологическим заболеваниям желудка. Такая вероятность существует, поскольку человек может быть носителем новых мутаций, которых нет у родителей, и кроме того, наследственный рак желудка может наследоваться от здоровых носителей патогенных мутаций. При этом в семье ранее может не быть случаев рака, но у данного конкретного пациента будет присутствовать новая комбинация онкогенных мутаций, унаследованных от обоих родителей-носителей, потенциально вызывающая рак.
Пациентам с уже диагностированной опухолью желудка в случае подозрения на наследственную природу заболевания, например, в случае относительно раннего возраста развития рака (у пациентов моложе 40 лет), в случае онкологически отягощённого семейного анамнеза, например, у пациентов моложе 50 лет с выявленным раком желудка и случаями этого заболевания в семье, у пациентов с раком желудка и раком молочной железы при выявлении хотя бы одного из них в возрасте до 50 лет, у пациентов с раком желудка и случаем раннего (до 50 лет) рака молочной железы у близкого родственника, у пациентов с раком желудка и случаями ювенильного полипоза и аденоматозного полипоза у близких родственников, у пациентов с раком желудка и случаями онкологических заболеваний, ассоциированных с синдромом Линча (колоректальный рак, рак эндометрия, опухоли тонкого кишечника и мочевыводящих путей) у близких родственников, при наличии двух и более первичных очагов опухоли у одного пациента (в желудке или в желудке и в другом органе), выявленных в любом возрасте.
У этой группы пациентов выявление патогенных мутаций позволяет уточнить диагноз и прогноз заболевания, а также выбрать правильную стратегию лечения.
Конечная цель исследования – полная информация о мутациях, связанных с наследственными формами рака желудка, интерпретированная специалистом лаборатории с точки зрения клинической значимости.
Гены, включенные в панель (на основе рекомендаций Национальной онкологической сети США, NCCN):
APC, ATM, BLM, BMPR1A, BRCA1, BRCA2, CDH1, DDB2, EPCAM, ERCC2, ERCC3, ERCC4, ERCC5, MLH1, MSH2, MSH6, PMS2, POLH, PTEN, SMAD4, STK11, TP53, XPA, XPC
Материал для исследования — венозная кровь, взятая в специальную пробирку.
Кровь вы можете сдать в лаборатории Genetico либо в другой лаборатории по месту жительства. Наша логистическая служба доставит биоматериал из любой точки России до места проведения исследования без дополнительных расходов для пациента.
Метод исследования — высокопроизводительное секвенирование ДНК нового поколения (next generation sequencing, NGS). Секвенирование, то есть определение последовательности нуклеотидов ДНК, относится к современным высокоточным методам молекулярного анализа.
Мы проводим полное исследование и формируем заключение в течение 35 рабочих дней.
Сроки могут показаться значительными, но это не так. Это самая высокая скорость на рынке для подобных исследований такого объёма, проводимых с использованием технологии NGS.
Указанное время требуется для выполнения многоступенчатого высокотехнологичного исследования, включающего в себя большое количество лабораторных этапов и промежуточного контроля их качества. В результате получается большой массив генетических данных, требующих отдельного анализа и интерпретации с помощью методов биоинформатики, на что тоже необходимо время.
Формат итогового заключения включает в себя описание результатов исследования и даёт следующую информацию:
- у пациентов с диагностированным раком желудка — список патогенных, вероятно патогенных мутаций и мутаций с неизвестным клиническим значением, их описание и интерпретация с точки зрения клинической значимости.
- у здорового человека — список патогенных и вероятно патогенных мутаций, их описание и интерпретация. Мутации с неизвестным клиническим значением в заключение не выносятся в связи с серьёзными сложностями их дальнейшей клинической интерпретации у здорового человека и низкой информативностью для дальнейших диагностических мероприятий.
Заключение отправляется заказчику по электронной почте. Если есть необходимость получить заключение в бумажном варианте, мы отправим его в любой регион почтой России без дополнительных расходов для заказчика.
После выполнения исследования, анализа данных и оформления заключения вы получите информацию о наличии мутаций, ассоциированных с наследственными формами рака желудка. В случае обнаружения мутаций возможны следующие варианты дальнейших действий:
- обсуждение выявленных мутаций с врачом-генетиком с целью клинической интерпретации полученных результатов;
- обсуждение с врачом-онкологом плана профилактических (профилактические осмотры и исследования, эндоскопия) и превентивных (гастрэктомия) мероприятий у здорового человека;
- обследование ближайших кровных родственников на наличие мутаций для выявления носительства методом секвенирования по Сэнгеру;
обсуждение с врачом-генетиком возможностей планирования беременности для рождения здорового потомства (пренатальная диагностика, ПГД) у пациентов детородного возраста;
уточнение диагноза и прогноза у пациентов с диагностированным раком желудка;
выбор стратегии и тактики лечения у пациентов с диагностированным раком.
При этом у здорового человека появится возможность ранней диагностики или даже предотвращения развития опухолевого процесса, обусловленного наличием единичной мутации или парных мутаций, а у пациента с диагностированным раком в случае выявления мутаций может быть больше вариантов для выбора эффективного лечения.
Нам удалось достичь минимальной цены для исследования такого уровня и такого охвата. Стоимость панели составляет 35 000 рублей. При этом все возможные логистические издержки (доставку биоматериала из других городов, отправку заключений) мы берём на себя без дополнительных затрат со стороны обследуемого. Выгрузка сырых данных в указанную стоимость не входит.
Если вы хотите определить предрасположенность к наследственным формам рака, но не знаете, что именно искать, рекомендуем пройти обследование по панели «Наследственный рак» (полная)
Это максимально полная панель в России, охватывающая наибольшее количество генов (всего – 207), мутации в которых наблюдаются при различных наследуемых злокачественных опухолях.
источник
Обозначение генетической природы рака достоверно подтверждено современными исследованиями. Известно, что основной причиной возникновения онкологии являются мутации ДНК. Мутирующие клетки способны клонироваться и бесконтрольно размножаться. Самые распространенные раковые заболевания в России – опухоли желудочно-кишечного тракта. Одним из них является наследственный рак желудка.
В целях собственной безопасности – каждый должен ознакомиться с причинами, симптомами и основными правилами профилактики болезни. Только таким образом можно полностью излечить, либо предотвратить развитие опасного заболевания.
Рак желудка (РЖ) передается наследственно 4 больным из 10. До 80-х годов РЖ стоял на первом месте в структуре раковой заболеваемости России. В последнее время статистика снижает свои показатели. Несмотря на уменьшение количества больных, недуг так и остается одной из важнейших проблем медицины. Желудочный рак занимает 2 место, уступая лишь онкологии легких у мужчин, и молочной железы у женщин. Мужчины склонны к образованию в желудке в 2 раза чаще, в отличие от противоположного пола.
Всемирная медицина и специалисты в сфере генетики до сих пор не определили точную причину наследственности раковых опухолей в желудке. Достоверно известно то, что рак начинает свое развитие по причине изменения структуры ДНК. Клетки мутируют, продолжают рост и размножение, образуя злокачественную опухоль.
Поскольку истинные причины мутации генов неизвестны, многочисленные исследования дали медикам возможность выделить лишь предполагаемые факторы, влияющие на развитие рака. Из них самые основные:
- Пол. Мужчины болеют данным заболеванием чаще, чем женщины. Причины не установлены.
- Возраст. Люди пожилого возраста болеют онкологией чаще. Риску подвержены пациенты от 55 до 70 лет.
- Неправильное питание. У любителей острой, соленой пищи риск к онкологии растет в 2 раза. Тоже касается приемников копченостей, солений, блюд с большим количеством приправ и специй.
- Курение. Каждый курильщик неконтролируемо глотает небольшое количество дыма, который попадает в желудок. Табачные масла способны разрушать слизистую оболочку органов пищеварения. Поврежденная слизистая имеет предрасположенность к мутации клеток, то есть – к развитию опухоли.
- Заболевания ЖКТ. Пациенты с заболеваниями желудка, такими как язва или гастрит, предрасположены к заболеванию в 2 раза больше.
- Прочие онкологические заболевания. Вероятность желудочной опухоли повышается, если у пациента были ранее другие образования. У женщин – это рак молочной железы, шейки матки, либо яичников. У мужчин – рак толстой кишки, простаты, или мочевого пузыря.
Еще одним наследственным фактором является группа крови. Поскольку она передается от родителей, этот факт считается так же генетической предрасположенностью. Люди с первой группой крови и положительным резусом – болеют онкологией желудка чаще, нежели обладатели других групп крови.
В зависимости от макроскопической картины, существуют такие формы наследственного рака желудка:
Чаще всего, полиповидный рак начинается с аденоматозных полипов, которые не диагностировались ранее.
Опухоль имеет форму блюдца. Она не поражает подслизистый слой, не имеет ярко выраженной клинической картины, поэтому является сложной в диагностировании.
Такая форма рака – самая каверзная. Зачастую, ее обнаруживают только на поздних стадиях, так как опухоль схожа с язвенным образованием на стенке желудка.
Имеет форму цветной капусты. Рост данного вида опухоли направлен в просвет органа пищеварения.
Данный вид образования разрастается внутрь желудочной стенки, поэтому его сложно обнаружить.
Такой вид рака быстрыми темпами дает метастазы, поэтому считается самым опасным. Поражается вся толщина стенок желудка, поверх которых развиваются язвенные наросты. В большинстве случаев эта форма – последующая стадия блюдцеобразной и диффузной форм.
В зависимости от симптоматики, унаследованный рак желудка разделяют на такие формы:
- Болевая (основным симптомом выступают сильные боли).
- Диспепсическая (проявляется вздутием и тяжестью в животе, тошнотой и отвращением к еде).
- Лихорадочная (не имеет остальных симптомов, за исключением высокой температуры тела (до 40 градусов)).
- Анемическая (резко снижается масса тела).
- Геморрагическая (вследствие преждевременного разрушения опухоли, случаются желудочные кровотечения).
Несколько лет назад, генетиками была установлена еще одна форма наследственного рака желудка – интестинальная. Опухоли такой формы выявляются при мутациях, которые изначально вызывали рак молочной железы или яичников. Риск заболевания при мутации такого гена составляет 60 %.
В 2002 году в России было зарегистрировано около 46 тысяч заболевших данным видом рака. Приблизительно у половины людей из этого количества, недуг был обусловлен наследственными факторами. Диагностика образования в желудке – довольно сложный процесс, так как часто – опухоль долго не дает о себе знать. Самое главное в таком случае – вовремя обнаружить рак.
В целях изучения наследственности рака желудка, в каждой онко-клинике ведется отдельная статистика. По ее результатам известно, что заболевание передается только от самых близких родственников. Например, от матери или отца – к детям, или от бабушки или деда – внукам. Наследственность в третьем поколении наблюдается очень редко.
При обнаружении малейших симптомов заболеваний желудка, рекомендуется обязательно посещения медучреждения. После осмотра, врач может дать направление на сдачу анализов и инструментальные методы обследования:
Через горло в желудок пациента вводиться гастроскоп. Во время процедуры врач имеет возможность видеть стенки органов на экране монитора. Такой вид диагностики – доступный и результативный.
Данное обследование – это комплекс мероприятий, нацеленных на диагностику раковых опухолей на ранней стадии. Чаще всего скрининг подходит пациентам, имеющим хронические заболевания ЖКТ.
Для анализа биопсией, с места предполагаемого злокачественного образования берется небольшое количество ткани. Затем – проводятся лабораторные исследования.
Рентген дает возможность определить локализацию опухоли и ее размер. Также – просмотреть очертания, что позволяет установить стадию и объемы поражения.
В отдельных случаях, например при повторных исследованиях, могут назначаться и другие виды диагностики: компьютерная томография, эндоскопия или лапароскопия.
Генетический анализ на онкологию желудка сдается с целью выявления клонов мутирующего гена. Для этого пациенту нужно сдать венозную кровь. Эту процедуру следует провести натощак или через 8 часов после приема пищи. Мутации в генах MLH1 и CDH1 считаются главными признаками развития наследственной болезни.
Результаты анализа дают возможность диагностировать заболевание на самой ранней стадии. Это способствует успешному лечению и (практически всегда) полному выздоровлению.
Обнаружение мутирующих генов не дает стопроцентную вероятность ракового заболевания, но позволяет вовремя принять необходимые меры. Пациенту с подозрениями на рак необходимо постоянное наблюдение врача-онколога. А задача специалиста – разработать индивидуальную методику лечения и профилактики развития опухоли. В таком положении, пациент должен четко придерживаться рекомендаций медиков, соблюдать все указания по диете и приеме препаратов. По статистическим данным, около 95 % пациентов, которые вовремя обратились к врачу и прошли надлежащее лечение, избавляются от желудочного рака полностью и ведут полноценный образ жизни.
В клинической генетике существует множество подходов к наблюдению носителей мутаций генов. Каждому пациенту предназначена своя методика проверок и диагностики. Это зависит от возраста, пола и общего состояния здоровья человека. Основным правилом для таких людей является обязательное ежегодное прохождение компьютерной диагностики.
Периодические осмотры производятся в целях ведения статистики носителей патологического генотипа. Вся информация о таких пациентах храниться в тайне, в связи с юридическими и морально-этическими аспектами.
Главным беспокойством для носителя онкологии является рождение ребенка. Это касается и семей, в которых хотя бы у одного родителя существует риск передачи заболевания своему потомству. Современные технологии позволяют определить наличие или отсутствие мутации уже на первых сроках беременности. Для этого матери нужно пройти анализ УЗИ и сдать кровь. Результаты анализов с большой вероятностью правдивы.
Для носителей данного заболевания существует специальная диета, а также препараты против активации мутирующего процесса. Все эти рекомендации для каждого пациента назначаются онкологом индивидуально.
Несмотря на сложности в диагностике и выявлении мутации генов, наследственный рак желудка не является приговором. Возможности современной медицины позволяют обнаружить недуг на самых ранних стадиях развития. Самое главное, при наличии малейших симптомов – обратиться к специалисту и пройти обследование. Качественное лечение дает возможность не только улучшить состояние больного, но и полностью излечить заболевание.
источник
Считается, что некоторые люди имеют предрасположенность к раку желудка. Само заболевание не передается по наследству. Дети наследуют определенные генетические особенности, которые под влиянием обусловленных факторов могут запустить механизм мутирования ДНК человека. Чаще всего при генетической предрасположенности образовывается диффузный тип патологии, который в большинстве случаев связан со второй группой крови.
Для развития онкологического процесса в желудке необходимы 2 условия:
- Мутация генетического строения клеток, при этом они могут сохранять или терять свои первоначальные свойства.
- Расстройство иммунной системы именно в той области, которая ответственная за устранение раковых клеток.
Очень часто механизм развития онкологии запускается различными вирусными инфекциями. Некоторые вирусы имеют свойство встраивается в генетический аппарат клеток. Таким образом, благодаря влиянию инфекции происходит мутирование ДНК. Заражение вирусам не означает 100% начало онкологического процесса. Для этого необходимое воздействие и других катализаторов. Наследственный рак желудка может развиваться, как следствие влияния внешних факторов:
- канцерогенны:
- ультрафиолет;
- рентгеновское излучение;
- вирусное инфицирование;
- курение;
- радиация;
- стрессы;
- неправильный образ жизни.
Вероятность образования злокачественной опухоли желудка возрастает, если присутствуют другие онкологические процессы в организме или развитие гастрита, язвы.
Перед началом онкологического процесса происходит дисплазия эпителия желудка. Больной человек может ощущать слабость, головокружение, нарушение пищеварения и отвращение к белковой еде. Выделяют несколько симптомов, при которых необходимо срочно обратится к врачу:
- частые болевые ощущения выше пупка, сопровождающиеся тошнотой;
- трудности во время глотания пищи;
- быстрое насыщение от небольшого количества еды;
- стремительная потеря массы тела;
- нехватка железа;
- рвота кровью;
- стул с кровяными включениями.
Вернуться к оглавлению
Если в семье пациента были случаи онкологических процессов, то риск возникновения патологии вырастает. По наследству могут передаваться такие гены:
- Определенная комбинация генов, способна спровоцировать образование злокачественных опухолей.
- Ген повышающий риск формирования любого вида заболевания.
- Гены, влияющие на развитие только одного типа онкологии.
По макроскопической картине передаются такие наследственные формы рака желудка:
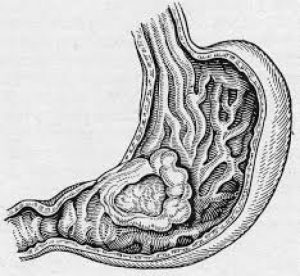
- Полиповыдный рак. На начальных стадиях не врастает в стенку органа, не приводит к выпадению перистальтики.
- Бляшковидный. Локализуется в подслизистом слое, клиническая картина смазанная. Патология тяжело диагностируется.
- Изъязвленный рак желудка. Онкологию трудно отличить от язвенного поражения, поэтому часто обнаруживается на последних стадиях развития.
- Диффузный. Поражает все слои желудочной стенки.
Вернуться к оглавлению
По данным клинических исследований, наследственность к онкологии может передаваться только от близких родственников, то есть до третьего поколения. Однако ребенок может и не иметь склонности к образованию злокачественных опухолей, так как получает 2 копии генов: одну от матери, другую от отца. Наследственные патологии имеют различный тип наследования: доминантный и рецессивный. Первый вариант означает, что для предрасположенности возникновения заболевания нужно унаследовать одну копию гена от одного из родителей. Второй вариант подразумевает получение патологически измененного гена от обоих родителей для формирования склонности. Таким образом, ребенок может иметь один рецессивный ген, полученный в наследство, что делает его только носителем.
Заболевание возникает в следствие мутирования ДНК. Предрасполагающие факторы влияют на структуру ДНК и запускают онкоген, который воздействует на жизненный цикл клеток. Человеческий организм, запрограммированный таким образом, что клетки живут определенное количество времени. Под влиянием онкогена происходит сбой этой регуляции и клетки, которые должны были погибнуть, начинают бесконтрольно размножаться, образовывая опухоли. Выделяют несколько предрасполагающих факторов, независимых от действий человека:

- Пол. Онкологией желудка чаще болеют мужчины.
- Возраст. В преклонном возрасте вероятность образования опухоли возрастает.
- Группа крови. К группе риска относится первая положительная.
Вернуться к оглавлению
Если человек состоит в группе риска, можно провести исследование на наличие онкомаркеров. Во время анализа выявляют мутагенные отклонения в строение генов MLH1, MSH2 и CDH1. Анализ делается натощак, до забора венозной крови нельзя есть на протяжении 8 часов. Выделяют такие показатели для проведения процедуры:
- наличие онкологий ЖКТ в семейном анамнезе;
- желудочные полипы;
- язвенные поражения;
- гастрит;
- анемия с нехваткой железа;
- иммунодефицит;
- вирус Эпштейн-Барра.
Вернуться к оглавлению
Невозможно точно узнать, запустится ли механизм развития онкологического процесса, даже при предрасположенности к наследственному раку. Чтобы контролировать ситуацию, рекомендуется раз в год сдавать анализ на наличие онкомаркеров. Таким образом, удастся обнаружить проблему на ранних стадиях развития. После 50 лет желательно делать исследования каждые 6 месяцев, так как возрастные изменения повышают риск возникновения онкологии. Врачи рекомендуют следить за состоянием здоровья, не запускать хронические болезни, правильно питаться, отказаться от вредных привычек и вести активный образ жизни. В качестве профилактических мер назначают различные гомеопатические препараты для поддержания стабильной работы иммунной системы.
источник
*без учета забора материалов
Весь день по графику работы медцентра
** График сдачи и условия подготовки актуальны только для данного анализа. Если необходимо сдать несколько анализов — рекомендуем уточнить график и условия по телефону колл-центра.
*** Обращаем ваше внимание, что сроки выполнения анализов могут быть увеличены по техническим причинам, связанным с особенностями биоматериала (гемолизированные, хилезные образцы, наличие сгустков и т.д.), что требует перестановок, а в некоторых случаях повторного забора материала.
Рак желудка — злокачественная опухоль, развивающаяся из слизистой оболочки желудка. На данный момент это одно из наиболее распространённых злокачественных заболеваний. Рак желудка является вторым в структуре онкологической смертности после рака лёгких. Чаще поражает мужчин. У 80—90 % больных раком желудка возникают метастазы. Такая распространенность связана с тем, что начальные стадии рака желудка протекают почти бессимптомно и пациенты обращаются к врачу слишком поздно.
Причиной любого злокачественного заболевания является повреждение наследственной информации клеток, которое происходит под действием различных факторов внешней среды. В случае рака желудка такими факторами являются особенности диеты, курение, употребление алкоголя и инфицирование бактерией Helicobacter pylori. Индивидуальную чувствительность человека к вредным факторам внешней среды определяет генетика. Наследственные изменения (мутации) в определенных генах увеличивают риск развития рака желудка в несколько раз, поэтому для осуществления своевременной диагностики так важно знать свой уровень риска.
Распространенность
Рак желудка занимает в мире четвёртое место среди злокачественных новообразований. От него ежегодно погибает до 800.000 человек.
Кому показано тестирование:
• Всем, кто заботится о своем здоровье;
• Тем, у кого в семье был хотя бы 1 случай заболевания раком желудка или кишечника;
• Людям с язвенной болезнью и другими заболеваниями желудочно-кишечного тракта.
Описание профиля
В рамках профиля ГП_12 в «Медицинской лаборатории СПб» осуществляется анализ мутаций в двух группах генов:
1. гены иммунного ответа, которые отвечают за местные воспалительные реакции в эпителии желудка;
2. ген фолатного обмена, мутации в котором увеличивают мутационный фон организма.
Данное тестирование позволяет определить индивидуальный уровень риска развития рака желудка и сориентировать в профилактических мероприятиях.
Как пройти тестирование:
• Необходимо отметить соответствующий профиль в направлении, сообщить о своем желании администратору или записаться на первичный прием к врачу-генетику или гастроэнтерологу медицинского центра
• Сообщить свой возраст и цель обследования (наличие семейной истории болезни)
• Осуществить забор крови из вены (в пробирку с ЭДТА, не обязательно натощак)
• Получить заключение врача-генетика с интерпретацией результатов и рекомендациями
• Анализ выполняется около 4-х недель с момента забора крови
• По результатам тестирования рекомендуется повторная консультация врача-генетика или гастроэнтеролога
Интерпретация результатов
В результате ДНК-диагностики по профилю ГП_12 врачом-генетиком будет выдано заключение с интерпретацией результатов и рекомендациями. Отрицательный результат ДНК-тестирования покажет, что уровень риска развития рака желудка, обусловленный индивидуальной чувствительностью к вредным факторам внешней среды, минимален и соответствует образу жизни пациента. При обнаружении мутаций в генах предрасположенности риск развития рака желудка увеличен в 2-5 раз в зависимости от гена.
Тактика ведения пациентов с выявленными факторами предрасположенности к развитию рака желудка
Из профилактических мероприятий могут быть рекомендованы:
• ежегодное диспансерное обследование с проведением эндоскопических и рентгенологических исследований желудка;
• после 40 лет — исследование кала на скрытую кровь каждые 6 месяцев;
• своевременное и правильное лечение заболеваний пищеварительного тракта;
• отказ от курения или снижение количества потребляемого табака;
• достаточное употребление аскорбиновой кислоты;
• диета с небольшим содержанием соли, исключение из рациона маринованных, пережаренных, копчёных продуктов, острой пищи, животного масла.
источник
Номенклатура МЗРФ (Приказ №804н): B03.027.011.002 «Комплекс исследований для диагностики кодирующих экзонов гена CDH1 (3 полиморфизма) в крови»
Срок выполнения (в лаборатории): 5 р.д. *
Рак желудка – это конечная фаза длительного предракового процесса, затрагивающия эпителиальный слой слизистой оболочки желудка. Одним из основных факторов риска развития рака желудка является онкологическая (наследственная) предрасположенность. Это значит, что при наличии рака желудка у ближайших родственников (родители, бабушка/дедушка), риск возникновения болезни повышается. К другим провоцирующим факторам относятся: наличие полипов желудка, пернициозная анемия, болезнь Менетрие, инфицирование Helicobacter pylori, ранее проведенные хирургические операции на желудке, систематическое нарушение в питании, профессиональные вредности. По статистике, мужчины чаще страдают от рака желудка, чем женщины. При обнаружении на ранних стадиях рак желудка операбелен, что в некоторых случаях позволяет добиться полного излечения.
Чтобы выявить предрасположенность к раку желудка и назначить адекватные меры профилактики рекомендуется провести генетическое исследование.
В состав данного исследования входит определение генетической предрасположенности к раку по 3 полиморфизмам гена CDH1: CDH1 ((C-160A; A-284C), (C2076T), (rs17690554))).
Важно: данный анализ является не основным, а дополнительным в комплексе диагностических процедур.
- Признаки рака желудка, в том числе наличие такого состояния у ближайших родственников.
Специальной подготовки не требуется. Взятие крови проводится не ранее, чем через 4 часа после последнего приема пищи. Накануне избегать переедания, физической нагрузки и эмоционального перенапряжения. За 24 часа до взятия материала не рекомендуется прием противовирусных и антибактериальных препаратов.
Для интерпретации результата анализа рекомендована консультация специалиста.
Адреса медицинских центров, в которых можно заказать исследование, уточняйте по телефону 8-800-100-363-0
Все медицинские центры СИТИЛАБ в г. Москва >>
| Код | Наименование | Цена | Заказ |
|---|---|---|---|
| 96-10-001 | Синдром Жильбера. Определение инсерции (варианта UGT1A1*28) в промоторной области гена UGT1A1 | от 5 р.д. | 3890.00 р. |
| 96-10-002 | Определение варианта в гене PTPN22 (R620W) | от 5 р.д. | 3360.00 р. |
| 96-10-003 | Риск развития сахарного диабета I типа (5 полиморфизмов генов) | от 5 р.д. | 7880.00 р. |
| 96-10-004 | Определение вариантов в генах TCF7L2 (RS 7903146), PPARG (P12A), KCNJ11 (E23K) | от 5 р.д. | 6410.00 р. |
| 96-10-005 | Определение вариантов в гене ApoE (8 полиморфизмов) | от 5 р.д. | 5150.00 р. |
* На сайте указан максимально возможный срок выполнения исследования. Он отражает время выполнения исследования в лаборатории и не включает время на доставку биоматериала до лаборатории.
Приведенная информация носит справочный характер и не является публичной офертой. Для получения актуальной информации обратитесь в медицинский центр Исполнителя или call-центр.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Ежегодно устрашающий раковый диагноз ставится более 12 млн. человек по всему миру, и онкология уносит жизни около 7 млн. человек. Украина – в первой десятке стран по масштабам заболеваемости раком: более 160 тыс. новых заболевших в год.
Среди всех онкологических заболеваний рак желудка по распространенности стоит на четвертом месте – после рака легких, молочной железы и толстой кишки.
Диагностика рака желудка не может базироваться на этиологии этого заболевания, ведь достоверные научно обоснованные причины появления у человека рака желудка на сегодняшний день медицине определить не удалось. Но факторов, которые могут дать толчок превращению клеток слизистой оболочки желудка в плацдарм злокачественного новообразования, великое множество.
Это и особенности питания человека, в котором преобладает жирная, жареная и острая пища. И злоупотребление алкоголем вкупе с курением. И такие хронические патологии желудка, как язва, гастрит (эрозивный или атрофический), полипы, а также имевшее место хирургическое вмешательство. Нередко причина онкологического заболевания, в том числе и желудка, связана с наследственностью, серьезным нарушением обмена веществ или проблемами иммунной системы.

Чем раньше выявлены онкологические проблемы желудка, тем больше возможностей успешно справиться с болезнью. Ведь при обнаружении рака желудка в самом его начале выживают восемь пациентов из десяти. Но, к большому сожалению, раннюю форму рака удается диагностировать не более чем в десяти случаях из ста. А более чем в 70% случаев обращений в лечебные учреждения констатируются поздние стадии рака желудка.
По единогласному мнению врачей, ранняя диагностика рака желудка (аденокарциномы, блюдцеобразного рака, стромальных опухолей, инфильтративно-язвенного, диффузного рака) – процесс сложный, так как в большинстве случаев на первых порах эта коварная болезнь себя никак не проявляет: нет ни боли, ни каких-либо функциональных нарушений.
Начальную стадию рака онкологи определяют как первичную опухоль слизистого и подслизистого слоев желудка размеров не более 2 см. И обычно она выявляется во время рентгеновского или эндоскопического обследования пациентов по поводу других заболеваний: хронического атрофического гастрита, хронического гипертрофического полиаденоматозного гастрита (болезни Менетрие), хронической язвы желудка, аденоматозных полипов или пернициозной анемии (болезни Аддисона-Бирмера).
Так, у значительного количества больных пернициозной анемией (вызванной дефицитом витамина В12 и ведущей к атрофии слизистой желудка) в итоге врачи диагностируют рак желудка. А перерождение полипов и хронических язв желудка в рак достигает 20%.

Среди самых первых симптомов, по которым у специалистов возникает подозрение на онкологическое заболевание желудка, отмечаются состояние слабости, ничем не объяснимую повышенную температуру тела, потерю аппетита и снижение веса, бледность или землистый оттенок кожи. Больных мучают изжоги, запоры и диарея. Однако такие проявления присущи довольно обширному кругу желудочно-кишечных заболеваний.
Но есть и более выраженные симптомы злокачественных опухолей желудка, когда пациенты жалуются на продолжительные ноющие или тянущие боли слева в подреберье, которые начинаются после приема пищи. Если опухоль затронула участок, где желудок переходит в двенадцатиперстную кишку (так называемую привратниковую часть желудка) – то неминуемы диспепсия (чувство тяжести и переполненности желудка), тошнота и рвота (съеденным накануне). Все это настолько серьезно, что нужно срочно обращаться к врачу.
Основываясь на данных лабораторных исследований крови — общего и биохимического анализов, можно выявить у пациента анемию (снижение уровня гемоглобина) или нарушение белкового обмена (как говорят, «пониженный белок»). Кроме того, определяют скорость оседания эритроцитов (СОЭ), которая при онкологии будет повышенной. Но только на данных анализов крови диагностика рака желудка невозможна, и пациента направляют сдать анализ крови на раковый антиген, то есть на наличие в составе крови белков (онкомаркеров), выделяемых только раковыми клетками.
При анализе состава желудочного сока можно определить содержание в нем соляной кислоты: ее выработка в желудке при раковых поражения органа сокращается практически до нуля — из-за атрофии слизистой желудка.
Поэтому без других методов диагностики рака желудка правильный диагноз поставить нельзя. К основным диагностическим технологиям относятся:
- рентгеноскопия желудка,
- эндогастроскопия (ЭГДС) с биопсией ткани желудка,
- ультразвуковое исследование (УЗИ),
- компьютерная томография (КТ),
- магнитно-резонансная томография (МРТ).
Общепринятое традиционное рентгеновское исследование желудка бывает эффективным при язвенно-инфильтративной форме рака (так как в данном случае результаты биопсии часто бывают отрицательными). С помощью рентгена также возможно выявление рецидивов раковой опухоли после ее оперативного лечения.
Диагностика рака желудка методом эндогастроскопии (ЭГДС) позволяет обследовать слизистую оболочку желудка, выяснить ее состояние и, что самое главное, провести биопсию тех участков слизистой, которые вызывают подозрение на рак. Именно биопсия является самым достоверным методом исследования клеточного состава ткани, и проведение биопсии обязательно для подтверждения онкологического диагноза.
После комплексного рентгено-эндоскопического обследования проводится ультразвуковая диагностика (УЗИ), а также лучевая диагностика рака желудка (КТ). Данные методы диагностики рака желудка позволяют обнаружить недоброкачественные опухоли, определить их расположение, размер и даже структуру.
Наиболее распространенный метод обследования органов брюшной полости — ультразвуковой (УЗИ). С его помощью специалисты выявляют косвенные признаки рака желудка (по изменениям формы очертаний органа), захват опухолью близлежащих органов и наличие или отсутствие метастазов (в печень, лимфоузлы или брюшину). Ультразвуковое исследование эффективно при ранней диагностике рака желудка, поражающего стенки органа.
Современная лучевая диагностика рака желудка — компьютерная томография (КТ) — направлена главным образом на уточнение данных УЗИ относительно наличия метастазов внутренних органах, расположенных в брюшной полости. Благодаря изображению желудка и его тканей в различных ракурсах КТ помогает онкологам более точно установить стадию рака желудка.
Метод магнитно-резонансной томография (МРТ) для получения изображения использует не рентгеновские лучи, а безопасное магнитное поле. МРТ-диагностика дает четкую «картинку» почти всех тканей и органов. Врачи-диагносты считают МРТ самым эффективным методом диагностики рака желудка и других новообразований в организме человека.
Диагностика рака желудка также проводится методом эндосонографии. Специалисты послойно «просматиривают» стенки желудка и определяют стадию онкологического заболевания. Этот метод помогает выявить метастазы рака желудка в близлежащие лимфатические узлы. В особо проблемных случаях диагностики делается лапароскопия: через небольшой прокол внутрь брюшной полости вводится лапароскоп (разновидность эндоскопа), и с его помощью врач осматривает органы. Особенность этого метода диагностики рака желудка состоит в том, что одновременно можно провести биопсию.
Дифференциальная диагностика широко применяется в медицинской практике, особенно в тех случаях, когда «букет» симптомов болезни настолько обширен, что складывается впечатление, что у пациента сразу несколько заболеваний. Принцип, на котором основана дифференциальная диагностика рака желудка (впрочем, как и любой другой патологии), состоит в том, чтобы путем исключения несоответствующих данному заболеванию симптомов установить единственно возможную болезнь в каждом конкретном случае.
Онкологи не скрывают того, что труднее всего – отличить изъязвленные формы рака желудка от обычной язвы. Все дело в том, что в клинических проявлениях обеих патологий неимоверное количество сходных симптомов, и единственная разница заключается в частоте и интенсивности их проявлений. При этом «перечня», в котором четко указывались бы критерии отнесения заболевания к онкологии, просто не существует.
К примеру, и при инфильтративно-язвенном раке, и при язве желудка пациенты часто жалуются на боли после еды, которые локализуются в эпигастральной области (то есть в области проекции желудка на переднюю брюшную стенку). Простой анализ желудочного сока на уровень кислотности мало чем помогает, и только обнаружение у пациента стойкой формы гистаминрезистентной ахлоргидрии — снижения секреторной функции желудка — дает основания на определение злокачественного изъязвления слизистой желудка.
Весьма похожи результаты рентгенологического и эндоскопического обследования больных при подозрении на рак желудка и пациентов с язвой желудка. И в этом случае врачи делают вывод только на данных гистологического исследования клеток желудочной ткани, взятых при проведении биопсии. Причем для исключения ошибки биопсию делают 2-3 раза.
Дифференциальная диагностика рака желудка помогает врачам разобраться и в случае с доброкачественным полипом желудка и возникшей на месте этого полипа раковой опухолью. Здесь также на помощь приходит эндогастроскопия (ЭГДС) с биопсией ткани желудка, так как рентгенологическое обследование, как показывает практика, в доброй половине случаев не выявляет даже обычные полипы желудка.
Как видите, в арсенале современной медицины достаточно много методов диагностики рака желудка. И врачи могут выявить онкологию и назначить адекватное лечение. Главное – внимательно относиться к своему здоровью, вовремя обращаться по любому подозрению на рак и не воспринимать этот диагноз как приговор.

источник
