Иммуногистохимия, или иммуногистохимический анализ — исследование, во время которого в образцах ткани с помощью антител выявляют определенные молекулы. Этот метод диагностики нашел широкое применение в онкологии.
Немного теории и истории. Для того чтобы обнаруживать и уничтожать чужеродные вещества, иммунная система использует особые молекулы — антитела. Они отличаются специфичностью: каждое антитело может связываться строго с определенным антигеном.
В 1941 году американский иммунолог Альберт Кунс впервые решил использовать антитела в лаборатории, чтобы «распознавать» с помощью них белки бактерий. В 1984 году биохимик из Аргентины Сезар Мильштейн получил Нобелевскую премию за то, что создал гибрид опухолевой клетки с лимфоцитом, которая могла синтезировать моноклональные антитела. После этого началось производство моноклональных антител для диагностических и лечебных целей.
В 1994 г. С. Тэйлор применил иммуногистохимический анализ, чтобы проверить 20 000 опухолей, и обнаружил, что диагнозы в половине случаев были ошибочными. Иммуногистохимия зарекомендовала себя как эффективный метод диагностики.
Иммуногистохимический анализ помогает врачам-онкологам:
- Отнести злокачественную опухоль к тому или иному типу.
- Выяснить, в каких генах опухолевых клеток произошли мутации, какие белки способствуют прогрессированию рака.
- Выявить первичную опухоль и ее метастазы.
- Определить, произошла ли злокачественная трансформация клеток.
- Определить прогноз для пациента.
- Разобраться, поможет ли в данном случае таргетная терапия.
- Определить, чувствительны ли опухолевые клетки к химиотерапии, лучевой терапии.
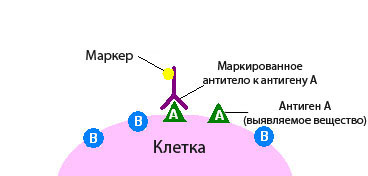
Иммуногистохимия бывает прямой и непрямой. В первом случае используют один вид антител, которые должны вступить в связь с определенной молекулой-мишенью. Если молекула-мишень присутствует в ткани, и реакция произошла, опухолевая ткань окрашивается:
- Чаще всего к антителу присоединяют фермент, например, пероксидазу. Этот фермент катализирует химическую реакцию, которая приводит к изменению цвета.
- Иногда к антителу присоединяют флюоресцин или родамин, при этом окрашивание выявляют с помощью флюоресцентной микроскопии.
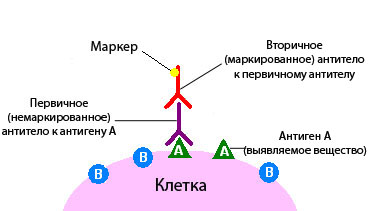
- всего применяют непрямую иммуногистохимию. При этом используют два антитела. Одно соединяется с антигеном, второе — с полученным комплексом антиген-антитело. Маркер, который вызовет изменение цвета, связывают со вторым антителом.
Непрямой метод имеет некоторые преимущества:
- Он обладает более высокой чувствительностью, потому что с одним первичным антителом (тем, которое связывается с белком-мишенью) может связаться несколько вторичных антител.
- Исследование занимает немного времени: для того, чтобы произошла реакция, нужно примерно 3 часа.
- Непрямая иммуногистохимия требует небольшого количества антител. Например, вторичное антитело, направленное на иммуноглобулины кролика, будет реагировать на любое первичное антитело «кроличьего» происхождения. Не нужно создавать много разных видов вторичных антител с окрашивающей или флуоресцентной меткой.
Для того чтобы выполнить иммуногистохимический анализ, нужно получить опухолевую ткань, то есть провести биопсию. В качестве материала можно использовать столбик ткани, полученный во время трепан-биопсии, фрагмент тканей или даже целый орган, удаленный во время операции.
Образец ткани фиксируют с помощью формальдегида (иногда используют метанол, ацетон и другие фиксаторы — это зависит от того, какой антиген нужно выявить, и реагирует ли он с теми или иными фиксаторами) и погружают в парафин. Парафинизация помогает законсервировать ткань, сохранить ее структуру на длительное время.
Затем ткань, помещенную в парафин, нарезают с помощью специального инструмента — микротома — на слои толщиной 3–5 мкм. Эти тонкие срезы помещают на стекло, покрытое, специальным клеем.
Некоторые образцы слишком чувствительны к реагентам, которые применяют во время вышеописанной процедуры. Их нельзя помещать в парафин. Такие ткани замораживают жидким азотом. Этим альтернативным методом пользуются редко, только в случае необходимости, так как у заморозки есть некоторые недостатки: она делает изображение под микроскопом не таким четким, требует специальных условий хранения образцов. Фиксацию ткани в таких случаях проводят уже после нанесения на стекло и размораживания, ацетоном или формальдегидом.
После того как срезы нанесены на стекло, из них нужно удалить весь парафин, иначе антитела не прореагируют с антигеном. Эта процедура называется депарафинизацией. Ее проводят с помощью ксилола. Затем выполняют еще некоторые подготовительные процедуры, чтобы антитела могли успешно прореагировать с нужными антигенами, и, наконец, проводят непосредственно иммуногистохимический анализ. Обработанную антителами ткань рассматривают под микроскопом, чтобы проверить, окрасилась ли она.
Количество возможных мишеней измеряется сотнями. Перед исследованием врач должен понимать, что он ищет, и использовать соответствующие антитела. В онкологии мишенями являются опухолевые маркеры — вещества, которые в здоровых клетках отсутствуют вообще или присутствуют в значительно меньшем количестве. Вот некоторые примеры:
- Рецепторы к эстрогенам и прогестерону помогают идентифицировать гормонально-позитивный рак молочной железы и разобраться, помогут ли женщине гормональные препараты.
- Простатспецифический антиген (ПСА) имеет значение в диагностике рака простаты.
- Альфа-фетопротеин — присутствует в гепатоцеллюлярной карциноме (рак печени).
- Цитокератины помогают в диагностике рака и некоторых сарком (злокачественных опухолей соединительной ткани).
- Фермент CD10 (CALLA) связан с карциномой почек, лимфобластным лейкозом.
Иммуногистохимический анализ помогает изучить характеристики злокачественной опухоли, которые не могут выявить другие методы диагностики. Зачастую это играет важную роль в уточнении диагноза и назначении правильного лечения. Врач может определить, какие комбинации препаратов будут наиболее эффективны для конкретного больного, иными словами, реализуется принцип персонализированного лечения. Зачастую это помогает улучшить результаты, подобрать эффективное лечение для пациентов, которым не помогает стандартная терапия.
источник
Поставить точно диагноз «онкология» без проведения специальных исследований практически невозможно. В настоящее время медицина обладает такими возможностями. Поэтому если имеется подозрение на рак, то проводится иммуногистохимическое исследование. Рассмотрим, что собой представляет данный анализ, в каких случаях назначается и что позволяет выявить.
Под данным исследованием подразумевается изучение образца тканей под микроскопом. Их получают при помощи биопсии и предварительно обрабатывают специфическими антителами.
Онкологические заболевания давно находятся в поле зрения врачей и ученых. В ходе многочисленных исследований было установлено, что злокачественные клетки в процессе жизнедеятельности продуцируют специфические белки, которые называют антигенами. Они связываются с антителами, именно на этом основано иммуногистохимическое исследование, когда ткань пациента, взятая для изучения, после обработки тщательно изучается при помощи микроскопии.
Когда антитела взаимодействуют с раковыми клетками, то можно наблюдать явление флуоресценции. Это дает основания практически на 100 % быть уверенным, что имеет место онкология.
Сейчас уже разработаны и активно внедрены в медицинскую практику антитела практически ко всем новообразованиям.
Иммуногистохимическое исследование при раке позволяет:
- Распознать новообразование и определить его разновидность.
- Выяснить распространенность первичного очага по организму.
- При взятии биологического материала из вторичных очагов можно определить источник распространения метастазов.
- Исследование позволяет оценить эффективность терапии.
- При помощи анализа можно выяснить, на какой стадии развития находится раковая опухоль.
- Иммуногистохимическое исследование позволяет также выяснить скорость роста новообразований.
Данный метод исследования считается более информативным по сравнению с обычным гистологическим. Если использовать оба метода исследования, то можно получить полнейшую картину, поэтому на практике чаще всего врачи так и поступают.
Исследовать при помощи этого метода можно практически все ткани человеческого организма, но чаще всего такой анализ назначают при подозрении на онкологию.
- Для определения первичных новообразований.
- Для выявления метастазов.
- Данный анализ помогает определить прогноз развития и протекания патологии.
- Анализ служит одним из методов исследования рецепторов к ряду гормонов.
- ИГХ-исследование позволяет обнаружить микроорганизмы.
- Метод исследования применяют для выяснения чувствительности раковых клеток к химиотерапии и радиотерапии.
Иммуногистохимическое исследование проводится в несколько этапов, первым из них является сбор биологического материала. Его получают путем биопсии или изъятия материала во время проведения операции.
Кусочек ткани помещают в формалин и направляют в лабораторию, где его подвергают изменениям:
- Материал обезжиривают специальными составами и заливают парафином. В таком состоянии он может храниться практически вечно, поэтому при необходимости исследование можно повторять.
- На следующем этапе получают тончайшие срезы — проводят микротомирование. Их размещают на специальных стеклах.
- Приготовленные срезы обрабатывают растворами антител определенной концентрации. Использовать для обработки могут составы, содержащие разное количество антител. Какие из них вступят во взаимодействие с раковыми клетками, будет зависеть от разновидности опухоли.
Такой анализ просто незаменим, если есть подозрение на наличие раковых клеток в груди. Обязательно определение количества рецепторов эстрогена и прогестерона. При их повышении активизируется процесс роста злокачественных клеток.
ИГХ-исследование позволяет не только распознать онкологическое заболевание, но и определить его стадию. При помощи исследования врачи выясняют, показана ли гормональная терапия.
Опухоли, имеющие большую концентрацию гормонов, чаще всего вполне эффективно лечатся антигормональными препаратами.
Во время проведения анализа обязательно определяют показатель Ki-67, он помогает определить злокачественность процесса. Если иммуногистохимическое исследование молочной железы показывает Ki-67 до 15 %, то исход заболевания считается благоприятным. Если показатель доходит до 30 %, то без химиотерапии не обойтись, потому что опухоль растет довольно быстро. Отметка в 90 % чаще всего свидетельствует о неизбежности летального исхода.
Данный анализ назначается не только при подозрении на онкологию груди, но еще он оказывается довольно информативным, если:
- Имеется бесплодие.
- Обнаружены злокачественные образования матки.
- Наблюдаются патологические изменения в репродуктивной системе.
Такой анализ проводится, если:
- Часто наблюдаются выкидыши.
- У женщины было несколько неудачных попыток ЭКО.
- Диагностирована хроническая форма эндометрита.
Данное исследование помогает выяснить, имеются ли клетки, мешающие зачатию естественным путем.
ИГХ-исследование тканей эндометрия назначается женщинам, у которых уже было несколько неудачных попыток искусственного оплодотворения.
Взятие тканей эндометрия проводится в разные дни цикла, которые назначает врач.
Необходимо иметь в виду, что исследовать подготовленные образцы тканей имеет право только врач, имеющий сертификат, подтверждающий специальную подготовку по проведению анализов по методу ИГХ.
В заключении должно быть указано:
- Показатели антител, к которым определена тропность исследуемой ткани.
- Указывается разновидность раковых клеток и их количество.
- Указываются выявленные антигены, которые помогают установить вид онкологии.
По результатам исследования нельзя ставить окончательный диагноз. Врач-онколог имеет право это сделать только после получения интерпретации всех диагностических процедур.
Таким образом, можно сделать вывод, что эффективно иммуногистохимическое исследование при раке молочной или других желез и других видах онкологии. Анализ дает исчерпывающую информацию и позволяет распознать начинающийся патологический процесс на клеточном уровне.
источник
HER2: биомаркер, меняющий подходы к терапии распространенного рака желудка и пищеводно–желудочного перехода
Рецептор эпидермального фактора роста 2-го типа (HER2) имеет важную прогностическую ценность при лечении распространенного рака желудка и пищеводно-желудочного перехода
- В настоящее время существует колоссальная потребность в повышении эффективности терапии распространенного рака желудка и пищеводно-желудочного перехода. Существующие стандартные методы лечения не позволяют увеличить медиану общей выживаемости пациентов более, чем на 1 год (по данным крупных международных исследований)
- В исследовании ToGA впервые было продемонстрировано беспрецедентное увеличение медианы общей выживаемости больных HER2-положительным распространенным раком желудка и пищеводно-желудочного перехода. Исследование ToGA было разработано для оценки эффективности и безопасности Герцептина в комбинации со стандартной химиотерапией в 1-й линии лечения HER2-положительного распространенного рака желудка и пищеводно-желудочного перехода
Рандомизированное исследование III фазы: дизайн исследования ToGA (n=594)
† ИГХ3+ и/или FISH+
* Кселода или в/в введение 5-ФУ на усмотрение исследователя;
ИГХ – иммуногистохимия; FISH – флуоресцентная гибридизация in situ;
РЖ – рак желудка; ПЖ переход – пищеводно-желудочный переход
- В общей популяции больных метастатическим раком желудка и пищеводно-желудочного перехода 22% опухолей являются HER2-положительными (ИГХ3+ и/или FISH+). В 16% случаев определяется гиперэкспрессия HER2 (ИГХ3+ или ИГХ2+ /FISH+)³
Герцептин увеличивает медиану общей выживаемости (ОВ) больных с гиперэкспрессией HER2 (ИГХ3+ или ИГХ2+/FISH+) до 16 месяцев
- Герцептин в сочетании с химиотерапией достоверно увеличивает общую выживаемость всех пациентов с HER2-положительным статусом опухоли (ИГХ3+ и/или FISH+)³
| Медиана | |||||
| Количество пациентов | ОВ | ОР | 95%-ный ДИ | p | |
| Химиотерапия + Герцептин | 167 | 13.8 | 0.74 | 0.60, 0.91 | 0.0046 |
| Химиотерапия | 182 | 11.1 | |||
- Наибольшее увеличение медианы общей выживаемости (ОВ) (до 16 месяцев) выявлено в подгруппе пациентов с гиперэкспрессией HER2 (ИГХ3+ или ИГХ2+/FISH+)³
| Медиана | ||||
| Количество пациентов | ОВ | ОР | 95%-ный ДИ | |
| Химиотерапия + Герцептин | 120 | 16.0 | 0.65 | 0.5, 0.83 |
| Химиотерапия | 136 | 11.8 | ||
Иммуногистохимические критерии оценки статуса HER2 при раке молочной железы не могут применяться при распространенном раке желудка и пищеводно- желудочного перехода
- Иммуногистохимические критерии оценки статуса HER2 при раке молочной железы не могут применяться при распространенном раке желудка и пищеводно- желудочного перехода 4
 |  |
| Гетерогенное окрашивание клеток опухоли желудка, экспрессирующих HER2 | Полное, базолатеральное или латеральное мембранное окрашивание |
Стандартизированные тесты для оценки статуса HER2 при распространенном раке желудка и пищеводно- желудочного перехода
Иммуногистохимический анализ (ИГХ)
- Анти HER-2/neu (4B5) (Ventana)
- HercepTest™ (Dako)
Гибридизация in situ (in situ hybridization)
- Флуоресцентная гибридизация in situ HER2 pharmDx™ (HER2 FISH pharmDx™ (Dako))
- Усиленная серебром гибридизация in situ (SISH) (INFORM™ HER2 SISH (Ventana))
- Тестовые системы CONFIRM™ anti-HER2/neu (4B5, Ventana) и INFORM™ HER2 SISH (Ventana) так же достоверно выявляют гиперэкспрессию HER2/neu и/или амплификацию гена HER2/ neu, как и тестовые системы HercepTest™ (Dako) и HER2 FISH pharmDx™ (Dako), применявшиеся для оценки HER2 статуса в исследовании ToGA 5
| Шкала | Образец, полученный при операции – характер окрашивания | Образец, полученный при биопсии – характер окрашивания | Оценка гиперэкспрессии HER2 | |
 | Нет окрашивания или мембранное окрашивание менее чем в 10% опухолевых клеток | Нет окрашивания или полное отсутствие мембранного окрашивания | Результат отрицательный | |
 | 1+ | Слабое/едва различимое частичное мембранное окрашивание в ≥10%опухолевых клеток | Слабое/едва различимое мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат отрицательный |
 | 2+ | Слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание в ≥10% опухолевых клеток | Слабое/умеренное полное, базолатеральное или латеральное мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат сомнительный (требуется подтверждение ISH) |
 | 3+ | Выраженное полное, базолатеральное или латеральное мембранное окрашивание в ≥10% опухолевых клеток | Выраженное полное, базолатеральное или латеральное мембранное окрашивание вне зависимости от доли окрашенных опухолевых клеток | Результат положительный |
Алгоритм определения статуса HER2 при распространенном раке желудка и пищеводно- желудочного перехода 3,4
- Все образцы опухолей больных раком желудка и пищеводно- желудочного перехода следует исследовать на статус HER2 ИГХ является методом выбора для первоначальной оценки статуса HER2
- Пациенты с уровнем экспрессии HER2 в опухоли 3+ (методом ИГХ) расцениваются как HER2-положительные. Им может быть назначен Герцептин
- Образцы с уровнем экспрессии HER2 (ИГХ2+) должны исследоваться методом гибридизации in situ (ISH) для подтверждения статуса HER2
- Пациенты с уровнем экспрессии ИГХ 2+/ISH+ в опухоли расцениваются как HER2-положительные. Им может быть назначен Герцептин
Список сокращений: ИГХ — иммуногистохимический анализ; SISH — усиленная серебром гибридизация in situ; ISH — гибридизация in situ; ОР — относительный риск; ХТ — химиотерапия
Ссылки: 1. Gravalos C, et al. Ann Oncol 2008; 19: 1523-29; 2. Tanner M, et al. Ann Oncol 2005; 16: 273-78; 3. Bang Y-J, Cutsem E, et al. The Lancet 2010; 376: 687-697; 4. — Hoffman M, et al. Histopathology 2008; 52: 797-805; 5. Powell et al. poster presented at ASCO GI 2010
Показание при раке желудка. Распространенная аденокарцинома желудка или ПЖ перехода с опухолевой гиперэкспрессией HER2 в комбинации с капецитабином или в/в введением 5-ФУ и препаратом платины в случае отсутствия предшествующей противоопухолевой терапии по по- воду метастатической болезни. Противопоказания. Повышенная чувствительность к трасту- зумабу или любому другому компоненту препарата. Побочное действие со стороны организма в целом: боли в животе, слабость, боли в грудной клетке, озноб, лихорадка, головные боли, боли; со стороны системы пищеварения: диарея, тошнота, рвота; со стороны костно-мышечной системы: артралгия, миалгия; со стороны кожи и подкожно-жировой клетчатки: сыпь. Полная информация о препарате представлена в инструкции по медицинскому применению.
источник
На вопросы о профилактике, диагностике и лечении рака желудка и пищевода отвечает руководитель онкологического центра комбинированных методов лечения клиники высоких медицинских технологий им. Н. И. Пирогова СПбГУ Андрей Павленко.
Нет, это не так. Рак желудка и рак пищевода — заболевания, которые входят в разные группы риска и провоцируются разными факторами.
Рак пищевода могут спровоцировать: многолетнее курение, любовь к горячим напиткам, частое (несколько раз в неделю) употребление крепких спиртных напитков. Почему? Они травмируют слизистую оболочку пищевода, провоцируют предраковые состояния. От курения никотин и смолы растворяются в слюне, крепкий алкоголь раздражает и вызывает воспалительные процессы.
Не так давно типичным эндемическим районом была Средняя Азия с ее любовью к горячему чаю. Его пили не остужая, и это приводило к заболеваниям среднегрудного отдела пищевода. Так что стоит пить и есть горячее, предварительно остудив во рту, либо охладив заранее до приемлемой температуры.
Рак желудка может быть вызван возбудителем helicobacter pylori. Он может довести слизистые оболочки до воспаления, которые потом трансформируются в метаплазии (изменения эпителия). Также в группу риска входят люди, употребляющие необработанные мясо и рыбу. Стоит помнить, что жареное и жирное скорее увеличит вероятность колоректального рака, нежели рака желудка.
По большей части — да. Если говорить о пищеводе, 99% больных — люди старше пятидесяти, многолетние курильщики, употребляющие много крепкого алкоголя. Если каждый день употреблять крепкий алкоголь, слизистая оболочка не будет успевать восстанавливаться. А со временем репаративные процессы замедляются. Но если ваши близкие не пьют, но при этом много и давно курят, то это тоже повод провериться.
Порядка 15-20% заболевших раком желудка — пациенты до 50 лет. Есть совсем ранние формы — у тридцатилетних. Достаточно часто молодой возраст сочетается с агрессивными формами рака. Как правило, выживаемость у таких больных достаточно низкая. Это преимущественно недифференцированные формы рака — перстневидноклеточные, диффузные и так далее.
Если опухоль агрессивна, то на любой стадии может произойти ее генерализация. В таких случаях прогноз практически всегда неблагоприятен. Если говорить о нашей диагностике, она, как правило, запаздывает.
Большинство больных приходит к нам на третьей стадии заболевания (когда лимфоузлы уже поражены опухолевыми клетками). Это касается как рака пищевода, так и рака желудка. Это происходит потому, что в России нет государственных программ скрининга, которые позволяли бы выявлять ранние формы рака среди большого количества обследуемых. У нас же, пока не начнутся боли, никто не идет к врачам.
Если у человека возникают симптомы: боль, стеноз выходного отдела желудка, дисфагия, кровотечение из опухоли, это означает, что болезнь уже запущена и опухоль большая. Рак пищевода проявляет себя тогда, когда опухоль перекрывает просвет и человек не в состоянии проглатывать пищу. С вероятностью 95% можно говорить о том, что болезнь запущена и третья стадия как минимум. Однако бывает и вторая стадия — когда опухоль большая, но поражения лимфоузлов нет, но это происходит довольно редко. 60% больных приходят к нам уже на третьей стадии. Ранние формы рака можно выявить в тот момент, когда человека ничего не беспокоит.
ФГДС (фиброэзофагогастродуоденоскопия) — исследование, на которое нужно получить направление при любом желудочном дискомфорте. Именно ФГДС — первая ступень в диагностике рака желудка или пищевода после того, как выявлена принадлежность к группам риска. Опытный специалист не будет смотреть желудок не осмотрев пищевод. Пищевод смотрится как при вхождении, так и на «обратной дороге».
При любых проявлениях желудочного дискомфорта или боли. Это относится абсолютно к любому возрасту, ждать сорока лет не нужно.
Вы приходите с определенной жалобой к терапевту и пожеланием выполнить ФГДС. Грамотный доктор не будет настаивать на том, чтобы была проведена просто тест-терапия, без визуального и морфологического подтверждения.
Желудочный дискомфорт четко связан с приемом пищи. Это тяжесть в желудке, тощаковые боли. Если на ФГДС ничего не находится, значит проблема не с желудком, и следует сделать УЗИ.
Настаивать. Нужно понимать, что людей, которые делают эндоскопию профессионально, меньше, чем необходимо. Понять это, пока вы не придете в клинику, невозможно.
Нет, слизистая оболочка желудка не имеет болевых рецепторов.
Гастрит с обсеменением helicobacter pylory входит в группу риска, также как и атрофический гастрит. Диагностировать это можно с помощью правильно выполненной гастроскопии. Необходимо делать во время ФГДС множественную биопсию, потому что диагноз «гастрит» ставится только на основании морфологического исследования. Если вам выполнили ФГДС, не взяв биопсию и сказали, что у вас гастрит — уходите от такого доктора. На приеме для этого необходимо просто спросить у эндоскописта, будет ли он делать вам биопсию. Множественная биопсия сейчас входит в официальные стандарты гастроэнтерологии. Кроме этого, нужно провести тест на обсеменение helicobacter pylory либо наиболее точный уразный тест. Вы дышите в трубочку, а прибор регистрирует уровень вырабатываемого бактерией фермента уразы.
Правильная ФГДС делается за 20 минут в несколько этапов, обязательными являются хромогастроскопия, биопсия, инверсия и осмотр в специальном спектре (например NBI). Необходимо использование красителя метиленового синего для окрашивания стенок. Именно с этим красителем можно выявить ранние формы заболевания. Через инструментальный канал эндоскопа при каждой ФГДС обязательно вводят краситель (хромогастроскопия). Также при проведении процедуры эндоскопист должен сделать инверсию — развернуть эндоскоп в сторону кардии. Также есть различные варианты другого спектра, когда рассматриваются слизистые, строение сосудистого рисунка.
Да, сейчас часто делают ФГДС в дневных стационарах поликлиник с использованием наркоза — седации. Человек спит, но аппарата искусственной вентиляции легких не требуется.
Прежде чем дать человеку прогноз, нам необходимо его правильно отстадировать. Во-первых, мы определяем степень прорастания опухоли в стенку органа, во-вторых, выясняем, есть ли поражение лимфоузлов, в-третьих — наличие отдаленных метастазов.
Первая стадия при раке желудка: 85% вероятности прожить 5 лет и более. Надо понимать, что 15% заболевших начнут прогрессировать и с первой стадией. 100% выживаемости нельзя достичь, несмотря на раннюю стадию. Вторая стадия — показатель пятилетней выживаемости от 55 до 60%. Третья стадия — 35-40%. То есть, почти 70% больных погибают при третьей стадии, не перешагнув пятилетний рубеж. Большинство из этих 70% на третьей стадии умирают в первые два года болезни.
Рак пищевода протекает, как правило, агрессивнее рака желудка. Самый распространенный вид рака для пищевода — плоскоклеточный. Он и наиболее агрессивный.Так, 80% с первой стадией переживут пятилетний рубеж. Из тех, кому диагностировали заболевание на второй стадии, при существующих видах лечения выживает только половина. Менее 20% при третьей стадии рака пищевода смогут пережить пятилетний рубеж. Самое важное, что пока опухоль не перекроет просвет, каких-либо симптомов и затруднений не будет.
В целом, да. Основная профилактика очень проста: нужно не курить, не употреблять спиртное, особенно крепкие напитки, а также избегать очень горячих жидкостей. Однако даже если убрать все факторы, никто не даст гарантии, что этих двух заболеваний удастся избежать.
Вариант первый (опухоль не найдена). Цепочка терапевт — эндоскопист (ФГДС) — гастроэнтеролог — лечение. Прийти к терапевту, описать свои опасения и жалобы, взять направление на ФГДС. На приеме у эндоскописта получаете рекомендацию вернуться за результатами гистологического исследования (от 10 дней до трех недель). Результаты необходимо показать гастроэнтерологу. Гастроэнтеролог проводит лечение в случае, если оно требуется.
Вариант второй (опухоль есть). Цепочка терапевт — эндоскопист (по направлению) — гистологическое исследование (две недели в среднем) — онкологическая поликлиника (стадирование рака) — КТ, УЗИ, колоноскопия (по направлению, около трех недель) — онкодиспансер (запись на две недели вперед).
Вы получили направление на эндоскопию. Эндоскопист подозревает по явным признакам, что рак есть. Его задача — взять информативную биопсию из разных участков пораженной слизистой и отправить гистологию в нормальную лабораторию. Очень много зависит от того, как качественно сделают гистологическое исследование. После того, как диагноз «рак» подтверждается в лаборатории, необходимо идти в онкологическую поликлинику. Там заболевание должны адекватно стадировать, проведя ряд диагностических тестов. Обязательно назначаются компьютерная томография грудной клетки и брюшной полости (ожидание 1-1,5 месяца), УЗИ малого таза, обязательным исследованием также является колоноскопия. Дело в том, что у 5% больных на фоне рака желудка может быть рак кишечника (колоректальный рак). Как только на руках есть все данные, можно идти к онкологу в онкодиспансер или в федеральный центр. На основании этих данных определяется дальнейшая тактика лечения. На комиссии решается, какое лечение пациенту необходимо и куда его необходимо госпитализировать.
От похода к терапевту до получения всех результатов, проводимых по ОМС, проходит в среднем около двух месяцев. Нужно понимать, что эти два месяца на течение опухоли не повлияют.
По новому приказу Минздрава мы не можем проводить этап диагностики дольше 30 дней. Это абсолютно утопическая цифра. Во-первых, большой поток людей. Во-вторых, нехватка грамотных специалистов — тех же морфологов, чтобы был поставлен диагноз. Так что ожидание результатов гистологического исследования длиной в две-три недели — это, увы, реальный срок.
Проблем много. Иногда люди приходят после всех тестов в онкодиспансер, его результаты пересматривают, но процентах в тридцати исследования на дисках оказываются неинформативными. Может быть недостаточно контраста, или его вообще нет. Почему это происходит — объяснить сложно. Нюансов много, и срыв может произойти на любом этапе. Иногда он бывает и счастливым — при повторном исследовании оказывается, что рака нет, но это бывает редко.
Основным методом лечения для рака желудка является хирургический. Это удаление больного органа, лимфодиссекция — удаление лимфоколлекторов вокруг желудка (области, которая потенциально обладает метастазами). Удаление лимфоузлов — диагностическая процедура, позволяющая дополнительно уточнить стадию заболевания. Для этого необходимо изучить не менее 22 лимфоузлов. Отсутствие метастазов в лимфоузлах — благоприятная ситуация, означает вторую стадию и увеличенные шансы для больного.
Да, есть. Малоинвазивные вмешательства возможны при ранних формах рака. Когда опухоль находится в пределах слизистой оболочки желудка, можно даже оставить орган полностью, оперировав его эндоскопически (эндоскопическая диссекция в подслизистом слое). Удаляется пораженный участок слизистой при отступлением от края опухоли. Если операция проходит успешно и по данным морфологического исследования, опухоль действительно не проросла сквозь слизистую, то больному больше не требуется дополнительного лечения. Однако не каждый онкоцентр обладает возможностями таких высокотехнологичных операций. Они делаются за счет федеральной квоты по показаниям.
Если рак проник сквозь слизистую оболочку и прорастет в подслизистый слой, и объем опухоли небольшой, есть возможность сделать лапароскопию. Всего делается пять небольших разрезов и пятисантиметровый небольшой разрез над пупком, чтобы «вытащить» удаленный материал.
Химиотерапия, как правило, используется на четвертой стадии либо на третьей стадии — для борьбы с отдаленными метастазами или уменьшения вероятности прогрессирования опухоли.
Метастазирование обычно происходит в печень, брюшину, параортальные лимфоузлы. При отдаленных метастазах оперировать желудок не следует. Прогноз для больного это не улучшит, а качество жизни ухудшит катастрофически.
Если опухоль расположена на границе желудка с двенадцатиперстной кишкой, если есть возможность отступить от края опухоли необходимое расстояние, то можно сохранить желудок частично. Однако объем лимфоаденэктомии остается прежним.
Если есть массивное поражение лимфоузлов или опухоль вышла за стенки желудка, идти на операцию сразу нельзя. Больному должны предложить вариант дооперационной (неоадъювантной) химиотерапии. При этом нужно понимать, что иногда даже ранние формы рака могут быть диссеминированными — распространенными по брюшине. Чтобы это понять при осмотре брюшной полости, делается смыв с брюшины, оправляется цитологу на исследование. Если находятся свободные опухолевые клетки, то человек попадает в ту же группу, что и пациенты с отдаленными метастазами. Эта группа пациентов вместе с обладателями продвинутых форм рака желудка рассматриваются как кандидаты для неоадъювантной формы химиотерапии.
Во время операции кишку сшивают с пищеводом. Человек продолжает есть естественным путем, однако диета назначается пожизненная с заместительной ферментной терапией. Нужно чаще есть, однако качество жизни будет нормальным.
Если не удалить больной желудок, вероятность того, что вы переживет пятилетний рубеж — 5-7%. Если его удалить, то даже на третьей стадии пережить пятилетний рубеж можно с вероятностью 50%. В нормальных специализированных центрах частота осложнений на превышает 12-15%, а летальность после таких операций не превышает 2-3%. Так что, если лечиться, шансов выжить спустя пять лет в 10 раз больше, чем если прийти, развести руками и не делать ничего.
источник
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами — антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR — протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны — эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu — это рецептор эпидермального фактора роста раковой клетки. Это — ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.
Ki-67 — это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот — чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке — активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется — индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.
VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF — для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Иммунотерапия в онкологии появилась сравнительно недавно, но уже успела показать удивительные результаты в лечении опухолей. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету увидеть опухоль и уничтожить её. Ответственные за «видимость» опухоли белки PD-1, PDL-1 и PDL-2 в достаточном количестве присутствуют не во всех опухолях. Именно поэтому одним пациентам иммунотерапия помогает, а другим нет.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
источник
Резюме. Проведено исследование, посвященное экспрессии онкобелков при раке желудка. Работа отличается обилием цифр и сложностью их интерпретации в ряде случаев. Всего в исследование, проведенное на базе абдоминального онкохирургического отделения КУ «Одесский областной онкологический диспансер», включено 188 больных, оперированных по поводу рака желудка в период 2007–2011 гг. Во всех случаях выполнены лимфодиссекции по принципиальным соображениям — обширные профилактические биопсии визуально неизмененных лимфоузлов. Проведен многофакторный анализ зависимости экспрессии онкобелков p53, VEGFR-3, erbB2 и пролиферативной опухолевой активности Ki-67 от вовлеченности опухолевого микроциркуляторного русла (ly, V), местного роста (Т), наличия резидуальной опухолевой ткани (R), степени дифференцировки опухоли (G), степени вовлеченности регионарных лимфоузлов (N), вида микроинфильтрации (Inf α, β, Inf γ).
Исследование взаимосвязи выраженности тех или иных гистологических и иммуногистохимических (ИГХ) маркеров до сих пор носит в значительной степени умозрительный, теоретизированный характер, оставаясь «кабинетной наукой». Его клиническое значение раскрывается в основном при прогнозировании результатов химиотерапии или скрининга. Например, значимая экспрессия Her2/new — назначение трастузумаба, лапатиниба [1]; мутированный ген EGFR — эрлотиниба, гефитиниба, афатиниба; транслокации EML4-ALK — кризотиниба; транслокации BCR-ABL — иматиниба; «дикий» тип генов тирозиновых киназ K-RAS и N-RAS — предикторы эффективности терапии цетуксимабом и панитумумабом [2], серин-треониновой киназы B-RAFwt — лечения вемурафенибом; наличие мутации генов CDH-1, BRCA-1, MLH1 [3], MLH3, MSH-2, MSH-6, PMS-1 — аутосомно-доминантное наследование предрасположенности к раннему раку желудка (РЖ) и т.д. В процессе разработки выявляют новые терапевтические «мишени»: ингибиторы ЦОГ-2 (есть сообщения об эффективности ацетилсалициловой кислоты при мутированном PIK3CA [4]), металлопротеиназы [5], теломераза, фарнезилтрансфераза [6].
ЦОГ-2 (СОХ-2), наряду с рецептором к фактору роста эндотелия сосудов (vascular endothelial growth factor receptor — VEGFR)-3 (VEGF-C), считается фактором прогноза при РЖ [7]. Имеется целый ряд сообщений о прогностической роли маркера Her2 при РЖ [8–11]. Экспрессия ERCC1 упоминается как предиктор чувствительности к оксалиплатину [12] при РЖ.
Уровень информационной РНК (mRNA — messenger RNA) гена BRCA-1 при РЖ в клинических исследованиях имел негативную корреляцию по отношению к чувствительности РЖ к цисплатину и положительную — к таксанам. В литературе описан случай успешного излечения доцетакселом BRCA-1+ метастатического РЖ с поражением печени [13] (рис. 1).
J.G. Kim [14] описывает следующие молекулы-мишени, актуальные при распространенном РЖ (2013 г.):
1. Моноклональные антитела к EGFR (цетуксимаб/панитумумаб).
2. Ингибиторы тирозиновой киназы EGFR (эрлотиниб/гефитиниб).
3. Моноклональные антитела к рецептору Anti-Her2 mAbs (трастузумаб).
4. Ингибиторы тирозиновой киназы Her2 TKI (лапатиниб).
5. Моноклональные антитела к фактору роста Anti-VEGF (бевацизумаб).
6. Моноклональные антитела к рецептору Anti-VEGFR (рамуцирумаб).
7. Ингибиторы тирозиновой киназы VEGFR (сунитиниб/сорафениб/седираниб/апатиниб).
8. Эверолимус — ингибитор mTOR (mammalian target of rapamycin), Akt pathway.
9. Онартузумаб — моноклональные антитела к рецептору фактора роста гепатоцитов (hepatocyte growth factor receptor — HGFR), кодируемому онкогеном c-Met. И некоторые другие молекулы, еще находящиеся на этапе клинических испытаний.
Продолжается мультицентровое исследование KEYNOTE-012 (1b фаза), посвященное перспективности иммунотерапии пембролизумабом у больных распространенным PD-L1+ РЖ [15].
Генетическое тестирование для индивидуализации программы скрининга здоровых людей (достаточно дорогостоящая процедура) делается всего один раз за весь период жизни (полноэкзомное секвенирование). Популяция опухолевых клеток неоднородна, имеются субпопуляции клеток в различных стадиях клеточного цикла, с различной чувствительностью к химиотерапевтическим режимам [16]. Различия между хемонаивными и предлеченными видами рака (формирование лекарственной устойчивости) мотивируют к получению повторных биопсий и стимулируют постепенное внедрение ИГХ исследования не только удаленных операционных препаратов, но и биоптатов опухолей [17], в том числе при РЖ.
Введение в клиническую практику молекулярной классификации РЖ [18], наподобие той, которая ныне широко используется при раке грудной железы, делает это направление поиска актуальным.
Невозможно в рамках одного исследования рассмотреть все белковые молекулы, экспрессируемые при РЖ [19, 20]. С учетом новой генетической классификации избраны четыре наиболее известных онкобелка, анализ которых максимально доступен.
Генетическая классификация РЖ включает четыре разновидности опухолей [21, 22]:
- генетически стабильный РЖ;
- РЖ с микросателлитной нестабильностью (microsatellite instability — MSI);
- хромосомно нестабильный (chromosome instable — CIN) РЖ;
- вирус Эпштейна — Барр (EBV)-ассоциированный РЖ.
Например, при так называемом CIN РЖ отмечают амплификацию гена TP53 (короткое плечо 17-й хромосомы) и онкогена Her2/new (длинное плечо 17-й хромосомы) — соответственно, при ИГХ исследовании будут экспрессированы белки p53 и erbB2 (CD340) (рис. 2 и 3). CIN РЖ составляет примерно 50% всех злокачественных эпителиальных опухолей желудка, поэтому исследование этих двух маркеров представлялось эффективным.
Три другие генетические формы РЖ представлены опухолями с MSI [3, 23, 24]; генетически стабильным раком («рак Наполеона» [25] — CDH-1-индуцированный, белковый продукт E-кадгерин), или, как его еще называют, кадгериновым РЖ; и EBV-индуцированным РЖ [22, 24, 26, 27], в котором выявляют экспрессию гена из другого сигнального каскада эпидермального рецептора EGFR — PI3K или PIK3CA — фосфоинозитол-3-киназы.
Наиболее часто отмечаемой мутацией при РЖ с MSI является так называемое умолкание (silencing) главного гена репарации ДНК — MLH1. Выключение других генов репарации — MLH3, MSH2, MSH3, MSH6, PMS1, PMS2 (хотя все гены-супрессоры считаются генами репарации, например BRCA) — фиксируют реже.
При CIN чаще развивается интестинальная форма РЖ по классификации Лорена, при генетически стабильном кадгериновом варианте — диффузный тип РЖ. Считается, что именно из-за дефицита или дефектности «межклеточного цемента» Е-кадгерина при диффузном РЖ раньше наступает гематогенная диссеминация. РЖ с MSI связан с гиперметилированием [24, 28] наиболее активных участков ДНК — CpG-островков (участков, где цитозин предшествует гуанину). Имеются отдельные сообщения о большей чувствительности этой генетической категории к химиотерапии иринотеканом. EBV-ассоциированный рак наиболее часто поражает антральный отдел желудка.
Генетический анализ MSI РЖ является единственным, который, как представляется, может быть использован в качестве хирургического фактора прогноза, так как классическая химиотерапия, особенно у пациентов пожилого возраста, в случае MSI не перспективна [29]. Данный вид опухолей проявляет выраженную локальную иммуносупрессивную активность [30, 31]. Поэтому, как и при EBV-ассоциированном РЖ, в лечении пациентов с РЖ с MSI считается оправданным назначение новых иммунологических препаратов (PD-L1/PD-L2: ипилимумаб, ниволумаб, пембролизумаб) [32].
Уже доступны моноклональные антитела для более широкого исследования MSI при РЖ [33]:
- Mismatch Repair Protein (MLH1) — антитела ES05;
- Mismatch Repair Protein (MSH2) — антитела 25D12;
- Mismatch Repair Protein (MSH6) — антитела PU29;
- Mismatch Repair Protein (PMS2) — антитела M0R4G.
В частности, E.N. Imyanitov [29] следующим образом комментирует важность анализа MSI для химиотерапии и его особенную значимость для хирургической онкологии:
1. Большинство карцином с MSI (колоректальный рак [КРР] с MSI-H [H — high — высокий уровень нестабильности], РЖ, рак эндометрия входят в синдром Линча) являются спорадическими [34, 35].
2. Наследственный КРР поражает относительно молодых субъектов, спорадические же случаи MSI-H накапливаются у пациентов пожилого возраста. Наследственный рак возникает из-за мутационной инактивации MLH1, MSH2, PMS2 или MSH6; спорадические опухоли с MSI-H обычно возникают в результате метилирования промотора гена MLH1, который может быть следствием широко распространенных нарушений эпигенетической регуляции («methylator-фенотипа»). По неизвестной причине, BRAF мутации происходят только в спорадических, но не в наследственных опухолях с MSI-H [35, 36].
3. Хотя опухоли с MSI-H низкодифференцированы, они, как правило, характеризуются благоприятным течением. В частности, демонстрируют относительно низкую частоту рецидивов после хирургического вмешательства [37, 38]; в соответствии с этим, только 4% местно-распространенного КРР имеют MSI-H фенотип [39, 40]. В результате, случаи MSI-H исключительно редки в исследованиях, связанных с метастатическим раком, поэтому прямая клиническая оценка их химиочувствительности является весьма сложной. Большинство ответов на лечение для случаев MSI-H являются производными от адъювантной терапии, где надежная дифференцировка между прогнозируемой и прогностической значимостью данного параметра не всегда возможна.
4. Чувствительность MMR-дефицитных клеток к различным противоопухолевым препаратам является предметом многочисленных лабораторных исследований. Важно иметь в виду, что естественные раковые клетки с MSI-H имеют исключительно высокую частоту мутаций и, следовательно, накапливается значительное количество «вторичных» генетических поражений; в зависимости от спектра генов-мишеней эти вторичные повреждения могут существенно изменить ответ на терапию [39, 41]. Кроме того, инактивация разных MMR генов, например MSH2 и MLH1, может привести к различным моделям химиочувствительности [42].
5. Большинство доклинических исследований указывает на резистентность MSI-H-клеток к 5-флуороурацилу (5-FU) [39, 43]. MSI-Н-статус также ассоциируется с низкой чувствительностью к цисплатину, карбоплатину, 6-тиогуанину, однако эти соединения в любом случае не применяют для лечения КРР [39, 42–44]. В то время как MMR-дефицитность связана с нечувствительностью к цисплатину [45–47] и карбоплатину, а также препарату третьего поколения оксалиплатину. Результаты нескольких исследований показали специфическую чувствительность MSI-H клеток к иринотекану; продемонстрировано, что ответ на топоизомеразу I может быть опосредован наличием вторичных мутаций в генах MRE11 и Rad50 [44]. Метотрексат является селективным ингибитором MSH2-дефицитных клеток; MLH1-дефектные клетки не показали специфической чувствительности к этому соединению [42, 48].
6. Существует консенсус в литературе, что у пациентов с MSI-H не применяют 5-флуороурацил в основе адъювантной терапии [49]. В некоторых сообщениях предполагают даже худший результат по сравнению с пролеченными пациентами; полихимиотерапия может поставить под угрозу естественный иммунный ответ на MSI-H клеток [39, 50, 51]. Адъювантная химиотерапия пациентов с наследственным КРР также продемонстрировала отсутствие пользы от 5-флуороурацила [52]. С учетом улучшенного прогноза течения опухолей с MSI-H, по общему мнению, адъювантная терапия должна быть опущена при КРР с MSI-H [39, 53, 54]. Комбинация 5-флуороурацила с оксалиплатином была недавно включена в руководящие принципы для адъювантной терапии III стадии КРР; поскольку только несколько пациентов с MSI-H в настоящее время доступны, то пока невозможно сделать выводы из существующей базы данных [55, 56]. Опыты с иринотеканом не квалифицировали этот препарат для использования в адъювантной терапии; однако анализ подгруппы пациентов с MSI-H показал, что эта специфическая категория больных может получить выгоду от добавления иринотекана к флуороурацилу и лейковорину [57].
7. Данные о применении химиотерапии при распространенном MSI-H раке ограничены несколькими небольшими исследованиями. J.T. Liang и соавторы [58] и W.M. Brueckl и соавторы [59] сообщили об улучшении ответа MSI-КРР на 5-флуороурацил. Существует противоречивая информация относительно роли статуса MSI в определении ответа на комбинацию терапии 5-флуороурацилом и оксалиплатином [60–62]. Несколько докладов продемонстрировали большую частоту ответа MSI-H для иринотекана [63–65], хотя это утверждение было оспорено в недавнем исследованием J.E. Kim и соавторов [66].
Так, рак с MSI-H соответствует достаточно частой клинической ситуации, когда при значительных размерах опухоли нет отдаленных метастазов (в противоположность тому, когда метастазы множественные, а первичной опухоли не удается найти вообще). При этом гистологически такой рак имеет наихудшие показатели агрессивности. Такие опухоли низкодифференцированные, характеризуются микроскопической опухолевой инфильтрацией (Inf γ), прорастают в окружающие структуры и могут иметь множественные метастазы в регионарных лимфоузлах. Однако после их удаления, как уже неоднократно сказано, процент рецидива достаточно низкий.
Еще одной, выявленной недавно, генетической особенностью РЖ является принадлежность части случаев (не более 5%) к так называемому синдрому Анжелины Джоли [67]: наличие наследственно передаваемой мутации одного из аллелей гена BRCA-1. Другими заболеваниями, относящимися к этому синдрому, являются рак грудной железы и рак яичника. Делеция оставшегося здорового аллеля (LOH — loss of heterosigosity — потеря гетерозиготности) ведет ко второму виду наследственного РЖ (первый — CDH1-ассоциированный). Так как все наследственные виды рака принадлежат к доминантно наследуемым, данная мутация проявляется в относительно раннем возрасте (до 50 лет).
Также, как и для BRCA-ассоциированного рака грудной железы, наличие амплификации этого гена при РЖ означает резистентность к химиотерапевтическим режимам на основе таксанов [68] и антрациклинов и чувствительность к митомицину С [69], цисплатину и PARP-ингибиторам (ингибиторы поли-АДФ-рибоза-полимеразы — парибы [70]), перспективность иммунотерапии [71]. Her2/neu позиционируется не только как фактор чувствительности к терапии трастузумабом, но и эпирубицином, доксорубицином [72], липосомальным доксорубицином.
Все вышесказанное свидетельствует о перспективности этого направления для анализа даже не в лабораторных, а полевых, клинических условиях.
ИГХ исследования выполняли для оценки степени экспрессии белковых продуктов p53, VEGFR-3, Ki-67 [73], Her2/new (рис. 4 и 5). Одним из самых важных фактов об экспрессии Her2/new при РЖ является более мягкий подход для признания маркера положительным по сравнению с раком грудной железы [74]. В нашем исследовании маркер «++» считался положительным. В то время как для рака грудной железы необходимым является критерий «+++».
источник