Раздел находится в стадии наполнения
Внедрение в клиническую практику молекулярно-генетических анализов позволило медицине добиться больших успехов в диагностике и лечении онкологии. Современные методы создают дополнительные возможности для постановки точного диагноза и определения предрасположенности, прогноза, а также для индивидуального подхода к терапии рака, основанного на генетическом анализе опухолевых клеток.
Тесты на рак выполняются в следующих ситуациях:
оценка предрасположенности к наследственным формам злокачественных новообразований;
уточнение диагноза в сомнительных случаях;
определение эффективности химиотерапии.
Данные виды исследований выполняются на современном оборудовании по доступной стоимости в лаборатории «Аллель» в Москве.
В результате теста можно выявить мутации в генах, указывающие на наследственную предрасположенность к онкологии. Такое исследование обязательно, если у родственников первой степени родства есть или было заболевание в молодом возрасте (обычно до 40 лет). Часто встречаются 3 наследственных формы онкологии:
Эти болезни имеют характерные генетические повреждения, которые указывают на наличие предрасположенности. Однако все больше появляется данных о роли наследственности в развитии других типов онкологии (желудка, легких, простаты и др).
Выявление предрасположенности в данном случае позволяет поставить пациента на диспансерное наблюдение и своевременно удалить опухоль на ранних стадиях в случае ее возникновения.
Генетические анализы также важны и при уже развившемся раке. В данном случае исследуя ДНК опухолевых клеток, можно подобрать эффективную терапию, а также спрогнозировать её эффективность. Например, при наличии большого количества копий гена Her-2/neu в опухолевой ткани рака молочной железы или желудка показана терапия препаратом «Трастузумаб», а препарат «Цетуксимаб» оказывает эффект лишь при отсутствии мутаций в генах K-ras и N-ras в клетках рака толстой кишки.
В данном случае генетический анализ позволяет определить эффективный вид терапии заболевания.
Молекулярные тесты в онкологии используются для постановки верного диагноза. Некоторые злокачественные опухоли имеют характерные генетические поломки.
Транслокация t(8;14)(q24;q32), t(8;22)(q24;q11) и t(2;8)(p12;q24)
Лимфома клеток мантийной зоны
Филадельфийская хромосома – транслокация t(9;22)(q34;q11)
Оцениваются гены RREB1(6p25), MYB(6q23), CCND1(11q13), CEP6
Результаты содержат информацию о состоянии ДНК пациента, которая может указывать на предрасположенность к отдельным болезням или чувствительность к определенным видам лечения. Как правило, в описании генетического анализа указываются мутации, на которые выполнялся тест, а их значимость в конкретной клинической ситуации определяет врач. Крайне важно, чтобы лечащий доктор владел всей необходимой информацией о возможностях молекулярной диагностики в онкологии.
Как проводится генетический анализ?
Для того чтобы сделать генетический анализ на наличие предрасположенности к наследственным формам рака, необходима цельная кровь пациента. Противопоказаний к тесту нет, специальная подготовка не требуется.
Для выполнения генетического анализа уже существующей опухоли потребуются сами опухолевые клетки. Стоит отметить, что уже развиваются диагностические методики выявления циркулирующей ДНК клеток рака в крови.
Существуют различные методы обнаружения мутаций в генах. Чаще всего используются:
FISH-анализ – флуоресцентная гибридизация in situ. Позволяет анализировать крупные участки ДНК (транслокации, амплификации, дупликации, инверсии) хромосом.
Полимеразная цепная реакция (ПЦР). Помогает изучить лишь небольшие фрагменты ДНК, однако имеет низкую цену и высокую точность.
Секвенирование. Метод позволяет полностью расшифровать последовательность генов и найти все существующие мутации.
Тест на предрасположенность к наследственному раку проходят однажды, поскольку последовательность ДНК не изменяется. Мутировать могут только отдельные клетки.
При наличии опухоли у пациента, ее ДНК может исследоваться несколько раз (например, до и после химиотерапии), т. к. опухолевые клетки обладают высокой способностью к мутации.
Точность генетического анализа ДНК на онкологию в лаборатории «Аллель» в Москве составляет 99–100 %. Мы используем современные методики, доказавшие свою эффективность в научных исследованиях, при относительно невысокой стоимости исследований.
На долю наследственных форм рака по различным данным приходится около 5–7 % всех случаев злокачественных новообразований. Главным показанием к определению предрасположенности является наличие онкологии у родственников первой степени родства в молодом возрасте.
Показанием к исследованию ДНК уже имеющихся опухолевых клеток является само наличие опухоли. Перед проведением генетического анализа необходимо проконсультироваться с врачом, чтобы определить, какие тесты необходимы и как они могут повлиять на терапевтические мероприятия и прогноз.
Современные методики генетического анализа позволяют выявить предрасположенность, а также повысить эффективность профилактики и лечения рака. Персонализированный подход сегодня используется в каждой специализированной клинике Москвы, что позволяет подбирать именно те схемы лечения, которые окажут максимально возможный эффект у конкретного пациента. Это снижает цену и повышает эффективность лечения болезни.
источник
Заболевание, носящее название рак легких, считается одним из наиболее опаснейших. И дело даже не в том, что жизнь пациента может угаснуть в считанные месяцы. А кроме этого, быстро развивающиеся злокачественные клетки переносятся с кровяным потоком к другим органам, тем самым поражая практически весь организм.
Поэтому любому пациенту следует запомнить, что если была диагностирована пневмония и после курсового лечения состояние стабилизировалось, но в течение месяца появились снова те же симптомы заболевания, то необходимо настаивать на проведении дополнительных исследований, А не стараться излечить недуг тем же самым путем, с учетом того, что прописанный антибиотик, оказавший эффект при лечении заболевания может быть повторно использован, только по истечении 3 календарных месяцев.
В противном случае вырабатывается устойчивый иммунитет к данному препарату и в последствии при его использовании можно не получить ни каких результатов.
Для того чтобы выявить злокачественные новообразования в легких на самых ранних стадиях, следует подключить все известные на сегодняшний момент способы выявления данного заболевания. Рассмотрим следующие:
-
Рентгенографический снимок. Это метод один из самых распространенных при ранней диагностики рака легкого. Хотелось бы отметить, что на снимке можно заметить не четкость, размытость и неоднородность контуров новообразования. Для того чтобы определить данным способом наличие раковой опухоли и поставить правильный диагноз, с момента появления данного заболевания должно пройти около 126 календарных дней.
- Магниторезонансная томография. Выявление злокачественной опухоли в тканях легких на ранних стадиях таким способом дает наиболее точную информацию о состоянии плевральной жидкости, состоянии сосудов легочных тканей и степени заражения данным процессом смежных органов.
- Исследование при помощи бронхоскопии. Данное исследование более эффективное, чем обычная рентгенография. Поскольку основывается оно на непосредственном введении специальной гибкой трубки со встроенным объективом в бронх. И таким образом обследуется бронхи при развитии раковой опухоли можно наблюдать сужение и изъявление, стенки его смещаются в сторону и поддаются деформации.
-
Еще один наиболее достоверный диагностический способ определения развития злокачественной опухоли – это исследование мокроты на цитологию . Важным условием является форма ее сбора, она производится только в моменты глубокого откашливания. В тех случаях, когда мокрота отходит скудно или вообще наличие мучительного кашля является сухим, то ее забор производится во время бронхоскопии. Данным методом обследования можно не только выявить развитие раковой опухоли, но и предсказать ее появление на несколько лет вперед, поскольку материал, предоставляемый на исследование может содержать клетки, которые склонны к мутации.
- Ранняя диагностика рака может определиться и по лабораторным исследованиям крови пациента . На развитие онкологического заболевания могут указывать следующие показатели:повышенный уровень белка, обнаружение в крови онкомаркеров – это РАЭ (злокачественные новообразования в органах дыхательных путей), NCE (развитие мелкоклеточного рака).
- Метод пункционной биопсии. Возможность его проведения основывается на близком расположении пораженного участка органа по отношению к грудной клетке. Проведение данной процедуры возможно только при одновременном проведении ультразвукового исследования либо компьютерной томографии. Взятая пункция подлежит детальному исследованию под микроскопом. При раке легких, можно определить не только этап развития поражения, но и его тип.
-
Развитие рака по периферическому типу диагностируется по несколько иным показателям:
- появление затененных участков, видимых на рентгеновском снимке, в виде овальной формы с выявленными неровными краями;
- если имеется явное поражение лимфоузлов, то на снимке будет прослеживаться дорожка, отходящая от зоны поражения к основанию легкого.
Еще одним действенным способом диагностики является обследование на рак легких при помощи ПЭТ (позитронно-эмиссионной томографии).
Данный вид обследования относится к одному из наиболее точных, то есть уверенность в постановке диагноза лежит в промежутке от 90 до 99%. Он основывается на использовании камеры специально типа и радиоактивном индикаторе, которые равномерно поступает во время проведения обследования в периферическою вену. Именно он проходит через весь обследуемый организм и способен к накоплению в очаге поражения.
Поскольку раковые клетки в несколько десятков раз активнее здоровых клеток, то именно они, в первую очередь захватят всю радиоактивную глюкозу. И в следствие этого, все опухолевые ткани становятся заметнее на позитронно-эмиссионных томографах.
Только при полном обследовании, сочетая все известные выше перечисленные методики по обнаружению рака, можно его диагностировать на ранних стадиях. Именно это позволяет человеку сохранить его жизнь и полностью избавиться от губительного недуга.
В тех случаях, когда развитие заболевания по некоторым причинам не было выявлено на ранних его стадиях, например:
-
нежелание обратиться к лечащему врачу;
- страх прохождения диагностических процедур;
- неправильное трактование клинической картины заболевания, особенно в следствие имеющейся наследственности.
Все эти факторы, к сожалению, возможны при современном темпе жизни человечества. Когда больному человеку регламентируют определенное количество времени, для посещения медицинского специалиста, а им в свою очередь отводят четкие рамки на прием одного пациента, что в среднем составляет не более 15 минут.
Нужно знать, что самые правдивые на сегодняшний момент показания дает лучевая диагностика рака легкого. Именно эта характеристика обследования способна дать все необходимые для лечащего врача показания.
И в связи с полученными данными специалист будет способен назначить оптимальный индивидуальный курс по излечению от недуга.
Кроме того, каждому пациенту следует помнить о том, когда незамедлительно стоит настаивать на обследовании, все дело в том, что диагностировать рак легких на поздних стадиях можно самостоятельно полагаясь на следующие симптомы
-
наличие частого влажного кашля с отходящей мокротой желто-зеленого цвета;
- мокрота часто наделена присутствием кровавых сгустков;
- частая утомляемость организма (даже при незначительных нагрузках);
- постоянное присутствие болевых ощущений в области грудной клетки (особенно в состоянии покоя);
- проявление одышки (даже при незначительной нагрузке на организм).
При всех проявлениях выше указанной симптоматики рак легких диагностируется с легкостью, используя один или два контрольных метода, которые были перечислены ранее.
Так же следует помнить о том, что при любом безосновательном обращении пациента прибегнуть к исследованию под названием лапароскопия специалист в праве ответить отказом.
Поскольку данный приравнивается к микрохирургии и дает показатели равные 99%. Данная диагностика является своего рода операцией, поэтому прежде чем прибегнуть к данному варианту, нужно оценить следующие показатели:
-
возраст больного;
- его реакцию на местный наркоз;
- показатели сердечно-сосудистой системы;
- данные других более безболезненных процедур по определению развития данного заболевания;
- использованная курсотерапия и ее показатели в динамике.
Безусловно, любой легочный онкологический процесс на поздних стадиях развития может диагностировать любой метод выше описанной диагностики. Но для положительного исхода развивающихся событий его следует обнаружить как можно ранее, поэтому, если пациент находится в группе риска, а именно:
- имеет наследственную предрасположенность к заболеванию;
- не отличается пассивностью к табакокурению;
- в следствие должностных обязанностей, пребывает в местах, обозначенных для курильщиков;
- страдает хронической формой бронхитов и пневмоний;
- работает с канцерогенными веществами (характерно для химиков, лаборантов и судебных медицинских экспертов).
Врачам следует обратить на них обособленное внимание, даже при незначительных проявлениях отклонений.
Важно помнить, что рак легких – это коварное заболевание, а его диагностика, особенно на ранних этапах очень затруднительна. Поэтому важное значение имеет комплексный подход к диагностике и своевременное обращение на свое здоровье.
источник
Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Каждая клетка человеческого организма содержит около 30 тысяч генов. Среди них есть те, которые контролируют рост и размножение клетки, ее продолжительность жизни, отвечают за «починку» поврежденной ДНК.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Генетические исследования в онкологии помогают решать важные задачи:
- Обнаружить наследственные мутации и оценить риск развития рака, своевременно принять профилактические меры.
- Разобраться, есть ли у человека генетические дефекты, связанные с повышенным риском онкологических заболеваний, которые он может передать своим детям.
- Составить «молекулярно-генетический портрет» опухоли и выяснить, к каким препаратам она чувствительна.
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Протоонкогены кодируют белки, активирующие деление клеток. В норме они должны «включаться» лишь в определенное время. Если в протоонкогене возникает мутация, либо он становится чрезмерно активным (например, из-за увеличения количества копий), он превращается в онкоген, и нормальная клетка становится опухолевой.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Гены-супрессоры опухолей ограничивают размножение клеток, восстанавливают поврежденную ДНК, отвечают за «смерть» отработавших своё клеток. Рак возникает из-за того, что в результате мутаций эти гены перестают справляться со своей функцией. Например, гены BRCA1 и BRCA2 отвечают за репарацию ДНК. При наследственных мутациях в них у женщин повышен риск того, что будет диагностирован рак молочной железы, яичников.
Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
- замену оснований — «букв» генетического кода;
- делеции — утрату участка хромосомы;
- инсерции — «лишние» вставки ДНК в хромосомах;
- изменение числа копий определенного гена;
- фьюжн-мутации — слияние генов, в результате которого образуется новый, гибридный ген;
- микросателлитную нестабильность;
- мутационную нагрузку опухоли.
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Если речь идет о наследственных мутациях, для анализа достаточно сдать кровь из вены. Для составления «молекулярно-генетического портрета» рака чаще всего нужен биоптат — образец ткани злокачественной опухоли. Существует и более современная методика — жидкостная биопсия, когда исследуют ДНК опухолевых клеток, циркулирующую в крови.
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь. Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
источник
Неотъемлемой частью традиционного лечения онкологии является воздействие на весь организм с помощью химиотерапевтических препаратов. Однако клинический эффект от этого лечения не всегда бывает достаточно высок. Это случается из-за сложного механизма возникновения рака и индивидуальных различий организмов пациентов, их ответа на лечение и количество осложнений. Чтобы повысить эффективность лечения в целом, в мире начали уделять все больше внимания индивидуализации лечения.
Индивидуальному подбору лечения в онкологии стали придавать большое значение вслед за развитием и внедрением в широкую клиническую практику таргетных препаратов, а генетический анализ помогает их правильно подобрать.
Индивидуальное лечение – это, прежде всего, точное лечение конкретной опухоли. Почему лечение должно проводиться точно, обьяснять нет необходимости. Поэтому получение большего количества полезных сведений об организме дает надежду на жизнь: 76% онкопациентов имеют те или иные варианты генных мутаций. Генетические анализы помогут найти эту мишень, исключить неэффективное лечение, чтобы не потерять самое продуктивное для лечения время. А также снизить физическое и психологическое бремя пациента и его родных.
Генетические анализы при онкологии — это анализы, определяющие мутации генов, устанавливающих последовательности ДНК и РНК. Каждая опухоль имеет свой индивидуальный генетический профиль. Генетический анализ помогает подобрать препараты таргетной терапии, именно те, которые подойдут конкретно для вашей формы опухоли. И помогут сделать выбор в пользу более эффективного лечения. Например, у пациентов с немелкоклеточным раком легких при наличии мутации EGFR эффективность лечения Гефитинибом составляет 71,2%, а химиотерапии Карбоплатин+Паклитаксел 47,3%. При отрицательном значении EGFR эффективность Гефитиниба 1,1%, то есть препарат не эффективен. Анализ этой мутации напрямую дает понять, какое лечение лучше предпочесть.
С помощью генетических анализов можно точно подобрать наиболее эффективный препарат, что позволит избежать потери времени и бесполезных нагрузок на организм.
- Больным на поздних стадиях онкологии.
Подбор эффективной таргетной терапии может значительно продлить жизнь пациентов с поздними стадиями, лечение которых традиционными методами уже не представляется возможным.
- Больным с редкими видами рака или же с онкологией неизвестного происхождения.
В таких случаях подбор стандартного лечения представляет большую сложность, а генетические анализы позволяют подобрать точное лечение даже без определения конкретного вида рака.
- Больным, ситуация которых не поддается лечению традиционными методами.
Это хороший выбор для пациентов, которые уже исчерпали возможности традиционного лечения, потому что генетические анализы позволяют выявить целый ряд дополнительных препаратов, которые можно применять.
- Больным с рецидивами. Генетические анализы при рецидивах рекомендуется проверять повторно, потому что генные мутации могут измениться. И тогда по новым генетическим анализам будут подбираться новые препараты таргетной терапии.
В Китае, стране с высокими показателями по заболеваемости онкологией, индивидуализация лечения получила широкое признание, а генетические анализы для подбора таргетной терапии прочно вошли в клиническую практику. В Харбине генетические анализы проводятся на базе отделения онкологии Хэйлунцзянской центральной больницы «Нункэн»
Наиболее информативно пройти полный комплекс генетических анализов – это секвентирование второго поколения, проводимое с помощью высокоплотного нейтронного потока. Технология генетических анализов второго поколения позволяет за один раз проверить 468 важных опухолевых генов, можно выявить все типы всех генетических участков, имеющих отношение к опухоли, обнаружить особые типы ее генных мутаций.
Определяются разрешенные FDA лекарственные мишени, мишени для экспериментальных лекарств.
- Гены, определяющие пути лекарств к мишеням — более 200 генов
- Гены, восстанавливающие ДНК — более 50 генов
Лучевая и химиотерапия, ингибиторы PARP, иммуная терапия
- Показательные наследственные гены — около 25 генов
Имеющие отношение к некоторым мишеням и эффективности химиотерапии.
- Другие высокочастотные мутирующие гены
Имеющие отношение к прогнозам, диагностике.
Из-за большого количества больных, китайские специалисты – онкологи традиционно пошли дальше своих коллег из других стран в развитии и применении таргетной терапии.
Исследования таргетной терапии в различных вариациях ее применения привели к интересным результатам. Разные таргетные препараты действуют на соответствующие мутации генов. Но сами генные мутации, как оказалось, далеко не так жестко привязаны к определеному виду рака.
Например, у пациента с раком печени после проведения полного комплекса генетических анализов была выявлена мутация, при которой высокий эффект показывает препарат Иресса, предназначенный для рака легкого. Лечение этого пациента препаратом для рака легкого привело к регрессу опухоли печени! Этот и другие подобные случаи придали совершенно новый смысл определению генетических мутаций.
В настоящее время проверка полного комплекса генетических анализов позволяет расширить список препаратов таргетной терапии теми лекарствами, которые изначально не предусматривались для использования, что существенно увеличивает клиническую эффективность лечения.
Генетические анализы определяются по тканям опухоли (это предпочтительнее! подойдет опухолевый материал после операции или после пункционной биопсии) или по крови (кровь из вены).
Для более точного определения генных мутаций, особенно при рецидивах, рекомендуется проводить повторную биопсию с забором нового опухолевого материала. Если биопсия практически невозможна или рискованна, тогда анализ проводят по венозной крови.
Результат готов через 7 дней. Заключение содержит не только результат, но и конкретные рекомендации с названиями подходящих препаратов.
источник
Высокая заболеваемость раком заставляет онкологов ежедневно трудиться над вопросами ранней диагностики и эффективного лечения. Генетический анализ на рак – это один из современных способов профилактики онкозаболеваний. Однако, так ли достоверно это исследование и всем ли оно должно назначаться? – вопрос, который беспокоит и ученых, и врачей, и пациентов.
Сегодня генетический анализ на рак позволяет выявить риск развития онкопатологий:
- молочной железы;
- яичников;
- шейки матки;
- простаты;
- легких;
- кишечника и толстой кишки в частности.
Также, существует генетическая диагностика на некоторые врожденные синдромы, существование которых повышает вероятность развития рака нескольких органов. Например, синдром Ли-Фраумени говорит о риске рака мозга, надпочечников, поджелудочной железы и крови, а синдром Пейтца-Егерса говорит о вероятности онкопатологий пищеварительной системы (пищевод, желудок, кишечник, печень, поджелудочная железа).
На сегодня ученые обнаружили ряд генов, изменения в которых в большинстве случаев приводят к развитию онкологии. Ежедневно в нашем организме развиваются десятки злокачественных клеток, но иммунная система, благодаря особым генам, способна с ними справиться. А при поломках в тех или иных структурах ДНК, эти гены работают неправильно, что дает шанс развитию онкологии.
Так, гены BRCA1 и BRCA2 защищают женщин от развития рака яичников и молочных желез, а мужчин – от рака предстательной железы. Поломки в этих генах напротив показывают, что имеется риск развития карциномы данной локализации. Анализ на генетическую предрасположенность к раку как раз дает информацию об изменениях в этих и других генах.
Поломки в этих генах передаются по наследству. Всем известен случай Анджелины Джоли. В ее семье был случай рака молочной железы, поэтому актриса решила пройти генетическую диагностику, которая и выявила мутации в генах BRCA1 и BRCA2. Правда, единственное, чем смогли помочь врачи в этом случае – провести операцию по удалению груди и яичников, чтобы не было точки приложения для мутировавших генов.
Противопоказаний к сдаче данного анализа не существует. Однако, не стоит его делать в качестве рутинного обследования и приравнивать к анализу крови. Ведь не известно, как результат диагностики повлияет на психологическое состояние пациента. Поэтому назначаться анализ должен только при наличии строгих к тому показаний, а именно зарегистрированных случаев рака у кровных родственников или при имеющемся у пациента предраковом состоянии (например, доброкачественное образование молочной железы).
Генетический анализ достаточно прост для пациента, так как проводится путем одного забора крови. После кровь подвергается молекулярно-генетическому исследованию, что позволяет определить мутации в генах.
В лаборатории имеется несколько реактивов, специфичных для той или иной структуры. За один забор крови может проводиться обследование на поломки в нескольких генах.
Специальной подготовки исследование не требует, однако следовать общепринятым правилам при сдаче крови не помешает. К таким требованиям относится:
- Исключение алкоголя за неделю до диагностики.
- Не курить в течение 3-5 дней перед сдачей крови.
- За 10 часов до обследования не есть.
- В течение 3-5 дней до сдачи крови придерживаться диеты с исключением жирных, острых и копченых продуктов.
Наиболее изученным является обнаружение поломок в генах BRCA1 и BRCA2. Однако, с течением времени врачи стали замечать, что годы генетического исследования значительно не повлияли на смертность женщин от рака молочной железы и яичников. Поэтому в качестве скринингового метода диагностики (проводимого каждому человеку) метод не годиться. А как обследование групп риска генетическая диагностика имеет место.
Основной акцент анализа на генетическую предрасположенность к раку состоит в том, что при поломке в определенном гене человек имеет риск развития рака или же риск передачи этого гена своим детям.
Доверять или нет полученным результатам – личное дело каждого пациента. Возможно, не следует при отрицательном результате проводить превентивное лечение (удаление органа). Однако, если поломки в генах обнаружены, то пристально следить за своим здоровьем и регулярно проводить профилактическую диагностику определенно стоит.
Чувствительность и специфичность – это понятия, которые показывают достоверность теста. Чувствительность говорит о том, сколько процентов пациентов с дефектным геном будет выявлено данным тестом. А показатель специфичности говорит о том, что с помощью данного теста будет обнаружена именно та поломка гена, которая кодирует предрасположенность к онкологии, а не к другим заболеваниям.
Определить процентные показатели для генетической диагностики рака достаточно сложно, так как исследовать нужно много случаев положительных и отрицательных результатов. Возможно, позже ученые смогут дать ответ на данный вопрос, но уже сегодня можно с точностью утверждать, что обследование имеет высокую чувствительность и специфичность, и на его результаты можно полагаться.
Полученный ответ не может на 100% уверить пациента в том, что он заболеет или не заболеет раком. Отрицательный результат генетического тестирования говорит о том, что риск развития рака не превышает средних цифр в популяции. Положительный ответ дает более точную информацию. Так, у женщин с мутациями в генах BRCA1 и BRCA2 риск карциномы груди составляет 60-90%, а карциномой яичников – 40-60%.
Данный анализ не имеет четких показаний к сдаче, будь то определенный возраст или состояние здоровья больного. Если у матери 20-ти летней девушки был обнаружен рак молочной железы, то ей не стоит ждать 10 или 20 лет чтобы обследоваться. Рекомендовано тут же пройти генетическое исследование на рак, чтобы подтвердить или исключить мутацию генов, кодирующих развитие онкопатологий.
Касательно опухолей предстательной железы, каждому мужчине после 50 лет с аденомой простаты или хроническим простатитом полезно будет провести генетическую диагностику, чтобы так же оценить риск. А вот выполнять диагностику лицам, в семье которых не было случаев злокачественной болезни, скорее всего неуместно.
Вы не уверены в правильности поставленного диагноза и назначенного Вам лечения? Ваши сомнения поможет развеять видеоконсультация специалиста мирового уровня. Это реальная возможность воспользоваться квалифицированной помощью лучших из лучших и при этом ни за что не переплачивать.
Показанием к проведению генетического анализа на рак являются случаи выявления злокачественных новообразований у кровных родственников. А назначаться обследование должно врачом-генетиком, который после и оценит результат. Возраст пациента для сдачи теста не имеет никакого значения, так как поломка в генах заложена с рождения, поэтому если в 20 лет гены BRCA1 и BRCA2 в норме, то выполнять то же исследование через 10 и более лет смысла нет.
При правильном проведении диагностики каких-либо экзогенных факторов, которые могут повлиять на результат нет. Однако, у небольшого количества пациентов в ходе обследования могут обнаруживаться генетические поломки, интерпретация которых невозможна по причине недостаточной изученности. И в сочетании неизвестных изменений с мутациями в раковых генах, могут повлиять на результат тестирования (т.е. снижается специфичность метода).
Генетический анализ на рак – это не исследование с четкими нормами, не стоит надеяться, что пациент получит на руки результат, где будет четко написано “низкий”, “средний” или “высокий” риск развития рака. Результаты обследования могут оцениваться только врачом-генетиком. На окончательный вывод влияет история семьи пациента:
- Развитие злокачественных патологий у родственников до 50 лет.
- Возникновение опухолей одной и той же локализации в нескольких поколениях.
- Повторные случаи рака у одного и того же человека.
Сегодня подобная диагностика не оплачивается страховыми компаниями и фондами, поэтому все расходы пациент вынужден брать на себя.
В Украине исследование одной мутации стоит около 250 грн. Однако, для достоверности данных должно быть исследовано несколько мутаций. Например, для рака молочной железы и яичников исследуется 7 мутаций (1750 грн.), для рака легких – 4 мутации (1000 грн.).
В России генетический анализ на рак молочной железы и яичников стоит порядка 4500 руб.
источник
Три эксперта в области онкологии о раке, наследственности и генетическом тестировании.
Онкологические заболевания ежегодно уносят миллионы жизней. Среди причин смерти рак занимает второе место после сердечно-сосудистых заболеваний, а по сопровождающему его страху — определённо первое. Такая ситуация сложилась из-за представления, что рак сложно диагностировать и практически невозможно предотвратить.
Однако каждый десятый случай заболеваемости раком — это проявление мутаций, заложенных в наших генах с самого рождения. Современная наука позволяет их отловить и значительно уменьшить риск возникновения заболевания.
Эксперты в области онкологии рассказывают, что такое рак, как сильно на нас влияет наследственность, кому показано генетическое тестирование в качестве меры профилактики и как оно может помочь, если рак уже обнаружен.
Рак — это, по сути, генетическое заболевание. Мутации, вызывающие онкологические заболевания, либо наследуются, и тогда они есть во всех клетках организма, либо появляются в какой-то ткани или конкретной клетке. Человек может унаследовать от родителей определённую мутацию в гене, который защищает от рака, или мутацию которая сама по себе может привести к раку.
Ненаследственные мутации возникают в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения. В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет. Этот путь люди проходят гораздо быстрее, если уже при рождении они унаследовали поломку. Поэтому при опухолевых синдромах рак возникает в гораздо более молодом возрасте.
Этой весной вышла замечательная статья в Science — о случайных ошибках, которые возникают в ходе удвоения молекул ДНК и являются основным источником появления онкогенных мутаций. При таких видах рака, как рак простаты, их вклад может достигать 95%.
Чаще всего причиной возникновения рака являются именно ненаследственные мутации: когда никаких генетических поломок человек не унаследовал, но в течение жизни в клетках накапливаются ошибки, которые рано или поздно приводят к возникновению опухоли. Дальнейшее накопление этих поломок уже внутри опухоли может сделать её более злокачественной или привести к возникновению новых свойств.
Несмотря на то, что в большинстве случаев онкологические заболевания возникают из-за случайных мутаций, надо очень серьёзно относиться к наследственному фактору. Если человек знает об имеющихся у него унаследованных мутациях, он сможет предотвратить развитие конкретного заболевания, риск возникновения которого у него очень велик.
Есть опухоли с ярко выраженным наследственным фактором. Это, например, рак молочной железы и рак яичников. До 10% случаев заболеваемости этими видами рака связаны с мутациями в генах BRCA1 и BRCA2. Самый распространенный среди нашего мужского населения вид рака — рак лёгкого — в основной массе вызывается внешними факторами, а конкретнее — курением. Но если предположить, что внешние причины исчезли, то роль наследственности стала бы примерно такой же, как и у рака молочной железы. То есть, в относительном соотношении для рака лёгкого наследственные мутации видны довольно слабо, но в абсолютных числах это всё же вполне существенно.
Кроме того, наследственный компонент довольно значительно проявляет себя в раке желудка и поджелудочной железы, колоректальном раке, опухолях головного мозга.
Большая часть онкологических заболеваний возникает за счёт сочетания случайных событий на клеточном уровне и внешних факторов. Однако в 5-10% случаев предопределяющую роль в возникновении рака играет наследственность.
Представим себе, что одна из онкогенных мутаций появилась в половой клетке, которой повезло стать человеком. Каждая из примерно 40 триллионов клеток этого человека (а также его потомков) будет содержать мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой, а риск заболеть определённым видом рака у носителя мутации будет существенно выше.
Повышенный риск развития рака передаётся из поколения в поколение вместе с мутацией и называется наследственным опухолевым синдромом. Опухолевые синдромы встречаются достаточно часто — у 2-4% людей, и вызывают 5-10% случаев рака.
Благодаря Анджелине Джоли самым известным опухолевым синдромом стал наследственный рак молочной железы и яичников, который вызывается мутациями в генах BRCA1 и BRCA2. У женщин с этим синдромом риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания гораздо ниже — 5,6%. Увеличивается вероятность развития рака и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин еще и предстательной железе.
Наследственные формы есть практически у любого онкологического заболевания. Известны опухолевые синдромы, которые вызывают рак желудка, кишечника, мозга, кожи, щитовидной железы, матки и другие, менее распространённые типы опухолей.
Носительство синдрома можно определить с помощью генетического теста, а на то, что вам стоит сдать тест, укажут следующие особенности семейной истории.
Несколько случаев одного вида рака в семье;
Заболевания в раннем для данного показания возрасте (для большинства показаний – раньше 50 лет);
Единичный случай определенного вида рака (например, рак яичников);
Рак в каждом из парных органов;
Больше одного типа рака у родственника.
Если для вашей семьи характерно что-либо из вышеперечисленного, вам следует проконсультироваться у врача-генетика, который определит, есть ли медицинские показания для того, чтобы сдавать генетический тест. Носителям наследственных опухолевых синдромов следует проходить тщательный скрининг на онкологические заболевания для того, чтобы обнаружить рак на ранней стадии. А в некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Несмотря на то, что наследственные опухолевые синдромы встречаются очень часто, западные национальные системы здравоохранения пока не ввели генетическое тестирование на носительство мутаций в широкую практику. Тесты рекомендуется сдавать лишь при наличии определённой семейной истории, указывающей на определённый синдром, и только в том случае, если известно, что тестирование может принести человеку пользу.
К сожалению, такой консервативный подход пропускает множество носителей синдромов: слишком мало людей и врачей подозревает о существовании наследственных форм рака; высокий риск заболевания далеко не всегда проявляется в семейной истории; многие пациенты не знают о заболеваниях своих родственников, даже когда есть, кого спросить.
Причём право судить о том, что такое польза, что такое вред, и как они соотносятся друг с другом, врачи оставляют исключительно себе. Медицинское знание — такое же вмешательство в мирскую жизнь, как таблетки и операции, и поэтому меру знания должны определять профессионалы в светлых одеждах, а то как бы чего не вышло.
Я, как и мои коллеги, считаю, что право на знание о собственном здоровье принадлежит людям, а не врачебному сообществу. Мы делаем генетический тест на наследственные опухолевые синдромы, чтобы те, кто хочет узнать о своих рисках развития рака, могли реализовать это право, и взять на себя ответственность за собственную жизнь и здоровье.
В процессе развития рака клетки изменяются и теряют свой первоначальный генетический «вид», унаследованный от родителей. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Чтобы узнать слабые места опухоли, нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
Нестабильность генома позволяет опухоли копить генетические нарушения, которые могут быть выгодными для самой опухоли. К ним относятся мутации в онкогенах — генах, которые регулируют деление клеток. Такие мутации могут многократно повышать активность белков, делать их нечувствительными к тормозящим сигналам или вызывать повышенную выработку ферментов. Это приводит к неконтролируемому делению клеток, а впоследствии и к метастазированию.
Некоторые мутации имеют известные эффекты: мы знаем, как именно они меняют структуру белков. Это даёт возможность разработать лекарственные молекулы, которые будут действовать только на опухолевые клетки, и при этом не будут уничтожать нормальные клетки организма. Такие препараты называют таргетными. Чтобы современная таргетная терапия работала, нужно до назначения лечения знать, какие мутации есть в опухоли.
Эти мутации могут различаться даже в пределах одного типа рака (нозологии) у разных пациентов, и даже в опухоли одного пациента. Поэтому для некоторых лекарств молекулярно-генетическое тестирование рекомендовано в инструкции к препарату.
На сегодняшний день в мире проводится более 30 000 исследований противоопухолевой терапии. По разным данным, до половины из них используют молекулярные биомаркеры для включения больных в исследование или для наблюдения в ходе лечения.
Но что даст пациенту молекулярное профилирование? Где его место в клинической практике сегодня? Хотя для ряда лекарств тестирование является обязательным, это всего лишь «надводная часть айсберга» современных возможностей молекулярного тестирования. Результаты исследований подтверждают влияние различных мутаций на эффективность лекарств, а некоторые из них можно встретить в рекомендациях международных клинических сообществ.
Однако известно ещё не менее 50 дополнительных генов и биомаркеров, анализ которых может быть полезным в выборе лекарственной терапии (Chakravarty et al., JCO PO 2017). Их определение требует использования современных методов генетического анализа, таких как высокопроизводительное секвенирование (NGS). Секвенирование позволяет обнаружить не только распространенные мутации, но «прочитать» полную последовательность клинически значимых генов. Это позволяет выявить все возможные генетические изменения.
На этапе анализа результатов используются специальные биоинформатические методы, которые помогают выявить отклонения от нормального генома даже если важное изменение встречается в небольшом проценте клеток. Интерпретация полученного результата должна опираться на принципы доказательной медицины, так как не всегда ожидаемый биологический эффект подтверждается в клинических исследованиях.
Из-за сложности процесса проведения исследований и интерпретации результатов молекулярное профилирование пока не стало «золотым стандартом» в клинической онкологии. Однако есть ситуации, в которых этот анализ может существенно повлиять на выбор лечения.
К сожалению, даже на фоне правильно подобранного лечения заболевание может прогрессировать, и не всегда есть выбор альтернативной терапии в рамках стандартов для данного онкологического заболевания. В этом случае молекулярное профилирование может выявить «мишени» для экспериментальной терапии, в том числе в рамках клинических исследований (например TAPUR).
Некоторые виды рака, например, немелкоклеточный рак лёгкого или меланома, известны множеством генетических изменений, многие из которых могут быть мишенями для таргетной терапии. В таком случае молекулярное профилирование может не только расширить выбор возможных вариантов лечения, но и помочь расставить приоритеты при выборе препаратов.
Молекулярное исследование в таких случаях помогает на начальном этапе определить более полный спектр возможных вариантов лечения.
Молекулярное профилирование и персонализация лечения требуют сотрудничества специалистов из нескольких областей: молекулярной биологии, биоинформатики и клинической онкологии. Поэтому такое исследование, как правило, стоит дороже обычных лабораторных тестов, а его ценность в каждом конкретном случае может определить только специалист.
источник
Рак легких на сегодняшний день не является редко встречающимся заболеванием. Патология наиболее часто прогрессирует под влиянием длительного табакокурения, когда стаж исчисляется годами либо при агрессивной окружающей обстановке, когда воздух сильно загрязнен.
Знание признаков, которые являются характерными для такой патологии, предоставляют возможность ее своевременно обнаружить и начать терапию. Современные диагностические методы позволяют обнаружить раковые опухоли даже на начальных этапах, что позволяет полностью ликвидировать патологический процесс и позволить человеку прожить длинную жизнь.
Диагностика рака легких подразумевает проведение многих манипуляций.
Рак легких подразделяется на 2 типа. Первый тип – центральный рак легких и 2 – периферический.
Основными причинами, которые указывают на прогрессирование рака легких, принято считать:
- генетическую предрасположенность;
- никотиновую зависимость;
- экологические факторы;
- хронические патологии бронхолегочной системы.
При раке легких достаточно часто проявляются следующие симптомы:
- дыхание с присвистом;
- понижение работоспособности;
- одышка;
- непроходящий кашель;
- частые повышения общей температуры тела без причины;
- слабость общего характера;
- отсутствие аппетита;
- мокрота с вкраплениями крови;
- болезненность области груди.
Указанные симптоматические проявления не всегда являются признаками рака легких, тем не менее, игнорировать их не рекомендуется, так как могут наличествовать иные патологические процессы дыхательной системы.
С течением времени, клиническая картина приобретает более выраженный характер:
- возникают тахикардические проявления;
- развивается одышка;
- кашель приобретает более интенсивный характер.
Даже при обыкновенном дыхании пациент может испытывать боли. Глотания затрудняется, а голос приобретает сиплый характер. Может развиться цианоз верхней части тела.
Прогрессирование онкологии легких подразделяется специалистами на несколько стадий, рассмотренных в таблице:
Стадии развития патологического процессаЭтапОписание БиологическийОн длится на протяжении момента возникновения опухолевого образования и до первых клинических проявлений, которые подтверждаются рентгенографическим исследованием.ДоклиническийИмеются исключительно рентгенологические признаки, но на данном этапе пациенты редко попадают к специалисту, так как их еще ничего не беспокоит.КлиническийНа данном этапе возникают внешние симптоматические проявления онкологического процесса. Наиболее часто образование язвенных поражений становится причиной беспокойства. Врач в таком случае поможет определить причину изменений.
Важно! Скорость течения онкологического процесса обуславливается лишь степенью агрессивности и характеристиками гистологии. В некоторых случаях, биологический и доклинический этапы могут продолжаться на протяжении многих лет, никак себя не проявляя и не вызывая у пациента никаких подозрений.
Рак легких подразделяется на 4 специфических группы, в зависимости от степени развития процесса и согласно предполагаемой стадии выполняются диагностические мероприятия:
- Первая группа заключает в себе методики, которые способны указать на вероятное прогрессирование опухолевого процесса. В эту категорию относится осмотр специалистом, рентгенографическое и флюорографическое исследования, цитологическое исследование мокроты.
- Вторая группа предполагает прохождение пациентом КТ, бронхоскопического и радионуклидного исследований, а также цитологического теста мокроты.
- Третья группа подразумевает диагностические мероприятия морфологического характера, которые способствуют окончательному подтверждению диагноза. В группу входят цитологическое исследование биоматериала, гистология.
- Четвертая группа представлена диагностическими мероприятиями, которые позволяют провести оценивание распространенности онкологического процесса. Для этого пациенту требуется пройти радионуклидное, ультразвуковое исследование и КТ.
Одним из важных моментов диагностики раковых опухолей легких является возможность отличить их от туберкулезных процессов, которые имеют сходные симптоматические проявления, к примеру — кровохарканье. Тем не менее, туберкулез и рак – категорически разные заболевания, которые специалисты определяют и отделяют после прохождения пациентом полноценного исследования.
Внимание! Определение рака легких по флюорографии является возможным, потому не следует пренебрегать основным правилом – ежегодное прохождение планового обследования.
Наиболее распространенным методом диагностирования рака легких выступает рентгеноскопия и флюорография, которую возможно сделать в любой городской больнице.
Рентгеноскопия характеризуется высокой степенью информативности и в 80% случаев позволяет обнаружить легочную онкологию. Лишь в малой доле случаев, рентгеноскопия отображает нормальное состояние легочных тканей при наличии онкологического процесса легочной системы.
При центральной форме ракового образования, на рентгенографии будет отображаться, что в легких присутствует расширенная сеть сосудов, а также имеются замутненные участки. Когда у легочной онкологии периферический характер, картина на рентгеновском изображении будет отображать присутствие четкой тени с неровными краями, от которой к корню легких отходят отростки в виде лент.
Онкология легких определяется при помощи флюорографического исследования, которое является наиболее доступным способом проверки легких на данный момент. Некоторые пациенты ошибочно думают, что такая методика не способна отобразить присутствие каких-либо опухолевых процессов.
Тем не менее, это не так и опытный рентгенолог способен обнаружить какие-либо патологические изменения в легочной системе. По этой причине не рекомендуется отказываться от флюорографического исследования. Именно этот метод ранней диагностики рака легкого доступен всем пациентам.
Бронхоскопия является диагностическим мероприятием, которое основывается на визуальном исследовании системы дыхании при помощи оптоволоконного зондирования. Зонд вводится в пути дыхания – при легочном раке бронхиальный просвет сужается и в нем развиваются язвенные процессы.
Также происходит деформация и смещение бронхиальных стенок. Могут также увеличиваться трахеобронхиальные лимфатические узлы.
Описываемая методика достаточно часто неприятна и по этой причине пациенту вводится успокоительное и обезболивающее. При помощи бронхоскопического обследования достаточно часто берут материал для биопсии опухолевых тканей. После выполнения исследование, на протяжении 1-2 суток, у пациента могут отхаркиваться сгустки крови темного цвета.
МРТ (на фото) базируется на принципе ядерно-магнитного резонанса, который в совмещении с необходимым ПО позволяет провести обработку полученных данных с максимальной достоверностью и предоставить наиболее доскональные результаты обследования. Такая диагностическая мера полностью безопасна для здоровья пациента.
Помимо этого, МРТ – это высоко информативный метод, так как при его использовании получается добиться снимков максимальной четкости и разрешения.
Тем не менее, имеются некоторые ограничения – МРТ противопоказано при электронных имплантатах, к примеру – сердечных клапанов, водителей ритма и прочих. Цена проведения обследования с использованием данного метода достаточно высока, особенно если рассматривать возможность проведения МРТ в частных клиниках.
КТ обычно используется при недостаточной ясности картины, которую предоставило рентгенологическое исследование о состоянии опухолевой патологии. Такая методика наиболее предпочтительна в сравнении с обыкновенной рентгенографической, так как у компьютерной томографии наибольшая чувствительность по отношению к присутствию опухолевых процессов в легочных структурах.
Видео в этой статье ознакомит читателей с особенностями проведения КТ при подозрении на рак легкого.
Суть методики заключается в том, что в процессе выполнения КТ выполняется огромное число снимков тела в срезе. В редких случаях пациентам, для того чтобы получить более полную картину происходящих в организме процессов, вводятся специфические контрастные вещества, которые способны повышать четкость изображения.
Цитологическое исследование мокроты предполагает при проведении диагностики использование специфического микроскопа. Когда возникают сложности с забором материала для исследований, то его изымают в ходе бронхоскопического исследования.
Достаточно часто, при легочном раке, в мокроте имеются плоскоклеточные атипичные фракции, которые и говорят о присутствии онкологического процесса.
Такая методика является наиболее финансово доступной и безопасной. Но, она характеризуется ограниченной информативностью, так как нередко при раке в мокроте могут отсутствовать определенные клеточные структуры, а значит – исследование потенциально способно предоставить специалистам ложноотрицательный результат, что приведет к осложнению течения.
Плевральная пункция также именуется как торакоцентез. Иногда, онкология легких сопровождается и поражениями плевры, а также возникновение плеврального выпота.
Инструкция полагает забор биоматериала для исследования и дальнейшее изучение именуется плевральной пункцией. В результате исследования, в материале обнаруживаются онкологические клетки, что и выступает доказательством присутствия ракового процесса в дыхательном органе.
Имеются и оперативные методики диагностирвоания, которые представлены торакотомией и медиастиноскопией. Первая методика базируется на взятии биопсии малого кусочка опухоли, а другая предполагает исследования взятых образцом лимфатических узлов либо тканей опухоли, в которых могут присутствовать метастазы.
Подобная диагностика требует выполнения всех мероприятий в условиях операционной. Оба метода способны стать причиной множественных осложнений, которые представлены инфекционными поражениями, кровотечениями либо побочными реакциями организма пациента на применяемые медикаменты.
Указанная диагностика выполняется за счет введения в очаг опухолевого процесс тонкой иглы, сквозь которую производится забор биоматериала. После этого образцы отправляются в лабораторию для дальнейшего изучения. Выполнение пункционной биопсии требует предварительного местного обезболивания либо наркоза.
Подобная диагностическая методика позволяет получить оценку работоспособностей тканей и активности обменных процессов. Изображения пострадавшего участка выполняются за счет влияния радиоактивных веществ с кратким периодом воздействия. Позитронно-эмиссионная томография позволяет выполнить изображения внутриорганных структур в 3D формате.
Пациенту вводят радиоактивный препарат с кратковременным действием, а после этого проводят сканирование. В процессе обследования, пациент получает облучение, которое по степени сопоставимо с флюорографией.
Выявить присутствие рака исключительно исходя из результатов лабораторных анализов, возможности не имеется. При таком исследовании могут быть обнаружены исключительно нарушения и отклонения состава крови и прочие признаки, характерные онкологическим процессам.
Присутствие либо нехватка определенных ферментов могут указывать на метастазирование некоторых органов.
Внимание! Определение рака легких по анализу крови на онкологические маркеры является простым и доступным методом диагностики, тем не менее, способ не позволяет утвердить абсолютно точный диагноз.
Для каждого из этапов онкологического процесса имеется собственная характерная стадия распространенности по структурам организма. Стадирование рака легких основывается на оценивании параметров новообразования, присутствия онкологических клеток в лимфатических узлах и прочим параметрам.
Стадирование выступает одной из наиболее важных диагностических мероприятий, которые помогают специалисту подобрать оптимальную схему лечения. Также, стадирование помогает выполнить прогноз жизни пациента.
источник
 Рентгенографический снимок. Это метод один из самых распространенных при ранней диагностики рака легкого. Хотелось бы отметить, что на снимке можно заметить не четкость, размытость и неоднородность контуров новообразования. Для того чтобы определить данным способом наличие раковой опухоли и поставить правильный диагноз, с момента появления данного заболевания должно пройти около 126 календарных дней.
Рентгенографический снимок. Это метод один из самых распространенных при ранней диагностики рака легкого. Хотелось бы отметить, что на снимке можно заметить не четкость, размытость и неоднородность контуров новообразования. Для того чтобы определить данным способом наличие раковой опухоли и поставить правильный диагноз, с момента появления данного заболевания должно пройти около 126 календарных дней. Еще один наиболее достоверный диагностический способ определения развития злокачественной опухоли – это исследование мокроты на цитологию . Важным условием является форма ее сбора, она производится только в моменты глубокого откашливания. В тех случаях, когда мокрота отходит скудно или вообще наличие мучительного кашля является сухим, то ее забор производится во время бронхоскопии. Данным методом обследования можно не только выявить развитие раковой опухоли, но и предсказать ее появление на несколько лет вперед, поскольку материал, предоставляемый на исследование может содержать клетки, которые склонны к мутации.
Еще один наиболее достоверный диагностический способ определения развития злокачественной опухоли – это исследование мокроты на цитологию . Важным условием является форма ее сбора, она производится только в моменты глубокого откашливания. В тех случаях, когда мокрота отходит скудно или вообще наличие мучительного кашля является сухим, то ее забор производится во время бронхоскопии. Данным методом обследования можно не только выявить развитие раковой опухоли, но и предсказать ее появление на несколько лет вперед, поскольку материал, предоставляемый на исследование может содержать клетки, которые склонны к мутации.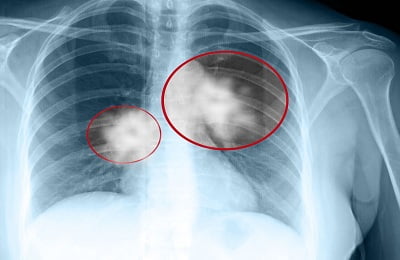 Развитие рака по периферическому типу диагностируется по несколько иным показателям:
Развитие рака по периферическому типу диагностируется по несколько иным показателям:  Поскольку раковые клетки в несколько десятков раз активнее здоровых клеток, то именно они, в первую очередь захватят всю радиоактивную глюкозу. И в следствие этого, все опухолевые ткани становятся заметнее на позитронно-эмиссионных томографах.
Поскольку раковые клетки в несколько десятков раз активнее здоровых клеток, то именно они, в первую очередь захватят всю радиоактивную глюкозу. И в следствие этого, все опухолевые ткани становятся заметнее на позитронно-эмиссионных томографах. нежелание обратиться к лечащему врачу;
нежелание обратиться к лечащему врачу; наличие частого влажного кашля с отходящей мокротой желто-зеленого цвета;
наличие частого влажного кашля с отходящей мокротой желто-зеленого цвета; возраст больного;
возраст больного; Врачам следует обратить на них обособленное внимание, даже при незначительных проявлениях отклонений.
Врачам следует обратить на них обособленное внимание, даже при незначительных проявлениях отклонений.
