Сущность метода заключается в титровании пробы стандартным раствором кислоты в присутствии индикаторов фенолфталеина или метилового оранжевого.
Чувствительность метода 50 мкг-экв./дм 3 .
Диапазон определяемых значений — от 0,5 до 20 мг-экв./л.
Комплектация рассчитана на проведение 1000 определений.
Необходимые для проведения анализа приборы и материалы:
Колбы мерные 2-1000-2 по ГОСТ 1770.
Колбы Кн-250 ТХС по ГОСТ 25336Е.
Цилиндры мерные вместимостью 100 см 3 по ГОСТ 1770
Воронка коническая стеклянная по ГОСТ 23932.
Бюретка 1-2-25-0,1 по ГОСТ 29251.
Вода дистиллированная по ГОСТ 6709 (вода обессоленная, конденсат).
Состав набора:
Кислота соляная, стандарт-титр для приготовления раствора с концентрацией 0,1 г-экв./дм 3 .
Метиловый оранжевый, индикатор, 0,1% водный раствор по ГОСТ 4919.1.
Фенолфталеин, индикатор, сухая смесь, по ГОСТ 4919.1.
Реактивы, входящие в состав набора, проверяются на соответствие требованиям действующих стандартов и технических условий.
Поправочные коэффициенты на нормальность стандартных растворов находятся в пределах 1±0,003.
Приготовление рабочих растворов.
Перед проведением анализа необходимо приготовить раствор соляной кислоты.
Для приготовления раствора соляной кислоты необходимо количественно перенести содержимое ампулы в мерную колбу, растворить примерно в 800-900 мл дистиллированной воды, хорошо перемешать и довести объем раствора до метки дистиллированной водой.
Время, затрачиваемое на проведение операции — около 20 минут.
Поправочный коэффициент для растворов, приготовленных из стандарт-титров, равен единице.
Готовый раствор перелить в емкости для хранения.
Проведение анализа.
1. В чистую коническую колбу Кн 2-250 мерным цилиндром отмеряют 100 см 3 анализируемой воды и прибавляют индикатор фенолфталеин.
Если проба имеет розовую окраску, ее титруют стандартным раствором соляной кислоты до обесцвечивания раствора. Результат титрования заносят в журнал. После чего к пробе прибавляют 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
Если после прибавления к пробе фенолфталеина окрашивание не проявляется. К пробе следует сразу прибавить 3-4 капли раствора индикатора метилового оранжевого. Проба окрасится в желтый цвет.
2. Окрашенную в желтый цвет пробу титруют стандартным раствором соляной кислоты до перехода окраски в апельсиновую.
3. Величина щелочности определяется по формулам:
Щфф — щелочность пробы по фенолфталеину, мг-экв./дм 3 ;
афф — расход кислоты на титрование с индикатором фенолфталеином, см 3
С — концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V — объем взятой на титрование пробы, см 3 .
Щмо — щелочность пробы по метиловому оранжевому (общая щелочность), мг-экв./дм 3 ;
амо — расход кислоты на титрование с индикатором метиловым оранжевым (в случае последовательного титрования за объем кислоты, пошедший на титрования с метиловым оранжевым берется суммарный расход кислоты с начала титрования), см 3 ;
С — концентрация применяемого для титрования раствора соляной кислоты, г-экв./дм 3 (С=0,1 или 0,01);
V — объем взятой на титрование пробы, см 3 .
источник
ИССЛЕДОВАНИЯ КАЧЕСТВА ИСХОДНОЙ (СЫРОЙ) КОТЛОВОЙ ВОДЫ ПАРОВОЙ КОТЕЛЬНОЙ И СЕТЕВОЙ ВОДЫ ВОДОГРЕЙНОЙ КОТЕЛЬНОЙ И ТЕПЛОВЫХ СЕТЕЙ
Цель работы: Практическое освоение методики аналитического контроля общей щелочности воды и отдельных форм щелочности; приобретение навыков анализа воды, используемой в теплоэнергетических установках.
Щелочность воды, реактивы, применяемые при ее определении
Щелочность воды – это общее содержание в воде веществ, обуславливающих при диссоциации или в результате гидролиза повышенную концентрацию ионов ОН —.
В исходной воде щелочность обычно связана с присутствием ионов 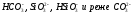

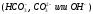
Большая щелочность воды определяется количеством соляной кислоты, затраченной на титрование анализируемой пробы воды (100 мл пробы) в присутствии индикатора фенолфталеина (I этап) и метилоранжа (II этап) 0,1 н. Количество кислоты (мл), израсходованной при титровании, равно щелочности испытуемой воды при рН = 3. 4 .
Малая щелочность воды определяется путем титрования 100 мл пробы в присутствии фенолфталеина (I этап) и метилрота или смешанного индикатора (II этап) 0,01 н. раствором серной или соляной кислоты. Величина щелочности при этом определяется по формуле:

где п – количество израсходованного 0,01 н. раствора кислоты, мл.
Анализы по определению отдельных форм щелочности основаны на том, что при титровании пробы воды сильной кислотой, реакции, протекающие между кислотой и различными анионами, обусловливающими форму щелочности, заканчиваются при различных значениях рН раствора. Титрование проводится в присутствии двух индикаторов, каждый из которых рассчитан на определенный диапазон значений рН. Одним индикатором является метилоранж, окраска которого изменяется на желтую в кислой среде при рН=3. 4, вторым — фенолфталеин, окраска которого изменяется на розовую в щелочной среде при рН > 8,4. Следует особо отметить, что значение рН=8,4 имеют растворы чистых гидрокарбонатов (НСО3), постоянно присутствующих в водах. При анализе пробы воды на первом этапе используется фенолфталеин, а на втором — метилоранж.
Оценка отдельных форм щелочности производится в соответствии с полученными при титровании данными. При этом возможны следующие случаи:
1) фенолфталеин не дает розового окрашивания, т.е. Ф = 0, где Ф — расход соляной кислоты, пошедшей на титрование пробы, окрашенной фенолфталеином, мл. Метилоранж дает желтое окрашивание пробы, которая затем титруется соляной кислотой до изменения окраски. В этом случае в воде присутствуют только бикарбонаты (бикарбонатная щелочность) Щб, которая подсчитывается по формуле (1), где А = М, а М — расход кислоты на титрование пробы воды, окрашенной метилоранжем, мг-экв/л;
2) фенолфталеин дает розовое окрашивание, причем при титровании пробы оказалось, что 2Ф М. В этом случае в воде присутствуют карбонаты и гидраты. Для расчета Щк в формулу (1) следует подставить А=2(М-Ф), а для расчета Щг — А = (2Ф — М);
5) фенолфталеин дает розовое окрашивание, причем М = 0 (т.е. после обесцвечивания фенолфталеина дальнейшее увеличение объема метилоранжа сразу вызывает оранжевую окраску пробы воды). В этом случае присутствуют только гидраты; для расчета Щг в формулу (1) следует подставить А = Ф. При Кн = 0,1 мг-экв/л и V = 100 мл для определения формы и численного значения щелочности удобно пользоваться таблицей.
Оценка точности значений щелочности, вычисленных по формуле (1), производится в случае однократного измерения с учетом погрешностей измерения объемов анализируемой пробы Av, мл, и кислоты АА, мл, пошедшей на титрование, мг-экв/л
Сухой остаток – это суммарное количество нелетучих веществ в воде, выраженное в мг/кг. Он получается путем осторожного выпаривания профильтрованной пробы с последующим высушиванием при температуре 110-120°С. Количество этих веществ, определенное взвешиванием и пересчитанное на 1 кг воды, составляет сухой остаток.
При оперативном обслуживании теплового оборудования, ХВО, тепловых сетей метод определения солесодержания воды путем выделения каждый раз сухого остатка не применяется из-за большого количества времени, затрачиваемого на него. Так как практически в каждой воде находятся ионы 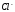

где K – коэффициент пропорциональности, Cl – концентрация хлоридов, мг/кг.
3. Концентрация хлоридов, реактивы, применяемые для ее определения.
Для определения концентрации хлоридов проба титруется раствором азотнокислой окисной ртути 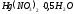
Расчет концентрации хлоридов ведется по формуле
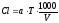
где a – расход раствора азотнокислой окисной ртути, мг; Т – титр раствора азотнокислой ртути по хлор-иону, мг/л; V – объем пробы воды на анализ, мл.
Относительная щелочность котловой воды паровых котлов.
Для правильного ведения режимов непрерывной и периодической продувок паровых котлов очень важно оптимальное соотношение щелочности и солесодержания котловой воды. Правилами Госгортехнадзора относительная щелочность нормируется:

где 40 – эквивалент NaOH, мг/кг*экв;
Щ – общая щелочность котловой воды, мг*экв/кг; S — сухой остаток, мг/кг.
Величина относительной щелочности более 50% вызывает межкристаллитную коррозию металла барабана котла.
5. Описание лабораторной установки
Установка состоит (рис. 2) из колбы-1, бюретки-3 со сливным устройством-2, емкости-4 с 0,1 н раствором HCI, мерной колбы-5 и пипеток с индикаторами (на рис. 2 не показаны).
Порядок выполнения лабораторной работы
Ознакомиться с лабораторной установкой, назначением и порядком включения двухходового крана-6, конструкцией и порядком работы со сливным устройством-2 бюретки-3. Записать технические и метрологические характеристики средств измерений, используемых в работе.
Определить общую щелочность анализируемой пробы воды; для этого:
а) мерной колбой — 5 отмерить 100 мл воды и перелить ее в колбу-1, добавить туда же 2-3 капли фенолфталеина до появления розовой окраски (при отсутствии реакции на фенолфталеин выполнить п.»б» и переходить сразу к п.»г»);
б) открыть двухходовой кран-6 и заполнять бюретку-3 до тех пор, пока середина мениска кислоты в бюретке не совпадет с любой оцифрованной отметкой в диапазоне 15. 20 мл; перекрыть кран, записать значение начального объема Ан в таблицу по форме 1; в эту же таблицу занести результаты последующих опытов и расчетов;
в) поставить колбу-1 под сливное устройство бюретки-3, сжимая пальцами шарик сливного устройства-2, титровать пробу соляной кислотой до обесцвечивания пробы; прекратить титрование, занести в таблицу значение объема кислоты, затраченной на титрование Аф;
г) добавить в анализируемую пробу воды 2-3 капли метилоранжа. Если проба воды окрасилась в оранжевый цвет, эксперимент считается законченным, следует занести в таблицу значение объема кислоты затраченной на титрование Ам=0, и перейти к расчетам, как это указано в п.»д»; при появлении желтой окраски следует титровать пробу, как это указано в п.»в», до появления оранжевой окраски; прекратить титрование, занести в таблицу значение объема кислоты, затраченной на титрование Ам!
д) вычислить расход кислоты Ф, затраченной на титрование пробы воды, окрашенной фенолфталеином; расход кислоты М, затраченной на титрование пробы воды, окрашенной метилоранжем; суммарный расход кислоты А; общую щелочность Що;
е) повторить еще два раза опыты и расчеты, как это указано в пп. «а. д», вычислить среднеарифметическое значение щелочности Що, доверительные границы и записать окончательный результат;
4. Определить отдельные формы щелочности и вычислить, пользуясь таблицей по форме 1, их численные значения.
1. Краткое описание лабораторной установки, технические и метрологические характеристики средств измерений, краткие пояснения проводимых опытов.
2. Результаты опытов и расчетов, таблицы.
3. Выводы по работе и анализ результатов (см. «Общие указания»).
1. Белан Ф.И, Водоподготовка. М.: Госэнергоиздат 1958.
2. Фрог Б.Н., Левченко А.П. Водоподготовка: Учебное пособие для вузов.
М. Издательство МГУ, 1996 г. 680 с; 178 ил.
3. Руководящие указания по водоподготовке и водно–химическому режиму тепловых сетей. / СЦНТИ Энергоатомиздат. М., 1973. С. 3 — 50
источник
Объемный (количественный) анализ.Объемный метод количественного анализа основан на точном измерении реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называются титрованными, т.к. они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными. Процесс прибавления стандартного титрованного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности, т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества согласно уравнению реакции. Необходимое условие объемного анализа – точная фиксация точки эквивалентности, поэтому используют реакции, конец которых характеризуется определенным внешним признаком (изменение окраски, выпадение осадка). Часто для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет или другие свойства с изменением концентрации исследуемого иона. Такие вещества называются индикаторами.
Требования к реакциям, применяемым в объемном анализе:
— возможность тем или иным способом фиксировать точку эквивалентности;
— количественное течение реакции до равновесия, характеризующегося соответствующей величиной константы равновесия реакции;
— можно применять только те реакции, которые протекают с достаточной скоростью;
— при титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным.
В зависимости от типа реакции, которая протекает при титровании, выделяют методы объемного анализа:
1 Нейтрализация. В основе метода лежит реакция нейтрализации:
Этим методом определяют кислотность, щелочность, карбонатную жесткость воды.
2 Окислительно-восстановительные методы, в основе которых применяют окислительно-восстановительные реакции, в ходе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму.
3 Осаждение. Объемные определения метода основаны на осаждении определенного иона в виде труднорастворимого соединения.
4 Комплексометрия. В методе исследуемый ион связывается водным реактивом в малодиссоциированный комплекс. Метод применяется при определении жесткости воды Mg 2+ , Ca 2+ , иона Fe 3+ .
Измерение объемов. Для точного измерения в объемном анализе используют бюретки, пипетки, мерные колбы.
1 Бюретки служат для титрования и представляют собой цилиндрические трубки с суженным концом, отсчет ведется сверху вниз.
2 Пипетки служат для точного отмеривания каких-либо определенных объемов исследуемого раствора.
3 Мерные колбы служат для разбавления исследуемого раствора до определенного объема.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксоанион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
1 сильные щелочи (KOH, NaOH) и летучие основания (например, NH3×H2O), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО3 2– , S 2– , PO4 3– , SiO3 2– и др.);
2 слабые основания и анионы летучих и нелетучих слабых кислот (HCO3 – , H2PO4 – , HPO4 2– , CH3COO – , HS – , анионы гуминовых кислот и др.).
Щелочность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН = 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений
рН = 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая данным образом величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Экспериментальная часть
Определение свободной щелочности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором HCl до обесцвечивания раствора. Расчет производят по формуле:
где х – свободная щелочность воды, мг-экв/л;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
Определение общей щелочности. В ту же колбу, где проводили титрование, добавляют 2 – 3 капли индикатора метилового оранжевого и продолжают титрование до тех пор, пока окраска индикатора из желтой не перейдет в оранжевую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 1. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 1 – Результаты титрования
| № | V (H2О), мл | V (HСl), мл | V (HCl) средн., мл |
| 100,0 |
Перед каждым титрованием заполняют бюретку раствором до нулевого деления шкалы.
Расчет производят по формуле:
где х – общая щелочность воды, мг-экв/л;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
V (H2О) – взятый объем воды, мл.
Аналогично щелочности при анализе сточных и технологических вод определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксоанионами. К таким соединениям относятся:
1) сильные кислоты: соляная HCl, азотная HNO3, серная H2SO4;
2) слабые кислоты: уксусная CH3COOH; сернистая H2SO3; угольная H2CO3; сероводородная H2S и т.п.;
3) катионы слабых оснований: аммоний NH4 + ; катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора.
Различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН = 4,3 – 4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO3, H2SO4, H3PO4.
Общая кислотность определяется при титровании до значений рН = 8,2 – 8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др.
Экспериментальная часть
Определение свободной кислотности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора метилового оранжевого и титруют раствором щелочи до перехода оранжевой окраски раствора в желтую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 2. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 2 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствра щелочи, мл;
СH(NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л;
Определение общей кислотности. В коническую колбу наливают 100мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором щелочи появления малиновой окраски индикатора.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 3. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 3 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствора щелочи, мл;
СH(NaOHl) – молярная концентрация эквивалента раствора щелочи, моль/л;
Вопросы для самоконтроля
1 На титрование 100 мл исследуемой воды пошло 20 мл 0,1 н раствора соляной кислоты по метиловому оранжевому. Определите щелочность воды.
2 Вода содержит (мг/л): CaSO4 – 50, Ca(HCO3)2 – 100, Mg(HCO3)2 – 25. Какова величина щелочности.
3 Какова общая щелочность воды, содержащей СО3 2- – 50 мг/л, НСО3 — – 122 мг/л.
4 При определении щелочности воды было израсходовано 0,1 н кислоты на титрование 100 мл пробы с индикатором фенолфталеином 3 мл и дополнительно с индикатором метиловым оранжевым 5 мл. Рассчитайте общую и отдельные виды щелочности воды.
5 Вода имеет жесткость равную 9 мг-экв/л. Постоянная жесткость составляет 60 % от общей жесткости (соли натрия отсутствуют). Какова величина щелочности воды.
6 В 1 л воды содержится 210 мг NaHCO3 и 5,3 мг Na2CO3. Определите общую щелочность воды.
ЛАБОРАТОРНАЯ РАБОТА
Дата добавления: 2016-11-20 ; просмотров: 7181 | Нарушение авторских прав
источник
Сущность метода. В основе метода определения общей щелочности воды лежит принцип образования нейтральных солей при взаимодействии кислоты с гидратами, гидрокарбонатами и карбонатами щелочных и щелочнозечельных металлов, а также свойство различных индикаторов изменять свой цвет в зависимости от величины рН.
Учитывая эти свойства, исследуемую пробу воды подвергают титрованию раствором соляной или серной кислоты требуемой концентрации в присутствии индикаторов фенолфталеина и метилоранжа.
Применяемые реактивы:
децинормальный (0,1 н.) раствор соляной или серной кислоты;
1%-ный спиртовый раствор фенолфталеина для определения гидратной и карбонатной щелочности;
0,1%-ный раствор метилоранжа, служащий индикатором при определении карбонатной и гидрокарбонатной щелочности.
Подготовка_пробы воды. При титровании воды кислота вступает во взаимодействие как со щелочами, так и с веществами, которые могут находиться в воде во взвешенном состоянии и которые не обусловливают щелочность воды. Чтобы уменьшить расход кислоты на ненужные реакции и обеспечить правильность определения щелочности, анализируемую пробу охлаждают до 20°С, если она была горячей, и пропускают через бумажный фильтр.
Порядок анализа. К 100 мл соответственно подготовленной для титрования пробы воды добавляют 2-3 капли фенолфталеина.
При окрашивании пробу титруют раствором соляной или серной кислоты соответствующей нормальности (0,1 н. или 0,01 н.) до исчезновения окраски. Титрование проводят медленно, тщательно перемешивая пробу воды.
Количество 0,1 н. или 0,01 н. раствора соляной или серной кислоты, пошедшее на титрование с фенолфталеином, записывают с пометкой «фф». Если в процессе прибавления фенолфталеина окрашивания не наступает, значит, в воде отсутствуют гидратная и карбонатная щелочности. В этом случае титровать пробы воды раствором кислоты не нужно, так как щелочность по фенолфталеину отсутствует.
После этого в эту же пробу добавляют 2-3 капли метилоранжа и титруют 0,1 н. или 0,01 н. раствором кислоты до перехода окраски пробы из желтой в оранжевую. Количество раствора кислоты, пошедшее на титрование с метилоранжем, записывают с пометкой «МО».
Для расчета общей щелочности воды берут суммарный расход кислоты, пошедшей на титрование с фенолфталеином и метилоранжем.
Расчет результатов анализа. Расчет результатов анализа основан на том, что каждый 1 мл нормального раствора соляной или серной кислоты оттитровывают 1 мг×экв щелочности. Соответственно этому 1 мл децинорнального (0,1 н.) раствора соляной кислоты оттитровывает 0,1 мг×экв. щелочности, а 1 мл сантинормального (0,01 н.) раствора оттитровывает 0,01 мг×экв щелочности.
Следовательно, общая щелочность воды
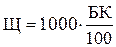
где Щ — общая щелочность воды, мг×экв/кг;
1000 — перерасчет результатов анализа на 1 л воды;
К — коэффициент нормальности раствора кислоты;
Б — суммарный расход кислоты на титрование, мл;
100 -объем пробы воды, взятой для анализа, мл.
При титровании 100 мл пробы воды децинормальным раствором кислоты (0,1 н.) формула упрощается:
При использовании саитинормального раствора кислоты (0,01 н.):
Для воды типа конденсата щелочность принято выражать в микро-грамм эквивалентах на литр (мкг×экв/кг). В этом случае
Щ =Б 0.01 × 1000 × 1000/100
СОСТАВЛЕНИЕ ОТЧЕТА
Для оформления отчета необходимо заполнить табл. 3.
Результаты расчетов
| № | Наименование параметра | По какой формуле определяется | Значение | Размерность |
| Карбонатная жесткость Некарбонатная жесткость Общая жесткость метод титрования метод комплексометрический Окисляемость Общая щелочность Сухой остаток Класс жесткости | табл.2 |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем обусловлена и в каких единицах измеряется карбонатная жесткость?
2. Чем обусловлена и в каких единицах измеряется некарбонатная жесткость?
3. Что такое общая жесткость?
4. Как определить класс жесткости воды?
5. Почему карбонатная жесткость устраняется при кипячении? Напишите, какие при этом протекают реакции.
6. Как устраняют жесткость воды в промышленных условиях?
7. Как определяют карбонатную жесткость?
8. Как определяют некарбонатную жесткость?
9. Как определяют общую жесткость?
10. Что такое окисляемоеть воды и чем она обусловлена, в каких единицах измеряется?
11. Как определяют окисляемоеть воды?
12. Что такое общая щелочность воды, в каких единицах измеряется?
13. Как определяют щелочность воды?
14. Что такое сухой остаток, в каких единицах измеряется и как определяется?
источник
Настоящий документ предназначен для измерения свободной и общей щелочности в природных и сточных водах методом потенциометрического титрования.
Диапазон измерения содержания общей и свободной щелочности 0,005 — 10 мг-экв/дм 3 .
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Таблица 1 — Диапазон измерений, значения показателей повторяемости, воспроизводимости и точности
Показатель повторяемости (относительное значение среднеквадратического отклонения повторяемости), s r, %
Показатель воспроизводимости (относительное значение среднеквадратического отклонения воспроизводимости), s R, %
Показатель точности (границы относительной погрешности) при Р = 0,95 ± d s , %
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией;
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
рН-метр или иономер И-130 с погрешностью измерения рН не более 0,05 единиц рН
Термокомпенсатор ТКА-4 (ТКА-5)
Электрод измерительный типа ЭСЛ-63-07, ТУ 25-05.2234-77
Электрод вспомогательный (сравнения) ЭВЛ-1МЗ ТУ 25-05.2181-77
Весы лабораторные общего назначения с наибольшим ГОСТ 24104-2001
пределом взвешивания 200 г и ценой наименьшего деления
ГСО с аттестованным содержанием гидрокарбонат-иона ГСО 4485-91
с погрешностью аттестованного значения не более 1 % при Р = 0,95
Стандарт-титры для приготовления буферных растворов ГОСТ 8.135-74
Термометр с ценой деления 0,2 °С ГОСТ 29224-91
Колбы мерные вместимостью 100, 250, 1000 см 3 ГОСТ 1770-74
Пипетки градуированные вместимостью 1, 5, 10 см 3 ГОСТ 29227-91
Бюретки с ценой деления 0,1 см 3 ГОСТ 29251-91
Цилиндры мерные или мензурки ГОСТ 1770-74
Плитка электрическая с закрытой спиралью ГОСТ 14919-83
и регулируемой мощностью нагрева
Шкаф сушильный лабораторный
Стаканчики для взвешивания (бюксы) ГОСТ 25336-82
Мешалка магнитная с числом оборотов в минуту в диапазоне 100 — 1000
Воронка стеклянная диаметром (13 — 15) см ГОСТ 25336-82
Воронка фильтрующая с пористой пластинкой ГОСТ 25336-82
Трубки хлоркальциевые ТХ-П-1-17(25) ГОСТ 25336-82
Устройство для продувания воздуха (или микрокомпрессор МК).
Фильтры обеззоленные ТУ 6-09-1678-86
Соляная кислота, раствор 0,1 моль/дм 3 , ТУ 6-09-2540
Натрия тиосульфат (натрий серноватистокислый), ГОСТ 27068-86
Спирт этиловый ректификованный ГОСТ 18300-87
Фильтры обеззоленные ТУ 6-09-1678-86
Допускается использование других средств измерений и вспомогательного оборудования, посуды и материалов с метрологическими и техническими характеристиками не хуже указанных. Средства измерений должны быть поверены в установленные сроки.
Все реактивы должны иметь квалификацию «хч» или «чда».
Определение щелочности основано на титровании пробы раствором сильной кислоты до достижения значения рН, эквивалентного свободной и общей щелочности.
Под щелочностью понимают способность некоторых компонентов, содержащихся в воде, связывать эквивалентное количество сильной кислоты. Щелочность создают все катионы, которые в воде были уравновешены гидроксильными ионами, анионами слабых кислот (карбонаты, бикарбонаты и т.п.). Щелочность определяется количеством сильной кислоты, необходимой для замещения этих анионов. Расход кислоты пропорционален их общему содержанию в воде и выражает общую щелочность воды (М). В обычных природных водах величина щелочности зависит, как правило, только от содержания гидрокарбонатов щелочных металлов. В этом случае значение рН
Наличие растворимых карбонатов и гидроокисей повышает значение рН > 8,3. Та часть общей щелочности, которая соответствует количеству кислоты, необходимой для понижения рН до 8,3, называется свободной щелочностью (Р). Количество титрованного раствора, израсходованного для достижения рН = 8,3, эквивалентно свободной щелочи; количество, необходимое для достижения рН = 4,5, эквивалентно общей щелочности. Если рН воды меньше 4,5, то ее щелочность равна нулю.
5.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76 .
5.2 Электробезопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019-79 .
5.3 Организация обучения работающих безопасности труда проводится по ГОСТ 12.0.004-90 .
5.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83 .
К выполнению измерений и обработке их результатов допускают специалистов, имеющих высшее или среднее специальное химическое образование или опыт работы в химической лаборатории и владеющих техникой метода потенциометрического титрования.
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
— относительная влажность не более 80 % при температуре 25 °С;
8.1 Отбор проб производится в соответствии с требованиями ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
8.2 Посуду, предназначенную для отбора и хранения проб, промывают раствором соляной кислоты (1:1), а затем дистиллированной водой.
8.3 Пробы воды отбирают в стеклянные бутыли. При фильтровании через любой фильтр первые порции фильтрата отбрасывают.
Объем отбираемой пробы должен быть не менее 300 см 3 .
8.4 Щелочность, особенно свободную, следует определять сразу после отбора пробы. Если это невозможно, отбирают полную бутыль и определяют щелочность не позднее, чем через 24 ч.
8.5 При отборе проб составляется сопроводительный документ по утвержденной форме, в котором указывается:
— цель анализа, предполагаемые загрязнители;
— должность, фамилия отбирающего пробу, дата.
9.1.1 Подготовку иономера или рН-метра проводят в соответствии с руководством по его эксплуатации.
9.1.2 Настройку прибора проводят по буферным растворам, приготовленным по п. 9.9.2 (ежедневно прибор проверяют по двум буферным растворам и один раз в неделю по всем буферным растворам). После настройки прибора электроды промывают дистиллированной водой, удаляют избыток влаги фильтровальной бумагой или обтирают тонкой мягкой тканью.
В нерабочее время электроды хранят в дистиллированной воде.
9.1.3 Разборку, заполнение и сборку электрода сравнения проводят в точном соответствии с инструкцией по заполнению электрода электролитом, приведенной в паспорте к электроду.
9.1.4 Подготовку стеклянного (измерительного) электрода проводят в строгом соответствии с паспортом к электроду.
9.2 Приготовление растворов и реактивов
9.2.1 Дистиллированная вода, свободная от растворенной углекислоты
Дистиллированную воду для стандартных буферных растворов кипятят 30 мин для удаления растворенной углекислоты. Охлаждают до комнатной температуры в колбе, закрытой пробкой, в которую вставлена хлоркальциевая трубка.
9.2.2 Приготовление стандартных буферных растворов с рН = 1,68, рН = 6,86, рН = 9,18
Стандартные буферные растворы готовят из стандарт-титров в соответствии с инструкцией к пользованию стандарт-титрами для рН-метрии.
В случае измерения рН раствора, превышающего указанный диапазон значений стандартных буферных растворов, применяют буферные растворы, охватывающие диапазон измерений.
Допускается приготовление буферных растворов в рабочем диапазоне значений рН согласно ГОСТ 4919.2-77 «Реактивы и особо чистые вещества. Методы приготовления буферных растворов».
Буферные растворы хранят в плотно закрытой полиэтиленовой (щелочные) или стеклянной посуде не более 2-х месяцев.
9.2.3 Приготовление раствора соляной кислоты с концентрацией 0,1 моль/дм 3 эквивалента
При приготовлении из стандарт-титра раствор готовят согласно инструкции.
При отсутствии стандарт-титра раствор готовят из концентрированной соляной кислоты. Пипеткой вместимостью 10 см 3 помещают 8,5 см 3 концентрированной соляной кислоты плотностью 1,188 г/см 3 в мерную колбу вместимостью 1 дм 3 с предварительно налитой дистиллированной водой в объеме (200 — 300) см 3 и доводят объем раствора дистиллированной водой до метки.
Срок хранения 6 месяцев в стеклянной посуде в месте, защищенном от попадания прямых солнечных лучей.
Коэффициент поправки соляной кислоты устанавливают в соответствии с ГОСТ 25794.1-83 «Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования» по 0,1 моль/дм 3 эквивалента раствору натрия углекислого и проверяют 1 раз в месяц (п. 9.3).
Навеску 60,0 г хлористого калия помещают в стакан вместимостью 300 см 3 и растворяют в 200 см 3 дистиллированной воды. Нагревают раствор до температуры (60 ± 2) °С, перемешивают раствор до полного растворения кристаллов хлористого калия. Охлаждают раствор до температуры (20 ± 2) °С, доводят объем до метки дистиллированной водой, перемешивают. Раствор хранят в стеклянной посуде в течение 6 месяцев.
9.2.5 . Приготовление раствора натрия углекислого с концентрацией 0,1 моль/дм 3 эквивалента
Натрий углекислый предварительно прокаливают при температуре 270 — 300 °С до постоянной массы в день установки титра. Охлаждают в эксикаторе. Затем берут навеску 5,3000 г и переносят в мерную колбу вместимостью 1 дм 3 , растворяют в небольшом количестве свежепрокипяченной и охлажденной дистиллированной воды и доводят до метки такой же водой.
Для предотвращения поглощения СО2 из воздуха раствор хранят в герметично закрытой склянке. Раствор хранят не более 3 месяцев.
9.3 Определение поправочного коэффициента для раствора соляной кислоты
Отбирают 20 см 3 раствора натрия углекислого, разбавляют до 100 см 3 свободной от СО2 дистиллированной водой и титруют раствором соляной кислоты с концентрацией 0,1 моль/дм 3 эквивалента, строго соблюдая те же условия, что и при определении общей щелочности (п. 10.2). Особенно следует соблюдать рекомендованные условия продувания воздухом. Титрование повторяют дважды и, если расхождение между объемами раствора соляной кислоты не превышает 0,02 см 3 , за результат титрования принимают среднее арифметическое значение.
Коэффициент поправки для раствора соляной кислоты находят по формуле:
где К — коэффициент поправки раствора соляной кислоты;
V н — объем раствора карбоната натрия, взятый для титрования, см 3 ;
V к — объём раствора соляной кислоты, израсходованный на титрование, см 3 .
Если при предварительном определении было установлено, что вода имеет свободную щелочность (рН = 8,3, реакция по фенолфталеину), то наряду с общей щелочностью определяют также и свободную щелочность.
10.1 Определение свободной щелочности (Р)
Отбирают 100 см 3 анализируемой пробы воды. Воду с высокой щелочностью берут в меньшем количестве и доводят объем приблизительно до 100 см 3 прокипяченной и охлажденной дистиллированной водой. Помещают в стаканчик для титрования, погружают магнитную вертушку и устанавливают на магнитную мешалку. Опускают и закрепляют электроды таким образом, чтобы шарик измерительного электрода полностью находится в жидкости. Закрепляют в штативе бюретку над стаканчиком. Включают мешалку. Титруют раствором соляной кислоты с концентрацией 0,1 моль/дм 3 эквивалента до установления рН = (8,3 ± 0,1). Показания считают установившимися не ранее чем через 1,5 минут после прекращения дрейфа показаний измерительного прибора. Во избежание перетитровывания, вблизи точки эквивалентности (рН = 8,3) раствор подают по каплям.
Производят отсчет количества титрующего раствора на проведение титрования до рН = 8,3 (V 1 , см 3 ) по бюретке.
Выполняют по два параллельных определения.
10.2 Определение общей щелочности (М)
Отмеряют 100 см 3 пробы или используют раствор после определения свободной щелочности, помещают в стаканчик для титрования и продувают воздухом в течение 2 — 3 мин, используя микропроцессор или аппарат КИП, устанавливают на магнитную мешалку. Опускают и закрепляют электроды таким образом, чтобы шарик измерительного электрода полностью находился в жидкости. Закрепляют в штативе бюретку над стаканчиком. Включают мешалку. Титруют раствором соляной кислоты с концентрацией 0,1 моль/дм 3 эквивалента до установления рН = (4,5 ± 0,1). Снова продувают воздух в течение 2 — 3 мин и, если показания прибора изменились, то дотитровывают.
Показания считают установившимися не ранее, чем через 1,5 минут после прекращения дрейфа показаний измерительного прибора. Во избежание перетитровывания, вблизи точки эквивалентности (рН = 4,5) раствор подают по каплям.
Производят отсчет количества титрующего раствора на проведение титрования до рН = 4,5 (V 2 , см 3 ) по бюретке.
Выполняют по два параллельных определения.
10.3 После измерений электроды ополаскивают дистиллированной водой и протирают фильтровальной бумагой или мягкой тканью.
Если возникает необходимость обезжирить электрод, то его протирают мягкой тканью, смоченной этиловым спиртом и затем несколько раз ополаскивают дистиллированной водой и протирают мягкой тканью.
При необходимости электрод регенерируют погружением на 2 часа в 2 %-ный раствор соляной кислоты и далее тщательно промывают дистиллированной водой.
11.1 Расчет свободной (Р) и общей (М) щелочности, мг/дм 3 эквивалента, рассчитывают по формулам
где V 1 — объем раствора соляной кислоты, пошедший на титрование до рН = 8,3 от исходного значения рН, см 3 ;
V 2 — объем раствора соляной кислоты, пошедший на титрование до рН = 4,5 от исходного значения рН, см 3 ;
N — концентрация раствора соляной кислоты, 0,1 моль/дм 3 эквивалента;
K — коэффициент поправки к концентрации раствора соляной кислоты;
V пр — объем пробы, взятый для анализа, см 3 .
11.2 За результат анализа Рср (свободной щелочности) и Мср (общей щелочности) принимают среднее арифметическое значение двух параллельных определений Р1 и Р2; М1 и М2
для которых выполняется следующее условие:
где r — предел повторяемости, значения которого приведены в таблице 2.
При невыполнении условия (6) могут быть использованы методы проверки приемлемости результатов параллельных определений и установления окончательного результата согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Расхождение между результатами анализа, полученными в двух лабораториях, не должно превышать предела воспроизводимости. При выполнении этого условия приемлемы оба результата анализа, и в качестве окончательного может быть использовано их среднее арифметическое значение. Значения предела воспроизводимости приведены в таблице 2.
При превышении предела воспроизводимости могут быть использованы методы оценки приемлемости результатов анализа согласно раздела 5 ГОСТ Р ИСО 5725-6-2002.
Таблица 2 — Значения пределов повторяемости и воспроизводимости при вероятности Р = 0,95
Предел повторяемости (относительное значение допускаемого расхождения между двумя результатами параллельных определений), r, %
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами измерений, полученными в разных лабораториях), R, %
источник
Методика определения щёлочности питательной воды и ее составляющих котловых вод, исходной и охлаждающей воды
Методика предназначена для определения общей щелочности питательной воды для котельных агрегатов.
Тема: Методика определения щёлочности питательной воды и ее составляющих котловых вод, исходной и охлаждающей воды
Методика предназначена для определения общей щелочности. Общая щёлочность воды Що – суммарная концентрация в воде растворимых гидроксидов и анионов слабых кислот HCO3 – CO2 за вычетом концентрации ионов водорода. (В котловой воде также – фосфатов и силикатов). Общую щёлочность выражают миллиграмм-эквивалентах на дм 3 .
Допустимые значения погрешности результатов определения щёлочности с доверительной вероятностью Р=0,95 приведены в таблице 1.1:
Таблица 1.1 — Допустимые значения погрешности результатов определения щёлочности
Определение щелочности воды основано на титровании воды кислотой в присутствии индикаторов: фенолфталеина, метилоранжа, смешанного состоящего из метиленового голубого и метиленового красного в определённых соотношениях. Значения рН, при изменении окраски этих, индикаторов таковы:
для метиленового оранжевого – 4,4;
Средства измерений, вспомогательные устройства, реактивы
Соляная или серная кислота, фиксанал;
Вода дистиллированная или конденсат;
Пипетки измерительные на 100см 3 ;
Колба мерная на 100, 1000см 3 ;
Колба коническая на 250см 3 ;
Бюретка для титрования на 25см 3 ;
Весы лабораторные общего назначения 1 и 2 классов точности;
К работе в лаборатории допускается персонал, который прошел инструктаж по ТБ (технике безопасности), теоретическую подготовку по новой профессии с обучением на рабочем месте 1 месяц, проверке знаний действующих правил техники безопасности и специальных инструкций.
При работе с концентрированными кислотами необходимо:
Работать под вытяжным шкафом.
Работать в защитных средствах (очки, фартук прорезиненный, перчатки).
Иметь нейтрализующие средства.
Кислоту лить в воду, а не наоборот.
При попадании кислоты на кожу необходимо:
снять кислоту тампоном ваты или бинта;
промыть поражённое место сильной струёй воды;
нейтрализовать 2%-ным раствором питьевой соды.
При попадании кислоты в глаза:
промыть сильной струёй воды;
нейтрализовать 0,5%-ным раствором питьевой соды;
отправить пострадавшего к врачу.
Разлитую кислоту засыпать немедленно песком, нейтрализовать известью, мелом или кальцинированной содой.
Требования к обслуживающему персоналу
К выполнению анализа допускаются персонал имеющий среднее, среднетехническое или высшее образование. При отсутствии специального химического образования необходимо пройти теоретическую подготовку по новой профессии с обучением на рабочем месте в течение месяца, изучить правила эксплуатации электрических станций, сдать экзамен и пройти дублирование в течение 2-х недель на рабочем месте.
Подготовка к проведению измерений
Выполнение анализа проводится при температуре 23 +/- 2 о С при атмосферном давлении.
Если в анализируемой воде присутствуют взвешенные вещества, то пробу необходимо отфильтровать.
Титрованный раствор соляной или серной кислоты 0,1н концентрации готовят из соответствующего фиксанала:
Раствор 0,01 концентрации готовят разбавлением 0,1н раствора. Каждый раствор переливают в склянку с присоединенной к ней бюреткой. Растворы устойчивы.
Раствор индикатора фенолфталеина 1%-ной концентрации: Растворяют 1г индикатора в 80 см 3 этилового спирта и доводят до 100 см 3 дистиллированной водой.
Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой. Для повседневного расхода часть раствора индикатора отливают в капельницу.
Раствор индикатора метилового оранжевого 0,1%-ной концентрации: растворяют 0,1г индикатора в мерной колбе вместимостью 100 см 3 в 80 мл горячей дистиллированной воды;
после охлаждения доводят объём до метки дистиллированной водой. Тщательно перемешивают.
Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой. Для повседневного расхода часть раствора индикатора отливают в капельницу.
Раствор смешанного индикатора готовят смешиванием равных объёмов раствора индикатора метилового красного и метиленового голубого.
Раствор индикатора метилового красного: растворяют 0,2 г метилового красного в 100 см 3 этилового спирта. Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой.
Раствор индикатора метиленового голубого: Растворяют при слабом нагревании 0,1 г метиленового голубого в 100 см 3 этилового спирта. Раствор устойчив, его хранят в склянке с хорошо закрывающейся пробкой.
В коническую колбу вместимостью на 250 см. куб. пипеткой или мерным цилиндром отбирают 100см 3 анализируемой воды прибавляют индикатор и титруют раствором соляной или серной кислоты.
Титрование выполняют 0,1 н раствором кислоты из обычной бюретки, если щёлочность анализируемой жидкости превышает 1мг-экв/дм 3 . Титрование выполняют из микробюретки и применяют 0,01 н раствор кислоты, при определении щелочности меньше 1мг-экв/дм 3 .
При титровании в присутствии фенолфталеина (5-7 капель) первоначальная розовая или красно-малиновая окраска, раствора должна полностью исчезнуть.
При титровании в присутствии смешанного индикатора (3-5капель) первоначальная зелёная окраска раствора в эквивалентной точке изменяют в фиолетовую.
При титровании в присутствии метилового оранжевого (3-5капель) первоначальная желтая окраска переходит в апельсиновую (достижение красной окраски свидетельствует об излишке прибавленной кислоты – проба перетитрована).
Для получения более надёжных результатов рекомендуется проводить титрование двух параллельных проб анализируемой воды. Расхождение между параллельными определениями не должно превышать 0,1 см. куб. титрованного раствора кислоты.
Величина щелочности по взятому индикатору определяется по формуле:
а х 0,1 х 1000 а х 0,01 х 1000 х 1000
М= _____________________ М1= ________________________________
где М – щёлочность, мг-экв/дм 3 ;
М1 – щёлочность, мкг-экв/дм 3 ;
а – расход кислоты на титрование со взятым индикатором, см 3 ;
V – объем воды, взятой для анализа, см 3 ;
0,1 и 0,01 – концентрации титрованных растворов кислот;
источник
Лабораторная работа №3
Взятие пробы воды для анализа
Для правильного суждения о качестве воды необходимо соблюдать следующие требования:
1. Брать пробы воды для анализа нужно из точно установленных мест, указанных в водном режиме котельной установи.
2. Если воду берут из трубопровода, то перед взятием пробы следует застоявшуюся воду слить в течение 2-3 минут.
3. Посуда, в которую берут пробу воды, должна быть чистой, ее следует 1-2 раза ополоснуть водой из-под крана, откуда берется проба.
4. Анализы качества котловой воды и теплого ящика проводятся ежесуточно, котельного танка (общая жесткость и содержание хлоридов) 1 раз в 5-7 суток. Полученные результаты фиксируются в журнале.
Проведение испытания
Водородный показатель (pH)
1.1 Метод определения и характеристики
Недородный показатель воды (pH, отрицательный десятичный логарифм концентрации водородных ионов) определяется двумя методами визуально-колориметрическим и потенциометрическим.
При визуально-колориметрическом определении, основанном на реакции ионов водорода с универсальным индикатором (ГД 24.031.120-91, РД 24.032.01-91), pH анализируемой воды определяют визуально сравнением окраски пробы с окраской образцов на контрольной шкале. Диапазон определяемых значений pH составляет 4,5-11,0 при точности анализа ±0,5 ед. pH.
Объём пробы для определения составляет 5 мл, продолжительность выполнения определения — не более 1 мин.
Принадлежности, реактивы и материалы
Определение выполняется с использованием оборудования из состава навесного ящика №1 СЛКВ, секция №2 «pH» или pH-метра типа pH-410 .
Реактивы:раствор индикатора универсального.
Принадлежности, материалы:контрольная шкала образцов окраски растворов для определения pH (pH 4,5; 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; 8,0; 8,5; 9,0; 10,0; 11,0); полимерная пипетка; пробирка колориметрическая с меткой «5 мл».
Отбор и хранение проб
Отбор проб воды и пара должен проводиться в соответствии с п. 9 настоящего руководства.
Для отбора проб используются бутыли из полимерного материала или стекла. Выполнение определений следует проводить как можно скорее и предпочтительнее на месте отбора пробы. Максимальный рекомендуемый срок хранение проб — не более 6 часов.
1.3 Выполнение определения
1) Ополосните колориметрическую пробирку несколько раз анализируемой водой. Налейте в пробирку анализируемую воду до метки «5 мл».
2) Добавьте полимерной пипеткой 3-4 капли раствора индикатора универсального и встряхните пробирку.
3) Проведите визуальное колориметрирование пробы. Для этого пробирку с пробой поместите на белое поле контрольной шкалы и, освещая пробирку рассеянным белым светом достаточной интенсивности, наблюдайте окраску пробы сверху вниз.
4)Определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение pH. При необходимости повторите определение.
2.1 Метод определения и характеристики
Щелочность воды — показатель, характеризующий содержание в воде соединений, способных реагировать с водородными ионами. К таким соединениям относятся гидроокиси щелочных металлов, карбонаты, гидрокарбонаты и фосфаты щелочных и щелочноземельных металлов, а также соли других слабых кислот.
Метод определения щёлочности является титриметрическим (РД 24.031.120-91, РД 24.032.01-91, РД 34.37.523.7-88). Определение щёлочности воды основано на титровании растворённых в воде щелочных соединений кислотой в присутствии индикаторов, меняющих свою окраску в зависимости от реакции среды. Метод определения щёлочности зависит от вида анализируемой воды и предполагаемого значения щёлочности.
Методом А определяется щёлочность исходной, известкованной, катионированной и питательной вод. Титрование проводят с индикаторами метиловым оранжевым и фенолфталеином при использовании в качестве титранта раствора соляной кислоты 0,1 моль/л. При этом, при титровании с фенолфталеином, определяется свободная щёлочность по фенолфталеину (ЩСВОБ), а при титровании с метиловым оранжевым — общая щелочность (ЩОБЩ). Величина ЩОБЩ условно характеризует суммарное содержание в воде бикарбонатов, карбонатов, гидратов, 2/3 ортофосфатов и гуматов, в то время как ЩСВОБ — гидратов, 1/2 карбонатов, 1/3 ортофосфатов и гуматов.
Методом Вопределяется общая щелочность котловой воды. Титрование проводят со смешанным индикатором для вод, имеющих значительную цветность, а также при титровании при электрическом освещении, при использовании в качестве титранта также раствора соляной кислоты 0,1 моль/л.
Методом С определяется щёлочность воды типа конденсата, т.е. при значении щёлочности менее 0,2 ммоль/кг экв. Титрование проводят со смешанным индикатором или с индикатором метиловым оранжевым, при использовании в качестве титранта раствора соляной кислоты 0,01 моль/л.
Данные по изменению окраски индикаторов в зависимости от pH среды приведены в табл. 3.2.
Отбор и хранение проб
Отбор проб воды и пара проводится в соответствии с требованиями.
Для отбора проб используются бутыли из полимерного материалаили стекла. Выполнение определений рекомендуется пропилить сразу после отбора проб.
Максимальный рекомендуемый срок хранение проб при охлаждении до 2-5°С — не более 24 ч.
Подготовка к определению
Подготовка к определению общей щелочности состоит в приготовлении израсходованного раствора соляной кислоты (0,01 моль/л). Потребитель готовит его самостоятельно, используя раствор соляной кислоты (0,1 моль/л) из состава лаборатории.
Жёсткость общая
3.1 Методы определения и характеристики
Метод определения общей жёсткости как суммарной массовой концентрации эквивалентов катионов кальция и магния — комплексонометрической, основан на реакции образования в щелочной среде (pH = 9) в присутствии индикаторов окрашенных внутрикомплексонных соединений катионов кальция и магния с трилоном Б (двунатриевой солью этилендиаминтетрауксусной кислоты). (РД 24.031.120-91, РД 24.032.01-91, РД 34.37.523.8-88).
В зависимости от предполагаемого значения жёсткости, опредение выполняется тремя методами.
Метод А— титриметрический.Определяется жёсткость природной, известковой и коагулированной воды при величине более 0,1 °Ж. При титровании используется раствор индикатора хром темно-синего и в качестве титранта — раствор трилона Б 0,05 моль/л экв.
Метод Б— титриметрический.Определяется жёсткость любых вод при величине в диапазоне 0,02-0,1 °Ж. При титровании используется раствор индикатора хром тёмно-синего и в качества титранта раствор трилона Б 0,005 моль/л экв.
МетодС — визуально-колориметрический.Определяется жёсткость вод при величине менее 0,02 °Ж. Особенностью данного метода, на первом этапе, является необходимость выбора пары индикатор — буферный раствор, которая для данной исходной (катионированной) воды обеспечивает оптимальный переход окраски от розового к синему, что является индивидуальной особенностью данной исходной воды.
Сравнение окраски анализируемой воды с окраской эталонных растворов позволяет определить фактическое значение жёсткости с чувствительностью 0,001-0,002 °Ж.
Индикаторы кислотный хром тёмно-синий и эриохром чёрный Т образуют с катионами солей жёсткости непрочные окрашенные соединения красного цвета. При добавлении в воду с подобными окрашенными соединениями раствора трилона Б в точке эквивалентности происходит их полное разрушение, при этом раствор становится синим.
В присутствии ионов цинка или меди (неотчётливый переход окраски) определение жёсткости проводят с добавлением раствора сульфида натрия, связывающего эти катионы в нерастворимые сульфидные соединения.
Влияние ионов марганца, приводящее к быстрому обесцвечиванию окраски, устраняют добавлением к пробе раствора солянокислого гидроксиламина.
Объём пробы для анализа составляет, в зависимости от метода, от 10 до 100 мл, продолжительность выполнения анализа — не более 15 мин.
Подготовка к определению
Подготовка к проведению анализа заключается в приготовлении расходных растворов из реактивов, входящих в состав лаборатории.
Буферные растворы следует приготавливать с использованием очищенной катионированной воды либо воды, применение которой не приводит к холостому окрашиванию пробы.
Очищенную воду, необходимую для проведения анализа, приготавливают по ОСТ 34.70.953.2-88, либо используют набор для приготовления очищенной воды.
Отбор и хранение проб
Отбор проб воды и пара должен проводиться в соответствии требованиями.
Пробы анализируемой воды следует отбирать в стеклянные бутыли или полимерные бутыли с пробками. Допускается хранение пробы до 24 ч без консервации.
3.4 Выполнение определения
Метод А. Определение общей жёсткости воды более 0,1 °Ж
1. Налейте анализируемую воду в коническую колбу вместимостью 250 мл до метки «100 мл».
2. Добавьте полимерными пипетками 1 мл аммиачного буферного раствора, 7 капель раствора индикатора кислотного хрома тёмно-синего.
3.Медленно титруйте пробу раствором трилона Б (0,05 моль/л экв.), используя бюретку или стойку-штатив с мерной пипеткой вместимостью 10 мл со шприцем-дозатором, до отчётливого изменения цвета с розового на синий.
Примечание.При нечётком переходе окраски или обесцвечивании пробы определение повторите с добавлением к пробе 0,5 мл раствора сернистого натрия для устранения мешающего действия ионов меди и цинка либо трёх капель раствора солянокислого гидроксиламина для устранения мешающего действия соединений марганца.
4Рассчитайте общую жёсткость (Жобщ) в °Ж по формуле:
ЖОБЩ =V × 0,5
На титрование 100 мл пробы воды израсходовано 3,5 мл раствора трилона Б (0,05 моль/л экв.). Общая жёсткость будет составлять:
ЖОБЩ = V × 0,5 = 3,5× 0,5 = 1,75°Ж
4.1 Метод определения и характеристики
Содержание хлоридов (массовая концентрация хлорид- иона) определяется методом аргентометрического титрования (РД 24.031.120-91, РД 24.032.01-91). Определение основано на титровании хлорид-ионов раствором нитрата серебра при pH 5,0- 8,0, в результате чего образуется суспензия практически нерастворимого хлорида серебра. В качестве индикатора используется хромат калия, который реагирует с избытком нитрата серебра с образованием хорошо заметного оранжево-бурого осадка хромата серебра.
Объём пробы для анализа — см. табл. 12, продолжительность выполнения анализа — не более 5 мин.
Отбор и хранение проб
Отбор проб воды и проводится в соответствии с требованиями.
Для отбора проб используются бутыли из полимерного материала или из стекла. Допускается хранение пробы I мес. без консервации.
В зависимости от предполагаемого содержания хлоридов отбираются пробы для анализа в количествах согласно табл. 12.
На титрование 10 мл пробы котловой воды израсходовано 1,1 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов составит:
мг/л.
На титрование 10 мл пробы воды израсходовано 0,02 мл раствора нитрата серебра (0,05 моль/л экв.). Величина израсходованного на титрование объёма раствора нитрата серебра свидетельствует о том, что концентрация хлорид-ионов меньше предполагаемой.
мг/л.
Так как предполагаемая концентрация хлорид-иона оказалась меньше 4,0 мг/л (см. табл. 3.3), на анализ повторно отбирается проба объёмом 6000 мл, которая упаривается до 150 мл (в 40 раз). На титрование упаренной пробы объёмом 150 мл израсходовано 9,5 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов в этом случае составляет:
мг/л.
На титрование 10 мл пробы воды израсходовано 4,82 мл раствора нитрата серебра (0,05 моль/л экв.). Величина израсходованного на титрование объёма раствора нитрата серебра свидетельствует о том, что концентрация хлорид-ионов больше предполагаемой.
мг/л.
Так как предполагаемая концентрация хлорид-иона оказалась Тоньше 700 мг/л (см. табл. 3.3), отобранная проба разбавляется дистиллятом в 10 раз, на анализ берётся объем 10 мл разбавленной пробы. На титрование отобранной пробы израсходовано 0,48 мл раствора нитрата серебра (0,05 моль/л экв.). Концентрация хлорид-ионов в этом случае составляет:
мг/л.
Вопросы для самоконтроля:
1. Дать определения понятиям: главный конденсат, вспомогательный конденсат, дистиллят испарительной установки, дренажи, добавочная вода, питательная вода, котельная вода, котловая вода, продувочная вода, охлаждающая вода.
2. Охарактеризовать основные показатели: Общее содержание примесей, Растворённые вещества, Взвешенные вещества, Остаток после прокаливания, Потеря при прокаливании, Концентрация водородных ионов, Кислотность, Щёлочность, Щелочное число, Общая жёсткость воды, Карбонатная жёсткость, Некарбонатная жёсткость, Cодержание хлоридов, Фосфатное число, Нитратное число, Содержание окислов меди и железа, Содержание кислорода, Содержание нефтепродуктов.
Лабораторная работа №3
Тема: ОПРЕДЕЛЕНИЕ КАЧЕСТВА КОТЛОВОЙ ВОДЫ
Цель:Определение качества котловой воды, изучение норм качества котловой воды, рекомендации по водному режиму.
В пароконденсатном цикле СЭУ с паротурбинной установкой (ПТУ) вода и пар циркулируют по замкнутому контуру, в котором могут быть различные утечки воды или пара, вызывающие периодическое или непрерывное восполнение контура циркуляции технической водой. Поэтому в СЭУ с ПТУ существуют специальные определения воды в различных точках циркуляционного контура:
• главный конденсат – вода после конденсации отработавшего пара на выходе из главного конденсатора;
• вспомогательный конденсат – вода после конденсации отработавшего пара из вспомогательных конденсаторов (после вспомогательных механизмов и теплообменных аппаратов);
• дистиллят испарительной установки – вода, полученная из морской путем её термической дистилляции;
• дренажи – конденсаты после паровых подогревателей топлива и общесудовых потребителей пара;
• добавочная вода – вода, подаваемая в циркуляционный контур для восполнения его в результате утечек (воды и пара);
• питательная вода – вода, подаваемая в паровой котёл для поддержания его паропроизводительности (так же, как и забортная вода, поступающая в камеру испарения водоопреснительной установки);
• котельная вода – питательная вода определённого химического состава, предназначенная исключительно для парового котла, находящаяся в танке котельной воды;
• котловая вода – вода, находящаяся в циркуляционном контуре котла;
• продувочная вода – котловая вода, удаляемая периодически или непрерывно из котла для уменьшения солесодержания в ней взвешенных частиц шлама;
• охлаждающая вода – вода, с помощью которой отводят теплоту через поверхность теплообмена системы охлаждения теплотехнического объекта.
Питательная вода судовых паровых котлов обычно состоит из конденсата отработавшего пара и добавочной воды. Добавочная вода может быть природной, полученной с берега и прошедшей соответствующую водообработку, или дистиллятом от испарительной установки забортной воды. В целом, добавочная вода составляет 2–5 % от общего количества питательной воды.
Вода является одним из лучших природных растворителей органических и минеральных веществ, а также газов. Поэтому она в результате круговорота в природе приобретает множество примесей в виде газов, взвешенных мелкодисперсных частиц и растворенных минералов различного происхождения. Конденсат отработавшего пара на морских судах чаще всего содержит примеси в виде продуктов коррозии трубопроводов или забортной воды при подсосах в трубных решётках конденсаторов, а также – нефтеостатков СЭУ (частицы жидкого топлива и смазочного масла). Поэтому питательной водой, например, для судовых вспомогательных паровых котлов может быть конденсат отработавшего пара или природная вода, содержащая в себе частицы песка и глины, а также растворенные накипеобразователи щелочно-земельных металлов (Ca2+ и Mg2+), такие как бикарбонаты, сульфаты, хлориды и силикаты, а также коррозионно-активные газы – кислород, хлор и углекислый газ.
Поступление в котловую воду любых вышеперечисленных примесей является нежелательным, т. к. это приводит к появлению накипных отложений и коррозии на поверхности нагрева, что увеличивает расход топлива и снижает надежность котельных установок и эффективность их эксплуатации.
В СДВС с высокотемпературной системой охлаждения вышеуказанное также имеет место. Поэтому на морских транспортных судах системы охлаждения ДВС обычно низкотемпературные и двухконтурные. В первом контуре циркуляции для охлаждения СДВС обычно применяют водные растворы ингибиторов коррозии, а во втором – проточную морскую забортную воду.
Техническая эксплуатация СЭУ невозможна без проведения соответствующего водного режима, предусматривающего контроль основных показателей качества воды (водоконтроля) и определенной технологии водообработки. Качество используемой в СЭУ воды в значительной мере определяет надёжность элементов СЭУ и объём трудозатрат на восстановление работоспособности оборудования. Выбор технологии водоподготовки определяется её эффективностью и экономической целесообразностью.
Основными задачами водоподготовки в СЭУ являются: создание условий для предотвращения процессов накипеобразования и коррозии на поверхности нагрева, а также исключение уноса солей с влажным паром из зоны кипения воды. Поэтому каждый инженер-судомеханик должен уметь определять основные показатели качества питьевой и технической воды, а также корректировать водные режимы и технологии водообработки в соответствии с инструкциями по технической эксплуатации судового оборудования.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник