Тисабри является одним из наиболее перспективных лекарственных препаратов моноклональных антител, применяющихся для лечения рассеянного склероза. Значимое снижение частоты обострений, снижение риска прогрессирования заболевания — повод, как для врачей, так и для пациентов, рассматривать натализумаб в качестве высокоэффективного препарата монотерапии РС.
Однако, несмотря на многообещающие перспективы, общепризнан весьма существенный фактор, ограничивающий применение препарата: риск развития в качестве побочного эффекта ПМЛ (прогрессирующей мультифокальной лейкоэнцефалопатии — демиелинизирующего заболевания, приводящего к тяжелой инвалидизации или смерти пациента).
Развитие ПМЛ связано с активизацией в условиях иммунодефицита вируса JCV (JC — вирус (вирус Джона Каннингема), названный в 1971 году по инициалам пациента, страдавшего ПМЛ).
JCV является широко распространенным вирусом, многие жители планеты (по некоторым данным более половины) сталкиваются с ним в какой-то момент жизни, но, при условии нормального функционирования иммунной системы вирус, как правило, остается безвреден. Однако, у людей с ослабленной иммунной системой, например, у пациентов, страдающих СПИДом, лейкемией, получавших иммуносупрессивную терапию или терапию моноклональными антителами (Тисабри) риск развития ПМЛ повышается.
Корпорацией Biogen (производитель Тисабри) совместно с Elan Corporation разработана тест-система для иммуноферментного анализа (ИФА), позволяющая определить наличие антител к вирусу JCV в крови человека. Иными словами, если ранее наличие вируса определялось в ликворе или собственно в ткани мозга, то теперь наличие антител к вирусу (как свидетельство того, что в какой-то момент времени этот вирус попал в организм человека, но инфекция не развилась) стало возможным определить с помощью специфического анализа крови.
Следует отметить, что отрицательный результат ИФА на наличие антител к JCV, как изолированный фактор, не свидетельствует о снижении риска развития ПМЛ т.к. с одной стороны сохраняется возможность инфицирования JCV, с другой — результат анализа может оказаться ложноотрицательным.
Специалисты определяют три основных фактора, значительно повышающих риск развития ПМЛ, как побочного эффекта терапии Тисабри:
- Наличие антител к вирусу JCV в крови пациента.
- Срок лечения Тисабри, превышающий 2 года.
- История иммуносупрессивного лечения (например, митоксантрон, азатиоприн, метотрексат, циклофосфамид, и т.д.).
Таким образом, на сегодняшний день оценка риска развития ПМЛ у пациентов, получающих терапию Тисабри, составляет:
| Срок лечения Тисабри¹ | Отсутствие иммуносупрес- сивного лечения (терапии иммуно- депрессантами) в истории болезни² | Иммуносупрессивное ле- чение (терапия иммуно- депрессантами) в истории болезни² |
| 1-24 месяцев | 1 / 1, 000 | 2 / 1, 000 |
| 25-48 месяцев | 4 / 1, 000 | 11 / 1,000 |
- Данные о лечении более 4 лет ограничены.
- Риск оценивался на основе предположений, что у 18% пациентов, получающих терапию Тисабри, лечение иммунодепрессантами в анамнезе, и что у 55% пациентов, получающих терапию Тисабри положительный результат на наличие антител к JCV.
- Предполагается, что количество ложноотрицательных результатов ИФА не превышает 3 %.
По данным на 4 января 2012 года во всем мире среди примерно 96 582пациентов, получавших Тисабри, зарегистрирован 201 случай ПМЛ.
источник
Прогрессирующая многоочаговая лейкоэнцефалопатия, вызванная вирусом JC, является демиелинизирующим заболеванием центральной нервной системы и характеризуется многочисленными поражениями головного мозга. Инфекция вызывается нарушением функции олигодендроцитов человеческим паповавирусом.
Данный вирус был идентифицирован как этиологический агент в 1967 году и назван вирусом JC в 1971 году по имени ученого Джона Каннингема, впервые выделившего вирус. Заболевание свойственно пациентам с ослабленным иммунитетом, а также больным СПИДом, лицам с гематологическими и лимфоретикулярными злокачественными опухолями, аутоиммунными ревматическими заболеваниями или пациентам, перенесшими трансплантацию органов. Кроме указанных категорий пациентов, вирус JC поражает также больных, проходящих иммунную терапию с использованием моноклональных антител (натализумаб, ритуксимаб) и других иммунодепрессантов, в том числе преднизона, циклофосфамида, метотрексата и циклоспорина.
Распространение заболевания
В 5% случаев болезнь поражает около 85% ВИЧ-инфицированных и является своеобразным индикатором СПИДа у этой категории пациентов. Возникает лейкоэнцефалопатия вследствие воспалительной реакции в мозге и образования множественных очагов воспаления. У многих пациентов фиксируется низкий уровень CD4 клеток.
Паповавирус в некотором роде можно представить как эндемическую форму полиомавируса. Около 90% здоровых людей имеют в своей крови антитела к этому вирусу, однако у остальных 10% наблюдается репликация вируса, то есть его распространение, умножение в организме. Когда пациент проходит высокоактивную антиретровирусную терапию, иммунная система становится в состоянии распознать субклиническую форму вируса JC.
Вирус, как полагают ученые, попадает в организм человека через дыхательные пути или перорально. После попадания он принимает латентную форму и локализуется в основном в почках, лимфоретикулярных тканях и головном мозге больного. На начальных этапах инфекция протекает бессимптомно. Существует определенный период размножения вируса без проявления клинических симптомов. Во время этой стадии JC возможно обнаружить только в моче. Под воздействием иммуносупрессии наступает репликация вируса, после чего вирус распространяется на головной мозг. С другой стороны, скрытая активация вирусного процесса может происходить уже непосредственно в мозгу. Исследования доказали, что частицы вируса попадают в центральную нервную систему с помощью лимфоцитов группы B.
Механизм действия вируса JC внутри человеческого тела
По данным исследователей, у трети пациентов из всех исследовательских подгрупп вирус JC был обнаружен в моче. У 43% он содержался в лимфоцитах, а у 63% — в плазме крови. У ВИЧ-инфицированных пациентов вирус в лейкоцитах был обнаружен только у 13% испытуемых, а в образцах плазмы – у 22% подопытных.
Продукты гена ВИЧ, в частности регуляторный белок Tat, могут особенным образом «активировать» вирус JC. Этот процесс обеспечивает дополнительный патогенный механизм, наряду с общей иммуносупрессией. Вирусная инфекция в олигодендроцитах является литической. Это означает, что в момент гибели одного олигодендроцита содержащиеся внутри клетки вирусы поражают соседние клетки, а далее процесс повторяется. Вирус заражает близлежащие клетки таким образом, что происходит прогресс демиелинизирующих поражений. Астроциты (нейроглиальные клетки), инфицированные вирусом, увеличиваются и принимают странный внешний вид (искажение ядер с увеличением или образованием нескольких ядер), в результате чего напоминают гигантские раковые клетки.
В США за период с 1998 по 2005 год было изучено 9675 случаев прогрессирующей многоочаговой лейкоэнцефалопатии. Статистика показала, что 82% случаев заболевания были связаны с ВИЧ-инфекцией. В Африке и Индии, например, низкий показатель диагностики этой болезни, но не потому, что там меньше ВИЧ-инфицированных, чем в США, а потому, что большинство случаев заболевания остаются неуточненными.
Клинические проявления
Пациенты с прогрессирующей многоочаговой лейкоэнцефалопатией (ПМЛ), как правило, на первых этапах болезни испытывают слабые, однако устойчивые симптомы, которые со временем переходят в хронические. Прежде всего, у больных ослабевают когнитивные функции, отмечаются заметные изменения в поведении, речи, двигательной активности. Больной, к примеру, может начать плохо видеть. Еще одно проявление мозговых нарушений – наличие постоянного тремора головы.
И хотя в названии заболевания фигурирует слово «многоочаговый», его появление сопровождается возникновением одноочаговой опухоли мозга. Интересно, что при процедуре магнитно-резонансной томографии мозга иногда отображаются поражения мозга в различных местах. В отличие от таких заболеваний, как церебральный токсоплазмоз или первичная лимфома, для которых характерен прогресс в течение нескольких часов или дней, вирус JC развивается в течение нескольких недель.
Среди наиболее распространенных симптомов вируса JC можно выделить такие:
- афазия;
- гемипарез;
- атаксия;
- корковая слепота;
- апраксия конечностей;
- нарушения деятельности, связанные с функцией задней части мозга (например, затылочных долей);
- тремор головы (возникает не во всех случаях заболевания).
Около 60% больных начинает испытывать затруднения при ходьбе, еще 30% проявляют признаки когнитивной дисфункции, а именно:
- ухудшение памяти, настроения;
- утрата способности концентрации внимания;
- агрессивность или чрезмерная чувствительность, плаксивость;
- подозрительность.
Вирус JC сопровождается нарушениями зрения, и этот симптом общий для всех больных, независимо от их иммунологического статуса. Все симптомы прогрессируют до наступления комы или вегетативного состояния.
Методы диагностики лейкоэнцефалопатии:
- компьютерная томография;
- магнитно-резонансная томография;
- поясничная пункция (спинного мозга);
- биопсия мозга.
При проведении диагностики отмечаются характерные для заболевания поражения мозга. Компьютерная томография может показать одиночные или множественные поражения в теменно-затылочной области головного мозга. Такие поражения, как правило, ассиметричны. Демиелинизирующие бляшки располагаются на подкорковых волокнах, но могут находиться также и в глубоких слоях серого вещества.
Тест ПЦР в некоторых случаях помогает избежать биопсии мозга, поскольку его правдивость составляет от 92 до 99%. По результатам биопсии можно судить о наличии и степени прогресса заболевания. Больше всего инфекция выражена в белом веществе, стволе мозга, мозжечке и отделах мозга, отвечающих за движение конечностей. Вирус JC поражает не только олигодендроциты и астроциты, но и зернистые клетки мозжечка. На снимках МРТ хорошо видно, как в мозгу располагаются микроскопические демиелинизирующие очаги. Еще одним признаком заболевания является наличие внутриядерных базофильных или эозинофильных вкраплений в олигодендроцитах.
Лечение и профилактика лейкоэнцефалопатии
К сожалению, в настоящее время утвержденных методов лечения заболевания не существует. Заболевание так или иначе приводит к летальному исходу. В зависимости от состояния иммунитета больного оно прогрессирует в большей или меньшей степени. Основным терапевтическим методом является антиретровирусная терапия несколькими классами препаратов. Чаще всего используют такие препараты как оланзапин, зипразидон, миртазапин, ципрогептадин и рисперидон. Одним из экспериментальных вариантов лечения являлся препарат Мефлохин, однако мнения ученых в вопросе его эффективности разошлись.
Профилактика заболевания заключается прежде всего в профилактике ВИЧ-инфекции. Поскольку ВИЧ-инфицированные наиболее рискуют заразиться вирусом JC, необходимо принимать меры по предотвращению распространения ВИЧ-инфекции. Прежде всего, это:
- контроль качества половой жизни;
- отсутствие половых связей с малознакомыми людьми;
- отказ от употребления наркотиков в любых формах, и от инъекционной формы употребления в особенности.
Летальный исход после постановки диагноза обычно наступает в течение 9 месяцев. В некоторых случаях больной живет чуть дольше (около двух лет).
По материалам:
John E. Greenlee, MD; Niranjan N Singh, MD, DNB Assistant Professor
of Neurology, University of Missouri-Columbia School of Medicine;
Pradeep C Bollu, MD Resident Physician, Department of Neurology,
University of Missouri-Columbia School of Medicine; National Institute
of Neurological Disorders and Stroke
источник
| вирус JC | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
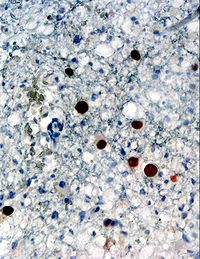 | |||||||||||||||||||||
| Иммуногистохимическое определение вирусного белка (JC окрашенных коричневый) в биопсии мозга ( глиальные клетки , демонстрирующие прогрессивный мультифокальной лейкоэнцефалопатия (PML)) | |||||||||||||||||||||
| классификация Вирус | |||||||||||||||||||||
| Группа: | |||||||||||||||||||||
| Признаки | По сравнению с Вашим обычным самочувствием были ли у Вас существенные изменения в любой из следующих ситуаций? | При ответе «ДА» получить описание признака/признаков с примерами | Проведение тестов, документирование результатов | |
| ДА | НЕТ | |||
| 1. Имеются ли у вас какие-либо стойкие проблемы со зрением (снижение зрения или двоение в глазах)? Есть ли затруднения при чтении? | Исследование полей зрения и окуломоторики | |||
| 2. Имеются ли у вас какие-либо стойкие проблемы с речью или пониманием вашей речи другими людьми? | Выявление при разговоре с больным дисфагии и дизартрии. Попросить больного назвать несколько окружающих объектов и повторить многокомпонентные фразы | |||
| 3. Испытываете ли вы стойкую слабость в руках или ногах? | Верхняя проба Барре или тест с фиксацией вращения руки. Оценка способности поднять любую ногу, постукивание пальцами кистей или стопами. Тест на мышечную силу | |||
| 4. Вы заметили, что регулярно натыкаетесь на окружающие предметы или появились проблемы с почерком? | Попросить образцы почерка, провести специальные пробы (пальценосовая, коленно-пяточная, тандемная походка) | |||
| 5. Испытываете ли вы стойкие трудности в понимании речи окружающих? | Оценка способности выполнять серии команд | |||
| 6. Есть ли у вас стойкие проблемы с памятью или мышлением? | Запомнить 3 объекта в течение 1 мин с отвлечением. Оценка способности выполнять команды | |||
| 7. Испытываете ли вы какое-либо стойкое онемение или иную потерю чувствительности? | Исследование чувствительности с обеих сторон при уколах иглой | |||
При нейровизуализационных методах исследования (КТ и, прежде всего, МРТ) в головном мозге выявляются очаги демиелинизации, не соответствующие зонам кровоснабжения определённых ветвей церебральных артерий. Эти очаги крупные, с тенденцией к слиянию, вовлекающие преимущественно белое, хотя иногда и серое, вещество, гиперинтенсивные в режимах T2w и FLAIR, гипоинтенсивные в режиме T1w, не дающие масс-эффекта (на начальных стадиях) и не копящие контраст (в 5-15% случаев такое всё же возможно).
Основные характеристики типичных для ПМЛ очагов при МРТ головного мозга (используемые сокращения: T2W = Т2-взвешенный режим; FLAIR = режим инверсии-восстановления с подавлением сигнала от свободной жидкости; T1W = Т1-взвешенный режим; T1W+C = Т1-взвешенный режим с контрастным усилением)
В зависимости от распространённости очагов выделяют унилобарную (очаги локализуются в одной доле), мультилобарную (очаги локализуются в смежных долях) и распространённую формы ПМЛ.
Формы ПМЛ в зависимости от распространённости очагов поражения (источник: http://pmlconsortium.org/objects/images/healthcare-professionals_classification.jpg, в собственной модификации)
Наиболее частая локализация очагов – субкортикальное белое вещество полушарий (чаще – теменные и затылочные доли, реже – лобные), ножки мозжечка и мозолистое тело. Более редко встречается поражение прилежащих к средним ножкам мозжечка отделов варолиева моста и полушарий мозжечка. Изолированное поражение продолговатого мозга или полушарий мозжечка встречается крайне редко. Очаги могут располагаться и в структурах, представленных преимущественно серым веществом, таких как зрительный бугор (чаще) или базальные ядра (реже), где имеются также и миелинизированные волокна. Казуистически может встречаться изолированное поражение только серого вещества [10].
МРТ головного мозга в T2w-режиме 30-летнего ВИЧ-инфицированного пациента с ПМЛ. Обращают на себя внимание билатеральные асимметричные сливные Т2w-гиперинтенсивные очаги в белом веществе лобно-височных областей, базальных ганглиях, зрительных буграх и мозолистом теле (источник: http://2.bp.blogspot.com/-uEGfpnoEW_U/TyEWJtSmFdI/AAAAAAABDgA/yMLcLiJZUqE/s1600/PML+MRI.jpg)
МРТ головного мозга 68-летнего больного ПМЛ, развившейся на фоне хронического лимфоцитарного лейкоза в процессе успешного лечения по химиотерапевтическому протоколу+ритуксимаб. В течение 6 недель у пациента развилась правосторонняя гемиатаксия, после чего присоединились выраженное головокружение и рвота. При МРТ головного мозга в режиме FLAIR был выявлен гиперинтенсивный очаг в правой гемисфере мозжечка и правой ножке мозжечка (А, показан стрелкой), который выглядел гипоинтенсивным и не накапливал контраст на T1w-изображении (В, показан стрелкой). При ликворологическом исследовании была получена положительная ПЦР на JC-вирус. Ритуксимаб был отменён, назначен тетрациклический антидепрессант с норадренергическим и специфическим серотонинергическим действием миртазапин в дозе 15 мг ежедневно. Однако неврологическая симптоматика продолжала нарастать, присоединилась дисфагия; через 10 дней было выполнено повторное МРТ-исследование, показавшее увеличение размеров очага с распространением на левое полушарие мозжечка и ствол мозга в режиме FLAIR (C, показано стрелкой) без накопления контраста на T1w-изображении (D, показан стрелкой). Через 3 месяца после постановки диагноза ПМЛ больной скончался.
Поражение белого вещества начинается с подкорковых областей, т.к. там имеется наибольший кровоток, а затем эта зона может распространяться на глубинные отделы белого вещества – в семиовальный центр и перивентрикулярно, что, впрочем, встречается нечасто. Вовлечение внутренней и наружной капсул также нетипично для ПМЛ. При прогрессировании или инволюции очагов в центре их могут образовываться некротические полости или микрокисты [50].
Типичное прогрессирование МРТ-картины ПМЛ (источник: http://pmlconsortium.org/objects/images/healthcare-professionals_diagnosis_progression.jpg, в собственной модификации)
МРТ-особенности прогрессирования ПМЛ можно проиллюстрировать на описанном в литературе примере 46-летней пациентки, страдавшей рассеянным склерозом, которая в течение 2 лет получала терапию натализумабом [21]. На фоне лечения произошло ухудшение её состояния, выражавшееся в быстро прогрессирующей амнестической афазии и появлении сложных фокальных эпилептических приступов. Больной было выполнено МРТ-исследование головного мозга с динамическим исследованием через месяц. Результаты представлены на серии рисунков ниже.
МРТ-картина динамики ПМЛ у 46-летней больной рассеянным склерозом на фоне двухлетней терапии натализумабом. На аксиальных изображениях в режиме FLAIR, выполненных с интервалом в 1 месяц, виден труднодифференцируемый субкортикальный очаг гиперинтенсивного сигнала в левой теменно-затылочной области (А), который через месяц существенно распространился на левое полушарие, кроме того, появился очаг в правом полушарии (В).
МРТ-картина динамики ПМЛ у 46-летней больной рассеянным склерозом на фоне двухлетней терапии натализумабом. На сагиттальных изображениях в режиме FLAIR, выполненных с интервалом в 1 месяц, виден очаг гиперинтенсивного сигнала в левой теменно-височно-затылочной области (А), который через месяц существенно распространился на всё полушарие (В).
МРТ-картина динамики ПМЛ у 46-летней больной рассеянным склерозом на фоне двухлетней терапии натализумабом. На коронарных изображениях в режиме FLAIR, выполненных с интервалом в 1 месяц, виден очаг гиперинтенсивного сигнала в левой теменно-затылочной области (А), который через месяц существенно распространился на всё полушарие; кроме того, появился очаг в правой теменной доле (В).
МРТ-картина ПМЛ у 46-летней больной рассеянным склерозом на фоне двухлетней терапии натализумабом. На аксиальных изображениях в режиме T1 (А) и Т1 с гадолиниевым контрастом (В) не видно участков накопления контраста в теменно-затылочном гипоинтенсивном очаге слева.
Через 5 недель после проведения динамического МРТ-исследования больная была доставлена в бессознательном состоянии в отделение интенсивной терапии, где в экстренном порядке ей была выполнена КТ головного мозга, при которой была получена картина отёка мозга со смещением полушарий мозга под серповидный отросток, после чего через 3 дня больная скончалась.
КТ-картина терминальной стадии ПМЛ у 46-летней больной рассеянным склерозом на фоне двухлетней терапии натализумабом. Выраженный масс-эффект, сглаженность борозд больших полушарий, смещение полушарий мозга под серповидный отросток.
МРТ-исследование обладает и некоторой прогностической ценностью. В крупном клинико-патоморфологическом исследовании, проведённом в 1999г. [38] было показано отсутствие корелляции между выживаемостью пациентов с ПМЛ и такими МРТ-характеристиками, как размеры, локализация очагов, интенсивность сигнала, выраженность атрофии мозга и гидроцефалии. Кроме того, была выявлена сильная положительная связь риска смерти пациента с наличием масс-эффекта на исходной МРТ, а также с очагами, вовлекающими серое вещество подкорковых узлов. В другом исследовании было установлено, что чем более обширно поражение мозга, тем дольше живут пациенты с ПМЛ [46]. Уменьшение интенсивности сигнала на Т1 и FLAIR-изображениях указывает на благоприятное течение процесса (признаки лейкомаляции и формирующихся атрофических изменений), в то время как повышение интенсивности сигнала на FLAIR-изображениях в сочетании с нарастанием гипоинтенсивности в режиме Т1 свидетельствует о прогрессировании ПМЛ и плохом прогнозе [22].
Согласно «Рекомендациям по алгоритму выбора препарата и плану управления рисками терапии Натализумабом у пациентов с ремиттирующим рассеянным склерозом» [3], сформулированы требования к стандартному протоколу МРТ головного мозга при подозрении на ПМЛ:
Общие требования для всех изображений
- Напряженность магнитного поля МР-сканера ≥ 1,5 Tл.
- Толщина среза ≤ 5 мм, промежутки между срезами менее 1 мм.
- Сканирование всего головного мозга.
- Ориентация плоскости аксиального сканирования по линии, проведенной между двумя нижними точками мозолистого тела на срединном сагиттальном срезе-локализере (целесообразно использовать трёхплоскостной локализер для точности позиционирования всех срезов сканирования).
- Все аксиальные срезы следует проводить в идентичной плоскости с использованием идентичных параметров сканирования по толщине среза и промежуткам между срезами
- Использование внутривенного контрастного усиления (МР-контрастные препараты на основе гадолиния в стандартной дозировке в расчете на 1 кг массы тела пациента).
- Возможна замена 2D Т1-ВИ на импульсную последовательность 3D Т1-ВИ с обязательным использованием толщины среза 1-1,2 мм или протокола с изотропным вокселем (матрица 256х256, поле обзора (FOV) — 25 см. при толщине среза 1 мм), что позволяет уменьшить продолжительность проведения постконтрастной части МРТ.
Протокол МР-сканирования
- Трехплоскостной локализер.
- Т2-ВИ в аксиальной проекции.
- Т2-FLAIR-ВИ в аксиальной проекции (целесообразно с использованием режима подавления МР-сигнала от жира).
- Т2-FLAIR-ВИ в сагиттальной проекции или 3D Т2-FLAIR ВИ в сагиттальнойпроекции.
- Т1-ВИ в аксиальной проекции или 3D Т1-ВИ в аксиальной проекции с толщиной среза 1 мм (желательно с использованием протокола с изотропным вокселем).
- ДВИ в аксиальной проекции с толщиной среза 5 мм.
- Т1-ВИ после внутривенного введения МР-контрастного препарата с выполнением срезов в аксиальной, сагиттальной и фронтальной проекциях или 3D Т1-ВИ в аксиальной проекции (целесообразно с использованием протокола с изотропным вокселем) с толщиной среза 1 мм.
При ПЭТ в большинстве случаев обнаруживаются участки пониженного метаболизма. МР-спектроскопия выявляет в очагах повышенное содержание холина и лактата, снижение уровня N-ацетиласпартата и увеличение соотношения холин/креатинин [6].
Анализ ликвора на JC-вирус методом ПЦР является обязательным для подтверждения диагноза ПМЛ. Этот метод обладает высокой чувствительностью (72-92%) и специфичностью (92-100%), однако его отрицательный результат не исключает диагноза ПМЛ. Например, с внедрением ВААРТ нередкими стали отрицательные результаты ПЦР у больных со СПИД при характерных для ПМЛ симптомах и данных МРТ. Этот феномен объясняют возможностью подавления репликации вируса и снижением концентрации вирусной ДНК в ликворе на фоне восстановления иммунитета при антиретровирусной терапии. В результате чувствительность определения JC-вирусной ДНК с помощью ПЦР у этих больных снизилась до 58%. У больных рассеянным склерозом, получающих лечение натализумабом, при развитии ПМЛ имеется достаточный Т-клеточный иммунный ответ на JC-вирус, чем и объясняется низкая вирусная нагрузка в спинномозговой жидкости. Отрицательный результат ПЦР не исключен и при отсутствии ВААРТ вследствие возможного полиморфизма JC-вирусной ДНК. Известно также, что результат может оказаться отрицательным на ранних стадиях ПМЛ (поэтому рекомендуется повторное 1-2-кратное исследование, ликвор необходимо направлять в лабораторию в количестве 5 мл). В случае отрицательного результата ПЦР при наличии характерной клинической и МРТ-картины настоятельно рекомендуется проведение биопсии мозга.
Чувствительность и специфичность этого метода составляют 64–91 и 100% соответственно. В то же время нежелательные реакции при проведении биопсии встречаются в 2,9% случаев, а осложнения – в 8,4% [6]. Классической патоморфологической триадой ПМЛ является демиелинизация, «причудливые» астроциты и увеличение ядер олигодендроглиоцитов. Иногда применяются иммуногистохимические исследования с применением моноклональных антител к каким-либо участкам генома JC-вируса (например, к аминотерминальным участкам всех ранних белков вируса, или к большому Т-ангигену вируса).
Срез биоптата головного мозга больного ПМЛ, окрашенный гематоксилин-эозином. Чёрными стрелками показаны реактивные астроциты, зачастую имеющие «причудливую» форму. Голубыми стрелками показаны существенно увеличенные ядра олигодендроцитов, содержание частицы JC-вируса, которые придают им сиреневую окраску (источник: http://library.med.utah.edu/WebPath/jpeg2/AIDS060.jpg, в собственной модификации)
Электронная микрофотография ядра олигодендроцита, поражённого JC-вирусом, на которой видны округлые тёмные вирусные частицы (источник: http://library.med.utah.edu/WebPath/jpeg5/CNS177.jpg)
Результат иммуногистохимического исследования среза биоптата головного мозга больного ПМЛ. Видно множество положительно окрашенных клеток, содержащих геном JC-вируса.
Согласно рекомендациям экспертов Американской академии неврологии (AAN) [8], постановка диагноза ПМЛ возможна в трёх модальностях: возможный, вероятный и определённый.
Воспалительный синдром восстановления иммунитета (ВСВИ)
Хотя Т-клеточный иммунный ответ, направленный против JC-вируса, является благом при ПМЛ, быстрое тотальное восстановление иммунитета может обернуться для нервной системы отрицательной стороной. В частности, оно может вызвать ВСВИ (воспалительный синдром восстановления иммунитета), обусловленный резким повышением количества Т-лимфоцитов на фоне присоединения ВААРТ у больных СПИД или отмены иммуносупрессивных препаратов у ВИЧ-негативных больных. И если у ВИЧ-инфицированных больных сочетание ПМЛ с ВСВИ наблюдается приблизительно в 23% случаев [16], то после отмены иммуносупрессивных препаратов у ВИЧ-негативных больных (например, отмены натализумаба у больных рассеянным склерозом) частота развития ВСВИ превышает 50%. Факторами риска ВСВИ являются длительность и степень иммунодефицита, а также скорость восстановления иммунитета. У пациентов с рассеянным склерозом и натализумаб-ассоциированной ПМЛ ВСВИ развивается чаще, чем при СПИД, а клинические проявления его более тяжёлые. Это может объясняться тем, что при отсутствии изначального иммунодефицита у пациентов с рассеянным склерозом при отмене натализумаба происходит более быстрое поступление лимфоцитов из крови в ЦНС.
Крайне редко встречаются формы ПМЛ, исходно протекающие с выраженным воспалительным компонентом (масс-эффект, накопление контраста по периферии типичных для ПМЛ очагов). Следует помнить, что контрастирование очагов – это явление временное, поэтому при выполнении МРТ его можно и не успеть застать.
Сроки развития ВСВИ оцениваются в интервале от 1 до 104 недель после начала кАРТ у больных СПИД [45]. Что же касается сроков возможного развития ВСВИ у больных рассеянным склерозом, которым был отменён натализумаб (например, по причине выработки нейтрализующих антител к препарату или из-за развития ПМЛ), то необходимо отметить, что биологическая активность этого гуманизированного моноклонального антитела сохраняется в организме в течение 3 месяцев; в течение всего этого времени возможно дальнейшее прогрессирование ПМЛ, а также возврат блокированных ранее натализумабом на уровне гемато-энцефалического барьера лимфоцитов в ЦНС. В течение недель-месяцев сохраняется вызванный натализумабом лейкоцитоз в периферической крови, и до 6 месяцев – изменение соотношения CD4:CD8 в ликворе [42][43]. Как правило, для ускорения выведения натализумаба из организма используются плазмаферез или гемосорбция, однако в течение 3 недель после их проведения возможно развитие ВСВИ [29].
Выделяют асимптомный ВСВИ, ВСВИ с клиническими проявлениями и катастрофический ВСВИ. При ВСВИ с клиническими проявлениями происходит парадоксальное нарастание неврологического дефицита, а при катастрофическом ВСВИ– резкое ухудшение состояния, сопровождающееся отёком мозга, развитием комы и/или другими признаками вклинения. Прогноз при развитии ВСВИ неблагоприятный, летальность составляет более 50%.
Воспалительная природа очагов при ВСВИ объясняет накопление контраста при МРТ-исследовании. Но, хотя это является маркером развития ВСВИ, контрастирование очагов при проведении МРТ обнаруживается только у 56% пациентов. Таким образом, отсутствие накопления контраста при клиническом ухудшении не может исключить диагноз ВСВИ. Классические варианты МРТ-картины ВСВИ приведены на рисунках ниже.
МРТ-картина ВСВИ, развившейся у 40-летней больной СПИД, через 18 дней после начала кАРТ по поводу диагностировнной ПМЛ. В верхнем ряду – МР-томограммы головного мозга при обращении пациентки, ранее не получавшей антиретровирусной терапии, по поводу лёгкого когнитивного снижения и постепенно нарастающего левостороннего фациобрахиального пареза. На снимке в аксиальной проекции в режиме FLAIR (A) видны пятнистые гиперинтенсивные субкортикальные очаги, не дающие масс-эффекта. На снимке в режиме Т1w с усилением гадолиниевым контрастом (В) виден гипоинтенсивный очаг субкортикально в правой лобной доле, не копящий контраст. На основании положительной ПЦР на JC-вирус больной был поставлен диагноз ПМЛ и начата кАРТ. Через 18 дней состояние больной резко ухудшилось, с появлением левосторонней гемиплегии и дизартрии. На снимке в аксиальной проекции в режиме FLAIR (С) видно увеличение гиперинтенсивных субкортикальных очагов, с развитием масс-эффекта (сглаживание борозд правой лобной доли). На снимке в режиме Т1w с усилением гадолиниевым контрастом (D) видно очаговое накопление контраста билатерально.
МРТ головного мозга 35-летней больной ремиттирующим рассеянным склерозом, которая в течение последних 2 лет получала монотерапию натализумабом в связи с неэффективностью предыдущего лечения иммуномодуляторами. У больной развилась дизартрия, онемение и слабость левых конечностей. При МРТ головы в режиме FLAIR был выявлен гиперинтенсивный очаг в правой лобной доле, распространяющийся на мозолистое тело (А, показан стрелками), не накапливающий контраст на T1w-изображении (В, показан стрелками). Пациентке был поставлен диагноз ПМЛ и было проведено 5 сеансов плазмафереза через день. Тем не менее, симптоматика продолжала нарастать, и через 3 недели больной было выполнено динамическое МРТ-исследование, которое показало увеличение зоны поражения в режиме FLAIR с присоединением масс-эффекта в виде компремирования правого бокового желудочка (С, показано стрелками), без накопления контраста в режиме T1w (D, показано стрелками). Состояние больной продолжало ухудшаться и при МРТ головы, выполненном ещё через 3-5 недель, было выявлено дальнейшее увеличение гиперинтенсивного в режиме FLAIR очага с распространением на обе лобные и правую теменную доли, отёком мозга и нарастанием масс-эффекта по отношению к боковым желудочкам (E, показано стрелками) с участками слабого линейного накопления контраста в режиме T1w (F, показано стрелками), что характерно для ВСВИ.
При ВСВИ в воспалительном инфильтрате доминируют CD8+ Т-лимфоциты. Избыточная реакция CD8+-клеток, лишённых контроля со стороны CD4+-клеток, вероятно, представляет собой компонент патогенеза ВСВИ.
Гистологическая картина ВСВИ, развившейся у 45-летнего больного СПИД, после перенесённой ПМЛ (окраска гематоксилин-эозином, увеличение х20 (А) и х40 (В)). Видна лимфоцитарная инфильтрация вещества головного мозга, преимущественно в периваскулярных областях.
Что касается ликворологического анализа на JC-вирус методом ПЦР, то при ВСВИ он как правило даёт отрицательный результат, т.к. приток цитотоксических Т-лимфоцитов подавляет репликацию вируса и уменьшает вирусную нагрузку ниже порога её определения.
JC-вирусная гранулярно-клеточная нейронопатия
При этой форме JC-вирусной инфекции изолированно поражаются гранулярные клетки мозжечка (которые, кстати, составляют почти половину всех нейронов ЦНС); олигодендроциты остаются интактными. Впервые утрата гранулярного слоя мозжечка была описана в 1983г. и по наблюдениям авторов встречалась у 5% больных ПМЛ [39]. Впоследствии были опубликованы и другие работы, описывающие поражение гранулярных клеток мозжечка или присутствие JC-вируса в биоптатах мозжечка, однако, как обособленная форма JC-вирусной инфекции гранулярно-клеточная нейронопатия была описана лишь в 2005г. [30].
JC-вирусная гранулярно-клеточная нейронопатия может развиваться как самостоятельно, так и параллельно с классической формой ПМЛ. Она встречается не менее чем в 51% случаев ПМЛ, независимо от того, имеется или нет классическое поражение белого вещества мозжечка.
Недавно было установлено, что по крайней мере в некоторых случаях эта форма JC-вирусной инфекции может быть связана с инфицированием особым штаммом JC-вируса, несущим мутацию по типу делеции в гене VP1, кодирующем одноимённый капсидный белок вируса [19][20].
Клинически JC-вирусная гранулярно-клеточная нейронопатия проявляется подострым или хроническим развитием мозжечковой симптоматики – атаксии при ходьбе, дизартрии, нарушения координации движений.
В начале болезни МРТ не выявляет никакой патологии, позже выявляются атрофия мозжечка и гиперинтенсивные в Т2-режиме очаги серповидной формы, иногда – с феноменом «белого креста» (англ. hot—cross—bun (HCB) sign, симптом крестовой булочки), сходным с таковым при мультисистемной атрофии.
МРТ-картина JC-вирусной гранулярно-клеточной нейронопатии, развившейся у 52-летнего больного СПИД через месяц после начала кАРТ. На 3D-градиент-эхо-T1-взвешенных корональном и сагиттальном изображениях (А, В) выявляется атрофия мозжечка и моста (показаны стрелками). На аксиальном T2-изображении (С) виден симптом «белого креста», сходный с таковым при мультисистемной атрофии (показан стрелками). На аксиальном T2-изображении в режиме FLAIR (D) видны гиперинтенсивные очаги в мозжечке – признак ПМЛ (показаны стрелками) и средних мозжечковых ножках. При диффузионной тензорной магнито-резонансной трактографии (E) выявлено снижение фракционной анизотропии в понтоцеребеллярных поперечных волокнах (фракционная анизотропия – это величина, характеризующая «направленную» организацию структуры головного мозга, которая зависит от количества и ориентации проводящих путей (трактов) белого вещества)
Гистологическая картина биоптата мозжечка представлена скоплениями частиц JC-вируса в телах гранулярных нейронов.
JC-вирусная гранулярно-клеточная нейронопатия. Скопления частиц JC-вируса в гранулярных клетках при гистологическом исследовании биоптата мозжечка (показаны стрелками).
JC-вирусный менингит
Впервые случай менингоэнцефалита, ассоциированного с JC-вирусом, был описан в 1992г. у иммунокомпетентного ребёнка [13]. Следует заметить, что далеко не у всех больных менингитом проводится анализ ликвора на JC-вирус, поэтому точная частота этой формы неизвестна, имеются лишь отдельные публикации. С другой стороны, обнаружение JC-вируса методом ПЦР в ликворе больного менингитом не позволяет уточнить, является ли JC-вирусная инфекция первичной или служит лишь отображением реактивации JC-вируса на фоне какой-либо другой инфекции.
Клинически JC-вирусный менингит проявляется развитием менингеального синдрома, без очаговой неврологической симптоматики. Очаговых изменений не выявляется и на МРТ; возможно небольшое расширение желудочков мозга. Диагноз подтверждается положительной ПЦР на JC-вирус при исключении других нейротропных вирусных инфекций.
JC-вирусная энцефалопатия
JC-вирус в основном тропен к белому веществу головного мозга, однако возможно и первичное поражение серого вещества. Эта клиническая форма, получившая название «JC-вирусной энцефалопатии», была впервые описана в 2009г. [51] у ВИЧ-отрицательной пациентки с раком лёгкого в анамнезе, у которой подостро развилось тотальное когнитивное снижение и афазия, затем присоединился судорожный синдром, а через 4-5 месяцев после появления симптоматики наступила смерть. При МРТ-исследовании были выявлены множественные неконтрастируемые очаги, первоначально локализующиеся в полушарном сером веществе с последующим распространением на субкортикальные зоны. ПЦР ликвора на JC-вирус оказалась положительной. Диагноз был верифицирован гистологическим исследованием, при котором была выявлена фульминантная продуктивно-литическая инфекция корковых пирамидальных нейронов и астроцитов, сопровождающаяся ламинарным некрозом.
Следует заметить, что ввиду наличия в коре головного мозга миелинизированных волокон, на них может распространяться поражение при ПМЛ [34].
Многоочаговое поражение ЦНС с прогрессирующим течением характерно для многих заболеваний. Основой дифференциальной диагностики ПМЛ являются нейровизуализационные методы. Проведенное сравнение МРТ пациентов с ПМЛ и рассеянным склерозом показало, что крупные, сливные очаги, гиперинтенсивные в Т2-режиме при ПМЛ обнаруживаются в 74% наблюдений, тогда как при рассеянном склерозе – только в 2%; вовлечение глубокого серого вещества – в 31% по сравнению с 7%; серповидные очаги в мозжечке при ПМЛ встречались в 23% наблюдений и не выявлялись при рассеянном склерозе. Перивентрикулярное расположение очагов, обнаруживающееся при рассеянном слерозе в 89% наблюдений, при ПМЛ отмечены только в 9%, а характерные для рассеянного склероза «пальцы Доусона» (61%) лишь изредка встречаются при ПМЛ (2%) Помощь в дифференциальной диагностике с рассеянным склерозом может оказать и метод трансфер-магнитизации (переноса намагниченности), выявляющий в очагах признаки ремиелинизации, тогда как повреждение в очагах ПМЛ необратимо. Следует помнить, что при ПМЛ никогда не поражается зрительный нерв, образуются только ретрохиазмальные очаги, а также практически никогда не бывает спинальной симптоматики. Для очагов ПМЛ в отличие от очагов при рассеянном склерозе характерны следующие признаки [52]: 1) диффузное субкортикальное, а не перивентрикулярное поражение белого вещества; более частое вовлечение структур задней черепной ямки; 2) постоянное увеличение очага, ограниченного белым веществом; 3) отсутствие масс-эффекта даже при очень крупном очаге; 4) диффузное увеличение гиперинтенсивности в Т2-режиме – недавно вовлеченные зоны более гиперинтенсивны, чем ранее вовлеченные; 5) резкое нарастание гипоинтенсивности в изначально изо- или гипоинтенсивных в Т1-режиме очагах (что является плохим прогностическим признаком); 6) отсутствие накопления контраста даже в крупных очагах. При лечении натализумабом картина МРТ может отличаться. В одной серии наблюдения за 28 пациентами у 43% из них при постановке диагноза ПМЛ отмечалось накопление контраста [4]. Это предполагает, что имеется воспалительный ответ на применение натализумаба и не следует рассматривать появление новых контрастируемых очагов как обострение рассеянного склероза. Параллельно с очаговыми изменениями при ПМЛ нарастает атрофия головного мозга.
МРТ-картина начинающейся ПМЛ у 46-летней больной рассеянным склерозом на фоне двухлетней терапии натализумабом. На аксиальных изображениях в режиме FLAIR видны гиперинтенсивные субкортикальные очаги в левой теменно-затылочной области (А) и левой лобно-теменной области (В). Очаг на изображении А обусловлен рассеянным склерозом (обратите внимание на характерный рисунок «пальцев Доусона»), в то время как очаг на изображении В является проявлением ПМЛ. Следует заметить, что при ПМЛ МР-картина «пальцев Доусона» также может встречаться приблизительно в 2% случаев.
У больных СПИДом могут присутствовать и другие заболевания, поражающие белое вещество, которые можно принять за ПМЛ. К ним относятся болезни с мультифокальным поражением белого вещества, такие как энцефалиты цитомегаловирусной, токсоплазменной природы и ВИЧ-1–ассоциированная энцефалопатия. Неврологические проявления последней вариабельны и в целом называются ВИЧ-ассоциированным когнитивным расстройством (англ. аббревиатура HAND – HIV-Associated Neurocognitive Disorder). Очаги повреждения располагаются главным образом в подкорковом сером веществе и в базальных ганглиях, что, как полагают, является основой развития прогрессирующей подкорковой деменции, которая может быть выявлена при нейропсихологическом обследовании уже на ранней стадии. МРТ обнаруживает атрофию головного мозга и поражение белого вещества. У пациентов со СПИДом появление на МРТ асимметричных двусторонних, множественных очагов, вовлекающих подкорковое белое вещество при отсутствии общей атрофии головного мозга, говорит о развитии у них ПМЛ, тогда как диффузные симметричные двусторонние очаги, не захватывающие подкорковое белое вещество (U-волокна), и атрофия мозга свидетельствуют о ВИЧ-энцефалите (обычно он развивается на поздней стадии, но в 10% случаев может быть манифестацией этой инфекции [5]). Масс-эффект наиболее характерен для лимфомы и токсоплазмоза, однако может иногда наблюдаться и при ПМЛ.
МРТ-картина ВИЧ-ассоциированной деменции – наиболее тяжёлого варианта ВИЧ-ассоциированного нейрокогнитивного расстройства, режим FLAIR (инверсии-восстановления с подавлением сигнала от свободной жидкости). Наиболее характерными нейровизуализационными признаками этого востояния являются: 1) атрофия коркового серого вещества, особенно передней поясной извилины, латеральных височных областей, первичной сенсорной и моторной коры, теменных и лобных долей; 2) изменение мр-сигнала от глубинных зон белого вещества и его атрофия; в некоторых случаях наблюдается очаговое поражение субкортикального белого вещества, напоминающее картину ПМЛ; 3) волюметрическая редукция базальных ганглиев, обусловливающая нарушения моторики; 4) нарушения целостности белого вещества мозолистого тела и лучистого венца; 5) на более поздних стадиях – сливные симметричные билатеральные очаги в полушарном белом веществе, преимущественно перивентрикулярно и в семиовальных центрах, с относительной интактностью его субкортикальных зон и области задней черепной ямки. На представленном снимке обращают на себя внимание зоны гиперинтенсивного сигнала от перивентрикулярных и глубоких отделов полушарий, имеющие симметричный характер, что нехарактерно для ПМЛ и других вирусных демиелинизирующих поражений мозга. Такая картина наиболее типична для ВИЧ-ассоциированной деменции, хотя нередко наблюдаются и случаи асимметричного/диффузного распределения очагов в белом веществе в сочетании с выраженной атрофией коры и расширением боковых желудочков.
Дифференциальный диагноз между ПМЛ и ОНМК основан на более обширном поражении и несоответствии очагов зонам кровоснабжения головного мозга. Кровоизлияния, нехарактерные для ПМЛ, тем не менее были описаны при этом заболевании некоторыми авторами [2].
В литературе имеются сообщения о случаях перехода очагов ПМЛ с одного полушария на другое через мозолистое тело, что может имитировать картину лимфомы или глиобластомы [38][49].
Иногда необходимо проводить дифференциальную диагностику ПМЛ с одним из вариантов митохондриальных энцефалопатий – синдромом MELAS. Этот синдром клинически проявляется одним или несколькими из следующих признаков: эпилептические припадки, когнитивные нарушения, утомляемость, мышечная слабость, лактатацидоз (наиболее тяжёлая форма метаболического ацидоза) и инсультоподобные эпизоды (как с обратимой, так и с необратимой симптоматикой). Обычными проявлениями инсультоподобных эпизодов являются гемипарезы, гемианопсия или корковая слепота. На МРТ обычно обнаруживается поражение затылочных долей головного мозга с бóльшим вовлечением коры, нежели подкоркового белого вещества. Очаги поражения крупные, сливные, обычно асимметричные. В коре головного мозга при проведении МРТ в режиме Т1 может выявляться накопление контрастного вещества. На КТ можно видеть отложения кальция в бледном шаре и хвостатом ядре, что помогает правильной диагностике [40].
Острый рассеянный энцефаломиелит (ОРЭМ) – обычно монофазное заболевание, развитию которого часто предшествует какое-нибудь вирусное заболевание. ОРЭМ характеризуется острым началом с эпилептическими припадками и быстрым прогрессированием нарушения сознания до сомноленции и комы. Очаговая неврологическая симптоматика разнообразна. На МРТ выявляются множественные асимметричные двусторонние очаги, накапливающие контраст в режиме Т1. Повторное проведение МРТ через некоторое время выявляет отсутствие новых очагов и разрешение старых. Также могут обнаруживаться очаги в спинном мозге.
К настоящему времени не существует ни специфической профилактики, ни специфического лечения ПМЛ. Попытки поиска этиотропной терапии не увенчались успехом. Так, исследования показали неэффективность таких препаратов, как цидофовир (используется для лечения цитомегаловирусной инфекции), цитарабин (противоопухолевый препарат, использующийся при гематоонкологических заболеваниях, который показал свою активность против JC-вируса in vitro), миртазапин (тетрациклический антидепрессант, блокирующий 5-HT2a-рецепторы, через которые, как было показано в исследованиях in vitro, JC-вирус проникает в культивируемые клетки). Досрочно в 2013г. завершено мультицентровое клиническое исследование мефлокина (противомалярийного препарата, угнетающего репликацию JC-вируса в культуре клеткок in vitro) в средней дозировке 1500 мг/сут в течение длительного времени, в котором при промежуточном анализе эффективность препарата не была доказана [17].
Таким образом, в отсутствие этиотропной терапии, целью лечения ПМЛ становится обеспечение адекватного иммунного ответа организма на активацию JC-вируса. У ВИЧ-инфицированных пациентов она достигается назначением кАРТ. У ВИЧ-отрицательных пациентов прежде всего, по возможности, отменяют иммуносупрессивную терапию, что возвращает иммунной системе способность контролировать JC-вирусную инфекцию. Однако это можно сделать не всегда (например, у пациента после пересадки органа это может вызвать активацию реакции отторжения трансплантата; у гематоонкологических пациентов могут быть истощены возможности костного мозга или иммунодепрессант обладать настолько длительным эффектом, что иммунитет просто не успеет восстановиться). Поэтому наиболее перспективным методом в настоящее время представляется направленная активация клеточного иммунного ответа против JC-вируса, реализуемая, например, с помощью методики вакцинации дендритных клеток [33].
В большинстве случаев отмена иммуносупрессивной терапии или начало кАРТ позволяет восстановить иммунный контроль над JC-вирусом в ЦНС, однако, реакция иммунитета может оказаться настолько выраженной, что может привести к развитию ВСВИ. В таких случаях прибегают к лечению глюкокортикостероидами, ограничивающими повреждение инфицированных участков ЦНС. Наиболее практичным подходом считается такое восстановление иммунитета, которое не приводит к развитию ВСВИ. У пациентов с ремиттирующим РС и гематоонкологических пациентов это достигается с помощью плазмафереза, форсирующего выведение остатков иммунодепрессанта (напр., натализумаба), после которого ВСВИ развивается в период от нескольких дней до нескольких недель, после чего проводится пульс-терапия глюкокортикостероидами.
В данной статье будет рассмотрен протокол лечения ПМЛ, развившейся у пациента с рассеянным склерозом на фоне терапии натализумабом [3].
Следует помнить, что ранняя диагностика и лечение ПМЛ могут улучшить прогноз заболевания. При подтверждении диагноза ПМЛ основными мероприятиями должны стать отмена препарата и проведение терапии с целью восстановления иммунитета. Пациента немедленно госпитализируют в специализированные отделения многопрофильного стационара, где могут быть проведены МРТ-диагностика и курсы плазмафереза. Запланированных инфузий натализумаба таким пациентам больше не проводится, а назначается плазмаферез с целью ускорения выведения натализумаба из циркуляции. В настоящее время рекомендуется проведение 5 сеансов в объеме 1,5 л плазмы в течение 10 дней (1 сеанс в 2 дня). Уже после первых 3 сеансов концентрация натализумаба в крови падает на 70-80%, а после 5 сеансов снижается до субтерапевтического уровня. В том случае, если клинические проявления и МРТ-картина характерны для ПМЛ, а JCV в ликворе не выявлен, плазмаферез можно начать до лабораторного подтверждения диагноза ПМЛ.
В течение нескольких дней-недель после окончания курса плазмафереза у большинства пациентов развивается ВСВИ. Как правило, предположение о его развитии возникает в тех случаях, когда у пациентов с ПМЛ появляются признаки клинического ухудшения, что обычно, но не всегда, сопровождается накоплением контрастного препарата в очагах ПМЛ с масс-эффектом или без него при МРТ. Клиническое ухудшение – следствие локальной воспалительной реакции; проявляется оно в нарастании неврологических симптомов: возникновении гемипарезов, атаксии, нарушении речи и зрения, когнитивных/поведенческих изменений и судорог (зависит от области формирования ВСВИ). Возможны также тяжелые осложнения, включая кому и летальный исход. Такой «побочный эффект» избыточно резкого восстановления иммунитета купируется глюкокортикостероидной терапией. В настоящее время общепринято, что с профилактической целью её не применяют, а назначают только при наличии достаточных оснований утверждать, что у пациента развился ВСВИ. Лечение проводится в условиях отделения реанимации и интенсивной терапии по одному из утверждённых в настоящее время режимов: 1) прием преднизолона внутрь в дозе 1,5 мг на 1 кг массы тела в день в течение 2 недель с последующим уменьшением дозы в течение 2 месяцев; 2) внутривенное введение метилпреднизолона (1 г/сут в течение 3 дней) с последующим применением схемы приема преднизолона внутрь с постепенным уменьшением дозы в течение 2 месяцев; 3) внутривенное введение метилпреднизолона 1 г/сут в течение 7 дней.
В том случае, если на фоне уменьшения дозы стероидов наблюдается ухудшение клинической картины, которое расценивают как обусловленное сохраняющейся либо новой воспалительной реакцией, рекомендовано повторить курс терапии стероидами в высоких дозах.
До настоящего времени не получено результатов рандомизированных исследований, позволяющих ответить на вопрос: «Что делать после прекращения терапии натализумабом?» По данным группы экспертов из Германии (Krankheitsbezogene Kompetenznetz Multiple Sklerose), делать перерыв в лечении или вводить метилпреднизолон один раз в месяц нецелесообразно, в отличие от переключения на другую линию терапии. Для перевода на терапию финголимодом необходимо выдержать восьминедельный интервал, в то время как лечение глатирамера ацетатом или интерферонами бета можно начинать непосредственно сразу после отмены натализумаба [27]. Считается, что наиболее эффективен перевод на другие ПИТРС II линии (в отличие от «лекарственных каникул» и перевода на глатирамера ацетат/интерфероны-бета-1), такие как финголимод, алемтузумаб, диметилфумарат [3].
Несмотря на то, что глюкокортикостероиды при ВСВИ, развившемся на фоне начала ВААРТ, могут повысить риск развития оппортунистических инфекций, они также применяются в таких случаях. Что же касается перспективных препаратов для альтернативного лечения ВСВИ на фоне ВААРТ, то к настоящему времени предложено 2 направления такого лечения, которое, в отличие от глюкокортикостероидной терапии, селективно подавляет воспалительную реакцию в ЦНС, не затрудняя при этом восстановление иммунитета. Первое направление – ингибирование клеточной миграции. Обсуждается применение таких препаратов, как маравирок, натализумаб и финголимод. Маравирок – относительно недавно разработанный противовирусный препарат, относящийся к антагонистам хемокиновых рецепторов CCR5, необходимых для связывания ВИЧ с клеткой и для проникновения вируса внутрь неё. Селективно связываясь с хемокиновыми рецепторами CCR5, маравирок предотвращает проникновение тропного к данным рецепторам ВИЧ-1 внутрь клетки. Кроме того, рецепторы CCR5 участвуют в процессах миграции лимфоцитов к участкам воспаления, в т.ч. в ЦНС, поэтому их блокирование обусловливает иммуномодулирующий/противовоспалительный эффект маравирока. Поэтому включение этого препарата (в России он зарегистрирован под торговым наименованием «Целзентри» (Pfizer, Германия)) в схему ВААРТ может улучшать исходы ВСВИ [31] [26]. Натализумаб, хотя и несёт определённую степень риска, учитывая его способность провоцировать развитие ПМЛ, тем не менее, обладает способностью преграждать путь Т-лимфоцитам и моноцитам через гематоэнцефалический барьер в ЦНС и может быть рекомендован как альтернативный препарат в тяжёлых случаях ВСВИ. Разумеется, речь идёт о непродолжительном применении препарата в небольших дозах. Обсуждается также роль финголимода как альтернативного препарата для лечения ВСВИ. Являясь функциональным антагонистом сфингозин-фосфатных рецепторов, играющих ключевую роль в регуляции выхода Т-лимфоцитов из тимуса и лимфоузлов, финголимод может снизить повреждающее действие воспалительного процесса на ЦНС. Однако, имеется и оборотная сторона его применения: блокируя выход молодых Т-клеток из тимуса, финголимод может затормозить «вторую волну» восстановления Т-клеточного иммунитета на фоне ВААРТ; кроме того, финголимод по-разному влияет на рециркуляцию популяций Т-лимфоцитов (наивных, центральных клеток памяти и эффекторных клеток памяти), поэтому его потенциальный эффект будет зависеть от того, какая из этих популяций преимущественно вовлечена в развитие ВСВИ. Второе направление – ингибирование цитокинов. В настоящее время это направление широко применяется в лечении тяжёлых воспалительных заболеваний. Например, ингибирование фактора некроза опухоли-альфа (TNFα) показало высокую эффективность при ВСВИ на фоне криптококкомы [41] и при тяжёлой парадоксальной реакции, протекавшей с вовлечением ЦНС, на фоне начала противотуберкулёзной терапии [12]. Принимая во внимание важную роль TNFα в процессе образования гранулём, лечение ингибиторами фактора некроза опухоли-альфа (инфликсимаб, адалимумаб, этанерцепт) может оказаться достойной альтернативной мерой при ВСВИ, ассоциированном с криптококковой и туберкулёзной инфекцией. Кроме того, интенсивно изучается возможность применения искусственных антагонистов рецептора интерлейкина-1 (анакинра) и более специфичных антагонистов рецептора интерлейкина-6 (тоцилизумаб).
И, наконец, говоря о перспективных методах лечения (и профилактики) ПМЛ, безусловно, стоит упомянуть иммунизацию. Например, в 2014г. в Германии был выдан патент на метод пассивной иммунизации рекомбинантными JCV VP1-специфическими моноклональными антителами, полученными от В-клеток памяти доноров, выздоровевших от ПМЛ или ВСВИ. Эти антитела способны связываться как с антигеном VP1 неинвазивных форм, так и прототипов (инвазивных форм) JC-вируса. Другой способ пассивной иммунизации был предложен в работе, описывающей случай ПМЛ, развившейся после трансплантации стволовых гемопоэтических клеток и курса иммуносупресивной терапии по поводу реакции «трансплантат против хозяина» [7]: пациенту были успешно осуществены инфузии JCV-специфических цитотоксических Т-лимфоцитов, полученных из особым образом обработанных стволовых донорских мононуклеарных клеток периферической крови. Активная иммунизация JC-вирусной вакциной в настоящее время находится на стадии интенсивной разработки. Предложена пероральная вакцина, содержащая один и более антигенов JC-вируса, конъюгированных со специальным носителем для инициации специфического иммунного ответа в ЖКТ (запатентована в 2012г.); вакцина, состоящая из рекомбинантного CD4-Т-клеточного эпитопа капсидного белка VP1, адьюванта и рекомбинантного человеческого интерлейкина-7 для усиления JCV-специфического Т-клеточного иммунного ответа (запатентована в 2012г.) и вакцины, состоящие из интерлейкина-7 и JC-вирусоподобных частиц, представляющих собой конформационно изменённый в виде сферы капсидный белок VP1 (запатентованы в 2013г.). И, как уже было сказано выше, наиболее перспективным методом в настоящее время представляется направленная активация клеточного иммунного ответа против JC-вируса, реализуемая, например, с помощью методики вакцинации дендритных клеток [33].
К мерам профилактики развития ПМЛ относятся:
— как можно более раннее назначение ВААРТ больным СПИДом;
— тщательный отбор пациентов, для проведения терапии натализумабом (исключение пациентов с повышенным риском развития ПМЛ);
— непрерывный мониторинг состояния пациентов, получающих натализумаб (в частности, компания-производитель оригинального препарата натализумаба «Тизабри» – Janssen – разработала и регулярно обновляет «План управления рисками при лечении рассеянного склероза», в котором детально описаны все мероприятия в рамках такого мониторинга);
— информирование врачей и пациентов о достоинствах и недостатках терапии натализумабом;
— применение натализумаба только при условии, что при подозрении на ПМЛ можно провести МРТ в срочном порядке на том же (или идентичном) оборудовании, на котором была выполнена исходная МРТ;
— наличие высокопольного (1,5 Тл и выше) МР–томографа;
— ранняя диагностика ПМЛ с помощью определения ДНК JCV в ЦСЖ и назначение лечения, направленного на элиминирование натализумаба из циркуляции крови.
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
ВААРТ – высокоактивная антиретровирусная терапия
ВИ – взвешенные изображения
ВИЧ – вирус иммунодефицита человека
ВСВИ – воспалительный синдром восстановления иммунитета
источник
