Некоторые биохимические показатели крови коров в стойловый период
Данилов М.С.. кандидат ветеринарных наук
Восточно-Казахстанский государственный технический университет им. Д.Серикбаева.
Изучение изменений в системе метаболического гомеостаза коров в стойловый период имеет важное значение в поддержании их продуктивного и репродуктивного состояния (1,2).
Период стойлового содержания животных является одним из сложных для организма, т.к. наиболее насыщен стрессовыми воздействиями: недостаток солнечной инсоляции и моциона, действие потенциально-патогенной микрофлоры и повышенной загазованности животноводческих помещений, возможный недостаток в кормах витаминов, микро- и макроэлементов (3,4). У животных возникают нарушения обмена веществ, которые часто протекают без клинического проявления. Такую форму патологии можно выявить только путем биохимических исследований.
Целью настоящей работы было изучение биохимического профиля крови у коров в стойловый период. Исследования проводили на 9 коровах черно-пестрой породы, в возрасте 5-6 лет, принадлежащих крестьянскому хозяйству «Багратион-2». Продуктивность животных составляла 3-3,5 тыс. кг молока в год. Рацион животных состоял из сена разнотравного, силоса, концентрированных кормов, соломы и составлял 9-9,5 к.е. Коровы имели среднюю упитанность. Работа проводилась в зимний стойловый период 2007-2008 гг.
У животных в начале стойлового периода, его середине и после окончания исследовали гематологические и биохимические показатели. Определяли количество эритроцитов, лейкоцитов, гемоглобина, активность щелочной фосфатазы (ЩФ), аспартатаминотрансферазы (АсАТ), аланин-аминотрансферазы (АлАТ), содержание в крови холестерина, глюкозы, кальция, фосфора, железа, общего белка и его фракций.
При проведении исследований использовали диагностические наборы «Биола-тест Lachema » (Чехия), а также общепринятые в ветеринарной практике методы (5).
Результаты исследований анализировали с применением математической статистики при обработке экспериментальных данных в ветеринарии путем определения уровня вероятности Р при помощи таблицы Стьюдента (6).
В течение стойлового периода за животными осуществляли клинические наблюдения.
Результаты исследований показали, что при содержании в крови в пределах нормы эритроцитов и лейкоцитов отмечали повышение их количества к концу стойлового периода на 18% и 26,4% соответственно (таблица). В обоих случаях (Р
Морфологические и биохимические показатели крови у коров
Кальций – является основным элементом в строении костной ткани, крови, нервной и мышечной ткани.
Фосфор, так же как и кальций, основа костной ткани. Участвует в обмене жиров и углеводов. Данный элемент необходим для нормального развития микроорганизмов в рубце коровы.
«Недостаток кальция и фосфора в организме животных может привести к рахиту, остеомаляции, остеопорозу, остеофиброзу».
Белок (он же протеин) – главная составляющая всех живых клеток. Протеин участвует во всех жизненно важных процессах: размножении, росте, развитии, продуктивности, а так же является основным компонентом ферментов, гормонов и иммунных тел.
Как видите, роль белка в организме значима, более подробно о роли протеина и других элементов, мы еще поговорим в отдельных статьях на блоге.
Резервная щелочность – по сути это показатель кислотно-щелочного соотношения в организме.
«Количество двуокиси углерода (мл), которое может связать100 мл плазмы крови»
Снижение данного параметра говорит о сдвиге кислотно-щелочного равновесия в сторону ацидоза, повышение — в сторону алкалоза.
Каротин – является провитамином (биохимическим предшественником витамина А). Витамин А участвует в развитии и росте клеток, обеспечивает нормальное состояние слизистых оболочек, поддерживает зрительные функции.
Кетоновые тела – промежуточные продукты обмена веществ белков, жиров и углеводов, которые образуются в печени. Это бета-оксимасляная кислота, ацетоуксусная кислота, ацетон. Повышенный уровень таких веществ говорит о нарушении обмена веществ.
- кальций 2,5 – 3,13 ммоль/л
- фосфор 1,45 – 1,94 ммоль/л
- белок 72- 86 г/л
- каротин 0,4 – 1,0 мг%
- резервная щелочность 46 -66%
Отлично. У нас есть результаты анализов. Мы знаем, на что влияет каждый показатель. Осталось только решить – что с этим делать?
На мой взгляд, есть три варианта развития событий.
1. Постараться сбалансировать рацион, что на практике, практически нереально. Улучшать кормовую базу при заготовке силоса, сенажа, сена. Обратить внимание видовой состав трав (отдать предпочтение сахару или протеину).
2. Включить в рацион животных кормовые добавки, которыми заполнен наш рынок. Здесь только вопрос цены и качества. К примеру, поставщик примексов в мое хозяйство, разработал минеральную добавку, чтобы восполнить пробелы в рационе.
3. Попробуйте найти медикаментозный выход. К примеру, существует множество препаратов, которые содержат витамин А (карток, карсел, элеовит, карофертин, каролин и др). Почему бы вам таким способом не восполнить дефицит данного витамина?
Надеюсь, что данная статья будет для вас полезной. Занимайтесь профилактикой заболеваний в стаде и надои ваших буренок обязательно вырастут!
Кровь у коровы берут из ярёмной вены. Она проходит в области шеи. Перед забором крови животное не кормят, не дают воды. Корову фиксируют, чтобы она не сломала иглу шприца. В лаборатории проводят биохимический анализ:
- определяют уровень рН в крови. Он показывает количество кислоты и щёлочи в организме. У здоровой коровы он составляет 7,44 единицы. Норма говорит о том, что все внутренние органы работают нормально, никакой инфекции у животного нет, рацион питания сбалансирован. Норма резервной щёлочи – 66%,
- определяют гематокрит, количество эритроцитов в крови. Показатель в норме у КРС – 45%, 7,0 млн/мкл. Он означает, что в организме для доставки кислорода к органам достаточно красных кровяных телец,
- как работают лёгкие, хватает ли кислорода в крови для организма, показывает другой анализ, на гемоглобин. В норме он у КРС – 14%. Белок в крови соединяется с железом, которое удерживает кислород,
- аномальная форма гемоглобина – метгемоглобин. Он не способен доставлять кислород в клетки тканей. Завышенный показатель укажет на кислородное голодание организма. Его количество в норме – до 350 мкмоль/л,
- анализ крови коровы на лейкоциты указывает на развитие воспалительного процесса в организме. В норме уровень составляет – 9,1 тыс/мкл. Повышенный показатель говорит о том, что у коровы начинает прогрессировать опухоль,
- кетоновые тела необходимы для нормальной работы сердца, почек, головного мозга, мышц. Он синтезируется в печени. Нормальное количество – 6 мг. В процессе обмена веществ кетоновые тела способствуют выделению уксусной кислоты и ацетона. Их количество необходимо анализировать. Повышенный уровень указывает на диабет, большое количество сахара. Норма составляет – до 1,4 мг. Ещё одним соединением является бета-оксимасляная кислота. Её норма 4,6 мг.
С помощью биохимического анализа крови коровы определяют уровень свободных жиров и микроэлементов. Если показатели не соответствуют норме, то у КРС диагностируют нарушение метаболического процесса. Это явление приводит к костным заболеваниям, сердечно-сосудистым нарушениям, аномальным проявлениям в мягких тканях.
Уровень свободных жиров в норме – до 15,0 %. Если жиров выявлено больше, то это указывает на ожирение общего организма или отдельных внутренних органов. Корова может оставаться с нормальным весом, но сердце, печень или почки покрываются жировым слоем. Это проводит к дисфункции органов.
При нормальном уровне минеральных веществ у коровы в крови устанавливаются следующие показатели (мг):
- кальций – 9-13,
- фосфор – 4,5-7,5,
- каротин при стойловом содержании – 0,4-1,0
- каротин при пастбищном содержании – 0,9-2,8
Количество электролитов измеряется в ммоль/л:
Анализ проводится для того, чтобы выявить у животного нарушения обмена веществ, недостаток каких-либо полезных веществ в организме. С помощью этой процедуры можно вовремя заметить развитие лейкоза, определить, каким именно инфекционным заболеванием заразилось животное.
Кровь разносит по организму все полезные вещества, витамины и минералы. От того, насколько правильно и быстро осуществляется кровоток, зависит не только общее состояние животного, но и количество получаемого молока. 
Способов взять кровь у скота существует три. Они заключаются в получении образцов из яремной, молочной, хвостовой вены. Их нужно брать исключительно новой и стерильной иглой. Животное обязательно следует фиксировать в неподвижном положении, чтобы оно не травмировало само себя, не перевернуло пробирку. Перед процедурой нужно выстригать шерсть в области, где будет сделан укол, дезинфицировать поверхность раствором фенола, йодом или спиртом. На пробирке с образцом должен присутствовать порядковый номер коровы. Ёмкость ни в коем случае нельзя трясти.
Взятие крови из яремной вены является самым распространённым способом. Рекомендуется проводить процедуру рано утром, перед первой кормлением. Чтобы провести анализ нужно привязать голову бурёнки, зафиксировать её в неподвижном состоянии. Далее следует зажать вену в нижней трети шеи, потом вводить иглу под острым углом. Кончик иглы должен быть направлен к голове животного.
Плюсами такого способа являются:
- животное почти не травмируется,
- лёгкость произведения операции,
- быстрота проведения процедуры.

- сильное разбрызгивание крови,
- появление риска распространения инфекций, которые опасны не только для животных, но и для человека,
- сложность фиксации коровы в определённом положении,
- частое возникновение осложнений, которые проявляются в виде абсцессов, гематом,
- стресс у коровы, который может привести к снижению удоя.
Забор образца из молочной вены происходит только у взрослых коров. Упомянутые вены находятся сбоку от вымени, тянутся по брюху снизу. Они снабжают молочную железу кровью и необходимыми питательными веществами. Чем лучше развиты вены, тем больше молока даёт бурёнка. 
Положительными сторонами данного метода являются:
- доступная цена материалов, необходимых для проведения процедуры,
- высокая скорость сбора образца,
- меньшее разбрызгивание, чем при взятии образца из яремной вены.
Минусов у такого способа значительно больше, чем плюсов:
- высокий риск травмировать животное,
- контакт с кровью коровы,
- во время процедуры тёлка испытывает огромный стресс, потому что забор образца проводится в очень нежной зоне, которую животное постоянно оберегает,
- сложность проведения процедуры.
Данный способ получения образца крови у крупного рогатого скота устарел. Благодаря новым технологиям, методам и оборудованию такую процедуру проводят гораздо быстрее и легче, минимизируя риски для животного.
Из хвостовой вены брать образец наиболее безопасно. Сейчас всё более популярным становится использование вакуумных систем — это специально сконструированные пробирки, в которых уже присутствует нужный антикоагулянт и снижено давление, чтобы кровь плавно вытекала в ёмкость. 
Из явных положительных сторон этого метода можно выделить:
- полученный образец стерилен,
- риск образования сгустков в пробирке значительно снижен,
- не требуется фиксировать животное,
- очень высокая скорость проведения процедуры. Один ветеринар может за час взять до двух сотен образцов,
- крайне малый шанс возникновения побочных эффектов или травм у коровы,
- исключение непосредственного контакта с кровью,
- корова не испытывает стресса и привычный удой сохраняется.

- более высокая стоимость оборудования,
- низкая популярность упомянутого метода.
источник
Приветствую всех посетителей блога. Предлагаю вернуться к основам кормления. Что нужно знать для балансировки рациона коровам? Это не только химический анализ кормов, но биохимические показатели крови крс. В ходе исследований можно увидеть реальную картину обмена веществ у животных.
Если вы не знаете, что такое биохимические исследования проб сыворотки крови, обратитесь к своему ветеринарному врачу. У него наверняка есть похожий документ, который я выложил здесь ниже. Если нет, срочно с ветеринарной службой исследуйте кровь стада. Это даст ответы на многие вопросы.
Биохимический анализ крови – это метод лабораторный диагностики, который позволяет определить работу внутренних органов, получить информацию о метаболизме (обмене веществ) и выяснить потребность в макроэлементах.
Если вам сложно уловить суть, то попробуйте перевести данную проблему на самого себя.
Вы заболели, пошли в поликлинику, записались к врачу на прием. Что первым делом он просит вас сделать? Правильно! Сдать анализы.
Вот и в животноводстве все аналогично. Только необходимо работать на опережение. Увидев картину биохимии, зоотехник может подкорректировать рацион под потребность животного.
А за этим следует улучшение здоровья и, как правило, увеличение продуктивности.
Хочу отметить, что пробы крови, представленные в документе, взяты от проблемных коров. К примеру, у коровы по кличке Аура был кетоз. Данное заболевание подтвердило наличие кетоновых тел в сыворотки крови.
Правильнее будет взять пробы крови у нескольких физиологических групп:
- нетели
- коровы в фазу раздоя
- коровы второй половины лактации
- сухостой первой половины
- сухостой второй половины
Возьмите от каждой группы минимум 10 образцов проб.
В этом месяце я обязательно со своей ветеринарной службой возьму еще раз кровь на биохимию и обязательно поделюсь с вами итогами анализов. Поэтому рекомендую подписаться на свежую рассылку статей. Перейти на статью об новых итогах исследования можно по этой ссылке.
Кальций – является основным элементом в строении костной ткани, крови, нервной и мышечной ткани.
Фосфор, так же как и кальций, основа костной ткани. Участвует в обмене жиров и углеводов. Данный элемент необходим для нормального развития микроорганизмов в рубце коровы.
«Недостаток кальция и фосфора в организме животных может привести к рахиту, остеомаляции, остеопорозу, остеофиброзу».
Белок (он же протеин) – главная составляющая всех живых клеток. Протеин участвует во всех жизненно важных процессах: размножении, росте, развитии, продуктивности, а так же является основным компонентом ферментов, гормонов и иммунных тел.
Как видите, роль белка в организме значима, более подробно о роли протеина и других элементов, мы еще поговорим в отдельных статьях на блоге.
Резервная щелочность – по сути это показатель кислотно-щелочного соотношения в организме.
«Количество двуокиси углерода (мл), которое может связать100 мл плазмы крови»
Снижение данного параметра говорит о сдвиге кислотно-щелочного равновесия в сторону ацидоза, повышение — в сторону алкалоза.
Каротин – является провитамином (биохимическим предшественником витамина А). Витамин А участвует в развитии и росте клеток, обеспечивает нормальное состояние слизистых оболочек, поддерживает зрительные функции.
Кетоновые тела – промежуточные продукты обмена веществ белков, жиров и углеводов, которые образуются в печени. Это бета-оксимасляная кислота, ацетоуксусная кислота, ацетон. Повышенный уровень таких веществ говорит о нарушении обмена веществ.
- кальций 2,5 – 3,13 ммоль/л
- фосфор 1,45 – 1,94 ммоль/л
- белок 72- 86 г/л
- каротин 0,4 – 1,0 мг%
- резервная щелочность 46 -66%
Отлично. У нас есть результаты анализов. Мы знаем, на что влияет каждый показатель. Осталось только решить – что с этим делать?
На мой взгляд, есть три варианта развития событий.
1. Постараться сбалансировать рацион, что на практике, практически нереально. Улучшать кормовую базу при заготовке силоса, сенажа, сена. Обратить внимание видовой состав трав (отдать предпочтение сахару или протеину).
2. Включить в рацион животных кормовые добавки, которыми заполнен наш рынок. Здесь только вопрос цены и качества. К примеру, поставщик примексов в мое хозяйство, разработал минеральную добавку, чтобы восполнить пробелы в рационе.
3. Попробуйте найти медикаментозный выход. К примеру, существует множество препаратов, которые содержат витамин А (карток, карсел, элеовит, карофертин, каролин и др). Почему бы вам таким способом не восполнить дефицит данного витамина?
Надеюсь, что данная статья будет для вас полезной. Занимайтесь профилактикой заболеваний в стаде и надои ваших буренок обязательно вырастут!
источник

Для того чтобы как можно раньше выявить какие-либо отклонения в работе организма бурёнки, необходимо сдавать биохимический анализ крови.
Анализ проводится для того, чтобы выявить у животного нарушения обмена веществ, недостаток каких-либо полезных веществ в организме. С помощью этой процедуры можно вовремя заметить развитие лейкоза, определить, каким именно инфекционным заболеванием заразилось животное.
Кровь разносит по организму все полезные вещества, витамины и минералы. От того, насколько правильно и быстро осуществляется кровоток, зависит не только общее состояние животного, но и количество получаемого молока. 
Способов взять кровь у скота существует три. Они заключаются в получении образцов из яремной, молочной, хвостовой вены. Их нужно брать исключительно новой и стерильной иглой. Животное обязательно следует фиксировать в неподвижном положении, чтобы оно не травмировало само себя, не перевернуло пробирку. Перед процедурой нужно выстригать шерсть в области, где будет сделан укол, дезинфицировать поверхность раствором фенола, йодом или спиртом. На пробирке с образцом должен присутствовать порядковый номер коровы. Ёмкость ни в коем случае нельзя трясти.
Взятие крови из яремной вены является самым распространённым способом. Рекомендуется проводить процедуру рано утром, перед первой кормлением. Чтобы провести анализ нужно привязать голову бурёнки, зафиксировать её в неподвижном состоянии. Далее следует зажать вену в нижней трети шеи, потом вводить иглу под острым углом. Кончик иглы должен быть направлен к голове животного.
Плюсами такого способа являются:
- животное почти не травмируется;
- лёгкость произведения операции;
- быстрота проведения процедуры.
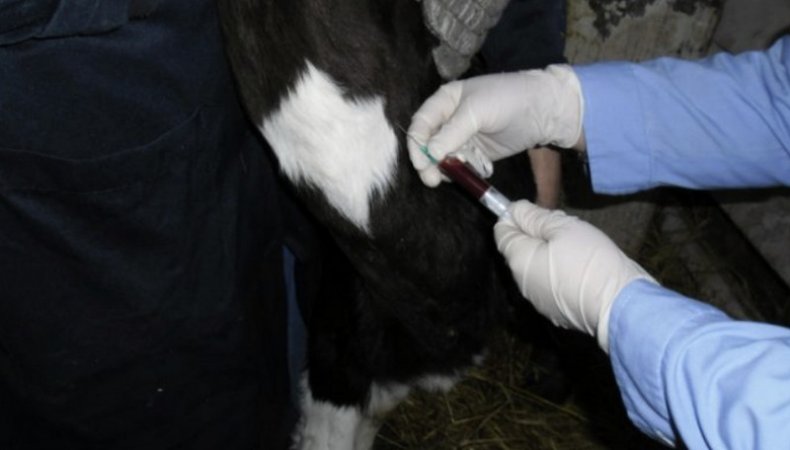
- сильное разбрызгивание крови;
- появление риска распространения инфекций, которые опасны не только для животных, но и для человека;
- сложность фиксации коровы в определённом положении;
- частое возникновение осложнений, которые проявляются в виде абсцессов, гематом;
- стресс у коровы, который может привести к снижению удоя.
Забор образца из молочной вены происходит только у взрослых коров. Упомянутые вены находятся сбоку от вымени, тянутся по брюху снизу. Они снабжают молочную железу кровью и необходимыми питательными веществами. Чем лучше развиты вены, тем больше молока даёт бурёнка. 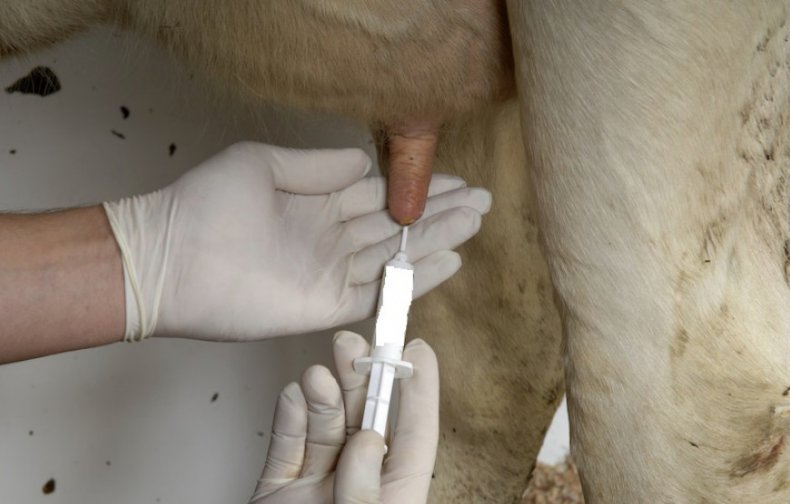
Положительными сторонами данного метода являются:
- доступная цена материалов, необходимых для проведения процедуры;
- высокая скорость сбора образца;
- меньшее разбрызгивание, чем при взятии образца из яремной вены.
Минусов у такого способа значительно больше, чем плюсов:
- высокий риск травмировать животное;
- контакт с кровью коровы;
- во время процедуры тёлка испытывает огромный стресс, потому что забор образца проводится в очень нежной зоне, которую животное постоянно оберегает;
- сложность проведения процедуры.
Данный способ получения образца крови у крупного рогатого скота устарел. Благодаря новым технологиям, методам и оборудованию такую процедуру проводят гораздо быстрее и легче, минимизируя риски для животного.
Из хвостовой вены брать образец наиболее безопасно. Сейчас всё более популярным становится использование вакуумных систем — это специально сконструированные пробирки, в которых уже присутствует нужный антикоагулянт и снижено давление, чтобы кровь плавно вытекала в ёмкость. 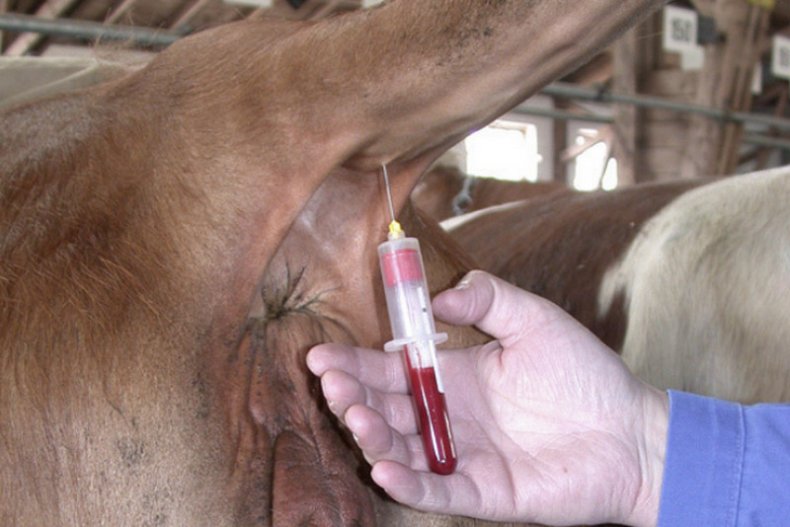
Из явных положительных сторон этого метода можно выделить:
- полученный образец стерилен;
- риск образования сгустков в пробирке значительно снижен;
- не требуется фиксировать животное;
- очень высокая скорость проведения процедуры. Один ветеринар может за час взять до двух сотен образцов;
- крайне малый шанс возникновения побочных эффектов или травм у коровы;
- исключение непосредственного контакта с кровью;
- корова не испытывает стресса и привычный удой сохраняется.

- более высокая стоимость оборудования;
- низкая популярность упомянутого метода.
При проведении биохимического анализа крови выделяют несколько основных показателей, которые являются наиболее важными при ведении молочного и мясного хозяйства. Чтобы лучше понимать, как должны выглядеть идеальные анализы, следует знать таблицу норм:
источник
Кислотная ёмкость по Неводову
Кислотная ёмкость по Коромыслову
Щелочная фосфатаза по Боданскому
Йод связанный с белком (СБИ)
Витамин «А»: стойловый период
6. Биохимические показатели мочи коров
Азот аммиака, % от общего азота мочи
Азот мочевины, % от общего азота мочи
Аминый азот, % от общего азота мочи
7. Некоторые показатели молока коров
Кислотность по Тернеру, оТ
Каротин, мг/л: в стойловый период
Вит.«А», мг/л :в стойловый период
Рациональная система выращивания молодняка крупного рогатого скота с учетом его биологических особенностей должна способствовать нормальному росту, развитию, формированию высокой продуктивности и крепкой конституции, продлению сроков хозяйственного пользования животных.
У ремонтных телок с раннего возраста должна быть развита способность к потреблению большого количества и более полному использованию грубых, сочных и зеленых кормов. Схемы выращивания молодняка основаны на широком использовании жидких молочных кормов, ЗЦМ, раннем приучении его к потреблению объемистых и концентрированных кормов. Применение таких схем позволяет значительно снизить затраты молока и повысить экономическую эффективность выращивания ремонтных телок. В этих условиях важно осуществлять полноценное и сбалансированное кормление, базирующееся на удовлетворении потребностей растущих животных в энергии, питательных и
биологически активных веществах по периодам роста.
В первые дни после рождения теленок обязательно должен получить молозиво,
в котором содержится повышенное (в сравнении с обычным молоком) количество белка, жира, минеральных веществ, витаминов, а также защитные антитела, создающие новорожденному теленку иммунитет против болезнетворных микробов.
В молочный период происходит значительная функциональная перестройка органов пищеварения, вырабатывается способность усваивать питательные вещества растительных кормов, усиливается белковый, минеральный и водный обмен. Этот период характеризуется одновременно интенсивным ростом органов и тканей, способностью животных давать высокие приросты. Интенсивность роста в этот период зависит от принятой в хозяйстве схемы кормления и целей выращивания молодняка. Планы роста телок молочных пород при умеренном выращивании приведены в таблице 1.
Планы роста телок молочных пород при
умеренном выращивании (живая масса, кг)
Нормы кормления для телок молочных пород составлены с учетом их возраста, живой массы и среднесуточных приростов. Они дифференцированы на выращивание коров с разной живой массой (400-450, 500-550 и 600-650 кг). Нормы составлены с месячным интервалом на весь период выращивания телок — до 28-месячного возраста (табл. 2, 3, 4,). Случку телок предусматривают в возрасте 17-18 мес, первый отел — в возрасте 26-28 мес.
Среднесуточные приросты телок с возрастом постепенно снижаются, а у нетелей в возрасте 25-28 мес. (последние месяцы стельности) они возрастают. Например, при выращивании коров живой массой 500-550 кг среднесуточные приросты в первые 6 мес. составляют 650-700 г, а затем с 7 -месячного до 12месячного возраста они снижаются до 550-600 г, с 13-месячного до 24-месячного возраста — до 450-500 г, а,в возрасте 25-28 мес. приросты увеличиваются до 500-550 г (при недостаточной упитанности нетелей — до 650-750 г). Повышение приростов в последние месяцы стельности связано с интенсивным ростом плода и созданием запасов питательных веществ в организме матери. Поэтому в этот период животных необходимо кормить более интенсивно.
Если в хозяйстве практикуется выращивание телок при умеренных приростах в первые месяцы жизни (450-500 г), то в последующие месяцы они должны составлять не менее 650-700 г, с тем чтобы к 12-месячному возрасту компенсировать временное отставание в росте и достигнуть запланированной живой массы.
2. Нормы кормления телок при выращивании коров мелких пород массой 400-450 кг, на голову в сутки
источник
В настоящее время интенсивные технологии в животноводстве занимают ведущее значение. Процесс эффективного молочного и мясного производства все стремительней отдаляет условия содержания животных от их естественной среды обитания. Сегодня уже смело можно сказать, что чем выше продуктивность животных, тем больше сбоев и срывов происходит из-за нарушения обмена веществ, в связи с особым значением кормления и содержания. Поэтому все без исключения специалисты животноводства должны участвовать в процессе не только производства продукции, но и создания комфортных условий пребывания животных на ферме.
Высокая продуктивность животных неразрывно связана с активизацией функционирования всех органов и систем организма. При этом уровень обмена веществ у некоторых животных настолько высок, что организм может работать на самоуничтожение. К сожалению, многие руководители хозяйств, специалисты-зооинженеры, ветеринарные врачи и даже ряд ученых этим пренебрегают. В наиболее распространенном понимании это выглядит так: «Животное имеет достаточно высокую продуктивность при имеющемся кормлении, качестве обслуживания и обработках– значит все нормально. Нужно еще поискать резервы экономии ресурсов». В результате таких настроений многие не могут понять, почему при погоне за удоем стремительно сокращается поголовье, почему коровы заканчивают третью лактацию на мясокомбинате с жировой дистрофией печени и т.д.
В большинстве случаев мы замечаем отклонения в здоровье, когда уже есть симптомы заболевания, а, значит, негативный фактор был, он оставил свой след в организме и, теперь, выдает ответную реакцию организма на его воздействие. Другими словами мы пропускаем, минимум два периода развития процесса – проникновение и распространение в организме. Разрабатывая наши рекомендации, надеемся, что вы, регулярно пользуясь биохимическими исследованиями крови, сможете на ранних стадиях неблагоприятного влияния своевременно отреагировать, классифицировать и принять меры к устранению воздействия.
Кровь является одной из главнейших связующих систем целостного организма. Она обеспечивает питание и дыхание всех органов и тканей, снабжает их необходимыми ферментами, гормонами, медиаторами и другими гуморальными веществами, без которых нормальное функционирование организма невозможно. У здоровых животных при нормальных физиологических условиях существует постоянство химико-морфологического состава и физико-химических свойств крови. Кроветворные органы чувствительно реагируют на различные физиологические и, в особенности на патологические, воздействия на организм изменением картины крови. Поэтому исследование крови имеет большое диагностическое значение.
Конечно, нужно заметить, что определенную ценность биохимические показатели имеют при внутренних незаразных болезнях, интоксикациях, но в большей степени отражают уровень кормления и обменные процессы. В связи с этим биохимические показатели не могут дать ответы на все вопросы, но при правильном понимании физиологических изменений становятся твердым основанием для принятия производственных решений.
ОТБОР И ПОДГОТОВКА ПРОБ КРОВИ
Для того чтобы провести биохимическое исследование необходимо правильно произвести отбор крови у животных.
Существует несколько вариантов взятия крови. Многие специалисты успешно их используют. Мы же остановимся на классическом (традиционном) способе.
У крупных животных кровь берут из яремной вены, расположенной в яремном желобе. Предварительно проводят антисептическую обработку – в месте вкола шерсть выстригают, поверхность кожи обрабатывают 70%-ным раствором спирта или 5% раствором йода.
Для взятия используют специальные инъекционные иглы заранее стерилизованные. Вкол проводят под углом 45 0 и во время набора крови иглу прижимают к стенке пробирки, чтобы избежать вспенивания.
Метод взятия крови у овец и коз такой же как и у коров.
У свиней кровь получают, отсекая кончик хвоста. У поросят оптимальным местом для взятия служит полая вена.
У птицы кровь берут из разреза гребня или сережек. У гусей и уток пункцию берут из мякоти ступней лапок.
Пробирки для отбора проб крови на исследования специалисты хозяйств могут получать в ветеринарной лаборатории или заранее готовить в условиях хозяйства, если такая возможность имеется.
Во время подготовки специальной посуды на одно животное запасают по 2 биологических пробирки, объемом не менее 20 мл, и по 2 центрифужных пробирки объемом 12 мл. В первую биологическую пробирку (20 мл) вносят 1%-ный раствор гепарина 2-3 капли или, если не определяется натрий в плазме крови, то для стабилизации используют лимоннокислый натрий. В результате полученную плазму можно исследовать на калий, натрий, каротин, витамины А и С.
Вторую пробирку оставляют без изменений, так как в ней будут получать сыворотку крови. В сыворотке крови определяют содержание общего белка, белковых фракций, мочевины, общих липидов, общего холестерина, общего кальция, йода неорганического, активность щелочной фосфатазы и др.
В одну из центрифужных пробирок вносят 0,5 мл вазелинового масла и каплю 1%-ного гепарина. После длительного центрифугирования 20-30 мин. уже в плазме определяют резервную щелочность. Во вторую центрифужную пробирку вносят 5 мл 20%-ного раствора трихлоруксусной кислоты. В дальнейшем из этой пробирки определяют глюкозу, неорганический фосфор и неорганический магний.
Для всех пробирок используются резиновые пробки, но в некоторых случаях допускаются пробки из ватных тампонов завернутых в марлевую повязку, при обязательном условии стерилизации и вертикальной транспортировки проб.
Таким образом, уже сама подготовка пробирок для взятия крови животных на исследование является трудоемкой и длительной. Поэтому в последнее время ее значительно упростили. Например, для биохимического исследования отбирают по 2⁄3 20 мл пробирки, а для гематологического и того меньше. В первую очередь это связано с разработкой в научно-исследовательских институтах специальных диагностикумов для определения биохимических компонентов с более мягкими требованиями пробоподготовки. Но и не последнее место занимает, конечно, сама точность и направление исследований. Если в каких то реакциях вам не нужны сотые и тысячные доли (не научные исследования) или вы уделяете большее внимание, каким то конкретным показателям, то, естественно, лучше упростить процедуру отбора.
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
Каротин является провитамином ретинола – витамина А. Содержится в растительных кормах, молозиве, рыбьем жире. Наибольшее значение имеет β-каротин. В тонком кишечнике и печени β-каротин превращается в витамин А. Основное депо каротина и витамина А – печень.
Витамин А способствует биосинтезу холестерина, ускоряет обмен фосфорных соединений, участвует в обмене веществ, повышает реактивность и резистентность, участвует в процессах иммуногенеза, повышении фагоцитарной активности лейкоцитов и выработке антител, стимулирует рост и развитие животных.
Количество каротина в сыворотке крови определяют спектрофотометрическим методом.
Принцип метода основан на щелочном гидролизе и экстракции витамина А и каротина из плазмы крови при помощи малолетучих растворителей и последующем спектрофотометрическом измерении поглощения света раствором при длине волны 328 нм для витамина А и 460 нм для каротина.
Материал для исследования – плазма крови.
Физиологические пределы: Содержание каротина в сыворотке крови повышается в летний период и снижается в зимне-стойловый период. Уровень каротина в сыворотке крови свидетельствует о величине поступления его в организм с кормами. Усвоение его и превращение в витамин А зависит от интенсивности обменных процессов в организме.
Количество каротина в сыворотке крови животных
источник
Чтобы оценить состояние здоровья коров, у них берут анализы: мочу и кровь. У ветеринара есть предписание, делать это регулярно, чтобы предупредить или выявить заболевания КРС. Исследованию подвергаются все животные в стаде.
Биохимический анализ крови выявляет нарушение обмена веществ у коров, развитие лейкоза, инфекционные заболевания. Анализируя результаты, назначается определённое лечение или даются рекомендации по изменению рациона питания.
Кровь у коровы берут из ярёмной вены. Она проходит в области шеи. Перед забором крови животное не кормят, не дают воды. Корову фиксируют, чтобы она не сломала иглу шприца. В лаборатории проводят биохимический анализ:
- определяют уровень рН в крови. Он показывает количество кислоты и щёлочи в организме. У здоровой коровы он составляет 7,44 единицы. Норма говорит о том, что все внутренние органы работают нормально, никакой инфекции у животного нет, рацион питания сбалансирован. Норма резервной щёлочи – 66%;
- определяют гематокрит, количество эритроцитов в крови. Показатель в норме у КРС – 45%, 7,0 млн/мкл. Он означает, что в организме для доставки кислорода к органам достаточно красных кровяных телец;
- как работают лёгкие, хватает ли кислорода в крови для организма, показывает другой анализ, на гемоглобин. В норме он у КРС – 14%. Белок в крови соединяется с железом, которое удерживает кислород;
- аномальная форма гемоглобина – метгемоглобин. Он не способен доставлять кислород в клетки тканей. Завышенный показатель укажет на кислородное голодание организма. Его количество в норме – до 350 мкмоль/л;
- анализ крови коровы на лейкоциты указывает на развитие воспалительного процесса в организме. В норме уровень составляет – 9,1 тыс/мкл. Повышенный показатель говорит о том, что у коровы начинает прогрессировать опухоль;
- кетоновые тела необходимы для нормальной работы сердца, почек, головного мозга, мышц. Он синтезируется в печени. Нормальное количество – 6 мг. В процессе обмена веществ кетоновые тела способствуют выделению уксусной кислоты и ацетона. Их количество необходимо анализировать. Повышенный уровень указывает на диабет, большое количество сахара. Норма составляет – до 1,4 мг. Ещё одним соединением является бета-оксимасляная кислота. Её норма 4,6 мг.
С помощью биохимического анализа крови коровы определяют уровень свободных жиров и микроэлементов. Если показатели не соответствуют норме, то у КРС диагностируют нарушение метаболического процесса. Это явление приводит к костным заболеваниям, сердечно-сосудистым нарушениям, аномальным проявлениям в мягких тканях.
Уровень свободных жиров в норме – до 15,0 %. Если жиров выявлено больше, то это указывает на ожирение общего организма или отдельных внутренних органов. Корова может оставаться с нормальным весом, но сердце, печень или почки покрываются жировым слоем. Это проводит к дисфункции органов.
При нормальном уровне минеральных веществ у коровы в крови устанавливаются следующие показатели (мг):
- кальций – 9-13;
- фосфор – 4,5-7,5;
- каротин при стойловом содержании – 0,4-1,0
- каротин при пастбищном содержании – 0,9-2,8
Количество электролитов измеряется в ммоль/л:
| № | Полезная информация |
|---|---|
| 1 | магний – 0,8-1,23 |
| 2 | натрий – 130-145 |
| 3 | калий – 5,1-6,4 |
| 4 | железо – 20-36 |
| 5 | марганец – 1,8-3,6 |
Чтобы подтвердить анализ крови, берут на исследование мочу и молоко у коровы. Недостаток каротина чаще всего бывает у молодняка. Нехватка витамина влияет на развитие костей, органов зрения, функции слизистых. Показатель не одинаков при различных условиях содержания животных.
Установлено, что лейкоз или лейкемия, относится к вирусным заболеваниям. Чаще всего вирус охватывает особей 4-7 лет. При развитии заболевания происходит изменение структуры крови. Это приводит к образованию злокачественных опухолей внутренних органов организма. При анализе крови на лейкоз обнаруживается повышенный уровень лейкоцитов, поэтому ещё одно название заболевания – белокровие. Показатель достигает 9 тыс. клеток на 1 мкл крови.
Вирус в организм животного попадает через ЖКТ, слизистые, через сперму при оплодотворении, через молозиво. Если поражённое животное не было выявлено и находилось вместе со стадом, то риск заражения других особей максимален. В организм телёнка вирус попадает с молозивом. На ферме объявляется карантин.
Против лейкемии КРС рекомендуют прививать вакцину. Она проводится в 2 этапа. На первом этапе вводятся препараты 6-меркаптурин, циклофосфамид. Для второго этапа применяют метотраксат. Вакцины вводят с промежутком в 3 дня.
Способ введения сложный эндолюмбальный. Иглу вводят в спинной мозг. Процедуру рекомендуют проводить в специальном помещении. Недопустимо вакцинировать КРС от лейкоза в условиях коровника или в открытых загонах.
Библиографическая ссылка на статью:
// Сельское, лесное и водное хозяйство. 2013. № 3 [Электронный ресурс]. URL: http://agro.snauka.ru/2013/03/935 (дата обращения: 07.02.2019).
Минжасов К.И., д.в.н., профессор, Мухаметова В.Д., к.б.н., Аубакирова А.К., к.в.н. ТОО «СевКазНИИЖиР»
В живом организме кровь играет первостепенную роль, выполняя транспортную, трофическую функции, доставляет к клеткам органов тела питательные вещества и кислород, удаляет продукты обмена и углекислоту. Через кровь обеспечиваются гормональная регуляция защитных функций, равновесие электролитов в организме [1].
Необходимым условием нормального существования организма, его органов и тканей является постоянство состава крови – гомеостаз. Различные нарушения жизнедеятельности органов и тканей влияют на состав крови, а изменение состава крови, в свою очередь, отражается на жизнедеятельности органов и тканей. Кровь черезвычайно тонко реагирует на различные потологические процессы, происходящие в организме, и нередко по изменению количества и составных элементов крови можно определить характер патологического процесса [2].
Таким образом, разностороннее исследование биохимического состава крови имеет большое диагностическое значение, поскольку помогает специалисту грамотно и достоверно определить общее состояние организма животного, объяснить корреляцию между показателями, прогнозировать исход заболевания, корректировать терапию, изучать влияние тех или иных лекарственных средств.
Проведя акушерско-гинекологическую диспансеризацию маточного поголовья в трех базовых хозяйствах: ТОО «Ульгули», ТОО «Северо-Казахстанская сельскохозяйственная опытная станция», ТОО «Зенченко и К» при общем поголовье животных – 615 голов, были отобраны в опыт коровы с нарушениями воспроизводительной функции (длительное отсутствие послеродовых половых циклов, больные эндометритами, маститами и др.) по 60 голов с каждого хозяйства.
В трех хозяйствах проводили взятие проб крови (60 голов×3 хозяйства = 180 проб) у животных с нарушением воспроизводительной функции и маститами. Хозяйства условно разделили по группам: I группа – ТОО «Ульгули», II группа – ТОО «Северо-Казахстанская сельскохозяйственная опытная станция», III группа – ТОО «Зенченко и К».
Результаты проведенных исследований оценки состояния белкового, фосфорно-кальциевого, витаминного обменов, кислотно-щелочного равновесия, функций печени представлены в таблице 1.
Из таблицы 1 видно явное отклонение некоторых биохимических показателей крови от норматива. В частности, содержание общего белка в крови больных животных было завышено, а во второй и третьей группах гораздо выше верхней границы нормы на 7 г/л и 26,5 г/л, соответственно, достигнув уровня 93,0 и 112,5 г/л, при норме 75,0 г/л. Гиперпротеинемию можно объяснить наличием в организме очага воспаления, в результате активации иммунологического процесса и повышенного образования иммуноглобулинов.
Альбумин – одна из фракций белка, при снижении уровня может указывать на поражения печени и наличие инфекционных процессов в организме. По результатам наших биохимических тестов показатель альбумина в трех группах был в пределах физиологической нормы (27,5-52,4 г/л): в I группе – 30,5 г/л, во II – 38,4 г/л, в III группе– 49,2 г/л.
В организме, в котором протекает воспалительный процесс, происходит уменьшение уровня кальция, что служит предпосылкой ослаблению родовых сил, нарушению кислотно-щелочного равновесия в организме.
В наших исследованиях уровень кальция был ниже нижней границы нормы 9,5 мг% во всех хозяйствах, группах: в I группе достиг – 6,8 мг%, во II – 5,4 мг%, в III группе– 8,8 мг%.
Показатель фосфора был в пределах нормы 2,0 ммоль/л во всех группах: в I группе достиг – 1,8 ммоль/л, во II – 1,6 ммоль/л, в III – 2,13 ммоль/л.
Щелочная фосфатаза – фермент, образующийся в костной ткани, печени, слизистой оболочке кишечника, плаценте, легких. Повышение активности щелочной фосфатазы указывает на ослабление воспроизводительной функции коров и свидетельствует о половых нарушениях. Результаты наших тестов подтверждают данные, уровень фосфатазы был значительно завышен во II группе – 145,6 МЕ/л, в III – 139,3 МЕ/л, против средней нормы 85,0 МЕ/л. В первой группе показатель был в пределах нормы – 40,4 МЕ/л.
Обмен веществ состоит из совокупности множества химических реакций, протекающих в организме. Течение этих реакций осуществляется с помощью биологических катализаторов-ферментов, одним из которых является класс трансфераз, катализирующих реакции гидролитического расщепления внутримолекулярных связей. Повышение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в сыворотке крови наблюдается при заболеваниях, связанных с разрушением клеток, заболеваниях печени, почечных некрозах.
В наших исследованиях отмечено резкое увеличение АЛТ на фоне сниженного уровня АСТ. Это является ярким подтверждением наличия процесса нагноение в органах половой системы самок.
При этом максимальное увеличение активности АЛТ, при норме 66,0 МЕ/л, на 23 % отмечено у животных II группы, достиг уровня 81,3 МЕ/л и на 39 % в III группе, достиг уровня – 92,1 МЕ/л. В первой группе показатель АЛТ был в пределах нормы – 41,4 МЕ/л. Активность АСТ была снижена в I группе на 71 % – 28,4 МЕ/л, во II на 71,6 %– 27,5 МЕ/л, в III группе на 20 % – 78,0 МЕ/л.
Таблица 1 – Биохимические показатели крови коров с нарушениями воспроизводительной функции
источник
Ориентировочные нормативы показателей крови у коров
Биохимические показатели крови коров осенью
Биохимические показатели крови коров в летний период
Биохимические показатели крови коров весной
Биохимические показатели крови коров в зимний период
| Показатели | Ед.измер. | Сухостойные | Новотельные | На 5-6мес. лактации |
| Общий азот | Мг% | 2883-3015 | 2898-2914 | 2757-2865 |
| Остаточный азот | « | 47-51 | 49,3-60,7 | 50,3-55,7 |
| Аминный азот | « | 2,68-3,32 | 2,9-3,5 | 3,41-4,19 |
| Мочевина | « | 19,3-22,3 | 14,3-17,5 | 14,3-17,3 |
| Мочевая кислота | « | 5,93-6,50 | 9,4-9,8 | 8,2-9,4 |
| Креатинин | « | 2,44-2,80 | 2,4-2,8 | 2,3-2,9 |
| Общий белок в.сыворотке крови | % | 7,8-8,39 | 8,35-9,1 | 8,35-8,57 |
| Бета-липопротеиды | Мг% | 298-350 | 360-412 | 360-412 |
| Общие липиды | « | 362-376 | 321-363 | 335-359 |
| Фосфолипиды | « | 79,0-95,4 | 99,5-112,3 | 70,2-88,0 |
| Холестерин | « | 77,3-79,5 | 68-72 | 75,9-80,2 |
| Сумма кетон. тел | « | 5,78-6,30 | 1,0-5,7 | 1,0-5,8 |
| Пируват | « | 1,33-1,81 | 1,7-2,3 | 1,43-1,93 |
| Глюкоза | « | 40-60 | 55-63 | 45-55 |
| Резервная щелочность | Об.% СО2 | 46-51 | 50-59 | 50-54 |
| ACT | Ед. | 112-118 | 142-156 | 127-143 |
| АЛТ | Ед. | 40,8-52,0 | 57,5-72,1 | 60,3-72,5 |
| Показатели | Ед. из-мер. | Сухостойные | Новотельные | На 5-6 мес.лактации |
| Общий азот | Мг% | 2913-3285 | 2742-2934 | 2818-3006 |
| Остаточный азот | « | 48-51 | 49-63 | 48-58 |
| Аминный азот | « | 3,5-6,0 | 3,4-6,0 | 4,1-6,0 |
| Мочевина | « | 10,6-3,20 | 13,25 | 32-45 |
| Мочевая кислота | « | 5,97-7,50 | 6,40-7,16 | 8,4-0-9,00 |
| Креатинин | « | 2,5-3,1 | 2,1-2,9 | 2,2-2,4 |
| Общий белок сыв.крови | % | 7,96-8,70 | 8,11-8,83 | 8,77-9,70 |
| Бета-липопротеиды | Мг% | 348-386 | 305-348 | 377-386 |
| Общие липиды | « | 374-469 | 352-497 | 343-405 |
| Фосфолипиды | « | 91-110 | 93-123 | 92-118 |
| Холестерин | « | 73,84 | 80-95 | 83-101 |
| Сумма кетон-х тел | « | 1,0-6,94 | 1,0-8,20 | 1,0-9,0 |
| Пируват | « | 1,7-1,91 | 1,11-1,23 | 1,20-1,56 |
| Глюкоза | « | 39-53 | 34-52 | 49-51 |
| Резервная щелочность | Об.% СО2 | 46-55 | 46-60 | 46-56 |
| ACT | Ед. | 97-102 | 104-117 | 83-96 |
| АЛТ | Ед. | 36-45 | 36-41 | 35-43 |
| Показатели | Ед. измер. | Сухостойные | Новотельные | На 5-6 мес.лактации |
| Общий азот | Мг% | 2751-3015 | 2691-2909 | 2667-2878 |
| Остаточный азот | « | 49-59 | 49-59 | 48-61 |
| Аминный азот | « | 3,1-4,1 | 3,4-4,4 | 3,5-3,9 |
| Мочевина | « | 22,6-30,0 | 21,6-25,0 | 19,1-31,0 |
| Мочевая кислота | « | 5,95-8,61 | 5,76-8,10 | 6,51-8,35 |
| Креатинин | « | 2,16-2,44 | 1,96-2,15 | 2,07-2,28 |
| Общий белок сыворотки крови | % | 8,2-9,1 | 8,5-9,1 | 8,5-9,0 |
| Бета-липопротеиды | Мг% | 328-329 | 300-316 | 316-336 |
| Общие липиды | « | 454-579 | 453-454 | 408-485 |
| Фосфолипиды | « | 98-110 | 101-108 | 99-112 |
| Холестерин | « | 60-96 | 88-126 | 112-123 |
| Сумма кетон. тел | « | 6,9-8,6 | 7,5-8,1 | 6,8-9,9 |
| Пируват | « | 1,67-3,65 | 3,1-5,2 | 2,6-4,3 |
| Глюкоза | « | 47-53 | 40-52 | 40,51 |
| Резервная щелочность | Об.% СО2 | 39-51 | 38-50 | 41-43 |
| ACT | Ед. | 75-110 | 70-102 | 76-97 |
| АЛТ | Ед. | 21-24 | 20-26 | 22-25 |
| Показатели | Ед. измер. | Сухостойные | Новотельные | На 5-6 мес.лактации |
| Общий азот | Мг% | 2792-2898 | 2632-2700 | 2600-2832 |
| Остаточный азот | « | 53-60 | 44-46 | 39,3-44,7 |
| Аминный азот | « | 3,2-4,0 | 3,7-4,9 | 3,0-3,4 |
| Мочевина | « | 30,2-33,4 | 22,0-30,0 | 23,7-26,3 |
| Мочевая кислота | « | 7,2-8,6 | 5,6-7,4 | 6,6-8,6 |
| Креатинин | « | 1,6-3,4 | 1,3-3,1 | 1,6-3,0 |
| Общийбелок сыв.крови | % | 7,9-8,7 | 8,1-8,2 | 8,4-8,8 |
| Бета-липопротеиды | Мг% | 245-273 | 221-243 | 247-279 |
| Общие липиды | « | 314-348 | 418-464 | 462-494 |
| Фосфолипиды | « | 59-64 | 69-77 | 77-84 |
| Холестерин | « | 58-62 | 71-82 | 62-72 |
| Сумма кетон. тел | « | 0,8-4,6 | 6,2-6,6 | 6,6-7,8 |
| Пируват | « | 2,87-3,93 | 2,74-4,06 | 2,29-3,91 |
| Глюкоза | « | 47,3-66,7 | 41,8-6,32 | 51-55 |
| Резервная щелочность | Об.% СО2 | 52-54 | 50-52 | 51,53 |
| ACT | Ед. | 41-47 | 30-36 | 34-43 |
| АЛТ | Ед. | 12,7-19,3 | 8,4-15,2 | 7,3-10,3 |
Дополнительные биохимические показатели крови, мочи и молока у клинически здоровых коров по сведениям литературы (ВИЖ, МГАВМБ, ВНИ-ИГРЖ, ВНИИФБиП и других) представлены в таблицах 5-7.
| Показатели | Исследуемый материал | Единицы измерения | Нормативные колебания |
| Билирубин | сыворотка | мг% | 0,01-0,30 |
| Кислотная ёмкость по Неводову | сыворотка | мг% | 420-600 |
| Кислотная ёмкость по Коромыслову | сыворотка | мг% | 300-400 |
| Щелочная фосфатаза по Боданскому | сыворотка | Ед.Боданск | 1,2-2,5 |
| Общий кальций | сыворотка | мкг% | 4,0-10,5 |
| Неорганический фосфор | сыворотка | мкг% | 4-7 |
| Медь | сыворотка | мкг% | 100-300 |
| Марганец | кровь | мкг% | 15-25 |
| Цинк | кровь | мкг% | 300-500 |
| Кобальт | кровь | мкг% | 5-9 |
| Йод общий | кровь | мкг% | 5-9 |
| Йод связанный с белком (СБИ) | кровь | мкг% | 4-5 |
| Каротин: стойловый период | сыворотка | мг% | 0,4-1,0 |
| пастбищный период | сыворотка | мг% | 0,9-3,0 |
| Витамин «А»: стойловый период | сыворотка | мкг% | 24-80 |
| пастбищный период | сыворотка | мг% | 40-150 |
Дата добавления: 2015-05-09 ; Просмотров: 1204 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Минеральные вещества и витамины, входящие в состав корма, являются для животных, важнейшими элементами питания. Недостаток и избыток их в рационах животных приносит животноводству значительный экономический ущерб за счет снижения продуктивности и плодовитости животных, вызывает заболевание и падеж, ухудшает качество продукции. Минеральные вещества и витамины в рационах должны поступать в организм животных в оптимальных количествах и соотношениях, строго в соответствии с потребностью высокопродуктивных животных. Они необходимы для роста и размножения животных, влияют на функции эндокринных желез, органов кроветворения, регулируют обмен веществ, принимают участие в биосинтезе белка, оказывают влияние на жизнедеятельность микрофлоры пищеварительного тракта и т.д.
Основным источником витаминов и минеральных веществ, для животных являются корма. В то же время минерально-витаминный состав каждого вида корма подвержен значительным колебаниям и зависит от типа почв, климатических условий, вида растений, фазы вегетации, проводимых хозяйствами агрохимических мероприятий, технологии уборки, хранения и подготовки заготовленных кормов к скармливанию и других факторов. Исходя из чего, в хозяйствах часто наблюдается в заготовленных кормах недостаток одних элементов и избыток других, что приводит к возникновению заболеваний, снижению продуктивности, нарушениям в воспроизводстве, ухудшению качества получаемого от коров молока и низкой эффективности использования кормов.
В современных условиях ведения животноводства контроль со стороны специалистов за обеспеченностью животных минеральными веществами и витаминами чрезвычайно важен, так как заболевания связанные с их недостаточностью, дисбалансом и токсичностью, получили сейчас широкое распространение. Дополнительно у животных появляются новые формы витаминно-минеральной недостаточности: остеохондрозы, токсикозы, остеодистрофии, артрозы, слабость конечностей, мышечные дистрофии у молодняка, послеродовые заболевания у высокопродуктивных коров (гипокальцемия, гипофосфатемия, анемия), нарушения в воспроизводительной функции, стрессоустойчивости и неспецифической резистентности организма, отравление экотоксинами, изменение поведения, образование камней в моче- и желчевыводящих путях, нарушение функции щитовидной железы, кислотно-щелочной дисбаланс и т.п.
На практике специалисты обычно наблюдают стертые и осложненные формы, что создает определенные сложности при постановке диагноза. Чаще всего нарушение витаминно-минерального обмена у животных протекает без каких-либо клинических признаков. К примеру, недостаточное или избыточное обеспечение животных минеральными веществами и витаминами ведет к снижению использования питательных веществ корма, продуктивности, качества продукции, воспроизводительной способности и устойчивости к болезням. Подобного рода субклиническую патологию специалисты имеют возможность определить только при проведении биохимического исследования у таких животных. При выявлении недостаточности или токсичности того или иного минерального элемента и витаминов необходимо учитывать все полученные данные: биохимические показатели крови, молока, органов, тканей, экскретов и волосяного покрова; содержание минеральных веществ в почве, воде и кормах; клинические признаки; уровень продуктивности; ответную реакцию организма на витаминно-минеральные добавки (премиксы).
У животных получающих несбалансированный по минеральным веществам рацион кормления отмечаем: ухудшение аппетита, использование питательных веществ корма, снижается воспроизводительная функция и продуктивность, шерстный покров становится тусклым и взъерошенным. Проявлением недостаточности или токсикоза минеральных веществ, служат такие болезни животных, как паракератоз, рахит, сухотка, зоб, тетания, флюороз, анемия и другие. Когда минеральный элемент тесно связан с одним органом или одной функцией организма (например, йод со щитовидной железой), мы будем иметь дело с однообразной и довольно специфической клинической картиной. В то же время специалисты при наличии у животного заболевания зобом должны учитывать, что зоб могут вызвать и гойтрогенные вещества, содержащиеся в рапсе, капусте, сурепке, льняном шроте, белом клевере, соевых бобах, горохе и др., а также некоторые лекарства. Недостаточность таких элементов, как медь и цинк, проявляется весьма своеобразно, в связи с участием их в биосинтезе многих ферментов. Дефицит минеральных веществ у животных может быть вторичным или комплексным, а также возможно одновременное проявление недостатка одного элемента и избытка другого: Си и Zn,Си и Мо, Сd и Zn, Mn и Fe,Cu и Pb.
Доказано, что определенные метаболические процессы могут нарушаться как при недостатке, так и избытке многих элементов. К примеру, аналогичные или очень близкие поражения костного скелета бывают при недостатке Са, Р,Mn,Cu, Mn, Zn, Si, витаминов А и D,а также при избытке Mo, F, Sr, витамина D. Анемию также может вызвать недостаток Fe, Cu, Co, некоторых витаминов или избыток в рационе Mn,Mo,Zn, Cu, Pb,Se. Снижение и извращение аппетита у животных бывает при дефиците Ca, P, Na, Co, Cu,Zn и при избытке многих элементов. Учитывая вышеизложенное специалисты хозяйств при оценке статуса минеральных веществ и витаминов основное свое внимание должны уделять своевременному выявлению у высокопродуктивных животных субклинических стадий их недостаточности, токсикоза и организации необходимых профилактических мероприятий.
Уровень кальция в крови здоровых животных зависит от содержания в рационе Ca,P, Mg, витамина D в рационе, от состояния гормональной системы, желудочно-кишечного тракта, почек и других органов.
Содержание кальция в крови понижается при длительном дефиците его в рационе, плохом усвоении вследствие недостатка витамина D и паратгормона. Гипокальцемия сопровождает остеодистрофию, рахит, послеродовой парез, гипофункцию околощитовидных желез. Гипокальцемия у животных может быть при нефрозе и нефрите. При субклинической форме недостаточности кальция в плазме (сыворотке) крови животных снижается концентрация кальция (ниже 8,0 мг %), повышается активность щелочной фосфатазы, содержание неорганического фосфора и магния; в моче увеличивается концентрация фосфора, магния, оксипролина; в костной ткани повышается (в 2-3 раза) активность щелочной фосфатазы, снижается содержание золы, Cа,P, Mg; уменьшается плотность и прочность костей.
При избытке кальция в корме (2% на сухое вещество) концентрация этого элемента в плазме крови возрастает в 1,4 раза, содержание неорганического фосфора снижается в 3 раза, активность щелочной фосфатазы не изменяется. Повышение кальция в крови у животных может быть при передозировке витамина D, гиперфункции паращитовидных желез.
Все виды обмена веществ в организме животных неразрывно связаны с превращением фосфорной кислоты. Уровень фосфора в крови зависит от тех же факторов, что и содержание кальция. Недостаток фосфора в кормах рациона сопровождается снижением в плазме крови концентрации неорганического фосфора (менее 4мг%), повышением активности щелочной фосфатазы, содержания Mg и Ca; в моче снижается концентрация фосфора и увеличивается количество Mg и Ca (в 5-10 раз), оксипролина; в костной ткани уменьшается содержание фосфора, кальция, магния, золы; снижается плотность и прочность костей. Снижение фосфора в крови отмечают при длительном недостатке его в кормах рациона, плохом усвоении или расстройствах желудочно–кишечного тракта, при недостатке витамина D и паратгормона, при остеодистрофии, рахите, уровской болезни, пеллагре и других заболеваниях животных.
Избыток фосфора в кормах приводит к увеличению в плазме крови количества фосфора, снижению концентрации магния и не изменяет содержание в ней кальция и активности щелочной фосфатазы. Аналогичную картину можно наблюдать в моче животных. Гиперфосфатемию наблюдают при уменьшении секреции паратгормона, при сердечной недостаточности, кетозе, передозировке витамина D, нефритах, нефрозах, токсикозах, мышечном перенапряжении.
Гиповитаминоз D сопровождается в плазме крови возрастанием активности щелочной фосфатазы и снижением концентрации кальция, фосфора и магния. Избыток витамина D приводит к значительному увеличению содержания кальция и фосфора в плазме крови.
При недостатке магния в рационе происходит уменьшение концентрации магния в плазме крови (менее 1,7 мг %), моче и костной ткани, на фоне умеренного снижения содержания Р и Mg в костях, без существенного изменения концентрации Са и Р и активности щелочной фосфатазы. Недостаточность магния в крови у животных, при избытке калия и азота в рационе клинически проявляется симптомами пастбищной тетании, послеродового пареза, остеодистрофии, транспортной болезнью.
Недостаточность натрия, калия, хлора, серы на обычных товарных фермах с содержанием животных имеющих небольшую продуктивность встречается редко, так как животноводы в рацион кормления животных регулярно добавляют поваренную соль и серосодержащие аминокислоты. Однако у высокопродуктивных животных (5000кг и более) обычно наблюдается недостаточность Na и S, Cl. Дефицит хлора, даже когда в рацион не вводится поваренная соль встречается у животных крайне редко, а недостаточность калия может быть у жвачных при высококонцентратном типе кормления, ввиду того,что зерновые корма составляющие основу рациона при высококонцентратном типе кормления бедны калием. При дефиците калия, серы и хлора в организме у животных снижается их концентрация в плазме крови и моче. Избыток натрия, хлора, калия и серы из организма животных выделяется в основном с мочой.
Функция электролитов в организме животного это поддержание кислотно-щелочного баланса. Снижение щелочного резерва (резервной щелочности) в крови у животного ниже 40 об. % СО² свидетельствует о сдвиге кислотно-щелочного баланса в сторону ацидоза. Метаболический ацидоз регистрируется при высококонцентратном типе кормления коров, вторичной остеодистрофии, расстройствах желудочно кишечного тракта и функции почек, воспалениях. Дыхательный ацидоз у животных наблюдается при сердечной недостаточности и эмфиземе легких.
Недостаточность железа обычно встречается у молодняка и клинически проявляется микроцитарной гипохромной анемией. У лактирующих коров может встречаться железодефицитное состояние проявляющееся нормальной концентрацией гемоглобина на фоне снижения запасов железа в тканях животного. При дефиците железа у телят происходит снижение концентрации этого элемента в плазме крови (≤ 65 мкг %), гемоглобина (≤80 г/л),гематокрита (≤30%), насыщенности трансферрина (≤25%), уменьшение количества эритроцитов (≤4,0*10 в 12степени/л) и увеличение общей железосвязывающей способности плазмы крови (≥ 100 мкмоль/л). Из приведенных выше показателей наиболее надежны для диагностики ранних форм недостаточности железа содержание этого элемента и ферритина в плазме крови, насыщенность трансферрина, концентрация гемоглобина. При избытке железа в рационе (1г/кг сухого вещества) содержание его возрастает в кишечнике, почках, селезенке и печени.
Недостаточность меди у животных субклинически сопровождается снижением церулоплазмина (в 10-15 раз) и содержания меди в плазме крови (менее 60 мкг%), а также уменьшением количества гемоглобина и эритроцитов. Нарушение защитного антимикробного механизма в нейтрофилах — самое раннее проявление недостаточности меди. Избыток меди в рационе животных приводит к накоплению элемента в печени, почках, стенке кишечника; при этом активность церулоплазмина и содержание меди в плазме крови существенно не изменяются, но наблюдается гипокальцемия. Избыток меди и церулоплазмина в крови наблюдают при заболеваниях печени, лейкемии, инфекционных заболеваниях, при беременности.
Недостаток цинка у коров сопровождается снижением его концентрации в плазме крови (ниже 50мкг%), костной ткани, печени, почках, поджелудочной железе, стенке кишечника, сердце, волосяном покрове, слюне.
При избытке цинка наблюдается повышение его содержания в основном в этих же тканях и органах. На долю эритроцитов приходится около 80% от общего количества цинка в крови, где он соединен главным образом с карбоангидразой; в связи с этим повышает содержание цинка в плазме. Концентрация цинка в сыворотке крови на 16% выше, чем в плазме. В практических условиях содержание цинка в плазме крови зависит от вторичных факторов (воспаления, инфекции, опухоли, стресса, избытка кальция, фосфора, меди, свинца, кадмия, фитина понижают цинкемию), возраста и физиологического состояния животных, их генетических особенностей. Клинически недостаточность цинка может возникнуть до существенного снижения его в крови и тканях. Эти же факторы способствуют усилению экскреции цинка с мочой. Наукой к настоящему времени обнаружено около 100 цинксодержащих ферментов, однако ни один из них пока не может быть использован в качестве надежного критерия статуса цинка в организме.
При недостатке цинка в организме снижается активность щелочной фосфатазы в плазме крови, печени, костях. Активность щелочной фосфатазы в плазме крови еще в большой мере зависит от вторичных факторов, чем от содержания цинка. Активность щелочной фосфатазы в плазме крови повышается при недостатке витамина D, остеодистрофии, рахите, гепатите, циррозе печени, а также в конце стельности из-за быстрого роста костной ткани плода. Примечательно, что у телят активность щелочной фосфатазы в 5-15 раз выше, чем у взрослых коров.
Содержание марганца в тканях животных мало изменяется как, при недостатке, так и при его избытке в кормах рациона.
При токсикозе животных содержание марганца возрастает в стенке кишечника, почках, коже, волосе, желчи и кале. При недостатке этого элемента в организме животных снижается активность аргиназы в печени, галактозилтрансферазы в костях, изоцитрат-и пируватдегидрогеназы в почках и мышцах, а также уменьшается концентрация и скорость сульфатирования гликозаминогликанов в хрящевой и костной ткани.
При недостатке в рационе кобальта, что наиболее часто наблюдается у жвачных в период пастбищного содержания, у животных снижается его концентрация в плазме крови (≤0,6 мкг %) и печени (≤0,1 мг/кг сухого вещества), но ввиду низкого содержания кобальта в тканях и биологических жидкостях данные показатели имеют для специалистов небольшую диагностическую ценность. Более объективным показателем является концентрация витамина В-12 в плазме крови (у крупного рогатого скота в норме 250-600 нг/л), печени и молоке. При недостаточности кобальта у жвачных резко снижается активность метилмалонил-КоА-мутазы и метионин-синтетазы, что приводит к накоплению в крови метилмалоновой и формиминоглутаминовой кислот и повышенной экскреции их с мочой. Определение в плазме крови метилмалоната (в норме ≤ 100 мкмоль/л) позволяет выявлять субклиническую форму недостаточности кобальта. При избытке кобальт накапливается в печени и почках.
При недостатке и избытке селена в рационе происходит быстрое изменение его содержания в плазме крови, эритроцитах, сердце, скелетных мышцах, печени, почках, костной ткани, легких, поджелудочной железе, волосе, коже, селезенке, молоко, моче, кале. При этом, в плазме крови и, особенно в волосе концентрация селена при недостатке селена снижается медленнее, чем в тканях. Более надежным прижизненным критерием недостаточности селена является активность селено зависимой глутатионпероксидазы в цельной крови. При дефиците селена в плазме крови возрастает активность аспарттатаминотрансферазы и креатинкиназы в два раз и более, что является следствием патологии мышечной ткани.
Определение содержания общего, белково-связанного, свободного, бутанол-экстрагируемого йода (БЭЙ) и тироксина в плазме крови позволяет выявить недостаток этого элемента; в то же время при избытке йода в рационе концентрация гормонов щитовидной железы и БЭЙ не увеличивается. При вторичной недостаточности йода, вызванной гойтрогенными веществами, содержание БЭЙ в крови также не изменяется, однако в моче при этом резко повышается уровень тиоцианатов. У лактирующих коров концентрация йода в молоке — наиболее яркий индикатор обеспеченности организма йодом. Волос у животных, особенно черный, также хорошо отражает статус йода, однако следует учитывать возможность его загрязнения, в том числе и за счет поглощения элемента из воздуха.
На сегодняшний день в природе известно более 50 каротиноидов, способных превращаться в организме животных в витамин А. Из них наиболее распространенный и эффективный — бета-каротин. Из одной молекулы оранжевого пигмента в организме животных образуется 2 молекулы витамина А. Бета-каротин, кроме участия в синтезе витамина А, имеет свои очень важные функции в организме. Он является природным антиоксидантом, повышает сопротивляемость организма к различным заболеваниям, улучшает воспроизводительную функцию, кроветворение и устойчивость организма к раковым заболеваниям, снижает риск сердечнососудистых заболеваний, воспаления слизистых оболочек, регулирует иммунные реакции, усиливает обмен энергии. Выявлена прямая зависимость между содержанием бета — каротина в организме и воспроизводительной способностью животных.
Ввиду того, что бета-каротин в процессе заготовки и хранения кормов быстро разрушается, обеспечить животных в зимнее- стойловый период бета –каротином в хозяйствах практически невозможно. Под действием света и высоких температур бета-каротин переходит в менее активные формы. Потребность животных в бета — каротине возрастает при избытке в рационе энергии, протеина, клетчатки, сульфатов, железа, тяжелых металлов, нитратов, нитритов, микотоксинов, прогорклых жиров, сапонинов, фитоэстрогенов, при воспаление кишечника, воздействии различных стресс факторов, при лечении кокцидиостатиками и некоторыми другими ветпрепаратами. Повышают усвоение бета-каротина витамины Е и В-12, оптимальные дозы фосфора, цинка, селена, кобальта и жира, углеводы.
Количество каротина в крови подвержено значительным сезонным колебаниям (0,4-1,0 мг% в стойловый период и более 1мг%- в пастбищный).
При дефиците каротина в корме снижается его содержание в крови. Снижение содержания каротина в крови у животных происходит в результате плохого его усвоения под влиянием многих вторичных факторов, гепатитах, гепатозах, недостатке в рационе белка, жиров, легкоусвояемых углеводов, при различных токсикозах в т.ч. нитратных.
Специалисты хозяйств и ветлабораторий должны учитывать тот фактор, что уровень каротина в сыворотке (плазме) крови при хранении образцов снижается, поэтому должны это учитывать при проведении анализов и интерпретации полученных результатов.
Наукой доказано, что в организме животных усваивается только 1/3-¼ часть поступившего в организм животного каротина и только 1/7 его часть превращается в витамин А. При этом от 25 до 50% витамина А депонируется в печени. Полноценное белковое кормление животных, хорошая обеспеченность рациона витамином В-12 и антиоксидантами существенно повышает эффективность превращения каротина в витамин А.
Концентрация витамина А в крови, так же как и каротина,подвержена значительным сезонным колебаниям (25-80 мкг% в стойловый период и 40-150 мкг%- в пастбищный). При снижении содержания витамина А в крови ниже 10мкг% и в печени ниже 50 мкг/г приводит к развитию у животных клинических признаков гиповитаминоза А. Снижение содержания витамина А в крови, печени, молозиве и молоке отмечают при недостатке каротина и витамина А в кормах рациона, плохом их усвоении вследствие имеющихся у животных хронических заболеваний желудочно-кишечного тракта и печени.
Снижение уровня общего белка в сыворотке крови (ниже 60г/л) бывает при длительном недокорме животных, неполноценном питании, остеодистрофии, хронических заболеваниях желудочно-кишечного тракта, почек и печени.
Мочевина является в организме животных основным конечным продуктом азотистого обмена. Процесс синтеза мочевины в организме жвачных животных происходит в печени и стенке рубца. Выделение мочевины из организма происходит главным образом почками. Концентрация мочевины в крови здоровых животных составляет 20-40 мг%, или 3,3-6,7 мкмоль/л. Резкое повышение содержания мочевины в крови (уремия) наблюдается при почечной недостаточности и других заболеваниях почек, а также при скармливании животным больших количеств зеленых бобовых кормов и передозировках в рационе синтетических азотистых веществ (мочевина и др.). В то же время уменьшение содержания мочевины в крови бывает при длительном белковом недокорме, при нарушении мочевинообразовательной функции печени. Данное явление часто бывает у коров с дистрофией печени в результате перенесенного ей кетоза.
Кетоновые тела (бета-оксимасляная кислота, ацетоуксусная кислота, ацетон) промежуточные продукты обмена белков, жиров и углеводов. При повышение уровня кетоновых тел у животных в крови, моче и молоке специалисты говорят о нарушении обмена веществ. Стойкая кетонемия встречается у коров при острой и подострой формах кетоза. При этом соотношение кетоновых тел меняется в сторону увеличения ацетона и ацетоацетата.
При острой форме кетоза в молоке и моче обнаруживаются ацетоновые тела (в моче до 100-500 при норме 5-10 мг%, в молоке до 20-80 при норме до 8 мг%), а в крови кетоновые тела (15-70 мг% и более при норме 1-6 мг%). При этом содержание сахара (глюкозы) в крови больных коров снижается до 30 мг% и ниже при норме 40-60 мг%, а резервная щелочность-ниже 40 об% СО².
У коров больных кетозом в крови увеличивается уровень ЛЖК, НЭЖК, молочной, пировиноградной кислот, тироксина. В рубцовом содержимом снижается рН, повышается концентрация масляной кислоты, аммиака, кетоновых тел.
При хроническом кетозе и вторичной остеодистрофии в крови содержание кетоновых тел повышено незначительно, снижается содержание гемоглобина, мочевины, кальция, резервной щелочности, сахара, а также происходит повышение в крови общего белка, активности аспартатаминотрансферазы и лактатдегидрогеназы.
Билирубин — желчный пигмент, образуется в клетках РЭС из гемоглобина разрушенных эритроцитов. В плазме крови билирубин образует непрочный комплекс с альбумином. Специалисты такой билирубин называют свободным или непрямым. Содержание такого билирубина в крови составляет 1-14 мкмоль/л. Такой билирубин из организма животных выводится с участием печени. В печени происходит экстрагирование билирубина из комплекса с альбумином и его соединение с глюкуроновой кислотой. Образовавшийся комплекс билирубина с глюкуроновой кислотой специалисты называют прямым билирубином. Прямой билирубин выделяется печенью в желчь и поступает в кишечник животного, где превращается в уробилиноген. В сыворотке крови здорового животного содержится в основном непрямой билирубин (до 80% от общего). Уровень общего билирубина повышается у животных больных гемолитической желтухой, усиленном гемолизе эритроцитов, и значительно в меньшей степени при гепатите и циррозе печени. Прямой билирубин находится в крови в незначительных количествах (от 0 до 5мкмоль/л) и повышается при болезнях печени и ее выводящих путей.
Глюкоза (сахар) — является основным источником энергии для организма. На ее долю приходится более 90% всех низкомолекулярных углеводов. Относительно постоянный уровень глюкозы в крови (40-60 мг% или 2,2-4,0 ммоль/л) поддерживается в организме животного гормонально. Гипогликемия у животных встречается при кетозе, вторичной остеодистрофии, послеродовом парезе, некоторых формах ожирения, токсических поражениях печени. Она часто бывает у животных в результате недостатка легкоусвояемых углеводов в кормах, большой потребности высокопродуктивных коров в глюкозе при высококонцентратном типе кормления, при преобладании в рационе кислых кормов. Гипогликемия у животных может быть как стойкой, так и непродолжительной. Непродолжительная гипогликемия бывает при скармливании животным больших количеств сахаристых кормов, а также при испуге животного, высокой температуре, стрессах. Стойкая гипергликемия встречается при сахарном диабете. Ветеринарные специалисты должны помнить, что концентрация глюкозы в сыворотке (плазме) крови при хранении быстро снижается, поэтому определение глюкозы необходимо проводить сразу же после взятия крови, а если нет такой возможности необходимо провести осаждение белков трихлоруксусной кислотой непосредственно на ферме.
источник
