Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.
Правда, достоверных доказательств участия всего перечисленного в злокачественном перерождении не представлено. Ясно одно, что-то помешало нормальному созреванию В-лимфоцитов или вмешалось в многоэтапный путь от их «детства» до лимфатической зрелости, из-за чего-то лимфоцит превратился в дефектный плазмоцит, давший начало миеломе.
Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.
Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
Вырабатываемые злокачественными плазмоцитами парапротеины откладываются в тканях органов, излюбленное «место складирования» — почки, в которых развивается «болезнь лёгких цепей» с исходом в почечную недостаточность. В поражённой печени снижается выработка разжижающих кровь веществ — повышается вязкость крови, нарушающая обменные процессы в тканях, образуются тромбы. Отложения иммуноглобулинов наносят урон и другим органам, но не столь фатальный.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.
Давний маркёр заболевания — белок Бенс-Джонса в моче, выявляемый у 70% пациентов. Белок формируется из цепочек иммуноглобулинов А и G небольшого молекулярного веса — «лёгких», которые просачиваются из почечных канальцев. По содержания Бенс-Джонса тоже контролируют течение болезни.
Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.
Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
Для каждого варианта заболевания предусмотрены определенные количественные характеристики и сочетания критериев, так для полной убеждённости в наличии у пациента миеломы необходимо обнаружить специфические «продукты»:
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны. Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.
Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания. Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями. При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов. Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
Астенизированного человека наши предки называли «квёлым». Такие пациенты рискуют не перенести агрессивного лечения, но достаточно неплохо отвечают на более легкие варианты противоопухолевой химиотерапии.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.
Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
Играет роль концентрация парапротеинов и их фракций, объем поражения на момент выявления болезни и степень вовлечения в патологический процесс других органов, так уже развившаяся почечная недостаточность «перевесит» все прочие благоприятные признаки заболевания.
источник
Миелома (миеломная болезнь) – виды (множественная, диффузная, солитарная и др.), симптомы и стадии, диагностика, методы лечения, продолжительность жизни и прогноз
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Миеломная болезнь также называется миеломой, болезнью Рустицкого-Калера, генерализованной плазмоцитомой, миеломатозом или ретикулоплазмоцитозом. Наиболее часто для обозначения данной патологии используются два термина – это миелома и миеломная болезнь. В дальнейшем тексте мы также будем пользоваться данными терминами в качестве синонимов.
Итак, миеломная болезнь представляет собой одну из разновидностей гемобластозов , которые в обиходе называют «раком крови». То есть, миелома – это заболевание, характеризующееся злокачественным ростом количества клеток крови определенного вида (плазмоцитов), которые вырабатывают патологический белок — парапротеин . Причем количество плазмоцитов в крови и костном мозгу растет из-за мутации в этих клетках. И именно мутация обуславливает синтез ими большого количества парапротеина.
Стойкое увеличение количества мутировавших плазмоцитов выше нормы является основным критерием того, что миелому относят к разновидности злокачественных опухолей. От рака другой локализации (например, рака яичников, кишечника и других органов) миеломная болезнь отличается тем, что опухолевые клетки могут сразу находиться в разных органах и тканях, куда их приносит кровоток.
Вследствие большого количества плазмоцитов в костном мозгу нарушается нормальный процесс кроветворения и разрушаются кости, а парапротеин откладывается во многих органах и тканях, нарушая их функционирование и обуславливая развитие полиморфной и разнообразной клинической картины заболевания.
Чтобы понимать суть миеломы, необходимо знать, что такое плазмоциты вообще и моноклональные плазмоциты в частности, а также секретируемые ими парапротеины. Не менее важно четко представлять себе природу изменений в клетках, вызвавших их неконтролируемое размножение, и структуру патологических белков. Рассмотрим все эти понятия по-отдельности.
Итак, любые плазмоциты (патологические и нормальные) представляют собой клетки, образовавшиеся из В-лимфоцитов. Процесс формирования нормальных плазмоцитов довольно сложен и всегда запускается попаданием какого-либо чужеродного микроорганизма в кровь. Дело в том, что после попадания микроба в кровь, в какой-то момент он «встречается» с циркулирующим В-лимфоцитом, который распознает в нем нечто чужеродное, а, следовательно, подлежащее уничтожению. После этого В-лимфоцит, встретившийся с антигеном, активируется и попадает в ближайший к его местоположению лимфатический узел. Например, если В-лимфоцит контактировал с патогенным микробом в сосудах кишечника, то он попадает в Пейеровы бляшки – особые скопления лимфоидной ткани кишок и т.д.
В лимфатических узлах В-лимфоцит видоизменяется и получает способность вырабатывать только один вид антител (иммуноглобулинов), которые будут прицельно уничтожать встреченную им разновидность патогенного микроорганизма. То есть, если В-лимфоцит встретился с вирусом краснухи, то в лимфатических узлах он получит способность вырабатывать антитела только против этого микроба. Соответственно антитела против вируса краснухи не смогут уничтожать менингококк или любой другой микроб. Благодаря подобному механизму достигается избирательность действия иммунной системы, которая уничтожает только патогенные микробы и не наносит вреда представителям нормальной микрофлоры различных органов и систем.
В-лимфоцит, получивший способность вырабатывать антитела против какого-либо микроба, становится зрелой иммунокомпетентной клеткой, которую уже называют плазмоцитом. То есть, плазмоцит и В-лимфоцит – это стадии зрелости одной и той же клетки иммунной системы. После превращения В-лимфоцита в плазмоцит, последний выходит в системный кровоток и начинает интенсивно размножаться. Это необходимо для того, чтобы клетки, способные вырабатывать антитела против обнаруженного патогенного микроба, оказались в кровотоке в большом количестве и максимально быстро уничтожили все микроорганизмы.
Всю совокупность клеток, образовавшихся из одного плазмоцита, называют моноклональными, поскольку, по сути, они представляют собой многочисленные одинаковые клоны одной и той же клеточной структуры. Такие моноклональные плазмоциты вырабатывают совершенно одинаковые антитела, направленные против какого-либо одного патогенного микроба. Когда микроб будет уничтожен, большая часть моноклональных плазмоцитов погибнет, а несколько сотен клеток претерпят очередное преобразование и превратятся в так называемые «клетки памяти», которые будут обеспечивать иммунитет к перенесенному заболеванию в течение некоторого промежутка времени. Именно так происходит в норме. А при нарушениях описанного процесса образования плазмоцитов и выработки ими антител возникают различные заболевания, в том числе миелома.
Так, миелома представляет собой результат нарушения процессов созревания и превращения В-лимфоцитов в плазмоциты и выработки ими антител (иммуноглобулинов). Дело в том, что миелома – это, по сути, безостановочное и постоянное образование моноклональных плазмоцитов, которые не погибают, а напротив, постоянно увеличиваются в числе. То есть, при формировании данного заболевания происходит нарушение механизма гибели плазмоцитов, которые из кровотока проникают в костный мозг и продолжают размножаться. В костном мозгу размножающиеся плазмоциты постепенно начнут вытеснять все остальные ростки, вследствие чего у человека разовьется панцитопения (уменьшение количества всех видов клеток крови – эритроцитов, тромбоцитов и лейкоцитов).
Кроме того, патологические непогибающие моноклональные плазмоциты, являющиеся субстратом миеломы, вырабатывают дефектные иммуноглобулины (антитела). У этих иммуноглобулинов имеются какие-либо дефекты составляющих их легких или тяжелых цепей, из-за которых они в принципе не способны уничтожать какие-либо патогенные микроорганизмы. То есть, моноклональные плазмоциты миеломы вырабатывают и секретируют в кровь дефектные молекулы иммуноглобулинов, которые по своей структуре являются белками (протеинами), и потому называются парапротеинами.
Данные парапротеины, неспособные уничтожать патогенные микробы, циркулируют в системном кровотоке и проникают в ткани различных органов и систем, куда их может принести кровь. То есть, парапротеины чаще всего проникают в ткани обильно кровоснабжаемых органов, таких, как почки, печень, селезенка, сердце, костный мозг, нервные волокна и т.д. Попадая в ткани, парапротеины откладываются в межклеточном пространстве, буквально нафаршировывая орган патологическими белками, что нарушает его нормальное функционирование. Именно с инфильтрацией парапротеинов в различные органы и системы связаны многочисленные и разнообразные клинические проявления миеломной болезни. То есть, непосредственно опухоль локализуется в костном мозге, а вырабатываемые ей парапротеины откладываются в разных органах.
Патологические плазмоциты, образующие миелому в костном мозгу, выделяют биологически активные вещества, которые оказывают следующие эффекты:
- Активизируют работу клеток-остеокластов, которые начинают интенсивно разрушать структуру костей, провоцируя их ломкость, остеопороз и болевой синдром;
- Ускоряют рост и размножение плазмоцитов, образующих миелому;
- Угнетают иммунитет, выступая в роли веществ-иммуносупрессоров;
- Активируют работу фибробластов, вырабатывающих эластические волокна и фиброген, которые, в свою очередь, проникают в кровь, повышают ее вязкость и провоцируют постоянное образование синяков и мелких кровотечений;
- Активируют активный рост клеток печени, которые перестают синтезировать достаточное количество протромбина и фибриногена, вследствие чего ухудшается свертываемость крови;
- Нарушают обмен белков из-за высокого содержания в крови парапротеинов, что вызывает поражение почек.
Подводя итог, можно сказать, что миелома – это злокачественное заболевание, обусловленное неконтролируемым размножением моноклональных патологических плазмоцитов, вырабатывающих парапротеины, инфильтрирующие жизненно-важные органы и ткани и вызывающие нарушения их функционирования. Поскольку патологические плазмоциты размножаются неконтролируемо и их число постоянно растет, то миелому относят к злокачественным опухолям системы крови – гемобластозам.
Миеломная болезнь обычно развивается у людей старшего возраста (старше 40 лет) и крайне редко регистрируется у молодых мужчин и женщин младше 40 лет. Частота встречаемости миеломы возрастает в более старших возрастных категориях, то есть, у людей 40 – 50 лет заболевание развивается реже, чем у 50 – 60 – летних и т.д. Мужчины болеют чаще женщин.
Миелома течет и развивается очень медленно. От момента появления в костном мозгу патологических плазмоцитов и формирования первых очагов опухоли до развития клинических симптомов может проходить 20 – 30 лет. Но после манифестации клинических симптомов миеломы, заболевание в среднем в течение 2 года приводит к смерти человека от осложнений, связанных с поражением парапротеинами различных органов и систем.
- Миелома Бенс-Джонса (встречается в 12 – 20% случаев);
- А-миелома (25% случаев);
- G-миелома (50% случаев);
- М-миелома (3 – 6%);
- Е-миелома (0,5 – 2%);
- D-миелома (1 – 3%)
- Несекретирующая миелома (0,5 – 1%).
Так, миелома Бенс-Джонса характеризуется выделением атипичного иммуноглобулина, который называется белком Бенс-Джонса, на основании чего опухоль и получила свое название. Миеломы G, А, М, Е и D секретируют, соответственно, дефектные иммуноглобулины типов IgG, IgA, IgM, IgE, IgD. А несекретирующая миелома не производит какого-либо парапротеина. Данная иммунохимическая классификация миелом в практической медицине используется редко, поскольку на ее основе невозможно выработать оптимальной тактики терапии и наблюдения за пациентом. Выделение данных разновидностей миеломы имеет значение для научных исследований.
На практике применяются другие классификации миелом, основанные на клинико-анатомических особенностях расположения плазмоцитов в костном мозгу, а также на особенностях клеточного состава опухоли.
Во-первых, в зависимости от того, в скольких костях или органах находятся очаги опухолевого роста, миеломы подразделяются на множественные и солитарные.
Множественная миелома характеризуется формированием очагов опухолевого роста одновременно в нескольких костях, внутри которых имеется костный мозг. Чаще всего поражаются позвонки, ребра, лопатка, крылья подвздошных костей, кости черепа, а также центральная часть длинных костей рук и ног. Кроме того, помимо костей, могут поражаться и лимфатические узлы, и селезенка.
Наиболее часто развивается множественная миелома, а наиболее редко – солитарная. Клинические проявления, а также принципы терапии данных разновидностей миелом одинаковы, поэтому, как правило, врачи выделяют конкретную форму заболевания для правильной постановки диагноза, а также оценки прогноза по жизни и по здоровью. В остальном каких-либо принципиальных различий между солитарной, множественной, диффузной и диффузно-очаговой миеломами нет, поэтому мы будем рассматривать их совместно. Если же для какой-либо разновидности миеломы необходимо будет подчеркнуть ее особенности, то это будет сделано.
Так, в зависимости от того, как плазмоциты расположены в костном мозгу, миеломы подразделяются на следующие виды:
- Диффузно-очаговая миелома;
- Диффузная миелома;
- Множественно-очаговая (множественная миелома).
Диффузно-очаговая миелома сочетает в себе черты множественной и диффузной.
В зависимости от клеточного состава миеломы ее подразделяют на следующие виды:
- Плазмоцитарная миелома (плазмоклеточная);
- Плазмобластная миелома;
- Полиморфноклеточная миелома;
- Мелкоклеточная миелома.
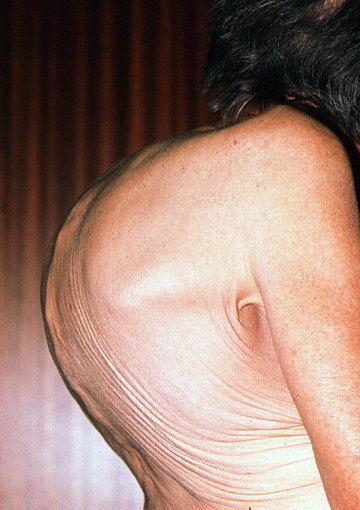
На данной фотографии видна деформация грудной клетки и позвоночника при миеломе.
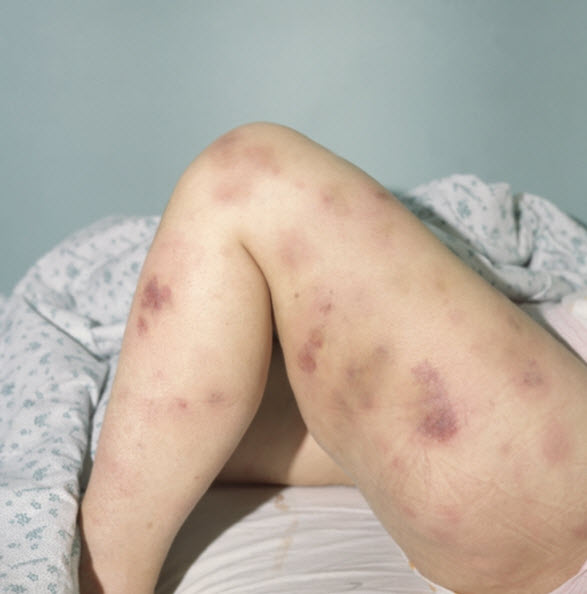
На данной фотографии видны многочисленные синяки и кровоподтеки, характерные для миеломы.
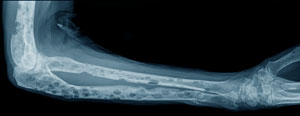
На данной фотографии видны пораженные миеломной болезнью кости предплечья.
К симптомам миеломы, связанным с локализацией и ростом опухоли в костях, относят следующие:
- Боли в костях;
- Остеопороз костей, в которых находятся очаги опухоли;
- Хрупкость костей и склонность к переломам;
- Деформация костей со сдавлением внутренних органов (например, при локализации очагов миеломы в позвонках происходит сдавление костного мозга и т.д.);
- Укорочение роста из-за деформации костей;
- Гиперкальциемия (повышенный уровень кальция в крови, который развивается вследствие резорбции костей и высвобождения из них соединений кальция);
- Анемия, лейкопения (сниженное число лейкоцитов в крови) и тромбоцитопения (сниженное число тромбоцитов в крови);
- Частые инфекционные заболевания бактериальной природы.
Боли в костях связаны с их разрушением, деформацией и сдавлением растущей опухолью. Боль обычно усиливается в положении лежа, а также при совершении движений, кашле и чихании, но не присутствует постоянно. Постоянные боли обычно свидетельствуют о переломе кости.
Остеопороз, хрупкость и склонность костей к переломам возникают из-за их разрушения растущей опухолью. Деформация костей и сдавление внутренних органов также связаны с нарушением их плотности. При компрессионном сдавлении спинного мозга деформированными позвонками нарушается нервная регуляция работы мочевого пузыря и кишечника, вследствие чего человек может страдать недержанием кала и задержкой мочи. Кроме того, при сдавлении позвоночника может нарушаться чувствительность ног или развиваться мышечная слабость.
Гиперкальциемия развивается постепенно и на ранних этапах проявляется тошнотой, обезвоживанием, сильной жаждой, сонливостью, общей слабостью, усиленным мочевыведением (более 2,5 литров мочи в сутки), запорами, мышечной слабостью и анорексией. Если не проводится адекватное симптоматическое лечение, направленное на уменьшение уровня кальция в крови, то гиперкальциемия может спровоцировать прогрессирующее нарушение умственной деятельности, почечную недостаточность и кому.
Частые инфекционные заболевания обусловлены тем, что плазмоциты в костном мозгу вытесняют нормальные кроветворные ростки, вследствие чего не образуется необходимого количества эритроцитов, лейкоцитов и тромбоцитов. Из-за дефицита образования в костном мозгу эритроцитов у человека, страдающего миеломой, развивается анемия. Из-за дефицита лейкоцитов – лейкопения, а тромбоцитов – соответственно, тромбоцитопения. Лейкопения, в свою очередь, приводит к резкому ухудшению иммунитета, вследствие чего человек начинает часто болеть различными бактериальными инфекциями, такими, как пневмония, менингит, цистит, сепсис и т.д. На фоне тромбоцитопении происходит ухудшение свертываемости крови, что проявляется с кровоточивости десен и т.д.
Симптомами миеломы, обусловленными секрецией парапротеинов в кровь и их отложением в различных органах и системах, являются следующие:
- Повышенная вязкость крови;
- Почечная недостаточность;
- Нефротический синдром;
- Кровоточивость (синдром «глаза енота» и спонтанные кровотечения из слизистых оболочек различных органов);
- Гипокоагуляция (снижение активности системы свертывания крови);
- Неврологические симптомы;
- Кардиомиопатия (нарушение работы сердца);
- Гепатомегалия (увеличение размеров печени);
- Спленомегалия (увеличение размеров селезенки);
- Макроглоссия (увеличение размеров и уменьшение подвижности языка);
- Алопеция (облысение);
- Разрушение ногтей.
Гипокоагуляция развивается вследствие двух факторов. Во-первых, это дефицит тромбоцитов в крови, а во-вторых, это функциональная неполноценность тромбоцитов, поверхность которых покрыта парапротеинами. В результате оставшиеся в крови тромбоциты не в состоянии обеспечивать нормальную свертываемость крови, что провоцирует кровоточивость и склонность к кровотечению.
Повышенная вязкость крови проявляется кровоточивостью (спонтанные кровотечения из десен, кишки, носа, влагалища и др.), а также образованием синяков и ссадин на кожном покрове. Кроме того, на фоне кровоточивости при миеломе может развиваться так называемый синдром «глаз енота», который возникает из-за ломкости сосудов и повышенной вязкости крови. Суть данного синдрома заключается в образовании большого синяка в области мягких тканей орбиты глаза после почесывания или легкого прикосновения к ним (рисунок 1).
Рисунок 1 – Синдром «глаза енота».
При исследовании сетчатки глаза, нафильтрованной парапротеином, видны характерные «сосисковидные» вены, растянутые слишком вязкой кровью. Повышенная вязкость крови всегда приводит к нарушениям зрения.
Кроме того, из-за повышенной вязкости крови у человека развиваются различные неврологические нарушения, такие как синдром Бинга-Нила , который включает в себя следующий характерный симптомокомплекс:
- Головокружение;
- Глухота;
- Парестезии (ощущение бегания «мурашек» и др.);
- Нарушение координации движений (атаксия);
- Головная боль;
- Судороги;
- Сонливость, способная переходит в ступор или кому.
Также из-за недостаточного кровоснабжения глубоко лежащих тканей и органов повышенная вязкость крови может вызывать сердечную недостаточность, одышку, гипоксию, общую слабость и анорексию. Вообще классической триадой проявлений повышенной вязкости крови считается сочетанное нарушение умственной деятельности, одышка и патологическая кома.
Почечная недостаточность и нефротический синдром обусловлены несколькими факторами – гиперкальциемией, отложением парапротеинов в канальцах почек и частыми бактериальными инфекциями. Отложение парапротеинов в канальцах почек называется AL-амилоидозом, который относится к осложнению миеломы. Из-за амилоидоза канальцы не могут выполнять свои функции, а избыток белка и кальция в фильтруемой крови перегружают почки, вследствие чего ткани органа необратимо повреждаются с формированием недостаточности. Поражение почек при миеломе проявляется протеинурией (белок в моче) без гипертонии и гиперурикемией (мочевая кислота в моче). Причем в моче при специальном исследовании обнаруживается белок Бенс-Джонса, что является отличительной чертой миеломной болезни. Отеков и гипертонии при нефротическом синдроме, обусловленном миеломой, не бывает, как при классической почечной недостаточности.
Изолированных форм миеломы, когда опухоль располагается в каком-либо органе, не существует. Даже солитарная миелома, при которой первичный очаг поражает либо костный мозг какой-либо одной кости, либо лимфатический узел, не может относиться к опухолям с определенной локализацией.
Часто, не понимая сущности миеломы, люди пытаются описать ее в привычных терминах и понятиях, искусственно локализуя опухоль в каком-либо органе, например, почках, позвоночнике, костном мозгу, коже или черепе. Вследствие этого употребляются соответствующие термины, такие, как миелома костей, миелома позвоночника, миелома кожи, миелома почки и т.д.
Однако все эти термины являются некорректными, поскольку миелома – это злокачественная опухоль, первичный очаг роста которой может располагаться в одной или нескольких костях, содержащих костный мозг. А поскольку костный мозг имеется в костях таза, черепа, рук и ног, а также в позвонках, ребрах и лопатках, то первичный очаг миеломы может располагаться в любой из указанных костей.
Для уточнения локализации первичного опухолевого очага врачи могут часто в короткой форме говорить «миелома позвоночника», «миелома черепа», «миелома ребер» или «миелома костей». Однако во всех случаях это означает только одно – человек страдает злокачественным заболеванием, симптомы которого будут одинаковыми вне зависимости от того, в какой именно кости локализован первичный очаг опухоли. Поэтому на практике с точки зрения подходов к терапии и клинической симптоматики миелома позвоночника ничем не отличается от миеломы черепа и т.д. Поэтому для описания клинических проявлений и подходов к лечению можно пользоваться термином «миелома», не уточняя, в какой именно кости локализован первичный очаг опухолевого роста.
Термины «миелома костей», «миелома костного мозга» и «миелома крови» являются некорректными, поскольку в них содержится характеристика, пытающаяся уточнить локализацию опухоли (кости, костный мозг или кровь). Однако это неправильно, поскольку миелома – это опухоль, которая всегда поражает костный мозг вместе с костью, в которой он содержится. Таким образом, термины «миелома костей» и «миелома костного мозга» — это наглядная иллюстрация известного выражения «масло масляное», описывающего избыточность и нелепость уточнений.
Миелома кожи и миелома почки – это неправильные термины, которые также пытаются локализовать опухоль в данных органах. Однако это в корне неверно. Очаг роста миеломы всегда локализован либо в костном мозгу, либо в лимфатическом узле, но вот секретируемые ей парапротеины способны откладываться в различных органах, вызывая их повреждение и нарушение функционирования. У разных людей парапротеины могут больше всего повреждать различные органы, в том числе кожу или почки, что является характерологическими чертами заболевания.
В зависимости от тяжести заболевания и объема поражения тканей миеломная болезнь подразделяется на 3 стадии (степени).
I степень миеломы соответствует следующим критериям:
- Концентрация гемоглобина в крови более 100 г/л или значение гематокрита более 32%;
- Нормальный уровень кальция в крови;
- Низкая концентрация парапротеинов в крови (IgG менее 50 г/л, IgA менее 30 г/л);
- Низкая концентрация белка Бенс-Джонса в моче менее 4 г в сутки;
- Общая величина массы опухоли не более 0,6 кг/м 2 ;
- Отсутствие признаков остеопороза, ломкости, хрупкости и деформации костей;
- Очаг роста только в одной кости.
Множественная миелома 3 степени выставляется, если у человека имеется хотя бы один из нижеперечисленных признаков:
- Концентрация гемоглобина крови ниже 85 г/л или значение гематокрита менее 25%;
- Концентрация кальция крови выше 2,65 ммоль/л (или выше 12 мг на 100 мл крови);
- Очаги опухолевого роста сразу в трех или более костях;
- Высокая концентрация парапротеинов крови (IgG более 70 г/л, IgA более 50 г/л);
- Высокая концентрация белка Бенс-Джонса в моче – более 112 г в сутки;
- Общая величина массы опухоли 1,2 кг/м 2 или более;
- На рентгенограмме видны признаки остеопороза костей.
II степень миеломы является диагнозом исключения, поскольку ее выставляют, если перечисленные лабораторные показатели выше, чем при I стадии, но ни один из них не доходит до значений, характерных для III стадии.
Диагностика миеломной болезни начинается с общего осмотра человека врачом, а также подробного расспроса о жалобах, времени их появления и особенностях течения. После этого врач ощупывает болезненные участки тела и спрашивает, усиливается ли боль и отдает ли она куда-либо.
После осмотра при подозрении на миеломную болезнь производятся следующие диагностические исследования:
- Рентген скелета и грудной клетки;
- Спиральная компьютерная томография;
- Аспирация (забор) костного мозга для производства миелограммы;
- Общий анализ крови;
- Биохимический анализ крови (обязательно определение концентраций и активности мочевины, креатинина, кальция, общего белка, альбуминов, ЛДГ, ЩФ, АсАТ, АлАТ, мочевой кислоты, С-реактивного белка и бета2-микроглобулина при необходимости);
- Общий анализ мочи;
- Коагулограмма (определение МНИ, ПТИ, АЧТВ, ТВ);
- Определение парапротеинов в моче или крови методом иммуноэлектрофореза;
- Определение иммуноглобулинов по методу Манчини.

1. Остеопороз;
2. Очаги разрушения костей черепа округлой формы, которые называются синдромом «дырявого черепа»;
3. Мелкие отверстия в костях плечевого пояса, расположенные по типу пчелиных сот и имеющие форму мыльного пузыря;
4. Маленькие и многочисленные отверстия в ребрах и лопатках, расположенные по всей поверхности костей и имеющие вид сходный с побитой молью шерстяной тканью;
5. Укороченный позвоночник и сдавленные отдельные позвонки, имеющие характерный вид, называемый синдромом «рыбьего рта».
Наличие указанных признаков на рентгенограмме подтверждает миеломную болезнь. Однако только рентгена недостаточно для определения стадии и фазы миеломы, а также степени тяжести общего состояния. Для этого используются лабораторные анализы.

Для миеломы характерны следующие значения показателей общего анализа крови:
- Концентрация гемоглобина менее 100 Г/л;
- Количество эритроцитов менее 3,7 Т/л у женщин и менее 4,0 Т/л у мужчин;
- Количество тромбоцитов мене 180 Г/л;
- Количество лейкоцитов менее 4,0 Г/л;
- Количество нейтрофилов в лейкоформуле менее 55%;
- Количество моноцитов в лейкоформуле более 7%;
- Единичные плазматические клетки в лейкоформуле (2 – 3%);
- СОЭ – 60 или более мм в час.
Кроме того, в мазке крови видны тельца Джолли, что свидетельствует о нарушении работы селезенки.
В биохимическом анализе крови при миеломе определяются следующие значения показателей:
- Концентрация общего белка 90 г/л или выше;
- Концентрация альбуминов 35 г/л или ниже;
- Концентрация мочевины 6,4 ммоль/л или выше;
- Концентрация креатинина выше 95 мкмоль/л у женщин и выше 115 мкмоль/л у мужчин;
- Концентрация мочевой кислоты выше 340 мкмоль/л у женщин и выше 415 мкмоль/л у мужчин;
- Концентрация кальция выше 2,65 ммоль/л;
- С-реактивный белок либо в пределах нормы, либо незначительно повышен;
- Активность щелочной фосфатазы выше нормы;
- Активность АсАТ и АлАТ в пределах верхней границы нормы или повышена;
- Активность ЛДГ повышена.
Определение концентрации белка бета2-микроглобулина производится отдельно при наличии подозрения именно на миелому и не входит в стандартный перечень показателей биохимического анализа крови. При миеломе уровень бета2-микроглобулина существенно выше нормы.
В общем анализе мочи при миеломе обнаруживаются следующие изменения:
- Плотность более 1030;
- Эритроциты в моче;
- Белок в моче;
- Цилиндры в моче.
При нагревании мочи выпадает в осадок белок Бенс-Джонса, количество которого при миеломной болезни составляет 4 – 12 г в сутки или более.
Указанные показатели анализов крови и мочи не специфичны только для миеломы, и могут встречаться при широком спектре различных заболеваний. Поэтому анализы мочи и крови в диагностике миеломы должны рассматриваться исключительно в комплексе с результатами других диагностических манипуляций, таких, как рентген, миелограмма, компьютерная томография и иммуноэлектрофоретическое определение парапротеинов. Единственными специфичными для миеломы показателями анализов являются резкое увеличение СОЭ более 60 мм/час, высокая концентрация бета2-микроглобулина в крови и белок Бенс-Джонса в моче, который в норме вообще не обнаруживается.
В коагулограмме при миеломе отмечается увеличение МНИ более 1,5, ПТИ выше 160% и ТВ больше нормы, а АЧТВ, как правило, остается нормальным.
Миелограмма представляет собой подсчет количества различных клеток костного мозга в мазке. При этом мазок готовится точно так же, как и мазок крови для обычного общего анализа. Костный мозг для миелограммы забирается при помощи специального мандрена из крыла подвздошной кости или грудины. В миелограмме при миеломной болезни обнаруживается более 12% плазмоцитов на различных стадиях созревания. Также имеются патологические клетки с вакуолями в цитоплазме и колесообразным хроматином ядра. Количество плазмоцитов более 12% и угнетение других ростков кроветворения подтверждают диагноз миеломной болезни.
Определение парапротеинов методом иммуноэлектрофореза и иммуноглобулинов по Манчини являются специфическими анализами, результаты которых однозначно отвергают или подтверждают миеломную болезнь. Наличие парапротеинов в крови или моче, и концентрация иммуноглобулинов выше нормы – это точное подтверждение миеломы. Причем высокое содержание какого-либо иммуноглобулина в крови называется М-градиентом (мю-градиентом).
После получения результатов всех анализов и обследований диагноз миеломы выставляется на основании различных диагностических критериев.
Классическими диагностическими критериями миеломы считаются следующие показатели анализов:
1. Количество плазмоцитов в костном мозге на основании данных миелограммы 10% или более.
2. Наличие или отсутствие плазмоцитов в биоптатах тканей не костного мозга (в почках, селезенке, лимфоузлах и т.д.).
3. Наличие М-градиента в крови или моче (повышенная концентрация иммуноглобулинов).
4. Наличие какого-либо из следующих признаков:
- Уровень кальция выше 105 мг/л;
- Уровень креатинина более 20 мг/л (200 мг/мл);
- Уровень гемоглобина ниже 100 г/л;
- Остеопороз или размягчение костей.
То есть, если у человека по результатам анализов выявлены указанные критерии, то диагноз миелома считается подтвержденным.
Во-первых, следует знать, что не существует методов радикального лечения миеломы, поэтому вся терапия заболевания направлена на продление жизни. То есть, миелому нельзя вылечить полностью, как например, рак прямой кишки, груди или другого органа, можно только остановить прогрессирование опухоли и ввести ее в состояние ремиссии, что и продлит жизнь человека.
Лечение миеломы складывается из применения специализированных цитостатических методов, которые обеспечивают остановку прогрессирования опухоли и продлевают жизнь человека, и симптоматической терапии, направленной на коррекцию нарушений работы жизненно-важных органов и систем.
К цитостатическим методам лечения миеломной болезни относят химиотерапию и лучевую терапию. Причем к лучевой терапии прибегают только в том случае, если химиотерапия оказалась неэффективной. К симптоматическим методам терапии миеломы относят хирургические операции при сдавлении органов, применение обезболивающих препаратов, коррекцию уровня кальция в крови, лечение почечной недостаточности и нормализацию свертываемости крови.

Монохимиотерапия проводится одним из следующих препаратов по схеме:
- Мелфалан – принимать по 0,5 мг/кг 4 дня через каждые 4 недели, и вводить внутривенно по 16 – 20 мг на 1 м 2 площади тела также по 4 дня через каждые 2 недели.
- Циклофосфамид – принимать по 50 – 200 мг один раз в день в течение 2 – 3 недель или вводить внутримышечно по 150 – 200 мг в сутки через каждые 2 – 3 дня в течение 3 – 4 недель. Можно вводить раствор внутривенно по 600 мг на 1 м 2 площади тела один раз в две недели. Всего следует сделать 3 внутривенные инъекции.
- Леналидомид – принимать по 25 мг каждый день в одно и то же время в течение 3 недель. Затем делают перерыв на неделю после чего возобновляют терапию, постепенно снижая дозировку до 20, 15 и 5 мг. Леналидомид следует сочетать с Дексаметазоном, который принимается по 40 мг 1 раз в сутки.
Полихимиотерапия проводится по следующим схемам:
- Схема МР – Мелфалан принимать в таблетках по 9 мг/м 2 и Преднизолон по 100 – 200 мг в течение 1 – 4 дней.
- Схема М2 – в 1 день внутривенно вводить три препарата: Винкристин по 0,03 мг/кг, Циклофосфамид по 10 мг/кг и BCNU по 0,5 мг/кг. С 1 по 7 дни вводить внутривенно Мелфалан по 0,25 мг/кг и принимать внутрь по 1 мг/кг Преднизолона.
- Схема VAD – в 1 – 4 дни включительно внутривенно вводить два препарата: Винкристин по 0,4 мг/м 2 и Доксирубицин по 9 мг/м 2 . Одновременно с Винкристином и Доксирубицином следует принимать по 40 мг Дексаметазона один раз в день. Затем с 9 по 12 и с 17 по 20 дни принимают только по 40 мг Дексаметазона в таблетках по одному разу в сутки.
- Схема VBMCP (мегадозная химиотерапия для людей моложе 50 лет) – в 1 день внутривенно вводят три препарата: Кармустин по 100-200 мг/м 2 , Винкристин по 1,4 мг/м 2 и Циклофосфамид по 400 мг/м 2 . С 1 по 7 дни включительно принимают внутрь в таблетках два препарата: Мелфалан по 8 мг/м 2 1 раз в сутки и Преднизолон по 40 мг/м 2 1 раз в день. Через 6 недель повторно в той же дозе вводят Кармустин.
Если химиотерапия оказалась эффективной, то после завершения курса производят трансплантацию собственных стволовых клеток костного мозга. Для этого в ходе пункции забирают костный мозг, выделяют из него стволовые клетки и подсаживают их обратно. Кроме того, в периоды между курсами химиотерапии для максимального продления периода ремиссии рекомендуется вводить внутримышечно препараты альфа-интерферона (Альтевир, Интрон А, Лайфферон, Реколин и т.д.) по 3-6 млн ЕД по 3 раза в неделю.
Химиотерапия позволяет достичь полной ремиссии в 40% случаев и частичной – в 50%. Однако даже при полной ремиссии часто возникает рецидив миеломы, поскольку заболевание является системным и поражает большое количество тканей.
Подробнее о химиотерапии

Для купирования болей сначала применяют препараты группы НПВС и спазмолитики – Спазган, Седальгин, Ибупрофен и Индометацин. Если эти препараты не эффективны, то для купирования болей принимают средства центрального действия, такие, как Кодеин, Трамадол или Просидол. Для усиления эффекта к средствам центрального действия можно добавлять препараты группы НПВС. И только если сочетанный прием препаратов НПВС и центрального действия не эффективен, то для купирования болей прибегают к применению наркотических анальгетиков, таких как, Морфин, Омнопон, Бупренорфин и др.
Для устранения гиперкальциемии применяют препараты, содержащие ибандронат натрия, кальцитонин, преднизолон, витамин Д и метандростенолол, в индивидуальных дозировках.
Для поддержания функций почек при почечной недостаточности рекомендуется принимать Хофитол, Ретаболил, Празозин и Фуросемид в индивидуальных дозировках. При выраженном повышении концентрации мочевины крови на фоне почечной недостаточности производят гемодиализ или плазмаферез.
К сожалению, прогноз при миеломной болезни неблагоприятный. В среднем химиотерапия в сочетании с симптоматическим лечением позволяет добиться ремиссии на 2 – 3 года практически у всех больных, увеличивая продолжительность жизни более чем на 2 года. Без лечения продолжительность жизни больных миеломой не превышает 2 лет.
В среднем продолжительность жизни при миеломе на фоне лечения составляет 2 – 5 лет, в редких случаях – до 10 лет, а без терапии – менее 2 лет. Полное излечение с продолжительностью жизни более 10 лет возможно только при солитарной форме миеломы.
Множественная миелома (миеломная болезнь): симптомы и патогенез заболевания, прогноз и продолжительность жизни, отзывы пациентов и рекомендации врача — видео
Автор: Наседкина А.К. Специалист по проведению исследований медико-биологических проблем.
источник
Миеломная болезнь (плазмоцитома) – злокачественная опухоль костного мозга, состоящая из плазматических клеток, которые в результате мутации превратились в злокачественные миеломные клетки. В пораженных костях костный мозг может полностью состоять из таких атипичных клеток. Болезнь относится к парапротеинемическим лейкозам, которые часто называют «рак крови».
При миеломной болезни злокачественные клетки не выходят в кровь. Но они вырабатывают видоизмененные иммуноглобулины – парапротеины, которые поступают в кровяное русло. Эти белки откладываются в тканях в виде особого вещества – амилоида и нарушают работу органов (почек, сердца, суставов).
Проявления миеломной болезни: боли в костях, патологические переломы, тромбозы и кровотечения. Начальные стадии плазмоцитомы протекают бессимптомно и выявляются случайно: на рентгене или при значительном повышении белка в моче.
Локализация. Опухоль образуется преимущественно в плоских костях (череп, ребра, таз, лопатки) и в позвонках. Вокруг злокачественных клеток появляются полости с ровными краями. Это результат лизиса (растворения) костной ткани остеокластами – особыми клетками, которые отвечают за разрушение застаревших костных клеток.
Причины возникновения миеломной болезни окончательно не выяснены. Заболевание преимущественно обнаруживается у людей подвергшихся радиоактивному облучению.
Статистика. Миеломная болезнь – наиболее распространенное заболевание среди плазмоклеточных опухолей: 1% от всех онкологических заболеваний и 10% от онкологических болезней крови. Ежегодно миеломная болезнь обнаруживается у 3 человек на 100 тысяч населения. Статистика заболеваемости выше у людей с черным цветом кожи. Большинство заболевших – мужчины старше 60 лет. Люди до 40 лет болеют исключительно редко.
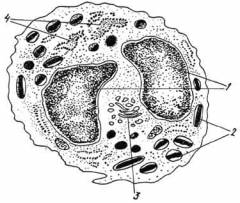
У здоровых людей плазмоциты составляют 5% от всех клеток костного мозга. Если их количество превысило 10%, то это уже говорит о развитии болезни.
Функции плазмоцитов – производство антител-иммуноглобулинов, обеспечивающих иммунитет в жидкостях (крови, лимфе, слюне). Плазмоциты являются одноклеточными железами, которые вырабатывают сотни иммуноглобулинов за секунду.
Как образуются плазмоциты? Этот процесс состоит из нескольких этапов:
- Предшественники плазмоцитов – В-лимфоциты образуются из стволовых клеток в печени и костном мозге. Это происходит в эмбриональный период, до рождения ребенка.
- В-лимфоциты с током крови попадают в лимфатические узлы и селезенку, лимфоидную ткань кишечника, где происходит их созревание.
- Здесь В-лимфоцит «знакомится» с антигеном (частью бактерии или вируса). Посредниками в этом процессе становятся другие иммунные клетки: моноциты, макрофаги, гистиоциты и дендритные клетки. Впоследствии, В-лимфоцит будет вырабатывать иммуноглобулины для обезвреживания только одного антигена. Например, вируса гриппа.
- В-лимфоцит активируется – начинает выделять антитела. На этом этапе он превращается в иммунобласт.
- Иммунобласт активно делится – клонируется. Он образует множество идентичных клеток, способных выделять одинаковые антитела.
- В результате последней дифференцировки клонированные клетки превращаются в одинаковые плазмоциты или плазматические клетки. Они вырабатывают иммуноглобулины и с их помощью защищают организм от чужеродных антигенов (вирусов и бактерий).
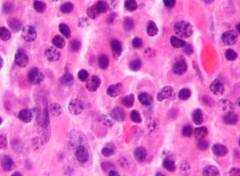
Злокачественная клетка образуется в костном мозге и прорастает в костную ткань. Там миеломные клетки активно делятся, их количество увеличиваются. Сами они обычно не выходят в кровь, но выделяют большое количество патологического иммуноглобулина парапротеина. Это патологический иммуноглобулин, который не принимает участия в иммунной защите, а откладывается в тканях и может быть обнаружен при анализе крови.
Попадая в костную ткань, миеломные клетки начинают взаимодействовать со своим окружением. Они активируют остеокласты, которые разрушают хрящи и костную ткань, образуя пустоты.
Миеломные клетки также выделяют особые белковые молекулы – цитокины. Эти вещества выполняют ряд функций:
- Стимулируют рост миеломных клеток. Чем больше в организме миеломных клеток, тем быстрее появляются новые очаги болезни.
- Угнетают иммунитет, в задачи которого входит уничтожение опухолевых клеток. Результатом становятся частые бактериальные инфекции.
- Активизируют остеокласты, которые разрушают кости. Это приводит к боли в костях и патологическим переломам.
- Стимулируют рост фибробластов, секретирующих фиброген и эластин. Это повышает вязкость плазмы крови и вызывает появление синяков и кровотечений.
- Вызывают рост клеток печени – гепатоцитов. При этом нарушается образование протромбина и фибриногена, ведущее к снижению свертываемости крови.
- Нарушают белковый обмен (особенно при миеломе Бенс-Джонса), что провоцирует поражение почек.
Течение болезни медленное. С момента появления первых миеломных клеток до развития яркой клинической картины проходит 20-30 лет. Однако после появления первых симптомов болезни, в течение 2-х лет может привести к летальному исходу, если не будет назначено правильное лечение.
Причины миеломной болезни до конца не выяснены. Среди врачей нет однозначного мнения, что провоцирует мутацию В-лимфоцита в миеломную клетку.
У кого повышен риск развития миеломной болезни?
- Мужчины. Миеломная болезнь развивается, когда уровень мужских половых гормонов снижается с возрастом. Женщины болеют значительно реже.
- Возраст 50-70 лет. Люди младше 40 лет составляют лишь 1% больных. Это обясняется тем, что с возрастом иммунитет слабее выявляет и уничтожает раковые клетки.
- Генетическая предрасположенность. У 15% больных родственники также страдают от этой формы лейкоза. Такая особенность вызвана мутацией гена, который отвечает за созревание В-лимфоцитов.
- Ожирение нарушает обмен веществ, снижает иммунитет, что создает условия для появления злокачественных клеток.
- Радиоактивное облучение (ликвидаторы аварии на ЧАЭС, люди прошедшие лучевую терапию) и длительное воздействие токсинов (асбест, мышьяк, никотин). Эти факторы повышают вероятность мутации в процессе формирования плазмоцита. В результате он превращается в миеломную клетку, которая дает начало опухоли.
При плазмоцитоме в первую очередь страдают кости, почки и иммунная система. Симптомы миеломной болезни зависят от стадии развития опухоли. У 10% больных клетки не вырабатывают парапротеины и болезнь протекает бессимптомно.
Пока злокачественных клеток не много, болезнь себя не проявляет. Но постепенно их количество увеличивается, и они заменяют нормальные клетки костного мозга. При этом в кровь поступает большое количество парапротеинов, которые негативно влияют на организм.
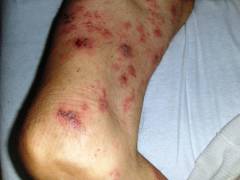
- Боли в костях. Под воздействием миеломных клеток в кости образуются полости. Костная ткань богата болевыми рецепторами, при их раздражении развивается ноющая боль. Она становится сильной и острой при повреждении надкостницы.
- Боли в сердце, суставах, мышечных сухожильях связаны с отложением в них патологических белков. Эти вещества нарушают функционирование органов и раздражают чувствительные рецепторы.
- Патологические переломы. Под воздействием злокачественных клеток в кости образуются пустоты. Развивается остеопороз, кость становится хрупкой и ломается даже при незначительной нагрузке. Чаще всего происходят переломы бедренных костей, ребер и позвонков.
- Снижение иммунитета. Нарушается функция костного мозга: он вырабатывает недостаточно лейкоцитов, что приводит к угнетению защитных сил организма. Количество нормальных иммуноглобулинов в крови уменьшается. Часто возникают бактериальные инфекции: отит, ангина, бронхит. Болезни затяжные и плохо поддаются лечению.
- Гиперкальциемия. Из разрушенной костной ткани большое количество кальция попадает в кровь. Это сопровождается запорами, болью в животе, тошнотой, выделением большого количества мочи, эмоциональными расстройствами, слабостью, заторможенностью.
- Нарушение функции почек – миеломная нефропатия вызвана тем, что кальций откладывается в почечных протоках в виде камней. Также почки страдают от нарушения белкового обмена. Парапротеины (белки, вырабатываемые раковыми клетками) поступают через почечный фильтр, и откладывается в канальцах нефронов. При этом почка сморщивается (нефросклероз). Кроме того нарушается отток мочи из почек. Жидкость застаивается в почечных чашечках и лоханках, при этом атрофируется паренхима органа. При миеломной нефропатии отеки отсутствуют, артериальное давление не повышено.
- Анемия, преимущественно нормохромная – цветовой показатель (соотношение гемоглобина к количеству эритроцитов) остается в норме 0,8 -1,05. При повреждении костного мозга снижается выработка эритроцитов. При этом пропорционально уменьшается концентрация гемоглобина в крови. Поскольку гемоглобин отвечает за транспортировку кислорода, то при анемии клетки ощущают кислородное голодание. Это проявляется быстрой утомляемостью, снижением концентрации внимания. При нагрузке возникает одышка, сердцебиение, головная боль, бледность кожи.
- Нарушения свертываемости крови. Повышается вязкость плазмы. Это приводит к спонтанному склеиванию эритроцитов в виде монетных столбиков, что может вызвать образование тромбов. Снижение уровня тромбоцитов (тромбоцитопения) приводит к спонтанным кровотечениям: носовым и десенным. Если повреждаются мелкие капилляры, то кровь выходит под кожу – образуются синяки и кровоподтеки.
- Сбор анамнеза. Врач анализирует, как давно появились боли в костях, онеменеие, утомляемость, слабость, кровотечения, кровоизлияния. Учитывается наличие хронических заболеваний и вредных привычек. На основе результатов лабораторных и инструментальных исследований ставиться диагноз, определяется форма и стадия миеломной болезни, назначается лечение.
- Осмотр. Выявляет внешние признаки миеломной болезни:
- опухоли на разных участках тела, преимущественно на костях и мышцах.
- кровоизлияния, возникшие в результате нарушения свертываемости крови.
- бледность кожных покровов – признак анемии.
- учащенный пульс – попытка сердца компенсировать недостаток гемоглобина ускоренной работой.
- Общий анализ крови. Лабораторное исследование, которое позволяет оценить общее состояние системы кроветворения, функции крови и наличие различных заболеваний. Забор крови осуществляется утром натощак. Для исследования берут 1 мл крови из пальца или из вены. Врач-лаборант изучает каплю крови под микроскопом, существуют автоматические анализаторы.
О миеломной болезни свидетельствуют такие показатели:
- повышение СОЭ – свыше 60-70 мм/час
- снижено количество эритроцитов – мужчины менее 4 10^12 клеток/л, женщины менее 3,7 10^12 клеток/л.
- снижено количество ретикулоцитов – менее 0,88% (из 100% эритроцитов)
- снижено количество тромбоцитов – менее 180 10^9 клеток/л.
- снижено количество лейкоцитов – менее 4 10^9 клеток/л.
- снижен уровень нейтрофилов – менее 1500 в 1 мкл (менее 55% от всех лейкоцитов)
- повышен уровень моноцитов – свыше 0,7 10^9 (более 8% от всех лейкоцитов)
- гемоглобин снижен – менее 100 г/л
- в крови могут обнаружиться 1-2 плазматические клетки.
Из-за угнетения кроветворной функции костного мозга уменьшается количество кровяных клеток (эритроцитов, тромбоцитов, лейкоцитов). Общее количество белка увеличивается за счет парапротеинов. Высокий уровень СОЭ свидетельствует о наличии злокачественной патологии.
Кровь забирается в утренние часы натощак, до приема лекарств и других исследований (рентгена, МРТ). Кровь берут из вены. В лаборатории в пробирки с кровью добавляют химические реагенты, которые вступают в реакцию с определяемыми веществами. Миеломную болезнь подтверждают:
- увеличение общего белка – свыше 90-100 г/л
- альбумин снижен мене 38 г/л
- уровень кальция повышен – свыше 2,75 ммоль/литр.
- мочевая кислота повышена – мужчины свыше 416,5 мкмоль/л, женщины свыше 339,2 мкмоль/л
- креатинин повышен – мужчины свыше 115 мкмоль/л, женщины свыше 97 мкмоль/л
- уровень мочевины повышен – более 6,4 ммоль/л
Выявленные отклонения свидетельствуют о повышении белка в крови за счет патологических парапротеинов, выделяемых миеломными клетками. Высокие уровни мочевой кислоты и креатинина указывают на поражение почек.
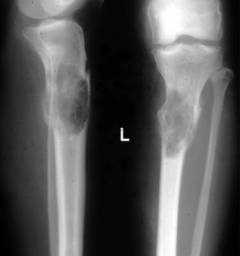 Миелограмма (трепанобиопсия) – изучение особенностей строения клеток костного мозга. С помощью специального прибора – трепана или иглы И. А. Кассирского делают пункцию (прокол) грудины или подвздошной кости. Извлекают образец клеток костного мозга. Из полученной паренхимы готовят мазок и под микроскопом изучают качественный и количественный состав клеток, их типы, соотношение, степень созревания.
Миелограмма (трепанобиопсия) – изучение особенностей строения клеток костного мозга. С помощью специального прибора – трепана или иглы И. А. Кассирского делают пункцию (прокол) грудины или подвздошной кости. Извлекают образец клеток костного мозга. Из полученной паренхимы готовят мазок и под микроскопом изучают качественный и количественный состав клеток, их типы, соотношение, степень созревания. Результаты при миеломной болезни:
- большое количество плазматических клеток – свыше 12%. Это указывает, на их аномальное деление и вероятность онкологических изменений.
- обнаруживаются клетки с большим количеством цитоплазмы, которая интенсивно окрашивается. В цитоплазме могут содержаться вакуоли. В ядерном хроматине заметен характерный рисунок, напоминающий колесо. Данные клетки не типичны для костного мозга здорового человека.
- угнетение нормального кроветворения
- большое количество незрелых нетипичных клеток
Изменения свидетельствуют, что нарушена нормальная работа костного мозга. Его функциональные клетки заменены злокачественными плазматическими клетками.
Для исследования берут кровь из вены в утренние часы. В ряде случаев может быть использована моча. В сыворотке крови обнаруживаются парапротеины, выделяемые миеломными клетками. В крови здоровых людей этих измененных иммуноглобулинов не обнаруживается.
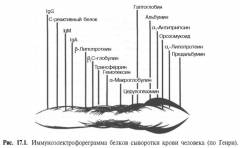
В зависимости от варианта миеломы выявляют:
- парапротеин класса IgG
- парапротеин класса IgА
- парапротеин класса IgD
- парапротеин класса IgЕ
- бета-2 микроглобулин
Данный анализ считается самым чувствительным и точным исследованием для определения миеломной болезни.
При миеломной болезни в моче обнаруживается:
- повышение относительной плотности – в моче содержится большое количество молекул (в основном белка)
- наличие эритроцитов
- повышено содержание белка (протеинурия)
- присутствуют цилиндры в моче
- белок Бенс-Джонса (фрагменты парапротеина) – свыше 12 г/сут (выпадает в осадок при нагревании)
Изменения в моче свидетельствуют о поражении почек парапротеинами и нарушении белкового обмена в организме.
Рентгенография костей метод рентгенологического исследования костей. Цель выявить участки поражения костей и подтвердить диагноз «миеломная болезнь». Для того чтобы получить полное представление о степени поражения делают снимки с передней и боковой проекции.
Изменения на рентгене при миеломной болезни:
- признаки очагового или диффузного остеопороза (снижение плотности костной ткани)
- «дырявый череп» – круглые очаги разрушения в черепе
- плечевые кости – отверстия в виде сот или «мыльных пузырей»
- ребра и лопатки имеют отверстия, «изъеденные молью» или «сделанные пробойником»
- позвонки сдавливаются и укорачиваются. Они приобретают вид «рыбьих позвонков»
При рентгенографии запрещено использование контрастных веществ. Так как йод, входящий в их состав, образует нерастворимый комплекс с белками выделяемыми миеломными клетками. Это вещество сильно повреждает почки.
- очаги разрушения кости
- опухоли мягких тканей
- деформация костей и позвонков
- ущемление спинного мозга в результате разрушения позвонков
Томография помогает выявить все очаги поражения костей и оценить распространенность миеломной болезни.
Химиотерапия является основным методом лечения единичных и множественных плазмоцитом.
Монохимиотерапия – лечение одним химиотерапевтическим препаратом.
| Представители | Механизм лечебного действия | Способ применения |
| Мелфалан Эффективность при назначении составляет 50%. | Углеродные соединения встраиваются в молекулу ДНК миеломных клеток. Это приводит к перекрестному связыванию двух цепочек ДНК и злокачественные клетки прекращают размножаться. | По 0,15 – 0,2 мг на килограмм массы тела в течение 4-х дней. Интервал между курсами лечения 4 недели. Препарат принимают внутрь или внутривенно. |
| Циклофосфамид (циклофосфан) Эфективность при монотерапии приближается к 50% | Действующее вещество встраивается в ДНК злокачественной клетки и заменяет собой одно из звеньев молекулы. При этом нарушается процесс деления клеток. Вызывает гибель миеломных клеток. | Внутрь по 50–200 мг на протяжении 2-3 недель. Внутримышечно по 200–400 мг. Инъекции делают 2-3 раза в неделю. Курс 3-4 недели. Внутривенно по 600 мг на 1 кв. м поверхности тела. Курс лечения одна инъекция в 2 недели. Необходимо 3 дозы. |
| Леналидомид Эффективен у 60% больных. | Повышает иммунную защиту против злокачественных клеток – активирует Т-киллеры. Препятствует образованию новых кровяных сосудов (капилляров) питающих опухоли. | Капсулу 25 мг проглатывать, не разжевывая, запивая достаточным количеством жидкости. Употребляют ежедневно в одно и то же время после еды. Курс лечения 3 недели, перерыв 7 дней. Перед повторным курсом необходима коррекция дозы. Ее пошагово снижают: 25, 15, 10, 5 мг. Препарат принимают совместно с дексаметазоном ( по 40 мг 1 раз в день) |
Химиотерапевтические препараты может назначать только врач-химиотерапевт, имеющий опыт в применении цитостатиков. Во время лечения необходим постоянный контроль за состоянием пациента и показателями периферической крови.
Полихимиотерапия – лечение миеломной болезни с помощью комплекса противоопухолевых средств.
В полихимиотерапии самыми эффективными признаны схемы VAD и VBMCP. На протяжении 6 месяцев после установки диагноза проводят 3 курса полихимиотерапии.
| Препараты | Механизм лечебного действия | Способ применения |
| Винкристин | Препарат блокирует белок, необходимый для постройки внутриклеточного скелета (микротрубочек) миеломных клеток. Останавливает деление клеток. | По 0,4 мг/день 1-4 дня. Препарат вводят постоянно внутривенно на протяжении суток. |
| Адриамицин (доксорубицин) | Подавляет рост и размножение клеток. При его применении образуются свободные радикалы. Они воздействуют на мембраны клеток, угнетают синтез нуклеиновых кислот (ДНК) несущих наследственную информацию. | Вводят внутривенно из расчета 9 мг/м² поверхности тела в день. Курс лечения 1-4 дня в виде постоянной капельницы. |
| Дексаметазон | Назначается в качестве профилактики побочных эффектов при химиотерапии. | Принимают внутрь или внутривенно по 40 мг/день. Дни 1-4, 9-12, 17-20. |
Схема VBMCP
| Препараты | Механизм лечебного действия | Способ применения |
| Кармустин | Угнетает обменные процессы в клетке, нарушает энергообеспечение и деление злокачественных клеток. | Вводится внутривенно капельно в первый день лечения. Дозу подбирают индивидуально из расчета 100-200 мг/м 2 поверхности тела. Следующая доза через 6 недель (по результатам анализа крови). |
| Винкристин | Блокирует митотическое деление клеток. | Препарат вводят внутривенно капельно по 1,4 мг/м² поверхности тела. Водят в первый день лечения. |
| Циклофосфамид | Оказывает токсическое действие на злокачественные клетки, обладает противоопухолевым эффектом. Нарушают целостность цепочек ДНК и размножение миеломных клеток. | Назначают индивидуально. Примерная дозировка по 400 мг/м² внутривенно в 1-й день лечения. |
| Мелфалан | Останавливает синтез белка, необходимого для размножения миеломных клеток. Разрушает их молекулы ДНК. | Применяют внутрь по 8 мг/м². Дни лечения с 1-го по 7-й. |
| Преднизолон | Кортикостероиды применяют для уменьшения побочного действия химиопрепаратов и профилактики гиперкальцемии. | Применяют внутрь по 40 мг/м² в дни с 1-го по 7-й. |
После достижения ремиссии в течение длительного периода назначают интерферон альфа 3 раза в неделю по 3 млн ЕД в для поддержания организма.
Химиотерапия угнетает кроветворение, поэтому периодически требуется трансфузия (вливание) эритроцитной, лейкоцитной или тромбоцитной массы.
Эффективность полихимиотерапии при миеломной болезни: у 41% больных удается достичь полного исчезновения симптомов (полная ремиссия). У 50% симптомы значительно уменьшились (частичная ремиссия).
К сожалению, у значительной части больных, даже после успешного лечения возникает рецидив. Это связано с тем, что в состав опухоли входят разнообразные клетки. Одни из них погибают во время курса химиотерапии, другие остаются и со временем дают начало новой опухоли. Обострение миеломной болезни лечат препаратами с большей активностью.
- Обезболивание
Обезболивание при миеломной болезни проводится трехступенчато:
I ступень – нестероидные противовоспалительные препараты (спазган, седалгин, индометацин, ибупрофен) используют для лечения слабой боли.
| Препарат | Механизм действия | Способ применения |
| Спазган | Оказывает обезболивающее, спазмолитическое и жаропонижающее действие. Препарат блокирует окончания парасимпатических нервных волокон, обеспечивая устранение спазмов и обезболивание. Назначают при болях в костях и внутренних органах. | По 1 таблетке 2 раза в день независимо от приема пищи. |
| Седалгин | Обезболивающее средней силы с успокаивающим эффектом. Рекомендовано при сдавливании нервного корешка и боли по ходу спинномозгового нерва. | По 1-2 таблетки 2-3 раза в день. |
| Индометацин | Блокирует синтез простагландинов, веществ ответственных за появление боли. Один из сильнейших нестероидных обезболивающих препаратов. | Принимают внутрь по 25 мг 2-3 раза в день после еды. При необходимости доза может быть увеличена до 150 мг в сутки. |
| Ибупрофен | Замедляет синтез простагландинов и фермента циклооксигеназы, чем ослабляет воспаление и боль. Эффективен при болях в костях и суставах. | В таблетках по 0,2 г 3-4 раза в день. Для профилактики раздражения слизистой оболочки желудка, рекомендовано принимать после еды. |
II ступень – слабые опиоиды, они же наркотические анальгетики (кодеин, трамундин, трамадол, дигидрокодеин, просидол). Для усиления обезболивающего эффекта используют совместно с нестероидными противовоспалительными препаратами (парацетамол, диклофенак, кеторолак). Назначают при нарастании болевого синдрома.
| Препарат | Механизм действия | Способ применения |
| Кодеин | Оказывают болеутоляющий эффект. Выделяемый из препаратов морфин связывается с опиодными рецепторами центральной нервной системы и блокирует прохождение болевых импульсов | По 0,015 г 4 раза в день. Максимальная суточная доза 0,06-0,09 г. |
| Трамадол | По 0, 05 – 0,1 г 3-4 раза в день. Суточная доза не должна превышать 0,4 г. | |
| Дигидрокодеин | По 0,06 – 0,12 г. Действие препарата длится до 12 часов, принимают 2 — 3 раза в день. | |
| Просидол | Активирует обезболивающую систему на разных уровнях ЦНС. Изменяет восприятие боли на эмоциональном уровне. | Таблетки для рассасывания под языком по 0,01–0,02 г. Максимальная доза 0,05–0,25 г в сутки. |
Внимание! При длительном применении вызывают привыкание и наркотическую зависимость.
III ступень – опиоиды сильного действия (морфин, омнопон, бупренорфин, налоксон, дюрагезик) предпочтительнее для лечения выраженной боли.
| Препарат | Механизм действия | Способ применения |
| Морфин | Подавляет сильную боль. Вещество блокирует прохождение болевых импульсов через рецепторы нервной системы. Оказывает успокаивающее действие. | По 0,01 г 4-5 раз в сутки. |
| Омнопон | Связываются с опиодными рецепторами нервной системы и подавляют чувствительность к боли. | По 0,02–0,04 г 3-4 раза в день. Суточная доза не должна превышать 0,12 г. |
| Бупренорфин | По 0,2-0,4 мг. Эффективен в меньших концентрациях, чем морфин. Суточная доза не должна превышать 1,2-1,6 мг. | |
| Налоксон | Вытесняет химические вещества, которые связываются с болевым рецептором. Связывается с опиатными рецепторами и блокирует их работу. | Принимают по 0,4 мг не более 2-х раз в день. |
Строго соблюдайте дозировку и рекомендации врача. Это снижает риск развития побочных эффектов и зависимости.
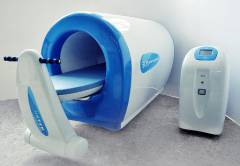
- Магнитотурботрон. Лечение магнитным полем низкой частоты оказывает положительное воздействие на организм:
- вызывает противовоспалительный и обезболивающий эффект
- замедляет митотическое деление злокачественных миеломных клеток
- повышает иммунитет и активирует естественную противоопухолевую защиту
- уменьшает побочные эффекты химиотерапии.
Продолжительность 10-15 минут. Курс 10 сеансов. Желательно повторять лечение 2 раза в год.
- Электросон. Воздействие на структуры мозга импульсными токами низкой или звуковой частоты (1-130 Гц), прямоугольной формы, малого напряжения и силы. Раздражение рефлекторных зон на коже век и затылка, а также непосредственное влияние тока на мозг вызывает:
- дремоту и сонливость
- снижает чувствительность к боли
- оказывает успокаивающее действие
Длительность процедуры 30-90 минут. Курс лечения 10-15 сеансов.
Для нормализации состава крови необходимо употреблять 3-4 литра жидкости в сутки. При этом излишки кальция вымываются из организма с мочой. Ее количество должно составлять 3-4 литра в сутки. 2 раза в сутки определяют количество электролитов, чтобы поддерживать в норме ионы калия и магния.
| Препарат | Механизм действия | Способ применения |
| Ибандронат натрия (Ибандроновая кислота) | Подавляет разрушение кости, уменьшает концентрацию кальция в крови. Предотвращает появление метастазов в кости. | Назначают короткими курсами. Вводят внутривенно по 2-4 мг в сутки. |
| Кальцитонин | Регулирует обмен кальция в костной ткани. Подавляет разрушение костей, способствует выведению кальция с мочой. | Вводят подкожно или внутримышечно 6–12 ч по 4–8 МЕ/кг. Курс 2-4 недели. После чего дозу уменьшают и продолжают лечение 6 недель. |
| Преднизолон | Пульс-терапия высокими дозами для подавления воспалительных реакций. Тормозит активность В-лимфоцитов и миеломных клеток. | 40 мг/м² принимают внутрь. Курс 5-7 дней. |
| Витамин D (эргокальциферол) | Для профилактики остеопороза и разрушения кости. | 300-500 ME в сутки в течение 45 дней. |
| Андрогены: метандростенолон | Нормализует обмен белков и укрепляет костную ткань в сочетании с витамином D. | Принимают внутрь по 0,005-0,01 г в день перед едой. Курс до 6 недель. |
Лечение почечной недостаточности при миеломной болезни
Повреждение большого числа нефронов приводит к нарушению функции почек. В основе лечения почечной недостаточности лежит борьба с основным заболеванием. Цель: уменьшить количество миеломных клеток и их парапротеинов, которые откладываются в почках. Также назначают препараты, поддерживающие почки, и средства для выведения токсинов.
| Препарат | Механизм действия | Способ применения |
| Хофитол | Увеличивает выделение мочевины с мочой, способствует очищению крови. | 5-10 мл препарата вводят внутривенно или внутримышечно. 12 инъекций на курс. |
| Ретаболил | Анаболический препарат назначают для снижения уровня азота в крови. С его помощью азот из мочевины используется в организме для синтеза белка. | Внутримышечно вводят по 1 мл 1 раз в неделю. Курс 2-3 недели. |
| Натрия цитрат | Применяют для борьбы с нарушением кислотно-щелочного баланса и повышенной кислотностью крови. Одновременно снижается количество кальция в крови. | Принимают в таблетках по 1,5-2 г 3 раза в день после еды. Суточная доза не должна превышать 4-8 г. |
| Празозин | Периферический вазодилататор снижает артериальное давление, повышает почечный кровоток и улучшает клубочковую фильтрацию | Первую дозу принимают на ночь, лежа в постели. Возможно сильное снижение давления вплоть до обморочного состояния. В дальнейшем по 0.5-1 мг 2-3 раза в день |
| Каптоприл | Ингибитор АПФ снижает сопротивление сосудов, расширяет их просвет. Нормализует внутриклубочковое кровообращение в почках. Способствует их нормальной работе и скорейшему выведению кальция. | По 0.25-0.5 мг/кг 2 раза в день натощак. Можно под язык. |
| Клубочковые диуретики (мочегонные) не рекомендуются при лечении миеломной болезни. | ||
Питьевой режим – около 3-х литров в день. Количество выделяемой мочи должно быть в пределах 2-2,5 литра.
Если нет отеков, то нет необходимости ограничивать потребление соли. Это может привести к нарушению электролитного баланса (слабости, потере аппетита, обезвоживанию).
Рекомендована диета с низким содержанием белка до 40-60 г в сутки. Ограничивают потребление мяса, рыбы, яиц.
При высоком уровне мочевины в крови рекомендован гемодиализ – очищение крови вне организма с помощью аппарата «искусственная почка».

- Пересадка костного мозга
- Удаление поврежденной кости
- Трансплантация гемопоэтических стволовых клеток совместно с химиотерапией мелфаланом. Метод довольно токсичен и связан с высокой смертностью (5-10%).
Длительная ремиссия (ослабление симптомов) возможна при соблюдении нескольких условий:
- болезнь выявлена на ранних стадиях
- пациент не имеет тяжелых сопутствующих заболеваний
- хорошая чувствительность к лечению цитостатическими средствами
- организм хорошо переносит лечение и не возникло тяжелых побочных эффектов
Врачи индивидуально подбирают лечение, которое позволяет контролировать болезнь. Комплексное использование химиотерапии и стероидных гормонов позволяет добиться ремиссии сроком на 2-4 года. Есть случаи, когда пациенты живут до 10-ти лет.
Среди пожилых людей химиотерапия низкими дозами и дексаметазон обеспечивают 2-хлетнюю выживаемость у 90% больных. Без лечения продолжительность жизни таких больных не превышает 2-х лет.
источник