Анализ периферической крови показывает, у большинства больных с множественной миеломой, наличие анемии. Эта анемия, обычно умеренная, гипохромного типа может быть иногда сильно выраженной (менее 1 миллиона гематий/мм3). На мазке наблюдаются аспекты анизоцитоза и пойкилоцитоза. Гематии проявляют часто тенденцию располагаться в виде «монетных столбиков»,—явление, связанное с наличием миеломатозных протеинов в сыворотке и с их скоплением на поверхности гематий. Количество Гб также понижено.
Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге.
Число тромбоцитов нормальное или умеренно пониженное.
Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости.
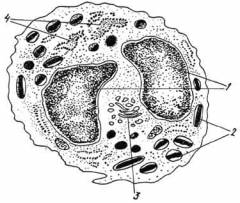
Для миеломы характерен численный рост плазмоцитарной серии, которая может составлять 90% клеточного населения костного мозга. Вообще, при 20% плазмоцитарных элементов ставится вопрос о существовании миеломы. Аномалийные плазмоцитарные элементы или так называемые «миеломатозные клетки», это клетки диаметром в 15—30(л, круглые или овальные. Ядро, диаметром в 5—7у., круглое, расположенное эксцентрично, содержит 1—2 нуклеоли. Нуклеарный хроматин менее комковатый и уже не представляет тот регулярный порядок, который наблюдается в нормальном плазмоците. Цитоплазма этих клеток интенсивно базофильная, становится яркосиней при окрашивании May-Grunwald-Giemsa (цветная вклейка III).
В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III).
Вариабильное число клеток может иметь 3 или более ядер. Другие имеют сильно выраженные черты незрелости: они более крупных размеров (20—35u) с болыпдм, круглым ядром, с очень тонким хроматином, а цитоплазма интенсивно базофильная. Встречаются также и несколько зрелых плазмоцитарных клеток, с ядром в виде «колесной спицы » и ясной перинуклеарной зоной. Иногда плазмоциты могут иметь ацидофильную цитоплазму, так называемые «пламенистые клетки » (flaming cells) (цветная вклейка III).
С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные.
Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.
Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид.
Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме.
Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев.
Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA.
Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14.
Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы.
Изменения протеинового метаболизма проявляются в трех формах:
1) появление сывороточной гипериротеинемии;
2) выведение протеинов через мочу и
3) отложение на уровне тканей аномалийных протеиновых веществ, известных под названием «амилоид» или «параамилоид».
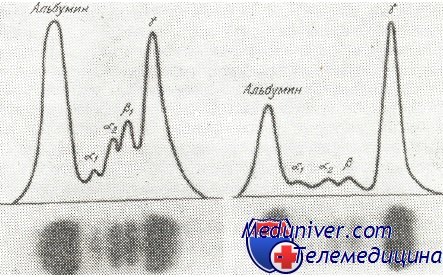
В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М.
В рамках множественной миеломы может происходить:
1) избыточный синтез, однако уравновешенный, цепей Н и L, с образованием цельных Ig;
2) неуравновешенный синтез, с избытком цепей L и образованием цельных Ig, параллельно с повышенным количеством свободных цепей L и
3) синтез лишь цепей L.
В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы).
В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2.
Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig.
Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр.
У больных с миеломой, количественный рост характерного миеломатозного Ig сопровождается сокращением производства других типов глобулинов.
Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакция оседания эритроцитов в большинстве случаев бывает очень ускоренной, достигая 100 мм в час. При миеломах Бенс-Джонса, РОЭ показывает более низкие цифры, иногда даже в нормальных пределах.
Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная.
В редких случаях отмечалось наличие сывороточных криоглобулинов с появлением синдрома Рейно на холоде и наблюдалось также наличие пироглобулинов.
Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными.
Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина.
В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты.
Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму.
Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота.
Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
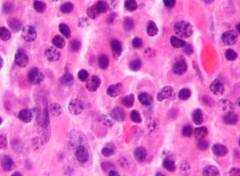
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы.
В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях.
При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick).
В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена.
Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации.
Почечная интерстициальная ткань представляет инфильтрационные поражения, либо благодаря миеломатозным клеткам, либо благодаря клеткам хронического воспаления.
В общей сложности, эти поражения составляют аспект «миеломатозной клетки».
источник
Миеломная болезнь (плазмоцитома) — заболевание, относящееся к парапротеинемическим гемобластозам, специфическим маркером которых, в большинстве случаев, являются иммуноглобулины (парапротеины) сыворотки крови.
Иммунохимические варианты миеломы определяются по классу иммуноглобулинов и типу легких цепей (λ или κ):
1. иммуноглобулин G — миелома встречается в 55-65 %,
3. иммуноглобулин D — миелома — в 2-5%,
5. болезнь легких цепей (миелома Бенс-Джонса) — в 12 -20%.
Общий анализ крови — у большинства больных анемия нормохромного и нормоцитарного типа. Железодефицитная анемия может развиться при кровотечениях, нарушениях гемостаза и по другим причинам. При дефиците витамина В12 и фолиевой кислоты в костном мозге выявляются признаки мегалобластного кроветворения (В12-дефицитной анемии, фолиеводефицитной анемии). Количество ретикулоцитов понижено. СОЭ увеличена.
У больных миеломной болезнью отмечается лейкопения, реже лейкоцитоз (повышенное количества лейкоцитов в крови). В лейкоцитарной формуле нейтропения, моноцитоз. Плазматические клетки обычно выявляются в небольшом количестве (лучше в лейкоконцентратах). Содержание тромбоцитов снижено.
Биохимический анализ крови — в сыворотке отмечается увеличение общего белка до 90 — 100 г/л и выше (повышение уровня гамма-глобулинов), количество альбумина снижено. При миеломной болезни возрастает уровень кальция, мочевой кислоты. У большинства больных отмечается повышение уровня креатинина и азота мочевины, снижение содержания электролитов. Значительное повышение активности альфа-нафтилацетатэстеразы выявляется в плазматических клетках.
Определение бета-2-микроглобулина используется для наблюдения за динамикой заболевания и эффективностью лечения.
При миеломной болезни проводят электрофорез белков сыворотки крови в полиакриламидном геле. Анализ выявляет М-компонент, чаще всего за счет иммуноглобулинов G и М (иммунохимические варианты миеломы). При миеломе Бенс-Джонса М-компонент в крови обычно отсутствует и выявляется на электрофореграмме белков мочи.
В анализе костного мозга находят большое количество плазматических клеток, которые выявляются у 86 — 95 % больных.
В анализе мочи при миеломной болезни находят протеинурию, цилиндрурию, белок Бенс-Джонса (свыше 12 г/сут). Поражение почек наблюдается при миеломной болезни у большинства больных. С учетом этого обстоятельства проводятся пробы Зимницкого и Реберга-Тареева.
- функция почек ослаблена в менее 50% случаев, обычно это потеря почечной концентрационной способности и азотемия
- протеинурия встречается часто из-за наличия микроальбумина и глобулинов в моче
- протеинурия Бенс-Джонса может быть интермиттирующей
- белок Бенс-Джонса наблюдается в 50% случаев миеломы, но почти всегда формируется почечная недостаточность вследствие миеломы почки
- выраженная анемия непропорциональна азотемии
- непостоянные изменения вследствие поврежденной функции канальцев:
— снижение уровня мочевой кислоты в сыворотке
— потеря с мочой фосфатов со снижением сывороточного фосфора и увеличением уровня щелочной фосфатазы
— нефрогенный несахарный диабет
— олигурия или анурия с острой почечной недостаточностью из-за дегидратации.
- гиперхлоремия (повышение уровня хлора) или гипербикарбонатемия с нормой или снижением натрия в сыворотке снижает ионную проницаемость, и следует предположить миелому при конкретных клинических симптомах
- изменения вследствие ассоциированной гиперкальциемии
источник
Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.
Правда, достоверных доказательств участия всего перечисленного в злокачественном перерождении не представлено. Ясно одно, что-то помешало нормальному созреванию В-лимфоцитов или вмешалось в многоэтапный путь от их «детства» до лимфатической зрелости, из-за чего-то лимфоцит превратился в дефектный плазмоцит, давший начало миеломе.
Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.
Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
Вырабатываемые злокачественными плазмоцитами парапротеины откладываются в тканях органов, излюбленное «место складирования» — почки, в которых развивается «болезнь лёгких цепей» с исходом в почечную недостаточность. В поражённой печени снижается выработка разжижающих кровь веществ — повышается вязкость крови, нарушающая обменные процессы в тканях, образуются тромбы. Отложения иммуноглобулинов наносят урон и другим органам, но не столь фатальный.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.
Давний маркёр заболевания — белок Бенс-Джонса в моче, выявляемый у 70% пациентов. Белок формируется из цепочек иммуноглобулинов А и G небольшого молекулярного веса — «лёгких», которые просачиваются из почечных канальцев. По содержания Бенс-Джонса тоже контролируют течение болезни.
Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.
Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
Для каждого варианта заболевания предусмотрены определенные количественные характеристики и сочетания критериев, так для полной убеждённости в наличии у пациента миеломы необходимо обнаружить специфические «продукты»:
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны. Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.
Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания. Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями. При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов. Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
Астенизированного человека наши предки называли «квёлым». Такие пациенты рискуют не перенести агрессивного лечения, но достаточно неплохо отвечают на более легкие варианты противоопухолевой химиотерапии.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.
Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
Играет роль концентрация парапротеинов и их фракций, объем поражения на момент выявления болезни и степень вовлечения в патологический процесс других органов, так уже развившаяся почечная недостаточность «перевесит» все прочие благоприятные признаки заболевания.
источник
Миеломная болезнь (плазмоцитома) – злокачественная опухоль костного мозга, состоящая из плазматических клеток, которые в результате мутации превратились в злокачественные миеломные клетки. В пораженных костях костный мозг может полностью состоять из таких атипичных клеток. Болезнь относится к парапротеинемическим лейкозам, которые часто называют «рак крови».
При миеломной болезни злокачественные клетки не выходят в кровь. Но они вырабатывают видоизмененные иммуноглобулины – парапротеины, которые поступают в кровяное русло. Эти белки откладываются в тканях в виде особого вещества – амилоида и нарушают работу органов (почек, сердца, суставов).
Проявления миеломной болезни: боли в костях, патологические переломы, тромбозы и кровотечения. Начальные стадии плазмоцитомы протекают бессимптомно и выявляются случайно: на рентгене или при значительном повышении белка в моче.
Локализация. Опухоль образуется преимущественно в плоских костях (череп, ребра, таз, лопатки) и в позвонках. Вокруг злокачественных клеток появляются полости с ровными краями. Это результат лизиса (растворения) костной ткани остеокластами – особыми клетками, которые отвечают за разрушение застаревших костных клеток.
Причины возникновения миеломной болезни окончательно не выяснены. Заболевание преимущественно обнаруживается у людей подвергшихся радиоактивному облучению.
Статистика. Миеломная болезнь – наиболее распространенное заболевание среди плазмоклеточных опухолей: 1% от всех онкологических заболеваний и 10% от онкологических болезней крови. Ежегодно миеломная болезнь обнаруживается у 3 человек на 100 тысяч населения. Статистика заболеваемости выше у людей с черным цветом кожи. Большинство заболевших – мужчины старше 60 лет. Люди до 40 лет болеют исключительно редко.
У здоровых людей плазмоциты составляют 5% от всех клеток костного мозга. Если их количество превысило 10%, то это уже говорит о развитии болезни.
Функции плазмоцитов – производство антител-иммуноглобулинов, обеспечивающих иммунитет в жидкостях (крови, лимфе, слюне). Плазмоциты являются одноклеточными железами, которые вырабатывают сотни иммуноглобулинов за секунду.
Как образуются плазмоциты? Этот процесс состоит из нескольких этапов:
- Предшественники плазмоцитов – В-лимфоциты образуются из стволовых клеток в печени и костном мозге. Это происходит в эмбриональный период, до рождения ребенка.
- В-лимфоциты с током крови попадают в лимфатические узлы и селезенку, лимфоидную ткань кишечника, где происходит их созревание.
- Здесь В-лимфоцит «знакомится» с антигеном (частью бактерии или вируса). Посредниками в этом процессе становятся другие иммунные клетки: моноциты, макрофаги, гистиоциты и дендритные клетки. Впоследствии, В-лимфоцит будет вырабатывать иммуноглобулины для обезвреживания только одного антигена. Например, вируса гриппа.
- В-лимфоцит активируется – начинает выделять антитела. На этом этапе он превращается в иммунобласт.
- Иммунобласт активно делится – клонируется. Он образует множество идентичных клеток, способных выделять одинаковые антитела.
- В результате последней дифференцировки клонированные клетки превращаются в одинаковые плазмоциты или плазматические клетки. Они вырабатывают иммуноглобулины и с их помощью защищают организм от чужеродных антигенов (вирусов и бактерий).
Злокачественная клетка образуется в костном мозге и прорастает в костную ткань. Там миеломные клетки активно делятся, их количество увеличиваются. Сами они обычно не выходят в кровь, но выделяют большое количество патологического иммуноглобулина парапротеина. Это патологический иммуноглобулин, который не принимает участия в иммунной защите, а откладывается в тканях и может быть обнаружен при анализе крови.
Попадая в костную ткань, миеломные клетки начинают взаимодействовать со своим окружением. Они активируют остеокласты, которые разрушают хрящи и костную ткань, образуя пустоты.
Миеломные клетки также выделяют особые белковые молекулы – цитокины. Эти вещества выполняют ряд функций:
- Стимулируют рост миеломных клеток. Чем больше в организме миеломных клеток, тем быстрее появляются новые очаги болезни.
- Угнетают иммунитет, в задачи которого входит уничтожение опухолевых клеток. Результатом становятся частые бактериальные инфекции.
- Активизируют остеокласты, которые разрушают кости. Это приводит к боли в костях и патологическим переломам.
- Стимулируют рост фибробластов, секретирующих фиброген и эластин. Это повышает вязкость плазмы крови и вызывает появление синяков и кровотечений.
- Вызывают рост клеток печени – гепатоцитов. При этом нарушается образование протромбина и фибриногена, ведущее к снижению свертываемости крови.
- Нарушают белковый обмен (особенно при миеломе Бенс-Джонса), что провоцирует поражение почек.
Течение болезни медленное. С момента появления первых миеломных клеток до развития яркой клинической картины проходит 20-30 лет. Однако после появления первых симптомов болезни, в течение 2-х лет может привести к летальному исходу, если не будет назначено правильное лечение.
Причины миеломной болезни до конца не выяснены. Среди врачей нет однозначного мнения, что провоцирует мутацию В-лимфоцита в миеломную клетку.
У кого повышен риск развития миеломной болезни?
- Мужчины. Миеломная болезнь развивается, когда уровень мужских половых гормонов снижается с возрастом. Женщины болеют значительно реже.
- Возраст 50-70 лет. Люди младше 40 лет составляют лишь 1% больных. Это обясняется тем, что с возрастом иммунитет слабее выявляет и уничтожает раковые клетки.
- Генетическая предрасположенность. У 15% больных родственники также страдают от этой формы лейкоза. Такая особенность вызвана мутацией гена, который отвечает за созревание В-лимфоцитов.
- Ожирение нарушает обмен веществ, снижает иммунитет, что создает условия для появления злокачественных клеток.
- Радиоактивное облучение (ликвидаторы аварии на ЧАЭС, люди прошедшие лучевую терапию) и длительное воздействие токсинов (асбест, мышьяк, никотин). Эти факторы повышают вероятность мутации в процессе формирования плазмоцита. В результате он превращается в миеломную клетку, которая дает начало опухоли.
При плазмоцитоме в первую очередь страдают кости, почки и иммунная система. Симптомы миеломной болезни зависят от стадии развития опухоли. У 10% больных клетки не вырабатывают парапротеины и болезнь протекает бессимптомно.
Пока злокачественных клеток не много, болезнь себя не проявляет. Но постепенно их количество увеличивается, и они заменяют нормальные клетки костного мозга. При этом в кровь поступает большое количество парапротеинов, которые негативно влияют на организм.
- Боли в костях. Под воздействием миеломных клеток в кости образуются полости. Костная ткань богата болевыми рецепторами, при их раздражении развивается ноющая боль. Она становится сильной и острой при повреждении надкостницы.
- Боли в сердце, суставах, мышечных сухожильях связаны с отложением в них патологических белков. Эти вещества нарушают функционирование органов и раздражают чувствительные рецепторы.
- Патологические переломы. Под воздействием злокачественных клеток в кости образуются пустоты. Развивается остеопороз, кость становится хрупкой и ломается даже при незначительной нагрузке. Чаще всего происходят переломы бедренных костей, ребер и позвонков.
- Снижение иммунитета. Нарушается функция костного мозга: он вырабатывает недостаточно лейкоцитов, что приводит к угнетению защитных сил организма. Количество нормальных иммуноглобулинов в крови уменьшается. Часто возникают бактериальные инфекции: отит, ангина, бронхит. Болезни затяжные и плохо поддаются лечению.
- Гиперкальциемия. Из разрушенной костной ткани большое количество кальция попадает в кровь. Это сопровождается запорами, болью в животе, тошнотой, выделением большого количества мочи, эмоциональными расстройствами, слабостью, заторможенностью.
- Нарушение функции почек – миеломная нефропатия вызвана тем, что кальций откладывается в почечных протоках в виде камней. Также почки страдают от нарушения белкового обмена. Парапротеины (белки, вырабатываемые раковыми клетками) поступают через почечный фильтр, и откладывается в канальцах нефронов. При этом почка сморщивается (нефросклероз). Кроме того нарушается отток мочи из почек. Жидкость застаивается в почечных чашечках и лоханках, при этом атрофируется паренхима органа. При миеломной нефропатии отеки отсутствуют, артериальное давление не повышено.
- Анемия, преимущественно нормохромная – цветовой показатель (соотношение гемоглобина к количеству эритроцитов) остается в норме 0,8 -1,05. При повреждении костного мозга снижается выработка эритроцитов. При этом пропорционально уменьшается концентрация гемоглобина в крови. Поскольку гемоглобин отвечает за транспортировку кислорода, то при анемии клетки ощущают кислородное голодание. Это проявляется быстрой утомляемостью, снижением концентрации внимания. При нагрузке возникает одышка, сердцебиение, головная боль, бледность кожи.
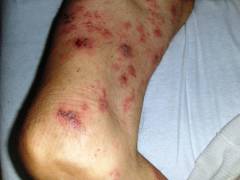
- Нарушения свертываемости крови. Повышается вязкость плазмы. Это приводит к спонтанному склеиванию эритроцитов в виде монетных столбиков, что может вызвать образование тромбов. Снижение уровня тромбоцитов (тромбоцитопения) приводит к спонтанным кровотечениям: носовым и десенным. Если повреждаются мелкие капилляры, то кровь выходит под кожу – образуются синяки и кровоподтеки.
- Сбор анамнеза. Врач анализирует, как давно появились боли в костях, онеменеие, утомляемость, слабость, кровотечения, кровоизлияния. Учитывается наличие хронических заболеваний и вредных привычек. На основе результатов лабораторных и инструментальных исследований ставиться диагноз, определяется форма и стадия миеломной болезни, назначается лечение.
- Осмотр. Выявляет внешние признаки миеломной болезни:
- опухоли на разных участках тела, преимущественно на костях и мышцах.
- кровоизлияния, возникшие в результате нарушения свертываемости крови.
- бледность кожных покровов – признак анемии.
- учащенный пульс – попытка сердца компенсировать недостаток гемоглобина ускоренной работой.
- Общий анализ крови. Лабораторное исследование, которое позволяет оценить общее состояние системы кроветворения, функции крови и наличие различных заболеваний. Забор крови осуществляется утром натощак. Для исследования берут 1 мл крови из пальца или из вены. Врач-лаборант изучает каплю крови под микроскопом, существуют автоматические анализаторы.
О миеломной болезни свидетельствуют такие показатели:
- повышение СОЭ – свыше 60-70 мм/час
- снижено количество эритроцитов – мужчины менее 4 10^12 клеток/л, женщины менее 3,7 10^12 клеток/л.
- снижено количество ретикулоцитов – менее 0,88% (из 100% эритроцитов)
- снижено количество тромбоцитов – менее 180 10^9 клеток/л.
- снижено количество лейкоцитов – менее 4 10^9 клеток/л.
- снижен уровень нейтрофилов – менее 1500 в 1 мкл (менее 55% от всех лейкоцитов)
- повышен уровень моноцитов – свыше 0,7 10^9 (более 8% от всех лейкоцитов)
- гемоглобин снижен – менее 100 г/л
- в крови могут обнаружиться 1-2 плазматические клетки.
Из-за угнетения кроветворной функции костного мозга уменьшается количество кровяных клеток (эритроцитов, тромбоцитов, лейкоцитов). Общее количество белка увеличивается за счет парапротеинов. Высокий уровень СОЭ свидетельствует о наличии злокачественной патологии.
Кровь забирается в утренние часы натощак, до приема лекарств и других исследований (рентгена, МРТ). Кровь берут из вены. В лаборатории в пробирки с кровью добавляют химические реагенты, которые вступают в реакцию с определяемыми веществами. Миеломную болезнь подтверждают:
- увеличение общего белка – свыше 90-100 г/л
- альбумин снижен мене 38 г/л
- уровень кальция повышен – свыше 2,75 ммоль/литр.
- мочевая кислота повышена – мужчины свыше 416,5 мкмоль/л, женщины свыше 339,2 мкмоль/л
- креатинин повышен – мужчины свыше 115 мкмоль/л, женщины свыше 97 мкмоль/л
- уровень мочевины повышен – более 6,4 ммоль/л
Выявленные отклонения свидетельствуют о повышении белка в крови за счет патологических парапротеинов, выделяемых миеломными клетками. Высокие уровни мочевой кислоты и креатинина указывают на поражение почек.
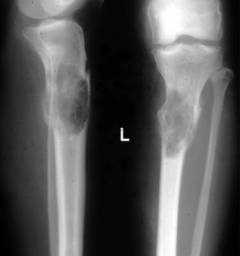 Миелограмма (трепанобиопсия) – изучение особенностей строения клеток костного мозга. С помощью специального прибора – трепана или иглы И. А. Кассирского делают пункцию (прокол) грудины или подвздошной кости. Извлекают образец клеток костного мозга. Из полученной паренхимы готовят мазок и под микроскопом изучают качественный и количественный состав клеток, их типы, соотношение, степень созревания.
Миелограмма (трепанобиопсия) – изучение особенностей строения клеток костного мозга. С помощью специального прибора – трепана или иглы И. А. Кассирского делают пункцию (прокол) грудины или подвздошной кости. Извлекают образец клеток костного мозга. Из полученной паренхимы готовят мазок и под микроскопом изучают качественный и количественный состав клеток, их типы, соотношение, степень созревания. Результаты при миеломной болезни:
- большое количество плазматических клеток – свыше 12%. Это указывает, на их аномальное деление и вероятность онкологических изменений.
- обнаруживаются клетки с большим количеством цитоплазмы, которая интенсивно окрашивается. В цитоплазме могут содержаться вакуоли. В ядерном хроматине заметен характерный рисунок, напоминающий колесо. Данные клетки не типичны для костного мозга здорового человека.
- угнетение нормального кроветворения
- большое количество незрелых нетипичных клеток
Изменения свидетельствуют, что нарушена нормальная работа костного мозга. Его функциональные клетки заменены злокачественными плазматическими клетками.
Для исследования берут кровь из вены в утренние часы. В ряде случаев может быть использована моча. В сыворотке крови обнаруживаются парапротеины, выделяемые миеломными клетками. В крови здоровых людей этих измененных иммуноглобулинов не обнаруживается.
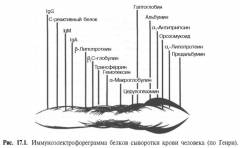
В зависимости от варианта миеломы выявляют:
- парапротеин класса IgG
- парапротеин класса IgА
- парапротеин класса IgD
- парапротеин класса IgЕ
- бета-2 микроглобулин
Данный анализ считается самым чувствительным и точным исследованием для определения миеломной болезни.
При миеломной болезни в моче обнаруживается:
- повышение относительной плотности – в моче содержится большое количество молекул (в основном белка)
- наличие эритроцитов
- повышено содержание белка (протеинурия)
- присутствуют цилиндры в моче
- белок Бенс-Джонса (фрагменты парапротеина) – свыше 12 г/сут (выпадает в осадок при нагревании)
Изменения в моче свидетельствуют о поражении почек парапротеинами и нарушении белкового обмена в организме.
Рентгенография костей метод рентгенологического исследования костей. Цель выявить участки поражения костей и подтвердить диагноз «миеломная болезнь». Для того чтобы получить полное представление о степени поражения делают снимки с передней и боковой проекции.
Изменения на рентгене при миеломной болезни:
- признаки очагового или диффузного остеопороза (снижение плотности костной ткани)
- «дырявый череп» – круглые очаги разрушения в черепе
- плечевые кости – отверстия в виде сот или «мыльных пузырей»
- ребра и лопатки имеют отверстия, «изъеденные молью» или «сделанные пробойником»
- позвонки сдавливаются и укорачиваются. Они приобретают вид «рыбьих позвонков»
При рентгенографии запрещено использование контрастных веществ. Так как йод, входящий в их состав, образует нерастворимый комплекс с белками выделяемыми миеломными клетками. Это вещество сильно повреждает почки.
- очаги разрушения кости
- опухоли мягких тканей
- деформация костей и позвонков
- ущемление спинного мозга в результате разрушения позвонков
Томография помогает выявить все очаги поражения костей и оценить распространенность миеломной болезни.
Химиотерапия является основным методом лечения единичных и множественных плазмоцитом.
Монохимиотерапия – лечение одним химиотерапевтическим препаратом.
| Представители | Механизм лечебного действия | Способ применения |
| Мелфалан Эффективность при назначении составляет 50%. | Углеродные соединения встраиваются в молекулу ДНК миеломных клеток. Это приводит к перекрестному связыванию двух цепочек ДНК и злокачественные клетки прекращают размножаться. | По 0,15 – 0,2 мг на килограмм массы тела в течение 4-х дней. Интервал между курсами лечения 4 недели. Препарат принимают внутрь или внутривенно. |
| Циклофосфамид (циклофосфан) Эфективность при монотерапии приближается к 50% | Действующее вещество встраивается в ДНК злокачественной клетки и заменяет собой одно из звеньев молекулы. При этом нарушается процесс деления клеток. Вызывает гибель миеломных клеток. | Внутрь по 50–200 мг на протяжении 2-3 недель. Внутримышечно по 200–400 мг. Инъекции делают 2-3 раза в неделю. Курс 3-4 недели. Внутривенно по 600 мг на 1 кв. м поверхности тела. Курс лечения одна инъекция в 2 недели. Необходимо 3 дозы. |
| Леналидомид Эффективен у 60% больных. | Повышает иммунную защиту против злокачественных клеток – активирует Т-киллеры. Препятствует образованию новых кровяных сосудов (капилляров) питающих опухоли. | Капсулу 25 мг проглатывать, не разжевывая, запивая достаточным количеством жидкости. Употребляют ежедневно в одно и то же время после еды. Курс лечения 3 недели, перерыв 7 дней. Перед повторным курсом необходима коррекция дозы. Ее пошагово снижают: 25, 15, 10, 5 мг. Препарат принимают совместно с дексаметазоном ( по 40 мг 1 раз в день) |
Химиотерапевтические препараты может назначать только врач-химиотерапевт, имеющий опыт в применении цитостатиков. Во время лечения необходим постоянный контроль за состоянием пациента и показателями периферической крови.
Полихимиотерапия – лечение миеломной болезни с помощью комплекса противоопухолевых средств.
В полихимиотерапии самыми эффективными признаны схемы VAD и VBMCP. На протяжении 6 месяцев после установки диагноза проводят 3 курса полихимиотерапии.
| Препараты | Механизм лечебного действия | Способ применения |
| Винкристин | Препарат блокирует белок, необходимый для постройки внутриклеточного скелета (микротрубочек) миеломных клеток. Останавливает деление клеток. | По 0,4 мг/день 1-4 дня. Препарат вводят постоянно внутривенно на протяжении суток. |
| Адриамицин (доксорубицин) | Подавляет рост и размножение клеток. При его применении образуются свободные радикалы. Они воздействуют на мембраны клеток, угнетают синтез нуклеиновых кислот (ДНК) несущих наследственную информацию. | Вводят внутривенно из расчета 9 мг/м² поверхности тела в день. Курс лечения 1-4 дня в виде постоянной капельницы. |
| Дексаметазон | Назначается в качестве профилактики побочных эффектов при химиотерапии. | Принимают внутрь или внутривенно по 40 мг/день. Дни 1-4, 9-12, 17-20. |
Схема VBMCP
| Препараты | Механизм лечебного действия | Способ применения |
| Кармустин | Угнетает обменные процессы в клетке, нарушает энергообеспечение и деление злокачественных клеток. | Вводится внутривенно капельно в первый день лечения. Дозу подбирают индивидуально из расчета 100-200 мг/м 2 поверхности тела. Следующая доза через 6 недель (по результатам анализа крови). |
| Винкристин | Блокирует митотическое деление клеток. | Препарат вводят внутривенно капельно по 1,4 мг/м² поверхности тела. Водят в первый день лечения. |
| Циклофосфамид | Оказывает токсическое действие на злокачественные клетки, обладает противоопухолевым эффектом. Нарушают целостность цепочек ДНК и размножение миеломных клеток. | Назначают индивидуально. Примерная дозировка по 400 мг/м² внутривенно в 1-й день лечения. |
| Мелфалан | Останавливает синтез белка, необходимого для размножения миеломных клеток. Разрушает их молекулы ДНК. | Применяют внутрь по 8 мг/м². Дни лечения с 1-го по 7-й. |
| Преднизолон | Кортикостероиды применяют для уменьшения побочного действия химиопрепаратов и профилактики гиперкальцемии. | Применяют внутрь по 40 мг/м² в дни с 1-го по 7-й. |
После достижения ремиссии в течение длительного периода назначают интерферон альфа 3 раза в неделю по 3 млн ЕД в для поддержания организма.
Химиотерапия угнетает кроветворение, поэтому периодически требуется трансфузия (вливание) эритроцитной, лейкоцитной или тромбоцитной массы.
Эффективность полихимиотерапии при миеломной болезни: у 41% больных удается достичь полного исчезновения симптомов (полная ремиссия). У 50% симптомы значительно уменьшились (частичная ремиссия).
К сожалению, у значительной части больных, даже после успешного лечения возникает рецидив. Это связано с тем, что в состав опухоли входят разнообразные клетки. Одни из них погибают во время курса химиотерапии, другие остаются и со временем дают начало новой опухоли. Обострение миеломной болезни лечат препаратами с большей активностью.
- Обезболивание
Обезболивание при миеломной болезни проводится трехступенчато:
I ступень – нестероидные противовоспалительные препараты (спазган, седалгин, индометацин, ибупрофен) используют для лечения слабой боли.
| Препарат | Механизм действия | Способ применения |
| Спазган | Оказывает обезболивающее, спазмолитическое и жаропонижающее действие. Препарат блокирует окончания парасимпатических нервных волокон, обеспечивая устранение спазмов и обезболивание. Назначают при болях в костях и внутренних органах. | По 1 таблетке 2 раза в день независимо от приема пищи. |
| Седалгин | Обезболивающее средней силы с успокаивающим эффектом. Рекомендовано при сдавливании нервного корешка и боли по ходу спинномозгового нерва. | По 1-2 таблетки 2-3 раза в день. |
| Индометацин | Блокирует синтез простагландинов, веществ ответственных за появление боли. Один из сильнейших нестероидных обезболивающих препаратов. | Принимают внутрь по 25 мг 2-3 раза в день после еды. При необходимости доза может быть увеличена до 150 мг в сутки. |
| Ибупрофен | Замедляет синтез простагландинов и фермента циклооксигеназы, чем ослабляет воспаление и боль. Эффективен при болях в костях и суставах. | В таблетках по 0,2 г 3-4 раза в день. Для профилактики раздражения слизистой оболочки желудка, рекомендовано принимать после еды. |
II ступень – слабые опиоиды, они же наркотические анальгетики (кодеин, трамундин, трамадол, дигидрокодеин, просидол). Для усиления обезболивающего эффекта используют совместно с нестероидными противовоспалительными препаратами (парацетамол, диклофенак, кеторолак). Назначают при нарастании болевого синдрома.
| Препарат | Механизм действия | Способ применения |
| Кодеин | Оказывают болеутоляющий эффект. Выделяемый из препаратов морфин связывается с опиодными рецепторами центральной нервной системы и блокирует прохождение болевых импульсов | По 0,015 г 4 раза в день. Максимальная суточная доза 0,06-0,09 г. |
| Трамадол | По 0, 05 – 0,1 г 3-4 раза в день. Суточная доза не должна превышать 0,4 г. | |
| Дигидрокодеин | По 0,06 – 0,12 г. Действие препарата длится до 12 часов, принимают 2 — 3 раза в день. | |
| Просидол | Активирует обезболивающую систему на разных уровнях ЦНС. Изменяет восприятие боли на эмоциональном уровне. | Таблетки для рассасывания под языком по 0,01–0,02 г. Максимальная доза 0,05–0,25 г в сутки. |
Внимание! При длительном применении вызывают привыкание и наркотическую зависимость.
III ступень – опиоиды сильного действия (морфин, омнопон, бупренорфин, налоксон, дюрагезик) предпочтительнее для лечения выраженной боли.
| Препарат | Механизм действия | Способ применения |
| Морфин | Подавляет сильную боль. Вещество блокирует прохождение болевых импульсов через рецепторы нервной системы. Оказывает успокаивающее действие. | По 0,01 г 4-5 раз в сутки. |
| Омнопон | Связываются с опиодными рецепторами нервной системы и подавляют чувствительность к боли. | По 0,02–0,04 г 3-4 раза в день. Суточная доза не должна превышать 0,12 г. |
| Бупренорфин | По 0,2-0,4 мг. Эффективен в меньших концентрациях, чем морфин. Суточная доза не должна превышать 1,2-1,6 мг. | |
| Налоксон | Вытесняет химические вещества, которые связываются с болевым рецептором. Связывается с опиатными рецепторами и блокирует их работу. | Принимают по 0,4 мг не более 2-х раз в день. |
Строго соблюдайте дозировку и рекомендации врача. Это снижает риск развития побочных эффектов и зависимости.
- Магнитотурботрон. Лечение магнитным полем низкой частоты оказывает положительное воздействие на организм:
- вызывает противовоспалительный и обезболивающий эффект
- замедляет митотическое деление злокачественных миеломных клеток
- повышает иммунитет и активирует естественную противоопухолевую защиту
- уменьшает побочные эффекты химиотерапии.
Продолжительность 10-15 минут. Курс 10 сеансов. Желательно повторять лечение 2 раза в год.
- Электросон. Воздействие на структуры мозга импульсными токами низкой или звуковой частоты (1-130 Гц), прямоугольной формы, малого напряжения и силы. Раздражение рефлекторных зон на коже век и затылка, а также непосредственное влияние тока на мозг вызывает:
- дремоту и сонливость
- снижает чувствительность к боли
- оказывает успокаивающее действие
Длительность процедуры 30-90 минут. Курс лечения 10-15 сеансов.
Для нормализации состава крови необходимо употреблять 3-4 литра жидкости в сутки. При этом излишки кальция вымываются из организма с мочой. Ее количество должно составлять 3-4 литра в сутки. 2 раза в сутки определяют количество электролитов, чтобы поддерживать в норме ионы калия и магния.
| Препарат | Механизм действия | Способ применения |
| Ибандронат натрия (Ибандроновая кислота) | Подавляет разрушение кости, уменьшает концентрацию кальция в крови. Предотвращает появление метастазов в кости. | Назначают короткими курсами. Вводят внутривенно по 2-4 мг в сутки. |
| Кальцитонин | Регулирует обмен кальция в костной ткани. Подавляет разрушение костей, способствует выведению кальция с мочой. | Вводят подкожно или внутримышечно 6–12 ч по 4–8 МЕ/кг. Курс 2-4 недели. После чего дозу уменьшают и продолжают лечение 6 недель. |
| Преднизолон | Пульс-терапия высокими дозами для подавления воспалительных реакций. Тормозит активность В-лимфоцитов и миеломных клеток. | 40 мг/м² принимают внутрь. Курс 5-7 дней. |
| Витамин D (эргокальциферол) | Для профилактики остеопороза и разрушения кости. | 300-500 ME в сутки в течение 45 дней. |
| Андрогены: метандростенолон | Нормализует обмен белков и укрепляет костную ткань в сочетании с витамином D. | Принимают внутрь по 0,005-0,01 г в день перед едой. Курс до 6 недель. |
Лечение почечной недостаточности при миеломной болезни
Повреждение большого числа нефронов приводит к нарушению функции почек. В основе лечения почечной недостаточности лежит борьба с основным заболеванием. Цель: уменьшить количество миеломных клеток и их парапротеинов, которые откладываются в почках. Также назначают препараты, поддерживающие почки, и средства для выведения токсинов.
| Препарат | Механизм действия | Способ применения |
| Хофитол | Увеличивает выделение мочевины с мочой, способствует очищению крови. | 5-10 мл препарата вводят внутривенно или внутримышечно. 12 инъекций на курс. |
| Ретаболил | Анаболический препарат назначают для снижения уровня азота в крови. С его помощью азот из мочевины используется в организме для синтеза белка. | Внутримышечно вводят по 1 мл 1 раз в неделю. Курс 2-3 недели. |
| Натрия цитрат | Применяют для борьбы с нарушением кислотно-щелочного баланса и повышенной кислотностью крови. Одновременно снижается количество кальция в крови. | Принимают в таблетках по 1,5-2 г 3 раза в день после еды. Суточная доза не должна превышать 4-8 г. |
| Празозин | Периферический вазодилататор снижает артериальное давление, повышает почечный кровоток и улучшает клубочковую фильтрацию | Первую дозу принимают на ночь, лежа в постели. Возможно сильное снижение давления вплоть до обморочного состояния. В дальнейшем по 0.5-1 мг 2-3 раза в день |
| Каптоприл | Ингибитор АПФ снижает сопротивление сосудов, расширяет их просвет. Нормализует внутриклубочковое кровообращение в почках. Способствует их нормальной работе и скорейшему выведению кальция. | По 0.25-0.5 мг/кг 2 раза в день натощак. Можно под язык. |
| Клубочковые диуретики (мочегонные) не рекомендуются при лечении миеломной болезни. | ||
Питьевой режим – около 3-х литров в день. Количество выделяемой мочи должно быть в пределах 2-2,5 литра.
Если нет отеков, то нет необходимости ограничивать потребление соли. Это может привести к нарушению электролитного баланса (слабости, потере аппетита, обезвоживанию).
Рекомендована диета с низким содержанием белка до 40-60 г в сутки. Ограничивают потребление мяса, рыбы, яиц.
При высоком уровне мочевины в крови рекомендован гемодиализ – очищение крови вне организма с помощью аппарата «искусственная почка».

- Пересадка костного мозга
- Удаление поврежденной кости
- Трансплантация гемопоэтических стволовых клеток совместно с химиотерапией мелфаланом. Метод довольно токсичен и связан с высокой смертностью (5-10%).
Длительная ремиссия (ослабление симптомов) возможна при соблюдении нескольких условий:
- болезнь выявлена на ранних стадиях
- пациент не имеет тяжелых сопутствующих заболеваний
- хорошая чувствительность к лечению цитостатическими средствами
- организм хорошо переносит лечение и не возникло тяжелых побочных эффектов
Врачи индивидуально подбирают лечение, которое позволяет контролировать болезнь. Комплексное использование химиотерапии и стероидных гормонов позволяет добиться ремиссии сроком на 2-4 года. Есть случаи, когда пациенты живут до 10-ти лет.
Среди пожилых людей химиотерапия низкими дозами и дексаметазон обеспечивают 2-хлетнюю выживаемость у 90% больных. Без лечения продолжительность жизни таких больных не превышает 2-х лет.
источник



