Апластическая анемия является тяжелым заболеванием крови, при котором развивается угнетение всех ростков костного мозга. Причины заболевания различные – от генетической предрасположенности до вредоносного действия ионизирующего излучения и различных химических соединений. Клинически заболевание проявляется анемическим, тромбоцитопеническим синдромом, а также выраженными инфекционными осложнениями.
Диагноз выставляется исходя из клинической картины, анализов крови и пункции костного мозга.
Что такое апластическая анемия?
Апластическая анемия является патологическим состоянием организма, при котором снижается количество всех трех типов клеток крови (эритроцитов, лейкоцитов и тромбоцитов) вследствие замедления или полного прекращения образования их в костном мозге.
По происхождению апластические анемии делятся на:
В большинстве случаев наблюдается угнетение всех трех ростков кроветворения, однако клинически замечено, что в различные фазы болезни может наблюдаться более выраженное угнетение какого-то одного из ростков
По преимущественному поражению костномозговых ростков выделяют:
- угнетение одного кроветворного ростка (эритроцитарного, лейкоцитарного или тромбоцитарного);
- угнетение двух кроветворных ростков;
- угнетение трех кроветворных ростков.
Причины апластической анемии
Причины апластической анемии различаются при врожденной и приобретенной анемии.
Различают следующие причины приобретенных апластических анемий:
- ионизирующее излучение;
- лекарственные препараты (декарис, анальгин, левомицетин, тетрациклин, бутадион и др.);
- химические соединения (пестициды, бензол);
- заболевания (вирусные гепатиты А, В и С, вирус Эпштейн-Барр, цитомегаловирус, вирус герпеса, ВИЧ, парвовирус В19 и др.).
- гормональные нарушения со стороны яичников, щитовидной шелезы и вилочковой железы.
Некоторые вредоносные агенты непосредственно воздействуют на костный мозг (ионизирующее излучение, химические и лекарственные вещества). Иные воздействуют опосредованно через аутоиммунные механизмы (вирусный гепатит В).
Диагностика апластической анемии
Клиническая картина заболевания может в значительной степени ориентировать врача в направлении анемии, однако диагноз должен быть подтвержден или опровергнут при помощи лабораторных анализов и параклинических исследований.
Наиболее ценными дополнительными исследованиями являются:
Общий анализ крови
Данные общего анализа крови при апластической анемии свидетельствуют в пользу панцитопении (снижение количества всех трех типов клеток костного мозга). Уменьшение количества лейкоцитов наблюдается преимущественно за счет снижения гранулоцитов (нейтрофилы, эозинофилы и базофилы). Таким образом, относительно увеличивается процент лимфоцитов и моноцитов в лейкоцитарной формуле. На различных стадиях заболевания могут быть выявлены воспалительные признаки в той или иной мере.
Ориентировочными показателями ОАК при апластической анемии являются:
Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
Эритроциты – 0,7 – 2,5 х 1012\л (норма 3,7 х 1012\л). Снижение количества зрелых эритроцитов.
Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
Тромбоциты – менее 35 промилле или 100 х 109\л. Снижение количества тромбоцитов.
Лейкоциты – 0,5 – 2,5 х 109\л (норма 4 – 9 х 109\л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
Анизоцитоз – наличие в крови эритроцитов различного размера.
Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Биохимический анализ крови
Некоторые виды биохимических анализов крови могут акцентировать внимание врача на отклонениях в организме, которые косвенно вписываются в три вышеперечисленных анемических синдрома.
Ориентировочными показателями БАК при апластической анемии являются:
Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Стернальная пункция
Данный вид исследования используется с целью визуализации клеток костного мозга и их процентного соотношения.
При апластической анемии миелограмма будет скудной, количество клеточных элементов значительно снижено. Камбиальные клетки эритроцитарного и лейкоцитарного ряда единичны или отсутствуют. Мегакариобласты отсутствуют. В редких случаях при пункции случается встретить сгруппированные очаги повышенной пролиферации клеток как компенсаторную реакцию здорового костного мозга на анемию. Такая миелограмма может сбить с толку, поскольку будет свидетельствовать в пользу отсутствия апластической анемии и поэтому будет ложноотрицательной.
Трепанобиопсия
Трепанобиопсия является способом изъятия части костного мозга из крыла подвздошной кости пациента. Преимущество данной процедуры над стернальной пункцией заключается в возможности забора большего количества материала с сохранением его структуры. Большее количество материала уменьшает вероятность ложноотрицательного результата апластической анемии, а изучение структуры костного мозга позволяет помимо цитологического исследования (миелограммы) провести еще и гистологическое.
При помощи анализа крови и результатов трепанобиопсии возможно определение степени тяжести апластической анемии.
- Апластическая анемия средней тяжести определяется следующими показателями:
гранулоциты менее 2,0 х 109\л;
тромбоциты менее 100 х 109\л;
гипоплазия костного мозга на трепанобиопсии.
- Апластическая анемия тяжелой степени определяется следующими показателями:
гранулоциты менее 0,5 х 109\л;
тромбоциты менее 20 х 109\л;
аплазия костного мозга на трепанобиопсии.
- Апластическая анемия крайне тяжелой степени определяется следующими показателями:
гранулоциты менее 0,2 х 109\л;
тромбоциты единичные или отсутствуют;
ретикулоциты единичные или отсутствуют;
аплазия костного мозга на трепанобиопсии.
Прогноз при апластической анемии
Прогноз при апластической анемии во многом зависит от сроков обнаружения заболевания. При раннем обнаружении существует возможность более активного вмешательства в течение заболевания. При более позднем обнаружении шансы на излечение уменьшаются.
Врожденная апластическая анемия Фанкони в большинстве случаев крайне тяжело поддается лечению, поскольку костный мозг никогда не был здоровым и, соответственно, очень сложно восстанавливается. Наличие врожденных аномалий развития сильно ограничивает показания к пересадке костного мозга таким пациентам. В большинстве случаев больные погибают в детском возрасте от аномалий развития или инфекционных осложнений.
Приобретенные апластические анемии имеют более благоприятный прогноз, поскольку в некоторых случаях являются обратимыми после прекращения действия повреждающего фактора на костный мозг.
Врач лабораторной диагностики
Новополоцкой городской больницы
Приемная главного врача
(+375 214) 50-62-70
(+375 214) 50-62-11 (факс)
Канцелярия
(+375 214) 50-15-39 (факс)
источник
Одной из патологий кровеносной системы человеческого организма является апластичекая (гипопластическая) анемия. Причиной тому служит частичная дисфункция, связанная с прекращением выработки важнейших элементов, содержащихся в крови человека. Прекращают вырабатываться тромбоциты, эритроциты, лейкоциты. Апластическая относится к числу редких заболеваний. Однако, риск возникновения подобного недомогания существует у всех возрастных категорий. Следует знать, какие анализы потребуются для выявления недуга. Причины, по которым возникает это заболевание, до конца так и не выяснены. Специалисты смогли выявить факторы, вызывающие предрасположенность к проявлению патологии. Пример: у людей, которые имеют регулярное соприкосновение с химическими веществами, радиоактивным облечением, страдают вирусными инфекциями или генетически предрасположены к патологии, принимают специфические медикаменты, часто наблюдается анемия.
Проведя общий анализ, медики выявляют показатели, которые могут указывать на пониженное содержание определенных клеток. Пониженное содержание лейкоцита наблюдается в том случае, если присутствует количественное понижение гранулоцита. Следовательно, лейкоцитная формула показывает относительное увеличение процентного содержания моноцита и лимфоцита. Апластическая, именуемая также как гипопластическая, на определенных этапах своего развития способна проявлять различные признаки воспалительного процесса. Чтобы определить степень воздействия таких процессов на организм, потребуется сдать анализы. Кроме сдачи крови, требует также биохимическая проверка. Диагностика показывает, что железо в крови больного имеет завышенные показатели, из-за чего им бывает перенасыщен трансферрин. Расшифровка проверки крови иногда выявляет завышенный фетальный гемоглобин. Повысятся и показатели билирубина в случае гемолиза. Однако, эритропоэтин часто бывает ниже положенной нормы.
Апластическая приводит к понижению количества тромбоцита в крови, что влечет за собой гипокоагуляцию. Диагностикой подобного явления занимается анализна свертываемость. Также изменяются функциональные особенности печени.
Основной причиной развития этой патологии является интенсивный распад эритроцита. Ряд факторов, провоцирующих гемолиз: неполноценный характер самого эритроцита в крови (генетическая предрасположенность), воздействие окружающей среды проживания больного (занесение вирусной инфекции через укус змеи или насекомого, применение медикаментов, лечение сердечно сосудистой системы организма). Гемолитическая диагностируется в том случае, если проводится анализ, биохимическое обследование, исследование мочи больного. Гемолитическая показывает понижение эритроцита, уровень гемоглобина колеблется зависимо от возрастной категории. Типология кровообразования не изменяется, эритроциты по своей форме могут различаться: от типичной до более округлой или вытянутой в овал, у детей поднимает содержание ретикулоцита выше 52%.
.gif» /> Если у ребенка диагностирована болезнь, также повышается количество билирубина, в кале обнаруживается высокое содержание стеркобилина, а в моче – концентрация уробилина. Это можно определить благодаря анализам. Когда обнаруживается гемолитическая, специалист может прибегнуть к серологическому обследованию пациента, чтобы обнаружить вероятные антитела в отношении эритроцита. Благодаря генотипированию эта анемия может быть спрогнозирована на предмет осложнений и более соответствующей терапии.
В эту группу патологий кровообразования входит и пернициозная.
Одной из наиболее вероятных причин возникновения заболевания является слабое всасывание витамина, обусловленное дисфункцией слизистой желудка.
Мегалобластная группа включает в себя целую группу патологий, отличающихся мегалобластным способом кровообразования. Наряду с тем, что в дефиците находится в 12, образовывается острая нехватка фолиевой кислоты. Чаще всего мегалобластное малокровие возникает по причине нехватки витаминов группы С, врожденной недостаточностью определенных микроэлементов.
Не обязательно проводить общий анализ, чтобы выявилась дефицитная. Недостачу в 12 можно определить по внешним проявлениям у пациента: расстройство желудочно-кишечного тракта, особенности внешнего вида кожного покрова, «лакированный» язык, неврологическое расстройство. Подобным образом проявляется В12. Однако, точная диагностика подразумевает исследование больного в лабораторных условиях и дальнейшая расшифровка показателей. Изучение пункции при нехватке в 12 не требуется. Анализ дает ясное представление: количество эритроцита пониженное, диаметр их тельца превышает 11-12 мкм. При диагностировании ретикулопении отмечается низкое содержание тромбоцита, лейкоцита.
В12 отличается относительным лимфоцитозом. Определить это может анализ на содержание в 12. Скорость опадания эритроцитов повышается. Если выявлена В12, диагностика мочи не определяет существенных отклонений. Биохимическое исследование выявляет билирубин в повышенном содержании, витамин существенно понижен.
В12, качественно диагностируется при использовании миелограммы. При подобном обследовании диагностика выявляет повышенное содержание эритроцита, мегабластное кровообразование, нейтрофилическая гиперсегментация. В12 требует исключительно комплексного подхода к лечению. Учитывается этиология болезни, ее выраженность, неврологическое расстройство. Правильно подобранный рацион питания, повышающий содержание в 12, белков, исключающий употребление алкоголя – неотъемлемое требование, чтобы В12 была вылечена. В12 в этом случае будет вводиться парентеральным образом, что является неотъемлемой частью патогенетической терапии. Необходимо нормализовать все нарушенные гемодинамические показатели. Также следует нейтрализовать существующие антитела, провоцирующие низкое усвоение В12. Чтобы не имела случаев рецидива, необходимо нормализовать сбалансированное питание. Пример: из рыбных и мясных продуктов. Кроме того, нехватка В12 хорошо восполняется молочными и соевыми продуктами.
По заключению анализов при малокровии рекомендуется внутривенное введение препаратов, содержащих витамин до двух раз на протяжении месяца. Пернициозная патология, прежде всего, появляется у людей, полностью отказавшихся от употребления мясных продуктов. Отсутствие в рационе пищи, содержащей В12, приводит к истощению организма недостающим микроэлементом. Определенный период организм в состоянии использовать естественные запасы витамина. Но при развитии дефицита этого вещества образовывается пернициозную. Также эта патология формируется на почве расстройства всасывания В12 в желудке. Пернициозная, крайне негативно отражается на функционировании ЦНС и костного мозга. Имея длительный период развития, наблюдаются сложнейшие патологические эффекты, часто опасные для человека. Пернициозная, как и любая патология, имеет провоцирующие факторы. Диагностика заболевания и расшифровка данных выявляет отклонения работы ЖКТ на предмет язв, гастрита или других заболеваний, нарушающих усвояемость пищи. Кроме того, она нарушает работу печени, вызывает почечную недостаточность.
Исходя из названия патологии, становится понятным, что возникает в результате острой нехватки указанного элемента в организме человека. Причиной того, почему образовывается железодефицитная патология, может быть продолжительная потеря крови (менструальные выделения, язвенные очаги, т. п.). Часто диагностика беременных девушек обнаруживает наличие такого заболевания в силу высокой необходимости в микроэлементе на этом жизненном этапе. Железодефицитная при исследовании в лаборатории показывает низкий гемоглобин, также эритроциты и железо в малом количестве. Лечится железодефицитная, посредством использования медикаментов с высоким содержанием железа, перорально или в виде уколов. Расшифровка при ЖДА покажет нарушение морфологической особенности эритроцита и их индекса. Также отличается анизоцитозом – когда эритроциты одного человека отличаются размером друг от друга. Кроме того, патология характеризуется пойкилоцитозом – различие форм эритроцитов одного пациента.
Прогрессирующая железодефицитная во время биохимического обследования крови выявляет сывороточный ферритин довольно низкий, железо в низком количестве, завышенное ОЖСС, трансферрин мало насыщен железом. Железодефицитная имеет три стадии развития: легкая, средняя, тяжелая. При подобном заболевании легкой формы гемоглобин находится в заниженном положении, но выше 88 г/л. Средней формы тяжести удерживает гемоглобин на отметке 72г/л. При тяжелом развитии, она снижает концентрацию гемоглобина ниже 69г/.
Общее обследование выявляет пониженное состояние эритроцита. В диаметре этот микроэлемент будет составлять более 12 мкм. Также фолиеводефицитная характеризуется ретикулопенией, понижением тромбоцита и лейкоцита. Кроме указанных проявлений, фолиеводефицитная патология вызывает лимфоцитоз. СОЭ повышает свою интенсивность. Фолиеводефицитная патология входит в подгруппу мегалобластной. Из-за низкого процента фолиевой кислоты деление зрелых кровяных клеток останавливается, развивается фолиеводефицитная.
Гиперхромная группа заболевания характеризуется пониженным количеством эритроцитов. При этом гемоглобиновый уровень практически не изменяется. Следовательно, эритроциты испытывают избыток этого вещества. Поэтому она вызывает насыщеный красный цвет эритроцитов. Диагностированная гипохромная провоцируется пониженным уровнем гемоглобина в эритроцитах. Диагностика заболевания приходит в лабораторных условиях. Расшифровка анализа крови помогает определить, присутствует ли она у пациента. Для этого необходимо определить соотношение эритроцитов, показатель гемоглобина и цвета.
источник
Гипопластическая анемия — патология, при которой подавляются основные функции костного мозга. Костный мозг — важнейший орган кроветворения, каждую секунду в нём зарождаются необходимые организму лейкоциты, эритроциты и тромбоциты. Они образуются из стволовых клеток и развиваются до полноценных форменных элементов, а затем проникают в кровь.
При гипопластической анемии клетки погибают в процессе формирования и остаются в костном мозге, не успев пополнить запасы кровеносной системы. Обеднённая кровь не в состоянии доносить органам кислород, самоочищаться и противостоять вредоносным бактериям. В результате происходят многочисленные нарушения во всём организме, что может привести к необратимым последствиям.
Впервые характеристики этого заболевания были описаны в 1888 году, с тех пор гипопластической анемии посвящено немало научных работ, но патогенный фактор, вызывающий разрушение клеток, остаётся до конца не выясненным. Однако статистика свидетельствует, что подобные патологии встречаются всё чаще. Это объясняется распространением лучевой терапии, большим разнообразием медицинских препаратов, развитием химической промышленности, что является одной из причин образования болезни. На сегодняшний день гипопластическая анемия диагностируется примерно в 3 — 4 случаях на миллион человек.
Классифицируют гипопластическую анемию по нескольким категориям.
В зависимости от факторов происхождения делят на виды:
- Первичные анемии — спровоцированы наследственными заболеваниями, при которых происходит угнетение кроветворных ростков костного мозга.
- Приобретённые анемии — вызваны приёмом лекарств, радиационным облучением, воздействием токсических веществ, вирусами, заболеваниями.
- Идиопатические. Природа возникновения патологии неизвестна. По разным данным к ним относятся от 60 до 87% всех приобретённых гипопластических анемий.
В зависимости от характера поражения выделяют:
- Парциальная (красноклеточная) — нарушается процесс образования эритроцитов, при этом тромбоциты остаются в норме, а число лейкоцитов незначительно снижается.
- Тотальная (панцитопения) — происходит угнетение всех трёх разновидностей кроветворных ростков.
В зависимости от тяжести развития патологии:
- Крайне тяжёлая. Нейтрофилы составляют 9 /л; тромбоциты — 9 /л. По данным трепанобиопсии клеточность костного мозга — 9 /л; тромбоциты — 9 /л. Клеточность костного мозга — 0,5 * 10 9 /л; тромбоциты — > 20 * 10 9 /л; клеточность — Причины возникновения
- анемия Фанкони;
- тромбоцитопения;
- анемия Блекфена-Даймонда;
- ретикулярный дисгенез.
- облучение радиацией при лучевой терапии, при воздействии рентгеновского аппарата;
- приём лекарственных средств (Левомицетин, Анальгин, Карбамазепин, Триметоприм, Метициллин, Меркозолил, Фенилбутазон, Индометацин и др.);
- воздействие токсичных веществ (инсектициды, гербициды, ртуть, мышьяк, растворители, лаки);
- вирусы: гепатит (не относящийся к А, В либо С), Эпштейн Барр, ВИЧ, парвовирус В 19;
- аутоиммунные заболевания (системная волчанка, ревматоидный артрит);
- последствия пересадки внутренних органов.
В зависимости от быстротечности заболевания симптоматика может быть ярко выраженной либо смазанной. Основные признаки гипопластической анемии:
- бледность кожных покровов и слизистых оболочек;
- подавленность, слабость;
- боли в области головы, суставов;
- чувство нехватки воздуха;
- учащённое сердцебиение;
- частые инфекционные заболевания, тяжёлое течение болезней;
- плохо заживающие раны;
- образование язвочек, трещин в ротовой полости;
- кровоточивость дёсен, кровотечения из носа, кровоподтёки и синяки;
- гул в ушах, появление «мушек» перед глазами;
- волосы и ногти ломкие, расслоенные;
- головокружения, обмороки.
Гипопластическая анемия у беременных может проявиться в 2 случаях:
- Процесс кроветворения был нарушен ещё до зачатия. Во время вынашивания плода болезнь обострилась.
- Анемия образовалась во время беременности.
Второй вариант является более опасным, рекомендуется прерывание беременности либо преждевременное родоразрешение. Причины возникновения патологии во время беременности выяснить пока не удалось. Предполагается, что фактором, провоцирующим разрушение кровяных клеток, выступает резус-конфликт либо сбой в иммунной системе, когда происходит агрессия элементов крови против собственных клеток организма.
Приобретённая во время беременности гипопластическая анемия в большинстве случаев развивается в ускоренном темпе. Случаи из практики указывают на то, что даже после прерывания беременности болезнь не поддаётся лечению. Для уменьшения риска летальности рекомендуется провести операцию по удалению селезёнки.
Терапевтический прогноз зависит от тяжести поражения кроветворных ростков. Благоприятный исход возможен при значениях тромбоцитов > 20 * 10 9 /л; лейкоцитов — > 1,5 * 10 9 /л; уровня гемоглобина — > 60 г/л; отсутствии кровотечений и инфекционных процессов.
Диагностика начинается с конкретизации симптоматики и анамнеза. Производится физикальное обследование, во время которого врач осматривает слизистые, полость рта, состояние кожи, ногтей, волос. Назначается общий анализ крови, который необходимо будет повторить, прежде чем начинать лечение.
- При диагностике клинического анализа учитывается число форменных элементов крови, их характеристики и соотношение; уровень гемоглобина.
- Биохимический анализ крови позволяет определить значения сывороточного железа, общую железосвязывающую способность сыворотки, характеристики трансферрина. Также изучаются показатели белка, билирубина, трансаминазы, магния, натрия, кальция, калия, мочевины, креатинина.
- Анализ мочи исследуется на наличие эритроцитов, уровень лейкоцитов и белка.
- Диагностика образца костного мозга выявляет количество очагов кроветворения, состояние кроветворной ткани.
- Дополнительно пациента могут направить на УЗИ брюшной полости, рентгенографию грудной клетки.
- В первую очередь устраняют причину заболевания (прекращение приёма лекарственных средств, взаимодействия с токсическими веществами).
- При аутоиммунных формах назначаются глюкокортикоидные лекарственные препараты. В тяжелой стадии наилучший результат достигается при удалении селезёнки. Также существует новый метод, доказавший свою эффективность — полная замена иммунных клеток.
- При наличии вирусных инфекций, вызвавших гипопластическую анемию, лечение может заключаться в приёме противовирусных, антибиотиков (если присутствует бактериальное присоединение), глюкокортикостероидов (при осложнениях различного характера).
- При интоксикации от взаимодействия с токсическими веществами назначаются лекарственные средства, прекращающие действие яда на организм — антидоты.
- Общее назначение при лечении гипопластической анемии — трансфузия. При снижении отдельных показателей кровяных клеток может осуществляться переливание только эритроцитарной, тромбоцитарной, лейкоцитарной массы. Исключение — аутоиммунная анемия.
- Приём средств, восстанавливающих кроветворение. Например, цианокобаламина — препарата, способствующего созреванию эритроцитов, активизации тромбоцитов.
- Пересадка костного мозга — единственный результативный способ реанимировать функцию костного мозга при крайне тяжёлых формах заболевания.
Гипопластические анемии в умеренной стадии хорошо поддаются лечению и имеют благоприятный прогноз. Тяжелые формы провоцируют необратимые осложнения, такие как сепсис, лейкоз и другие опасные патологии. Пересадка костного позволяет полностью восстановить кроветворение в 80 — 90% случаев.
Лицам, находящимся в зоне риска по образованию гипопластической анемии, необходимо обратиться к гематологу и периодически сдавать необходимые анализы. К ним относятся:
- работники химической промышленности, соприкасающиеся с токсичными веществами;
- пациенты, переболевшие вирусом Эпштейн-Барр, парвовирусом В 19 и т.д.;
- дети с врождёнными заболеваниями (анемия Фанкони и др.), а также их ближайшие родственники;
- пациенты, которым была проведена операция по пересадке внутренних органов;
- пациенты, получающие лечение при помощи радиоактивного облучения.
Профилактические меры включают в себя бережное отношение к своему здоровью: исключение самолечения медицинскими препаратами, недопущение передозировки лекарственных средств, а также своевременное обращение к врачу при наличии симптомов анемии.
источник
Диагноз выставляется исходя из клинической картины, анализов крови и пункции костного мозга. Лечение в большинстве случаев предполагает пересадку здоровых стволовых клеток. Эффективность лечения зависит от множества факторов, основными из которых являются антигенная совместимость стволовых клеток донора и реципиента, внутренние резервы организма реципиента, качество посттрансплантационного ведения больного и др. Прогноз заболевания скорее отрицательный ввиду сложности нахождения подходящего донора костного мозга, высокого числа осложнений со стороны иммунной системы больного, высокой частоты развития инфекционных осложнений и острой полиорганной недостаточности.
Интересные факты
- В теле взрослого человека содержится в среднем 25 – 30 х 10 12 эритроцитов, что приблизительно равно 2 кг.
- Костный мозг производит в среднем 10 миллиардов эритроцитов в час.
- Благодаря особой форме и структуре эритроцит проходит через сосуды шириной 0,5 – 0,7 мкм.
- Впервые идея о пересадке костного мозга возникла в конце 19 века и успешно осуществилась в 1968 г. в США.
Эритроциты, или красные кровяные тельца, являются наиболее многочисленными клетками крови. Они представляют собой безъядерные клетки в форме двояковогнутого диска. При рассмотрении под микроскопом они выглядят как круги с просветлением посередине. Существуют определенные показатели нормального состояния эритроцита. В первую очередь, форма эритроцита, упомянутая выше. Измененная форма эритроцита часто указывает на определенные виды наследственных анемий. Наличие в крови измененных красных кровяных клеток различной формы называется пойкилоцитозом.
Диаметр эритроцита находится в пределах 7,2 – 7,5 мкм. Увеличение или уменьшение диаметра может свидетельствовать в пользу определенных видов анемий. Присутствие в периферической крови эритроцитов с различным диаметром именуется анизоцитозом.
Средний объем эритроцита равняется 90 мкм 3 . Длительность жизни эритроцита составляет 90 – 120 дней. Физиологическая норма количества эритроцитов и концентрации гемоглобина зависит от пола. У мужчин – 3,9 – 5,2 х 10 12 \л; у женщин – 3,7 – 4,9 х 10 12 \л. Уровень гемоглобина у мужчин колеблется в пределах 130 – 160 г\л, у женщин – 120 – 150 г\л.
Особенности структуры эритроцита
Внутри эритроцита, а точнее, в ячейках цитоскелета (комплекс белков, обеспечивающих поддержание формы клетки) содержится вещество под названием гемоглобин. Подсчитано, что в одном эритроците может находиться от 280 до 400 миллионов молекул данного вещества. Гемоглобин представляет собой белковый комплекс, состоящий из белка глобина и гемма (сложная молекула, в центре которой располагается железо). Основной функцией гемоглобина является перенос молекул кислорода к тканям и удаление из них углекислого газа. Существует несколько разновидностей гемоглобина (Hb). Гемоглобин А (HbA) является наиболее численной фракцией (95 – 98%) и представляет собой обычный гемоглобин, находящийся в кровеносной системе взрослого человека. Гемоглобин А2 (HbA2) является структурной модификацией стандартного гемоглобина и отличается некоторыми особенностями, проявляющимися в неблагоприятных условиях среды. Его количество равно 2 – 3% от общего пула эритроцитов. Гемоглобин F (HbF) – фетальная фракция, у взрослых практически отсутствует (1 – 2%), однако превалирует у новорожденных детей (70 – 90%). К концу первого года жизни эритроциты, содержащие фетальный гемоглобин, разрушаются, а их место занимают эритроциты, заполненные взрослым HbA.
Мембрана эритроцита состоит из двойного слоя липидов, пронизанных белками, выполняющими функцию транспорта ионов и поддержания оптимального электролитного равновесия. На поверхности клеточной мембраны располагается особый слой гликопротеидов, называющийся гликокаликс. Различные молекулы, входящие в его состав, играют роль рецепторов и антигенов гистосовместимости, отличающих эритроцит от других клеток организма. По приблизительным подсчетам на поверхности красных кровяных телец находится как минимум 250 видов различных антигенов, наиболее изученными из которых являются антигены системы АВ0 и резус-фактора. Согласно системе АВ0 эритроциты разделяются на 4 группы, а по резус-фактору различают две группы. Данные группы исключительно важны при переливании крови или эритроцитарной массы от доноров к реципиентам.
По системе АВ0 различают 4 группы крови:
- отсутствие агглютиногенов на поверхности эритроцитов;
- присутствие агглютиногенов А;
- присутствие агглютиногенов В;
- присутствие агглютиногенов А и В.
По резус-фактору различают 2 группы крови:
- резус-положительная (у 85% населения);
- резус-отрицательная (у 15 % населения).
Однако даже при переливании крови пациентам с одинаковой группой крови по обеим группам антигенов случаются анафилактические реакции. Данный феномен объясняется несовместимостью крови донора и реципиента по остальным типам антигенов. Учитывая различные комбинации между ними, вероятность переливания абсолютно идентичной группы крови ничтожно мала. Практически со стопроцентной вероятностью можно утверждать, что, сколько на планете людей, столько и групп крови.
Гликокаликс на поверхности мембраны здорового эритроцита имеет еще одну важную особенность – отрицательный заряд. Благодаря тому, что поверхность всех эритроцитов носит одинаковый заряд, согласно законам физики происходит их взаимное отталкивание. Более того, эндотелиоциты (клетки, выстилающие внутреннюю поверхность кровеносных сосудов) также обладают отрицательным зарядом. Таким образом, предотвращается слипание эритроцитов между собой и их прикрепление к стенкам сосудов, что, в свою очередь, снижает вероятность образования тромбов. Соответственно, при нарушении метаболизма эритроцитов или при повреждении эндотелия сосудов возрастает риск образования тромбов.
Отличительной особенностью эритроцитов является их поразительная способность проникать через сосуды, диаметр которых менее диаметра эритроцита в 2 – 3 раза. С этой целью в процессе созревания эритроцита происходит разрушение его ядра и большинства органелл. Свойство эритроцита изменять свою форму называется деформируемостью и обеспечивается устойчивой работой цитоскелета клетки. Цитоскелет является системой продольных внутриклеточных белков, которые, выстраиваясь определенным образом, придают клетке необходимую форму и способствуют ее активному передвижению. Основными структурами цитоскелета являются микротрубочки и микрофиламенты, а белки, из которых они состоят, называются актин, миозин и тубулин. При необходимости удлинения и сужения эритроцита для прохождения через узкий сосуд происходит активное нагнетание в него ионов кальция, под действием которых происходит перестроение цитоскелета. После прохождения узкой зоны происходит выход кальция из клетки, приводящий к восстановлению его формы.
Однако в определенных случаях пластичность цитоскелета эритроцитов может ухудшаться, приводя к замедленному их прохождению по микроциркуляторному руслу и даже застреванию. При прохождении через селезенку эритроциты с пониженной деформируемостью задерживаются в ее сосудах и уничтожаются клетками макрофагальной системы. Наиболее частыми причинами, ведущими к этому, являются высокие показатели гемоглобина при эритремии, повышенная жирность крови и выход ее температуры за пределы оптимальных величин.
Как и любая живая клетка, эритроцит нуждается в питательных веществах для поддержания работоспособности. Занимательно то, что клетки, переносящие кислород во все уголки тела человека, не нуждаются в нем и соответственно не потребляют его в процессе транспортировки. Образование молекул АТФ (аденозинтрифосфат), являющихся топливом для большинства ферментных систем клетки, происходит анаэробным, то есть безвоздушным путем. Таким образом, эритроциты абсолютно не чувствительны к недостатку кислорода, однако могут страдать от снижения уровня глюкозы в крови.
Помимо функции газообмена эритроциты выполняют еще ряд важных функций:
- поддержание кислотно-щелочного равновесия крови – посредством карбонатной буферной системы, второй по важности в организме.
- определение реологии крови – посредством изменения численности клеточных элементов крови по отношению к жидкой части.
- гемостаз – участие в образовании тромба в месте повреждения сосудистой стенки.
- участие в иммунных процессах – посредством специфических рецепторов к иммуноглобулинам и комплементу на мембране эритроцита.
Созревание и старение эритроцита
Первичной клеткой, из которой происходит рост и дифференцировка эритроцита, является стволовая мультипотентная клетка. Из всех клеток организма она обладает наиболее высоким потенциалом к делению и самым широким спектром возможностей к дифференцировке. Иными словами, она является клеткой предшественницей всех тканей организма, и поэтому уровень ее дифференцированности приравнивается к нулевому. При стимуляции малоизученными наукой медиаторами данная клетка трансформируется в тотипотентные клетки, способность которых к размножению также велика, а уровень дифференцированности выше. Впоследствии при дальнейшей дифференцировке тотипотентной клетки образуется колониеобразующая единица эритроцитарного ряда, иначе именуемая эритроцитарным ростком, являющимся непосредственным и первым предшественником красных кровяных телец.
По мере созревания клетки состав ее органелл значительно изменяется, среда из кислой становится нейтральной, а затем щелочной. Эти изменения соответствуют стадиям проэритробласта и эритробласта. Непосредственным предшественником эритроцита является ретикулоцит. Данная клетка в начале своего развития располагается в костном мозге в течение 24 – 30 часов, после чего выходит в кровеносное русло и дозревает в течение 36 – 44 часов. Отличительной особенностью данных клеток является больший размер по сравнению с эритроцитом, скопления распавшегося ядра в виде небольших включений, незначительная сине-фиолетовая исчерченность. По мере полного созревания ретикулоцита его размер уменьшается за счет удаления из клетки остатков ядра и органелл, связанных с синтезом веществ. Освободившееся место занимается молекулами гемоглобина, располагающимися в ячейках цитоскелета. В сформировавшемся эритроците еще в течение некоторого времени происходит синтез гемоглобина из остаточных цепей матричной РНК. По мере ее распада все синтетические процессы замирают, и эритроцит переходит в режим полноценной работы и параллельного поддержания жизнеспособности.
Регуляция роста и дифференцировки всех клеток эритроидного ряда осуществляется при непосредственном влиянии эритропоэтина. Данное вещество является одним из гормонов, синтезируемых почками. Точкой приложения его действия является проэритробласт. Регуляция осуществляется по механизму обратной связи. Иными словами, при снижении количества эритроцитов или гемоглобина в периферической крови происходит компенсаторный выброс эритропоэтина и наоборот – при высокой концентрации гемоглобина и эритроцитов образование эритропоэтина приостанавливается. Эритропоэтин стимулирует рост, размножение и дифференцировку клеток эритроидного ряда, непосредственно воздействуя на них. Косвенная регуляция скорости эритропоэза (процесс образования эритроцитов в костном мозге) осуществляется посредством фактора стволовых клеток, интерлейкиа-3, витамина В12, микроэлементов (цинк, медь, железо, селен и др.), гормонов (соматостатин, тироксин, кортикостероиды и половые гормоны).
По прошествии 90 – 120 дней ферментные системы эритроцита постепенно изнашиваются, в результате чего размеры эритроцита уменьшаются, а содержание гемоглобина остается без существенных изменений. В результате происходит относительное повышение вязкости цитоплазмы, при котором относительная концентрация гемоглобина составляет 360 – 380 г\л. Возрастает и плотность эритроцита, которая отражается в снижении его деформируемости. При прохождении через узкие сосуды селезенки старые непластичные эритроциты застревают в них, поглощаются и разрушаются макрофагами.
Лейкоциты, или белые кровяные тельца, изначально были выделены в отдельную подгруппу, поскольку содержали ядро и не имели собственной окраски. Данный тип клеток подразделяется на множество видов по форме и выполняемой функции. Их деятельность можно резюмировать в обеспечении активных и пассивных иммунных реакций организма. На поверхности лейкоцитов находятся два комплекса гистосовместимости. Первый хранит информацию о собственных тканях организма, препятствуя их разрушению. Второй содержит информацию об антигенах чужеродных веществ, которые когда-либо попадали в организм, для того чтобы при встрече незамедлительно их атаковать.
Лейкоциты обладают способностью к самостоятельному передвижению в направлении увеличения концентрации определенного вещества. Такое движение называется хемотаксисом. Веществами, притягивающими лейкоциты, являются биологически активные соединения, высвобождающиеся при разрушении любых других лейкоцитов в процессе борьбы с патогенными бактериями, простейшими, грибками и вирусами, попавшими в организм. Физиологическая норма лейкоцитов 4 – 9 х 10 9 \л.
Длительность жизни лейкоцитов разнообразна и зависит преимущественно от функции, которую выполняет клетка. В среднем она колеблется от нескольких десятков дней до нескольких десятков лет. Образование лейкоцитов происходит в красном костном мозге из общего лейкоцитарного ростка. Первичное обучение, в процессе которого лейкоциты приобретают первый комплекс гистосовместимости, осуществляется в тимусе. Вторичное обучение, в процессе которого лейкоциты приобретают второй комплекс гистосовместимости, осуществляется в периферических лимфатических узлах.
Тромбоциты являются третьей и последней разновидностью клеточных элементов крови. Сразу же необходимо заметить, что тромбоциты не являются самостоятельными клетками. Их образование происходит также в красном костном мозге из клеток, называемых мегакариоцитами. Мегакариоцит представляет собой наиболее крупный кроветворный росток по сравнению с эритроцитарным и лейкоцитарным. В диаметре он может достигать 20 – 25 мкм. В центре мегакариоцита располагается крупное ядро. В цитоплазме синтезируется большой спектр биологически активных веществ, которые впоследствии становятся содержимым тромбоцита. Клеточная мембрана образует множество выростов, края которых постоянно отрываются. Мембраны оторвавшихся фрагментов смыкаются, образуя то, что, по сути, и является тромбоцитом.
Тромбоцит выполняет преимущественно функцию гемостаза – сохранения целостности кровеносного русла. Он первый среди остальных клеточных элементов реагирует на повреждение сосудистой стенки и образует первичный тромб, к усилению которого впоследствии привлекаются лейкоциты и эритроциты. Располагаясь непосредственно над сосудистым дефектом, тромбоциты формируют мелкую сеть, в которую попадают эритроциты и лейкоциты. Таким образом образуется сгусток. По мере закрытия сгустком всей поврежденной поверхности тромбоциты выделяют определенные вещества, приводящие к стягиванию сети и ретракции сгустка. При этом из него удаляется большая часть жидкости, а сам тромб становится плотнее.
По данным последних исследований обнаружена еще одна важнейшая функция тромбоцитов, которая заключается в стимуляции процессов роста и регенерации тканей в поврежденной области. Таким образом, тромбоцит играет роль не только в обеспечении гемостаза, но еще и в росте и функциональном восстановлении поврежденных тканей. Физиологическая норма тромбоцитов находится в пределах 180 – 320 х 10 9 \л.
По происхождению апластические анемии делятся на:
- врожденные;
- приобретенные.
В большинстве случаев наблюдается угнетение всех трех ростков кроветворения, однако клинически замечено, что в различные фазы болезни может наблюдаться более выраженное угнетение какого-то одного из ростков. В подтверждение этому был проведен ряд экспериментов, в результате которых было продемонстрировано различное по выраженности эффекта влияние разнообразных неблагоприятных факторов на костный мозг.
По преимущественному поражению костномозговых ростков выделяют:
- угнетение одного кроветворного ростка (эритроцитарного, лейкоцитарного или тромбоцитарного);
- угнетение двух кроветворных ростков;
- угнетение трех кроветворных ростков.

Наиболее распространенным видом врожденной апластической анемией является анемия Фанкони. Непосредственной причиной заболевания является повышенная чувствительность ДНК клеток к повреждающим агентам. Данное заболевание наследуется по аутосомно-рецессивному типу. Это значит, что, для того чтобы оно проявилось, необходимо, чтобы у обоих родителей присутствовал дефект причинного гена. Лишь только в подобном случае вероятность развития клинических признаков заболевания у ребенка составляет приблизительно 25%. Соответственно, предотвратить данное заболевание можно, если заранее знать, что в роду обоих родителей имелись больные данным типом анемии, и предостеречь данную пару от зачатия ребенка.
Различают следующие причины приобретенных апластических анемий:
- ионизирующее излучение;
- лекарственные препараты (декарис, анальгин, левомицетин, тетрациклин, бутадион и др.);
- химические соединения (пестициды, бензол);
- заболевания (вирусные гепатиты А, В и С, вирус Эпштейн-Барр, цитомегаловирус, вирус герпеса, ВИЧ, парвовирус В19 и др.).
- гормональные нарушения со стороны яичников, щитовидной шелезы и вилочковой железы.
Различают следующие теории патогенеза апластической анемии:
- стромальная;
- аутоиммунная;
- преждевременный апоптоз.
Доказано, что рост и созревание клеток костного мозга невозможен без влияния факторов, вырабатываемых стромой. Строма является скоплением соединительнотканных клеток, образующих своего рода «скелет» или «ложе» в котором залегают клетки костного мозга. Строма вырабатывает такие вещества как ИЛ (интерлейкины) 1, 3 и 6 и фактор стволовых клеток. Данные вещества направляют развитие клеток предшественников в то или иное русло на различных стадиях их развития.
В 15 – 20% случаев апластических анемий причинной их развития становится недостаточное формирование и выделение стромальных факторов роста. По этой причине дифференцировка клеток крови останавливается на определенной стадии развития. В костном мозге при специальном исследовании можно обнаружить скопление предшественников клеток крови. В периферической крови отмечается увеличение эритропоэтина, который в норме влияет на строму костного мозга.
Апоптоз является физиологическим процессом, при котором происходит самостоятельное разрушение клеток с определенными мутационными аномалиями или клеток, изживших отведенный им срок. Посредством апоптоза организм защищается от накопления мутаций и вызванных этим осложнений преимущественно опухолевого происхождения. Однако апоптоз может стать и патологическим процессом, когда будет приводить к преждевременному саморазрушению клеток. Причина преждевременного апоптоза заключается в мутации гена, синтезирующего белок Р-450.
Несмотря на существование нескольких успешных теорий развития апластических анемий, в научном мире по-прежнему ведутся многочисленные исследования в данном направлении. Однако для практикующего врача, и тем более для пациента, поиск механизма, по которому происходит развитие заболевания, практически никогда не имеет смысла. Это связано с тем, что на сегодняшний день не существует более или менее эффективных препаратов, помимо стероидных гормонов, способных замедлить прогрессию анемии или хотя бы частично ее компенсировать. К тому же, наиболее эффективным лечением сегодня является трансплантация костного мозга. Поэтому изучение механизма развития апластической анемии имеет исключительно научный интерес.
Редкая врожденная апластическая анемия с тяжелым течением, диагностируемая в возрасте от 4 до 10 лет. Поражает с одинаковой частотой мужской и женский пол. Развивается по причине высокой подверженности ДНК клеток тела, и костного мозга в частности, к различного рода мутациям. Клинически проявляется тремя вышеперечисленными синдромами. Степень выраженности симптомов болезни имеет волнообразный характер с периодами ремиссий и обострений. Отмечается высокий риск развития злокачественных опухолевых процессов.
До 80% больных рождаются со следующими телесными аномалиями:
- Со стороны мышечно-костной системы — добавочные, отсутствующие или сращенные пальцы, недоразвитие или отсутствие лопаток, незаращение твердого неба (волчья пасть, заячья губа), отсутствие ушных раковин, деформация хрящей носа, добавочные позвонки, сколиоз и др.
- Со стороны нервной системы — микроэнцефалия или анэнцефалия, макроцефалия, спинномозговые грыжи, слепота, глухота, миастения, парапарезы и тетрапарезы, умственная отсталость.
- Со стороны мочеполовой системы — недоразвитие или отсутствие почек, добавочные почки, почечный поликистоз, S-образная почка, подковообразная почка (сращение одного из полюсов) эктопия мочеточников, экстрофия (выворот) мочевого пузыря, агенезия (отсутствие развития) матки, двурогая матка, полное заращение девственной плевы, анорхия (отсутствие яичек), агенезия уретры и пениса и др.
- Со стороны сердечно-сосудистой системы — незаращение овального отверстия и межпредсердной перегородки, открытый баталов проток, стенозы аорты на различных уровнях, инверсия магистральных сосудов сердца и др.
- Со стороны пищеварительной системы — стенозы и аневризмы кишечника, дивертикулез, атрезия кишечника (слепо заканчивающийся кишечник), бронхопищеводные свищи на различных уровнях.
Данный тип анемии считается парциально пластическим, поскольку проявляется угнетением исключительно эритроцитарного ростка костного мозга без вовлечения лейкоцитарного и тромбоцитарного ростков. Заболевание носит семейный характер и может проявиться, если хотя бы один родитель болен им. Поскольку заболевание является аутосомно-доминантным, то вероятность проявления колеблется в пределах 50 – 100% в зависимости от комбинации генов родителей.
Непосредственная причина заболевания – низкая чувствительность клеток костного мозга к эритропоэтину. Клинически наблюдается только анемический синдром. Замечена высокая вероятность развития острых лейкозов. В большинстве случаев определяются антитела к эритрокариоцитам, поэтому часто эффективным оказывается иммуносупрессивное лечение. Поддерживающее лечение осуществляется посредством регулярных переливаний эритроцитарной массы.
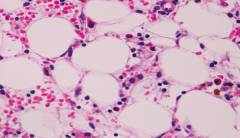
Наиболее ценными дополнительными исследованиями являются:
- общий анализ крови (ОАК);
- биохимический анализ крови (БАК);
- стернальная пункция;
- трепанобиопсия.
Данные общего анализа крови при апластической анемии свидетельствуют в пользу панцитопении (снижение количества всех трех типов клеток костного мозга). Уменьшение количества лейкоцитов наблюдается преимущественно за счет снижения гранулоцитов (нейтрофилы, эозинофилы и базофилы). Таким образом, относительно увеличивается процент лимфоцитов и моноцитов в лейкоцитарной формуле. На различных стадиях заболевания могут быть выявлены воспалительные признаки в той или иной мере.
Ориентировочными показателями ОАК при апластической анемии являются:
- Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
- Эритроциты – 0,7 – 2,5 х 10 12 \л (норма 3,7 х 10 12 \л). Снижение количества зрелых эритроцитов.
- Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
- Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
- Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
- Тромбоциты – менее 35 промилле или 100 х 10 9 \л. Снижение количества тромбоцитов.
- Лейкоциты – 0,5 – 2,5 х 10 9 \л (норма 4 – 9 х 10 9 \л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
- Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
- Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
- Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
- Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
- Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
- Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
- Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
- Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
- Анизоцитоз – наличие в крови эритроцитов различного размера.
- Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Некоторые виды биохимических анализов крови могут акцентировать внимание врача на отклонениях в организме, которые косвенно вписываются в три вышеперечисленных анемических синдрома.
Ориентировочными показателями БАК при апластической анемии являются:
- Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
- Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
- НBs-АГ и анти HBcor иммуноглобулины G – положительны (в норме — отрицательны). Данный анализ указывает на наличие вирусного гепатита В. В ряде случаев данный вирус провоцирует развитие аутоиммунной реакции против клеток костного мозга.
- С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
- Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Данный вид исследования используется с целью визуализации клеток костного мозга и их процентного соотношения. Пункция осуществляется в процедурном кабинете с применением стерильного инструментария и обезболивающих препаратов, преимущественно ингаляторного действия. Обработка места прокола осуществляется попеременно несколькими антисептическими растворами. Пациент находится в положении лежа на спине. Для пункции используются специальные широкие иглы с ограничителем глубины ввода. Шприц и поршень должны обеспечивать достаточный уровень компрессии, поэтому предпочтительнее использовать стеклянные шприцы с железным поршнем. Классически прокол осуществляется в теле грудины на уровне 2 – 3 ребра медленными вращательными движениями до ощущения провала. Резкое прободение повышает риск соскальзывания иглы с грудины и ранение органов грудной полости. После ощущения провала игла фиксируется одной рукой, а второй рукой производится тракция стержня шприца. Забор пунктата осуществляется до отметки 0,3 – 0,5 мм, после чего иглу извлекают, а отверстие заклеивают лейкопластырем. При отсутствии пунктата в месте прокола пункцию выполняют повторно на несколько сантиметров ниже. После пункции пациент должен продолжать находиться в горизонтальном положении под наблюдением медицинского персонала еще в течение 30 минут.
После извлечения шприца выполняется его опорожнение на несколько предметных стекол, из которых впоследствии будут изготовлены 10 – 15 мазков. Мазки фиксируются, окрашиваются и исследуются согласно соответствующим методикам. Результат исследования именуется миелограммой. Миелограмма отражает фактический и относительный клеточный состав костного мозга.
При апластической анемии миелограмма будет скудной, количество клеточных элементов значительно снижено. Камбиальные клетки эритроцитарного и лейкоцитарного ряда единичны или отсутствуют. Мегакариобласты отсутствуют. В редких случаях при пункции случается встретить сгруппированные очаги повышенной пролиферации клеток как компенсаторную реакцию здорового костного мозга на анемию. Такая миелограмма может сбить с толку, поскольку будет свидетельствовать в пользу отсутствия апластической анемии и поэтому будет ложноотрицательной.
Трепанобиопсия является способом изъятия части костного мозга из крыла подвздошной кости пациента. Преимущество данной процедуры над стернальной пункцией заключается в возможности забора большего количества материала с сохранением его структуры. Большее количество материала уменьшает вероятность ложноотрицательного результата апластической анемии, а изучение структуры костного мозга позволяет помимо цитологического исследования (миелограммы) провести еще и гистологическое.
При трепанобиопсии пациент находится в положении лежа на животе. Иглы для проведения данной процедуры схожи с иглами при стернальной пункции, но больше в размерах. Обезболивание и техника забора материала идентична вышеописанной. Результаты трепанобиопсии повторяют результаты стернальной пункции. Вдобавок к этому определяется увеличение процентной доли стромы по отношению к кроветворным клеткам, а также увеличение доли желтого неактивного костного мозга по отношению к красному активному.
При помощи анализа крови и результатов трепанобиопсии возможно определение степени тяжести апластической анемии.
Апластическая анемия средней тяжести определяется следующими показателями:
- гранулоциты менее 2,0 х 109\л;
- тромбоциты менее 100 х 109\л;
- ретикулоциты менее 2 – 3%;
- гипоплазия костного мозга на трепанобиопсии.
Апластическая анемия тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,5 х 109\л;
- тромбоциты менее 20 х 109\л;
- ретикулоциты менее 1%;
- аплазия костного мозга на трепанобиопсии.
Апластическая анемия крайне тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,2 х 109\л;
- тромбоциты единичные или отсутствуют;
- ретикулоциты единичные или отсутствуют;
- аплазия костного мозга на трепанобиопсии.

Медикаменты являются неотъемлемой частью лечения апластической анемии. Наиболее часто используются три группы препаратов — иммунодепрессанты (дексаметазон, метилпреднизолон и др.), цитостатики (циклофосфан, 6-меркаптопурил, циклоспорин А, метотрексат, имуран и др.) и антибиотики (цефалоспорины, макролиды, азалиды, хлорхинолоны и др.). Реже могут использоваться препараты для коррекции артериального давления, нарушений перистальтики микрофлоры кишечника, ферментные препараты и др.
Иммуносупрессоры могут быть использованы в виде монотерапии лишь в начальных стадиях заболевания и в процессе диагностики. Цитостатики при апластической анемии могут применяться в комбинации с иммуносупрессорами. Также важным их предназначением является очистка концентрата стволовых клеток от примесей злокачественных клеток. Антибиотики применяются во всех стадиях заболевания с целью лечения сопутствующих инфекционных осложнений, возникающих на фоне ослабленного или даже отсутствующего иммунитета.
По мере прогрессирования панцитопении возникает необходимость в трансплантации костного мозга – единственного радикального способа излечения апластической анемии. Проблема заключается в том, что для пересадки необходим донор, который предоставит костный мозг совместимый или хотя бы частично совместимый по антигенному составу с костным мозгом реципиента. Нахождение донора может занять длительное время, которым больной в большинстве случаев не располагает. В таких случаях пациенту осуществляются переливания цельной донорской крови или ее компонентов с целью поддержания компенсированного состояния его здоровья.
В данном разделе необходимо указать, что операция, как таковая, производится только донору костного мозга. Реципиент не оперируется. На протяжении десятилетий с момента первой трансплантации костного мозга в 1968 году изучались различные способы введения в организм больного стволовых клеток. Из всех методов наиболее эффективным оказалось внутривенное их введение. Именно по этой причине в дальнейшем операция при апластической анемии будет именоваться трансплантацией стволовых клеток.
Существуют следующие виды трансплантации стволовых клеток:
- аллогенная трансплантация костного мозга;
- аллогенная трансплантация периферических стволовых клеток крови;
- аутологичная трансплантация пуповинной крови;
- аутологичная трансплантация костного мозга;
- аутологичная трансплантация периферических стволовых клеток крови;
- сингенная трансплантация костного мозга.
Данный вид лечения подразумевает извлечение костного мозга донора и трансплантацию его больному реципиенту. Выполнение данной процедуры является технически сложным процессом и подразумевает соблюдение определенных правил.
В первую очередь донор должен быть совместим с организмом реципиента по трем антигенам в двух комплексах гистосовместимости HLA. В итоге ожидается полное сходство донора и реципиента по 6 антигенам. Минимальным порогом, при котором может осуществиться трансплантация является совпадение по 4 из 6 антигенов, однако в этом случае риски различного рода осложнений возрастают в несколько раз. По приблизительным подсчетам только в 30% случаев среди ближайших родственников больного отыскиваются доноры, полностью совместимые по всем 6 антигенам. Не имеет значения ни возраст, ни пол донора. Самым молодым донором в мире являлся четырехмесячный ребенок с весом тела 3,6 кг.
Операция по извлечению костного мозга является модификацией трепанобиопсии с некоторыми изменениями. В первую очередь данное вмешательство значительно более болезненно, поэтому обязательно использование общей или эпидуральной анестезии. Использующиеся иглы обладают большим диаметром. Пункция выполняется от 10 до 20 раз в гребешок каждой подвздошной кости. Количество забираемого материала значительно выше и составляет 10 – 15 мл на килограмм массы тела донора. Таким образом, у донора весом 70 кг будет взято количество костного мозга равное 700 – 1050 мл. Осложнения после подобной процедуры развиваются менее чем в 1% случаев. Подавляющее большинство осложнений связано с анестезией и острой сердечной недостаточностью при массивной кровопотере.
В дальнейшем полученный костный мозг медленно переливается в организм реципиента при помощи внутривенного доступа. Однако подобные случаи достаточно редки, и чаще костный мозг получается из специальных банков-хранилищ биологических материалов. Данные банки пополняются донорами по всему миру. На сегодняшний день насчитывается более 50 национальных банков-хранилищ биологических материалов и более 4 миллионов доноров по всему миру. После выделения костного мозга его необходимо сохранить на длительное время. Для этого он помещается в специальный раствор, не образующий кристаллов льда при замораживании и размораживании. Темпы охлаждения равняются 3 градусам в минуту. При температуре -85 градусов стволовые клетки сохраняются в течение 6 месяцев. При температуре -196 градусов стволовые клетки сохраняются в течение десятков лет. При необходимости использования стволовые клетки размораживаются при температуре 44 – 45 градусов.
Перед введением взвеси стволовых клеток производится их обработка цитостатиками с целью уничтожения примеси злокачественных клеток. Длительный период после трансплантации пациент должен получать интенсивную иммуносупрессивную терапию с целью предотвращения отторжения трансплантата и других нежелательных иммунных реакций.
Несмотря на то, что наиболее распространенным способом добывания стволовых клеток из организма донора является вышеописанная операция, в последние годы активно исследуется метод получения стволовых клеток из периферической крови. Его суть заключается в отделении определенный видов клеток при помощи физического явления, называемого лейкаферезом, с последующей фильтрацией крови в специальных клеточных сепараторах. В данном случае источником стволовых клеток является донорская кровь. После извлечения она обогащается рекомбинантными факторами роста, что приводит к ускорению темпов деления стволовых клеток и увеличению их количества.
Такой метод имеет ряд преимуществ. Во-первых, его побочные эффекты такие же, как при обычном заборе донорской крови. Во-вторых, не страдает костный мозг донора, который при операции должен восстанавливаться в течение как минимум полугода. В-третьих, после трансплантации добытых таким образом стволовых клеток реже развиваются побочные иммунные реакции.
Трансплантация стволовых клеток производится от донора, которым является гомозиготный (однояйцевый) близнец больного. Антигены на поверхности клеток их организмов идентичны, поэтому такой трансплантат не вызовет реакции отторжения и приравнивается к аутологичному.
После проведенной пересадки стволовых клеток пациент должен находиться под бдительным контролем медицинского персонала. Обязательно проведение активной иммуносупрессивной терапии. Низкий иммунитет больного подразумевает его нахождение в специализированных стерильных палатах с замкнутой системой вентиляции, бактериальными фильтрами и т. п. Перед тем как войти в палату медицинский персонал должен быть одет в стерильные костюмы и пройти через санпропускник.
Суть данного осложнения заключается в конфликте иммунных клеток организма хозяина со свежесформированными иммунными клетками донорских стволовых клеток. При этом донорские лимфоциты проявляют выраженную агрессию по отношению к лимфоцитам хозяина. Клинически это проявляется обильной сыпью, кожными буллами, язвами, нарушением функций желудочно-кишечного тракта, сердечно-сосудистой системы и т. д.
Данное осложнение развивается исключительно при пересадке костного мозга или стволовых клеток от аллогенного донора. При пересадке собственных, замороженных ранее стволовых клеток, такое осложнение не развивается. Данное осложнение происходит при полной совместимости костного мозга донора и реципиента по всем 6 антигенам в 30% случаев. При частичной совместимости риск такого осложнения возрастает до 80%. С целью профилактики данной патологической реакции применяются цитостатики. Наиболее часто препаратом выбора является циклоспорин А в паре с одним из следующих препаратов — метотрексат, имуран или глюкокортикоиды (дексаметазон, метилпреднизолон и др.)

Врожденная апластическая анемия Фанкони в большинстве случаев крайне тяжело поддается лечению, поскольку костный мозг никогда не был здоровым и, соответственно, очень сложно восстанавливается. Наличие врожденных аномалий развития сильно ограничивает показания к пересадке костного мозга таким пациентам. В большинстве случаев больные погибают в детском возрасте от аномалий развития или инфекционных осложнений.
Приобретенные апластические анемии имеют более благоприятный прогноз, поскольку в некоторых случаях являются обратимыми после прекращения действия повреждающего фактора на костный мозг.
Применение методов консервации пуповинной крови, стволовых клеток костного мозга и периферической крови повышает шансы на полное выздоровление до 75 – 80%.
источник
