Диагностические методы исследования включают пальцевое исследование прямой кишки, сигмоидо- и колоноскопию, исследование кала на скрытую кровь, радиографию с использованием бариевой клизмы, компьютерную и позитронно-эмиссионную томографию.
В последние годы всё чаще применяют определение в крови уровня карцино-эмбрионального антигена, который является индикатором метастатических процессов развития опухоли в толстом кишечнике.
ПАЛЬЦЕВОЕ ИССЛЕДОВАНИЕ
Всем лицам в возрасте старше 40 лет ежегодно рекомендуется проходить пальцевое исследование прямой кишки и сдавать кал для анализа на скрытую кровь.
Во время пальцевого исследования доктор ощупывает прямую кишку изнутри пальцем в перчатке для обнаружения патологических образований. В это время можно производить забор кала для анализа на скрытую кровь. Кроме этого, у мужчин одновременно проводится обследование предстательной железы.
АНАЛИЗ КАЛА НА СКРЫТУЮ КРОВЬ
Важным скрининговым методом для обнаружения колоректального рака и полипов является анализ кала на скрытую кровь.
Для опухолей толстой и прямой кишки характерна кровоточивость с попаданием крови в кал. Небольшое количество крови, перемешанное с калом, обычно невооруженным взглядом не видно. Используемые анализы кала на скрытую кровь основаны на изменении цвета химических веществ, что позволяет обнаружить микроскопические количества крови. Данные тесты являются достоверными и недорогими.
При проведении анализа небольшое количество кала наносится на специальную карточку. Обычно забирается три последовательных образца кала. При положительном анализе кала на скрытую кровь вероятность наличия полипа толстой кишки равна 30-45%, а вероятность рака толстой кишки составляет 3-5%. Если рак толстой кишки обнаружен при подобных обстоятельствах, то диагностика считается ранней, а долгосрочный прогноз — благоприятным.
Важно помнить, что положительный результат анализа кала на скрытую кровь вовсе не обязательно означает наличие у человека рака толстой кишки. Кровь в кале может появляться при самых разных состояниях. Тем не менее, при обнаружении в кале скрытой крови необходимо провести дополнительное обследование, в том числе ирригоскопию, колоноскопию и другие тесты для исключения рака толстой кишки и выявления источника кровотечения. Кроме этого, важно понимать, что отрицательный результат анализа кала на скрытую кровь не означает отсутствие колоректального рака или полипов. Даже при идеальных условиях анализ кала на скрытую кровь упускает, по крайней мере, 20% случаев рака толстой кишки. У многих пациентов с толстокишечными полипами результат теста на скрытую кровь является отрицательным. При подозрении на опухоли толстого кишечника, а также при наличии высокого риска развития колоректальных полипов и рака гибкая сигмоидоскопия или колоноскопия проводится даже при отрицательных результатах теста на скрытую кровь.
СИГМОИДОСКОПИЯ
Начиная с 50-летнего возраста, всем лицам, каждые 3-5 лет рекомендуется проведение гибкой сигмоидоскопии.
Гибкой сигмоидоскопией называется сокращенный вариант колоноскопии (обследование прямой кишки и нижних отделов толстой кишки с помощью специальной трубки).
Применение скрининговой сигмоидоскопии снижает летальность от рака толстой кишки. Это происходит в результате выявления у лиц с отсутствием симптомов полипов или рака на ранней стадии. При обнаружении полипа или опухоли рекомендуется проведение полной колоноскопии. При колоноскопии без открытого оперативного вмешательства можно полностью удалить большинство полипов. Врачи рекомендуют проводить скрининговую колоноскопию вместо гибкой сигмоидоскопии всем здоровым лицам, начиная с возраста 50-55 лет.
КОЛОНОСКОПИЯ
Пациенты с высоким риском развития колоректального рака могут проходить колоноскопию с возраста менее 50 лет. Например, пациентам с раком толстой кишки в семейном анамнезе рекомендуется начинать колоноскопию на 10 лет раньше, чем ближайшему родственнику был поставлен самый первый диагноз рака, или на 5 лет раньше, чем у ближайшего родственника был выявлен самый первый предопухолевый полип. Еще более ранняя колоноскопия рекомендуется пациентам с наследственными синдромами рака толстой кишки, такими как САП, АСАП, ННРТК и MYH-полипоз. Рекомендации зависят от генетического дефекта: например, при САП колоноскопию можно начинать с подросткового возраста для отслеживания развития полипов толстой кишки. Кроме этого, для исключения рецидива колоноскопию следует проводить пациентам, у которых полипы или рак толстой кишки отмечались ранее. У пациентов с длительным течением хронического язвенного колита (более 10 лет) риск развития рака толстой кишки повышен, а поэтому для обнаружения предраковых изменений в стенке кишечника им следует регулярно проходить колоноскопию.
Для проведения колоноскопии используется тонкий длинный зонд, который вставляется через прямую кишку для обследования внутренних поверхностей толстого кишечника. Колоноскопия считается более точным методом, чем рентгенологическое исследование.
При обнаружении полипов, обычно с помощью колоноскопа проводится их удаление, образец ткани отправляется на гистологическое исследование. Патоморфолог изучает полип под микроскопом для обнаружения признаков озлокачествления. Большинство удаляемых при колоноскопии полипов являются доброкачественными. Но у многих из них бывают признаки предопухолевого состояния. Удаление предраковых полипов предотвращает развитие из них в дальнейшем колоректального рака.
Если при проведении колоноскопии обнаруживается злокачественная опухоль, то производится биопсия (забор небольших образцов ткани) с последующим их исследованием под микроскопом. Если биопсия подтверждает диагноз рака, проводится определение стадии опухоли. Это позволяет выявить ее распространенность в другие органы. Для колоректального рака характерно распространение в легкие и печень. Поэтому при определении стадии опухоли обычно используется рентгенография органов грудной клетки, УЗИ или компьютерная томография легких, печени и органов брюшной полости.
ИРРИГОСКОПИЯ
При ирригоскопии — рентгенологическом исследовании толстой и прямой кишки пациент получает клизму с бариевой взвесью (белая жидкость, содержащая барий). Барий не проницаем для рентгеновских лучей и позволяет увидеть контуры толстого кишечника при рентгенографии.
АНАЛИЗ КРОВИ
В некоторых случаях проводится анализ крови на раково-эмбриональный (или карцино-эмбриональный) антиген (РЭА). РЭА — это вещество, которое образуется некоторыми раковыми клетками. Иногда высокое содержание РЭА обнаруживается у пациентов с колоректальным раком.
ГЕНЕТИЧЕСКОЕ ИССЛЕДОВАНИЕ
В настоящее время доступно генетическое исследование для обнаружения наследственных синдромов рака толстой кишки, таких как САП, АСАП, ННРТК и MYH-полипоз.
Генетическое консультирование с последующим генетическим тестированием необходимо проводить в тех семьях, члены которых страдают раком толстой кишки, множественными толстокишечными полипами или другими видами рака, например, мочеточников, матки, 12-перстной кишки и т.д., а также при возникновении рака в молодом возрасте.
Генетическое тестирование без предварительного консультирования не одобряется, поскольку требует дополнительного обучения членов семьи, а полученные результаты сложны для интерпретации.
Преимущества проведения генетической консультации с последующим генетическим тестированием включают:
Выявление членов семьи с высоким риском развития рака толстой кишки, которым требуется раннее проведение колоноскопии;
Выявление членов семьи с высоким риском развития других видов рака, которым может потребоваться профилактическое обследование, например, УЗИ для выявления рака матки, анализы мочи на рак мочеточника, эндоскопическое обследование верхних отделов желудочно-кишечного тракта на рак желудка и 12-перстной кишки;
Устранение беспокойства тех членов семьи, у которых наследственные генетические дефекты отсутствуют.
Если желаете поделиться данными этой статьи с друзьями, опубликуйте ссылку на него на своей странице, выбрав кнопку нужной соцсети:
источник
Колоректальный рак – это злокачественное новообразование в стенке толстой кишки. Опасность патологии в том, что она долгое время развивается бессимптомно, пациент не обращает внимания на первичные признаки. Однако заболевание продолжает прогрессировать, появляются осложнения, которые значительно ухудшают прогноз для пациента. Поэтому при наличии колоректального рака так важно своевременно провести диагностику.
- общая слабость;
- повышенная утомляемость;
- наличие неприятного привкуса во рту, появление отрыжки кислым;
- тошнота, рвота, не приносящая облегчения;
- вздутие живота, метеоризм;
- ощущение тяжести в области эпигастрия;
- тянущие боли в животе, часто локализующиеся в левой части живота.
-
частичная, а затем и полная кишечная непроходимость;
- острые боли, возникающие резко и имеющие схваткообразный характер;
- постоянные нарушения перистальтики – чередование запоров и диареи;
- выраженная интоксикация – слабость, утомляемость, повышение температуры;
- выделение крови в начале дефекации;
- ощущение неполного опорожнения кишечника;
- снижение массы тела пациента;
- анемия;
- сухость слизистых глаз, рта, носа;
- повышенная потливость;
- боли при дефекации;
- иммунодефицитное состояние, которое сопровождается частыми инфекциями;
- сохраняется тошнота и рвота, потеря аппетита.
-
наследственная предрасположенность;
- воспалительные патологии толстого кишечника (неспецифический язвенный колит, болезнь Крона);
- пожилой возраст;
- особенности питания (постоянное употребление жирных продуктов, животного белка, недостаточное количество клетчатки в меню);
- употребление алкогольных напитков, курение;
- наличие полипов кишечника;
-
недостаточная физическая активность;
- ожирение;
- сахарный диабет;
- кальциевая недостаточность в питании;
- вторичный или первичный иммунодефицит;
- гиповитаминозные состояния;
- прием некоторых лекарств.
- Стадия I. Характеризуется возникновением первичной опухоли, которая распространяется на глубину слизистой и подслизистой оболочки толстого кишечника.
- Стадия IIa. Опухоль распространяется глубже, но не прорастает всю стенку кишечника. Образование перекрывает не более половины полости органа. При этом не обнаруживается распространения в другие органы, в том числе в лимфатические узлы.
- Стадия IIb. Отличается от предыдущей стадии глубиной распространения – опухоль прорастает всю стенку кишечника, но при этом не выходит в полость органа более чем на половину поперечника и не дает метастазов в лимфатические узлы.
- Стадия IIIa. Новообразование распространяется на всю глубину стенки кишечника, закрывает более половины просвет, но не переходит на лимфатические узлы.
- Стадия IIIb. Опухолевый очаг прорастает всю стенку органа, значительно перекрывает его полость и распространяется в ближайшие лимфоузлы.
- Стадия IV. Опухоль значительно разрастается, может распространяться в соседние органы или отдавать гематогенные метастазы в отдаленные ткани.
- Анализ клинико-анамнестических данных. О наличии рака может свидетельствовать длительное вялое течение заболевания, характерные кишечные симптомы, наличие астенизации пациента (слабость, вялость, субфебрильная лихорадка), а также снижение массы тела (признак кахексии).
- Пальцевое ректальное исследование. Считается первичным методом диагностики. С помощью ректального исследования можно обнаружить только образования, расположенные в области анального канала.
-
Колоноскопия. Основной метод диагностики колоректального рака. Методика может применяться и в качестве скрининга – профилактического обследования пациентов группы риска (пожилых людей старше 50 лет). Исследование предполагает введение в пищеварительную систему пациента через анальное отверстие специального эндоскопа, с помощью которого можно осмотреть стенку кишечника и обнаружить патологическое образование. В ходе диагностики из подозрительной опухоли обязательно берется фрагмент ткани.
- Гистологическое исследование. Полученный при колоноскопии биоптат отправляется в лабораторию для определения его клеточного состава. Анализ морфологии ткани позволяет дифференцировать злокачественное новообразование от доброкачественных полипов. Проведение гистологического исследования является обязательным компонентом диагностики, без которого невозможно подтвердить диагноз колоректального рака.
- Ирригоскопия. Методика представляет собой «запасной» метод диагностики, который применяется при наличии противопоказаний к колоноскопии. Она относится к рентгеноконтрастным исследованиям. По информативности ирригоскопия значительно ниже, чем эндоскопическая диагностика.
- Исследование кала. При анализе копрограммы можно обнаружить скрытую кровь в кале, которая свидетельствует о наличии повреждения стенки кишечника, характерного для колоректального рака. Однако такой признак не является специфическим для новообразования, он может появляться и при других патологиях пищеварительной системы.
-
Дополнительные исследования. После обнаружения очага рака пациента в обязательном порядке обследуют на наличие метастазов опухоли в других органов. С этой целью проводится комплекс исследований, который включает УЗИ, КТ или МРТ брюшной полости, рентгенографическое исследование грудной клетки, урографию, цистоскопию. Объем обследования пациента зависит от наличия симптомов повреждения тех или иных органов, которые появляются на поздних стадиях заболевания.
- Общий и биохимический анализ крови. Лабораторные исследования являются рутинными методиками, которые необходимы для оценки общего состояния пациента. При колоректальном раке в общем анализе обычно определяется выраженная анемия, а в биохимическом – снижение функциональной активности печени.
Основными методами борьбы с раком являются химиотерапия, лучевая терапия и хирургическое вмешательство. Консервативными методами избавиться от заболевания невозможно.
В большинстве случаев при колоректальном раке прибегают к хирургическому вмешательству. Объем операции зависит от стадии развития рака:
-
На ранних стадиях заболевания, когда оно имеется четко локализованный характер, удаляется только пораженный фрагмент кишечника с окружающей его клетчаткой и регионарными лимфатическими узлами.
- Распространенная опухоль нижнего отдела требует более радикального вмешательства. Проводится удаление прямой кишки вместе с сфинктером. На переднюю брюшную стенку накладывается сигмостома – прямое сообщение сигмовидной кишки с поверхностью кожи. В дальнейшем каловые массы будут удаляться через эту стому.
- В некоторых случаях может быть проведена более щадящая операция – сфинктеросохраняющая резекция. В ходе нее удаляется только прямая кишка, сфинктер остается на месте, и к нему подшивается низведенная сигмовидная кишка. Такая операция более удобна для пациента в дальнейшем, однако не всегда анатомическое строение позволяет подвести вышележащий отдел без натяжения ткани.
- Если рак находится на последних стадиях и осложняется кишечной непроходимостью, операция проводится в несколько этапов. Первоначально необходимо восстановить движение пищевых масс по кишечнику, для чего пациенту накладывается колостома – соустье между ободочной кишкой и поверхностью кожи. Через некоторое время проводится операция по удалению новообразования способом, описанным выше.
Пациенту обязательно проводится симптоматическое лечение, которое направлено на снятие клинических проявлений заболевания. На опухоль эти лекарства никак не влияют, поэтому заменить этиологическое лечение ими невозможно.
- анальгетики – для купирования болей;
- противорвотные средства;
- препараты железа при анемии;
- иммуностимуляторы.
Во время лечения от рака пациент должен значительно скорректировать свой образ жизни, в том числе и питание. Правильное питания – это дополнительный положительный фактор, который поможет поддерживать нормальное состояние пациента при прохождении терапии.
| Рекомендуемые продукты | Нерекомендуемые продукты |
Отдельно стоит отметить антиканцерогенные продукты, которые рекомендуется ввести в рацион:
|
|
Прогноз жизни для пациента зависит от того, насколько рано была диагностирована опухоль.
- На I и II стадии заболевания после адекватного лечения выздоравливают 80-90% пациентов, при этом вероятность ремиссии заболевания практически отсутствует. При прогрессировании патологии прогноз ухудшается.
- На III стадии только 50% больных выздоравливает.
- IV стадия характеризуется появлением тяжелых осложнений и активного метастазирования опухоли. Это считается фатальным для пациента и почти всегда приводит к летальному исходу.
Специфическая профилактика заболевания на данный момент не разработана. В качестве неспецифической профилактики колоректального рака рекомендуется:
- правильно питаться, соблюдать режим приемов пищи, отказаться от вредных блюд, полуфабрикатов, фастфуда;
- включать в рацион больше продуктов, содержащих много клетчатки;
- отказаться от употребления алкоголя, бросить курить;
- регулярно проходить осмотр у гастроэнтеролога после достижения 50 лет;
- удалять доброкачественные полипы толстого кишечника, так как они могут переродиться в злокачественную опухоль.
источник
- повышенное потребление животных белков и жиров
- потребление рафинированных углеводов
- малое употребление клетчатки
- изменение секреции желчи и состава желчных кислот
- изменение кишечной флоры
- дефицит витаминов А и С
Роль наследственности в развитии рака ободочной кишки изучена недостаточно. Первичные генетические факторы являются значимыми у 5-10% больных.
- Полипозом толстой кишки
- Одиночными и групповыми полипами толстой кишки
- Язвенным колитом
- Болезнь Крона
- Предшествующая операция по поводу рака толстой кишки
- Предшествующая операция на молочной железе и яичниках
В настоящее время большинство исследователей выделяют 3 основные гистологические формы рака ободочной кишки: железистый рак, или аденокарциному (70-75% случаев), солидный рак (до 20%) и коллоидный или слизистый рак (8-17% случаев). В соответствии с классификацией ВОЗ по степени дифференцировки различают высоко дифференцированные (низкая степень злокачественности), среднюю степень дифференцировки и злокачественности и низко дифференцированные опухоли (высокая степень злокачественности).
Стадия 0 — Tis (рак in situ)
Стадия I — T1N0M0, T2N0M0
Стадия II — T3N0M0,T4N0M0
Стадия III — все значения T, N1-3M0
Стадия IV — все значения T и N, M1
Т1- опухоль прорастает слизистую оболочку и подслизистую основу кишки
Т2 — опухоль прорастает мышечный слой стенки кишки
Т3 — опухоль прорастает субсерозную ткань или неперитонезированные участки
кишки
Т4 — инвазия опухоли в периректальные ткани и соседние органы.
Тx — первичная опухоль не может быть оценена
N1 — один — три пораженных метастазами регионарных лимфатических узла
N2 — более трех пораженных лимфатических узла
N3 — поражение лимфатических узлов вдоль магистральных сосудов прямой кишки
M0 — отдаленных метастазов нет
M1 — есть отдаленные метастазы
Основным методом лечения рака ободочной кишки является хирургический . Он позволяет выполнить полное удаление опухоли в пределах здоровых тканей. Решить задачу подавления последующего опухолевого роста призваны лучевая , химио- , иммуномодулирующая терапии.
Хирургическое лечение
Хирургические операции в зависимости от распространенности опухоли и объема операции делятся на радикальные и паллиативные. Паллиативные операции могут выполняться в объеме радикальных резекций кишки или быть симптоматическими.
При радикальной операции удаляется пораженный опухолью отдел ободочной кишки одним блоком с регионарным лимфатическим аппаратом.
Паллиативные резекции выполняются при отдаленных метастазах рака и помогают предупредить в послеоперационном периоде такие осложнения, как выраженный болевой синдром, кровотечения из распадающейся опухоли, зловонные, раздражающие ткани кишечные выделения. Тем самым улучшается качество жизни запущенных онкологических больных.
Симптоматические операции без резекции кишки выполняются в объеме разгрузочных колостомий или обходных анастомозов у больных с далеко зашедшим опухолевым процессом по поводу осложнений рака.
По способу завершения различают операции с первичным восстановлением кишечной непрерывности и с наложением колостомы. Последние используются как первый этап в лечении рака, осложненного кишечной непроходимостью (с дальнейшим восстановлением) и при паллиативном лечении.
Химиотерапия
Одним из методов комбинированного лечения рака ободочной кишки является адьювантная (дополнительная) химиотерапия. Чувствительность рака ободочной кишки к ней выявлена у 25-30% больных. Адьювантная терапия проводится после операции при поражении опухолью регионарных лимфатических узлов.
Иммуномодулирующая терапия
В последнее время появляются сообщения о достоверном снижении количества рецидивов и отдаленных метастазов после проведения химиоиммунопрофилактики. Метод заключается в назначении пациентам после хирургического лечения при отсутствии метастазов в регионарных лимфоузлах в течение года еженедельно цитостатика и иммуномодулятора.
Лучевая терапия используется:
— Как предоперационный метод лечения рака прямой кишки (для уменьшения стадийности рака)
— Для послеоперационного облучения больных раком прямой кишки для сокращения частоты рецидивов
— Как основной метод лечения неоперабильного местнораспространенного рака прямой кишки.
Еще раз подчеркиваем, что только выявление колоректального рака на ранних стадиях позволяет максимально использовать весь спектр современных методов лечения и добиться хороших результатов. Рак на ранних стадиях может вызывать минимум жалоб и протекать под маской многих других проктологических и хирургических заболеваний. Поэтому своевременно обращайтесь к специалистам.
источник
«Колоректальный рак» — собирательное понятие для рака (опухоли) различных отделов толстой (colon) и прямой (rectum) кишки. Среди множества онкологических заболеваний эта патология остается наименее освещенной и наиболее покрытой мифами и страхами пациентов, но, тем не менее, современные возможности ранней диагностики дают основания считать КРР на

В России колоректальный рак занимает одну из ведущих позиций. Среди мужчин, заболевших злокачественными новообразованиями, КРР находится на 3-м место после рака легкого и желудка, а у женщин, соответственно, после рака молочной железы и рака кожи. Тревожным фактом является высокий уровень летальности на 1-м году жизни после установления диагноза, обусловленный тем, что при первичном обращении пациентов к врачу запущенные формы рака (III-IV стадии) уже имеют более 70% пациентов с раком ободочной кишки и более 60% пациентов с раком прямой кишки, при этом хирургическому лечению подвергается около 40% больных.
В США ежегодно регистрируется приблизительно 140 000 новых случаев болезни и около 50 000 летальных исходов по поводу КРР. Удивительно, но именно в США отмечается медленная, но постоянная тенденция снижения заболеваемости КРР, а показатели выживаемости при КРР – одни из самых высоких в мире. Данные отчетности Национального института рака США показывают, что 61% пациентов с данным диагнозом преодолел пятилетнюю выживаемость.
В США и многих других западных странах улучшение результатов достигнуто, в частности, своевременным обнаружением и удалением полипов толстой кишки, диагностикой КРР на ранней стадии и более эффективным лечением. К сожалению, во многих странах с ограниченными ресурсами и иной инфраструктурой здравоохранения, особенно в Центральной и Южной Америке и Восточной Европе, смертность от КРР продолжает расти.
Колоректальный рак чаще всего развивается как перерождение аденоматозных (железистых) полипов.
Несмотря на то, что наследственная предрасположенность значительно увеличивает риск развития КРР, большинство случаев является спорадическими (иными словами — непредсказуемыми, эпизодическими), а не семейными: приблизительно 80-95 % случаев спорадических против 5-20%, имеющих наследственную причину. Но среди всех других видов рака у человека КРР проявляет наибольшую связь с семейной заболеваемостью. Исследования молекулярных механизмов развития колоректального рака выявили ряд генетических нарушений, большинство из которых наследуется по аутосомно-доминантному типу и значительно повышает риск развития рака. Семейный аденоматозный полипоз и синдром Линча (наследственный неполипозный колоректальный рак) являются наиболее распространенными из семейных видов рака с изученными генетическими дефектами, вместе на их долю приходится лишь около 5% случаев колоректального рака.
Из других наиболее известных предрасполагающих факторов стоит отметить воспалительные заболевания кишечника (язвенный колит, болезнь Крона) — риск рака увеличивается с продолжительностью течения этих заболеваний. Общая заболеваемость колоректального рака начинает увеличиваться примерно через 8 –10 лет после возникновения воспалительного заболевания кишечника и возрастает до 15-20% через 30 лет. Главными факторами риска являются длительность заболевания, распространенность поражения, молодой возраст и наличие осложнений.
Возраст является значимым фактором риска: колоректальный рак является редкостью до 40 лет, однако частота колоректального рака увеличивается в каждом последующем десятилетии и достигает максимума в 60-75 лет.
Существуют факторы, которые повышают риск развития колоректального рака. Установлено, что популяции людей, в которых заболеваемость колоректального рака высока, употребляют пищу, бедную клетчаткой, но при этом с высоким содержанием животного белка, жира и рафинированных углеводов. Ожирение примерно в 1,5 раза увеличивает риск развития колоректального рака, причем в большей степени у мужчин. Избыточное употребление алкоголя и курение также находятся в числе факторов, повышающих спорадическую заболеваемость полипозом толстого кишечника и колоректального рака, и значительно увеличивают риск рака у пациентов с наследственными заболеваниями толстого кишечника (например, с синдромом Линча).
Это методы активного выявления лиц с факторами риска развития КРР или с бессимптомно протекающим КРР, основанные на применении специальных методов диагностики. Скрининговые исследования при колоректальном раке помогают значительно уменьшить вероятность его развития, так как позволяют выявить предраковое заболевание кишечника или рак на ранней стадии и своевременно оказать лечебную помощь.
В первую очередь скринингу подлежат лица, у которых среди родственников первой линии (у детей, родителей, братьев и сестер) имеются случаи рака толстой или прямой кишки, аденомы и воспалительные заболевания кишечника. Наличие у родственника такого диагноза увеличивает риск примерно в 2 раза по сравнению с популяцией в целом.
Рекомендации ряда научных сообществ по изучению колоректального рака (American College of Gastroenterology, Multisociety Task Force on Colorectal Cancer from the American Cancer Society, American College of Radiology) содержат указания по срокам проведения первой колоноскопии у следующих пациентов:
раннее, до 40 лет, у пациентов, имеющих ближайших родственников с аденомой кишечника, диагностированной в возрасте до 60 лет;
в срок на 10-15 лет раньше, чем был выявлен самый «молодой» КРР в семье, и/или этот диагноз был установлен в 60 лет и моложе.
Сроки скрининговых исследований могут быть изменены, если пациент имеет дополнительные факторы риска КРР: радиационные облучения брюшной полости в раннем возрасте по поводу рака, диагноз акромегалии (при котором возможно развитие аденоматоза толстой кишки), перенесенная трансплантация почки (как причина долгосрочной иммуносупрессивной терапии).
Правый отдел толстой кишки имеет большой диаметр, тонкую стенку и ее содержимое – это жидкость, поэтому закупорка просвета кишки (обтурация) развивается в последнюю очередь. Чаще пациентов беспокоит желудочно-кишечный дискомфорт, обусловленный расстройствами функций соседних органов — желудка, желчного пузыря, печени, поджелудочной железы. Кровотечение из опухоли обычно скрытое, и утомляемость и утренняя слабость, вызванные анемией, могут быть единственными жалобами. Опухоли иногда становятся достаточно большими, что позволяет прощупать их через брюшную стенку, прежде чем появятся другие признаки.
Левый отдел толстой кишки имеет меньший просвет, каловые массы в нем — полутвердой консистенции, и опухоль имеет тенденцию по кругу суживать просвет кишки, вызывая кишечную непроходимость. Застой кишечного содержимого активирует процессы гниения и брожения, что сопровождается вздутием кишечника, урчанием в животе. Запор сменяется обильным жидким, зловонным стулом. Больного беспокоят коликообразные боли в животе. Стул может быть смешан с кровью: кровотечение при раке толстой кишки наиболее часто связано уже с распадом или изъязвлением опухоли. У некоторых пациентов наблюдаются симптомы прободения кишки с развитием перитонита.
При раке прямой кишки основным признаком является кровотечение при дефекации. Всякий раз, когда наблюдается кровотечение или выделение крови из заднего прохода, даже при наличии выраженного геморроя или дивертикулярной болезни, должен быть исключен сопутствующий рак. Могут присутствовать позывы на дефекацию и ощущение неполного опорожнения кишечника. Боль появляется при вовлечении тканей, окружающих прямую кишку.
В ряде случаев, еще до появления кишечных симптомов у пациентов могут обнаруживаться признаки метастатического поражения – распространения опухоли в другие органы, например, увеличение печени, асцит (скопление жидкости в брюшной полости), увеличение надключичных лимфатических узлов.
Нарушение общего состояния больных может наблюдаться и на ранних стадиях и проявляется признаками анемии без видимого кровотечения, общим недомоганием, слабостью, иногда повышением температуры тела. Эти симптомы характерны для множества заболеваний, но их появление стать поводом для немедленного обращения к врачу общей практики.
У колоректального рака существует много «масок», поэтому следует обратиться к врачу за консультацией:
при повышенной утомляемости, одышке, нехарактерной для пациента бледности, если ранее их не было;
при длительных запорах или поносах;
при частых/постоянных болях в области живота;
при наличии видимой крови в кале после дефекации;
при наличии скрытой крови в анализе кала.
При острой боли в области живота, при вздутии или асимметрии живота, при отсутствии отхождения стула и газов следует вызвать «скорую помощь» или срочно обратиться за медицинской помощью.
Как только диагностирован рак, пациентам необходимо выполнить компьютерную томографию брюшной полости и грудной клетки с целью выявления метастатических поражений, а также лабораторные исследования для оценки выраженности анемии.
У 70 % пациентов с колоректальным раком наблюдается повышение уровня раково-эмбрионального антигена сыворотки (РЭА) и онкомаркера СА19.9. В дальнейшем мониторинг РЭА и СА19.9 может быть полезным для ранней диагностики рецидива опухоли. По показаниям исследуются и другие маркеры колоректального рака.
Основным скрининговым исследованием у пациентов старше 50 лет со средней степенью риска является колоноскопия. При наличии полипов или другой патологии в толстой и прямой кишке регулярность исследований может возрастать до ежегодных или каждые 3-10 лет. Оценивая степень риска развития колоректального рака у пациентов с заболеваниями кишечника, врач принимает решение о частоте проведения исследований индивидуально для каждого больного.
Лишь только такая активная позиция врачей по поводу ранней диагностики полипов и профилактике опухолей толстой и прямой кишки привела к замедлению темпов роста заболеваемости колоректального рака в США.
Хирургическое лечение колоректального рака может быть проведено у 70-95 % пациентов без признаков метастатической болезни. Хирургическое лечение заключается в удалении сегмента кишки с опухолью с местным лимфатическим аппаратом с последующим соединением концов кишки (созданием анастомоза) для сохранения естественной способности к опорожнению кишечника. При раке прямой кишки объем операции зависит от того, на каком расстоянии от анального отверстия расположена опухоль. Если необходимо полностью удалить прямую кишку, формируется постоянная колостома (хирургически созданное отверстие в передней брюшной стенке для выведения кишки), через которую содержимое кишечника будет опорожняться в калоприемник. Учитывая современные достижения медицины и приспособления для ухода за колостомой, негативные последствия этой операции сводятся к минимуму.
При наличии метастазов в печени у неистощенных пациентов рекомендуется удаление ограниченного числа метастазов в качестве дальнейшего метода хирургического лечения. Эта операция выполняется, если первичная опухоль была полностью удалена, метастаз печени находится в одной доле печени и отсутствуют внепеченочные метастазы. Выживаемость после операции в течение 5 лет составляет 6- 25 %.
Эффективность лечения колоректального рака зависит от того, на какой стадии болезни пациент обратился к врачу. Только ранняя диагностика колоректального рака позволяет максимально использовать весь спектр современных методов лечения и добиться удовлетворительных результатов.
Внимательное отношение к своему организму и своевременное обращение за квалифицированной медицинской помощью увеличивает шансы на продолжение активной жизни даже при таком серьезном онкологическом заболевании.
источник

Онкологический больной, согласно практике, попадает к врачам онкологам-колопроктологам уже с запущенными стадиями заболевания, вследствие чего до 50% таких пациентов умирают в первый год диагностики заболевания. Первым специалистом, к которому обращается больной с предопухолевым заболеванием или опухолью органов желудочно-кишечного тракта, является терапевт или гастроэнтеролог, затем врач-эндоскопист и лишь потом онколог; при раке прямой и ободочной кишки – соответственно врач-хирург или колопроктолог, эндоскопист и онколог.
Большинство (свыше 60%) больных колоректальным раком поступают в онкологические, хирургические и колопроктологические стационары, нередко на фоне развившихся таких тяжелых осложнений, как кишечная непроходимость, параканцерозные инфильтраты, абсцессы, кровотечения, перфорация стенки толстой кишки. Это не только существенно ухудшает непосредственные и отдаленные результаты хирургического лечения, но и является причиной увеличения удельного веса больных со стомами. Даже в специализированных стационарах формированием стом заканчивается каждая 3-4-я операция на толстой кишке; 12-20% больных являются неоперабельными.
По причине поздней диагностики заболевания летальность больных раком ободочной кишки в течение года составляет 41,8%, прямой кишки – 32,9%. К сожалению, заболевание в преобладающем количестве случаев выявляют на III-IV стадии, что не позволяет выполнять щадящие радикальные вмешательства, в частности, трансанальные микрохирургические резекции. Показатель 5-летней выживаемости составляет 83% при локализации опухоли в пределах кишечной стенки, 64% — при распространении опухоли на всю толщину кишечной стенки. При наличии метастазов в лимфатических узлах этот показатель составляет в среднем 38%, а при наличии отдаленных метастазов (чаще всего в печени) – не превышает 3%.
Важным резервом снижения заболеваемости и распространенности рака органов желудочно-кишечного тракта, его своевременной диагностики и лечения на ранних стадиях является формирование врачами групп риска развития опухолей (пациенты, имеющие предопухолевые заболевания, неблагоприятные в плане онкологии, отягощенный семейный анамнез и др.) и активное наблюдение за такими больными.
— полипы: диффузный семейный полипоз, аденоматозные полипы;
— неспецифический язвенный колит;
— болезнь Крона;
— дивертикулез;
— другие доброкачественные и воспалительные заболевания прямой кишки.
Именно предраковые заболевания являются своеобразным водоразделом между терапией, гастроэнтерологией и онкологией. Учитывая, что прогрессирование и рост опухоли через стадию дисплазии – рака in situ – до стадии метастазирования происходят в течение года, это терапевтическое и диагностическое окно должны активно использовать именно врачи общего профиля для проведения первичной и вторичной профилактики рака данной локализации. В связи с этим становится актуальным своевременное обследование толстой кишки у практически здоровых людей для выявления у них бессимптомных заболеваний (полипов, раннего рака толстой кишки и др.).
Количество заболевших и умерших от колоректального рака может быть существенно уменьшено за счет полноценного скрининга – тестирования бессимптомных пациентов, имеющих предраковые заболевания или колоректальный рак на ранних стадиях. Наиболее частой находкой при проведении скрининга являются аденоматозные полипы, распространенность которых, по данным скрининговых колоноскопий, составляет 18-36%.
Согласно рекомендациям Американского общества рака, для своевременной диагностики рака в бессимптомной популяции в естественных (обычных) условиях риска показано проведение следующих методов обследования:
— пальцевое исследование прямой кишки – ежегодно у лиц старше 40 лет;
— исследование кала на скрытую кровь – ежегодно у лиц ≥ 50 лет;
— фиброколоноскопия – каждые 3-5 лет у лиц старше 50 лет (в нашей стране с учетом радиоэкологической ситуации – каждые 2 года).
— наличия хронических воспалительных заболеваний кишечника, аденоматозных полипов, рака другой локализации и др.;
— семейного анамнеза (наличие одного или двух родственников первой линии родства с колоректальным раком или семейным диффузным полипозом кишечника);
— возраст старше 50 лет (более 90% больных колоректальным раком – лица данной возрастной категории; средняя степень риска).
Превентивная колопроктологическая программа должна включать активное выявление бессимптомных полипов и рака толстой кишки на ранней стадии, их адекватное и своевременное хирургическое лечение. Эффективное наблюдение за выявленными больными позволяет предотвратить возникновение новообразований в толстой кишке у 94,4% больных, предупредить прогрессирование онкологической патологии в 94,7-99,5% случаев.
Возраст является важным фактором риска колоректального рака как у мужчин, так и у женщин. После 50 лет заболеваемости колоректальным раком увеличивается с 8 до 160 и более случаев на 100000 населения. Количество аденоматозных полипов толстой кишки у лиц в возрасте 50-75 лет увеличиваетс на 20-25%. Таким образом, люди, которым исполнилось 50 лет, даже при отсутствии симптоматики составляют группу умеренного риска колоректального рака. Вторую категорию – группу повышенного риска колоректального рака (20%) – составляют лица с генетической и семейной предрасположенностью, страдающие хроническими воспалительными заболеваниями кишечника и диффузным семейным полипозом.
Группа высокого риска колоректального рака определена в соответствии с Амстердамскими критериями (наличие злокачественных опухолей в двух поколениях, наличие рака у родственника первой линии в возрасте до 50 лет). В этом случае скрининг колоректального рака определяется врачом перед началом скрининга для выбора объема исследований и частоты их проведения.
- Выявлялись ли у пациента в прошлом аденоматозные полипы или колоректальный рак?
- Имеет ли пациент хронические воспалительные заболевания кишечника (язвенный колит, болезнь Крона и др.), предрасполагающие к развитию колоректального рака?
- Отягощен ли семейный анамнез в отношении колоректального рака или аденоматозного полипа толстой кишки? Если да, то как часто среди родственников первой степени родства и в каком возрасте рак или полип были впервие диагностированы?
Положительный ответ на любой из этих вопросов должен расцениваться как фактор риска развития колоректального рака.
Скрининг колоректального рака является комплексным обследованием и включает проведение теста на скрытую кровь в кале, выполнение сигмоскопии, колоноскопии, рентгеноконтрастных иследований, определение поврежденной ДНК в кале и др. Условием успешности скрининговой программы является соблюдение множества условий, важнейшими из которых представляются осведомленность и активность врачей первичного звена, готовность пациента к проведению скрининговых тестов, своевременность их выполнения и проведения необходимого лечения, последующего активного наблюдения за пациентами и т.д.
Причина поздней диагностики рака данной локализации и госпитализации больных заключается в отсутствии государственной программы по профилактике и ранней диагностике хронических заболеваний толстой кишки (полипов толстой кишки, колоректального рака, неспецифического язвенного колита, болезни Крона и др.), а также в снижении доступности населению, особенно жителям сельской местности, специализированных видов медицинской помощи, в том числе проктологической и онкологической.
Широкая информативность врачей-хирургов, терапевтов, гастроэнтерологов, колопроктологов о современных требованиях к проведению скрининга колоректального рака способствует своевременной диагностике и лечению этой патологии на начальном этапе и снижению показателей заболеваемости населения колоректальным раком.
Таким образом, объединение усилий основных звеньев в области здравоохранения и утверждение целевых государственных программ будут способствовать решению проблемы успешной профилактики и лечения рака толстой кишки, которая остается актуальной и требует принятия незамедлительных мер.
Уже на ранних доклинических стадиях развития колоректального рака в содержимом кишечника могут быть выявлены кровь и другие элементы тканей толстой кишки, что можно установить при исследовании кала на скрытую кровь. Как свидетельствуют результаты проведенных рандомизированных испытаний, использование данного исследования в качестве скринингового позволяет улучшить диагностику заболевания на ранних стадиях, снизить показатели смертности на 15-45% в зависимости от типа выполненного исследования и частоты его проведения.
В настоящее время одним из наиболее эффективных методов диагностики рака и предраковых состояний является быстрый иммунохроматографический экспресс-тест (ИХА-тест). К его преимуществам относятся отсутствие необходимости в подготовке больного к исследованию или соблюдении им определенного режима питания, выявление только неповрежденного человеческого гемоглобина, что исключает возможность ложноположительных реакций, высокая чувствительность (более 95%) и специфичность. Метод ИХА – CITO TEST FOB – быстрый, удобный в применении, высокочувствительный, не требует специального оборудования и реактивов, подготовленного медицинского персонала и значительных материальных затрат (стоимость эквивалентна 4-5 долларам США).
Колоректальный канцерогенез сопровождается рядом приобретенных генетических мутаций, которые могут обуславливать изменения нормальной слизистой оболочки толстой кишки вплоть до неизлечимых стадий рака. Сегодня появилась возможность получения человеческой ДНК из кала и ее тестирования на наличие генетических и других повреждений. Проведенные исследования подтверждают чувствительность этого метода на уровне 91% для рака и 82% для аденом толстой кишки со специфичностью 93%. В будущем следует ожидать стремительного развития этого скринингового метода.
Использование сигмоскопического исследованияпозволяет на две трети уменьшить смертность от колоректального рака, локализованного в пределах досягаемости сигмоскопа. С помощью гибкой сигмоскопии можно проводить визуальный осмотр внутренней поверхности толстой кишки на расстоянии до 60 см от анального отверстия. Эта методика не только позволяет выявлять колоректальные полипы и рак, но и используется для удаления полипов и взятия биопсии для патоморфологического исследования. К преимуществам гибкой сигмоскопии относится возможность проведения ее неэндоскопистом; процедура требует меньше времени, чем колоноскопия; подготовка толстой кишки проходит легче и быстрее; нет необходимости в проведении седации. Исследование по типу «случай-контроль» показали, что скрининговая сигмоскопия снижает смертность от колоректального рака на 60-70%. Опасные для жизни пациента осложнения встречаются в 1 случае на 10000 исследований.
Это один из наиболее информативных методов исследования толстой кишки, позволяющий не только выявить полипы, взять биоптат с любого участка толстой кишки или в зоне выявленного новообразования, но и провести оперативное вмешательство – полипэктомию в любом отделе толстой кишки. Имеются доказательства того, что проведение скринингового колоноскопического исследования позволяет существенно снизить показатели заболеваемости колоректальным раком, особенно у больных с аденоматозными полипами, уменьшить смертность пациентов с колоректальным раком. Однако сложность выполнения, высокая стоимость и неудобство для пациента существенно ограничивает использование колоноскопического исследования в качестве скрининга. 5-летний интервал между скрининговыми исследованиями для лиц со средней степенью риска развития колорктального рака (если предыдущее исследование было отрицательным) оправдан, так как среднее время развития аденоматозного полипа с трансформацией в рак составляет по меньшей мере 7-10 лет. Однако, в нашей стране, учитывая радиоэкологическую ситуацию, этот срок должен быть сокращен до 2-3 лет. в обнаружении дисплазии слизистой оболочки и опухолей толстой кишки существенную помощь оказывает хромоэндоскопическое исследование с использованием метиленового синего или индигокармина.
Спиральная компьютерная томография с последующей компьютерной обработкой дает трехмерное изображение толстой кишки с высоким разрешением. Исследование является неинвазивным и не сопровождается развитием серьезных осложнений. Выполняется после стандартной подготовки толстой кишки и инсуффляции в нее воздуха, что неудобно для пациента и сопровождается лучевой нагрузкой. Поскольку данный метод не может визуализировать плоские аденомы, его экономическая целесообразность (стоимость процедуры эквивалентна 80-100 долларам США) недостаточна, чтобы причислить его к категории широко распространенных скрининговых тестов.
В настоящее время нет рандомизированных исследований, подтверждающих снижение смертности или заболеваемости колоректальным раком в результате проведения скринингового ирригоскоического исследования у лиц со средней степенью риска развития заболевания.
источник
Колоректальный рак — объединённое название всех карцином толстого кишечника, начиная со слепой кишки и далее до анального отверстия.
Злокачественные процессы в слепой, поперечно-ободочной и сигмовидной части кишечника принято относить к болезням ободочной кишки. Некоторые исследователи опухоли сигмовидной кишки считают отдельной группой — карциномы ректосигмоидного отдела.
Колоректальный рак (КРР) — это два разных заболевания, одно локализуется в ободочной, другое — в прямой кишке, их объединяет анатомия, схожесть причин развития и совпадение некоторых аспектов противоопухолевого лекарственного лечения.
При этих болезнях значимо различается диагностика, клинические проявления, подходы к хирургии и само оперативное лечение, отношение к использованию лучевой терапии и, конечно, прогноз.
Объединение в одну болезнь полезно для проведения профилактических мероприятий, но для утилитарных целей онкологии термин КРР не означает единства лечебно-диагностического подхода, потому что это два очень разных злокачественных процесса со своими клиническими особенностями и терапевтическими сложностями.
Карцинома прямой кишки в большинстве случаев течет агрессивно и, несмотря обязательность добавления к хирургическому лечению облучения, показатели выживаемости много хуже, чем при карциномах ободочной кишки.
Предполагается развитие колоректальных аденокарцином из долго существующих ворсинчатых полипов, и доказано, что своевременное удаление полипов при колоноскопии снижает частоту карцином в популяции. Есть мнение, что злокачественный процесс может начинаться не в полипе, а с дисплазии слизистой оболочки.
Однозначное этиологическое мнение пока не сформировано, наоборот, совсем не исключается возникновение злокачественного процесса сразу в нескольких участках слизистой кишечника, причём часто морфологически не схожего.
Поскольку большинство новообразований локализуется в местах физиологической задержки содержимого, растет уверенность в активной канцерогенной роли особенностей и модели питания:
- заболеваемость африканского населения, сидящего на быстро эвакуирующейся по кишечной трубке растительной диете, незначительна;
- европейцы и американцы, предпочитающие высокобелковые продукты и фастфуд, болеют чаще.
Наследственные колоректальные раки большая редкость — едва ли у каждого 20-го больного можно проследить семейную заболеваемость, тем не менее, выведен целый список генетических синдромов с соучастием КРР. При наследственном заболевании карцинома возникает в десятки раз чаще и раньше по возрасту.
Предполагают негативное влияние алкоголя, причём не определенного напитка, а объемов употребления этилового спирта.
К факторам риска КРР причислено также:
- курение,
- низкая физическая активность,
- ожирение,
- сахарный диабет,
- хроническое воспаление слизистой кишечника при язвенном колите.
Знать точные причины злокачественных заболеваний важно для поиска путей профилактики, при выявлении заболевания у конкретного человека неважны вызвавшие его причины, необходимо подобрать адекватное лечение, но сначала провести полную диагностику.
Клинические проявления заболевания зависят от:
- уровня локализации новообразования,
- размеров и степени обтурации просвета кишечной трубки,
- от агрессивности раковых клеток и связанной с нею скоростью развития метастазов.
Один и наиболее частых симптомов колоректального рака — боль, не относится к признакам раннего рака. Для инициации болевого синдрома необходимо существенное нарушение перистальтической функции или выход опухоли за пределы кишечника с вовлечением в раковый конгломерат богато иннервированной брюшины.
Интенсивная прогрессивно нарастающая боль характерна для кишечной непроходимости, обусловленной частичным или полным перекрытием просвета трубки. В большинстве случаев КРР боли кратковременные и не стабильны по интенсивности, часто пациенты трактуют их как желудочный дискомфорт.
Задержка продвижения каловых масс проявляется ощущениями вздутия живота, негативно влияет на аппетит и может вызывать тошноту, но чаще беспокоит отрыжка. Рвота с каловым запахом характерна для кишечной непроходимости.
Изменения стула, как правило, в виде нестабильного чередования запоров и жидкого зловонного кала, и появление слизи при дефекации чаще возникает при поражении прямой кишки и левой половины ободочной. При новообразованиях правых отделов ободочной части отмечается склонность к запорам. При локализации опухоли в прямой кишке пациенты нередко не удовлетворены результатом дефекации — нет ощущения полного опорожнения.
Симптомы интоксикации — слабость и быстрая утомляемость обусловлены застоем кишечного содержимого с усилением процессов гниения и всасывания в кровь через стенку образующихся эндотоксинов. Разрушение раком сосудов может проявиться анемией вследствие хронического кровотечения.
Симптомы колоректального рака у женщин мало отличаются от мужских, но женщины внимательнее прислушиваются к голосу своего организма и много реже доводят себя до непроходимости.
В большинстве случаев симптоматика КРР настолько разнопланова и нестабильна, что не позволяет обнаружить процесс в ранней стадии, ярко манифестирует болезнь далеко не в начальной стадии.
По типу роста колоректальной карциномы выделяют экзофитную — растущую подобно полипу и эндофитную форму, распространяющуюся внутри кишечной стенки и часто сужающую просвет трубки.
По клеточному строению у восьми из десяти пациентов находят аденокарциному толстой кишки, у одного — слизистую аденокарциному, ещё реже встречается перстневидно-клеточный и плоскоклеточный раки.
Вне зависимости от уровня локализации процесса предполагается следующее разделение по распространенности:
- 1 стадия — опухоль занимает только слизистую оболочку;
- 2 стадия — карцинома внутри кишечной стенки, но не вышла наружу — в брюшную полость;
- 3 стадия — любого размера раковый конгломерат с метастатическими лимфоузлами;
- 4 стадия — находят метастазы в других органах.
Стадия злокачественного процесса устанавливается до начала химиотерапии с облучением или после операции. Правильно установленная стадия — ключ к выбору оптимальной терапии, поэтому необходимо иметь в клинике высокоточное диагностическое оборудование, должны делаться все современные анализы, а врачи обязаны быть опытными. Пациентам Европейской клиники доступно все необходимое для этого.
Диагностика колоректального рака не представляет особых сложностей — колоноскопия признана «золотым стандартом» выявления любой патологии кишечника и позволяет взятие материала для микроскопии. Осматривается вся кишечная трубка — тотально. Если колоноскопия невозможна, прибегают к ирригоскопии — рентгеноскопия с введением контраста в кишку, или к современной КТ-колонографии.
МРТ малого таза обязательно выполняется при прямокишечном раке, МРТ брюшной полости или аналогичного объема КТ выявит все внекишечные проявления болезни.
Комплексное обследование — эндоскопия с одновременным УЗИ позволит понять степень поражения кишечной стенки.
При подозрении на метастазы в брюшной полости выполняется лапароскопия.
Опухолевые маркеры РЭА и СА 19.9. не помогают раннему обнаружению рака, потому что повышаются по множеству бытовых причин, но мониторинг их уровня позволяет понимать динамику процесса и оценивать эффективность лечения.
Для подбора оптимального лекарственного лечения в кусочке опухоли выявляют генетические мутации и микросателлитную нестабильность.
Колоректальные раки метастазируют в окружающие лимфатические узлы, по лимфатическим сосудам раковые клетки могут добраться до надключичной области. Степень вовлеченности лимфоколлектора коррелирует с агрессивностью карциномы и длительностью её существования. При высокодифференцированной аденокарциноме течение более благоприятно, а метастазы не столь обильны.
По кровеносным сосудам раковые отсевы заносятся в печень и чуть реже — в легкие. Костные метастазы совсем не характерны для КРР, но не исключаются при низкодифференцированной аденокарциноме.
Прорастание кишечной стенки может привести к разносу клеток по брюшной полости и, нередко, канцероматозу с асцитом.
При нечасто встречающемся раннем КРР и начальных стадиях без вовлечения лимфатических узлов удается излечить одним только хирургическим методом, в остальных случаях добавляется лекарственное воздействие — химиотерапия, а при прямокишечной карциноме в программу обязательно входит локальная лучевая терапия.
При начальном процессе в ободочной кишке предпочтительно органосохраняющее вмешательство с использованием эндоскопического оборудования и удалением только поражённого участка слизистой оболочки — эндоскопическая резекция.
Принципиально все злокачественные процессы в толстом кишечнике можно разделить на две группы: операбельные или резектабельные и, соответственно, не операбельные.
Удаляется колоректальное образование несколькими способами, объем операции зависит от размера поражения: резекция части кишечника, удаление половины кишечника — гемиколэктомия, почти весь толстый кишечник — колэктомия и операция Гартмана.
На объеме хирургии не сказывается каким образом пациент попал на операционный стол — экстренно по жизненным показаниям или в плановом порядке с качественной предоперационной подготовкой.
Предпочтительная операция при небольшом числе метастазов в печени или легких, но только при технической возможности их одновременного удаления с пораженной кишкой.
Если опухоль невозможно удалить, во избежание развития фатальной кишечной непроходимости, кишка выводится на живот — стома, а внутри брюшной полости мимо пораженного участка создается обходной путь.
Алгоритм хирургического лечения прямокишечной карциномы аналогичен оперативным подходам при раке ободочной кишки с той лишь разницей, что оперативное вмешательство дополняется локальной лучевой терапией и химиотерапией.
Основная операция — мезоректумэктомия только при ранней карциноме не дополняется облучением.
Пациент с неоперабельным процессом направляется в радиологию, если нет необходимости в паллиативном хирургическом вмешательстве, к примеру, установке стента в суженный участок. После облучения вновь рассматривается возможность операции на прямой кишке.
При невозможности выполнения операции на первом этапе, вопрос о ней должен ставиться после каждого последующего лечебного этапа — только хирургическое вмешательство существенно отражается на продолжительности жизни.
После радикальной операции по поводу распространенного или с метастазами в лимфоузлах КРР проводится профилактическая полугодовая химиотерапия, она должна начаться в течение первых 4 недель. Также поступают при одновременном удалении первичной опухоли и метастазов в печени или легких.
Если химиотерапию делали до операции, после оперативного вмешательства проводится лекарственное лечение, суммарно охватывающее период в 6 месяцев. Комбинаций цитостатиков несколько, но все они обязательно включают фторпиримидины.
При неоперабельной карциноме прямой кишки химиотерапию фторпиримидином проводят вместе с длительным облучением, а по завершении лучевой добавляют ещё несколько курсов ХТ.
При неоперабельном раке ободочной кишки после вывода колостомы начинается длительная химиотерапия схемами FOLFIRI, FOLFOX или иными комбинациями с фторпиримидинами.
Пациент с впервые выявленным метастатическим заболеванием может рассчитывать на длительное лекарственное лечение, при стабилизации процесса перерыв в ХТ продлится до появления симптомов прогрессирования.
В обязательном порядке и неоднократно у каждого больного должна рассматриваться возможность и целесообразность оперативного вмешательства после завершения каждого этапа лечения. Но есть одна проблема — городские онкологические учреждения грешат очередями на первичное лечение, поэтому нечасто берут на операционный стол пациентов с анамнезом отказа в оперативном вмешательстве.
Облучение показано при карциноме прямой кишки как программное добавление к операции и проводится вместо операции при невозможности хирургии. Клиническими исследованиями доказано, что еженедельное введение до облучения химиопрепарата фторурацила повышает эффективность терапии.
При поперечно-ободочном раке лучевая терапия практически не используется, хотя ей можно найти достойное место у отдельных пациентов с метастатическими формами болезни.
Прогноз определяется множеством факторов, но главные — распространение заболевания на момент начала лечения и морфологические особенности клеток, то есть агрессивность и устойчивость к лекарственному воздействию.
Основная причина смерти при ободочном раке — метастазирование в печень как изолированно, так и в сочетании с поражением легких и лимфатических узлов.
После лечения прямокишечной карциномы часто возникают рецидивы в месте операции или продолженный рост после химиолучевого лечения, а также метастатическое поражение печени.
Хороший прогноз обещает ранний КРР без метастазов в лимфатические узлы.
Невозможно предотвратить развитие множества злокачественных заболеваний, но регулярное эндоскопическое обследование кишечника после 45 лет жизни способно предотвратить развитие КРР — это научная истина.
Можно исключить все факторы риска заболевания, правильно питаться и держать в норме вес, но при множественных полипах канцерогенный риск приближается к 100%, маловероятно избежать злокачественной опухоли, отказываясь от регулярного колоноскопического наблюдения и удаления ворсинчатых полипов.
Несколько полипов или даже один увеличивают риск КРР до 20%, болезнь Крона и другие язвенные поражения слизистой могут завершиться раком у каждого 20–25 пациента.
Лечение и выявление онкологических заболеваний — профиль нашей Клиники, наша цель — вернуть вам здоровье, если это невозможно, то мы готовы качественно изменить вашу жизнь.
источник
 частичная, а затем и полная кишечная непроходимость;
частичная, а затем и полная кишечная непроходимость;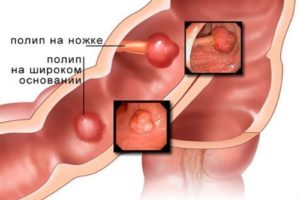 наследственная предрасположенность;
наследственная предрасположенность; недостаточная физическая активность;
недостаточная физическая активность;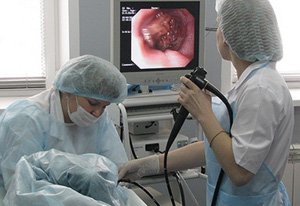 Колоноскопия. Основной метод диагностики колоректального рака. Методика может применяться и в качестве скрининга – профилактического обследования пациентов группы риска (пожилых людей старше 50 лет). Исследование предполагает введение в пищеварительную систему пациента через анальное отверстие специального эндоскопа, с помощью которого можно осмотреть стенку кишечника и обнаружить патологическое образование. В ходе диагностики из подозрительной опухоли обязательно берется фрагмент ткани.
Колоноскопия. Основной метод диагностики колоректального рака. Методика может применяться и в качестве скрининга – профилактического обследования пациентов группы риска (пожилых людей старше 50 лет). Исследование предполагает введение в пищеварительную систему пациента через анальное отверстие специального эндоскопа, с помощью которого можно осмотреть стенку кишечника и обнаружить патологическое образование. В ходе диагностики из подозрительной опухоли обязательно берется фрагмент ткани.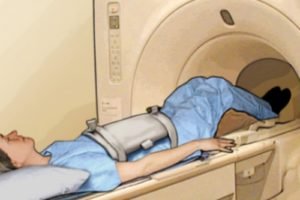 Дополнительные исследования. После обнаружения очага рака пациента в обязательном порядке обследуют на наличие метастазов опухоли в других органов. С этой целью проводится комплекс исследований, который включает УЗИ, КТ или МРТ брюшной полости, рентгенографическое исследование грудной клетки, урографию, цистоскопию. Объем обследования пациента зависит от наличия симптомов повреждения тех или иных органов, которые появляются на поздних стадиях заболевания.
Дополнительные исследования. После обнаружения очага рака пациента в обязательном порядке обследуют на наличие метастазов опухоли в других органов. С этой целью проводится комплекс исследований, который включает УЗИ, КТ или МРТ брюшной полости, рентгенографическое исследование грудной клетки, урографию, цистоскопию. Объем обследования пациента зависит от наличия симптомов повреждения тех или иных органов, которые появляются на поздних стадиях заболевания.
 На ранних стадиях заболевания, когда оно имеется четко локализованный характер, удаляется только пораженный фрагмент кишечника с окружающей его клетчаткой и регионарными лимфатическими узлами.
На ранних стадиях заболевания, когда оно имеется четко локализованный характер, удаляется только пораженный фрагмент кишечника с окружающей его клетчаткой и регионарными лимфатическими узлами.